Generalidades, clasificación y factores de riesgo
Dr. César Vicherat, Dr. Daniel Morán
C64, es el código del CIE 10 por el cual se reconoce el Cáncer renal que es el protagonista de este capítulo. (1)

El Cáncer Renal representa actualmente el 2 a 3% de todos los cánceres, siendo el Carcinoma de Células Renales (CCR) el más frecuente, alcanzando un 90% de estos. En 2020, se estimó que hubo 431.288 casos nuevos de CCR a nivel mundial. (2).
En Chile, la incidencia reportada por el Departamento de Estadísticas e Información de Salud (DEIS) es de 4.9/100.000 habitantes en 2021. A nivel mundial se observa un incremento en las tasas de incidencias, así como de mortalidad y solo en Francia, Alemania, Austria, los Países Bajos e Italia se reporta disminución de esta última (2, 3).
Ocupa el tercer lugar de prevalencia entre las neoplasias malignas urológicas, después de los cánceres de próstata y vejiga respectivamente a nivel mundial, sin embargo, en Chile sigue al cáncer de próstata en incidencia (2, 3, 4).
Afecta dos veces más a hombres que a mujeres y la edad promedio de presentación es entre los sesenta y setenta años de edad.
Los datos del DEIS en nuestro país, muestran la progresión sostenida de la incidencia en el tiempo, sobrepasando los 40 casos por 100.000 habitantes en varones sobre los 65 años (2).
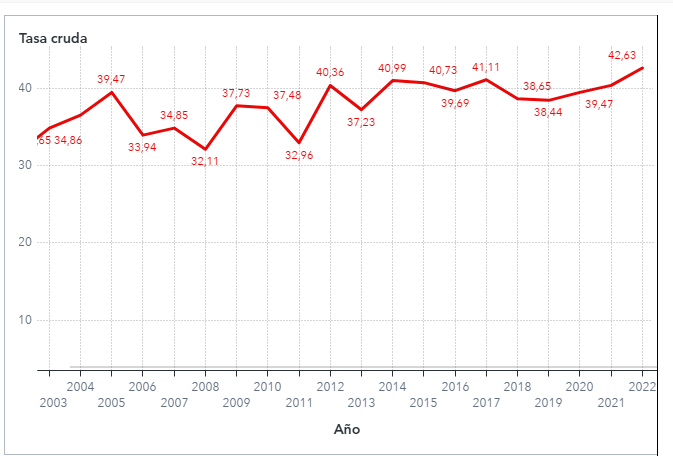
Tabla 1: Tasa cruda de incidencia sobre 65 años, fuente DEIS.
Inzunza y colaboradores mostraron en el reciente XLV Congreso Chileno de Urología que la mortalidad prematura es aquella que se produce antes de la edad promedio de muerte estimada. Para evaluar la magnitud y las tendencias de la mortalidad se recomienda el indicador Años de Vida Potenciales Perdidos (AVPP), que ilustra la pérdida que sufre la sociedad como consecuencia de la muerte de personas jóvenes o de fallecimientos prematuros. El principio de los AVPP es cuanto más prematura es la muerte, mayor pérdida de vida. Los autores estimaron los AVPP proyectados por Cáncer Renal en la población chilena durante periodos quinquenales hasta 2035, concluyendo que se proyecta un aumento importante los AVPP en Chile en la próxima década de acuerdo con estimaciones de mortalidad y expectativa de vida (5). Lo anterior se condice absolutamente con las proyecciones de Globocan y ratifican la necesidad de intensificar la promoción en salud y la educación de médicos generales en la detección precoz.
| AVPP | |||||
| 2025 | VAR | 2030 | VAR | 2035 | |
| Hombres | 23703 | 22% | 28883 | 24% | 34570 |
| Mujeres | 12940 | 9% | 15145 | 11% | 17720 |
Tabla 2: Años de Vida Potenciales Perdidos por cáncer renal, proyección. Fuente Inzunza y colaboradores mostraron en el reciente XLV Congreso Chileno de Urología.
Esta sustancial variación al alza entre los periodos 2025-2030 y 2030-2035 en un 2% de aumento de los AVPP, nos advierte que los esfuerzos realizados hasta la fecha para controlar esta patología distan bastante de las metas objetivo para la década establecida por la OMS y el MINSAL.
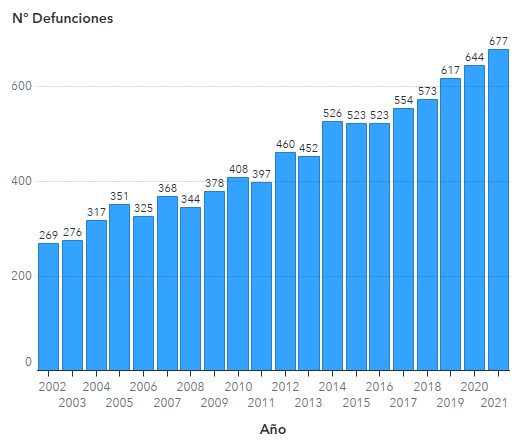
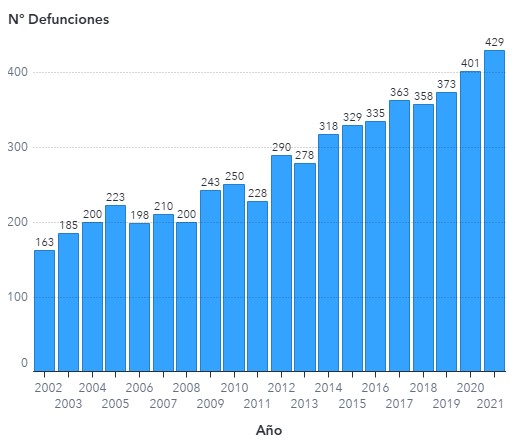
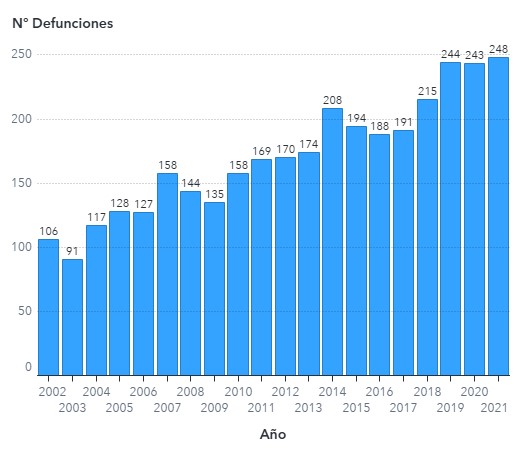
Hombres Mujeres
Tablas 3,4 y 5: Tasas: n° defunciones x 100.000 habitantes
Las tasas crudas son calculadas utilizando como denominador la población proyectada por el INE para cada año en base al Censo 2017.
La estandarización de tasas se realizó por sexo y edad por método directo utilizando como población de referencia la proyección de población del INE para el año 2017.
Factores de riesgo
Son importantes factores de riesgo el tabaco, la obesidad y la hipertensión arterial. Otros factores específicos como la exposición ocupacional a carcinógenos, aún no cuentan con un nivel de evidencia de alta calidad. (3).
El consumo moderado de alcohol parece tener un efecto protector por razones aún desconocidas, mientras que cualquier nivel de actividad física también parece tener algún efecto protector (3).
Obesidad: Alrededor de un 40% de los pacientes con CCR presentan algún grado de obesidad o sobrepeso. El índice de masa corporal (IMC) y el perímetro abdominal permiten objetivar esta relación. Ambas mediciones muestran mayor relación causal en mujeres que en hombres.
En el obeso aumentan los niveles séricos de hormonas esteroidales y del factor de crecimiento derivado de insulina tipo I (IGF-I). Estas alteraciones podrían generar cambios, como aumento de adipocitoquinas (por aumento de los niveles plasmáticos de insulina) llevando a respuesta inflamatoria crónica y aumento de peroxidación lipídica que induciría a mutación del ADN, favoreciendo oncogénesis (6,7).
Tabaquismo: Entre un 20 a 30% de CCR reconocen como causa el hábito tabáquico. Se ha demostrado riesgo relativo de 1,5 para hombres y de 1,2 para mujeres. Riesgo directamente relacionado con dosis diaria de tabaco. Así, grandes fumadores, sobre 20 cigarrillos por día, aumentan el riesgo de presentar CCR al doble. Por otro lado, 15 años después de dejar el consumo de cigarrillos, el riesgo de presentar CCR disminuye entre un 15 y un 30% (6,7).
Analizados 30282 casos de CCR en el National Program of Cancer Registry Project en Atlanta Georgia, el componente más notable de la asociación estadísticamente significativa (P < 0,001) entre el tabaquismo y la histología se relacionó con los carcinomas cromófobos, en los que el porcentaje de nunca fumadores entre los casos fue el más alto (62,0%) y los porcentajes de fumadores actuales y exfumadores fueron los más bajos (10,4% y 27,6%, respectivamente) de todos los tipos histológicos. (8)
Hipertensión arterial: Actualmente, diversos estudios han demostrado relación entre incidencia de CCR e hipertensión arterial, aunque en gran parte de estos trabajos no ha sido posible separar las dos variables implicadas: hipertensión arterial y tratamiento respectivo, se ha concluido que ninguno de los fármacos antihipertensivos, en uso actual, está consistentemente relacionado al riesgo de presentar cáncer renal.
Los mecanismos fisiopatológicos por los cuales hipertensión arterial puede llevar a presentar un tumor renal, aún no son claramente conocidos, aunque se propone que la injuria renal crónico más la inflamación secundaria a hipertensión y a cambios metabólicos como funcionales en túbulo renal como los factores que intervendrían en aumentar la susceptibilidad a los efectos de carcinógenos (3, 7, 9).
Genéticos: En 2024 un estudio sueco de 9.416 pacientes con CCR, el 3,1 % tenía 1 o más familiar directo relacionado (FDR) previamente diagnosticados con CCR (CCR familiar). No hubo diferencias estadísticas en la mediana de edad entre el CCR esporádico y el CCR familiar. La comparación de casos/controles indica que las personas con un FDR con CCR tienen aproximadamente el doble riesgo de ser diagnosticados con CCR, con un mayor riesgo para las mujeres que para los hombres. Tener 2 o más FDR era muy raro, pero se asociaba con un riesgo seis veces mayor. El CCR familiar se asoció fuertemente con tumores bilaterales y multifocales. (10)
La carga genética heredada puede causar tumores en pacientes jóvenes y a menudo con compromiso bilateral. Aunque sólo un 4% de los CCR explican como causa alguna predisposición genética. El antecedente familiar de CCR, particularmente si el diagnóstico en el familiar fue a corta edad, con múltiples tumores y/o afectación bilateral, puede sugerir CCR hereditario (11).
En los últimos años se han producido avances significativos en el conocimiento del desarrollo de las formas hereditarias de CCR, identificando supresores tumorales y oncogenes.
Existen varios síndromes hereditarios de CCR bien descritos, así como otros recientemente identificados, cuyo espectro clínico completo aún no se ha definido. En la nueva era de la medicina de precisión, la identificación de estos síndromes puede desempeñar un papel importante en el manejo y la selección del tratamiento sistémico.
Se han descrito varios síndromes hereditarios autosómicos dominantes de CCR, incluyendo aquellos relacionados con variantes patogénicas de la línea germinal en VHL, MET, FH, TSC1/TSC2, FLCN, SDHA/B/C/D, BAP1, CDC73 y MITF. El espectro clínico de SDH, BAP1 y MITF aún se está definiendo, aunque estos parecen estar asociados con una menor incidencia de CCR que el primero. El FH y probablemente el CCR BAP1 se asocian con una enfermedad más agresiva. Estudios preclínicos y clínicos muestran que el uso de terapia sistémica que explota vías genéticas específicas es una estrategia prometedora.(3)
Cuadros hereditarios que implican factor de riesgo para desarrollar CCR son: Enfermedad de Von Hippel Lindau (VHL), Carcinoma papilar hereditario, Leiomiomatosis hereditaria, el Síndrome de Birt Hogg Dubé (BHD o FLCN), entre otros (7).
| SINDROME | GENETICA | MANIFESTACION CLINICA | ||
| Von Hippel-Lindau | Gen VHL
Cromosoma 3p25 – 26 BVS |
Cáncer Renal de Células Claras
Hemangioblastomas del SNC Angiomas de la Retina Feocromocitoma |
||
| CCR Papilar Hereditario | c–MET proto-oncogene
Cromosoma 7q31 |
CCR Papilar tipo 1 | ||
| Leiomiomatosis Hereditaria | Fumarato Hidratasa (FH)
Cromosoma 1q42 |
CCR Papilar tipo 2
Leiomiomas Cutáneos Leiomiomas Uterinos |
||
| Birt–Hogg-Dubé | Gen BHD1
Cromosoma 17p12q11 |
CCR Cromófobo
Oncocitoma Tumor Oncocítico Híbrido CCR Células Claras (ocasional) Fibrofoliculomas Cutáneos Quistes Pulmonares Neumotórax Espontáneo |
||
|
TSC1/TSC2 | Angiomiolipoma ccRCC oncocitoma quístico |
Tabla 6: Síndromes Hereditarios con Riesgo de Cáncer de Células Renales
Con los avances en la tecnología de secuenciación de próxima generación, los paneles genéticos ahora abarcan una lista en expansión de genes disponibles. Se han establecido recomendaciones específicas:
a) recopilación de antecedentes familiares
b) pruebas de panel multigénico de línea germinal
c) genes que se incluirán en paneles multigénicos
d) pruebas de línea germinal en asociación con pruebas de tumores genéticos somáticos.
Para el CCR, los genes recomendados para pruebas e inclusión en paneles multigénicos son: BAP1, FH, FLCN, MET, SDHA, SDHAF2, SDHB, SDHC, SDHD PTEN, VHL (más recomendado) y TSC1/TSC2 (menos recomendado) (3).
Otros: Un número importante de otros factores han sido mencionados: virales, dietéticos, químicos, pero ninguno de ellos ha sido claramente identificado como responsable específico de CCR (3, 7).
Por otro lado, el consumo moderado de alcohol pudiese tener un efecto protector por motivos no aclarados, así como, la actividad física de cualquier grado, también tendría un efecto benéfico (3).
Cáncer renal y Garantías Explícitas en Salud
Dr. César Vicherat
Antes de continuar con el desarrollo clínico de este capítulo, debemos hacer una pausa entregando información de gran relevancia para los médicos generales que tengan la fortuna de contar con la información de nuestro manual, así como de la futuras generaciones de urólogos de nuestro país, pues por Ley, esta patología se encuentra incluida en las Garantías Explicitas de Salud (GES), su no cumplimiento arriesga sanciones importantes para el profesional como para la institución en la que se desempeñe (11).
El 3 de septiembre de 2004, fue promulgada la Ley de Acceso Universal a Garantías Explícitas, conocida como AUGE, Ley 19.966, la cual comenzó a operar oficialmente el 1º de julio 2015.
La ley 19.966 que dio origen a este programa, era parte de un paquete mayor de iniciativas legales que pretendían mejorar el sistema de salud en beneficio de todos los chilenos, especialmente de aquellos con menores recursos. Este plan establece un conjunto de garantías explícitas para la “buena atención” de un conjunto prioritario de patologías, asegurando el acceso, la oportunidad, la calidad y la protección financiera. A un año de la creación del plan, éste cubría 40 enfermedades, pasando a ser 56 en el 2007. En la actualidad son 87 problemas de salud los incorporados a este plan.
El cáncer renal con excepción del originado en la pelvis renal entró en vigencia como el problema de salud número 83, con el Decreto Nº 22 del año 2019, garantizando las etapas de diagnóstico y tratamiento para todas las personas mayores de 15 años (12).
Este plan de salud contiene garantías explícitas que constituyen un conjunto de beneficios garantizados por ley para las personas afiliadas a Fonasa y a las Isapres:
1. Garantía de Acceso: Recibir las atenciones definidas para cada enfermedad.
2. Garantía de Oportunidad: Las prestaciones garantizadas en el AUGE/GES deben ser entregadas de acuerdo a plazos establecidos.
3. Garantía de Protección Financiera: Cancelar sólo el copago: 0% Afiliados del Fonasa A y B; 10% grupo C y 20% grupo D y afiliados a Isapres.
4. Garantía de Calidad: Las prestaciones garantizadas en el AUGE/GES deben ser entregadas por un prestador de salud registrado y acreditado en la Superintendencia de Salud.
Frente a una persona, a quien el médico tratante le ha diagnosticado cáncer renal (lesión imagenológica sospechosa de cáncer renal); debe confeccionar un informe de proceso diagnóstico (IPD) de confirmación, lo que gatilla la etapificación que tiene un plazo garantizado de 45 días para la confirmación del diagnóstico, permitiendo determinar el grado de avance del cáncer y de acuerdo con la decisión del Comité Oncológico se define el tratamiento a seguir.
Las alternativas terapéuticas disponibles para este problema de salud son: cirugía, tratamiento sistémico y radioterapia. La secuencia de estos tratamientos dependerá de las condiciones de cada paciente y de la indicación del Comité oncológico. El tratamiento primario, tiene una garantía de 30 días desde la indicación médica y se inicia cuando el médico tratante (urólogo), registra en la ficha clínica la información correspondiente al tratamiento indicado.
Si requiere de tratamiento adyuvante, éste se inicia teniendo un plazo de 30 días desde la indicación. Una vez finalizados los tratamientos indicados, se cierra el caso Ges, sin embargo, la persona puede continuar en controles de seguimiento según indicación del equipo tratante, fuera de garantía Ges, lo cual es parte de múltiples cuestionamientos a diversas garantías de esta ley (12).
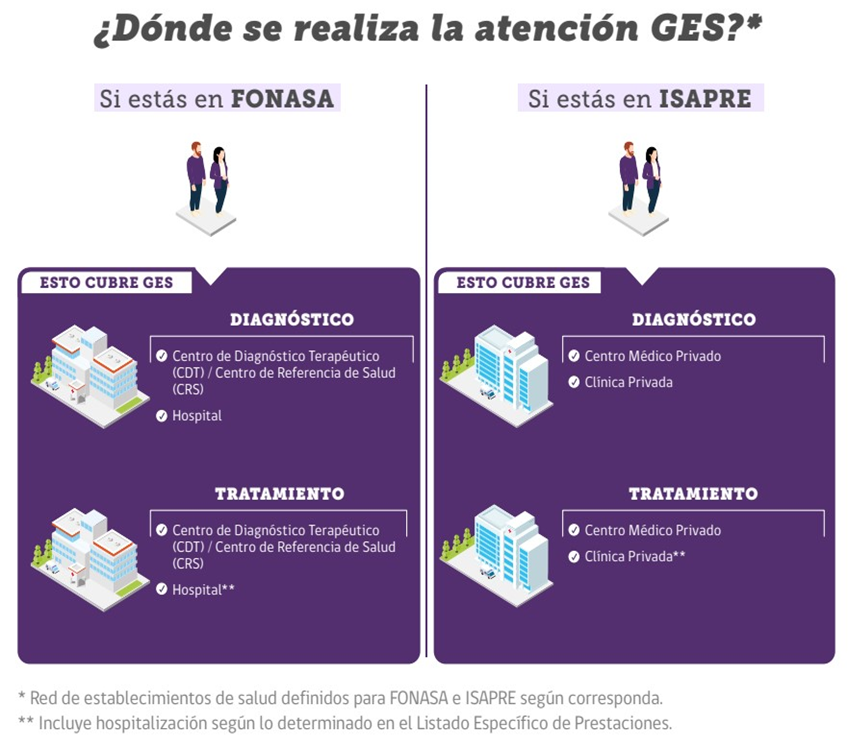
Figura 1: Entidades que realizan las atenciones relacionadas a la Garantía.

Tabla 7: Casos GES N° 83
Queda en evidencia la progresión en el número de casos por año, lo que puede estar en relación con los efectos de la pandemia del covid-19, y a la masificación de la información como en la supervisión del cumplimiento de las notificaciones (2, 4).
Punto aparte es el hecho que esta información solo cubre a los afiliados de FONASA, por lo que, para la evaluación de incidencias y tasas, se debe contar con información general de la población chilena, así definido, creemos que la información parcializada implica que el problema de salud como tal se encuentra subvalorado.
Teniendo la información a la vista, si hacemos el ejercicio con los casos GES del 2024 y el Censo en Chile de 2017, la incidencia resulta en 19.2 por 100.000 habitantes, lo que representa una cifra 4 veces mayor a lo reportado por la literatura nacional.
Por lo anterior resulta de gran interés trabajar como Sociedad en la obtención de datos fidedignos que permitan la toma de decisiones más adecuadas a las autoridades.
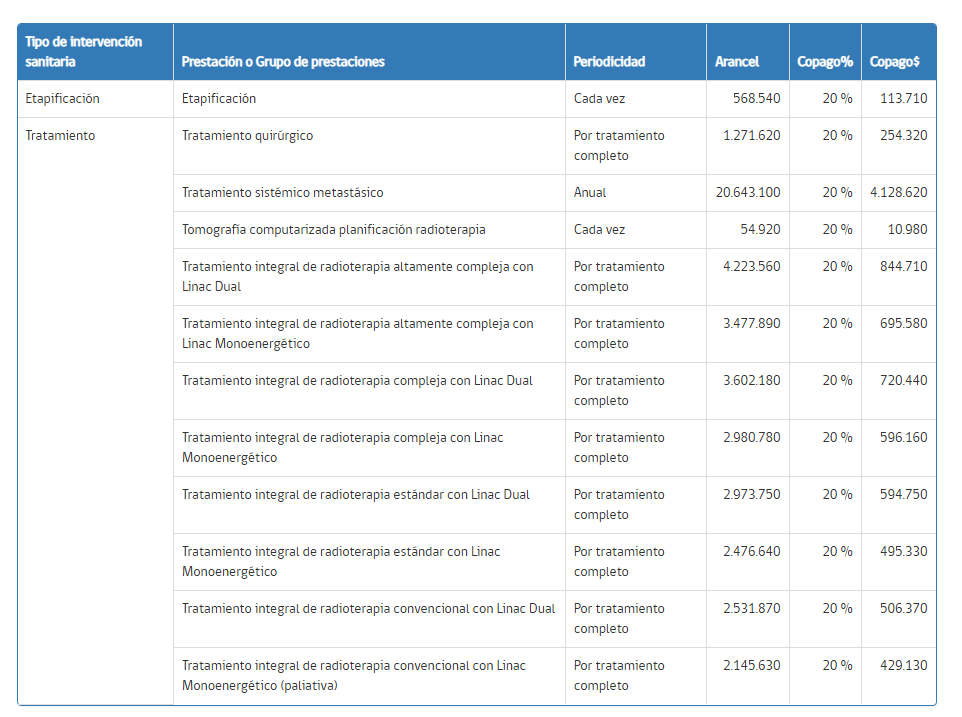
Tabla 8: Coberturas GES N° 83. Superintendencia de Salud.
CLASIFICACIÓN
Dr. César Vicherat
En este apartado desde la década de los 80 ha evolucionado considerablemente. La clasificación de Mostofi, pasando por la de Mainz en 1986, Heidelberg en 1997 y OMS en 2004 y 2016. Los cambios entre cada una son importantes debido a un mejor conocimiento de la morfología, las características genéticas y moleculares de los tipos histológicos, con ello se ha modificado el pronóstico de los tumores renales como se verá en el desarrollo de este capítulo.
Las diferentes entidades histopatológicas descritas en la quinta edición de la clasificación de tumores urogenitales de la Organización Mundial de la Salud (OMS) publicada en 2022, presenta criterios de diagnóstico morfológico estándar, combinados con inmunohistoquímica y pruebas moleculares relevantes que se revisaron significativamente en comparación con la clasificación de 2016.
Se ha introducido una clasificación de tumores renales impulsada molecularmente además de los tumores renales y su clasificación morfológica clásica. Los ejemplos de tumores renales epiteliales definidos molecularmente incluyen carcinoma medular renal deficiente en SMARCB1, RCC reordenado en TFE3 y TFEB, CCR reordenado en ALK y CCR con mutación de elongina C (ELOC). Los cambios más profundos en la clasificación de la OMS de 2022 se refieren principalmente a los tumores renales raros. (3)
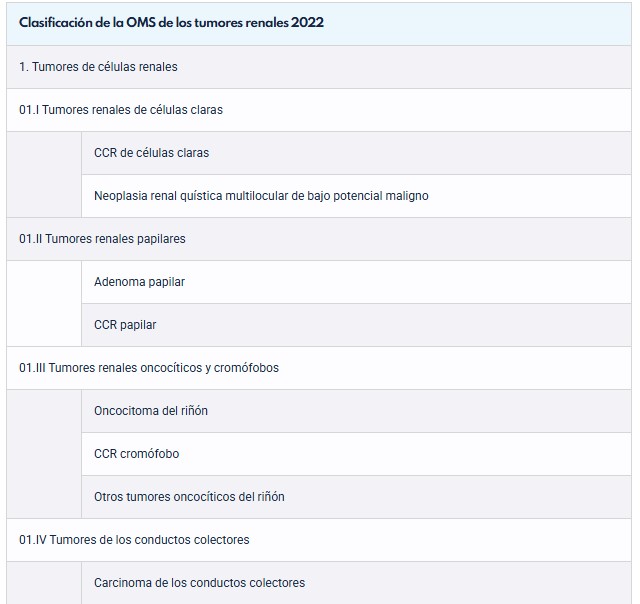


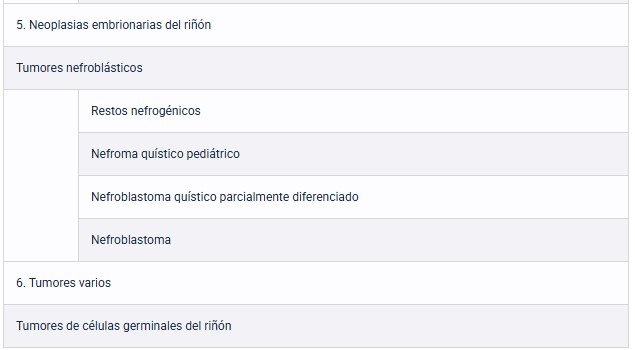
Tabla 9: Clasificación OMS 2022. Guía EAU 2025.
Oncocitoma
Tumor sólido benigno más común de este grupo, constituye el 5% de los tumores renales, afectando mayormente a hombres que a mujeres en relación 2:1 y con edades de presentación entre los 10 y 94 años. El clásico Oncocitoma es un tumor benigno sin potencial metastásico. Deriva del túbulo distal renal, tal como el CCR cromófobo, pero no hay evidencia de transformación maligna.
Microscópicamente predominan las células grandes eosinofílicas, cuyo citoplasma tiene un alto contenido de mitocondrias (Oncocitos). Macroscópicamente, de un color levemente café y homogéneo, presenta pseudocápsula y cicatriz central, hemorragia tumoral en un 20 a 30% y extensión a la grasa perirrenal en un 11 a 20%. Más del 95% de estos tumores presentan diploidía celular y alteraciones del ADN, distintas a lo observado en CCR.
El estudio imagenológico habitualmente es incapaz de sugerir el diagnóstico. En la Tomografía se observa como lesión sólida, homogénea, ocasionalmente con una cicatriz estrellada central, pero es insuficiente para diferenciar al Oncocitoma del CCR. La Resonancia Nuclear Magnética (RNM) tampoco aporta al diagnóstico diferencial. Sin embargo, la SPECT/TC con 99m Tc-sestamibi (SestaMIBI, MIBI) ha mostrado resultados iniciales prometedores para la diferenciación entre tumor renal benigno y CCR de bajo grado. Sin embargo, debido a la incapacidad de las técnicas de imagen modernas para diferenciar masas renales, existe un renovado interés en la biopsia de masa renal (BMR) antes de la intervención quirúrgica. En este contexto, es necesario tener en cuenta la precisión de la biopsia y el tratamiento de los oncocitomas avanzados o en progresión, ya que las neoplasias renales oncocíticas diagnosticadas mediante BMR en el examen histológico después de la cirugía mostraron oncocitoma solo en el 64,6 % de los casos, por lo anterior la clasificación de la OMS de 2022 excluye estrictamente que se realice un diagnóstico definitivo de oncocitoma en una biopsia con aguja gruesa (3).
Se describen 4 características angiográficas que sugieren su diagnóstico:
1.- Un anillo lúcido creado por la cápsula tumoral
2.- Patrón capilar homogéneo con densidad similar al parénquima renal
3.- Distribución homogénea del material de contraste en el tumor, sin acúmulos ni shunts arteriovenosos.
4.- Apariencia en “radios de rueda” de las arterias que lo irrigan.
La coexistencia entre Oncocitoma, CCR y Carcinomas cromófobos respectivamente puede dificultar su evaluación y diagnóstico diferencial, orientando su manejo a conductas más agresivas.
No existen diferencias clínicas significativas, entre Oncocitoma y CCR, su diagnóstico es histopatológico. La Inmunohistoquímica (principalmente marcador CK7) y el estudio citogenético son de gran ayuda para el diagnóstico diferencial con el CCR cromófobo. Es un tumor habitualmente asintomático y su hallazgo suele ser incidental, tal como ocurre con CCR. La Nefrectomía Parcial o Radical, dependiendo del tamaño y localización del tumor, constituyen el tratamiento de elección, tal como si fuera CCR (7).
Angiomiolipoma
Tumor benigno poco frecuente, presente en el 0,1 a 0,3% de la población general. Se origina desde la cresta neural, deriva de células epitelioides perivasculares. Tiene tres componentes según su nombre lo indica: tejido adiposo, músculo liso y vasos sanguíneos de pared delgada. Se le conocía como hamartoma, sin embargo, al ser una proliferación monoclonal, es considerada una neoplasia. Se presenta con mayor frecuencia en mujeres de edad media en una relación 4:1 con varones. De presentación excepcional antes de la pubertad, razón por la cual, su crecimiento se asocia a factores hormonales. En un 50% de los casos, se observa relacionado a la esclerosis tuberosa. Generalmente es de tamaño pequeño (< de 4 cm), pero en ocasiones puede ser de gran dimensión o multifocales (7).
El diagnóstico es imagenológico. La Ecotomografía permite sospecharlo y la TAC confirmarlo. La nitidez de la imagen es mayor en la medida que el contenido adiposo del tumor predomine. Angiomiolipomas pobres en grasa, pueden ser confundidos con CCR. La inmunihistoquímica puede ser necesaria para establecer su diagnóstico, presentando marcador + para HMB45 y negativos para CK y EMA (marcadores epiteliales).
La principal complicación de los Angiomiolipomas es el sangramiento perirrenal, cuadro que puede ser de extrema gravedad y requerir de tratamiento inmediato. Síndrome de Wünderlich se denomina a la hemorragia retroperitoneal masiva proveniente desde este tumor. La hemorragia espontánea constituye una asociación relativamente frecuente con Angiomiolipoma, incluso más que con CCR (7).
El tratamiento depende de la presentación del tumor, tamaño, función renal y estado de gravidez. La Angioembolización Renal selectiva es el tratamiento de elección en caso de hemorragia aguda. En el tratamiento electivo de tumores grandes, la embolización y la cirugía parcial mínimamente invasiva, constituyen las primeras elecciones.
Otros Carcinomas Renales de importancia clínica: Carcinoma asociado con enfermedad renal terminal; carcinoma renal asociado con enfermedad quística adquirida
Los cambios degenerativos quísticos (enfermedad renal quística adquirida [ACKD]) y una mayor incidencia de CCR son características típicas de Enfermedad Renal Crónica (ERC). Los carcinomas de células renales de riñones nativos en etapa terminal se encuentran en aproximadamente el 4% de los pacientes con ERC. Su riesgo de por vida de desarrollar CCR es al menos diez veces mayor que en la población general. Son generalmente multicéntricos y bilaterales, se encuentran en pacientes más jóvenes (en su mayoría hombres) y son menos agresivos (3).
Carcinoma de células renales (CCR)
En la actualidad y tras la clasificación del 2022, existen tres tipos principales de CCR: de células claras (CCRcc), papilar (CCRp ya no dividido en tipo I y II) y cromófobo o CCRch. La clasificación del tipo de CCR ha sido confirmada por análisis citogenéticos y genéticos (3).
El CCR sarcomatoide no es un subtipo específico, sino que representa esencialmente un patrón de diferenciación asociado con un mal pronóstico, independientemente del subtipo de CCR subyacente; debe clasificarse como grado IV de la OMS/ISUP (Sociedad Internacional de Patología Urológica).
La neoplasia renal quística multilocular de bajo potencial maligno es un nuevo subtipo de CCR en la clasificación de 2022 (3).
Todos los RCC derivan del epitelio que recubre los túbulos renales. Cada uno de ellos es claramente diferenciable del otro por su morfología, inmunohistoquímica y biología (7).
La supervivencia general (SG) a 5 años para el CCR cromófobo no metastásico (incluidos N0-N1), papilar, de células claras y de conducto colector es del 91 %, 82 %, 81 % y 44 %, respectivamente (3).
Se revisan los tres tumores más frecuentes de este grupo: carcinoma de células claras, carcinoma papilar y carcinoma de células cromófobas (7).
Carcinoma Renal de Células Claras (CCRc)
Es la variante histológica más frecuente con un 70% de todos los casos de Cáncer Renal, representando el 2% de los cánceres del adulto. Afecta principalmente entre la quinta y sexta décadas de la vida, con una relación mayor para hombres que mujeres (2:1). Hoy en día la mayoría se presenta sin metástasis a distancia al momento del diagnóstico, gracias al uso masivo de técnicas de imágenes antes mencionadas, aunque puede tener invasión de grasa perirrenal, vena renal o vena cava. En un 1% de los casos puede ser bilateral. (3).
Macroscópicamente corresponde a tumor sólido, localizado hacia la periferia renal. Al corte presenta color amarillo brillante o naranja pálido. En ocasiones puede tener zonas hemorrágicas, necróticas o formaciones quísticas. Microscópicamente se observan células de citoplasma claro, ricas en glicógeno, contenido eosinofílico o mixto. La característica principal del estroma es una importante red capilar.
Citogenética evidencia alteración en cromosoma 3p y mutación del gen VHL en cromosoma 3p25.
En relación a la inmunohistoquímica, los marcadores utilizados son citoqueratinas (CK) de bajo peso molecular y Vimentina.
La Clasificación de ISUP/WHO (International Society of Urologic Pathologists) que en la actualidad ha reemplazado a la de Fuhrman en cuanto a valor pronóstico destaca (13):

Tabla 10. Clasificación ISUP/WHO. Guía EAU 2025.
Neoplasia renal quística multilocular de bajo potencial maligno (MCNLMP)
Tumor renal indolente, exclusivamente quístico, multiloculado, sin crecimiento sólido expansivo, con revestimiento de células claras y núcleos de bajo grado. La detección de pequeños nódulos sólidos expansivos y necrosis tumoral son incompatibles con MCNLMP. Representa el 0,5-2,5% de todos los tumores renales y es una lesión benigna. No hay informes de progresión, metástasis o muerte relacionada con el cáncer con un seguimiento a largo plazo (3).
Carcinoma Renal Papilar (CCRp)
Corresponde al segundo en prevalencia dentro de los cánceres de células renales, representando entre un 13 y el 20 % de ellos. Suelen ser multifocales y en un 1% de los casos, bilateral. En general suele tener mejor pronóstico que el de CCR. (3).
En la nueva clasificación de la OMS de 2022, el antiguo CCRp tipo I ahora se denomina » CCRp de patrón clásico». Se han introducido tres patrones morfológicos adicionales de CCRp, entre ellos:
a) patrón bifásico (alveoloescamoso) que presenta un crecimiento principalmente sólido
b) neoplasia papilar con polaridad nuclear inversa, anteriormente descrita como » CCRp oncocítico de bajo grado»
c) CCRp tipo Warthin que presenta una inflamación intensa que imita el tumor de Warthin de la glándula salival. (3).
Macroscópicamente corresponden a tumores bien delimitados, encapsulados, generalmente periféricos al riñón y confinados a éste. Friables, de superficie rojiza marrón. Se caracterizan por presentar zonas necrohemorrágicas. Ocasionalmente se observan quistes en la superficie tumoral. Angiográficamente la mayoría son hipovasculares. El crecimiento del tumor causa la necrosis de las papilas, que es una fuente de proteínas hiperosmóticas que causan el «crecimiento» posterior del tumor, líquido dentro del tumor y solo un margen serpiginoso que realza el contraste. El carcinoma renal de patrón clásico puede imitar un quiste patológicamente modificado (Bosniak IIF o III). (3).
Existe un riesgo de siembra del tracto de biopsia del tumor renal (12,5%), probablemente debido a la fragilidad de las papilas tumorales (3).
El estudio citogenético de carcinoma papilar muestra trisomías de cromosomas 7, 17 y pérdida de Y. No presenta alteraciones del cromosoma 3 a diferencia del Carcinoma Renal de Células Claras. Tanto CCRp como CCRc comparten varios marcadores inmunohistoquímicos, sin embargo, el Carcinoma Papilar presenta positividad para CK7 y de racemasa (p504S), en cambio, no sucede así con Carcinoma Renal de Células Claras. Por su parte el Carcinoma Papilar resulta positivo con CD10, con el marcador de carcinoma renal (RCCm). Las mutaciones del gen de transición mesenquimal-epitelial (MET) son más frecuentes en el CCRp de bajo grado. (3).
Carcinoma Cromófobo (CCRch)
El CCR cromófobo ahora se agrupa en «Tumores oncocíticos y cromófobos”, corresponde al 5% de los carcinomas renales. No tiene predilección por sexo y se presenta en edades similares al de CCR de Células Claras, y de mejor pronóstico que éste último a grado y estadio similar. Macroscópicamente se observa un tumor sólido, circunscrito, cortical, de color café. 10 a 15% presentan área central cicatricial, similar al Oncocitoma, con el cuál se puede plantear diagnóstico diferencial. Histológicamente se distinguen dos tipos celulares: el típico o Cromófobo Clásico y el Eosinofílico. En el primero, las células cromófobas corresponden a células claras con abundante citoplasma de aspecto espumoso, y halo perinuclear. Los organelos están desplazados con mayor frecuencia hacia la periferia dando a la membrana celular aspecto prominente. En el tipo Eosinofílico, las células son más pequeñas y su citoplasma contiene finos gránulos eosinófilos. El núcleo en ambas células es hipercromático y con cierta frecuencia doble, grandes, sin nucléolo prominente y con baja actividad mitótica. (3).
El CCR cromófobo no se puede clasificar mediante el sistema de clasificación de la OMS/ISUP (anteriormente Fuhrman) debido a su atipia nuclear innata. Se ha propuesto un sistema de clasificación alternativo, pero aún debe validarse (3).
La citogenética muestra pérdida de cromosomas Y, pérdidas combinadas en cromosomas 1,2,6,10,13,17 y 21 y mutaciones en el gen TP53 en el 27% de los casos. (3).
El pronóstico es relativamente bueno, con una alta supervivencia libre de recurrencia (SLR) a 5 años y una SCE a 10 años. Las tasas de SLR a 5 y 10 años fueron del 94,3% y del 89,2%, respectivamente. La enfermedad recurrente se desarrolló en el 5,7% de los pacientes y el 76,5% presentó metástasis a distancia con un 54% de los diagnósticos de enfermedad metastásica que involucraban un solo órgano, más comúnmente el hueso. (3).
Clínica
Dr. César Vicherat
El Carcinoma de Células Renales puede presentar diversos signos y síntomas (Tabla 11). En estadios precoces, es muy pobre en sintomatología. Por su localización retroperitoneal, muchas masas renales permanecen no palpables hasta avanzada la enfermedad. Actualmente cerca del 60% de las masas renales son detectadas de manera incidental, por lo que la mayoría de los pacientes son asintomáticos (9-15).
Los síntomas asociados al cáncer renal se relacionan a crecimiento tumoral, hemorragia, metástasis y/o síndromes paraneoplásicos (Tabla 12). Dolor en el flanco puede ocurrir por hemorragia (hematoma perirrenal), obstrucción por coágulos, o en enfermedad localmente avanzada. La triada clásica compuesta por dolor en flanco, hematuria (hasta 40% de los pacientes) y masa palpable se presenta solo en el 9% de los pacientes y sugiere enfermedad localmente avanzada (14). Así, algunos autores, la han calificado como la “tríada del demasiado tarde”.
Hematuria macro o microscópica se observa en 40 a 60% de los pacientes. Cuando es severa, con coágulos, se manifiesta con cólico renal. Masa abdominal o en flanco, se asocia habitualmente a tumores del polo inferior, palpable, especialmente en pacientes delgados, o a grandes masas, palpables, a veces visibles a la inspección, en pacientes caquécticos con tumores avanzados (3). La presencia de varicocele de inicio súbito o que no desaparece con el decúbito se puede presentar hasta en el 11% de los pacientes (15) y se produce por obstrucción de la vena gonadal a nivel de su desembocadura en la vena renal. En caso de compromiso de la vena cava inferior se puede producir edema bilateral de extremidades inferiores, ascitis, disfunción hepática y trombo embolismo pulmonar.
Otros síntomas de enfermedad avanzada corresponden a baja de peso, fiebre, sudoración nocturna, varicocele no reductible, edema de ambas extremidades inferiores (secundario a compromiso venoso). Adenopatía cervical o síntomas como dolor óseo o tos persistente son menos frecuentes.
| De diagnóstico incidental | Diagnóstico por Imágenes |
| Crecimiento Tumoral | Hematuria
Dolor del Flanco Masa abdominal Hematoma Perirrenal |
| Metástasis | Dolor óseo
Tos persistente Adenopatía Cervical Baja de peso, fiebre, sudoración nocturna |
|
Obstrucción vena cava inferior |
Edema de Extremidades Inferiores (bilateral)
Varicocele no reductible, o derecho |
| Síndromes Paraneoplásicos | Hipercalcemia
Hipertensión Arterial Policitemia Síndrome de Stauffer |
Tabla 11. Presentación Clínica del Cáncer renal
Síndromes Paraneoplásicos
Los Síndromes Paraneoplásicos (SPN) son definidos como una constelación de síntomas y signos clínicos que ocurren en pacientes con una neoplasia conocida, los cuales afectan a órganos diferentes de los comprometidos por el tumor primario, y no están relacionados con el avance local ni distante del cáncer, como tampoco son causadas por deficiencias nutricionales o infecciones (16). Esta vinculación (CCR y SPN) llevó al CCR a hacerse acreedor del título de “el tumor del internista” a raíz de su frecuente relación con una diversidad de manifestaciones clínicas asociadas a estos síndromes. El término “paraneoplasia” se utilizó por primera vez en 1949 por Guichard y Vignon en el momento en que describieron el diagnóstico diferencial de una paciente con neuropatía central y periférica en el contexto de metástasis de un cáncer de cérvix.
Los SPN se encuentran aproximadamente en el 20% de los pacientes con diagnóstico reciente de CCR y pueden alcanzar hasta un 40% durante la historia natural de la enfermedad, especialmente en estadios más avanzados (16). Algunos de estos tumores están ligados a una diversidad de estos síndromes, que se pueden presentar en forma aislada, o lo más frecuentemente, asociados entre ellos.
| SINDROME | % |
| Elevación de la VHS | 55,6 |
| Hipertensión arterial | 37,5 |
| Anemia | 36,3 |
| Caquexia, baja de peso | 34,5 |
| Pirexia | 17,2 |
| Disfunción hepática | 14,4 |
| Hipercalcemia | 4,9 |
| Policitemia | 3,5 |
| Neuromiopatía | 3,2 |
| Amiloidosis
Otros |
2,0 |
Tabla 12. Manifestaciones Paraneoplásicas del Cáncer Renal
Es importante valorar y reconocer los síndromes paraneoplásicos puesto que nos permiten sospechar el diagnóstico de un RCC subyacente no detectado, afectando las decisiones clínicas de tratamiento, la respuesta a las mismas y el seguimiento posterior de la enfermedad. (16-18).
Dentro de los SPN podemos identificar diferentes mecanismos por los cuales se producen estos fenómenos. Pueden ser en base a sustancias biológicamente activas como hormonas, pro-hormonas o sustancias con actividad “tipo-hormona”. En general son proteínas que son secretadas directamente por el tumor o moduladas por el sistema inmune a través de la producción de inmuno-complejos. Otros mecanismos permanecen en el espectro de causas poco esclarecidas (16).
Cabe destacar que la base biológica de algunos de estos síndromes en el CCR está relacionada con la intervención de citokinas, como la interleukina-6 (IL-6), la cual se eleva hasta en un 80% de los pacientes y confiere un peor pronóstico. Tendría directa intervención en la aparición de fiebre, Síndrome de Stauffer, trombocitosis y anemia (20). Sin embargo, los mecanismos específicos por los cuales se manifiestan los SPN aún son motivo de mayor análisis.
Hipercalcemia
Dentro de los SPN, la elevación del calcio ha sido uno de los más estudiados, ya que se ha descrito en una serie de otras neoplasias malignas como cáncer de mama, pulmón y vejiga. La presencia de hipercalcemia en cáncer renal se describe en un 4,9% en los últimos reportes, pero se ha descrito hasta en un 13- 20% en series más antiguas (21,22). A pesar de que dentro de los pacientes que debutan con hipercalcemia el 75% presentan carcinomas renales de alto grado y la mitad presentan metástasis al momento del diagnóstico, este síndrome paraneoplásico no ha mostrado ser un marcador de pronóstico de sobrevida (23).
La hipercalcemia se puede clasificar según su fisiopatología en:
–Hipercalcemia en base a la presencia de hormonas circulantes, como el péptido relacionado a PTH (PTH-rp).
-Hipercalcemia localizada osteolítica, causada por factores paracrinos como prostaglandinas secretadas por el tumor.
El PTH-rp es una poli-hormona de la familia de la paratohormona, familia la cual posee diversas actividades en relación a su splicing alternativo del transcrito primario. Las proteínas del tipo PTH-rp tienen la capacidad de tener control sobre la proliferación celular, muerte y diferenciación de muchos tipos celulares. La acción principal de estas proteínas es el aumentar la resorción ósea (acción pro-osteoclástica), aumentar la reabsorción de fosforo y disminuir el clearence renal de calcio.
El cuadro clínico va desde síntomas inespecíficos leves como la astenia, cefaleas, inapetencia, náuseas, y constipación, pudiendo llegar a síndromes confusionales, incluso hasta el coma. Cuando el calcio excede los 18mg/dL ocurre la muerte (22).
El laboratorio clásico de este síndrome es con niveles de calcio plasmático elevado junto a un descenso en los de fosforo y cloro, baja PTH o en el límite inferior y niveles altos de fosfatos en orina. La resolución quirúrgica del tumor hace remitir generalmente este cuadro, y a excepción de los cuadros severos la hipercalcemia no necesita tratamiento farmacológico, siendo la hidratación con soluciones fisiológicas suficiente para lograr mantener niveles seguros de calcio en sangre.
Hipertensión arterial y policitemia
Definida como la aparición o el deterioro de esta condición preexistente (21). La hipertensión arterial es otro síndrome importante comúnmente encontrado en los pacientes con CCR, presentándose hasta en un 37,5% de los pacientes que presentan un cuadro paraneoplásico concomitante.
La hipertensión asociada a CCR puede ser secundaria directamente al aumento de la producción de renina por parte del tumor o asociado a la isquemia del parénquima renal; secundario a la compresión o encarcelamiento de la arteria renal o una de sus ramas, lo que conduce a una estenosis arterial; o una fistula arteriovenosa dentro del tumor. Causas menos comunes incluyen la policitemia, hipercalcemia, obstrucción ureteral y el aumento de la presión intracraneana asociado a metástasis cerebrales (7).
La presencia de hipertensión ha sido asociada tanto a tumores renales órgano confinados como también en el caso de la enfermedad metastásica y se resolvería con la nefrectomía (en promedio dentro del mes siguiente a la cirugía). La presencia aislada de HTA como SPN estaría asociada al estadio tumoral, pero requiere mayores estudios para determinarlo con certeza (22).
Policitemia
La policitemia, definida como un hematocrito >50% en hombre y >36% en mujeres (23), está presente en 1 a 8% de los pacientes con CCR (7). Puede estar asociada a un incremento en la producción de eritropoyetina, ya sea directamente por el CCR o por el parénquima adyacente en respuesta a la hipoxia inducida por el crecimiento tumoral; y en base a algunos estudios, pudiera predecir la respuesta a la inmunoterapia (24). Tanto la presencia de HTA y policitemia, estarían relacionadas con la expresión del factor de crecimiento vascular endotelial (VEGF) (23).
Síndrome de Stauffer
Descrita en 1961, es uno de los síndromes más singulares asociados al CCR. La disfunción hepática no metastásica ha sido reportada entre un 3-20% de los casos. La mayoría de los pacientes presentan una elevación de las fosfatasas alcalinas séricas, 67% tienen un aumento del tiempo de protrombina o hipoalbuminemia, y entre un 20 – 30% presentan niveles de bilirrubinemia o transaminasas elevadas. Otros hallazgos comunes incluyen trombocitopenia y neutropenia (16).
Es común la presencia de síntomas típicos como fiebre y baja de peso, así también en algunos pacientes se encuentras pequeñas áreas de necrosis hepática. En este contexto, la presencia de metástasis hepáticas debe ser descartada.
La realización de una biopsia debe ser realizada cuando esté indicada, la que frecuentemente demuestra una hepatitis inespecífica asociada a una importante infiltración linfocítica del tejido hepático. Niveles elevados de IL-6 han sido encontrados y hace pensar que esta y otras citokinas pudieran jugar un rol patogénico (20). La función hepática se normaliza después de la nefrectomía entre un 60–70% de los casos. La persistencia del cuadro, o la recurrencia de la disfunción hepática, son casi siempre indicativos de la presencia de tumor viable, y por lo tanto representa un mal pronóstico.
Otras manifestaciones
Pirexia: Se presenta como un estado febril sin foco. Debido a que la hemorragia y necrosis es un fenómeno común en los cuadros de CCR, se cree que la fiebre estaría originada en el aumento de la reabsorción de las sustancias y desechos necróticos (24)
Anemia: En general, la presencia de anemia no parece ser secundaria a la pérdida de sangre crónica o hematuria persistente. Se presenta como una anemia normocítica-normocrómica, probablemente secundaria a mala alimentación, depresión de la medula ósea hematopoyética (24) asociada a la producción tumoral de proteínas ligadoras de fierro, ferritina y lactoferrina (25,26). El hematocrito de estos pacientes regresa a la normalidad luego de la nefrectomía.
Leucocitosis: Presente con cierta frecuencia, este SPN ha sido relacionado con la producción tumoral del factor de estimulación de colonias de granulocitos (G-CSF) que promueve el desarrollo de neutrófilos maduros por parte de las células progenitoras hematopoyéticas (27).
Neuropatía: La neuropatía inducida por el CCR es un evento raro y puede deberse a la afección del nervio fémorocutaneo por una gran masa renal, lo que induce dolor intenso y parestesias de la cara antero lateral del muslo, puede ser tratada exitosamente con la resección cuidadosa del tumor primario con preservación del nervio (28).
Entre otros cuadros clínicos asociados a los SPN se describen alteraciones poco frecuentes asociadas como la esclerodermia, alteraciones de la ferritina, hipoglicemia e hiperprolactinemia, amiloidosis y osteomalacia entre otros.
En general, el tratamiento de los SPN está asociado al tratamiento quirúrgico del CCR o terapia sistémica de los focos de metástasis. A excepción de la hipercalcemia, la terapia médica de estos síndromes no ha demostrado ser útil (7).
A pesar de que los SPN asociados al CCR son eventos conocidos que se presentan con cierta frecuencia al momento del diagnóstico o como factor desencadenante del estudio clínico de un paciente que demuestra la presencia de una neoplasia renal, destaca la existencia de escasas publicaciones y estudios realizados con el fin de conocer más en profundidad este amplio espectro de manifestaciones clínicas.
Diagnóstico
Dr. César Vicherat
En cuanto al Screening poblacional, hasta el momento no se han identificado biomarcadores urinarios o séricos clínicamente validados. No se puede recomendar la tomografía computarizada debido a su coste, la dosis de radiación y el mayor potencial de otros hallazgos incidentales. Se podría utilizar la ecografía y tiene una sensibilidad y especificidad aceptables, aunque depende del tamaño del tumor y del operador.
Los esfuerzos entonces deben dirigirse a individuos de alto riesgo y/o combinar la detección de CCR con otros exámenes de salud de rutina puede representar opciones pragmáticas para mejorar la relación costo-efectividad. (3)
Laboratorio
Hallazgos como anemia, alteración en los parámetros de función hepática (Síndrome de Stauffer), aumento de lactato deshidrogenasa, aumento de fosfatasas alcalinas o aumento de la calcemia puede ser signos de enfermedad avanzada (29).
La estimación de la función renal es también un elemento importante, puesto que la presencia de enfermedad renal crónica tiene impacto en la elección del tratamiento. Se estima que entre en 20% y 40% de los pacientes mayores de 70 años con diagnóstico de CCR presentan ERC etapa III o superior (29-30).
Si hay presencia de masa renal que compromete la zona central o invade el sistema colector, el estudio de la citología en orina asociado a una evaluación endoscópica de la lesión puede ser útil para descartar carcinoma urotelial.
Tomografía Axial Computarizada (TAC)
Se estima que el 50% de los mayores de 50 años tienen al menos una masa renal quística o sólida, la mayoría de estas benignas (31). La tomografía computada multidetector (TCMD) es el examen de elección para la evaluación de pacientes con hematuria y sospecha de tumor renal, ya que permite hacer estudios multifásicos rápidos con buena diferenciación entre las estructuras con reconstrucciones multiplanares y en 3D (32).
La presencia de una masa renal sólida con un incremento mayor a 15 a 20 UH entre la fase pre-contraste y post-contraste es indicador de CCR. Por el contrario, una masa sólida con captación de -20 UH es indicativa de grasa y hace el diagnóstico de angiomiolipoma. Además, la TAC aporta información acerca de los límites tumorales, vasos renales, sistema colector y compromiso tumoral linfático o suprarrenal, lo que ayuda a la planificación quirúrgica (33).
Otra posibilidad es la aparición de una lesión quística, lo que determina la necesidad de diferenciar una lesión quística benigna de una maligna, para lo que nos basamos en la clasificación de Bosniak que divide las lesiones renales quísticas observadas en una TAC en 5 categorías dependiendo de la probabilidad de malignidad de la lesión, basado en las características de la pared de la lesión, presencia, grosor y contorno de tabiques, cantidad, características y localización de calcificaciones intralesionales y la presencia de componentes sólidos. Esta clasificación nace en la década de los 80 y se ha modificado en 2005 y en 2019 (34).
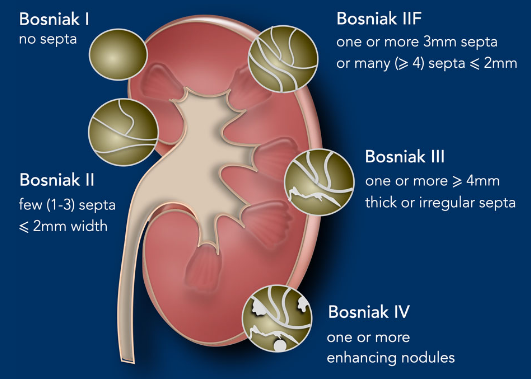
Figura 2: Clasificación de Bosniak: General. Chris Lunt y Frederieke Elsinger, 2019, Masas renales Quísticas, BC Cáncer Agency Vancouver, 2022.
Una revisión sistemática y un metanálisis de 2025 determinaron que la clasificación Bosniak de 2019 proporciona una mejor especificidad diagnóstica y confiabilidad entre evaluadores que la versión de 2005, lo que podría mejorar la toma de decisiones clínicas y disminuir el sobre tratamiento en el manejo de masas renales quísticas (34).
En bosniak 2019 se emplea el término «clase», reemplazando el uso de «categoría» en 2005 para los diferentes grupos (34).
Clasificación
La nueva versión tiene criterios separados para TC y RM:
Clase I
TAC
- pared lisa, delgada y bien definida (≤2 mm)
- fluido simple homogéneo (-9 a 20 HU)
- sin septos ni calcificación
- La pared puede realzarse tras la administración de contraste.
RNM
- pared lisa, delgada y bien definida (≤2 mm)
- fluido simple homogéneo (intensidad de señal similar al LCR)
- sin septos ni calcificación
- La pared puede realzarse tras la administración de contraste
CONDUCTA
- Quiste renal simple benigno que no requiere seguimiento.
Clase II
TAC
- seis tipos, todos con paredes lisas y delgadas (≤2 mm)
- Masas quísticas con tabiques delgados (≤2 mm) y pocos (1-3)
- Los tabiques y la pared pueden realzarse
- Puede tener calcificaciones de cualquier tipo (aunque si la calcificación es gruesa y nodular, considere una resonancia magnética antes de asignar una clase)
- masas hiperatenuantes homogéneas (≥70 HU) en la TC sin contraste
- Masas homogéneas sin realce >20 HU en el protocolo de masa renal TC
- Puede tener calcificaciones de cualquier tipo (aunque si la calcificación es gruesa y nodular, considere una resonancia magnética antes de asignar una clase)
- masas homogéneas (-9 a 20 HU en TC sin contraste)
- masas homogéneas (21 a 30 HU en la TC de fase venosa portal)
- Masas homogéneas de baja atenuación que son demasiado pequeñas para caracterizarlas.
- Masas quísticas con tabiques delgados (≤2 mm) y pocos (1-3)
RNM
- tres tipos, todos con paredes lisas y delgadas (≤2 mm)
- masas quísticas con
- tabiques delgados (≤2 mm) y pocos (1-3) realzados
- cualquier septo que no realce
- calcificación de cualquier tipo
- Masas homogéneas marcadamente hiperintensas en T2W (similares al LCR) en la resonancia magnética sin contraste
- Masas homogéneas marcadamente hiperintensas en T1W (aproximadamente 2,5 veces la intensidad de la señal parenquimatosa normal) en la resonancia magnética sin contraste.
- masas quísticas con
CONDUCTA
- Quiste renal benigno tipo Bosniak II que no requiere seguimiento.
- «Probable masa renal benigna de Bosniak II que no requiere seguimiento»
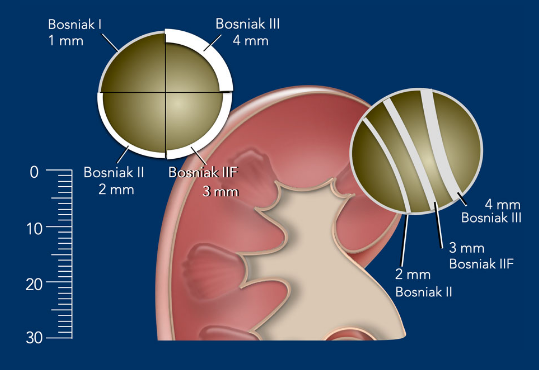
Figura 3: Clasificación de Bosniak: Pared y Tabiques. Chris Lunt y Frederieke Elsinger, 2019, Masas renales Quísticas, BC Cáncer Agency Vancouver, 2022.
Clase IIF
TAC
- Pared lisa mínimamente engrosada (3 mm) que realza
- Engrosamiento mínimo liso (3 mm) de uno o más tabiques realzados
- muchos (≥4) septos lisos, delgados (≤2 mm) y realzados
RNM
- dos tipos:
- masas quísticas con
- Pared lisa mínimamente engrosada (3 mm) que realza
- Engrosamiento mínimo liso (3 mm) de uno o más tabiques realzados
- muchos (≥4) septos lisos, delgados (≤2 mm) y realzados
- Masas quísticas que son heterogéneamente hiperintensas en imágenes T1W saturadas en grasa sin contraste.
- masas quísticas con
CONDUCTA
- Masa renal quística de IIF de Bosniak. La gran mayoría de las masas de IIF de Bosniak son benignas. Cuando son malignas, casi todas son indolentes. Generalmente, se realiza un seguimiento de las masas de IIF de Bosniak mediante imágenes a los 6 y 12 meses, y luego anualmente durante un total de 5 años para evaluar cambios morfológicos.
Clase III
TAC
- una o más paredes o tabiques que son
- aumento de espesor (≥4 mm de ancho)
- realce irregular (que muestra protuberancias convexas con márgenes obtusos de ≤3 mm)
RNM
- una o más paredes o tabiques que son
- aumento de espesor (≥4 mm de ancho)
- realce irregular (que muestra protuberancias convexas con márgenes obtusos de ≤3 mm)
CONDUCTA
- Las masas Bosniak III tienen una probabilidad intermedia (50%) de ser malignas. Si aún no se han obtenido, considere consultar con un urólogo.
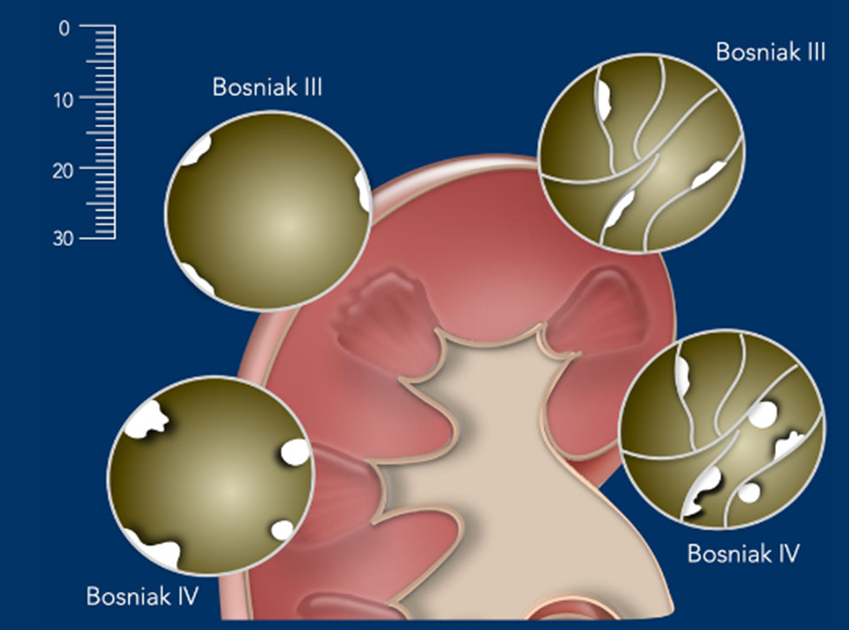
Figura 4: Clasificación de Bosniak: Nódulos y protrusiones. Chris Lunt y Frederieke Elsinger, 2019, Masas renales Quísticas, BC Cáncer Agency Vancouver, 2022.
Clase IV
TAC
- uno o más nódulos realzados
- Protrusión convexa ≥4 mm con márgenes obtusos
- una protuberancia convexa de cualquier tamaño que tiene márgenes agudos
RNM
- uno o más nódulos realzados
- Protrusión convexa ≥4 mm con márgenes obtusos
- una protuberancia convexa de cualquier tamaño que tiene márgenes agudos
CONDUCTA
- Masa renal quística Bosniak IV. La gran mayoría (hasta el 90%) de las masas Bosniak IV son malignas. Tratamiento activo
Sugerimos visitar el siguiente enlace externo:
- Calculadora de lesiones quísticas renales (TC) de Bosniak 2019 – Rad At Hand
- https://radathand.com/radiology-calculators/body-imaging/bosniak-classification-of-renal-cyst-cystic-mass-ct-mri/
A pesar de la alta sensibilidad de la TCMD para el diagnóstico de CCR (cercana al 100% en masas mayores de 15 mm de diámetro), aproximadamente el 10% de las masas renales serán indeterminadas, por lo que necesitarán estudio imagenológico adicional. A su vez, cerca del 20% de las masas renales pequeñas, sólida e hipercaptantes, sugerentes de CCR en la TC, tienen un diagnóstico histólogo postquirúrgico benigno como oncocitomas o angiomiolipomas pobres en grasa (35).
Resonancia Nuclear Magnética (RNM)
Una alternativa aceptable a la TAC es la RNM, cuyos resultados son considerados comparables a los de la TAC por el Colegio Americano de Radiología, y ofrece algunas ventajas, como una resolución mejorada con contraste, posibilidad de realizar técnicas funcionales, la factibilidad de poder realizarla en pacientes con alergia al medio de contraste yodado y la ausencia de radiación ionizante, característica que cobra mayor importancia al momento de evaluar a pacientes embarazadas. Una consideración importante con la RNM es la nefrotoxicidad inducida por gadolinio y la falla renal aguda que puede ocurrir en pacientes con enfermedad renal crónica preexistente, por lo que el método imagenológico ideal en pacientes con enfermedad renal crónica sigue siendo controversial (9).
La resonancia magnética puede proporcionar información adicional sobre la afectación venosa si la extensión de un trombo tumoral en la vena cava inferior (VCI) está mal definida en la TC (36) (NE: 3). En la RM, especialmente las imágenes ponderadas en T2 de alta resolución proporcionan una mejor delineación del trombo tumoral superior, ya que el flujo sanguíneo realzado puede verse reducido debido al extenso crecimiento oclusivo del trombo tumoral en la VCI. La imagen ponderada en T2, con su contraste intrínseco, permite una buena delineación (37)
La resonancia magnética está indicada en pacientes alérgicos al medio de contraste intravenoso para TC y en el embarazo sin insuficiencia renal (38) (grado de comprobación científica: 3). La resonancia magnética permite la evaluación de un realce dinámico sin exposición a la radiación. Se están explorando técnicas avanzadas de resonancia magnética, como la ponderada por difusión (DWI) y la ponderada por perfusión, para la evaluación de la masa renal (39). Recientemente, se informó del uso de la resonancia magnética multiparamétrica (mpMRI) para diagnosticar el CCRcc mediante una puntuación de probabilidad de células claras (ccLS) en SRM (40). La ccLS es una clasificación de 5 niveles que denota la probabilidad de que una masa represente un CCRcc, que va de “muy improbable” a “muy probable”. Los autores validaron prospectivamente el rendimiento diagnóstico de la ccLS en 57 pacientes con tumores cT1a y encontraron una alta precisión diagnóstica. El rendimiento diagnóstico del ccLS basado en mpMRI se validó aún más en una cohorte retrospectiva más grande (n = 434) en todos los tamaños y estadios tumorales (41), y se encontró que el ccLS era un factor pronóstico independiente para identificar CCRcc.
Para el diagnóstico de quistes renales complejos (Bosniak IIF-III), la RMN puede ser preferible. La precisión de la TC es limitada en estos casos, con baja sensibilidad (36%) y especificidad (76%; κ = 0,11); la RMN, debido a una mayor sensibilidad al realce, mostró una sensibilidad del 71% y una especificidad del 91% (κ = 0,64). La ecografía con contraste mostró alta sensibilidad (100%) y especificidad (97%), con un valor predictivo negativo del 100% (κ = 0,95) (42).
Ecotomografía Renal (Ultrasonografía)
Más del 80% de los tumores renales asintomáticos son diagnosticados de manera incidental mediante ultrasonografía (43). Este examen que cuenta con una sensibilidad del 70% para detección de tumores renales mayores a 1,5 cm (44). Sin embargo, cuenta con la dificultad técnica de su realización en pacientes obesos, limitación de la visibilidad en pacientes con meteorismo intestinal, menos precisión en la descripción de tamaño y localización de la masa y el hecho de ser un examen operador y equipo dependiente.
Dentro de sus ventajas tenemos que es un examen económico, no invasivo y de fácil acceso. Además, nos permite poder diferenciar una lesión sólida de una quística. En el caso de este último, tiene la capacidad de diferenciar entre un quiste renal simple, que son las lesiones benignas renales más frecuentes (70% de las masas asintomáticas, entre 20% y 50% en la población general) y uno complejo, por lo tanto, potencialmente quirúrgico. Los elementos diagnósticos ecográficos de un quiste renal simple son una pared lisa, de forma redonda u oval, sin elementos hiperecoicos en su interior y con presencia de sombra acústica posterior.
Por su parte, la descripción de un quiste complejo debe incluir las características de la pared, cantidad y características de los septos, presencia de calcificaciones y de componentes sólidos en su estructura. A su vez, si las características de la lesión no son claramente compatibles con un quiste simple, el estudio se debe complementar con una TAC.
Estudios radiográficos para evaluar metástasis de CCR
La TC de tórax es precisa para la etapificación torácica (45). Se ha propuesto el uso de nomogramas para calcular el riesgo de metástasis pulmonares según el tamaño del tumor, el estadio clínico y la presencia de síntomas sistémicos (46). Estos se basan en grandes conjuntos de datos retrospectivos y sugieren que la TC de tórax puede omitirse en pacientes con cT1a y cN0, y sin síntomas sistémicos, anemia o trombocitemia, debido a la baja incidencia de metástasis pulmonares (<1%) en este grupo de pacientes.
Existe un consenso de que la mayoría de las metástasis óseas son sintomáticas en el momento del diagnóstico; por lo tanto, las imágenes óseas de rutina generalmente no están indicadas (47). Sin embargo, el cintigrama óseo, la TC cerebral o la RMN se pueden utilizar en presencia de signos y síntomas clínicos o de laboratorio específicos (48).
Biopsia renal
La biopsia renal percutánea es un método diagnóstico que nos permite revelar la histología de la masa renal con una sensibilidad y especificidad del 92% y 90% respectivamente, teniendo un valor predictivo positivo del 99,8% en dos 2 metaanálisis (49). Sin embargo, existen reportes de biopsias renales percutáneas no diagnósticas (por material insuficiente, parénquima renal normal, fibrosis o necrosis) que oscilan entre el 10% y el 20% (50). Los resultados mejoran tras la repetición de la biopsia.
El actual aumento en el hallazgo incidental de tumores renales de pequeño tamaño asociado a la ampliación en las opciones de tratamiento mínimamente invasivas, como la termoablación, crioablación o la vigilancia activa, ha producido un nuevo interés por la utilización de la biopsia en masas renales en pacientes seleccionados, en los cuales el diagnóstico por imágenes es insuficiente. Aunque los estudios por imagen son la primera herramienta diagnóstica en el estudio de las masas renales, en muchos casos, la biopsia con aguja gruesa juega un rol crucial en la toma de decisiones clínicas. La biopsia de las masas renales pequeñas (cT1a) todavía genera controversias. Quienes se oponen a esta técnica cuestionan su seguridad y la correlación del diagnóstico patológico entre la biopsia y la extirpación completa de la masa. Por otra parte, las masas renales menores de 4 cm son benignas un 25% de los casos y muchos consideran que esto implica un alto número de pacientes que se operarán innecesariamente.
Así, se han establecido varias indicaciones para la realización de una biopsia renal, entre las que se incluyen:
1) Pacientes con un tumor probablemente maligno, pero en el cual no está indicada la cirugía.
2) Masa renal indeterminada, que puede ser benigna y por lo tanto no necesite tratamiento.
3) Masas pequeñas sólidas. Esto se sustenta en que mientras más pequeño es el tumor, es más probable que sea benigno.
4) Paciente con sospecha de masa renal metastásica. Aproximadamente un 7-13% de los pacientes con cáncer metastatizan al riñón.
5) Tumor renal irresecable, porque el tumor es localmente avanzado o porque es metastásico al diagnóstico. La biopsia es importante para determinar el subtipo histológico y guiar el tratamiento sistémico.
6) En pacientes con importantes comorbilidades, en el que es necesario conocer la relación riesgo/ beneficio de una cirugía.
7) Masas en las que se plantee un tratamiento ablativo, en las que es necesario conocen el subtipo histológico, previo al tratamiento.
El diagnóstico histológico incluye, además del tipo de CCR, la evaluación del grado nuclear ISUP, las características sarcomatoides, la invasión vascular, la necrosis tumoral y la invasión del sistema colector y la grasa perirrenal, las categorías pT o incluso pN. El sistema de clasificación de cuatro niveles de la OMS/ISUP ha reemplazado al sistema de clasificación de Fuhrman (3).
Durante el estudio de la biopsia renal hay que considerar:
• Subtipo histológico: El ratio de acierto en el subtipo histológico varía entre el 86 y 98% y la correlación interobservador es alta. Existen dificultades como, por ejemplo, en los tumores híbridos (cromófobo/oncocitoma), ya que dependen de la zona que se biopsie y también existen dificultades en diferenciar un oncocitoma de un cromófobo aún con la ayuda de la inmunohistoquímica. En los tumores con células claras existen dificultades entre el carcinoma renal de células claras y el carcinoma túbulo-papilar de células claras.
• El grado histológico: La literatura refleja un comportamiento subóptimo de la biopsia renal para gradar los tumores renales en comparación con la pieza quirúrgica. La presencia de un bajo grado en la biopsia renal no excluye un alto grado en el estudio completo del tumor. Existe peor reproducibilidad interobservador. Identificar un alto grado en la biopsia renal tiene un alto valor predictivo positivo.
• Lesiones oncocíticas: Es particularmente difícil diferenciar estas entidades en las biopsias renales. En este caso se plantea el diagnóstico diferencial entre: oncocitoma, carcinoma híbrido, carcinoma cromófobo y carcinoma papilar tipo 2. En estos casos ayuda el uso de técnicas de inmunohistoquímica y, si persisten las dudas, obtener una nueva muestra y su análisis por un uropatólogo experto mejora el diagnóstico.
Las complicaciones inherentes al procedimiento consisten en:
- Sangrado: Puede ocurrir en el sistema colector (produciendo hematuria micro o macroscópica en el 3,5% de los casos), subcapsular (caracterizado por dolor), o en el espacio perinéfrico, (produciendo hematoma y una potencial caída del hematocrito con necesidad de transfusión, 0,9% de los casos). Tal severidad de hemorragia requiere de una nefrectomía en el 0,01% de las situaciones. La mortalidad por sangramiento se asocia al 0,02%. La mayoría de los eventos hemorrágicos e reconocen 12 a 24 horas posterior a la biopsia (44).
- Dolor cólico y lumbar: Si es persistente mayor a 12 horas (4%) es indicativo de obstrucción ureteral por coágulos o hematomas subcapsulares.
- Fístulas arteriovenosas: Generalmente son silentes y resuelven espontáneamente en 1 o 2 años. El diagnóstico de confirma con eco doppler o arteriografía.
- Infección del tejido perirrenal: Con una presentación del 0,2%, la mayoría de ellos se observa en pacientes con infecciones activas del parénquima renal.
- Sembrado tumoral: Extremadamente raro (51)
Evaluación genética
El cáncer renal puede estar relacionado con una alteración de la línea germinal monogénica hereditaria o de novo y este reconocimiento tiene implicaciones significativas (52). Se cree que el cáncer de riñón hereditario representa el 5-8% de todos los casos de cáncer de riñón, aunque es probable que esta cifra sea una subestimación, ya que un estudio más reciente encontró mutaciones de la línea germinal en hasta el 38% de todos los pacientes con cáncer de riñón metastásico (53). Los pacientes con una predisposición de la línea germinal al cáncer de riñón a menudo requieren enfoques multidisciplinarios; es fundamental que los médicos estén familiarizados con cómo y cuándo se justifica la derivación para asesoramiento, los métodos de pruebas genéticas, las implicaciones de los hallazgos, la detección de órganos en riesgo (no renales) y el protocolo de detección para los miembros de la familia.
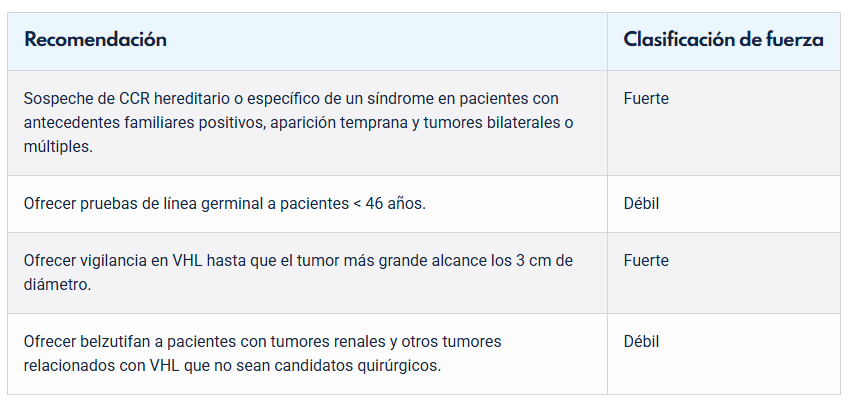
Tabla 13: Recomendaciones de estudio genético. Guía EAU 2025.
Pronóstico
Dr. Juan Carlos Rojas
Los factores pronósticos se pueden clasificar en: anatómicos, histológicos, clínicos y moleculares (54).
Factores anatómicos
El tamaño del tumor, la invasión y extensión venosa, la invasión del sistema colector, la invasión de la grasa perinefrítica y sinusal, la afectación suprarrenal y la metástasis de ganglios linfáticos y a distancia se incluyen en el sistema de clasificación TNM.
El estadio patológico es el factor predictor más importante de sobrevida en pacientes con cáncer renal.
Según la Clasificación TNM, la sobrevida a 5 años alcanza en promedio: T1 88-100%, T2-T3a 60%, T3b 15-20% y T4 0-20% (55), (ver tabla 14). La literatura nacional demostró para los pacientes con cáncer renal localizado tratados con Nefrectomía Radical Laparoscópica una sobrevida a 5 años de 80-90% (56).
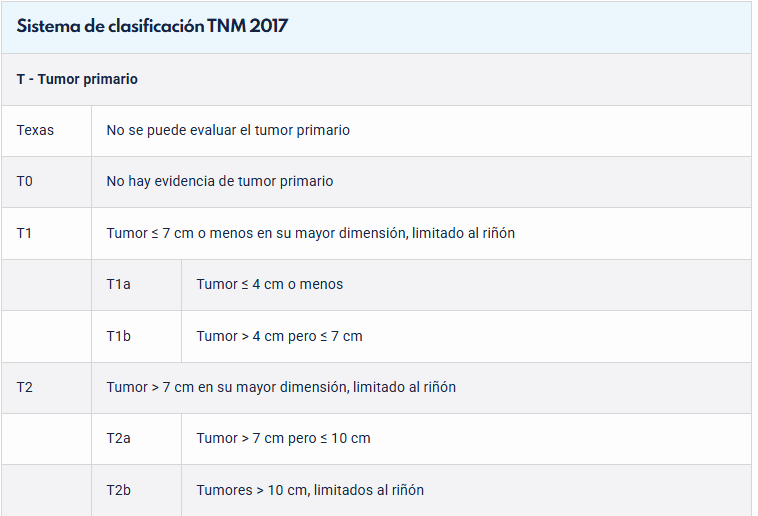


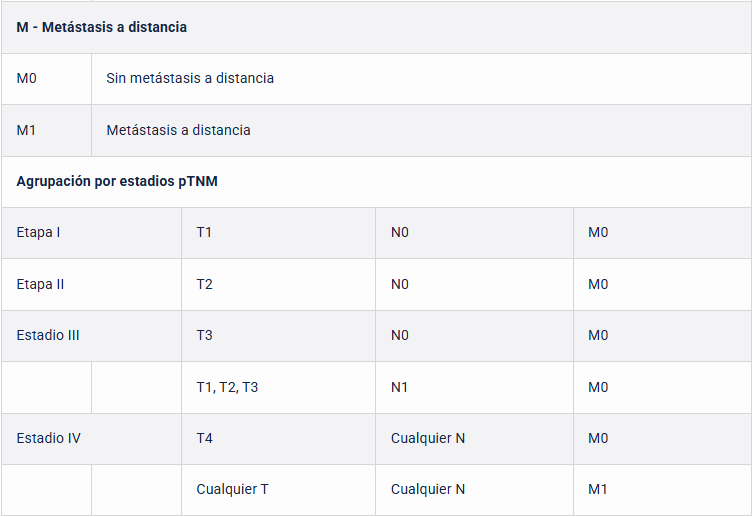
Tabla 14: Clasificación TNM. Guía EUA 2025.
Hay un servicio de asistencia para preguntas específicas sobre la clasificación TNM disponible en http://www.uicc.org/tnm . *Adaptado del Comité Conjunto Estadounidense sobre el Cáncer (AJCC), 8ª edición, 2017.
Factores histológicos
Los factores histológicos incluyen el grado del tumor, el subtipo de CCR, la invasión linfovascular, la necrosis tumoral y la invasión del sistema colector. El grado del tumor se considera uno de los factores pronósticos histológicos más importantes. El grado nuclear de Fuhrman ahora ha sido reemplazado por la clasificación de clasificación de la OMS/ISUP. Esta se basa únicamente en la prominencia del nucléolo para los tumores de grado 1 a 3, lo que permite una menor variación entre observadores. Se ha demostrado que la clasificación de la OMS/ISUP proporciona información pronóstica superior en comparación con la clasificación de Fuhrman, especialmente para los tumores de grado 2 y grado 3. Los cambios rabdoides y sarcomatoides se pueden encontrar en todos los tipos de CCR y son equivalentes a los tumores de grado 4. Los cambios sarcomatoides se encuentran con mayor frecuencia en el CCRch que en otros subtipos. El porcentaje del componente sarcomatoide también parece ser pronóstico, y un mayor porcentaje de afectación se asocia con una peor supervivencia.
Factores clínicos
Los factores clínicos incluyen el estado funcional (PS), los síntomas locales, la caquexia, la anemia, el recuento de plaquetas, el recuento de neutrófilos, el recuento de linfocitos, la PCR , la albúmina y varios índices derivados de estos factores, como la relación neutrófilos a linfocito (NLR) . Como marcador de la respuesta inflamatoria sistémica, un NLR preoperatorio alto se ha asociado con un pronóstico malo, pero hay una heterogeneidad significativa en los datos y no hay acuerdo sobre el punto de corte pronóstico óptimo. Aunque la obesidad es un factor etiológico del CCR, también se ha observado que proporciona información pronóstica. Un índice de masa corporal (IMC) alto parece estar asociado con mejores resultados de supervivencia en el CCR no metastásico y metastásico. Esta asociación es lineal con respecto a la mortalidad específica por cáncer (CSM), mientras que los pacientes obesos con CCR muestran una mortalidad por todas las causas creciente con el aumento del IMC.
Factores moleculares
Se han investigado numerosos marcadores moleculares como la anhidrasa carbónica IX (CaIX), VEGF, HIF, Ki67 (proliferación), p53, p21, ciclo celular de PTEN (homólogo de fosfatasa y tensina) , E-cadherina, osteopontina CD44 (adhesión celular) , CXCR4 PD-L1 , miRNA, SNP, mutaciones genéticas y metilaciones genéticas . Si bien la mayoría de estos marcadores están asociados con el pronóstico y muchos mejoran la discriminación de los modelos de pronóstico actuales, se ha puesto muy poco énfasis en los estudios de validación externa. Además, no hay evidencia concluyente sobre el valor de los marcadores moleculares para la selección del tratamiento en el CCRm. Por lo tanto, no se recomienda su uso rutinario en la práctica clínica.
Si bien se estudian en la actualidad numerosos marcadores moleculares como factores pronósticos, ninguno ha demostrado aumentar la precisión de los factores pronósticos tradicionales, carecen de validación internacional y su uso en la toma de decisiones aún no es recomendable (54).
Tabla 15: Características basales y supervivencia específica del cáncer de pacientes tratados quirúrgicamente según el tipo de CCR, EAU 2025. CSS = supervivencia específica del cáncer.
Tratamiento tumor localizado
Dr. Rodrigo Canales, Dr. César Vicherat
Consideraciones Generales
La misión de toda especialidad quirúrgica es resolver los problemas de sus pacientes e intentar curarlos mediante un gesto quirúrgico. Si bien este objetivo no siempre podrá lograrse, nos encontraremos con situaciones particulares en las que indicaremos un procedimiento quirúrgico cuyo objetivo no será la curación, sino que la paliación de los síntomas y, en consecuencia, una mejoría de su calidad de vida, aunque sin impacto en su supervivencia. Entre ambos escenarios, cabría incluir la cirugía citorreductora, en el que esperamos que nuestra intervención tenga un impacto en la supervivencia del paciente en el contexto de una estrategia terapéutica multimodal, para que los tratamientos sistémicos tengan una mejor respuesta al reducir la carga tumoral a tratar. Estos pacientes exigen una colaboración estrecha entre diversos especialistas, pudiendo ser necesaria la colaboración de cirujanos generales, cirujanos vasculares, radioterapeutas, oncólogos médicos, unidades del dolor y psiquiatras, entre otros.
La medicina moderna se basa en la prevención y por ende en el diagnóstico precoz. Esta premisa, así como la disponibilidad de imágenes nos ha permitido diagnosticar tumores renales malignos en un estadio cada vez más precoz, lo que por un lado nos brinda la posibilidad ser más eficaces en nuestros tratamientos con intención curativa y por otra parte aplicar el concepto de Cirugía Conservadora.
Tratamiento quirúrgico
En la actualidad, el Cáncer Renal se trata en su mayoría mediante técnicas mínimamente invasivas, destacando los abordajes laparoscópicos o asistidos por robot. Los procedimientos mínimamente invasivos han demostrado ventajas incuestionables desde el punto de vista de la morbilidad, tasas de transfusión, dolor postoperatorio, estancia hospitalaria e incluso desde un punto de vista cosmético. El urólogo oncológico debe tener la solvencia suficiente para abordar con garantías la cirugía oncológica por vía laparoscópica e, idealmente, estar familiarizado tanto con los abordajes transperitoneales como con los retroperitoneales.
Como pilar de toda decisión quirúrgica en el contexto del Cáncer Renal está la preservación de la función del órgano, no existen dudas sobre el beneficio de la cirugía conservadora puesto que la insuficiencia renal puede tener un impacto directo en la supervivencia de los pacientes, al aumentar el riesgo de eventos cardiovasculares. La conservación de nefronas se puede llevar a cabo mediante cirugía o a través de la aplicación de terapias ablativas.
La Masa Renal pequeña incluye en esta definición, a todo tumor renal menor a 4 cm, debido a su menor riesgo de metástasis. Así, se contempla incluso la posibilidad de la abstención terapéutica y el seguimiento de estos tumores.
En tumores renales pequeños de cara posterior, puede considerarse el abordaje laparoscópico retroperitoneal, que tendrá como beneficio un control más precoz de la arteria renal y una menor posibilidad de iatrogenia intestinal, si bien el espacio de trabajo será menor que en el abordaje transabdominal.
La ablación por radiofrecuencia, por microondas y la crioablación son 3 opciones de tratamiento en tumores corticales de hasta 3 cm, especialmente en pacientes frágiles que presenten un alto riesgo quirúrgico y en aquellos con deterioro severo de la función renal, monorrenos, CCR hereditario o con múltiples tumores bilaterales. En general, se recomienda una biopsia confirmatoria previa, como ya se mencionó.
La Nefrectomía Parcial (NP) es la técnica de elección en aquellos tumores de hasta 7 cm, pudiendo realizarse por cirugía abierta, laparoscópica o robótica. En general, se recomienda la Nefrectomía Radical Laparoscópica (NRL), si la NP no es técnicamente factible. En pacientes con compromiso de la función renal contralateral, en monorrenos y en pacientes con tumores renales bilaterales, la NP es una indicación imperativa.
Si bien la gran mayoría de los casos se realizan por vía de la laparoscopía, se debe tener presente la cirugía robótica como una mejor alternativa en aquellos casos de tumores renales complejos, en particular aquellas NP de tumores endofíticos centrales. Su indicación además dependerá de la disponibilidad del recurso y de la evaluación de los costos asociados.
En definitiva, ante tumores de diámetro máximo inferior a 7 cm, debemos considerar siempre la cirugía renal conservadora, en casos seleccionados las terapias ablativas y en tumores de diámetro máximo menor a 4 cm incluso el seguimiento.
Dado que los resultados oncológicos de la NP son comparables a los de la RN, la NP es el tratamiento de elección para el CCR T1, ya que preserva mejor la función renal y potencialmente limita la incidencia a largo plazo de trastornos cardiovasculares y enfermedad renal terminal (ERT). En pacientes frágiles, las decisiones de tratamiento deben individualizarse, sopesando los riesgos y beneficios de la NP frente a la RN, el mayor riesgo de complicaciones perioperatorias con la NP y el mayor riesgo de desarrollar o empeorar la enfermedad renal crónica (ERC) con la RN (3).
En tumores renales T2 (>7 cm) en general, la principal indicación será la NRL. Incluso en tumores mayores a 10 cm, la nefrectomía laparoscópica sigue siendo una opción, existiendo varios reportes que lo avalan. El uso de instrumentos especiales y de agentes hemostáticos disponibles en la actualidad, permite un mejor control de sangrado en casos como éstos, donde existirán un número mayor de vasos de neoformación.
Varios estudios actuales (3) que incluyen masas T2 tienen un alto riesgo de sesgo de selección debido al desequilibrio entre los grupos NP y NR con respecto a la edad del paciente, las comorbilidades, el tamaño del tumor, el estadio y la posición del tumor. Estos desequilibrios en los factores que influyen en el outcome del paciente pueden tener un mayor impacto en el resultado del paciente que la elección de NP o NR. Por lo anterior, se deben analizar los riesgos y beneficios de la NP con pacientes con tumores T2. En este contexto, se debe considerar la NP, si es técnicamente viable, en pacientes con riñón único, tumores renales bilaterales o enfermedad renal crónica con suficiente volumen parenquimatoso preservado para permitir una función renal posoperatoria adecuada.
En aquellos casos de tumores localmente avanzados (T3 y T4) la cirugía abierta sigue siendo un estándar, pero el abordaje laparoscópico debe siempre ser considerado, dependiendo de las particularidades técnicas del caso y de la experiencia del equipo quirúrgico.
Un metanálisis de nueve artículos que incluían 1278 pacientes con PN y 2113 pacientes con NR para RCC pT3a no mostró diferencias en los resultados de sobrevida a largo plazo lo cual indica que las técnicas de NP se pueden utilizar para obtener beneficios funcionales y si son técnicamente factibles (57)
La presencia de trombo tumoral por sí sola no contraindica la técnica laparoscópica, pero dependerá del nivel de extensión. El abordaje de estos casos se verá a continuación en un apartado específico que hemos considerado necesario incluir en esta revisión. En nuestra experiencia, los trombos que comprometan sólo parcialmente la vena renal no exigirán variaciones en la técnica laparoscópica habitual. Sin embargo, aquellos de mayor extensión, podrán requerir maniobras de extracción del trombo tumoral desde la vena renal. Cuando la extensión es aún mayor y cercana a la vena cava, recomendamos el uso de engrapadoras del tipo Endo-GIA para ocluir la vena renal a nivel yuxtacavo y, de esta forma, evitar la liberación de un émbolo tumoral o la transección del trombo, con el consecuente compromiso del margen oncológico. Cuando exista presencia de trombo en la vena cava, en general, se optará por cirugía abierta y, dependiendo de la extensión cefálica del trombo, podrán requerirse maniobras de movilización hepática con clampeo transitorio de la vena hepática o, aún más cefálica, abordaje combinado toracoabdominal con uso de circulación extracorpórea.
El abordaje laparoscópico debe indicarse para la cirugía citorreductiva, en particular en aquellos casos de riesgo bajo o intermedio, ya que permite una recuperación más rápida en comparación a la cirugía abierta y, de esta forma, permite un inicio precoz de los tratamientos sistémicos adyuvantes.
La edad no debe considerarse una limitante para la indicación del abordaje laparoscópico.
Por último, debemos tener siempre presente el concepto de ventana de oportunidad terapéutica. Ser oportunos en los diagnósticos y en el desarrollo de las estrategias para no perder dicha ventana y aumentar las posibilidades de éxito de nuestros tratamientos.
Un estudio prospectivo no aleatorizado comparó los resultados de la NR con o sin adrenalectomía ipsilateral (3). El análisis multivariable mostró que la ubicación del polo superior no predijo la afectación suprarrenal, pero sí el tamaño del tumor. No se observaron diferencias en la supervivencia global (SG) a los cinco o diez años con o sin adrenalectomía. La adrenalectomía se justificó mediante criterios basados en hallazgos radiográficos e intraoperatorios. Solo 48 de 2065 pacientes se sometieron a adrenalectomía ipsilateral concurrente, de los cuales 42 de las 48 intervenciones se realizaron por lesiones benignas.
La indicación para la disección de LN (LND) junto con NP o NR aún es controvertida. La evaluación clínica del estado de los LN se basa en la detección de un agrandamiento de los LN, ya sea por TC/RM o palpabilidad intraoperatoria de los nódulos agrandados. Menos del 20% de los nódulos metastásicos sospechosos (cN+) son positivos para enfermedad metastásica en el examen histopatológico (pN+) (3).
En un estudio retrospectivo grande, se compararon los resultados de NR con o sin LND, en pacientes con no-CCRm de alto riesgo utilizando un análisis de puntaje de propensión. La LND no se asoció significativamente con un riesgo reducido de metástasis distantes, mortalidad específica por cáncer o por todas las causas. La extensión de la LND no se asoció con mejores resultados oncológicos. (58)
Alternativas de tratamiento
Para determinar la vía terapéutica adecuada debe primero etapificarse correctamente al paciente. Para esto se utiliza la Clasificación TNM. Debe considerarse como “Localizado” a los Estadios I, II y III; es decir, a los tumores que se encuentran confinados al riñón y a los órganos vecinos (Glándulas Suprarrenales y Vena Renal/Cava) sin atravesar la fascia de Gerota (51).
De acuerdo a las Guías Clínicas NCCN del 2022 (9) recomiendan para el abordaje de tratamiento del Cáncer renal localizado el siguiente enfoque:

Figura 5: Algoritmo de decisión terapéutica. NCCN 2022
Figura 6: Algoritmo de decisión terapéutica. Etapa IV. NCCN 2022
Nefrectomía Parcial
La asociación entre la Enfermedad Renal Crónica y la morbimortalidad cardiovascular hacen que hoy día la intensión sea preservar tanto parénquima renal normal como sea posible, aparece entonces el concepto de Conservación de Nefrones (Nephron Sparing) (3). De esta manera, para los tumores menores a 7 cm de diámetro (T1 y de ubicación periférica), el procedimiento a realizar es la NP (la cual puede ser realizada por vía abierta, laparoscópica o robótica) y debe ser de elección en pacientes con función renal comprometida, monorrenos o con tumores bilaterales (9).
Se ha transformado como una alternativa de tratamiento ampliamente aceptada que produce resultados oncológicos prácticamente idénticos a la Nefrectomía radical en pacientes adecuadamente seleccionados que, a largo plazo, da lugar a una mejor función renal, disminución de la mortalidad global, reducción de la frecuencia de episodios cardiovasculares, logrando, por lo tanto, una mejor calidad de vida y sobrevida del paciente. Así, sólo en el caso que la nefrectomía parcial no sea posible se debe optar por la extirpación total del riñón afectado (59).
Los problemas potenciales de esta opción terapéutica incluyen márgenes quirúrgicos inadecuados, hemorragia, isquemia caliente y fugas de orina. Las medidas adoptadas para evitar estas complicaciones incluyen el uso de hielo en la base del tumor, la compresión manual, uso de diuréticos y eliminadores de radicales libres, isquemia fría y cierre meticuloso del sistema colector y la cápsula. La técnica de hipotermia se usa cuando se piensa que el tiempo de clampeo va a ser superior a 30 minutos, bajando la temperatura entre 5 a 20°C, lo que causa una disminución del metabolismo celular para asegurar una adecuada protección tisular y así permitir un mayor tiempo de isquemia sin daño renal (60).
Si bien el tiempo en que se instala el daño renal irreversible en la isquemia aún no está definido, se postula que 30 minutos para la isquemia caliente (WIT) y 60 minutos para la isquemia fría deben ser los márgenes a respetar. Estudios tempranos en animales e informes clínicos limitados fueron contradictorios, pero sugirieron que el tiempo de isquemia de >30 minutos era perjudicial para la recuperación de la función renal tanto a corto como a largo plazo. Sin embargo, un estudio prospectivo diseñado por Parekh et al desafía esta afirmación. En su estudio, el efecto de la isquemia se estudió en tiempo real utilizando biopsias de tejido tomadas antes, durante y después del pinzamiento renal en 40 pacientes sometidos a nefrectomía parcial con un riñón contralateral sano (duración de la isquemia >30 minutos en el 82,5% de los pacientes). Sus hallazgos cristalizaron para muchos en la comunidad del cáncer de riñón el hecho de que el riñón humano es altamente resistente al tiempo de isquemia caliente. Los pacientes experimentaron solo elevaciones transitorias leves en la creatinina, los estudios funcionales renales no se correlacionaron con el tiempo de isquemia y los cambios estructurales histológicos después de una isquemia prolongada fueron significativamente menos graves que lo mostrado previamente en modelos animales con una pronta recuperación después de la restitución del flujo arterial. (61, 62) Sin embargo, el umbral de seguridad ideal del WIT sigue siendo un área de debate.
Se creía así mismo, que la isquemia fría protegía la función renal durante el tiempo de isquemia más prolongado, de hasta 3 h, sin causar ninguna lesión renal. Sin embargo, estudio posteriores ratifican que la técnica sin pinzamiento mostraba una tendencia hacia una mejor recuperación de la función renal después de la nefrectomía parcial que la técnica de isquemia fría y de isquemia caliente. (63)
Castillo y col., (64) presentaron 95 casos de Nefrectomía Parcial Robótica por vía transperitoneal con el sistema da Vinci S-HD®. El tamaño tumoral preoperatorio fue 4,25 ± 6 cm. El tiempo quirúrgico fue 106,3 ± 41,7 minutos. La mediana de tiempo de isquemia fue 19 minutos (RI 14-25). La mediana de sangrado intraoperatorio fue 150 ml (RI= 100-400). Hubo 2 complicaciones intraoperatorias (2,1%), una lesión del diafragma y una laceración esplénica reparadas en el mismo acto quirúrgico (Satava grado 2). Nueve pacientes (9,4%) presentaron complicaciones postoperatorias Clavien ≥ III y no hubo mortalidad. El 78% de los tumores fue carcinoma de células renales. El estadio patológico más frecuente fue T1a (84%). No hubo márgenes quirúrgicos positivos. Concluyen que esta técnica es una alternativa viable en el manejo conservador mínimamente invasivo de tumores renales localizados estadio T1.
Los resultados oncológicos y funcionales perioperatorios y a corto plazo fueron comparables entre la NP asistida por robótica y la NP laparoscópica cuando fueron realizados por cirujanos altamente experimentados (3).
Con el incremento de la técnica parcial, se hacen necesarios instrumentos que permitan estandarizar los tumores que tratamos, valorar la complejidad de la cirugía y en lo posible prever resultados y complicaciones. Dentro de los modelos que responden a esta necesidad, los más utilizados son el sistema R.E.N.A.L y el P.A.D.U.A (65). Estas dos clasificaciones integran el tamaño de las lesiones tumorales con la localización de las mismas dentro del parénquima renal. Así, ambos sistemas han podido clasificar las lesiones en baja, media o alta complejidad, al presentar valores de 4-6, 7-9 y >10 (R.E.N.A.L.) y 6‐7, 7‐9 y >10 (P.A.D.U.A) respectivamente.
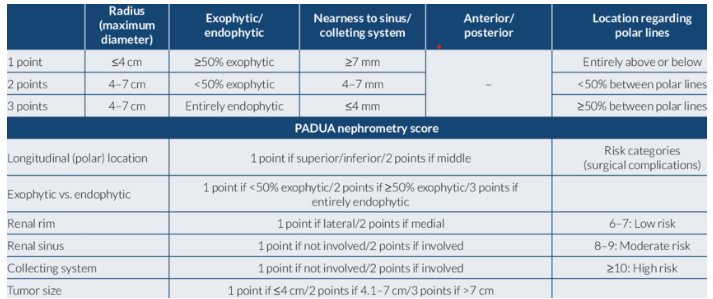
Tabla 16: Alves P., et all, Pre-operative imaging evaluation of renal cell carcinoma, June 2024, Revista da Associação Médica Brasileira 70(suppl 1) DOI:10.1590/1806-9282.2024s107
Hew y cols. (66), realizaron la validación de los dos sistemas en una revisión de más de 100 pacientes, encontrando que puntuaciones altas en ambas clasificaciones eran predictores adecuados de las complicaciones postoperatorias. Esto se hace aún más evidente si consideramos que a una mayor exigencia técnica puede existir un mayor número de complicaciones, que alcanzan según la Escala Clavien modificada, hasta un 26 % las menores (Clavien 1-2) y un 11,5% las mayores (Clavien 3-5) (67).
En cuanto a los márgenes quirúrgicos en la NP, se encontraron recurrencias locales del lecho tumoral en el 16% de los pacientes con margen positivo, en comparación con el 3% de los que tenían márgenes negativos. Por lo tanto, la RN o la nueva resección de los márgenes pueden resultar en un sobre tratamiento en muchos casos. Se debe informar a los pacientes con márgenes positivos que necesitarán un seguimiento de vigilancia (imagen) más intenso y que tienen un mayor riesgo de terapias locales secundarias. Por otro lado, la protección contra la recurrencia no está garantizada por márgenes quirúrgicos negativos, ya que se informa en hasta el 1,5% de los casos en esta categoría de pacientes (3).
Nefrectomía Radical
Para los tumores localizados de más de 7 cm de diámetro (T2) o sin importar su tamaño, se encuentra en una zona céntrica del riñón, se recomienda la Nefrectomía Radical.
Esta técnica incluye la extirpación del riñón completo incluyendo fascia de Gerota, la mitad proximal del uréter, los ganglios linfáticos regionales (hasta el área de sección de los vasos renales) y, eventualmente, la glándula suprarrenal. La resección de esta última se realiza siempre y cuando se objetive su alteración por TAC o RNM (compromiso de la glándula sólo en un 2%), en tumores de polo superior mayores a 4 cm o en cáncer renal diseminado. En caso contrario, su extracción no cambia el pronóstico (68).
En relación a la linfadenectomía, no parece ser que la técnica ampliada o extendida mejore la supervivencia a largo plazo tras una nefrectomía por tumor (69). Así pues, a efectos de etapificación, la linfadenectomía puede limitarse a la región del hilio y debe considerarse la linfadenectomía extendida sólo en los pacientes considerados de mayor riesgo, como los T3 o T4, los Sarcomatoides, presencia de necrosis y/o en sospecha de metástasis en imágenes preoperatorias. En los pacientes con adenopatías palpables o detectadas mediante TAC se debe practicar una resección de los ganglios linfáticos afectados para obtener mayor información histológica (70).
La técnica abierta por años ha demostrado gran eficacia oncológica, sin embargo, en un esfuerzo por reducir la morbilidad del paciente y con los avances en la cirugía mínimamente invasiva y sus beneficios en la disminución del dolor postoperatorio, estadía hospitalaria más corta y una recuperación más rápida, hoy de elección la técnica utilizada es la Nefrectomía Radical Laparoscópica.
Descrita por primera vez en 1991 existen múltiples adaptaciones y avances de la técnica (71). El abordaje laparoscópico puede ser transperitoneal o retroperitoneal. La primera proporciona un espacio amplio de trabajo y permite una visualización directa de la anatomía intraperitoneal, siendo la más utilizada. En este sentido, la identificación del músculo psoas, del uréter y la vena gonadal son fundamentales para identificar posteriormente el hilio renal.
Existe una escasa literatura de ensayos controlados y aleatorizados que comparen las diferentes modalidades de tratamientos quirúrgicos laparoscópicos, sin embargo, no hay diferencias significativas en los resultados perioperatorios usando diferentes enfoques mínimamente invasivos. La bibliografía demuestra importantes ventajas de la Nefrectomía Laparoscópica frente a la abierta, con una reducción en la morbilidad peri y postoperatoria, manteniendo la eficacia oncológica a largo plazo, sobre todo en pacientes con tumores pequeños y localizados. Las complicaciones fluctúan entre 8- 17% y se necesita conversión a abierta entre un 1,7 y 4% de los casos. La complicación más frecuente es la lesión de órgano adyacente (duodeno, bazo, hígado o páncreas) en el 2,7%; la lesión vascular en 2,2%; el sangrado postoperatorio con necesidad de transfusión en 1,3 % y el íleo paralítico en un 1,3% (71).
En comparaciones entre la Nefrectomía Radical Abierta v/s Laparoscópica, los resultados oncológicos resultan similares con ambas técnicas, mostrando una estancia hospitalaria significativamente más corta y menor uso de analgésicos usando la opción laparoscópica. El tiempo de convalecencia también fue significativamente más corto en esta modalidad. No hubo diferencia en el número de pacientes que recibieron una transfusión de sangre entre los dos enfoques quirúrgicos, pero la pérdida de sangre fue significativamente menor en los operados por vía laparoscópica. Las complicaciones quirúrgicas fueron marcadas por bajas tasas de eventos y los intervalos de confianza muy amplios. No hubo diferencias en las complicaciones, pero el tiempo de operación fue significativamente más corta en el brazo de la nefrectomía abierta. Las puntuaciones de calidad de vida postoperatorias fueron similares entre los dos grupos.
Finalmente, cuando el tumor invade la grasa perirrenal, las glándulas suprarrenales o los vasos del hilio o cercanos a éste, hablamos de un Tumor Renal Avanzado. El tratamiento de elección en este caso es la Nefrectomía Radical Abierta. Los pacientes con afectación de la vena cava deben ser sometidos a trombectomía y la técnica quirúrgica propiamente tal dependerá de la extensión cefálica del trombo.
Los datos de un gran estudio de cohorte retrospectivo sobre la RN laparoscópica asistida por robot frente a la laparoscópica mostraron que la RN laparoscópica asistida por robot no se asoció con un mayor riesgo de ninguna complicación o complicaciones mayores, pero tuvo un tiempo de operación más largo y costos hospitalarios más altos en comparación con la RN laparoscópica (3).
Vigilancia Activa
Se define como el monitoreo inicial del tamaño del tumor por imágenes abdominales seriadas (ECO, TAC o RNM) con el retraso en la intervención, reservada para aquellos tumores que muestran progresión clínica durante el seguimiento (60). Los pacientes diagnosticados con una masa renal T1 clínica pueden ser candidatos para “Vigilancia activa”.
Este consiste en el seguimiento cercano de la neoplasia (cada 3-12 meses) y de su patrón de desarrollo mediante imagenología en tumores menores a 3.5 cm y con un crecimiento menor a 0.28 cm/año (72). Las indicaciones incluyen pacientes de edad avanzada, los que tienen menor expectativa de vida o aquellos con comorbilidades médicas que se asocian con un mayor riesgo quirúrgico. Sin embargo, la historia natural de los tumores renales no es predecible. Los tumores pueden variar sus tasas de crecimiento drásticamente o ser malignos desde el inicio. La bibliografía internacional es variada, mientras un meta-análisis informó que la progresión de metástasis en más de 390 pacientes con tumores pequeños (menor a 3,5 cm) alcanzaba sólo un 1%, otros estudios como el de la Clínica Mayo demuestran que sólo el 46% de los tumores menores a 1 cm eran benignos.
La literatura reporta una amplia variedad de protocolos de vigilancia, ninguno de las cuales ha sido fundamentado adecuadamente. Actualmente están en estudio marcadores biológicos que permitan una vigilancia activa con menores costos y con mayor sensibilidad. Así, la Vigilancia Activa sólo es una opción razonable para pacientes con esperanza de vida muy limitada o para aquellos que no son aptos o que no desean una intervención. Para aquellos tumores sólidos o quistes complejos Bosniak 3 o 4, especialmente menores de 2 cm, el seguimiento debe ser cada 3 a 6 meses.
El paciente debe ser asesorado sobre el riesgo de progresión del cáncer y sobre posibles pérdidas de la oportunidad de una cirugía curativa. También se le debe señalar la falta de terapias de rescate curativas si se desarrollan metástasis, las limitaciones de la biopsia de la masa renal y las deficiencias de la literatura actual que respaldan esta alternativa. En este contexto no se sugiere tomar las decisiones para los pacientes, pero si expresar con total claridad y términos atingentes a cada realidad de nuestros usuarios, la información necesaria para una elección a conciencia que brinde tranquilidad.
Embolización
En los pacientes que no son candidatos a la cirugía, o que presentan una enfermedad inoperable, la embolización puede controlar síntomas tales como hematuria macroscópica o dolor en el flanco.
La práctica de una embolización tumoral antes de la nefrectomía carece de beneficios.
La embolización antes de la resección de metástasis óseas o vertebrales hipervasculares puede reducir la hemorragia intraoperatoria. En determinados pacientes con metástasis óseas o paravertebrales dolorosas, la embolización puede contribuir también a aliviar los síntomas (73).
Terapias de Ablación Térmica
Las distintas terapias de ablación térmica, como la Criocirugía renal y la Ablación mediante Radiofrecuencia, han surgido como tratamiento alternativo del CCR localizado (previa confirmación histológica por medio de una biopsia renal) para poder preservar tejido renal. Ambas pueden efectuarse por vía percutánea o a través de la exposición laparoscópica. Estos abordajes tienen la posibilidad de una morbilidad menor y de una recuperación más rápida, pero no han mostrado una diferencia significativa en cuanto a las tasas de sobrevida global, sobrevida específica de cáncer, tasa de sobrevida libre de recurrencia y alteración de la velocidad filtración glomerular al comparar estas técnicas entre sí, independiente del tipo de abordaje (74).
Crioablación
La crioablación es la destrucción de tejidos por congelación y descongelación mediante el efecto de Joule-Thomson (enfriamiento rápido del extremo de una sonda por el paso de nitrógeno gaseoso o argón en estado líquido a través de un orificio pequeño), pudiendo alcanzar temperaturas -185,7°C en un punto específico dentro de los tejidos blandos, generando rápidamente una “bola de hielo” que se puede monitorear en tiempo real mediante ECO, TAC o RNM. La necrosis tisular se produce por daño celular directo (formación de hielo) y por daño indirecto a partir de la mala perfusión durante la fase de descongelación. Desde el punto de vista histológico, el resultado es la necrosis por coagulación, seguida de fibrosis y cicatrización (75).
El grado de destrucción tisular depende de la velocidad de congelación, del número de ciclos de congelación y descongelación (se recomiendan al menos 2 ciclos), del tamaño y del área de contacto de la sonda y, lo más importante, de la temperatura más baja alcanzada (al menos -40°C para garantizar la destrucción de las células neoplásicas); y del tiempo que se mantiene la temperatura por debajo de cero, donde la mayoría de los tumores pueden ser tratados con un ciclo inicial de 8 – 10 minutos y un segundo ciclo de congelación de 6 – 8 minutos. En la práctica clínica, la bola de hielo debe extenderse preferiblemente 10 mm más allá del margen del tumor, monitorizando en tiempo real el avance de la zona de congelación. La crioablación por punción es la técnica preferida en la actualidad, porque el proceso de congelación depende del contacto con la sonda.
Aunque el número de estudios es limitado al comparar la crioablación con la nefrectomía parcial (técnica estándar), no se ha observado una diferencia significativa en los resultados perioperatorios en cuanto al tiempo de recuperación, tasa de complicaciones, cambios en la creatinina sérica post operatoria y número de transfusiones requerida por los pacientes. Si bien algunos estudios no han mostrado una diferencia en la sobrevida general, existe una significativa diferencia en las tasas de sobrevida específica de cáncer a los 3,5 y 7 años (nefrectomía parcial laparoscópica 100% a 7 años, crioablación 93% y 82% a 3,5 y 7 años) (75-76-77).
La recurrencia después de la crioablación inicial a menudo se trata con una nueva crioablación, pero solo el 45 % de los pacientes permanecen libres de enfermedad a los dos años (3).
Un análisis del registro prospectivo multinacional europeo EuRECA (871 pacientes sometidos a crioablación) mostró que el uso de la biopsia previa a la crioablación ha aumentado significativamente del 42% (65/156) en 2015 al 72% (88/122) en 2019 (p < 0,001), lo que hace que el tratamiento para una histología benigna o desconocida sea significativamente menos probable. (3).
Ablación por radiofrecuencia
La ablación por radiofrecuencia es el calentamiento por encima de 60 °C que da como resultado la necrosis instantánea e irreversible de todos los tejidos biológicos, con desnaturalización de las proteínas celulares, fusión de los lípidos y desintegración de la membrana celular. Estas temperaturas se alcanzan enviando corriente eléctrica alterna de radiofrecuencia hacia la zona del espectro electromagnético por tratar mediante un electrodo de aguja intersticial, tanto en sistemas monopolares como bipolares.
La destrucción tisular depende de la distancia del electrodo, de la intensidad de corriente de radiofrecuencia (idealmente para generar una temperatura por sobre los 105°C) y de la duración de su aplicación, donde los tumores menores de 2 cm son típicamente tratados con dos ciclos de 5 minutos; tumores de entre 2 – 3 cm son tratados con dos ciclos de 7 minutos; tumores mayores de 3 cm son tratados con dos ciclos de 8 minutos. Con el uso de dispositivos modernos multielectrodos, la energía de radiofrecuencia es controlada en forma independiente y automática según la impedancia del tejido alrededor de cada terminal, obteniendo lesiones más homogéneas. A diferencia de la crioablación, la radiofrecuencia no siempre ocasiona la necrosis completa (78).
Tanto la ECO intraoperatoria, RM y TAC no son buenos métodos para cuantificar el éxito operatorio de la radiofrecuencia, debido al bajo contraste intrínseco entre el tejido sujeto a ablación y los artefactos provenientes de la formación de burbujas de gas. En general, las técnicas por imágenes se utilizan sólo para colocar los electrodos, y la radiofrecuencia se controla midiendo los cambios de temperatura y/o de impedancia con termosensores integrados en el extremo del emisor de radiofrecuencia.
La calidad de la evidencia en cuanto la radiofrecuencia para el tratamiento del CCR localizado es baja. La mayoría de las publicaciones son estudios de cohortes retrospectivas con un bajo número de pacientes y limitado seguimiento. Si bien algunos estudios muestran que la sobrevida específica de cáncer al comparar la ablación por radiofrecuencia v/s nefrectomía parcial es similar y de un 100% para ambos grupos, la sobrevida general es inferior para el grupo de la radiofrecuencia (75 v/s 100%) (79-80).
La tasa de efectividad total de la ablación tumoral fue del 90,9% para el CCRcc y del 100% para el CCRp. Un estudio que comparó la ablación por radiofrecuencia (ARF) con la cirugía sugirió peores resultados con la ARF que con la NP en el CCR cT1b, mientras que no se observaron diferencias en aquellos con CCR no cT1b. (3)
Otras técnicas ablativas
Con respecto a otras técnicas ablativas, algunos estudios han mostrado la factibilidad de otros procedimientos percutáneas y mínimamente invasivos guiados por imágenes como la ablación por microondas, ablación láser, ablación por ultrasonido de alta intensidad. Sin embargo, y en base a la evidencia actualmente disponible, estas técnicas deben ser consideradas experimentales (47). No se ha establecido la eficacia a largo plazo, y los datos preliminares sugieren que la tasa de recidiva local puede ser algo mayor que la comunicada para los enfoques quirúrgicos tradicionales.
Los candidatos ideales para los procedimientos de ablación térmica son lesiones tumorales pequeñas (<3 – 4 cm) en pacientes de edad avanzada o con comorbilidades importantes que prefieren un enfoque pro-activo y que no son considerados buenos candidatos para la cirugía convencional, pacientes que tienen una recidiva local después de una cirugía de preservación de nefronas, pacientes con cáncer renal hereditario que se presentan con lesiones multifocales en los cuales la nefrectomía parcial de múltiples tumores pueden ser problemáticas o imposibles.
Al emplear cualquier técnica ablativa, se debe hacer un seguimiento intensivo del paciente con estudios de imágenes contrastados (TAC o RNM) seriados en manos de un radiólogo experto cada 3 meses durante el primer año, y después un seguimiento bianual por un año y en forma anual por 5 años hasta la regresión completa o si la lesión se vuelve estable para asegurarse de que no se produzca la recurrencia de un margen. La pérdida completa del refuerzo de contraste se considera un signo de destrucción total del tejido. Si la lesión no muestra una pérdida del realce por medio de contraste después del tratamiento o requiere más de una sesión de ablación para lograr la pérdida del realce, entonces se considera como una ablación incompleta. Si al cabo de 6 meses la lesión no se ha reducido (en el caso de la crioablación) o se observa un crecimiento independientemente del método ablativo, la biopsia es indispensable sea cuales fueren los resultados de los estudios con contraste por considerarse una recurrencia o progresión.
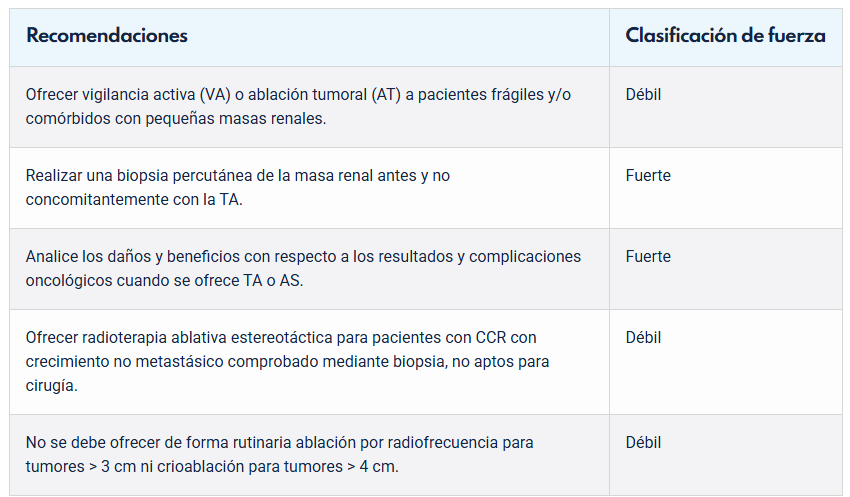
Tabla 17: Recomendaciones para proponer terapias ablativas: Guía EUA 2025.
Seguimiento
No hay consenso sobre las estrategias de seguimiento después del tratamiento del RCC, con evidencia limitada que sugiere que los intervalos de imágenes postoperatorias más frecuentes no proporcionan ninguna mejora para la detección temprana de la recurrencia que llevaría a una mejor supervivencia. Como tal, la vigilancia radiológica intensiva puede no ser necesaria para todos los pacientes. El seguimiento también es importante para evaluar los resultados funcionales y limitar las secuelas a largo plazo, como el deterioro de la función renal, enfermedad renal crónica en etapas IV y V así como eventos cardiovasculares (3).
Después del tratamiento quirúrgico el urólogo debe controlar y/o identificar las complicaciones postoperatorias inmediatas y tardías, la función renal, la recurrencia local, la recurrencia en el riñón contralateral o ipsilateral (después de la nefrectomía parcial) y el desarrollo de las metástasis. La metodología y el tiempo empleado para los controles ha sido objetivo de muchas discusiones y publicaciones, no logrando un consenso absoluto.
Los pacientes sometidos a seguimiento deben enfrentarse siempre con una buena historia clínica y la exploración física debe estar dirigida a la detección de signos y síntomas de diseminación metastásica y/o recidiva local. Deben también someterse a pruebas de laboratorio básico que incluya nitrógeno de urea en sangre, creatinina, tasa de filtración glomerular estimado y análisis de orina.
En cada control se debe realizar radiografía de tórax. Sin embargo, cuando el riesgo de recaída es alto (tumores > 7 cm, margen positivo, tumores de histología más agresiva) en estos pacientes el TAC de tórax es la prueba de elección. Sugerimos un estudio por imágenes de la cavidad abdominal debe solicitarse 2 veces al año los primeros 3 años y luego anualmente. El uso de Tomografía por emisión de positrones (PET) y PET-CT, no son el estándar debido a su especificidad y sensibilidad limitada.
Otras evaluaciones de laboratorio, incluyendo hemograma, lactato deshidrogenasa, pruebas de función hepática, fosfatasa alcalina y el nivel de calcio, se pueden usar a discreción del médico. Los pacientes con insuficiencia renal progresiva en la evaluación de laboratorio de seguimiento deben ser referidos a nefrología (81).
No existe consenso con respecto a la frecuencia de controles que deberían tener los pacientes tratados por un cáncer renal, sin embargo, en términos generales y en base a la experiencia del grupo recomendamos que los pacientes debiesen controlarse cada 3 a 4 meses durante el primer año, cada 6 meses durante los siguientes 2 años y posteriormente una vez al año, al menos por 10 años. Las guías recomiendan también una gammagrafía ósea en pacientes con fosfatasa alcalina elevada, dolor óseo y/o si hay hallazgos radiológicos sugerentes de metástasis ósea. Por su parte los pacientes con antecedentes de un tumor renal que presentan signos o síntomas neurológicos agudos deben someterse a un TAC o RNM de cerebro y/o RNM de columna vertebral basado en la localización de la sintomatología.
La vigilancia posterior al tratamiento del CCR permite al urólogo controlar o identificar:
- complicaciones postoperatorias;
- función renal;
- recurrencia local;
- recurrencia en el riñón contralateral;
- metástasis a distancia;
- eventos cardiovasculares.
Actualmente, la pregunta clave es si la detección de recurrencia durante el seguimiento y el tratamiento posterior conducirá a algún cambio significativo en el resultado de supervivencia de estos pacientes. A diferencia de la enfermedad de alto grado y/o localmente avanzada, el pronóstico después de la cirugía para tumores de bajo grado T1a es casi siempre excelente. Por lo tanto, es razonable estratificar el seguimiento, teniendo en cuenta el riesgo de cada CCR diferente de desarrollar una recurrencia local o distante. Por ello, la vigilancia radiológica intensiva puede no ser necesaria para todos los pacientes. El seguimiento también es importante para evaluar los resultados funcionales y limitar las secuelas a largo plazo, como el deterioro de la función renal y eventos cardiovasculares (3).
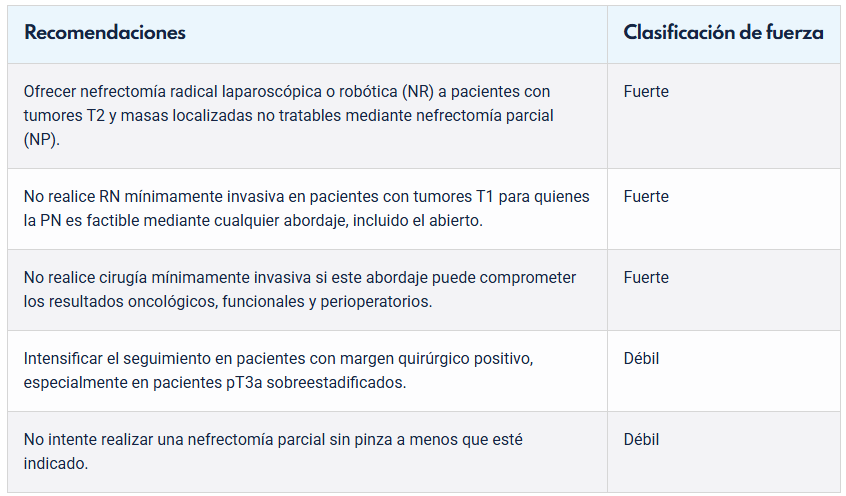
Tabla 18: Recomendaciones generales de tratamiento quirúrgico: Guía EUA 2025.
Tratamiento del CCR localmente avanzado
Dr. Guillermo Soto, Dr. Stefano Brusoni, Dr. Andrés Schaub
A continuación se mencionaran distintas estrategias de abordaje disponibles para pacientes con CCR localmente avanzado según distintas variables a considerar. Se considera un CCR localmente avanzado aquellos tumores cT3/cT4 con cN0-N1 y en quienes se ha excluido la presencia de enfermedad metastásica.
CCR CON GANGLIOS LINFATICOS REGIONALES
La presencia de linfonodos positivos es un factor pronostico adverso tanto en la enfermedad local como en la metastásica (81-82). En el CCR el papel de la linfadenectomia (LND) es controversial.
En el caso de cN positivos se encuentra un compromiso metastásico variable desde 0-25% de los ganglios resecados, dependiendo principalmente del tamaño tumoral y evidencia de metástasis a distancia. La realización de LND en cN- esta solo justificada ante la evidencia de lesión o adenopatía visible o palpable durante la cirugía, sin demostrarse hasta la fecha en beneficio claro en términos de control oncológico. (83)
Un revisión sistemática con meta análisis reciente muestran beneficio en la sobrevida en paciente tratados con LND. En el grupo CCR localmente avanzado (cT3-T4NxM0) la LND mostró una tasa de supervivencia general significativamente mejor en pacientes que se sometieron a LND en comparación con aquellos sin LND (HR: 0,73) (84).
En el caso de cN+ la probabilidad de identificar metástasis de linfonodales confirmadas en la biopsia varía entre 10.3% (tumores cT1) y hasta 54.5% en caso de enfermedad localmente avanzada. En cN+, la extracción de ganglios visibles y palpables durante LND está justificada, al menos para etapificación, pronóstico, terapia adyuvante e implicaciones de seguimiento, aunque aún no se ha demostrado un beneficio en términos de control del cáncer (85).
CCR CON TROMBO TUMORAL VENOSO
Dr. Stefano Brusoni, Dr. Andrés Schaub
El CCR se puede acompañar de formación de trombos tumorales (TT) en el 4-10% de los casos mientras que el 1% de estos casos se extiende a la aurícula derecha (3-86).
Pudiendo considerarse como un estado previo a la enfermedad metastásica y un desafío quirúrgico importante. La existencia de un trombo tumoral también agrega complejidad al tratamiento, dado que los trombos asociados pueden conducir a congestión venosa y el riesgo de embolización (87).
Los TT constituyen un factor pronóstico adverso con un mayor riesgo de evolucionar a enfermedad metastásica y una tasa de supervivencia a los 5 años que varía entre 36-57%. En este grupo de pacientes la diferenciación sarcomatoide es frecuente y se encuentra en hasta un 58% de los casos (3).
Respecto a la historia natural, series han reportado una sobrevida de alrededor de 8 meses en pacientes que no metastásicos que no reciben tratamiento, dilucidando la rápida progresión de la enfermedad y la importancia del tratamiento quirúrgico radical oportuno (88).
La mayoría de los pacientes, al ser un tumor localmente avanzado suelen presentar síntomas, incluyendo hematuria macroscópica, dolor en el flanco y masas palpables. Otros síntomas, como fiebre, pérdida de peso y fatiga, pueden también estar presentes. Es fundamental sospechar de TT en pacientes con masas renales que presenten signos como edema en las extremidades inferiores o varicocele que no colapsa al estar en decúbito.
CLASIFICACIÓN
La clasificación del TNM para el cáncer renal considera la presencia de trombo tumoral y su extensión considerándolo para el estadiaje. Así, la presencia de TT que involucre la vena renal se define como pT3a, la VCI subdiafragmatica como pT3b y la VCI supradiafragmatica o bien con invasión directa de su pared como pT3c sin importar el tamaño del tumor primario. De esta forma series han reportado valor pronóstico con sobrevida aproximada a 5 años de un 43%, 37% y 22% respectivamente (89).
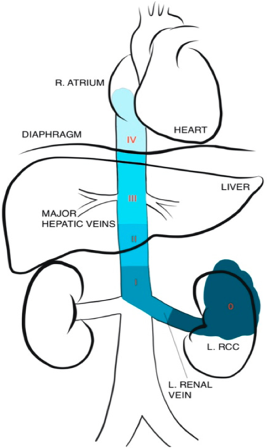
Figura 7: Clasificación de Neves-Zincke para la extensión del trombo tumoral.
El sistema de Clasificación de Neves y Zincke, figura 7, es preferido debido a su especificidad en los niveles de TT y consideraciones quirúrgicas adicionales (90). Como se detalla más adelante.
- Limitado a la vena renal
- En la VCI <2cm por sobre el ostium de la vena renal
- > 2cm en VCI sobre el ostium de la vena renal bajo las venas hepáticas mayores
- En la VCI Infra diafragmática por sobre las venas hepáticas mayores
- VCI Supra diafragmática o en aurícula derecha
ESTUDIO IMAGENOLOGICO
La imagenología juega un papel crucial en la evaluación preoperatoria. Aunque la tomografía computarizada (TC) es la modalidad inicial, la resonancia magnética (RM) se considera el estudio de elección para evaluar masas renales con sospecha de TT. TC es preferida para una evaluación detallada, y se recomienda la ecocardiografía transesofágica en casos con trombo en la aurícula derecha (87).
La Resonancia magnética, si bien no es mandatoria, es el método de elección para caracterizar la extensión, el grado de oclusión y la invasión de la VCI. Además, la RM permite valorar adecuadamente las características del trombo y la presencia de componente de trombo blando y trombo tumoral. El TT se presenta como una ocupación luminal que se adhiere al tumor renal primario y se extiende hacia proximal por el territorio venoso, generalmente adherido al endotelio vascular pudiendo o no invadir directamente la pared vascular. Compuesto de células viables organizadas, imagenologicamente se acompaña de congestión vascular con formación de colaterales y una captación heterogénea de contraste similar al tumor primario. Este tiende a ser más estable y tener menor potencial embolico respecto a su contraparte, el trombo blando, de fibrina, que presenta una apariencia más homogénea sin captación de contraste. Debido a la posible rápida progresión, es esencial contar con imágenes actualizadas para la planificación quirúrgica. (87-91)
La presencia de trombo tumoral supone un mayor riesgo de eventos tromboembólicos.
Respecto a la anticoagulación, no existe consenso claro respecto al uso de rutina. Su uso debe ser evaluado caso a caso. En ausencia de eventos tromboembólicos demostrados, pacientes con componente de trombo blando por sobre trombo tumoral, significativa oclusión de VCI o compromiso auricular debiesen recibir anticoagulación idealmente con HPBM en ausencia de contraindicación hemorrágica. La instalación de filtro de VCI puede dificultar la resección y no se recomienda de rutina. Debe considerarse el uso de tromboprofilaxis postoperatoria por 1 mes en los pacientes sometidos a tratamiento quirúrgico (92).
TRATAMIENTO
La Nefrectomía radical en conjunto a la trombectomía tumoral se considera el tratamiento de elección, con una mortalidad reportada de hasta un 10%. Se han reportado tasas de supervivencia libre de cáncer a largo plazo que oscilan entre el 40% y el 65% tras la resección quirúrgica.
El tratamiento sistémico para reducción del trombo tumoral cuenta con resultados limitados. Una revisión sistemática con meta análisis mostro una reducción del nivel de TT de un 29,4% en quienes recibieron Neoadyuvancia con significativamente menor tiempo operatorio y sangrado quirúrgico, sin diferencias respecto a complicaciones y resultados oncológicos.(93)
Aunque la angioembolización preoperatoria puede ofrecer beneficios, se discute su utilidad en la reducción de la pérdida de sangre intraoperatoria (87).
En general todos los pacientes con enfermedad no metastásica y trombo tumoral venoso que cuenten con una capacidad funcional aceptable deben considerarse para tratamiento quirúrgico, independientemente de la extensión del trombo tumoral en la presentación (3).
Tanto el abordaje abierto, laparoscopio y robótico son factibles según las características del paciente, la experiencia del cirujano y el volumen del centro. La decisión respecto a este debe ser individualizada caso a caso.
En comparación con la trombectomía abierta, el abordaje robótico se ha asociado con una menor tasa de transfusiones, menor pérdida sanguínea, menor tasa de complicaciones y estancia hospitalaria pero con resultados similares en sobrevida (94).
La extensión proximal del componente tumoral es esencial para la planificación quirúrgica. Además, algunas series han reportado menor sobrevida a 5 años en pacientes tratados con TT Nivel 4 en comparación a Nivel 0 de aproximadamente de un 38% vs un 48%.
En la tabla se resumen alternativas de manejo quirúrgico según la extensión del TT. Es importante considerar que la extensión del trombo puede superar la planificación preoperatoria, así como el grado de trombo libre y la presencia de adhesión o invasión vascular local puede requerir técnicas de resección más complejas con reconstrucciones vasculares o inclusive ligadura de la VCI en los casos más complejos. Se debe considerar el abordaje multidisciplinario de estos pacientes, usualmente requiriendo asistencia de cirugía hepatobiliar, cirugía cardiaca , o vascular para el correcto enfrentamiento de estos pacientes (87-95).
| Nivel | Descripción | Manejo quirúrgico |
| 0 | Limitado a la vena renal | Ligadura de la vena renal |
| I | En la VCI, <2 cm por encima
de la vena renal |
Ordeñar hacia la vena renal. Puede requerir cavotomia, generalmente sin reconstrucción. |
| II | >2 cm sobre vena renal, pero por debajo de venas
Hepáticas |
Cavotomia con clampeo VCI subhepático. Puede requerir reconstrucción |
| III | Superior a la venas hepáticas, Infradiafragmático | Abordaje multidisciplinario / Maniobras de movilización hepática / potencial clampeo de venas hepáticas o uso de CEC / Clampeo VCI suprahepático / ETE |
| IV | Supradiafragmático /
Aurícula derecha |
Abordaje toracoabdominal, uso de CEC / ETE / Abordaje multidisciplinario |
Tabla 19. Clasificación de Neves-Zincke para la extensión del trombo tumoral y posible manejo quirúrgico. CEC: Circulación extracorpórea. ETE: Ecocardiograma transesofágico. VCI: Vena Cava Inferior
Las complicaciones postoperatorias varían según el nivel del trombo. Aunque la tasa de complicaciones en trombos de vena renal se asemeja a la de nefrectomías sin trombo, los trombos de nivel IV a menudo requieren técnicas más complejas, como la circulación extracorpórea (CEC), que aumenta el riesgo de complicaciones neurológicas y coagulopatía.
MANEJO DEL CCR LOCALMENTE AVANZADO IRRESECABLE
El tratamiento del CCR localmente avanzado irresecable debe basarse en la terapia sistémica. Se recomienda una evaluación multidisciplinaria, que incluya urólogos, oncólogos médicos y radioterapeutas, para maximizar el control del cáncer, el control del dolor y la mejor terapia de soporte. Existen reportes de casos donde en pacientes seleccionados, el uso de terapia sistémica como neoadyuvancia podría disminuir el tamaño tumoral posibilitando la cirugía radical (96).
En pacientes con enfermedad irresecable, la embolización puede controlar los síntomas, como la hematuria visible o el dolor en el flanco (97).
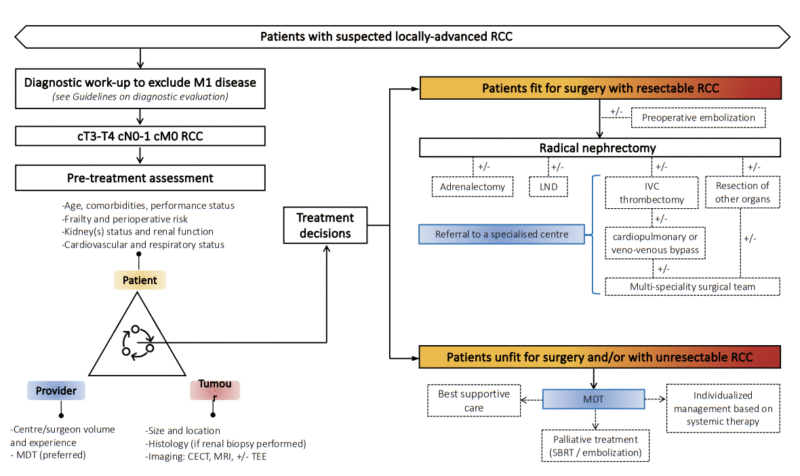
Figura 8: Esquema resume manejo del CCR localmente avanzado. Guía EAU 2025.
Radioterapia en tumores renales
Dr. Rodrigo Canales
El concepto histórico de la radioterapia para el CCR, tanto en el contexto primario como en el metastásico, es que se reserva principalmente para fines paliativos. Sin embargo, en la práctica actual, se están obteniendo resultados favorables que han comenzado a cambiar el paradigma de posible radio resistencia del CCR.
Radiación en tumores primarios y sobre metástasis del carcinoma de células renales
La radioterapia ablativa estereotáctica (SBRT) administra una dosis más alta por fracción que puede producir efectos citotóxicos en el CCR. La extrapolación de los resultados exitosos de la radiocirugía estereotáctica en la irradiación de metástasis intracraneales de CCR, con tasas de control local impresionantes en comparación con las tasas proporcionadas por la radiación fraccionada convencional, respaldan la eficacia de la SBRT para el CCR. Por otra parte, los avances en la guía por imágenes y el control del movimiento han facilitado la aplicación de la SBRT para el CCR primario y metastásico.
En cuanto a la radioterapia del tumor primario, las guías clínicas de la NCCN de 2024 establecen que la SBRT puede considerarse para pacientes médicamente inoperables con cáncer de riñón en estadio 1 (categoría 2B) o con cáncer de riñón en estadio II/III (ambos de categoría 3).
Figura 9: Rol de la Radioterapia en el tratamiento CCR. NCCN 2024.
Un metaanálisis de 26 estudios, incluidos 11 ensayos prospectivos, realizado en 2019 por el grupo del Dr. Silva, figura 10, demostró que la SBRT para el CCR primario logra una tasa de control local del 97,2 %, con toxicidad de grado 3-4 en el 1,5 % de los pacientes (98).
Figura 10: Meta análisis Dr. Da Silva.
Dentro de los hallazgos, cabe destacar que la pérdida promedio de velocidad de filtración glomerular (TFGe) con respecto al valor inicial fue de tan solo -7,7 ml/min.
Con datos más recientes provenientes del metaanálisis de datos individuales de pacientes del IROCK (Consorcio Internacional de Radiocirugía Renal), Silva et al. Informaron los resultados a 5 años tras la SBRT para el CCR primario. Este metaanálisis incluyó a 190 pacientes con CCR primario en 12 instituciones. Los pacientes recibieron (SBRT) de fracción única o múltiple con una dosis por fracción >5 Gy. La mediana del diámetro tumoral fue de 4 cm y el 75 % de los pacientes fueron considerados inoperables por el urólogo remitente. La tasa de fracaso local a 5 años fue del 5,5 %, y la SBRT de fracción única presentó menos fracasos en comparación con la SBRT multifracción (p = 0,02). No se observaron toxicidades de grado 3 ni 5, pero un paciente desarrolló una úlcera duodenal de grado 4 y gastritis tardía de grado 4. Siete pacientes (3,7 %) requirieron diálisis después de la SBRT(99).
En ASTRO 2023, se presentaron los resultados del ensayo TROG 15.03 FASTRACK II. El objetivo de este ensayo fue investigar la eficacia de la SBRT, siendo el primer ensayo multicéntrico de fase II de terapia no quirúrgica para el CCR primario. Este estudio incluyó pacientes con:
- CCR primario confirmado por biopsia, con lesión única en un riñón.
- Caso inoperable médicamente o con alto riesgo quirúrgico.
- Decisión multidisciplinaria que justificaba el tratamiento activo.
- Tumor <10 cm y sin interposición colónica adyacente.
El resultado principal del estudio fue evaluar el control local tras la SBRT, asumiendo una tasa de control local del 90 % a 1 año. Una tasa de control local ≤80 % no justificaría la realización de un ensayo controlado aleatorizado posterior. En este ensayo, la tasa de control local fue del 100 %, con una ausencia del 99 % de fallo a distancia. La supervivencia específica para el cáncer fue del 100 % y la pérdida media de la función renal fue de -14,6 ml/min. Al comparar estos resultados con los de la nefrectomía radical o parcial para tumores análogos, se expuso que estos excelentes resultados de eficacia y seguridad de la SBRT para el CCR primario en pacientes inoperables establecen la SBRT como un nuevo estándar de atención para pacientes no aptos para cirugía. Creemos que el siguiente paso es evaluar este enfoque en pacientes operables (es decir, un ensayo clínico de cirugía versus radioterapia de reemplazo renal continuo (SBRT) y, evidentemente, un seguimiento a más largo plazo.
Por otra parte, un análisis de datos agrupados de 2019 de 81 pacientes con riñón solitario tratados con SBRT en 9 instituciones IROCK, demostró que la disminución media de la TFGe fue de -5,8 ml/min (-9 % respecto al valor inicial), sin que ningún paciente requiriera diálisis tras una mediana de seguimiento de 2,6 años. Datos más recientes, presentados en ASTRO 2023, de 190 pacientes (56 con riñón solitario) sometidos a SBRT no encontraron diferencias significativas en la disminución de la TFGe en todos los puntos temporales evaluados (p > 0,05) ni diferencias en la enfermedad renal terminal (ERT), ni en diálisis entre ambos grupos. El análisis multivariable reveló que el aumento del tamaño tumoral y la TFGe basal se asociaba con mayor probabilidad a una disminución de la TFGe tras la SBRT, sin una asociación significativa entre riñones únicos y bilaterales.
La evaluación de la respuesta a la SBRT para el CCR primario sigue siendo controvertida. Actualmente, el control local se determina mediante imágenes de TC/criterios RECIST basados en el tamaño, pero esta herramienta de evaluación presenta limitaciones. Existe la preocupación por la «pseudoprogresión» tras la SBRT, en la que se produce un aumento inicial del tamaño de la lesión tumoral que puede malinterpretarse como progresión de la enfermedad. A diferencia de la SBRT, las técnicas de ablación provocan cambios inmediatos en los patrones de realce del contraste. Estos cambios en el realce del contraste evolucionan mucho más tras la SBRT. En ocasiones, también se puede observar un aumento en el realce del contraste, debido, entre otras razones, a la inflamación.
Los desafíos actuales de la SBRT para el CCR primario incluyen:
- Control del movimiento: la inserción de fiduciales como indicadores de la posición del tumor se complica por el riesgo de hemorragia en tumores altamente vascularizados.
- Posible función de la radioterapia ablativa estereotáxica (SABR) basada en resonancia magnética para mejorar la visualización/seguimiento del tumor.
- Tumores con amplio contacto con el intestino: la radiación adaptativa puede mejorar la conformidad del tratamiento, evitando dosis altas en órganos de riesgo.
- Evaluación de la respuesta a mediano y largo plazo.
¿Qué ocurre con la radioterapia para las oligometástasis del CCR? Lo que se sabe hasta la fecha es que:
- La SBRT puede retrasar el cambio de una terapia sistémica.
- La SBRT puede retrasar la terapia sistémica.
- La SBRT se puede utilizar de forma segura en combinación con inhibidores de puntos de control inmunitarios.
En 2021, Cheung et al. publicaron los resultados de un estudio multicéntrico prospectivo de fase II que evaluó el uso de la SBRT en pacientes con CCR oligoprogresivo y metastásico, que presentaban estabilidad o respuesta previa tras ≥3 meses de terapia con inhibidores de la tirosina quinasa (TKI) y que desarrollaron una progresión de cinco o menos metástasis. Las dosis de SBRT variaron según la zona anatómica irradiada. El control local de las lesiones irradiadas al año fue del 93 %. La incidencia acumulada de cambio de terapia sistémica fue del 47 % al año, con una mediana de tiempo hasta el cambio de terapia sistémica de 12,6 meses (100).
Por otra parte, un ensayo similar de Hannan et al., publicado en 2021, demostró que la SBRT puede retrasar el cambio a la terapia farmacológica de siguiente línea, independientemente de si los pacientes recibían un TKI, inhibidores Checkpoints inmunológicos (ICI) o terapia combinada. En este ensayo, se incluyeron 20 pacientes que recibían TKI (n = 8), ICI (n = 8) o terapia combinada (n = 4) con estabilidad previa en el tratamiento, pero posteriormente con evidencia de progresión de la enfermedad metastásica en 1-3 zonas. El control local de las lesiones irradiadas al año fue del 100 %. La mediana de tiempo hasta el cambio de terapia sistémica fue de 11,1 meses (IC del 95 %: 4,5 a 19,3 meses) (101).
En una publicación de 2021 de Lancet Oncology, Tang et al., figura 11, demostraron que la SBRT secuencial puede diferir la terapia sistémica. En su ensayo de viabilidad de fase 2 de un solo brazo, se inscribieron 30 pacientes con CCR con ≤5 lesiones. Los pacientes no debían haber recibido terapia sistémica previa o solo una si la interrumpían un mes antes del tratamiento. Los pacientes recibieron SBRT en ≤5 fracciones con ≥7 Gy/fracción para todas las lesiones, si la localización anatómica lo permitía; de lo contrario, se administró hipo fraccionamiento. Los criterios de valoración principales de este ensayo incluyeron la viabilidad y la supervivencia libre de progresión. Los pacientes se mantuvieron sin terapia sistémica hasta que se observó progresión de la enfermedad. La mediana de supervivencia libre de progresión fue de 22,7 meses y la supervivencia libre de terapia sistémica a 1 año fue del 82 %. Las limitaciones notables de este ensayo fueron la inclusión de una población altamente seleccionada, la decisión de iniciar terapia sistémica a discreción del médico y del paciente, y el corto tiempo de seguimiento de 17,5 meses (102).
Figura 11: SBRT secuencial puede diferir la terapia sistémica. Lancet 2021.
En ASCO GU 2024 la Dra. Sophia Kamran, oncóloga radioterapeuta del Centro Oncológico del Hospital General de Massachusetts (MHHC) y profesora adjunta de Harvard, señaló que los datos parecen indicar que la SBRT puede ser un tratamiento eficaz para pacientes altamente seleccionados con CCR metastásico. En tal sentido, es posible que podamos mejorar los resultados gracias a los efectos inmunoestimulantes de la combinación de SBRT + ICI. El estudio de fase II NIVES de nivolumab en combinación con SBRT en pacientes con CCR metastásico pre tratados incluyó a 69 pacientes que recibieron 10 Gy x 3 fracciones en una sola lesión, siete días después de la primera dosis de nivolumab. La hipótesis del estudio fue que la adición de SBRT mejoraría la tasa de respuesta objetiva (TRO) del 25 % con nivolumab solo a un 40% con nivolumab + SBRT. En este ensayo, se irradiaron principalmente metástasis de pulmón y ganglios linfáticos. En un seguimiento medio de 26 meses, la ORR fue del 17% y la tasa de control de la enfermedad fue del 55%. La PFS media fue de 5,6 meses (RIC: 2,9 – 7,2), que se compara favorablemente con los 4,6 meses observados con nivolumab en el ensayo CheckMate-25. La OS media fue de 20 meses. Se observó toxicidad de grado 3-4 en el 26% de los pacientes (para comparación, 19% en CheckMate-25). Este ensayo demuestra la seguridad de la combinación SBRT + ICI, con una ORR más alta para lesiones irradiadas frente a no irradiadas (29% frente a 12%). Las limitaciones importantes incluyeron el pequeño tamaño de la muestra, la falta de revisión radiográfica central, la falta de proceso para determinar qué lesiones irradiar y la inclusión de histología de células no claras, que tiende a ser menos sensible a los ICI (103)
Para evaluar si dos ICIs son mejores que sólo uno, el ensayo de fase II RADVAX-RCC incluyó a 25 pacientes que recibieron nivolumab/ipilimumab + SBRT (10 Gy x 5 a 1-2 lesiones). La TRO fue del 56 % y la mediana de SSP fue de 8,2 meses, equivalente a la observada en el estudio CheckMate-214. La toxicidad de grado 3-4 fue del 36 % (46 % en el estudio CheckMate-214) (104).
A diferencia de estos ensayos, el ensayo RAPPORT, que incluyó a 30 pacientes con CCR de células claras oligometastásico con 1-5 lesiones, trató todas las localizaciones de la enfermedad con SBRT (20 Gy x 1) seguida de pembrolizumab durante 8 ciclos. Cabe destacar que 4 de 30 pacientes suspendieron el tratamiento con pembrolizumab debido a neumonitis y 2 de 30 debido a la progresión de la enfermedad. En total, se irradiaron 83 lesiones, de las cuales el 77% recibió SBRT (el resto recibió radioterapia convencional). No se presentaron eventos adversos de grado 4 ni 5. Tras una mediana de seguimiento de 28 meses, la mediana de duración de la respuesta fue de 24 meses, y la supervivencia libre de progresión local a 1 y 2 años fue del 94% y del 92%, respectivamente.
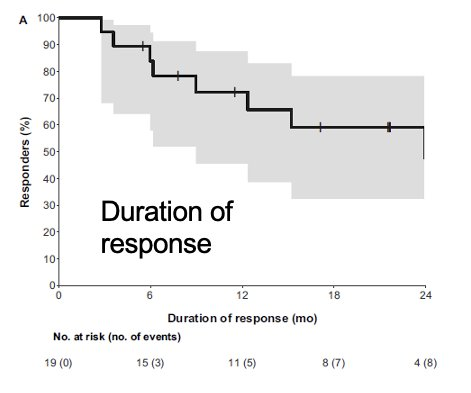
Figura 12: Estudio RAPPORT: Tras una mediana de seguimiento de 28 meses, la mediana de duración de la respuesta fue de 24 meses, Eur Urol. 2022.
La supervivencia libre de progresión a 1 y 2 años fue del 60% y del 45%, respectivamente. La incidencia acumulada de un primer fallo a 1 año fue a distancia en el 30% de los casos y local en el 7%. La mayoría de los pacientes que progresaron presentaron lesiones a distancia (105).
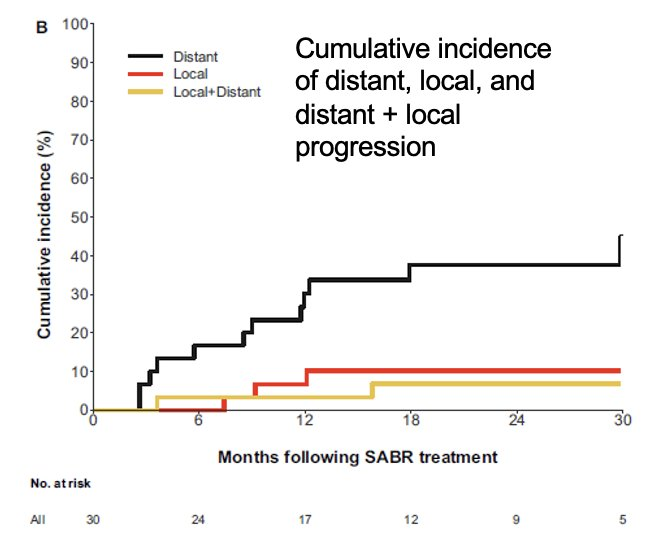
Figura 13: Estudio RAPPORT: supervivencia libre de progresión a 1 y 2 años fue del 60% y del 45%, respectivamente, Eur Urol. 2022
En resumen, el ensayo RAPPORT demostró que:
- SBRT + pembrolizumab es una opción de tratamiento razonable para el CCR oligometastásico
- Fue un tratamiento bien tolerado, con altas tasas de control local.
- La SLP a 2 años del 45 % se compara favorablemente con la SLP a 2 años del estudio KEYNOTE-427 (monoterapia con pembrolizumab), que fue del 22,3 %.
Si bien, el pequeño tamaño de la muestra, el diseño de un solo brazo y la inclusión de una población altamente seleccionada son limitaciones relevantes de este estudio, los resultados alentadores observados con la ablación metastásica total y pembrolizumab en el CCR oligometastásico, justifican una mayor investigación. Lo que aún no está claro es si la mayor TRO y la mejor SLP se deben al tratamiento de todas las lesiones oligo metastásicas o debidas a la secuenciación de la inmunoterapia tras la SBRT.
En tal sentido, las futuras fronteras en este ámbito incluyen:
- Tratamiento de lesiones inmunológicamente «frías» en CCR metastásico sometido a terapia ICI.
- Investigaciones adicionales sobre la secuenciación, el momento de aplicación, el número de sitios, el campo de radioterapia, la dosis y la biología de ICI + SBRT.
- Estudios adicionales para evaluar la combinación de SBRT + terapia sistémica dirigida (sunitinib, pazopanib, sorafenib) + ICI.
Así, el ensayo aleatorizado de no inferioridad de fase III EA8211 SOAR, figura 14, comparará la SBRT secuencial en todas las metástasis con la terapia sistémica estándar posterior en la progresión de la SBRT, en comparación con la terapia sistémica estándar en pacientes con CCR oligometastásico.
Figura 14, Estudio fase III, EA8211 SOAR, en desarrollo.
Los pacientes son asignados aleatoriamente a 1 de 2 brazos:
Brazo A: Los pacientes reciben terapia sistémica estándar a discreción del proveedor tratante en el estudio.
Brazo B: Los pacientes se someten a SAbR secuencial hasta la progresión y luego reciben terapia sistémica estándar a discreción del proveedor tratante en el estudio.
Los pacientes de ambos brazos se someten a una tomografía computarizada (TC) o una resonancia magnética (RM) durante todo el ensayo.
Una vez finalizada la intervención del estudio, se realiza un seguimiento de los pacientes cada 3 meses durante los años 1 y 2, cada 6 meses durante los años 2 a 5, y luego cada 12 meses durante los años 5 a 10 a partir de la fecha de aleatorización.
¿Qué hay del tratamiento de la lesión primaria con SBRT en el CCR metastásico? Estudios aleatorizados realizados en la era de las citocinas demostraron que la nefrectomía inicial en pacientes seleccionados con CCR metastásico se asociaba con una supervivencia prolongada. Sin embargo, el estudio CARMENA con sunitinib sin o con nefrectomía citorreductora, ha cambiado el estándar de atención a partir de 2018 (106).
En la era de la terapia dirigida, la nefrectomía citorreductora beneficia a menos pacientes con CCR metastásico al diagnóstico inicial, en comparación con la era de la terapia con citocinas (107). Es probable que los pacientes con riesgo intermedio y alto no deban someterse a nefrectomía citorreductora, aunque puede seguir siendo una opción razonable para determinados pacientes con enfermedad oligo metastásica y buen estado funcional.
Así, la citorreducción del tumor primario mediante SBRT podría ser útil en el CCR metastásico (similar a CARMENA). Este concepto se evaluará en los ensayos de fase II SAMURAI (NCT 05327686) y CYTOSHRINK (NCT 04090710)
En resumen, los resultados disponibles muestran que en la enfermedad oligo metastásica, la RT puede utilizarse para prolongar una terapia sistémica exitosa o retrasar el inicio de la terapia sistémica y que también puede combinarse con ICI para mejorar la respuesta terapéutica y los resultados. Si bien hasta la fecha no se ha completado ningún ensayo aleatorizado de fase III, la evidencia ya muestra que el CCR no debe considerarse como radio resistente y la radioterapia debe formar parte de la atención multidisciplinaria, aunque aún es necesario una mejor evaluación de la respuesta al tratamiento, definir las dosis, momento, secuencia y sitio de tratamiento (metástasis versus primario).
Tratamiento del cáncer renal metastásico
Dr. Juan Robson, Cristián Alliende, Guillermo Soto
Aproximadamente un tercio de los pacientes con CCR presenta enfermedad avanzada o metastásica (CCRm) al momento del diagnóstico inicial y entre un 20% a 40% de los pacientes con enfermedad clínicamente localizada al diagnóstico, eventualmente desarrollarán metástasis. El CCRm es casi siempre fatal, con tasas de sobrevida a 10 años menores de un 5% (3).
Tratamiento quirúrgico
La nefrectomía es potencialmente curativa sólo logra resecar todos los depósitos tumorales. La información disponible refiere que esto es posible en pacientes seleccionados con tumores primarios localizados o en presencia de enfermedad mono u oligo metastásica resecable. Sin embargo, para la mayoría de los pacientes con enfermedad metastásica, la nefrectomía citoreductiva es sólo paliativa (en pacientes con dolor de difícil manejo, hematuria, síntomas constitucionales o en presencia de SPN) y muchas veces es necesario un tratamiento sistémico complementario (50).
Algunos reportes han descritos casos de regresión espontanea de las metástasis después de una NR (estimado en <1% de los casos), posiblemente asociado a que las grandes masas tumorales pueden inhibir la función de las células-T y B. En un metaanálisis de dos estudios randomizados, se comparó la nefrectomía citoreductiva + inmunoterapia v/s inmunoterapia sola, observándose un aumento en la sobrevida a largo plazo en los pacientes tratados con nefrectomía citoreductiva en enfermos con CCRm y buen performance status (79).
Nefrectomía citorreductiva
Conceptualmente, la nefrectomía citorreductiva (NC) es la nefrectomía que se realiza con el objetivo de disminuir carga tumoral en un paciente con metástasis consignadas. El mecanismo mediante el cual se produciría un beneficio no está claro. Las teorías principales hacen referencia a:
(1) la eliminación del “sumidero inmunogénico” (concepto de la nave nodriza) (108) (2) la disminución de la producción de factores de crecimiento y citoquinas por el tumor primario (109-110)
(3) la acidosis metabólica secundaria a la azoemia en algunos pacientes (111)
Habitualmente la NC se realiza en combinación de terapia sistémica, antes o después de la cirugía. Pese a que este concepto es antiguo, continúa siendo un tema controversial.
Revisamos 2 estudios randomizados fase III, que merecen especial mención cuando nos referimos a este tema son el Surtime y CARMENA, que produjeron cambio de paradigma que había sido establecido por estudios como el del Flanigan y Mickisch (112-113). Eso asociado al hecho de que con el advenimiento de las terapias sistémicas dirigidas (inhibidores de mTOR, antiangiogénicos e inhibidores de tirosinkinasa), la sobrevida de estos pacientes mejoró de manera significativa y el beneficio observado en la NC de los estudios anteriores comenzó a parecer menos significativo.
SURTIME (114) fue un estudio con intención de tratar, que comparó Sunitinib antes y después de la NC v/s NC inmediata y posteriormente Sunitinib. El objetivo principal de sobrevida libre de progresión fue similar a las 28 semanas en ambos grupos. La sobrevida global (intención de tratar) fue un objetivo secundario y fue mayor en el grupo de NC diferida (HR 0,57).
Dentro de las limitaciones de este estudio se encuentra que se terminó precozmente con solo 99 pacientes reclutados y se permitió un amplio crossover.
CARMENA (115) fue un estudio de no inferioridad que comparó el uso de Sunitinib solo o después de NC en pacientes en condiciones, “fit”, con riesgo de MSKCC intermedio o pobre. Se concluyó que el Sunitinib solo no obtuvo peor sobrevida global que la NC seguida de tratamiento con Sunitinib (análisis con intención de tratar) y que el beneficio clínico en ese grupo era mucho mejor. En pacientes con riesgo intermedio, específicamente los con 2 puntos, la sobrevida global fue significativamente mayor en el grupo de Sunitinib solo (HR 0,63; p=0,033). En base a esta información y considerando los datos del Surtime, se concluyó que la NC no debía continuar siendo el estándar en pacientes metastásicos con indicación de tratamiento sistémico.
Limitaciones principales:
- Solo se alcanzó a reclutar 450 de 576 pacientes planificados.
- Deficiente caracterización de la etapificación local en ambos grupos (T, N).
- Alta carga de pacientes de riesgo pobre, y el tumor primario correspondía en promedio aprox. solo 60% de la masa tumoral total (menor posibilidad esperada de responder a la NC).
- 17% del grupo de Sunitinib solo, recibió finalmente nefrectomía (>80% electivas – Crossover).
- 22,5% del grupo de Sunitinib + NC nunca recibió Sunitinib y 6,7% no recibió NC.
- El análisis de los pacientes que recibieron efectivamente lo designado por el estudio (PP2) no logró la significancia estadística.
- Actualmente el Sunitinib dejó de ser la primera línea en estos pacientes.
Existe además evidencia retrospectiva (116) donde se ha observado que la NC antes o después de la terapia sistémica (terapia dirigida – no inmunoterapia), se asociaba a mejor sobrevida global que los que no la recibían, tanto en riesgo intermedio como pobre. Los pacientes que no recibieron NC eran mayores, con mayor carga metastásica y mayor riesgo de IMDC.
En contexto de inmunoterapia, el estudio de Hakimi y cols. (117) mostraron que la NC después de la inmunoterapia, específicamente cuando se lograba “bifecta” (márgenes negativos y ausencia de complicaciones quirúrgicas) se relacionaba con una mejor sobrevida libre de progresión a 2 años.
Este 2025, Yildrim y cols. (118) publican una comparación entre NC de entrada v/s diferida en pacientes recibiendo inmunoterapia o TKI y observaron mayor sobrevida global solo en el grupo de NC en entrada en inmunoterapia. Esta evidencia retrospectiva pudiese ser una señal de las diferencias que pueden demostrarse con los tratamientos más contemporáneos.
Estudios en desarrollo:
Estudio PROBE (119) estudio randomizado que evaluará sobrevida global en NC post tratamiento con inmunoterapia v/s inmunoterapia sola.
Estudio NORDIC-SUN (120) estudio randomizado que iniciará con doble inmunoterapia IO/IO o IO/TKI con 2 períodos de diferenciación de ramas (1er y 2do año) según la respuesta a tratamiento, cada vez en 2 grupos: no resecable 🡪 sin randomización: continuar tratamiento con Nivolumab o IO/TKI (rama C) v/s resecable 🡪 randomización: NC + Nivo o IO/TKI (rama A) o solo Nivo o IO/TKI (rama B).
Este estudio además integrará un programa de investigación con muestras de tejido y análisis de biomarcadores.
En síntesis, actualmente la NC es aún una alternativa válida, que puede realizarse de entrada o de manera diferida de acuerdo con la respuesta a la terapia sistémica. Los pacientes que son seleccionados para NC suelen tener menos puntajes de riesgo que en los estudios cargados intencionalmente a riesgo pobre y menor carga metastásica. Los pacientes que más podrían beneficiarse son los de riesgo bajo o intermedio (especialmente 1 punto), buenos respondedores a tratamiento sistémico y pacientes con solo 1 sitio de metástasis, considerando además evitar mal Performance Status y cirugías de alta morbimortalidad esperada.
Terapia local de la metástasis en el CCRm
A pesar de que existen más de 2200 estudios publicados, ninguno de estos compara en forma randomizada la resección de metástasis con algún otro tipo de tratamiento en el CCRm. Por lo tanto, y basándonos en la evidencia actualmente publicada es que toda recomendación y decisión de realizar la resección de una metástasis tumoral debe ser individualizada de paciente en paciente según las características de cada caso.
Terapia local de las metástasis pulmonares (121): Múltiples estudios, especialmente en casos de metástasis única pulmonar; han comparado la resección completa de la metástasis v/s una resección incompleta o la preservación de las misma, reportando un aumento estadísticamente significativo de la sobrevida general y sobrevida específica de cáncer en los pacientes en quienes se logra una resección completa de la metástasis en contraparte con la resección incompleta o no resección de ésta (con un valor medio para la sobrevida global o específica de cáncer de 14,8 meses, con un rango entre los 8 y 55 meses). Varios factores se han asociado con una mejoría en los resultados después de una metastasectomía, incluyendo la resección completa, presencia de metástasis solitaria, edad menor de 60 años, tamaño tumoral pequeño, metástasis pulmonar y enfermedad metastásica al momento del diagnóstico.
Terapia sistémica
Dr. Juan Carlos Rojas, Dr. Guillermo Soto
Al abordar el CCR metastásico, así como otras neoplasias en estadios avanzados, surge la necesidad en comparar la eficacia clínica de diferentes estudios, fármacos, así como, estimar sobrevida, en pacientes con tratamiento sistémico, para ello la creación y respectiva validación de escalas en las que se defina la condición de salud del paciente de forma global permite estandarizar los elementos a comparar.
El sistema de Memorial Sloan Kettering Cancer Center (Criterios de MSKCC/Motzer)) fue el Gold Standard en el seguimiento durante el tratamiento con citoquinas en el CCRm, siendo utilizado en algunas partes hasta la actualidad. Una mejora a este sistema fue introducida con la escala del International Metastatic RCC Database Consortium (IMDC) (122,123,124).
La neutrofilia y trombocitosis han sido adicionados a los factores de riesgo del modelo de Motzer, y el LDH ha sido removido.
• Escala de Karnofsky (KPS) <80%: 1 punto
• Hemoglobina menor a límite inferior normal (120g/L o 12 g/dL): 1 punto
• Menos de un año desde el diagnóstico al inicio de la terapia sistémica: 1 punto
• Calcemia corregida mayor al límite normal (8.5-10,2 mg/dL): 1 punto
• Recuento Plaquetas mayor a límite normal (150.000-400.000): 1 punto
• Recuento Neutrófilos mayor al límite normal (2.0-7.0 x 109/L): 1 punto
Esta escala define 3 grupos:
- Puntaje 0 es de pronóstico favorable o bajo riesgo con una sobrevida media de 43,2 meses.
- Puntaje entre 1 a 2 es de pronóstico o riesgo intermedios con una sobrevida de 22,5 meses.
- Puntaje mayor a 3 define un grupo de alto riesgo o de mal pronóstico, con una sobrevida media de 7,8 meses.
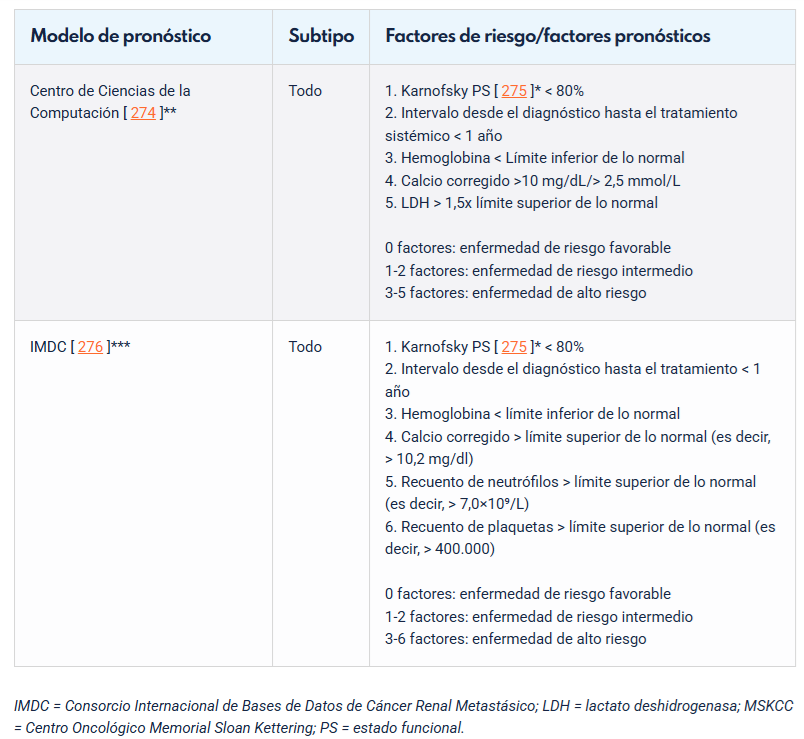
Tabla 20: Modelos pronósticos. Guía EAU 2025
Terapia sistémica cáncer renal metastásico
Quimioterapia
Esta alternativa generalmente es ineficaz en el tratamiento del CCR, pero se puede ofrecer a pacientes con carcinoma de conductos colectores o carcinoma medular (3).
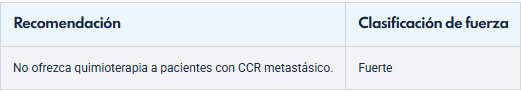
Tabla 21: Recomendación sobre el no uso de Quimioterapia. Guía EAU 2025.
Drogas inhibidoras de la angiogénesis (Terapia Dirigida)
En la actualidad se sabe que, en el CCR, se produce una acumulación del factor inducido por hipoxia debido a una inactivación del gen VHL (Von Hippel Landau) provocando una sobreexpresión de los factores de crecimiento derivado de plaquetas (PDGF) y del endotelio vascular (VEGF), ambos factores promueven la neo angiogénesis. Este proceso contribuye al desarrollo y progresión del cáncer renal. En la actualidad, varios medicamentos dirigidos a estas moléculas objetivo han sido aprobados para el tratamiento del CCRm tanto en Estados Unidos como en Europa y muchos otros actualmente se encuentra bajo investigación.
1. Inhibidores de la tirosina kinasa (TKIs)
Sorafenib: Es un inhibidor multikinasa oral con actividad contra Raf-1 serina/treonina kinasa, B-Raf, receptor 2 VEGF, receptor PDGF y c-KIT. Se ha comparado Sorafenib y placebo después del fallo de la inmunoterapia sistémica inicial o pacientes que no son candidatos a inmunoterapia, el estudio ha reportado un aumento de 3 meses en la sobrevida libre de progresión a favor de sorafenib (media de 5,5 meses) sobre placebo (media de 2,8 meses, p<0,01) (125). Este beneficio no ha sido observado al comparar Sorafenib con Interferón-alfa en pacientes con CCRm no tratados previamente (126). Algunos reportes anecdóticos de pequeñas series de casos sugieren que algunos pacientes en los cuales la enfermedad neoplásica renal ha progresado a pesar del tratamiento con otro inhibidor de los receptores VEGF podrían responder favorablemente a Sorafenib, por lo que este agente es utilizado frecuentemente en pacientes cuya enfermedad ha progresado con Sunitinib o algún agente similar.
Sunitinib: Es en la actualidad el inhibidor oral de la tirosina kinasa más ampliamente utilizado en el tratamiento inicial del CCRm. Inhibidor selectivo y de acción sinérgica sobre de los receptores PDGF y VEGF, c-KIT y FLT-3; tiene actividad antiangiogénica y antitumoral. Estudios en fase II con Sunitinib en monoterapia de segunda línea en pacientes con CCRm demostraron una respuesta parcial en el 34% – 40% de los pacientes y una enfermedad estable > 3 meses en el 27% – 29% de los pacientes (127). Diferentes estudios con intención de tratar han demostrado la superioridad de Sunitinib vs Interferón-alfa en monoterapia de primera línea (26 vs 21 meses) en pacientes con Motzer de riesgo bajo y medio. Así también una mejor calidad de vida, menor tasa de reacciones adversas y disminución en la mortalidad en los pacientes que pasaron del brazo de tratamiento de interferón-alfa a recibir Sunitinib.
En el ensayo EFFECT, se comparó sunitinib 50 mg/día (cuatro semanas con tratamiento/dos semanas sin tratamiento) con sunitinib 37,5 mg/día continuo e ininterrumpido en pacientes con carcinoma renal metastásico de células claras (CCRcc-m) No se observaron diferencias significativas en la SG (23,1 frente a 23,5 meses, p = 0,6159 con toxicidad comparable, pero mayor tiempo hasta progresión con dosis estándar (128).
Pazopanib: Es un inhibidor oral de la angiogénesis dirigida a los receptores VEGF, PDGF y c-KIT. En un ensayo aleatorizado prospectivo de Pazopanib comparado con placebo en pacientes con CCRm no tratados previamente y paciente tratado con citocinas, se constató una mejora significativa de la supervivencia sin progresión y la respuesta del tumor (9,2 vs. 4,2 meses). Así también en estudios en fase III (COMPARZ) de no inferioridad, al comparar Pazopanib con Sunitinib, se ha establecido que Pazopanib es una opción en el tratamiento de primera línea, ya que no se ha asociado a una disminución significativa en la sobrevida global al compararlo con Sunitinib. Así también se ha reportado una mejor calidad de vida asociado a la toxicidad por drogas con el uso de Pazopanib en comparación con Sunitinib (129,130).
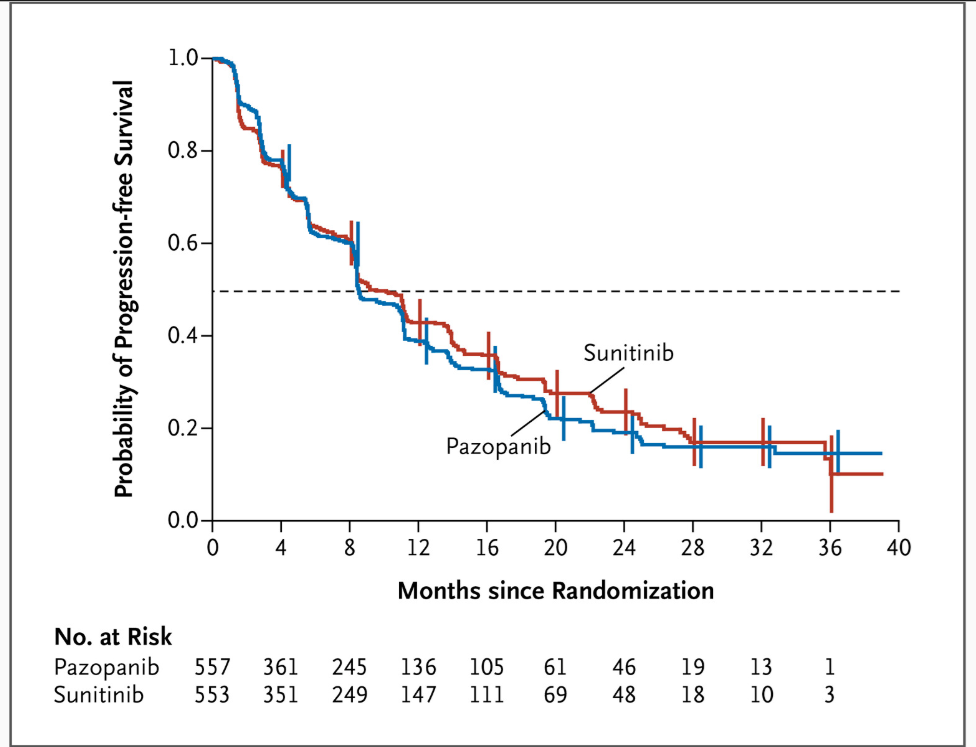
Figura 15: Sobrevida libre de progresión pazopanib vs sunitinib.
En el estudio PISCES pazopanib presento menor toxicidad en comparación s sunitinib ( 70% vs 22% , p<0.05) (131)
Axitinib: Es un inhibidor selectivo oral de segunda generación de los receptores 1, 2 y 3 de VEGF con mínima inhibición de otros blancos y corta vida media. En el análisis inicial del estudio AXIS, si bien Axitinib mostró un mayor grado de toxicidad (diarrea, hipertensión, fatiga, náuseas y vómitos) al compararlo con Sorafenib en el tratamiento de segunda línea del CCRm (pacientes que habían recibido previamente tratamiento con citokinas o los agentes dirigidos habían fallado), no demostró una diferencia significativa en la sobrevida global entre Axitinib y Sorafenib (108). No existe evidencia que respalde el uso de Axitinib como terapia de primera línea en el CCRm. Estos nuevos fármacos, han abierto una nueva línea orientada a precisar e inhibir un componente específico de la vía del gen VHL en el tratamiento del CCRm, al mismo tiempo que disminuyen las reacciones adversas de los inhibidores de múltiples kinasas.
Cabozantinib: Cabozantinib es un inhibidor oral de la tirosina quinasa, incluyendo MET, VEGF y AXL. Cabozantinib se investigó en un estudio de fase I en pacientes resistentes a inhibidores de VEGFR y mTOR, demostrando respuestas objetivas y control de la enfermedad. En un ensayo clínico aleatorio (ECA) se investigó cabozantinib vs. everolimus en pacientes con ccRCC que no respondieron a una o más terapias dirigidas al VEGF (METEOR) Cabozantinib retrasó la SSP en comparación con everolimus en la enfermedad refractaria a la terapia dirigida al VEGF (HR: 0,58, IC del 95%: 0,45-0,75). La mediana de supervivencia global (SG) fue de 21,4 meses (IC del 95 %: 18,7 a no estimable) con cabozantinib y de 16,5 meses (IC del 95 %: 14,7-18,8) con everolimus en el CCR resistente al VEGF. El HR de mortalidad fue de 0,66 (IC del 95 %: 0,53-0,83; p = 0,0003) (3). Se notificaron eventos adversos de grado III o IV en el 74 % con cabozantinib y en el 65 % con everolimus.
El ensayo aleatorizado de fase II Alliance A031203 CABOSUN que comparó cabozantinib y sunitinib en primera línea en 157 pacientes de riesgo intermedio y alto favoreció cabozantinib para RR y PFS, pero no para OS. Cabozantinib aumentó significativamente la mediana de PFS (8,2 frente a 5,6 meses)). La tasa de respuesta objetiva fue del 46 % (IC del 95 %: 34-57) para cabozantinib frente al 18 % (IC del 95 %: 10-28) para sunitinib. Los eventos adversos fueron similares (132).
Levantinib: es un inhibidor de la tirosina quinasa (TKI) oral multidiana de VEGFR1, VEGFR2 y VEGFR3, con actividad inhibidora contra los receptores del factor de crecimiento de fibroblastos (FGFR1, FGFR2, FGFR3 y FGFR4), el receptor del factor de crecimiento plaquetario (PDGFRα), reorganizado durante la transfección (RET) y el receptor del factor de células madre (KIT). Recientemente se ha investigado en un estudio aleatorizado de fase II en combinación con everolimus frente a lenvatinib o everolimus solo. En este estudio los pacientes fueron aleatorizados mediante un sistema de respuesta de voz interactivo en una proporción 1:1:1 a lenvatinib (24 mg/día), everolimus (10 mg/día) o lenvatinib más everolimus (18 mg/día y 5 mg/día, respectivamente) administrados por vía oral en ciclos continuos de 28 días hasta la progresión de la enfermedad o la aparición de efectos tóxicos inaceptables. El objetivo principal fue las sobrevida libre de progresión. Como resultado se concluye que Lenvatinib más everolimus prolongó significativamente la supervivencia libre de progresión en comparación con everolimus solo (mediana de 14,6 meses frente a 5,5 meses, pero no en comparación con lenvatinib solo (7,4 meses [IC del 95 %: 5,6-10,2]; HR de 0,66; IC del 95 %: 0,39-1,10; p = 0,12). El lenvatinib como agente único prolongó significativamente la supervivencia libre de progresión en comparación con everolimus solo (HR 0,61, IC del 95% 0,38–0,98; p = 0,048). (3)
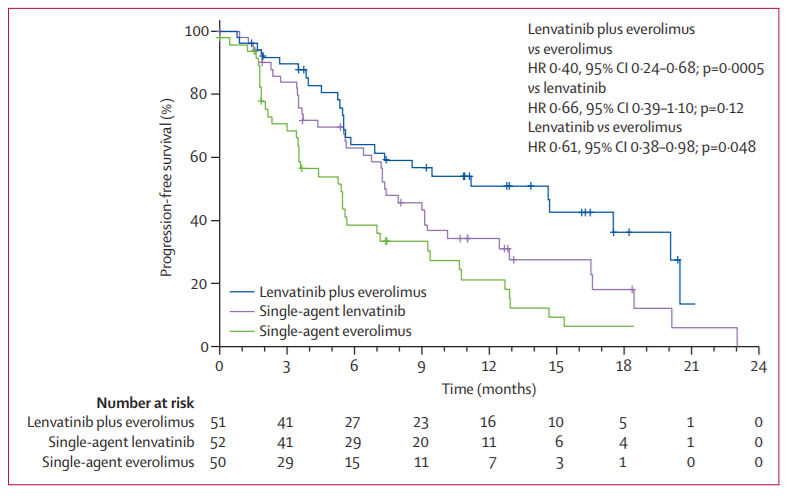
Figura 16: Tabla Sobrevida libre de progresión por grupo
Tivozanib
Tivozanib es un potente inhibidor de la tirosina quinasa (TKI) selectivo de VEGFR1, VEGFR2 y VEGFR3, y se comparó con sorafenib en dos ensayos de fase III en pacientes con CCRm. Tivozanib fue aprobado por la EMA para el tratamiento de primera línea en CCRm. Si bien se asoció con una ventaja en la SSP en ambos estudios, no se observó ninguna ventaja en la SG. (3)
2. Inhibidores mTOR (mammalian target of rapamycin)
La mTOR es una proteína intracelular clave, componente de variadas cascadas metabólicas incluyendo a aquellas que median los efectos de los factores de crecimiento celular, apoptosis, micronutrientes y angiogénesis.
Temsirolimus: Es un inhibidor específico de la mTOR. La eficacia y seguridad de ésta molécula fue demostrada por medio de un estudio en el que se aleatorizó a pacientes con CCRm de alto riesgo a recibir tratamiento de primera línea con Temsirolimus o Interferón-alfa monoterapia o combinado, sin embargo, actualmente no se considera como tratamiento de primera línea (3).
Everolimus: Es un inhibidor oral de la mTOR que se ha establecido en el tratamiento de la enfermedad refractaria al VEGF. Un estudio comparó Everolimus + el mejor tratamiento sintomático (MTS) vs. placebo + el MTS en paciente en que había fracasado un tratamiento previo con Sunitinib, Sorafenib o ambos. La media de supervivencia sin progresión fue de 4 meses con Everolimus y de 1.9 meses con placebo (P <0.001). Un estudio reciente comparativo de Sunitinib vs Everolimus en el tratamiento del CCRm seguidos de Sunitinib o Everolimus en el caso de progresión muestran una media de sobrevida libre de progresión de 7,9 meses para Everolimus y 10.7 meses para Eunitinib. Estos resultados muestran un beneficio significativo en la enfermedad libre de progresión para Sunitinib comparado con Everolimus en el tratamiento de primera línea. Actualmente se considera como opción de tratamiento en paciente con intolerancia o fracaso previo a terapias dirigidas el sistema inmulogico y al VEGF (3)
3. Inhibidor de moléculas pequeñas.
Belzutifan: es un inhibidor del factor de transcripción HIF2a con actividad como agente único en el CCRcc. Los ensayos iniciales de fase I/II en 55 pacientes confirmaron una tasa de respuesta objetiva del 25% (todas las respuestas parciales) y una mediana de SSP de 14,5 meses. Los eventos adversos de grado ≥ 3 más frecuentes fueron anemia (27%) e hipoxia (16%). En el estudio aleatorizado de fase III LITESPARK 005, mostró una ventaja en la SSP sobre everolimus en el CCRcc con tratamiento previo intensivo. Presenta un perfil favorable de eventos adversos. Debe considerarse una alternativa atractiva a everolimus en este contexto. Belzutifan también se ha investigado en combinación con cabozantinib en un ensayo de fase II de un solo grupo con dos cohortes (sin tratamiento previo y tras inmunoterapia con hasta dos líneas). En segunda y tercera línea, esta combinación produjo una tasa de respuesta objetiva del 30,8% con una CR (2%) (3).
Terapia dirigida al factor de crecimiento endotelial vascular (VEGF) intermitente
La terapia intermitente dirigida al VEGF resulta atractiva para pacientes con terapia a largo plazo, debido a la toxicidad crónica asociada, como la fatiga. Se ha probado con sunitinib o pazopainib en un estudio de fase III y se ha demostrado su seguridad. Los pacientes del estudio mantuvieron una enfermedad estable (o mejor) durante al menos seis meses después de iniciar la terapia. Se les realizó un seguimiento estrecho de la progresión mediante imágenes transversales. La interrupción de la terapia se asoció con mayores tasas de progresión, pero no se observó ningún efecto perjudicial en la supervivencia general. La terapia intermitente no se ha probado con combinaciones de VEFG/PD-1, por lo tanto, se desconoce su aplicación en el entorno moderno de primera línea, pero la extrapolación sugiere que debería ser segura (133).
Inmunoterapia
Dr. Rodrigo Canales
La historia natural de la enfermedad en pacientes con CCR avanzado o metastásico puede variar ampliamente de unos pocos meses a muchos años, dependiendo de las características clínicas, patológicas, de laboratorio y radiográficas de la enfermedad, así como de la respuesta a las terapias. La inmunoterapia con inhibidores de puntos de control inmunitario (inhibidores de checkpoints) se ha convertido en una modalidad importante para el tratamiento del CCR de células claras, tanto como terapia inicial, como después de la terapia antiangiogénica.
La inmunología y la oncología se han vinculado desde finales del siglo XIX, cuando el cirujano William Coley informó que una inyección de bacterias muertas en sitios de sarcoma podría conducir a la reducción del tumor, así como también gracias al uso de la BCG intravesical para el manejo del tumor vesical. Desde entonces, avances exponenciales en la comprensión de la intersección entre la vigilancia inmunológica y el crecimiento y desarrollo tumoral han conducido a amplios avances terapéuticos que ahora se están estudiando en todos los tipos de cánceres. Gracias a su importante aporte, el 2018, se otorga el Premio Nobel de Medicina a James P. Allison por sus trabajos en el desarrollo de anticuerpos que bloquean la acción de la proteína CTL-4 ubicada en la superficie de los linfocitos T (Figura 1) y cuya actividad inhibe la respuesta inmunitaria antitumoral; y a Tasuku Honjo, por sus investigaciones enfocadas en la proteína PD-1 presente en la superficie de los linfocitos T, que también frena la activación de los linfocitos, y cuyo bloqueo mediante anticuerpos favorece la respuesta antitumoral.
En los últimos años, los anticuerpos anti PD-1 y PD-L1 se han postulado como la gran promesa en el ámbito de la inmunoterapia contra el cáncer. Cada vez son más los ensayos clínicos con anticuerpos monoclonales con resultados que, aún lejos de ser la terapia definitiva, son esperanzadores para avanzar en el tratamiento de esta enfermedad.
El receptor PD-1 y sus ligandos PD-L1/PD-L2, pertenecen a la familia de proteínas de control inmune y actúan como factores co-inhibidores para modular la respuesta de las células T y evitar una inflamación autoinmune crónica. Cuando los receptores de los linfocitos T reconocen los antígenos de superficie que identifican a una célula como cancerosa, éstos se activan para eliminarla. Pero cuando una célula T es activada, también es necesaria una señal de stop que asegure que no se producirá una sobre activación. Una de las vías por las que se regula esta activación de los linfocitos T es mediante receptores de inhibición como el PD-1 (receptor de muerte celular programada, también conocido como CD279), presente en la superficie de las células T, como ya se mencionó.
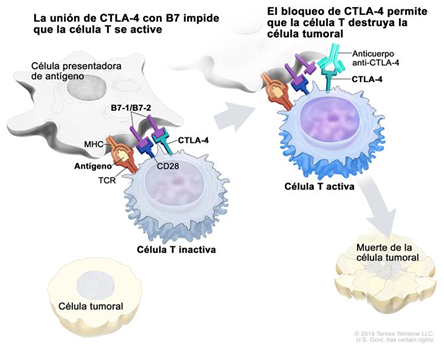
Fig. 17. Mecanismo de Acción del bloqueo de CTLA-4 que traduce muerte celular. The Cancer-Immunity Cycle. Immunity, 2013.
Tras la activación, los linfocitos T aumentan la expresión del receptor PD-1 que les permitirá recibir la señal de desactivado. Esta señal se producirá tras la unión de este receptor a su ligando PD-L1 o PD-L2, que normalmente se expresan en la superficie de células dendríticas y macrófagos, y que provocará la reducción de la producción de citoquinas y la supresión de la proliferación de las células T. Es precisamente este mecanismo, el que han integrado muchos tumores con el fin de bloquear el reconocimiento de los mismos, mediante la expresión en su superficie de las proteínas PD-L1 y PD-L2, logrando escapar así de la acción del sistema inmune y continuar proliferando. La ruta PD-1/PD-L1 representa, por tanto, un mecanismo de resistencia inmune adaptativa que desarrollan las células tumorales en respuesta a la actividad antitumoral endógena. (134)
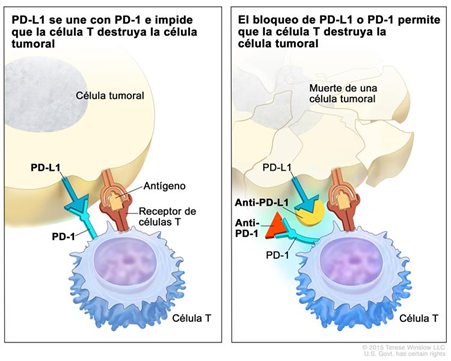
Fig. 18. Mecanismo de Acción del bloqueo de PD-L1 o PD-1 que traduce muerte celular. The Cancer-Immunity Cycle. Immunity, 2013.
Inmunoterapia con anticuerpos anti PD-1 y PD-L1
La inmunoterapia contra el cáncer pretende superar la capacidad de las células tumorales para resistir a la respuesta inmune endógena, mediante la estimulación del propio sistema inmune de cada paciente. Así, una molécula capaz de bloquear el receptor PD-1 presente en la superficie de los linfocitos, o bien los ligandos PD-L1 y PD-L2 expresados por las células cancerosas, impediría la unión de ambos y, por lo tanto, no se produciría la señal inmunomoduladora, permitiendo que las células T continúen activas contra el tumor.
Se han desarrollado anticuerpos monoclonales frente a PD-1 (Pembrolizumab, Nivolumab) y PD-L1 (Atezolizumab), además otros en estudio, conocidos como inhibidores de checkpoints inmunológicos, capaces de bloquear esa unión y estimular la respuesta inmune frente a las células tumorales. Prueba de ello son los numerosos ensayos clínicos con anticuerpos anti PD-1 y PD-L1 que se están llevando a cabo con resultados prometedores especialmente en cáncer de pulmón no microcítico, melanoma, carcinoma renal y cáncer de vejiga.
Fig. 19. Terapias que pueden afectar el ciclo de inmunidad al cáncer. The Cancer-Immunity Cycle. Immunity, 2013
Estos hallazgos ahora se han extendido a CCR avanzado y han reemplazado a la inmunoterapia más antigua.
Elección de la terapia
El papel de la inmunoterapia en el tratamiento del CCR y su integración con la terapia dirigida molecularmente discutidos en este capítulo, son consistentes con las guías clínicas actualizadas de la Asociación Europea de Urología (AEU).(134)
Inhibidores de checkpoints inmunológicos (ICI)
El nivolumab , un inhibidor de la muerte celular programada 1 (PD-1) de los linfocitos T, ha sido aprobado como segunda línea de terapia después del tratamiento dirigido antiangiogénico para CCR avanzado basado en mejoras en la supervivencia general (SG) en un ensayo de fase III, y la combinación de nivolumab más ipilimumab en pacientes sin tratamiento previo, se han incorporado a las guías clínicas, basadas en los resultados de otro ensayo de fase III.(122) Ipilimumab corresponde a un anticuerpo monoclonal antitumoral de tipo IgG1κ frente al antígeno 4 del linfocito T citotóxico (CTLA-4), obtenido mediante tecnología de ADN recombinante humano. La unión del CTLA-4 a sus ligandos (CD80 y CD86, o B7.1 y B7.2) se traduce como una inhibición de la activación del linfocito T. Ipilimumab, al promover la activación y proliferación de los linfocitos T, así como su infiltración en los tumores, lleva por tanto a la muerte de las células tumorales.
Estratificación de riesgo
La elección del tratamiento para pacientes con enfermedad avanzada debe considerar los factores de riesgo pronóstico sobre carcinoma metastásico de células renales del International Metastatic RCC Database Consortium (IMDC).(123) El modelo de pronóstico integra seis factores adversos. Los pacientes con ninguno de estos factores de riesgo se consideran con bajo riesgo, aquellos con uno o dos se consideran de riesgo intermedio, y aquellos con tres o más factores se consideran de alto riesgo.
En general, la terapia sistémica se inicia rápidamente cuando la enfermedad es avanzada. Sin embargo, para muchos pacientes asintomáticos con una carga de enfermedad limitada y sin características de mal pronóstico, la vigilancia activa estrecha puede representar una alternativa para quienes desean diferir el inicio de la terapia y su toxicidad concomitante, hasta que se documente una progresión de la enfermedad más convincente.
Pacientes previamente no tratados
Para aquellos con enfermedad de riesgo intermedio o bajo, las opciones preferidas incluyen nivolumab más ipilimumab o pembrolizumab más axitinib, aunque se desconoce si estas combinaciones mejoran las tasas de respuesta completas y tienen la capacidad de proporcionar una supervivencia sin tratamiento, que es típica de las inmunoterapias efectivas.
Los datos convincentes sobre el papel de la inmunoterapia en pacientes no tratados previamente provino de un ensayo de fase III que demostró un beneficio en sobrevida global (SG) con la combinación de nivolumab más ipilimumab sobre sunitinib.(122) Posteriormente, la combinación de pembrolizumab más axitinib demostró una supervivencia libre de progresión (SLP) y beneficios en SG sobre sunitinib. Dado el beneficio en SG visto con pembrolizumab más axitinib sobre sunitinib , se considera una opción apropiada de primera línea para aquellos pacientes con CCR avanzado que no tienen contraindicación para tratamiento.
Mientras avelumab más axitinib es una opción alternativa de primera línea, no es uno de los actuales regímenes preferidos ya que no se demostró un beneficio de SG en ensayos aleatorizados.
La combinación de nivolumab e ipilimumab está aprobada por la FDA para el tratamiento de riesgo intermedio y de bajo riesgo, sin tratamiento previo, para pacientes con CCR avanzado, y se incorpora a las pautas clínicas de la AEU.
Nivolumab más ipilimumab: En pacientes con CCR avanzado, la combinación de nivolumab más ipilimumab demostró un beneficio de supervivencia y una toxicidad favorable en relación con sunitinib. En el ensayo de fase III CheckMate 214, 1096 pacientes con CCR metastásico de células claras con tratamiento previo, avanzado o sin tratamiento previo, se asignaron aleatoriamente a nivolumab más ipilimumab versus sunitinib. Pacientes con metástasis cerebrales y exposición previa a terapia dirigida o a un inhibidor de punto de control fueron excluidos. La combinación de nivolumab (3 mg / kg) más ipilimumab (1 mg / kg) se administró cada tres semanas para cuatro dosis, seguidas de nivolumab (3 mg / kg) cada dos semanas. Sunitinib se administró a 50 mg por día durante cuatro semanas de cada ciclo de seis semanas. En una mediana de seguimiento de 25 meses, los resultados incluyeron lo siguiente: para toda la población de estudio por intención de tratar, la SG aumentó significativamente con nivolumab más ipilimumab (mediana no alcanzada versus 32.9 meses, HR 0.68, 99.8%CI 0,49-0,95). La tasa de respuesta objetiva también aumentó significativamente (39 versus 32 por ciento), pero no hubo diferencias en la SLP (mediana 12.4 versus 12.3 meses, HR 0,98). Para los 847 pacientes con enfermedad de riesgo intermedio o alto, hubo una significativa mejoría en la SG con nivolumab más ipilimumab, en comparación con sunitinib (mediana no alcanzada versus 26 meses, HR 0.63, IC 95% 0.44-0.82) y en la respuesta objetiva (42 versus 27 por ciento). La mediana de SLP también aumentó, pero no alcanzó significación estadística (11.6 versus 8.4 meses, HR 0.82, IC 95% 0.64-1.05). Sin embargo, la SLP y el beneficio de respuesta parecieron mejorar en pacientes con tumores con expresión de PD-L1 ≥1 por ciento.(122,136)
Los efectos secundarios y los datos de calidad de vida también favorecieron la combinación de nivolumab más ipilimumab sobre sunitinib.
Sólo hay datos limitados sobre la actividad de la monoterapia con nivolumab (es decir, administrada sin ipilimumab) en pacientes sin tratamiento previo con CCR avanzado.
Axitinib más pembrolizumab: Se ha demostrado que el agente antiangiogénico axitinib se puede combinar de manera efectiva y segura con el inhibidor de punto de control pembrolizumab. Esta combinación no se ha comparado directamente con nivolumab más ipilimumab o axitinib más avelumab y, dadas las diferencias en las poblaciones estudiadas, el período de estudio, los centros participantes y los distintos endpoints de los estudios, son difícilmente comparables, a pesar de sus brazos de control comunes. En el ensayo fase III KEYNOTE-426, 861 pacientes con CCR de células claras avanzado, sin tratamiento previo, fueron asignados aleatoriamente a pembrolizumab más axitinib versus sunitinib solo. Después de una mediana de seguimiento de 13 meses, el pembrolizumab más axitinib mostró beneficios independientemente de la expresión de PD-L1 e independientemente de la clasificación internacional de riesgo.(137)
Otras estrategias. Axitinib más avelumab : también se ha demostrado que Axitinib se combina de forma segura y mejora la SG (90 versus 78 por ciento a los 12 meses, HR 0.53, IC 95% 0.38-0.74); con una SLP más larga (mediana 15.1 versus 11.1 meses, HR 0.69, IC 95% 0.57-0.84) y tasas de respuesta objetiva superior (59 versus 36 por ciento); pero con tasas numéricamente más altas de eventos adversos de grado 3 o superiores (76 frente a 71 por ciento).(138) Es una opción para la terapia de primera línea; sin embargo, se prefiere nivolumab más ipilimumab o axitinib más pembrolizumab, para pacientes sin contraindicaciones para la inmunoterapia.
En ausencia de comparaciones directas de nivolumab más ipilimumab versus pembrolizumab más axitinib, cualquiera de estas opciones es apropiada.
Pembrolizumab: La inmunoterapia con pembrolizumab como agente único, se estudió en el ensayo KEYNOTE-427. En la cohorte A de ese estudio, 110 pacientes con CCR de células claras avanzado o metastásico fueron tratados con pembrolizumab (200 mg cada tres semanas). Todos los pacientes tenían una enfermedad medible y no habían recibido previamente terapia sistémica. Los resultados preliminares se presentaron en la ASCO 2018. En una mediana de seguimiento de 12 meses, la tasa de respuesta objetiva general fue del 38 por ciento, que incluyó tres pacientes con una respuesta completa y 39 pacientes con una respuesta parcial; la tasa de control de la enfermedad fue del 69 por ciento. La tasa de respuesta fue mayor en pacientes con enfermedad de riesgo intermedio / alto, en comparación con aquellos con enfermedad de riesgo favorable (42 versus 32 por ciento), y la tasa de respuesta fue mayor en aquellos con una expresión de PD-L1 ≥1 por ciento versus aquellos con expresión de PD-L1 <1 por ciento.(125)
Choueiri y cols, en el estudio KEYNOTE-564 (139), publicado en abril de 2024, mostró que el tratamiento adyuvante con pembrolizumab como terapia neoadyuvante del carcinoma de células renales evidenció una mejora significativa de la supervivencia libre de enfermedad. En este ensayo de fase 3, doble ciego y controlado con placebo, se asignaron aleatoriamente (en una proporción 1:1) a participantes con CCR de células claras con mayor riesgo de recurrencia tras la cirugía, a recibir pembrolizumab (dosis de 200 mg) o placebo cada 3 semanas durante un máximo de 17 ciclos (aproximadamente un año) o hasta la recurrencia, la aparición de efectos tóxicos inaceptables o la revocación del consentimiento. Un total de 496 participantes fueron asignados a recibir pembrolizumab y 498 a recibir placebo. Al 15 de septiembre de 2023, la mediana de seguimiento fue de 57,2 meses. El beneficio de supervivencia libre de enfermedad fue consistente con el de análisis previos (cociente de riesgo de recurrencia o muerte, 0,72; intervalo de confianza del 95% [IC], 0,59 a 0,87). Cabe destacar que también se observó una mejora significativa en la supervivencia global con pembrolizumab en comparación con placebo (cociente de riesgo de muerte, 0,62; IC del 95%, 0,44 a 0,87; P = 0,005). La supervivencia global estimada a los 48 meses fue del 91,2% en el grupo de pembrolizumab, en comparación con el 86,0% en el grupo de placebo; el beneficio fue consistente en los subgrupos clave. Si bien el pembrolizumab se asoció con una mayor incidencia de eventos adversos graves de cualquier causa (20,7 % frente al 11,5 % con placebo) y de eventos adversos de grado 3 o 4 (18,6 % frente al 1,2 % con placebo), no se registraron muertes atribuidas al tratamiento con pembrolizumab. Con base en estos hallazgos, los autores concluyeron que el tratamiento adyuvante con pembrolizumab se asoció con una mejora significativa y clínicamente relevante de la supervivencia global, en comparación con placebo, en pacientes con carcinoma renal de células claras con mayor riesgo de recurrencia tras la cirugía.
Alternativas en pacientes previamente tratados con antiangiogénicos
Para aquellos pacientes que progresan al tratamiento inicial con un inhibidor de VEGF sin exposición previa a la inmunoterapia con inhibidores de punto de control, existe evidencia que respalda el tratamiento con nivolumab. El nivolumab mejora la sobrevida general (SG) en comparación con everolimus en esta población. La dosis de nivolumab como monoterapia es 240 mg cada dos semanas o 480 mg cada cuatro semanas. En el ensayo de fase III CheckMate 025, 821 pacientes fueron asignados aleatoriamente a nivolumab (3 mg / kg cada dos semanas) o everolimus (10 mg / día). Todos los pacientes habían recibido una o dos terapias antiangiogénicas previas. El ensayo se detuvo temprano en función de la SG en un análisis provisorio planificado.(140)
Eventuales opciones ante la falla a la inmunoterapia
Para los pacientes que progresan después de la inmunoterapia, los estudios sugieren terapia dirigida al receptor del factor de crecimiento endotelial vascular (VEGFR) en lugar de un inhibidor de mTOR. Así, para quienes progresan después de la inmunoterapia inicial y que no han recibido previamente terapia antiangiogénica, las opciones incluyen axitinib, cabozantinib, sunitinib, pazopanib o lenvatinib con everolimus.
Al respecto, existe un primer informe sobre resultados con TKI, después del fracaso de nivolumab-ipilimumab como primera línea en CCR metastásico, como parte del ensayo Checkmate 214. La mediana de SLP con TKI de primera generación (sunitinib / pazopanib) y de segunda generación (axitinib / cabozantinib) fue de 8 meses y 7 meses, respectivamente. Estas medianas de SLP sugiere un beneficio sostenido de TKI y respalda los ensayos que investigan la secuencia óptima.(141)
Inmunoterapia en tumores renales de histología papilar: debemos mencionar el estudio CALYPSO,que en su fase I/II evaluó la eficacia y seguridad de la combinación de durvalumab (anti PDL-1) más savolitinib (inhibidor del protoncogen MET, que codifica para un receptor tirosinkinasa) en pacientes con carcinoma metastásico de células renales variante papilar. En este ensayo, la tasa de respuesta objetiva de durvalumab más savolitinib fue del 27% con una mediana de supervivencia libre de progresión de 5,3 meses. El estudio reclutó a pacientes con carcinoma metastásico de células renales papilares, independientemente de si habían recibido tratamiento previo o no.(142) Los resultados favorables en paciente con mutación MET (en torno al 80%), llevaron a la formulación del estudio SAMETA, un fase III que evalúa savolitinib + durvalumab versus sunitinib y durvalumab en monoterapia en pacientes con un tumor renal papilar no resecable localmente avanzado o metastásico, cuyo primer paciente fue enrolado en octubre de 2021.
Creemos que los avances con el uso de la inmunoterapia para el tratamiento del carcinoma metastásico de células renales son esperanzadores, por lo que debemos seguirlos atentamente con la idea de determinar con aún mayor precisión qué opciones terapéuticas serán las más adecuadas y cuáles financiar por nuestros sistemas de salud. Hasta ahora, la mejor evidencia se ha obtenido con pembrolizumab en adyuvancia en pacientes con riesgo de recurrencia intermedio o alto, por lo que consideramos importante conocer su perfil de seguridad y aprender sobre el manejo de las complicaciones inmunomediadas, además de buscar estrategias de financiamiento que permitan instaurar su uso en la práctica clínica en este subgrupo de pacientes.
Manejo de enfermedad metastásica
Dr. Cristián Alliende
En el contexto del carcinoma renal metastásico (CCRm), el momento adecuado para iniciar la terapia sistémica sigue siendo materia de discusión. En pacientes con enfermedad de bajo volumen, asintomáticos y sin factores de mal pronóstico, puede considerarse la vigilancia activa inicial. Esta estrategia, respaldada por estudios retrospectivos y prospectivos, permite postergar el inicio de una terapia potencialmente tóxica sin afectar la supervivencia. (II, A) (143).
Sigue siendo fundamental la estratificación pronóstica de los pacientes utilizando el modelo del International Metastatic RCC Database Consortium (IMDC), el cual clasifica a los pacientes en riesgo bajo, intermedio o alto, según la presencia de seis factores de riesgo: KPS < 80%, tiempo desde el diagnóstico hasta el tratamiento < 1 año, hemoglobina baja, calcio sérico elevado, neutrofilia y trombocitosis. Esta clasificación orienta la elección de la terapia.
PRIMERA LÍNEA DE TRATAMIENTO EN CCR DE CÉLULAS CLARAS
Pacientes de bajo riesgo: En este grupo se consideran varias combinaciones IO/TKI como opciones preferidas:
- Pembrolizumab + axitinib (KEYNOTE-426, I, A) (144)
- Pembrolizumab + lenvatinib (CLEAR, I, A) (145)
- Nivolumab + cabozantinib (CheckMate 9ER, I, A) (146)
Pacientes de riesgo intermedio o alto: El estándar de tratamiento ha evolucionado hacia combinaciones que incluyen inmunoterapia, con las siguientes opciones preferidas:
- Nivolumab + ipilimumab (CheckMate 214, I, A) (147)
- Pembrolizumab + lenvatinib (CLEAR, I, A)
- Nivolumab + cabozantinib (CheckMate 9ER, I, A)
- Pembrolizumab + axitinib (KEYNOTE-426, I, A)
- Cabozantinib (CABOSUN, II, A) (148)
En casos donde la inmunoterapia esté contraindicada o no disponible, pueden considerarse sunitinib (I, B) (149), pazopanib (I, B) (150) o tivozanib (II, B) (151), aunque ya no son las opciones preferentes.
SEGUNDA LÍNEA DE TRATAMIENTO
La selección de la terapia de segunda línea depende de la terapia utilizada previamente, existiendo múltiples opciones, entre ellas:
- Si se inició con inmunoterapia: se prefiere una TKI como cabozantinib (METEOR, I, A) (152), tivozanib (TIVO-3, II, B) (153) o lenvatinib + everolimus (II, B) (154).
- Si no se ha utilizado inmunoterapia: se puede considerar nivolumab (CheckMate 025, I, A) (155), cabozantinib (METEOR, I, A) (156) o lenvatinib + everolimus (II, B) (154).
Everolimus o axitinib en monoterapia han quedado relegados como opciones menos preferidas (II, C) (157).
CCR NO CÉLULAS CLARAS
Debido a ser un grupo de menor incidencia y heterogéneo en sí mismo, los CCR no células claras no cuentan con el nivel de evidencia que disponemos para la variante de células claras. Es por esto que las recomendaciones que se pueden realizar son en base a estudios retrospectivos, prospectivos fase II, metaanálisis y revisiones sistemáticas. En el futuro cobrará mayor relevancia la identificación de otros subtipos de CCR como los con déficit de fumarato hidratasa o succinato deshidrogenasa deficientes. (158)
Actualmente el régimen preferido es:
- Cabozantinib (SWOG 1500, II, A) (159)
Otras alternativas recomendadas son: sunitinib (ASPEN, II, A) (160), lenvatinib + everolimus (II, A), nivolumab (II, A) y pembrolizumab (KEYNOTE-427, II, A) (162).
Para el CCR sarcomatoide:
- Nivolumab + ipilimumab ha mostrado efectividad especial en esta variante (CheckMate 214, subgrupo sarcomatoide, I, A) (163).
Otros subtipos (medular, sin clasificar):
- Regímenes similares a papilar/cromófobo
- Participación en ensayos clínicos
CONSIDERACIONES ESPECIALES
Inmunoterapia subcutánea: Nivolumab + hialuronidasa-nvhy se aprobó como alternativa vía subcutánea a la formulación intravenosa, pero no debe usarse en combinación con ipilimumab (164).
COMENTARIOS FINALES
Las nuevas combinaciones inmuno-dirigidas han transformado el tratamiento del CCRm. La selección debe individualizarse según riesgo, tolerancia, comorbilidades, acceso y preferencias del paciente. Se espera que futuras estrategias, como combinaciones triples o el uso de biomarcadores predictivos, sigan refinando el manejo de esta patología.

Tabla 22: Recomendaciones tratamiento CCR metastásico: Guía EAU 2025.
Sigue siendo importante la categorización de los pacientes a tratar en grupos de riesgo, ya que la respuesta clínica en los diversos estudios puede ser distinta, dependiendo del pronóstico inicial del paciente.
BIBLIOGRAFIA
- https://ais.paho.org/classifications/chapters/pdf/volume1.pdf
- DEIS MINSAL https://informesdeis.minsal.cl/.
- EAU-Guidelines-on-Renal-Cell-Carcinoma-2025. Disponible en: https://d56bochluxqnz.cloudfront.net/documents/full-guideline/EAU-Guidelines-on-Renal-Cell-Carcinoma-2025_2025-04-17-105637_dkgm.pdf GLOBOCAN:https://gco.iarc.fr/today/en/dataviz/bars?types=0_1&mode=cancer&cancers=29&sort_by=value1&key=asr&populations=152&age_start=8&multiple_populations=0
- (XLV Congreso Chileno de Urología, MUERTE PREMATURA POR CÁNCER GENITOURINARIO EN CHILE. ESTIMACIÓN DE IMPACTO EN PRÓXIMA DÉCADA, Inzunza et all)
- Moch H., Humphrey PA., Ulbright TM., Reuter VE (Eds): WHO Classification of Tumors of The Urinary System and Male Genital Organs (4° Ed) LARC: Lyon 2016.
- Campbell – Walsh Urology 10th Edition 2012. Chapter 49 Malignant Renal Tumors Chapter 51 Benign Renal Tumors.
- Gansler et al., Prevalence of Cigarette Smoking among Patients with Different Histologic Types of Kidney Cancer, Cancer Epidemiol Biomarkers Prev. 2020 July ; 29(7): 1406–1412. doi:10.1158/1055-9965.EPI-20-0015).
- National Comprehensive Cancer Network. Clinical Practice Guidelines in Oncology (NCCN Guidelines). Kidney Cancer. Version 3.2022.
- Jakobsson RG, Nasic S, Bratt O, Johansson ME, Grenabo Bergdahl A. Family history and risk of renal cell carcinoma: anational multiregister case-control study. J Urol. 2024;211(1):71-79).
- https://auge.minsal.cl/problemasdesalud/index/83
- Subsecretaria de Redes Asistenciales, Instructivo de Proceso y Registro GES
- Hemamaili et all, The ISUP system of staging, grading and classification of renal cell neoplasia, Journal of Kidney Cancer and VHL 2014; 1(3):26-39
- Lara P., Jonasch N. Kidney Cancer Principles and Practice. Springer 2012. 70-75.
- Garnick M. Primary neoplasms of the kidney. In: Therapy in Nephrology and Hypertension: A Companion to Brenner and Rector’s the Kidney, Brady H., Wilcox C. (Eds), W. Saunders, Philadelphia 1998.
- David Y., Chen T., Uzzo R. Evaluation and Management of the Renal Mass. Med Clin N 2011. Am 95, 179 – 189.
- Sacco E. et al. Paraneoplastic syndromes in patients with urological malignancies. Urol Int 83, 1-11 (2009).
- Ding, G., et al. Is there an association between advanced stage of renal cell carcinoma and paraneoplastic syndrome? Med Princ Pract 2012; 21, 370-4.
- Kawai Y. et al. Preoperative erythrocyte sedimentation rate is an independent prognostic factor in Japanese patients with localized clear cell renal cell carcinoma. Urol Int 2009;83, 306-10.
- Sengupta S. et al. The preoperative erythrocyte sedimentation rate is an independent prognostic factor in renal cell carcinoma. Cancer 2006; 106, 304-12.
- Kim H., Han K., Zisman A., Figlin R., et al. Cachexia-like symptoms predict a worse prognosis in localized t1 renal cell carcinoma. J Urol 2004; 171, 1810-3.
- Blay J., Rossi J., Wijdenes J., et al. Role of interleukin-6 in the paraneoplastic inflammatory syndrome associated with renal-cell carcinoma. Int J Cancer 1997;72:424 –30
- Kim H., Belldegrun A., Freitas D., et al. Figlin.Paraneoplastic signs and symptoms of renal cell Carcinoma: implications for prognosis. J Urol 2003 Nov;170(5):1742-6
- Janik J. E., Sznol M., Urba W. Figlin R., et al. Erythropoietin production. A potential marker for interleukin-2/interferon-responsive tumors. Cancer, 72: 2656, 1993
- Weiss R., Lin P. Renal cell carcinoma: identification of novel targets for therapy. Kidney Int 2006; 69: 224–232
- Handler J. Renal cell carcinoma and hypertension. J Clin Hypertens (Greenwich) 2005;7: 249–251
- Kirkali Z., Esen A., Kirkali G., Guner G. Ferritin: a tumor marker expressed by renal cell carcinoma. Eur Urol 1995; 28:131–134.
- Loughlin K., Gittes R., Partridge D., Stelos P. The relationship of lactoferrin to the anemia of renal cell carcinoma. Cancer 1987; 59:566–571
- Motzer R., Bacik J., Murphy B., et al. Interferon alfa as a comparative treatmentfor clinical trials of new therapies against advanced renal cell carcinoma. J Oncol 2002; 20 (1):289-96
- Lane B., Demirjian S., Weight C., et al. Performance of the chronic Kidney disease-epidemiology study equations for estimating glomerular filtration rate before and after nephrectomy. J Urol 2010; 183(3):896-901.
- Cleo K., Stuart G., Ronilda L., Ramin K. Renal Masses Detected At Abdominal CT: Radiologists´Adherence to Guidelines Management Recommendations and Communucations of Critical Result. AJR 2014; 203:828-834
- Bazan F., Busto M. Radiología del carcinoma renal. Radiología 2013
- Zagoria R. Imaging of small renal masses: a medical success history. AJR Am J Roentgenol 2000;175(4):945-955.
- Chris Lunt y Frederieke Elsinger, Clasificación de Bosniak 2019, Masas renales Quísticas, BC Cancer Agency Vancouver, 2022.
- Kutikov A., Fossett L., Ramchandani P., Tomaszewski J., et al. Incidence of benigh pathologic findings at partial nephrectomy for solitary renal mass presumed to be renal cell carcinoma on preoperative imaging. BJU Int 2008; 68: 737.
- Mueller-Lisse, UG, et al. Imagenología del carcinoma renal avanzado. World J Urol, 2010. 28: 253.
- Hallscheidt, PJ, et al. Estadificación preoperatoria del carcinoma de células renales con trombo en la vena cava inferior mediante TC y RM multidetector: estudio prospectivo con correlación histopatológica. J Comput Assist Tomogr, 2005. 29: 64
- Putra, LG, et al. Mejora de la evaluación de lesiones renales en el embarazo mediante resonancia magnética. Urología, 2009. 74: 535
- Giannarini, G., et al. Potencial y limitaciones de la resonancia magnética ponderada por difusión en el cáncer de riñón, próstata y vejiga, incluyendo la estadificación de los ganglios linfáticos pélvicos: un análisis crítico de la literatura. Eur Urol, 2012. 61: 326
- Johnson, BA, et al. Rendimiento diagnóstico de las puntuaciones de probabilidad de células claras (ccLS) asignadas prospectivamente en masas renales pequeñas mediante resonancia magnética multiparamétrica. Urol Oncol, 2019. 37: 941.
- Steinberg, RL, et al. Rendimiento prospectivo de las puntuaciones de probabilidad de células claras (ccLS) en masas renales evaluadas mediante resonancia magnética multiparamétrica. Eur Radiol, 2021. 31: 314.
- Defortescu, G., et al. Rendimiento diagnóstico de la ecografía con contraste y la resonancia magnética para la evaluación de quistes renales complejos: Un estudio prospectivo. Int J Urol, 2017. 24: 184.
- Malaeb B., Martin D., et al. The utility of Screening renal ultrasonography: identifying renal cell carcinoma in an elderly asymptomatic population. BJU Int 2005;95:977-81.
- Jamis-Dow P., Leening S. Small (<3cm) renal masses: Detection with CT versus US and pathologic correlation. Radiology, 198: 785, 1996
- Heidenreich, A., et al. Imágenes preoperatorias en cáncer de células renales. World J Urol, 2004. 22: 307.
- Voss, J., et al. Tomografía computarizada de tórax para la estadificación de tumores renales: validación y simplificación de un modelo de predicción de riesgo a partir de una gran cohorte retrospectiva contemporánea. BJU Int, 2020. 125: 561
- Koga, S., et al. El valor diagnóstico de la gammagrafía ósea en pacientes con carcinoma de células renales. J Urol, 2001. 166: 2126
- Seaman, E., et al. Asociación entre la gammagrafía ósea con radionúclidos y la fosfatasa alcalina sérica en pacientes con carcinoma renal metastásico. Urología, 1996. 48: 692
- Lane B., Samplaski M., Herts B., et al. Renal mass biopsy–a renaissance? J Urol 2008; 179:20.
- Tomaszewski J., Uzzo R., Smaldone M.. Heterogeneity and renal mass biopsy: a review of its role and reliability. Cancer Biol Med 2014; 11:162.
- William L., Stephen M., Indications for and complications of renal biopsy, UpToDate 2015, Glassok J., Rovin H. (Ed). Disponible en www.uptodate.com
- Bratslavsky, G., et al. Evaluación del riesgo genético para el carcinoma hereditario de células renales: Declaración de consenso clínico. Cancer, 2021. 127: 3957
- Mucci, LA, et al. Riesgo familiar y heredabilidad del cáncer en gemelos en países nórdicos. JAMA, 2016. 315: 68
- Directrices RCC de 2025, EAU, 24-29.
- Guidelines on Renal Cell Carcinoma. European Association of Urology. Update 2018.
- Castillo O., et al. Nefrectomía radical laparoscópica, nuestra experiencia en 150 pacientes consecutivos. Rev Chil Cir. 2008 Vol 60. Nº4. Págs.297-302.
- Transl Androl Urol. Marzo de 2021; 10(3):1170–1178)
- Renal Cell Carcinoma: A Multi-Institutional Analysis. J Urol. 2018 May;199(5):1143-1148.
- Huang C., Levey A., Serio A., Snyder M., et al. Chronic kidney disease after nephrectomy in patients with renal cortical tumours: a retrospective cohort study. Lancet Oncol 2006; 7: 735.
- Nabi G., Cleves A., Shelley M. Surgical management of localised renal cell carcinoma. Cochrane Database of Systematic Reviews 2010, Issue 3. Art. No.: CD006579. DOI: 10.1002/14651858.CD006579.pub2
- Jared Schober; et all, Tiempo de isquemia durante la nefrectomía parcial: ¿podemos dejar de contar los minutos?, AUA news: 1 de junio de 2021.
- Simone, G. et al. Indications, techniques, outcomes, and limitations for minimally ischemic and off-clamp partial nephrectomy: A systematic review of the literature. Eur. Urol. 68(4), 632–640 (2015).
- Lee, J., Hwang, Y.C., Yoo, S. et al. Changes in kidney function according to ischemia type during partial nephrectomy for T1a kidney cancer. Sci Rep 12, 4223 (2022). https://doi.org/10.1038/s41598-022-07919-5
- Castillo O., Rodríguez-Carlin A., Vidal-Mora I., Schatloff O., et al. Nefrectomía Parcial Robótica: Resultados Perioperatorios en 95 casos consecutivos. Rev Chil Urol 2014; 79: 28
- Alves P., et all, Pre-operative imaging evaluation of renal cell carcinoma, June 2024, Revista da Associação Médica Brasileira 70(suppl 1) DOI:10.1590/1806-9282.2024s107
- Hew M., Baseskioglu B., Barwari K., De La Rosette C., et al. Critical Appraisal of the PADUA Classification And Assessment Of the R.E.N.A.L. Nephrometry Score in Patients Undergoing Partial Nephrectomy. J Urol 2011;186, 42‐46.
- Dindo D., Demartines N., Clavien P., Classification of surgical complications: a new proposal with evaluation in a cohort of 6.336 patients and results a survey. Ann Surg. 2004; 240: 205-13.
- Masson-Lecomte A., Bensalah K., Seringe E., et al. A prospective comparison of surgical and pathological outcomes obtained after robot-assisted or pure laparoscopic partial nephrectomy in moderate to complex renal tumours: results from a French multicentre collaborative study. BJU Int 2013 Feb; 111(2):256-63.
- Heldwein F., Casey T. Localized Renal Cell Carcinoma Management: An Update. 2008; 34 (6): 676-690.
- Blom J., Van Poppel H., Maréchal J., Jacqmin D., et al. EORTC Genitourinary Tract Cancer Group. Radical nephrectomy with and without lymph-node dissection: final results of European Organization for Research and Treatment of Cancer (EORTC) randomized phase 3 trial 30881. Eur Urol 2009 Jan; 55(1):28-34.
- Richi.J., et al. Definitive surgical management of renal cell carcinoma. 2014. Up to Date.
- American Urological Association (AUA) Guideline. Follow-up for Clinically Localized Renal Neoplasms. 2013
- Jeingfei T., Yi G. Prognostic Value of Clinical and Pathological Factors for Surgically Treated Localized Clear Cell Renal Cell Carcinoma. Chinese Medical Journal. 2014; 127 (9): 1640-1644.
- Sisul D., Liss M., Palazzi K., et al. RENAL nephrometry score is associated with complications after renal cryoablation: a multicenter analysis. Urology 2013 Apr;81(4):775-80.
- Desai M., Aron M., Gill I. Laparoscopic partial nephrectomy vs. Laparoscopic cryoablation for the small renal tumor. Urology 2005 Nov;66(5 Suppl):23-8.
- Ko Y., Park H., Moon du G., et al. A matched-cohort comparison of laparoscopic renal cryoablation using ultra-thin cryoprobes with open partial nephrectomy for the treatment of small renal cell carcinoma. Cancer Res Treat 2008 Dec;40(4):184-9.
- Klatte T., Mauermann J., Heinz-Peer G., et al. Perioperative, oncologic, and functional outcomes of laparoscopic renal cryoablation and open partial nephrectomy: a matched pair analysis. J Endourol 2011 Jun;25(6):991-7.
- Pieroraziop M., Allaf M. Quality of life on active surveillance for small renal masses vs. Immediate intervention: interim analysis of the DISSRM (delayed intervention and surveillance for small renal masses) registry. J Urol 2013;189(3S):e259
- Olweny E., Park S., Tan Y., et al. Radiofrequency ablation vs. Partial nephrectomy in patients with solitary clinical T1a renal cell carcinoma: comparable oncologic outcomes at a minimum of 5 years of follow-up. Eur Urol 2012 Jun;61(6):1156-61
- Takaki H., Yamakado K., Soga N., et al. Midterm results of radiofrequency ablation vs. Nephrectomy for T1a renal cell carcinoma. Jpn J Radiol 2010 Jul;28(6):460-8.
- American Urological Association (AUA) Guideline. Follow-up for Clinically Localized Renal Neoplasms. 2013
- Pantuck AJ, Zisman A, Dorey F, Chao DH, Han KR, Said J, et al. Renal cell carcinoma with retroperitoneal lymph nodes: role of lymph node dissection. J Urol. 2003;169(6):2076-83.
- Vasselli JR, Yang JC, Linehan WM, White DE, Rosenberg SA, Walther MM. Lack of retroperitoneal lymphadenopathy predicts survival of patients with metastatic renal cell carcinoma. J Urol. 2001;166(1):68-72.
- Bhindi B, Wallis CJD, Boorjian SA, Thompson RH, Farrell A, Kim SP, et al. The role of lymph node dissection in the management of renal cell carcinoma: a systematic review and meta-analysis. BJU Int. 2018;121(5):684-98.
- Luo X, Li JX, Liu YT, Zou G, Yao WX, Qing GQ, et al. Influence of lymph node dissection in patients undergoing radical nephrectomy for non-metastatic renal cell carcinoma: a systematic review and meta-analysis. Eur Rev Med Pharmacol Sci. 2019;23(14):6079-90.
- Gershman B, Thompson RH, Boorjian SA, Larcher A, Capitanio U, Montorsi F, et al. Radical Nephrectomy with or without Lymph Node Dissection for High Risk Nonmetastatic Renal Cell Carcinoma: A Multi-Institutional Analysis. J Urol. 2018;199(5):1143-8.
- Tabbara MM, González J, Martucci M, Ciancio G. Current Approaches in Surgical and Immunotherapy-Based Management of Renal Cell Carcinoma with Tumor Thrombus. Biomedicines. 2023;11(1):204
- Dason S, Mohebali J, Blute ML, Salari K. Surgical Management of Renal Cell Carcinoma with Inferior Vena Cava Tumor Thrombus. Urol Clin North Am. 2023;50(2):261-84.
- Reese AC, Whitson JM, Meng MV. Natural history of untreated renal cell carcinoma with venous tumor thrombus. Urol Oncol Semin Orig Investig. 2013;31(7):1305-9.
- Mota YS. Long-term survival after surgical management of renal cell carcinoma with venous tumor thrombus. J Educ Health Sport. 2020;10(12):246-55.
- Neves RJ, Zincke H. Surgical treatment of renal cancer with vena cava extension. Br J Urol.;59(5):390-5.
- Quencer KB, Friedman T, Sheth R, Oklu R. Tumor thrombus: incidence, imaging, prognosis and treatment. Cardiovasc Diagn Ther.;7(Suppl 3):S165-77.
- Williams CM, Myint ZW. The Role of Anticoagulation in Tumor Thrombus Associated with Renal Cell Carcinoma: A Literature Review. Cancers. 2023;15(22):5382.
- Gu L, Peng C, Li H, Jia T, Chen X, Wang H, et al. Neoadjuvant therapy in renal cell carcinoma with tumor thrombus: A systematic review and meta-analysis. Crit Rev Oncol Hematol. 196:104316.
- Garg H, Psutka SP, Hakimi AA, Kim HL, Mansour AM, Pruthi DK, et al. A Decade of Robotic-Assisted Radical Nephrectomy with Inferior Vena Cava Thrombectomy: A Systematic Review and Meta-Analysis of Perioperative Outcomes. J Urol. 2022;208(3):542-60.
- Almatari AL, Sathe A, Wideman L, Dewan CA, Vaughan JP, Bennie IC, et al. Renal cell carcinoma with tumor thrombus: A review of relevant anatomy and surgical techniques for the general urologist. Urol Oncol. 2023;41(4):153-65.
- Bilen MA, Jiang JF, Jansen CS, Brown JT, Harik LR, Sekhar A, et al. Neoadjuvant Cabozantinib in an Unresectable Locally Advanced Renal Cell Carcinoma Patient Leads to Downsizing of Tumor Enabling Surgical Resection: A Case Report. Front Oncol. 2020;10:622134.
- Wright B, Johnson BS, Vassar M, Saidian A, Rais-Bahrami S, Gunn AJ. Trans-arterial embolization of renal cell carcinoma: a systematic review and meta-analysis. Abdom Radiol N Y. 2022;47(6):2238-43.
- Correa RJM, Louie AV, Zaorsky NG, et al. The Emerging Role of Stereotactic Ablative Radiotherapy for Primary Renal Cell Carcinoma: A Systematic Review and Meta-Analysis. Eur Urol Focus. 2019;5(6):958-69.
- Siva S, Ali M, Correa RJM, et al. 5-year outcomes after stereotactic ablative body radiotherapy for primary renal cell carcinoma: an individual patient data meta-analysis from IROCK (the International Radiosurgery Consortium of the Kidney). Lancet Oncol. 2022;23(12):1508-16.
- Cheung P, Patel S, North SA, et al. Stereotactic Radiotherapy for Oligoprogression in Metastatic Renal Cell Cancer Patients Receiving Tyrosine Kinase Inhibitor Therapy: A Phase 2 Prospective Multicenter Study. Eur Urol. 2021;80(6):693-700.
- Hannan R, Christensen M, Hammers H, et al. Phase II Trial of Stereotactic Ablative Radiation for Oligoprogressive Metastatic Kidney Cancer. Eur Urol Oncol. 2022;5(2):216-24.
- Tang C, Msaouel P, Hara K, et al. Definitive radiotherapy in lieu of systemic therapy for oligometastatic renal cell carcinoma: a single-arm, single-centre, feasibility, phase 2 trial. Lancet Oncol. 2021;22(12):1732-1739.
- Masini C, Iotti C, De Giorgi U, et al. Nivolumab in Combination with Stereotactic Body Radiotherapy in Pretreated Patients with Metastatic Renal Cell Carcinoma. Results of the Phase II NIVES Study. Eur Urol. 2022;81(3):274-82.
- Motzer RJ, Tannir NM, McDermott DF, et al. Nivolumab plus Ipilimumab versus Sunitinib in Advanced Renal-Cell Carcinoma. N Engl J Med 2018;378(14):1277-1290.
- Siva S, Bressel M, Wood ST, et al. Stereotactic Radiotherapy and Short-course Pembrolizumab for Oligometastatic Renal Cell Carcinoma-The RAPPORT Trial. Eur Urol. 2022;81(4):364-72.
- Mejean A, Ravaud A, Thezenas S, et al. Sunitinib alone or after nephrectomy in metastatic renal cell carcinoma. N Engl J Med 2018 Aug 2;379(5):417-427.
- Update on immunotherapy for renal cancer. Canales R. Medwave.2021;21(5):e8202. DOI:10.5867/medwave.2021.05.8202 PMID: 34214067.
- Spencer WF, Linehan WM, Walther MM, et al. Immunotherapy with interleukin-2 and alpha-interferon in patients with metastatic renal cell cancer with in situ primary cancers: a pilot study. The Journal of urology. 1992;147(1):24-30]
- Lahn M, Fisch P, Kohler G, et al. Pro-inflammatory and T cell inhibitory cytokines are secreted at high levels in tumor cell cultures of human renal cell carcinoma. European urology. 1999;35(1):70-80
- Kawata N, Yagasaki H, Yuge H, et al. Histopathologic analysis of angiogenic factors in localized renal cell carcinoma: the influence of neoadjuvant treatment. Int J Urol. 2001;8(6):275-281
- Gatenby RA, Gawlinski ET, Tangen CM, Flanigan RC, Crawford ED. The possible role of postoperative azotemia in enhanced survival of patients with metastatic renal cancer after cytoreductive nephrectomy. Cancer research. 2002;62(18):5218-5222.
- Flanigan RC, Salmon SE, Blumenstein BA, et al. Nephrectomy followed by interferon alfa-2b compared with interferon alfa-2b alone for metastatic renal-cell cancer. The New England journal of medicine. 2001;345(23):1655-1659
- Mickisch GH, Garin A, van Poppel H, et al. Radical nephrectomy plus interferon-alfa-based immunotherapy compared with interferon alfa alone in metastatic renal-cell carcinoma: a randomised trial. Lancet. 2001;358(9286):966-970.
- Bex A, Mulders P, Jewett M, et al. Comparison of Immediate vs Deferred Cytoreductive Nephrectomy in Patients with Synchronous Metastatic Renal Cell Carcinoma Receiving Sunitinib: The SURTIME Randomized Clinical Trial. JAMA Oncol. 2018
- Mejean A, Ravaud A, Thezenas S, et al. Sunitinib Alone or after Nephrectomy in Metastatic Renal-Cell Carcinoma. The New England journal of medicine. 2018
- Kato R, Naito S, Numakura K, Hatakeyama S, Koguchi T, Kojima T, Kawasaki Y, Kandori S, Kawamura S, Arai Y, Ito A, Nishiyama H, Kojima Y, Ohyama C, Habuchi T, Tsuchiya N, Obara W. Significance of upfront cytoreductive nephrectomy stratified by IMDC risk for metastatic renal cell carcinoma in targeted therapy era – a multi-institutional retrospective study. Int J Clin Oncol. 2022 Mar;27(3):563-573
- Hakimi K, Saidian A, Panian J, Barata P, Berg S, Chang S, et al., Outcomes of deferred cytoreductive nephrectomy following primary immunotherapy in advanced renal cell carcinoma: a multicenter analysis. Journal of Urology, J Urol, 2023,
- Yildirim, Hilin et al., A Nationwide Real-world Evaluation of Upfront Cytoreductive Nephrectomy in Patients with Synchronous Metastatic Renal Cell Carcinoma in the Immunotherapy Era, European Urology Oncology, 2025,
- ClinicalTrials.gov: NCT04510597, Comparing the Outcome of Immunotherapy-Based Drug Combination Therapy With or Without Surgery to Remove the Kidney in Metastatic Kidney Cancer, the PROBE Trial (PROBE), 2024
- ClinicalTrials.gov: NCT03977571, Deferred Cytoreductive Nephrectomy in Synchronous Metastatic Renal Cell Carcinoma: The NORDIC-SUN-Trial (NORDIC-SUN), 2025
- Staehler M., Kruse J., Haseke N., et al. Metastasectomy significantly prolongs survival in patients with metastatic renal cancer. Eur Urol Suppl 2009;8:181.
- Powles T, Albiges L, Staehler M, et al. Updated European Association of Urology. Guidelines Recommendations for the Treatment of First-line Metastatic Clear Cell Renal Cancer. Eur Urol 2017.
- Motzer RJ, Tannir NM, McDermott DF et al, for the CheckMate 214 Investigators. Nivolumab plus ipilimumab versus sunitinib in advanced renal-cell carcinoma. N Engl J Med 2018; 378(14): 1277–1290. DOI: 10.1056/NEJMoa1712126
- Heng, D.Y., et al. External validation and comparison with other models of the International Metastatic Renal-Cell Carcinoma Database Consortium prognostic model: a population-based study. Lancet Oncol, 2013. 14: 141.
https://www.ncbi.nlm.nih.gov/pubmed/23312463 - Motzer RJ, Penkov K, Haanen J et al. Avelumab plus axitinib versus sunitinib for advanced renal-cell carcinoma. N Engl J Med 2019; 380(12):1103–1115.
- McDermott DF, Lee JL, Szczylik C, et al. Pembrolizumab monotherapy as first-line therapy in advanced clear cell renal cell carcinoma: Results from cohort A of KEYNOTE-427. J Clin Oncol 2018; 36S: ASCO #4500.
- Motzer RJ, Escudier B, McDermott DF, George S, et al. Nivolumab versus Everolimus in Advanced Renal-Cell Carcinoma. N Engl J Med. 2015;373(19):1803. Epub 2015 Sep 25.
- Motzer, R.J., et al. Randomized phase II trial of sunitinib on an intermittent versus continuous dosing schedule as first-line therapy for advanced renal cell carcinoma. J Clin Oncol, 2012. 30: 1371.
https://www.ncbi.nlm.nih.gov/pubmed/22430274 - Rodríguez CS, Larkin J, Patel P, et al. Overall survival results for durvalumab and savolitinib in metastatic papillary renal cancer. J Clin Oncol 38, 2020 (suppl 6; abstr 619): ASCO GU 2020 Abstract #:619
- Renal Mass and Localized Renal Cancer: AUA Guideline, Vol. 198, 520-529, September 2017
- Escudier, B., et al. Randomized, controlled, double-blind, cross-over trial assessing treatment preference for pazopanib versus sunitinib in patients with metastatic renal cell carcinoma: PISCES Study. J Clin Oncol, 2014. 32: 1412.
- Choueiri, T.K., et al. Cabozantinib Versus Sunitinib As Initial Targeted Therapy for Patients With Metastatic Renal Cell Carcinoma of Poor or Intermediate Risk: The Alliance A031203 CABOSUN Trial. J Clin Oncol, 2017. 35: 591.
https://www.ncbi.nlm.nih.gov/pubmed/28199818 - Brown, J.E., et al. Temporary treatment cessation versus continuation of first-line tyrosine kinase inhibitor in patients with advanced clear cell renal cell carcinoma (STAR): an open-label, non-inferiority, randomised, controlled, phase 2/3 trial. Lancet Oncol, 2023. 24: 213.
- George D, Jonasch E. Systemic therapy of advanced clear cell renal carcinoma. UpToDate, Jan 2020.
- Daniel S. Chen and Ira Mellman: Oncology Meets Immunology: The Cancer-Immunity Cycle. Immunity, 2013 Jul 25;39(1):1-10. doi: 10.1016/j.immuni.2013.07.012.
- Rini BI, Plimack ER, Stus V, Gafanov R, Hawkins R, et al. KEYNOTE-426 investigators. Pembrolizumab plus Axitinib versus Sunitinib for Advanced Renal-Cell Carcinoma. N Engl J Med. 2019 Mar 21;380(12):1116-1127. doi: 10.1056/NEJMoa1816714. Epub 2019 Feb 16
- Ko JJ, Xie W, Kroeger N, Lee JL, Rini B, Knox JJ, et al. The International Metastatic Renal Cell Carcinoma Database Consortium model as a prognostic tool in patients with metastatic renal cell carcinoma previously treated with first-line targeted therapy: a population-based study. Lancet Oncol. 2015 Mar;16(3):293-300.
- Motzer RJ, Rini BI, McDermott DF et al. Nivolumab plus ipilimumab versus sunitinib in first-line treatment for advanced renal cell carcinoma: extended follow-up of efficacy and safety results from a randomised, controlled, phase 3 trial. Lancet Oncol 2019; 20(10): 1370–1385.
- Choueiri et all, Supervivencia global con pembrolizumab adyuvante en el carcinoma de células renales, N Engl J Med 2024 ; 390 : 1359 – 1371, DOI: 10.1056/NEJMoa2312695
- Rini BI, Powles T, Atkins MB et al. Atezolizumab plus bevacizumab versus sunitinib in patients with previously untreated metastatic renal cell carcinoma (IMmotion151): a multicentre, open-label, phase 3, randomised controlled trial. Lancet 2019; 393(10189): 2404–2415
- Auvray M, Auclin E, Barthelemy P, Bono P, et al. Second-line targeted therapies after nivolumab-ipilimumab failure in metastatic renal cell carcinoma. Eur J Cancer 2019 Feb;108:33-40. doi: 10.1016/j.ejca.2018.11.031. Epub 2019 Jan 5.
- Rodríguez CS, Larkin J, Patel P, et al. Overall survival results for durvalumab and savolitinib in metastatic papillary renal cancer. J Clin Oncol 38, 2020 (suppl 6; abstr 619): ASCO GU 2020 Abstract #:619
- Renal Mass and Localized Renal Cancer: AUA Guideline, Vol. 198, 520-529, September 2017
- Rini BI, Dorff TB, Elson P, Rodriguez CS, Shepard D, Wood L, et al. Active surveillance in metastatic renal-cell carcinoma: a prospective, phase 2 trial. Lancet Oncol. 2016 Sep;17(9):1317–24. doi:10.1016/S1470-2045(16)30196-6.
- Rini BI, et al. Pembrolizumab plus axitinib versus sunitinib for advanced renal-cell carcinoma. N Engl J Med. 2019;380:1116–27.
- Motzer RJ, Porta C, Eto M, et al. Lenvatinib plus pembrolizumab versus sunitinib in first-line treatment of advanced renal cell carcinoma: Final prespecified overall survival analysis of CLEAR, a phase III study. J Clin Oncol. 2024;42:1222–8. Available at: https://www.ncbi.nlm.nih.gov/pubmed/38227898.
- Choueiri TK, et al. Nivolumab plus cabozantinib versus sunitinib for advanced renal-cell carcinoma. N Engl J Med. 2021;384:829–41.
- Motzer RJ, et al. Nivolumab plus ipilimumab versus sunitinib in advanced renal-cell carcinoma. N Engl J Med. 2018;378:1277–90.
- Choueiri TK, Halabi S, Sanford BL, et al. Cabozantinib versus sunitinib as initial targeted therapy for patients with metastatic renal cell carcinoma of poor or intermediate risk: The Alliance A031203 CABOSUN trial. J Clin Oncol. 2017;35:591–7. Available at: https://www.ncbi.nlm9er.nih.gov/pubmed/28199818.
- Motzer RJ, et al. Sunitinib versus interferon alfa in metastatic renal-cell carcinoma. N Engl J Med. 2007;356:115–24.
- Sternberg CN, et al. Pazopanib in locally advanced or metastatic renal cell carcinoma: results of a randomized phase III trial. J Clin Oncol. 2010;28:1061–8.
- Motzer RJ, et al. Tivozanib versus sorafenib as initial targeted therapy for metastatic renal cell carcinoma: results from a phase III trial. Lancet Oncol. 2020;21:95–104.
- Choueiri TK, et al. Cabozantinib versus everolimus in advanced renal-cell carcinoma. Lancet Oncol. 2016;17:917–27.
- Rini BI, et al. Tivozanib versus sorafenib in patients with advanced renal cell carcinoma (TIVO-3): a phase 3, multicentre, randomized, controlled, open-label study. Lancet Oncol. 2020;21:95–104.
- Motzer RJ, et al. Nivolumab versus everolimus in advanced renal-cell carcinoma. Lancet Oncol. 2015;16:147–56.
- Motzer RJ, et al. Nivolumab versus everolimus in advanced renal-cell carcinoma. N Engl J Med. 2015;373:1803–13.
- Rini BI, et al. Comparative effectiveness of axitinib versus sorafenib in metastatic renal cell carcinoma: results from a randomized phase III trial. J Clin Oncol. 2011;29:4573–80.
- Drobner J, Portal D, Runcie K, Yang Y, Singer EA. Systemic treatment for advanced and metastatic non-clear cell renal cell carcinoma: examining modern therapeutic strategies for a notoriously challenging malignancy. J Kidney Cancer VHL. 2023 Sep 26;10(3):37–60. doi:10.15586/jkcvhl.v10i3.295.
- Pal SK, et al. A comparison of sunitinib with cabozantinib, crizotinib, and savolitinib for treatment of advanced papillary renal cell carcinoma: a randomised, open-label, phase 2 trial. Lancet. 2021;397(10275):695–703. https://www.thelancet.com/action/showCitFormats?doi=10.1016%2FS0140-6736%2821%2900152-5
- Armstrong AJ, Halabi S, Eisen T, et al. Everolimus versus sunitinib for patients with metastatic non-clear cell renal cell carcinoma (ASPEN): a multicentre, open-label, randomised phase 2 trial. Lancet Oncol. 2016;17:378–88. https://www.ncbi.nlm.nih.gov/pubmed/26794930.
- McDermott DF, Lee JL, Ziobro M, et al. Open-label, single-arm, phase II study of pembrolizumab monotherapy as first-line therapy in patients with advanced non-clear cell renal cell carcinoma. J Clin Oncol. 2021;39:1029–39. https://www.ncbi.nlm.nih.gov/pubmed/33529058.
- Tannir NM, Signoretti S, Choueiri TK, et al. Efficacy and safety of nivolumab plus ipilimumab versus sunitinib in first-line treatment of patients with advanced sarcomatoid renal cell carcinoma. Clin Cancer Res. 2021;27(1):78–86. doi:10.1158/1078-0432.CCR-20-2063.
- FDA label: Opdualag SC (nivolumab-hyaluronidase).
- Beck SDW, et al. Outcomes and prognostic variables associated with aggressive surgical resection of renal cell carcinoma with vena caval involvement. J Urol. 2004;171:2186–90.

