INTRODUCCIÓN
La radioterapia en la última década ha logrado disminuir en forma importante las complicaciones de toxicidad de los tratamientos oncológicos en prácticamente todas las patologías. En uro-oncología, es fundamental para el tratamiento definitivo, adyuvante y metastásico de múltiples patologías. La disminución de la toxicidad aguda y tardía ha ocurrido de la mano de la expansión del uso de técnicas modernas de radioterapia como la radioterapia de intensidad modulada (IMRT), la radioterapia guiada por imágenes (IGRT) y la braquiterapia de alta tasa de dosis. Esto ha llevado a un aumento de su utilización en múltiples patologías como cáncer de próstata, cáncer de vejiga y en pacientes oligometastásicos.
Debido al crecimiento exponencial que ha presentado esta modalidad de tratamiento durante los últimos años, es importante evidenciar la gran cantidad de evidencia que se publica, mediante un capítulo que sea capaz de resumir de forma práctica y sencilla las principales técnicas e indicaciones de radioterapia en la patología Uro-oncológica.
IMÁGENES DE LA EVOLUCION DE LAS DIFERENTES TECNICAS DE RADIOTERAPIA EN LOS ULTIMOS AÑOS
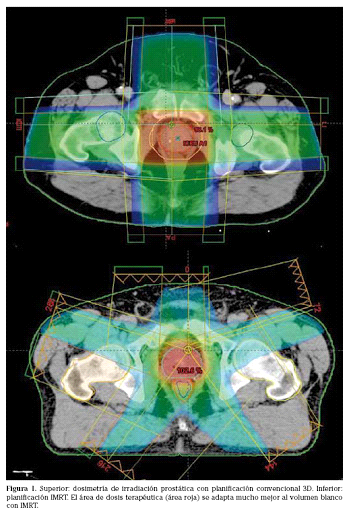
Fig. 1. Técnica de Radioterapia 3D. Se utilizan varios campos de tratamiento y las dosis en OARS son muchos más altas y por lo tanto con mayor riesgo de complicaciones. (Técnica en desuso). Al comparar con las figuras previas, la dosis en rojo sobre la próstata está menos conformada, o sea es un cuadrado en vez de presentar la morfología de la próstata, lo que hace que lleguen mayores dosis sobre los órganos de riesgo como el recto y la vejiga.
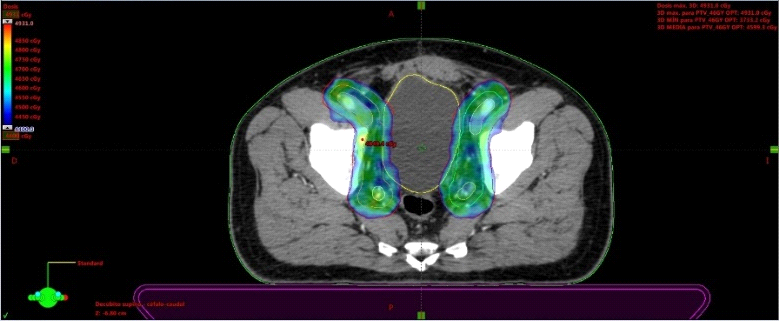
Fig. 2. Técnica de IMRT (Radioterapia de intensidad modulada). Se observa como la conformación de la dosis terapéutica protege de manera segura los órganos de riesgo (OARS). La zona de color, muestra la dosis de radiación terapéutica (46Gy) sobre las regiones ganglionares a nivel ilíaco interno, externo y obturatriz. Se evidencia así que las dosis llegan exclusivamente a la zona de interés, respetando la vejiga y el recto.
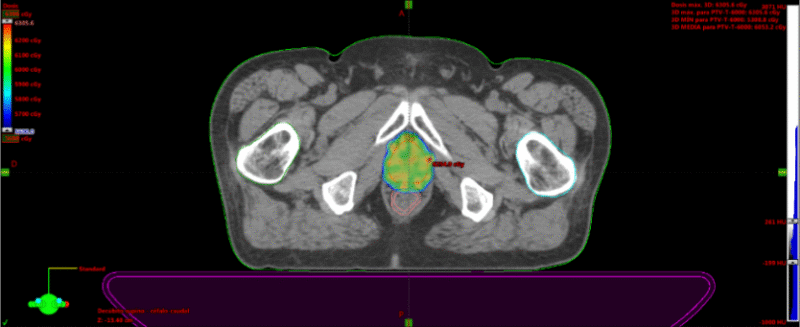
Fig. 2b. Técnica de IMRT (Radioterapia de intensidad modulada). La zona de color, muestra la dosis de radiación terapéutica (70Gy) sobre la próstata. Se evidencia que la dosis alta sólo llega sobre el target, respetando hacia posterior el recto.
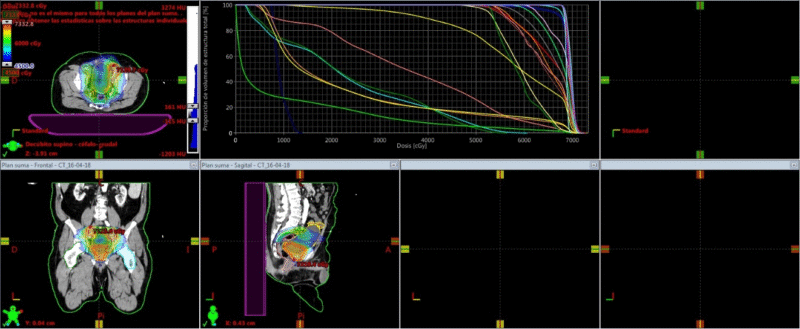
Fig. 2c. Técnica de IMRT (Radioterapia de intensidad modulada). Se observa en los colores las dosis de radiación sobre la pelvis (verde y azul, 46Gy) y sobre la próstata (naranjo, 70Gy). En el gráfico, las líneas de colores corresponden a los órganos de riesgo (OAR) y los target, en donde se mide la dosis de radiación, en un volumen determinado que llega al OAR, para así saber que está en rangos de buena tolerancia (ya predeterminados) y que las zonas target reciban al menos las dosis mínimas terapéuticas. Las dosis están en cGy (70Gy= 7000cGy).
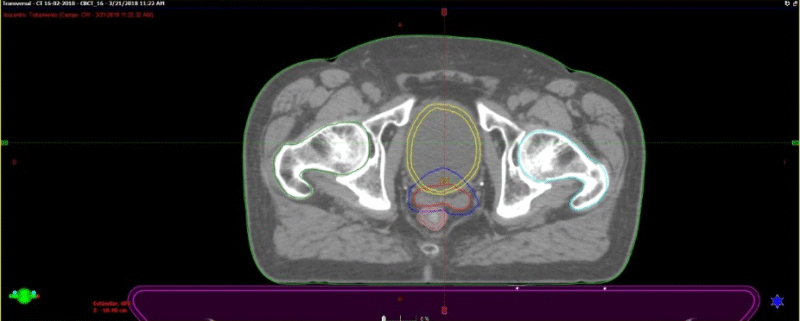
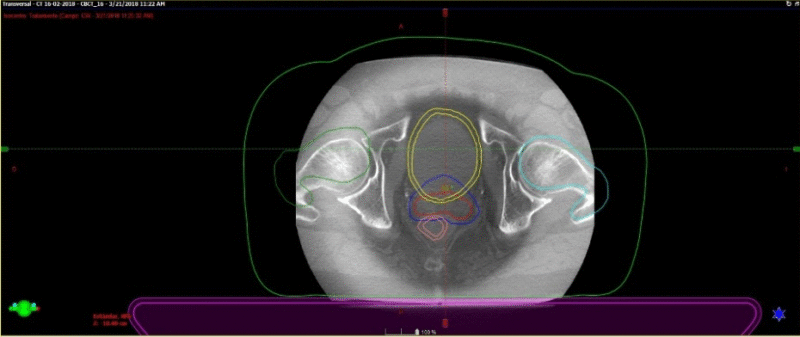
Fig. 3. Técnica de Radioterapia IGRT (Guiada por imágenes). Derecha: TAC de simulación con contornos: Rojo CTV: clinic target volume(próstata y vesículas seminales); Azul: PTV: patologic target volume); Amarillo: Vejiga (OAR); Rosado: Recto (OAR); Verde: Cadera derecha (OAR); Celeste: Cadera izquierda (OAR). Izquierda: Conbeam en máquina de tratamiento, en donde la imagen en el aceleradorse superpone con los contornos hecho en el TAC de simulación.
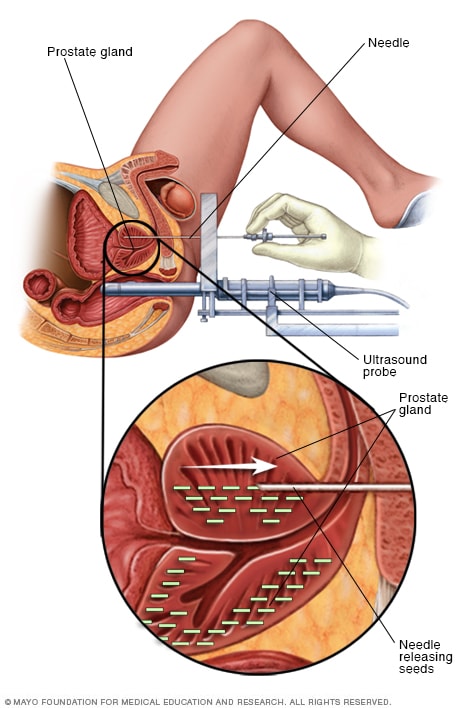
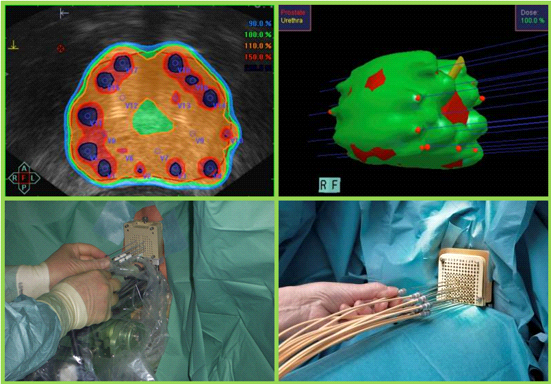
Fig. 4. Braquiterapia de Alta Tasa de Dosis. Se insertan agujas que se cargan posteriormente con iridio.(Imagen de Mayo Foundation)
CÁNCER DE PRÓSTATA
El cáncer prostático (CaP), es la tercera causa de muerte por cáncer en población masculina en Chile (detrás de estómago y pulmón) y su incidencia se estima entre 60-63 por cada 100.000 habitantes. La edad promedio de diagnóstico es a los 70 años, sin embargo, existe tasas de incidencia de alrededor de 10 x 100.000 habitantes entre paciente de 40-59 años. En estados Unidos, se estima que al año se diagnostican cerca de 268.490 nuevos casos y 34.500 muertes anuales, lo que corresponde al 19% del total de las patologías oncológicas en hombres.
Tanto las Guías Europeas (ESMO) como Americanas (NCCN), recomiendan realizarse el antígeno prostático específico (PSA), para pacientes mayores de 50 años y menores de 70-75 años (1). Esto debido a un estudio randomizado con más de 400.000 pacientes, que demostró que el screening con APE sólo pesquisa más cáncer de próstata, pero no tiene un efecto significativo en la mortalidad en hombres de 50-69 años a 10 años, si se compara con hombres que no se realizaron el examen (2)
Desde el punto de vista anatómico, el 50-80% de los cánceres prostáticos, se originan en el ápex (región inferior), el resto se distribuye en la zona media de la glándula. Según la última clasificación de la Sociedad internacional de Patología Urológica (ISUP) se clasifica en 5 tipos:
ISUP 1: Gleason Score ≤ 6 glándulas generalmente bien formadas y diferenciadas)
ISUP 2: Gleason Score 7 (3+4) glándulas con predominio bien formadas y escaso componente cribiforme o fusadas
ISUP 3: Gleason Score 7 (4+3) Glándulas con predominio de morfología cribiforme o fusadas y escasa glándulas bien formadas
ISUP 4: Gleason Score 8, 4+4=8, 3+5=8, 5+3=8 Glándulas exclusivamente cribiformes o fusadas o Glándulas bien diferenciadas con escasa pérdida del componente glandular
ISUP 5: Gleason Score 9 -10, pérdida completa del componente o con necrosis, con o sin glándulas
El tratamiento del cáncer de próstata con radioterapia cuenta con evidencia de Nivel-I en las guías internacionales (NCCN y ESMO), dejándola como una opción de tratamiento estándar en todo paciente diagnosticado con esta patología. Al momento de enfrentarnos a un paciente con esta patología, el tratamiento que le debemos ofrecer va a depender de la clasificación de riesgo que tenga al momento del diagnóstico (Tabla 1).
Riesgo/Hechos Clínico-Patológicos MANEJO SLE
PSA < 10 Gleason ≤ 6 ISUP 1 biopsia con menos de 3 cores positivos, ≤ 50% de cáncer en cada core T1c |
Expectativa de vida ≥ 20 años:
Expectativa de Vida 10-20 años:
Expectativa de vida ≤ 10 años:
No requiere estudio de diseminación |
85-95% |
PSA < 10 Gleason ≤ 6 (ISUP 1) biopsia con 3 o más cores positivos, ≥ 50% de cáncer en cada core T1-T2a |
Expectativa de vida ≥ 10 años
No requiere estudio de diseminación |
85-95% |
PSA10-20 Gleason 7 3+4 ISUP 2 Biopsia < 50% cores positivos. T2b-T2c |
Expectativa de vida ≥ 10 años
Expectativa de vida ≤ 10 años
Estudio óseo no recomendable de inicio TAC AP sólo si probabilidad de N en normogramas es ≥ 10% |
80-85% |
PSA: 10-20 Gleason 7 4+3 ISUP 3 T2c |
Expectativa de vida ≥ 10 años:
Expectativa de vida ≤ 10 años
Estudio óseo recomendado si es T2 y PSA >10 TAC AP sólo si probabilidad de N en normogramas es ≥ 10% |
70-75% |
PSA > 20 Gleason 8 (4+4), (5+3) o (3+5) ISUP 4 T3a |
Expectativa de vida ≥ 5 años:
Expectativa de vida ≤ 5 años:
Estudio óseo recomendado TAC AP sólo si probabilidad de N en normogramas es ≥ 10% |
60-70% |
PSA > 20 Gleason 9-10 (5+4, 4+5, 5+5) ISUP 5 T3b-4 |
Expectativa de vida ≥ 5 años:
Expectativa de vida ≤ 5 años:
Estudio óseo recomendado TAC AP sólo si probabilidad de N en normogramas es ≥ 10% |
50-60% |
SLE: Sobrevida Libre de enfermedad; RTE: Radioterapia Externa: VA: Vigilancia Activa;
PR: Prostatectomía radical, BA: Bloqueo Androgénico (2)
Tabla 1. Manejo del cáncer de próstata en relación al riesgo clínico
De hecho, la radioterapia es tan importante que el estudio PROTEC, en pacientes con CaP de bajo riesgo, demostró que la mortalidad específica por cáncer de próstata fue baja, independiente de la rama de control (Monitoreo, Radioterapia o Prostatectomía radical). No hubo diferencias significativas en mortalidad, sólo hubo mayor progresión de enfermedad y metástasis a distancia en el grupo de Vigilancia Activa. (3) por lo que en pacientes seleccionados el rol del médico radioterapeuta o urólogo es fundamental para entregar la mejor herramienta terapéutica al paciente e intentar optar por la vigilancia activa.
Prostatectomía radical
La cirugía se puede realizar por distintas vías, la vía transperineal y retropúbica, esta última es el que ha sido usado con más popularidad, así como también el enfrentamiento laparoscópico y cirugía robótica. Todas estas se asocian o no a la linfadenectomía pelviana. Es importante considerar los mejores resultados se asocian a que lo centros concentran mayor número de especialistas y mayor volumen de pacientes, siendo el escenario ideal, el paciente con cáncer de próstata localizado. Algunos trabajos como el Escandinavo SPCG-4 luego de 20 años de seguimiento, logró evidenciar que los pacientes sometidos a Prostatectomía radical presentaron reducción en la frecuencia de muertes por cualquier causa, de próstata y el riesgo de desarrollar metástasis, principalmente en pacientes menores de 65 años y hasta riesgo intermedio favorable. (4)
En términos generales, los pacientes con Gleason 7 (3+4) claramente tienen mejor pronóstico que los Gleason 7 (4+3), con sobrevida libre de recurrencia bioquímica de 48% v/s 38%, recurrencia sistémica de 8% v/s 15% respectivamente, mostrando a su vez una mayor sobrevida específica por cáncer con cifras de 97% v/s 93%. (5)
Siempre al momento de enfrentarse a un paciente categorizado como N0, se debe tener como consideración que existe un porcentaje que puede estar subetapificado. Así lo demostró Pagliarulo, en su publicación (JCO 2006), donde encontró un 13% de metástasis ganglionares ocultas en pacientes categorizados como N0. (6)
En el contexto de neoadyuvancia en cirugía, existen múltiples nuevos estudios que compararon, neoadyuvancia con bloqueo androgénico más PR v/s PR sola. Demostrando una disminución en los márgenes (+) post quirúrgicos y una disminución del volumen tumoral, pero no demostrando cambios en la sobrevida libre de progresión bioquímica.
En el contexto de comparación con radioterapia, no existe ninguna evidencia en donde la Prostatectomía radical sea más efectiva que la Radioterapia para el tratamiento del cáncer de próstata, ya sea con o sin utilización de bloqueo androgénico.(3). Existe un metaanálisis publicado por Wallis el año 2016, el cual ha sido ampliamente criticado, debido a fallas en el diseño del estudio y las poblaciones comparadas en este. (7)
Debe recordarse que, por cada 10 pacientes operados, sólo 1 no necesitará radioterapia externa.
Radioterapia Externa
Al evaluar la radioterapia externa en el contexto de un cáncer de próstata, hay que tener en consideración, que en la actualidad existen múltiples técnicas y fraccionamientos que han demostrar ser efectivos en estos pacientes actualmente para la radioterapia prostática, siempre teniendo en cuenta que las dosis van a variar dependiendo de si nos encontramos en el contexto de un tratamiento primario o definitivo vs el contexto de un paciente ya operado, donde hay que irradiar el lecho.
Radioterapia en Paciente no Operado
La radioterapia en el contexto de un tratamiento definitivo ha demostrado ser útil en pacientes de riesgo bajo, intermedio y alto, con ciertas diferencias de tratamiento en cada una de ellas. El esquema convencional, entrega dosis de 74-78Gy a 1,8-2Gy por fracción sobre a próstata y vesículas seminales. (8-9) y a linfonodos pélvicos entrega dosis de entre los 45-50Gy. En caso de confirmar compromiso ganglionar evidente, se puede escalar hasta 60-66Gy con IMRT sobre las adenopatías comprometidas.
Durante los últimos años ha cobrado relevancia el tanto el hipofraccionamiento moderado con IMRT (tratamientos entre 20-25 fracciones) como el hipofraccionamiento extremo (tratamientos entre 5 a 7 fracciones) mediante técnica SBRT (Stereotactic Body Radiation Therapy), lo que ha permitido disminuir de manera segura los tiempos de tratamiento, logrando administrar dosis entre 6.5 -10 Gy por fracción en no más de 5 a 7 sesiones.
En términos generales, la SBRT prostática, es una excelente herramienta de tratamiento en centros especializados, logrando gran efectividad en términos de control tumoral y preservación de tejidos sanos (10). La dosis más común en el tratamiento con SBRT es de 36.25 Gy en 5 fx sobre próstata y vesículas seminales, con una dosis de 25 Gy en 5 fx sobre linfonodos pélvicos en caso de que se requiera irradiar la región pélvica. Dentro de las principales preocupaciones al realizar un tratamiento de este tipo, es la toxicidad. Esto fue desmentido en el estudio PACE-B (Lancet Oncol 2022) que demostró que en centros capacitados, la SBRT tiene una toxicidad comparable a esquemas de radioterapia moderadamente hipofraccionada, con excelentes tasas de control bioquímico.
En la publicación del RTOG 9413, que evaluó irradiación pélvica y que comparó la radioterapia sobre pelvis completa v/s radioterapia sobre mini-pelvis v/s radioterapia sobre solo campos prostáticos. La Radioterapia de pelvis completa mejoró la sobrevida libre de progresión en 40% v/s mini-pelvis 35% v/s campos prostáticos con 27%. (11). Es por esto que la recomendación actual de irradiar la región pélvica, dependerá del grupo oncológico, aunque en general se recomienda en todo paciente con riesgo ≥ 15% de tener compromiso linfonodal, en todo paciente operado con ganglios (+) y pacientes de alto y muy alto riesgo con expectativas de vida ≥ 5 años.
Bloqueo Androgénico en Pacientes con Tratamiento Definitivo
El uso de bloqueo androgénico en pacientes de riesgo intermedio se encuentra indicado durante 3 a 6 meses, debido a que múltiples estudios han demostrado beneficio en sobrevida libre de progresión 10-25% y de un 5% en sobrevida específica por cáncer.
El uso de bloqueo androgénico durante 18 a 36 meses, en pacientes de alto riesgo, años, también ha demostrado beneficio en sobrevida libre de progresión y sobrevida global, incluso a compararlo con bloqueo acortado por un periodo de 6 meses. El standard actualmente en la mayoría de los pacientes de alto riesgo es 2-3 años, sin embargo, se puede usar 1.5 años en pacientes con muchas comorbilidades. (12-15)
Paciente operado
Por lo general, la radioterapia post-operatoria, se encuentra indicada en pacientes pT3b +/- márgenes (+), en pacientes con cáncer de próstata Gleason 8 o mayor y en pacientes con compromiso ganglionar linfático. El grupo de pacientes pT3a y/o pacientes con márgenes (+), son un grupo especial, ya que si el APE post operatorio queda indetectable (< 0.05) se podría esperar el inicio de la radioterapia hasta que el antígeno sea > 0.2. En el resto de los pacientes, se indica la radioterapia entre 3-6 meses después de la cirugía para evitar complicaciones como la estenosis. (11).
Dentro de este contexto el fraccionamiento más utilizado es el fraccionamiento convencional con dosis de 60 a 70 Gy, con dosis de 1,8 a 2 Gy por fracción. Aunque en los últimos años han ido ganando terreno los fraccionamientos hipofraccionados moderados y extremos, ya que al comparar las toxicidades aguas y crónicas en los distintos esquemas de radioterapia, vemos que no hay diferencias significativas, sin embargo, en los grupos con dosis ≥ 3 Gy, existe mayor porcentaje de toxicidad aguda (3-4 meses) y luego las curvas se tienden a igualar, sin diferencias significativas de toxicidad a largo plazo (Figura 5). (16,17), por lo que se acepta que estos esquemas de tratamiento tienen la misma progresión libre de enfermedad que fraccionamiento convencional, aunque con un leve mayor riesgo de toxicidad (18,19).
En el grupo del hipofraccionamiento, encontramos el hipofraccionamiento extremo mediante técnica SBRT, en el cual se administran dosis de 30 a 34 Gy en 5 fx sobre el lecho prostático, con dosis 25 Gy sobre la región pélvica en caso de que se encuentre indicado.
Un tema que se discute en el tratamiento de los pacientes post operados es la escalación de dosis debido que múltiples estudios evidencian que un aumento progresivo de la dosis sobre el lecho operatorio ha mostrado un aumento entre 10 a 20% en sobrevida libre de progresión, pero no beneficio en sobrevida (10,16,20).
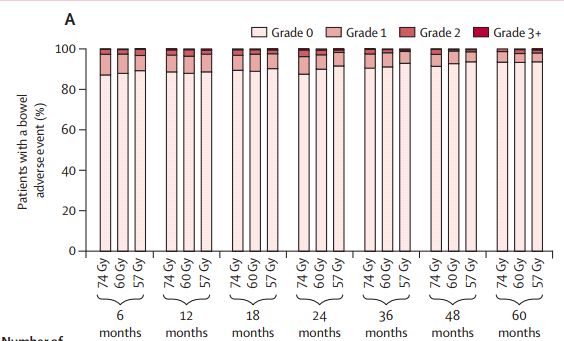
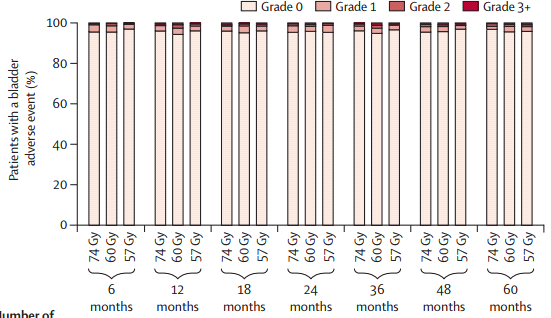
Fig. 5. Toxicidad en distintos esquemas de radioterapia
Radioterapia de salvataje
Por lo general, la recurrencia bioquímica, ocurre entre un 15-50% de los pacientes operados. Los hombres con APE en ascenso luego de Prostatectomía radical tienen un 60% más riesgo de desarrollar metástasis a distancia y un 20% de mortalidad por cáncer de próstata a 10 años si no reciben tratamiento. El tiempo de aparición de metástasis con aumento del APE es a los 8 años, pero sólo en 3 años para los Gleason mayor a 7 y APE que se dobla antes de 3 meses.
En por esto, que en pacientes con recurrencia bioquímica, la radioterapia de salvataje se encuentra indicada, ya que ha demostrado mejorar la sobrevida libre de progresión y la mortalidad por cáncer de próstata (21).
SBRT como tratamiento de rescate en recidiva local tras radioterapia previa
En el caso de pacientes con recaída local tras radioterapia previa, SBRT ha emergido como una opción de reirradiación focal con intención curativa. La revisión sistemática y metaanálisis MASTER (Valle et al., Eur Urol 2021) muestra que SBRT ofrece una sobrevida libre de recaída a 5 años de aproximadamente 60%, con menor toxicidad gastrourinaria (GU) severa comparado con prostatectomía radical de rescate.
Datos recientes de series prospectivas y estudios multicéntricos como los de Boldrini et al. (Radiat Oncol 2023) y Ekanger et al. (JCO 2024) respaldan el uso de SBRT guiado por MRI, destacando su factibilidad y baja toxicidad aguda y tardía.
El análisis de Schröder et al. (Clin Transl Radiat Oncol 2024) reportó toxicidad GU ≥ G2 en 25% y gastrointestinal (GI) ≥ G2 en solo 5% de los casos, con una sobrevida libre de recaída bioquímica a 2 años de 72%. La selección adecuada de pacientes es clave, considerando tiempo desde la irradiación inicial, valores de PSA, volumen tumoral, y uso de imágenes funcionales como PET-PSMA.
Quimioterapia con radioterapia
Los estudios randomizados en pacientes de alto riesgo, como el STAMPEDE o Lancet 2016, muestran que el agregar docetaxel mejoró la sobrevida libre de progresión tanto en pacientes no metastásicos como metastásicos (HR 0.6), sin embargo, hubo mayor incremento en la toxicidad. (52% v/s 38%). (15)
El RTGO 0521 (Sandler, ASCO 2015) en pacientes de alto riesgo, RTE con BA comparado con la rama que se agregó docetaxel x 6 ciclos + prednisona, aumentó en un 6% la enfermedad libre de progresión. (22)
Rol del Bloqueo androgénico con Radioterapia Adyuvante
En el RTOG 9601 (Shipley, NEJM 2017) en pacientes operados pT3N0 ó pT2N0 con márgenes (+), al comparar con la RTE y el uso de BA (Bicalutamida) x 2 años. El uso de BA aumentó en un 5% la sobrevida global (76% v/s 71%) y la mortalidad por cáncer de próstata (6% v/s 13%). El beneficio en sobrevida global favorecida al Gleason 7. (23)
BQT/LDR (baja tasa de dosis)
RTOG 0232 (Prestidge, ASTRO 2016): al comparar pacientes de bajo riesgo hasta intermedio favorable (T1c-T2b, G: 6-7, APE < 20 tratados con BQT/LDR v/s RET, sin diferencias en SLP, sólo mayor toxicidad en RTE tanto Genitourinaria (GU) (7/ v/s 3%) y gastrointestinal (GI) (3% v/s 2%) (24)
En un tratamiento de RT, hay regiones que reciben una dosis más alta. A eso se le llama sobreimpresión o “Boost”. ASCENDE-RT (Morris, ASCO 2015): pacientes de riesgo intermedio y alto riesgo que se randomizaron a RTE de pelvis 46Gy + boost hasta 78Gy (+ BA x 1 año v/s RTE a pelvis 46Gy y boost con BQT/LDR I-125 hasta 115Gy). El boost con iridio mejoró la sobrevida libre de recurrencia en un 15%, pero también existió un leve aumento de toxicidad GU y GI (25).
BQT/HDR (alta tasa de dosis)
Yoshioka (IJROBP 2016): Tratamiento como monoterapia en pacientes de riesgo intermedio 42%, alto riesgo 58% y un 73% con BA. Se aplicaron dosis de 48Gy/8Fx, 54Gy/9F o 45.5Gy/7Fx. A 8 años de seguimiento la SLP fue de 91% en riesgo intermedio y de 77% para riesgo alto. Toxicidades de 1-3%. (26)
Hauswald (IJROBP) 2016): se compararon pacientes de bajo riesgo 64% y riesgo intermedio 36%. Solo el 9% recibió BA. Dosis entre 42G-43.5Gy /7-7.25Fx en 1 semana. A 6 años de seguimiento la SLP para bajo riesgo fue de 99% y 95% para riesgo intermedio. Toxicidades menores al 4% (27)
Seguimiento
Los pacientes con cáncer prostático, el pilar fundamental es el APE. Depende de cada centro los criterios y tiempo de control, nosotros recomendamos repetir el APE cada 3-4 meses luego de finalizado los tratamientos.
Criterios De Phoenix se definen como falla en el APE luego de radioterapia externa con o sin Bloqueo androgénico, y se define como un aumento ≥ 2ng/ml sobre el nadir del APE, definido como el valor menor que se logró. Este criterio de falla bioquímica es el mejor predictor temprano de mortalidad total, mortalidad especifica por cáncer y desarrollo de metástasis a distancia. (28)
El nadir del APE se logra idealmente:
Prostatectomía radical < 3 semanas
Radioterapia Externa < 2-3 años
Braquiterapia < 3-5 años
El uso de PET/PSMA en el seguimiento del cáncer prostático se recomienda cuando los valores de APE ≥ 0.5, o bien en dudas frente a otras herramientas diagnósticas como el TAC TAP y cintigrama ósea. Sin embargo, este criterio difiere mucho en cada centro de cuando es el momento de solicitarlo.
Pasquier (IJROBP, 2019 GETUG study), presentó casos de falla local uni o bilateral en próstata, luego de radioterapia externa, nunca operados, donde realizó SBRT con dosis de 36Gy/6Fx en promedio, a corto seguimiento de 29 meses. Hubo control local sin falla bioquímica, estadísticamente significativa con toxicidad aceptable. (29)
CÁNCER DE VEJIGA
Actualmente, la cirugía es el tratamiento estándar en cáncer de vejiga para control loco regional de la enfermedad. Sin embargo, la cistectomía radical se puede asociar a disminución en calidad de vida de los pacientes. En este sentido, el tratamiento con radioterapia (RT) juega un importante rol en términos de mejor calidad de vida con preservación de órgano y de su función. La RT actualmente representa una alternativa terapéutica a la cirugía en pacientes seleccionados, así como también opción de tratamiento ya sea curativo o paliativo en pacientes no candidatos a cirugía. La técnica de RT externa puede ser 3D, IMRT/VMAT e idealmente imagen -guiada (IGRT).
Enfermedad no músculo invasora
No hay evidencia que demuestre que la radioterapia ofrezca mayor probabilidad de preservación de vejiga que otros tratamientos, pero podría considerarse una opción en pacientes seleccionados T1.
El estudio de Weiss (30) incluyó 141 pacientes con cáncer vesical T1 primario o recurrente, de alto riesgo (G3, múltiples recurrencias a tratamiento intravesical, carcinoma in situ asociado, lesiones multifocales, >5 cm diámetro) quienes fueron tratados con RT (28 pacientes) o radioquimioterapia (RTQT) (113 pacientes). Se realizó RT 4-6 semanas luego de resección transuretral del tumor vesical (TURBT). Los pacientes recibieron RT 3D con mediana de dosis de 50.4 Gy sobre linfáticos pélvicos, seguido de sobreimpresión a vejiga hasta mediana de dosis de 55.8 Gy, con QT concurrente semana 1 y 5 con cisplatino + 5FU. Luego de 6 semanas del tratamiento se reevaluó con TURBT.
A las 6 semanas, la respuesta completa fue de 88%. La falla global fue 49% a 5 años y 64% a 10 años. La tasa de progresión a 5 años fue de 19% y sobrevida cáncer específica a 5 años fue 82%. La preservación de vejiga se logró en 80% de los pacientes. Se reportó toxicidad aguda G3-4: 23% diarrea, 4% náuseas / vómitos, 20% leucopenia.
El estudio RTOG 0926 (31) es un estudio fase 2 de una rama que evaluó tratamiento trimodal (TMT) (TURBT máxima seguido de RTQT) en paciente con cáncer vesical T1 de alto grado con falla a terapia intravesical inicial o que fueran considerados inelegibles para tratamiento con BCG.
El tratamiento con radioterapia consistió en una dosis de 41.1 Gy en 23 fracciones a vejiga (más uretra prostática en hombres) y linfonodos obturadores e iliacos internos y externos, seguido de sobreimpresión secuencial a vejiga de 19.8 Gy en 11 fracciones, llegando a un total de 61.2 Gy en 34 fracciones diarias, con técnica 3D. De manera concomitante, los pacientes recibieron quimioterapia (cisplatino, mitomicina, 5 -FU de acuerdo a la elección del tratante).
Se analizaron 34 pacientes con una mediana de edad 74 años. Todos los pacientes recibieron BCG, y 94.1% tenían tumores G3. La mediana de seguimiento fue 5.1 años. Dentro de los primeros 3 años, 4 pacientes fueron sometidos a cistectomía radical. La tasa de sobrevida libre de cistectomía fue de 88.2%. De aquellos que fueron a cirugía, ninguno tenía enfermedad músculo invasora.
La sobrevida global (SG) a 3 años fue 69.5% y 56.4% a 5 años. La incidencia de metástasis a distancia fue de 12.2% a 3 años y 18.7% a 5 años. Ocho pacientes murieron por la enfermedad.
A 3 años, 12 pacientes tuvieron recurrencia local, resultando en una incidencia acumulada a 3 años de 32.4%. La sobrevida libre de recurrencia a 2 años fue 55.9% y a 5 años 32.4%. A 1 año, en la reevaluación 23 pacientes no tenían evidencia de enfermedad, 2 pacientes tenían carcinoma in situ y en 6 pacientes no se evaluó la enfermedad. 18 pacientes tuvieron toxicidad G3-4: 17 pacientes G3 y 1 paciente G4. No hubo muertes relacionadas al tratamiento. Las toxicidades más frecuentes fueron anemia, linfopenia, alteraciones de electrolitos, hematuria.
En este escenario, el tratamiento trimodal presenta una opción atractiva en comparación con la cistectomía inmediata de rescate, especialmente en pacientes de edad avanzada o con complicaciones médicas. Sin embargo, debe compararse con otras estrategias de tratamiento emergentes.
Enfermedad músculo invasora
La preservación de vejiga con tratamiento trimodal (TURBT máxima seguido de RTQT) es el tratamiento de elección en pacientes seleccionados: tumor de vejiga unifocal, tumor menor a 5 cm, sin hidroureteronefrosis, buena función vesical, TURBT visiblemente completa. No hay publicados estudios randomizados que comparen cistectomía radical con tratamiento conservador trimodal (32).
El BC 2001 (33) es un estudio fase 3 randomizado en pacientes con cáncer de vejiga (adenocarcinoma, transicional o escamoso) etapa T2 – T4a, N0, M0 que comparó tratamiento con RT sola versus RTQT con 5FU y MMC. Además, se randomizó el campo de tratamiento, RT a vejiga versus RT dosis alta a un volumen reducido de vejiga. Se prescribió una dosis de 55 Gy en 20 fracciones o 64 Gy en 32 fracciones.
Un 55% de los pacientes tuvieron resección completa con TURBT. A 2 años, la sobrevida libre de enfermedad loco-regional fue mejor con RTQT (67% vs 54%, p=0.03). En grupo RTQT hubo mayor toxicidad gastrointestinal G3-5 de acuerdo a escala NCI CTCAE 9.6% RTQT vs 2.7% RT (p=0.007), pero no se observó diferencia según RTGO y LENT/SOMA.
A largo plazo (34), con una mediana de seguimiento de 9.9 años, se mantuvo el beneficio del RTQT por sobre RT. A 5 años, la sobrevida libre de recurrencia fue 63% en grupo RTQT versus 49% en grupo RT sola (HR 0.61, IC 95% 0.43-0.86; p = 0.004). También hubo beneficio en control invasor locorregional (HR 0.55, IC 95% 0.36 – 0.84, p = 0.006).
RTQT también se asoció a reducción en cistectomías. A 5 años, la tasa de cistectomía fue 14% con RTQT y 22% con RT (p=0.034). La mayoría de las cistectomías fueron por recurrencia de enfermedad (81%), mientras que 9.4% fueron por efectos tardíos de RT.
La sobrevida global a 5 años fue 49% en el grupo RTQT y 37% en grupo RT sola, y a 10 años 30% y 26%, respectivamente (HR 0.88, IC 95% 0.69 – 1.13; p=0.03). Hubo una significancia límite en sobrevida cáncer específica luego de ajustar por factores pronósticos, con un HR 0.73 (95% IC 0.54 – 0.99, p = 0.043)
No hubo diferencias en control locorregional de acuerdo al volumen de radioterapia, pero no se pudo establecer que volumen reducido de dosis alta fuera no inferior.
No hubo diferencias de toxicidad tardía ni LENT/SOMA ni RTOG. La incidencia acumulada de toxicidad RTOG G3/4 fue 9.2% en grupo RTQT y 17% RT sola.
En una revisión sistemática (35) de estudios retrospectivos y prospectivos de TMT y cistectomía radical, se observó una sobrevida global a 5 años de 52% con cistectomía radical y 57% con terapia trimodal (p = 0.04), analizando el grupo completo, más pacientes sobrevivieron a 5 años con TMT versus cistectomía radical (HR 1.22; IC 95% 1.13 – 1.32), con un beneficio absoluto de 5%. En la comparación de TMT versus cistectomía radical sola (sin QT), la sobrevida a 5 años fue mejor con TMT que con cirugía: 57% versus 51% (p=0.002); pero no hubo diferencia estadísticamente significativa con la sobrevida observada de 53% en aquellos que recibieron cistectomía más QT (p = 0.38). En el análisis multivariado de sobrevida global, se confirmó TMT como variable pronóstica tanto en grupo de cistectomía sola como en cistectomía más quimioterapia (p=0.03)
Más recientemente, se publicó un análisis retrospectivo (36) que incluyó pacientes con carcinoma urotelial de vejiga localizado cT2-T4N0M0 que habrían sido elegibles tanto para cistectomía radical como para tratamiento trimodal, tratados entre 2005 y 2017. Los pacientes incluidos tenían tumores únicos, menores de 7 cm, sin hidroureteronefrosis (HUN) o HUN solamente unilateral, función renal adecuada y sin carcinoma in situ extenso o multifocal. Aquellos pacientes con carcinoma in situ limitado al sitio adyacente al tumor primario, pacientes con HUN unilateral y pacientes con alto riesgo de morbimortalidad por cistectomía radical no fueron excluidos de la consideración de terapia trimodal. Todos los pacientes recibieron quimioterapia sensibilizante.
440 pacientes fueron tratados con cistectomía radical y 282 con TMT. La mediana de seguimiento fue 4.38 años para el grupo de cirugía y 4.88 años en TMT.
A 5 años, no hubo diferencias significativas entre las dos modalidades de tratamiento para sobrevida libre de metástasis, sobrevida libre de falla a distancia y sobrevida libre de falla regional: La sobrevida libre de metástasis fue de 74% en grupo de cirugía y 75% en TMT.
La sobrevida libre de falla a distancia fue 78% en el grupo de cirugía y 77% en grupo TMT. La sobrevida libre de falla regional a 5 años fue 95% en grupo de cistectomía radical y 91% en grupo TMT. Tampoco hubo diferencia a 5 años en sobrevida libre de enfermedad entre ambos tratamientos: 73% cirugía y 74% TMT.
Sí hubo una diferencia estadísticamente significativa en sobrevida global a 5 años a favor de TMT: 66% en grupo cirugía y 73% en TMT, con un HR 0.70 (95% IC 0.53 – 0.92; p=0.010).
La sobrevida cáncer específica a 5 años fue 81% en grupo de cirugía y 84% en grupo TMT, no estadísticamente significativo.
En el análisis entre cirugía más quimioterapia neo o adyuvante versus TMT, no se encontró diferencia en sobrevida libre de metástasis a 5 años, ni en sobrevida cáncer específica, ni en sobrevida libre de enfermedad, así como tampoco cuando se analizó cistectomía más quimioterapia neoadyuvante solamente versus TMT.
De aquellos pacientes que recibieron TMT (282 pacientes), 13% (39 pacientes) tuvo cistectomía de rescate. 97% de estos pacientes recibieron cistectomía radical por recurrencia (no-músculo invasora y músculo invasor) y una cistectomía fue por toxicidad relacionada a tratamiento.
De aquellos que recibieron TMT y tuvieron recurrencia, 20% tuvieron recurrencia no músculo invasora (57/282 pacientes) y 11% (30/282) recurrencia músculo invasora. Todas las fallas ocurrieron dentro de los primeros 3 años. 18 pacientes con recurrencia invasora recibieron cistectomía radical de rescate, 4 de ellos desarrollaron metástasis. De los 12 pacientes que no se operaron, 4 desarrollaron metástasis.
En grupo TMT, hubo 8% de recurrencia pélvica. No hubo diferencia en SV cáncer específica a 5 años entre aquellos que recibieron cistectomía radical de rescate luego de TMT y aquellos tratados con TMT sin necesidad de cirugía.
Con respecto a la dosis y fraccionamiento, se comparó en un metaanálisis de datos individuales (37) dos fraccionamientos de radioterapia: 64 Gy en 32 fracciones en 6.5 semanas o 55 Gy en 20 fracciones en 4 semanas. De 782 pacientes, 48% recibieron 32 fracciones y 52% 20 fracciones. La mediana se seguimiento fue 120 meses. El esquema hipofraccionado fue no inferior con respecto al esquema de fraccionamiento convencional en control invasor loco-regional, y más aún, el análisis ajustado sugiere que el esquema en 20 fracciones podría ser superior en control invasor locorregional a 5 años (aHR 0.71, IC 95% 0.52 – 0.96). Así también, el esquema hipofraccionado fue no inferior en comparación con el esquema de 32 fracciones tanto para para sobrevida global, como para toxicidad tardía rectal y vesical a 5 años.
Basado en estos resultados, un manejo conservador con preservación de órgano es una alternativa plausible sin detrimento en los resultados oncológicos, con buena calidad de vida y con buen perfil de toxicidad. Es importante tener en consideración estudios en curso que integran otros agentes como inmunoterapia, que refinarán aún más el esquema de tratamiento en estos pacientes.
Radioterapia Adyuvante
Radioterapia adyuvante se puede considerar en pacientes con alto riesgo de recurrencia: pT3 – pT4, pN0-2, márgenes positivos.
Un estudio fase 2 (38), se randomizaron pacientes tratados con cistectomía radical con márgenes negativos y 1 o más de los siguientes factores: ≥T3b, G3, pN+, a 3 ramas de tratamiento: RT, QT + RT esquema sándwich (Gem+Cisp RT Gem+Cisp) o QT (4 ciclos). La QT fue con gemcitabina y cisplatino cada 28 días y la RT sobre pelvis con dosis total 45 Gy, bifraccionado 1,5 Gy dos veces al día con técnica 3D. En esta publicación solo se analizaron los pacientes de las ramas de QT+RT y QT
De 120 pacientes incluidos, 54.7% y 51.5% tenían histología urotelial en QT+RT y QT, respectivamente. La sobrevida libre de recurrencia local a 2 años fue 96% con QT+RT y 69% con QT (p = <0.01). La sobrevida libre de enfermedad a 2 años fue 68% con QT+RT vs 56% con QT (p = 0.07). No hubo diferencia en sobrevida global (71% QT+RT vs 60% QT) ni en sobrevida libre de metástasis (73% con QT+RT y 79% con QT).
En un estudio multicéntrico, fase 2 (39), buscó evaluar la toxicidad aguda de radioterapia adyuvante. Incluyeron pacientes manejados con cistectomía, con carcinoma urotelial invasor pT3 con invasión linfovascular, pT4, con menos de 10 linfonodos resecados, pN+, o márgenes positivos. Los pacientes recibieron radioterapia externa a linfáticos pélvicos (ilíacos comunes, externos, internos, presacros y obturadores) y lecho de cistectomía en casos de márgenes positivos. Se prescribió una dosis de 50 Gy en 25 fracciones y se podía dar boost integrado a ganglios sospechosos en PET CT 18F FDG hasta 70 Gy. El tratamiento se realizó con técnica VMAT e IGRT con conebeamCT diario.
72 pacientes se incluyeron en el estudio, 83% tenían carcinoma urotelial, 11% escamoso; 49% pT3 y 29% pT4; 65% pN+; 19% márgenes positivos; 47% recibió quimioterapia neoadyuvante. La mediana de seguimiento fue de 18 meses. 13% tenían linfonodos sospechosos en PET CT 18F FDG.
61% presentaron toxicidad gastrointestinal aguda G2, 6% G3 y 1 paciente toxicidad G5 con diarera y vómitos por obstrucción 1 mes luego de radioterapia. Las toxicidades ≥G2 más frecuentes fueron diarrea, cólico abdominal y aumento de frecuencia. 35% presentaron toxicidad gastrointestinal tardía (8% G3).
La toxicidad aguda urinaria fue evaluada en 17 pacientes con neovejiga: 53% (n=9) presentaron toxicidad aguda G2 y 18% (n=3) G3. La toxicidad tardía se evaluó en 11 pacientes: 45% (n=5) y 18% (n=2) presentaron toxicidad G2 y G3, respectivamente.
Posteriormente (40), reportaron los resultados con una mediana de seguimiento de 39 meses en pacientes sin recurrencia y 60 meses en aquellos vivos. 13 pacientes presentaron recurrencia local, 12 durante el primer año luego de radioterapia. La sobrevida libre de recurrencia locorregional a 2 y 5 años fue 81% y 79%. 43 pacientes desarrollaron metástasis a distancia, 10 de ellos presentaron recurrencia local y a distancia de manera simultánea. La sobrevida libre de recurrencia clínica (falla local, ganglionar o a distancia) a 2 y 5 años fue 32% y 20%.
La sobrevida global a 2 y 5 años 48% y 34%, respectivamente, con una mediana de sobrevida fue 23 meses.
Con respecto a calidad de vida, puntajes de salud global y de funcionalidad se deterioraron al final de la radioterapia adyuvante, pero volvieron al basal luego de un mes, excepto funcionamiento cognitivo que volvió al basal a los 3 meses. En la evaluación de sintomatología, el ítem diarrea tuvo el mayor aumento y aunque mejoró al mes de finalizada la radioterapia, se mantuvo por sobre el basal. La mayoría de la toxicidad hematológica fue G2, y solo hubo 9% linfopenia G4.
Otro estudio que evalúa RT adyuvante, es el de Zaghloul (41), un randomizado fase 2/3, en pacientes con diagnóstico de cáncer urotelial de vejiga, tratados cistectomía radical con márgenes negativos con ≥ 1 de los siguientes factores: ≥pT3b, grado 3, invasión linfovascular o pN+. Los pacientes fueron randomizados a radioterapia adyuvante con dosis de 50 Gy en 25 fracciones o a observación. La técnica de radioterapia fue con IMRT e IGRT con conebeamCT diario, y la dosis fue prescrita a lecho de cistectomía y región ganglionar pélvica (iliacos externos, internos, presacros y obturadores). 122 pacientes se randomizaron, 62 a radioterapia adyuvante y 60 a observación. La mediana de edad fue 62 años, 52 pacientes recibieron quimioterapia neoadyuvante y más pacientes en grupo RT tuvo pN+ (40.3% vs 25%, p=0.01). 85.2% tenían tumores G3. La clasificación patológica fue pT2 en 21 pacientes, 64 pacientes pT3b, 24 pacientes pT4a. 13.9% pN1 y 17.2% pN2, solo dos pacientes pN3. Con una mediana de seguimiento 43.4 meses, 8 pacientes presentaron LRF en la rama RT y 17 pacientes en rama observación. La sobrevida libre de recurrencia locorregional a 3 años fue 81% en grupo RT comparado con 71% en grupo observación HR 2.48 (95% CI, 1.02-6.03) (p=0.0457).
No hubo diferencia estadísticamente significativa en sobrevida global. A 3 años fue 47% y 44% en grupo RT y observación, respectivamente (p=0.221), la sobrevida libre de enfermedad fue 59% en RT y 50% en observación (p=0.2) y la sobrevida libre de metástasis a distancia fue 62% en RT y 55% observación.
Sobrevida libre de recurrencia locorregional fue mejor con RT en aquellos pN+ (72% RT vs 59% observación) pero también en aquellos pN0 (84% RT vs 71% observación, HR 2.48 (IC 95%, 1.02-6.03).
Solo 2 pacientes presentaron toxicidad G3, no reportaron toxicidad >G3. No hubo diferencias en toxicidad tardía entre ambos grupos.
Otro estudio fase 3 que evaluó RT adyuvante, es el estudio BART (42), un estudio randomizado, multicéntrico, que compara la eficacia y seguridad de radioterapia adyuvante versus observación en pacientes con carcinoma urotelial de alto grado localmente avanzado, tratados con cistectomía radical y quimioterapia. Se incluyeron pacientes con ≥1 característica de alto riesgo: pT3-4, pN1-3, <10 linfonodos disecados, márgenes de resección positivos, o cT3+ con reducción de tamaño luego de quimioterapia neoadyuvante. El volumen de RT incluyó lecho de cistectomía y regiones linfáticas pélvicas (ilíacos comunes, ilíacos internos, ilíacos externos, presacros y obturadores), y se prescribió una dosis de 50.4 Gy en 28 fracciones con IMRT e IGRT.
Se randomizaron 76 paciente a observación y 77 a RT. La mediana de edad fue 57 años. 90% de los pacientes recibieron quimioterapia y de estos 70.6% recibió quimioterapia neoadyuvante, ningún paciente recibió inmunoterapia. Hubo 40% de compromiso nodal, menos de 5% márgenes positivos. 134 pacientes fueron elegibles para este análisis de toxicidad.
No hubo diferencia en toxicidad aguda G3 entre ambos grupos (4.2% vs 1.6%, p = .34). El grupo RT presentó mayor toxicidad aguda G2 (17.5% vs 1.1%, p <0.001), mayoritariamente gastrointestinal (lo más frecuente fue diarrea/enteritis).
Con una mediana de seguimiento de 27 meses, se analizaron 104 pacientes para toxicidad tardía. No hubo diferencia en toxicidad tardía G3 y 4 entre ambos grupos (10.5% observación vs 8.4% RT, p = 0.62). La incidencia de toxicidad tardía G2+ también fue similar entre ambos grupos (17.5%% en observación y 23.3% RT, p =0.27)
Hay otros estudios randomizados en curso de radioterapia y radioquimioterapia adyuvante. El GETUG AFU 30 (43), estudio fase 2 randomizado en curso evaluando radioterapia adyuvante en cáncer de vejiga músculo invasor de alto riesgo. Compara RT adyuvante sobre pelvis 50,4 Gy en 28 fracciones versus vigilancia. El NRG-GU001 (44) estudio fase 2 randomizado de radioterapia adyuvante con IMRT luego de cistectomía en pacientes con cáncer urotelial pT3-4 pN0-2, con o sin QT adyuvante (no QTRT concurrente).
Las recurrencias locorregionales posterior a cistectomías pueden causar importante morbilidad y mortalidad en pacientes con características patológicas de alto riesgo, por lo tanto, mejorar el control locorregional es una consideración importante en el manejo de estos pacientes. La radioterapia adyuvante es una alternativa atractiva en pacientes con cáncer musculo invasor localmente avanzado para control de enfermedad microscópica pélvica, sin embargo, esto debe ser analizado en el contexto de otras alternativas terapéuticas adyuvantes en estudio.
Recomendaciones de Tratamiento
- Enfermedad no músculo invasora cT1 con factores de riesgo se puede considerar RT en casos seleccionados.
- Enfermedad músculo invasora cT2-T4aN0-1:
Preservación de vejiga con tratamiento trimodal con radio quimioterapia concurrente es una alternativa razonable.
Tratamiento sistémico pre/perioperatorio y cirugía.
Radioterapia sola en pacientes no candidatos a tratamiento sistémico.
- Enfermedad músculo invasora IIIB / IVA:
tratamiento sistémico y reevaluación. Considerar RTQT en el manejo posterior a tratamiento sistémico como alternativa a cirugía o en casos seleccionados como tratamiento de entrada. - Luego de cistectomía radical
Se puede considerar RT adyuvante de acuerdo a factores de algo riesgo. - Recurrencia local luego de cistectomía
Se puede considerar RTQT sobre pelvis, con sobreimpresión sobre recurrencia.
CÁNCER DE TESTÍCULO
La radioterapia en el cáncer de testículo de histología seminoma es un tratamiento ampliamente validado y que tiene un rol en todos los estadios de tratamiento, ya sea adyuvante, en caso de que el paciente se encuentre operado, como de manera paliativa en las fases más avanzadas de la enfermedad.
En los pacientes con un seminoma estadio I, el tratamiento de elección es la vigilancia activa (45), y la radioterapia toma relevancia en el caso de que el paciente no sea candidato a seguimiento (fundamentalmente dado por la imposibilidad de tener controles regulares durante los primeros 2 años). Aquellos pacientes en los que se decida el tratamiento de radioterapia como elección, deben ser tratados con dosis de 20 Gy en 10 fracciones sobre la región lumbo-aórtica, teniendo en consideración que, si ha tenido cirugías previas como orquipexia o hernioplastia, se deben incluir los linfonodos ilíacos ipsilaterales y en algunos casos incluir los inguinales.
En los pacientes con diagnóstico de cáncer de testículo de tipo seminoma en estadio IIA/IIB la radioterapia es una buena alternativa de tratamiento. El tratamiento clásico aceptado es la radioterapia con dosis de 20 Gy en 10 fracciones sobre región paraaórtica y pélvica ipsilateral con un boost sobre adenopatías hasta 30 Gy sobre en pacientes estadio IIA (1-2 cm) y hasta 36 Gy en estadio IIB (2-3 cm)(45). A pesar de que este tratamiento se encuentra ampliamente validado, en los últimos años ha aparecido una nueva alternativa validada por guías internacionales y basada en el estudio SAKK 01/10 (46), que es el tratamiento con un ciclo de carboplatino seguido de radioterapia a ganglio comprometido (30 Gy en 15 fracciones en estadio IIA y 36 Gy en 18 fracciones en estadio IIIB), con excelentes resultados.
Recomendaciones de Tratamiento:
| ESTADIO | TRATAMIENTO |
| ETAPA 1 |
|
| ETAPA II A/B |
|
| ETAPA III |
|
Resumen Evidencia Para Seminoma Etapa I
El Estudio MRC (Fossá JCO 1999) (47) comparó en pacientes con seminoma puro etapa I (sin intervención quirúrgica previa inguinal ni escrotal), el campo paraaórtico (PA) versus campo dog leg (DL) aplicando dosis de 30 Gy en 15 fracciones.
Se definió como campo DL (242 pacientes):
– límite superior: disco entre T10-T11,
– límite inferior: mitad de agujero obturador
– límite lateral ipsilateral: hilio renal hasta disco L5-S1 y luego diagonal hasta borde lateral de acetábulo y luego vertical hasta la mitad del agujero obturador,
– margen contralateral: proceso transverso en región paraórtica hasta L5-S1, luego diagonal en paralelo con borde ipsilateral, luego vertical hasta borde de agujero obturador.
El Campo PA (236 pacientes) fue idéntico a DL por superior a nivel de L5-S1.
Se demostró menor toxicidad aguda en campo PA gastrointestinal, hematológica, gonadal, con RFR a 3 años 96% PA y 96,6% DL, SV libre de recurrencia pélvica a 3 años 98,2% PA y 100% DL y SV a 3 años 100% DL y 99,3% PA.
Resumen Evidencia Para Seminoma Etapa II
El estudio prospectivo (Classen JCO 2003) (48) incluyo 87 pacientes: 66 IIA y 21 IIB con una mediana de seguimiento 70 meses. El objetivo fue evaluar el tratamiento con campos reducidos paraaórticos e ilíacos tomando como límite inferior hasta el borde superior de acetábulo.
Con dosis de 30 Gy en 15 fracciones en etapa IIA y 36 Gy en 18 fracciones en etapa IIB, no hubo fallas bajo límite inferior de tratamiento logrando sobrevida libre de enfermedad a 6 años de 95,3% en IIA y de 88,9% en IIB. No hubo muertes por seminoma.
El estudio retrospectivo del PMH (Chung IJROBP 2003) (49), incluyo 79 pacientes etapa IIA y IIB con tratamiento campo DL con dosis 25 Gy en 20 fracciones + sobreimpresión de 10 Gy en 5-8 fracciones a linfonodos paraaórticos (+), sin RT supradiafragmática profiláctica. Con una mediana de seguimiento de 8,5 años. se logra sobrevida libre de recurrencia a 5 años de 91% (7 pacientes fallaron, 3 en linfonodos supradiafragmáticos). El campo estándar es solamente infradiafragmático.
SAKK 01/10 es un estudio Fase II que incluyó 120 pacientes, de los cuales fueron elegibles 116 (46 pacientes etapa IIA y 70 pacientes IIB), que fueron a tratamiento con un ciclo de carboplatino seguido de radioterapia a ganglio comprometido con dosis de 30 Gy en 15 fracciones en pacientes estadio IIA y 36 Gy en 18 fracciones a pacientes en estadio IIB. Dentro de sus resultados destaca una sobrevida libre de progresión de 93,7% a 3 años. No se logró cumplir el objetivo fijado de 95%, pero aun así, los resultados son igual de buenos tanto los de quimioterapia como los de radioterapia, sin muertes reportadas a una mediana de seguimiento de 4,5 años. Los efectos adversos fueron bajos, con toxicidad G3/4 de solo un 4% (neutropenia 4%, trombocitopenia 3% y vómitos 1%), lo que lo llevó a ser un esquema aceptado para el tratamiento de estos pacientes.
Resumen de Evidencia para Dosis de Tratamiento
Seminoma Etapa I
El Estudio MRC T18 (Jones JCO 2005) (50) es un estudio randomizado a RT 30 Gy en 15 fracciones o 20 Gy en 10 fracciones (dosis a línea media) campo paraaórtico.
Se presentaron náuseas y vómitos G3-4 19,7% con 30 Gy y 18,4% con 20 Gy. Más dispepsia con 30 Gy. RFR a 2 años fue 97% en ambos grupos.
Seminoma Etapa II
El estudio retrospectivo (CHUNG 2004 Eur urol) (51) incluyó 128 pacientes con seminoma etapa II: 50 IIA, 37 IIB y 39 IIC (8 con masa >10 cm). De estos 95 pacientes fueron tratados con RT (79 IIA/B y 16 IIC).
La dosis de RT prescrita fue 25 Gy en 20 fracciones en 35 pacientes; 44 pacientes recibieron además 10 Gy en 5-8 fracciones y 16 pacientes dosis entre 30 – 45 Gy. Además, 31 pacientes fueron tratados con QT (23 pacientes tenían etapa IIC), con esquema etopósido 100 mg/m2 y cisplatino 20 mg/m2 (EP) por 5 días en la mayoría de los pacientes.
La mediana de seguimiento fue 8,5 años logrando una OS de 93% a 5 y 10 años y CSS de 94% a 5 y 10 años. CSS para etapa IIA, IIB y IIC fue 95,5%, 100% y 85,8% a 5 y 10 años (p=0.04).
La RFR a 5 y 10 años fue 85%. A 5 años fue 91,9% en etapa IIA, 88,6% etapa IIB y 73% etapa IIC (p=0,035)
Con RT, RFR a 5 años fue 91,7% en etapa IIA y 89,7% en etapa IIB. Hubo 9/16 de recurrencia de los pacientes etapa IIC tratados con RT, y 7/79 recurrencias de aquellos en etapa IIA/B. Con QT, la RFR a 5 años fue 83,3% en etapa IIB.
De los pacientes con etapa IIC, aquellos tratados con radioterapia (RT) tuvieron mayor riesgo de recurrencia que aquellos tratados con QT (p=0.0004).
El estudio SWENOTECA, poblacional prospectivo (52) realizó RT 25,2 Gy en 14 fracciones en pacientes seminoma etapa I y 27 Gy en 15 fracciones para seminoma etapa II. QT se aplicó en etapa IIB o mayor, 4 EP o BEP. En etapa I, hubo mayor riesgo de recurrencia con QT (HR 4,7; p=0.031): 0,8% RT vs 3,9% QT. En 102 pacientes Etapa IIA/B, mayores recurrencias fueron en pacientes tratados con RT (3/29). No hubo recurrencias en los 73 pacientes tratados con QT. En Etapa IIC, hubo 6/42 recurrencias (14%) en RT.
Riesgo de segundo cáncer
JNCI (53) presenta una revisión de 40.576 pacientes, 10.534 tratados con RT y 808 con QT. El Riesgo acumulado de segundo cáncer sólido fue 36% en seminoma comparado con 23% en población general: RR = 2 con RT y RR = 1.8 con QT, ambos RR = 2.9. De los pacientes con sobrevida de al menos 10 años, se observó aumento de riesgo de cánceres sólidos con un RR = 2 con RT; RR = 1,8 con QT, y RR = 29,9 con RT y QT. En otro estudio (54) con 2707 pacientes con seminoma y no seminoma, con una mediana de seguimiento de 17,6 años se observó aumento de riesgo absoluto de 32.3 por 10.000 persona/año. El riesgo de segundo cáncer fue 2.6 veces luego de RT infradiafragmática (sin aumento significativo de enfermedad cardiovascular).
Mientras que QT con base a cisplatino se asoció a un aumento de riesgo de 2.1 veces de segundo cáncer y 1.7 veces aumento de riesgo de enfermedad cardiovascular. El aumento de riesgo de ambos tratamientos es comparable con el aumento de riesgo de tabaquismo.
CÁNCER DE PENE
El cáncer de pene es una enfermedad infrecuente. El tratamiento tradicional es quirúrgico, que puede ir desde procedimientos conservadores como resección local, a penectomía parcial o total dependiendo de la extensión de la enfermedad.
El tratamiento con radioterapia ya sea radioterapia externa (RT) o braquiterapia (BT), ofrece una alternativa terapéutica conservadora, sobre todo en estadio temprano, reservando la cirugía como tratamiento de rescate en caso de necesidad. Hay que tener en consideración que la penectomía se asocia a mayor incidencia de depresión y suicidio.
El manejo de esta enfermedad se ha extrapolado de otros cánceres escamosos como vulva y ano. Debido a la naturaleza de esta patología, siempre se considerar su diseminación linfática, el compromiso inguinal bilateral es común y de éstos 20-30% tendrá linfonodos pelvianos comprometidos, lo que representa un factor pronóstico ominoso en esta enfermedad (55,56)
Radioterapia Primaria
Un estudio retrospectivo del Royal Marsden Hospital (57) de 101 pacientes, 59 fueron tratados con RT externa con mediana de dosis de 60 Gy, 13 con BT, la mayoría T1 superficial y 29 con penectomía. La mediana de seguimiento fue 5.2 años.
La SV a 5 años fue de 57%, SV cáncer específica 66%, control local 60% y 50% preservación de pene. No hubo diferencia en control local entre cirugía y RT, considerando el rescate.
Los factores pronósticos adversos de sobrevida cáncer específica fue tumores poco diferenciados, extensión fuera de glande, ganglios positivos y edad ≥ 60 años. Mayor incidencia de falla local con dosis total <60, no ES.
Dentro de las complicaciones destaca estenosis uretral en 7/56 pacientes tratados con RT externa, 2 requirieron penectomía (1 por necrosis y 1 por daño uretral severo). Estenosis uretral severa se presentó en 3/13 con BT con iridio. Mientras que hubo una estenosis uretral moderada y dos estenosis uretrales severa en 29 pacientes tratados con cirugía. Hubo 1 suicidio y 1 intento de suicidio luego de penectomía.
Otro estudio retrospectivo (58) incluyo 60 pacientes con carcinoma escamoso de pene. En él, 27 pacientes fueron tratados con cirugía y 29 con RT primaria (7 con RT + BT y 1 solamente BT). Además 22 pacientes necesitaron RT postoperatoria por margen positivo y/o compromiso nodal. El volumen de tratamiento incluyó el pene en todos los pacientes y en 19 pacientes linfonodos regionales. Ningún paciente recibió quimioterapia con intención curativa. La mediana de seguimiento fue 14 meses. La falla local fue 13% en pacientes tratados con penectomía parcial +/- RT y 56% en pacientes manejados con tratamiento conservador (p = 0.0001). El 73% de las fallas locales fueron tratadas con cirugía de rescate. Existió control local con preservación de órgano en 39% y la preservación de pene total fue de 52%.
La SV global y cáncer específica a 5 años fue 43% y 61% respectivamente. El control local y loco-regional a 5 años fue 63% y 50% respectivamente. De demostró que el estado nodal fue el único factor pronóstico para SV cáncer específica. El control local y loco-regional estuvieron influenciados solamente por tipo de tratamiento: cirugía 88% vs 49% RT (p=0.005) y 73% con cirugía vs 36% con RT para control loco-regional (p=0.004). El tipo de tratamiento primario no afectó SV. En pacientes tratados con RT, la probabilidad de preservación de órgano a 5 años fue de 43% y a 10 años de 25%.
Un Metaanálisis (59) analizó de 1505 pacientes tratados con penectomía, 673 con BT y 155 con RT externa. La SV fue similar con penectomía y BT (76% cirugía, 73% BT; p=0.863) y ambos se compararon favorablemente con la SV de 58% con RT externa (p < 0.001). El control local a 5 años fue 84% con penectomía y 79% con BT (p=0.009). Ambos mejores que el control local de 50% con RT externa (p=<0.001). La conservación de pene con BT fue 74% y 49% con RT (p<0.001). Sin embargo, hubo diferencias en la dosis alcanzada con BT (60 Gy) y RT (51 Gy).
Presentaron 9-45% estenosis uretral con BT y 9-27% con RT. Necrosis existió en 6-26% con BT.
Por último, un estudio del Instituto de Cáncer Holandés (60), presenta un análisis de compromiso nodal en paciente con cáncer escamoso de pene de 110 pacientes. La práctica institucional en cN0 era observación y cN1 disección ganglionar. En los primeros años se realizó disección ganglionar unilateral al lado clínicamente positivo. Luego, linfadenectomía inguinal bilateral en paciente cN0 T2 G3, T3 independiente del grado, y T4 operables. La RT adyuvante fue indicada en pacientes con extensión extracapsular y/o más de 2 LN comprometidos.
Del total, 66 pacientes fueron cN0 y de estos 55 fueron observados, mientras que en 5 se realizó disección ganglionar (+ RT en 1, y RT externa en 4). En 40 pacientes cN+, se realizó disección ganglionar en 27 (con RT adyuvante en 11, solo biopsia en 4, RT externa en 4 y vigilancia en 5). La recurrencia regional fue de 23% (25/110). La SV libre de enfermedad a 5 años fue 88% N0, 67% N1 y 55% N2. La SV cáncer específica a 5 años en pN0 fue 100%, 79% en pN1y 17% en pN2. El riesgo de recurrencia y muerte aumento con 2 o más LN positivos (p=0.007) mientras que el Grado tumoral también fue predictor de recurrencia regional (64% G3 vs 17% G1-2, p=0.000)
Radioterapia Adyuvante Postoperatoria
La incidencia de falla inguinal en pacientes tratados con linfadenectomía varía entre 25 a 77%. En el estudio de Chen (61) RT postoperatoria a región inguinal disminuyó la recurrencia inguinal de 60% a 11%. En esta revisión de 45 pacientes, 95% fueron pN+. El tratamiento estándar fue disección ganglionar y 9 pacientes recibieron RT adyuvante a primario + región inguinal bilateral + ilíacos bajos con mediana de dosis de 54Gy. Mientras que 3/22 cN0 recibieron disección inguinal electiva.
Con una mediana de seguimiento de 37 meses, la SV a 5 años fue 54,3% y SV libre de enfermedad a 5 años fue de 43,4%. Pacientes pT1-2 cN+ con disección ganglionar + RT adyuvante la falla regional fue 14% si cN+ versus 60% en aquellos que sólo recibieron cirugía. Pacientes pN0, la SV global y SV libre de enfermedad a 5 años fue 70% y 55%, versus 22% y 16% en aquellos cN+. (p=0.01 y p=0.004 respectivamente). En grupo pN+ hubo 11% de falla con RT adyuvante versus 60% de falla sin RT (p=0.057).
El estudio InPACT (62) actualmente en curso, randomizado multi-institucional en paciente con cáncer escamoso de pene clínicamente N1-N3, tiene como objetivo:
- determinar si hay un rol de tratamiento neoadyuvante
- determinar si la disección ganglionar pélvica mejora la sobrevida en pacientes con alto riesgo de recurrencia luego de disección ganglionar inguinal.
Los pacientes son randomizados primero de 1-3 ramas:
- Disección ganglionar inguinal
- Quimioterapia neoadyuvante (QTNA) con docetaxel, ifosfamida y cisplatino (TIP) seguido de disección ganglionar inguinal.
- Quimiorradioterapia neoadyuvante con cisplatino semanal seguido de disección ganglionar inguinal.
En la segunda randomización, los pacientes de alto riesgo son randomizados a:
- Disección ganglionar pélvica profiláctica
- No disección ganglionar pélvica profiláctica.
Todos aquellos que no reciben QTRT NA, reciben QTRT adyuvante.
Recomendaciones de tratamiento con radioterapia (63-66)
Dada la baja frecuencia de esta patología y la falta de evidencia categoría I para guiar el tratamiento, es fundamental que estos pacientes sean discutidos en un comité interdisciplinario de tumores urológicos.
En etapa temprana, el objetivo del tratamiento se plantea con intención curativa con resección quirúrgica buscando la preservación de órgano tanto en funcionalidad (sexual y urinaria) como en cosmesis. La radioterapia puede ser una opción en estos pacientes, sobre todo en aquellos con lesiones superficiales o exofíticas de menos de 4 cm, ubicadas en el glande. La radioterapia puede ser externa, usualmente con dosis hasta 66 – 74 Gy con fraccionamiento convencional o braquiterapia (previa circuncisión), con dosis y fraccionamiento variables dependiendo de si es baja tasa, tasa de dosis pulsada o alta tasa. Los efectos secundarios incluyen edema de pene, radiodermitis. También se ha reportado disfunción sexual, necrosis de pene y estenosis uretral.
En cáncer de pene localmente avanzado, se puede considerar radioterapia/radioquimioterapia en aquellos pacientes con progresión o irresecables luego de QT neoadyuvante, o RTQT en aquellos no candidatos a neoadyuvancia o cirugía.
También, considerar radioterapia adyuvante en caso de márgenes positivos, compromiso nodal bilateral, metástasis ganglionar >4cm, metástasis ganglionar pélvica en >2 linfonodos, extensión extracapsular, o en casos de recurrencia.
CÁNCER DE ESCROTO (67-71)
El cáncer de escroto es una neoplasia infrecuente, que tiene como factor de riesgo la exposición a hollín, alquitrán y brea. La mayoría son tumores de piel, que dada su relación con exposición ocupacional se clasifican como una entidad separada a cánceres de piel.
También podemos encontrar otro tipo de tumores, aun menos frecuentes, como lo son los sarcomas, melanomas, linfomas, enfermedad de Paget, mesoteliomas y otros. En este caso, el manejo dependerá de la histología y de la etapa de enfermedad y, por lo tanto, la radioterapia dependerá del manejo que requiera su neoplasia según histología.
Radioterapia estereotáxica en tumores urológicos
La radioterapia estereotáxica o radiocirugía corporal (conocida por sus siglas SBRT o SABR) es una modalidad de radioterapia externa en la cual con técnicas avanzadas guiadas por imágenes es posible entregar grandes dosis de radiación por fracción. En el campo de la urología, la SBRT ya se encuentra en la práctica clínica principalmente en el tratamiento del cáncer de próstata de riesgo bajo e intermedio y en el tratamiento de los tumores oligometastásicos. En el último tiempo se ha estudiado con resultados prometedores un posible rol en pacientes con cáncer renal que no sean candidatos a cirugía por comorbilidades u otras razones.
Esta técnica de radioterapia tiene algunas diferencias radiobiológicas en comparación a los tratamientos con fraccionamiento estándar que podrían reflejarse en un beneficio clínico. Por una parte, al entregar una gran dosis de radiación por fracción se producen cambios en el estroma tumoral a través de la activación de las vías de apoptosis endotelial teniendo un efecto ablativo sobre el tumor. Asimismo, los efectos inflamatorios y apoptosis reclutan células dendríticas en el sitio irradiado. Estas células dendríticas se unen a los antígenos tumorales los cuales son presentados a linfocitos T CD4 y CD8 desarrollándose una inmunidad específica contra el tumor (72).
Kishan et al., publicaron los resultados a largo plazo de la SBRT en cáncer de próstata de riesgo bajo e intermedio en base a un análisis individual de pacientes tratados en 10 instituciones (73). Se eligieron para el análisis un total de 2142 pacientes con un promedio de edad de 67,9 años. Del total, 1185 (55,3%) tenían enfermedad de bajo riesgo, 692 (32,3%) enfermedad de riesgo intermedio favorable y 265 (12,4%) riesgo intermedio desfavorable. Las dosis usadas para la SBRT variaron entre 33,5 a 40 Gy entregadas en 4 o 5 fracciones. Las tasas acumuladas de recurrencia bioquímica a 7 años fueron para la enfermedad de bajo riesgo, riesgo intermedio favorable y riesgo intermedio desfavorable de 4,5%, 8,6% y 14,9% respectivamente. Respecto a la toxicidad, las incidencias de eventos genitourinarios y gastrointestinales agudos G3 o más fueron de un 0,6% y 0,09% respectivamente, y a 7 años los eventos urinarios G3 o más resultaron en un 2,4% y los gastrointestinales en 0,4%. Estos hallazgos sugieren que la SBRT en cáncer de próstata de riesgo bajo e intermedio, tanto en términos de control de la enfermedad como toxicidad, es comparable con las otras alternativas terapéuticas con la ventaja de un tiempo de tratamiento significativamente menor en comparación a la radioterapia con fraccionamiento estándar.
En los últimos años, los ensayos randomizados PACE han generado evidencia de referencia que posiciona a la SBRT como una opción consolidada en el tratamiento del cáncer de próstata localizado, especialmente en pacientes de bajo y riesgo intermedio. Dos de sus estudios clave son PACE-B y PACE-A.
PACE-B fue un ensayo multicéntrico, fase III, de no inferioridad, que incluyó 874 pacientes entre 2012 y 2018 (74). Los hombres tenían cáncer de próstata T1–T2, Gleason ≤3+4, PSA ≤20 ng/mL y no recibieron tratamiento hormonal. Se comparó SBRT (36,25 Gy en 5 fracciones durante 1–2 semanas) con radioterapia convencional o moderadamente hipofraccionada. A una mediana de seguimiento de 74 meses, la sobrevida libre de fracaso bioquímico o clínico a 5 años fue del 95,8% en SBRT frente a 94,6% en CRT. Las toxicidades tardías grado ≥2 fueron algo más frecuentes en la rama SBRT para toxicidad genitourinaria (26,9% vs 18,3%), mientras que la toxicidad gastrointestinal fue similar (10,7% vs 10,2%).
Por otro lado, PACE-A comparó SBRT con prostatectomía radical en pacientes T1-T2, Gleason ≤3+4 y PSA ≤20 ng/mL (75). Con 123 pacientes aleatorizados, se evaluaron desenlaces centrados en calidad de vida a 2 años, incluyendo continencia urinaria, función intestinal y uso de absorbentes. Los resultados favorecieron significativamente a la SBRT en términos de preservación de continencia y menor impacto en la función sexual, aunque con un aumento leve en síntomas intestinales leves. No se observaron diferencias relevantes en toxicidad severa.
Estos estudios confirman que la SBRT es una alternativa eficaz, bien tolerada y con potencial ventaja en calidad de vida comparada tanto con esquemas de radioterapia prolongados como con tratamiento quirúrgico, especialmente en pacientes con enfermedad de bajo o riesgo intermedio y expectativa de vida prolongada.
Otro rol terapéutico de la SBRT en cáncer de próstata es el tratamiento de la recidiva local luego de radioterapia convencional, escenario que siempre ha sido un desafío para el clínico. La re-irradiación con SBRT ha mostrado resultados prometedores en relación a sobrevida libre de enfermedad y de recurrencia bioquímica, retrasando la necesidad de iniciar otras terapias como bloqueo androgénico, con una toxicidad genitourinaria y gastrointestinal aceptable (76,77).
El uso más frecuente de la SBRT entre la práctica clínica urológica actual es el tratamiento del paciente con enfermedad de baja carga metastásica. El estado oligometastásico fue descrito por primera vez en el año 1995 por Hellman y Weischelbaum. Este estado crea el paradigma de pacientes que tienen una enfermedad con un número limitado de metástasis que podrían ser curados o tener mejor sobrevida usando tratamientos radicales.
El principal estudio randomizado que evalúa el rol de la SBRT en oligometástasis es el SABR-COMET por Palma et al (78). El objetivo de este ensayo clínico fue evaluar el impacto de las terapias ablativas en la sobrevida global de pacientes con enfermedad maligna con primario controlado y de 1 a 5 metástasis. Los pacientes fueron randomizados a SBRT versus radioterapia paliativa convencional. En ambos grupos podían recibir tratamiento sistémico estándar a criterio del tratante.
En el último reporte muestran los resultados de 99 pacientes randomizados. Los primarios más frecuentes fueron mama, pulmón, colorrectal y próstata. Cabe destacar que los pacientes con cáncer de próstata con enfermedad hormono-sensible no fueron incluidos en este estudio. La sobrevida global a 5 años en el grupo de radioterapia paliativa convencional fue de 17,1% versus un 42,3% de la rama con SBRT (p=0,006). Por otra parte, la SBRT no tuvo un impacto negativo en la calidad de vida de los pacientes.
En cáncer renal, en los últimos años ha surgido evidencia creciente sobre el uso de la SBRT (o SABR) para tratar el tumor primario en pacientes no aptos para cirugía. Un hito importante es el estudio TROG 15.03 FASTRACK II, un ensayo internacional prospectivo fase II, no aleatorizado, publicado en The Lancet Oncology en marzo de 2024 (79). Se incluyeron 70 pacientes con carcinoma de células renales primario, no metastásico, técnicamente o médicamente inoperables, tratados en siete centros de Australia y uno en los Países Bajos.
Los pacientes recibieron SBRT según el tamaño tumoral: 26 Gy en única fracción para tumores ≤ 4 cm (23 pacientes), o 42 Gy en tres fracciones para tumores de 4–10 cm (47 pacientes). Con un seguimiento medio de 43 meses, se reportó un control local al año del 100% (p<0,0001), sin fallecimientos relacionados con la enfermedad .
La toxicidad fue limitada: sólo 10 % de los pacientes experimentaron eventos adversos grado 3 (náuseas/vómitos, dolor, obstrucción colónica), sin toxicidad grado 4 ni muertes vinculadas al tratamiento. Además, la función renal mostró un descenso inicial —aproximadamente 10–14 mL/min/1,73 m² en eGFR a los 12–24 meses— tras lo cual se estabilizó en concordancia con la progresión natural de la enfermedad renal crónica.
Estos resultados posicionan a la SBRT como una opción curativa no invasiva en pacientes con tumores primarios renales inoperables, respaldando su potencial comparativo frente a la cirugía en futuros ensayos aleatorizados.
Históricamente, el cáncer renal ha estado fuera de la práctica habitual del oncólogo radioterapeuta considerándose un tumor resistente a la radiación, limitando el uso de la radioterapia principalmente a un contexto paliativo.
La mayoría de los carcinomas de células renales son altamente vascularizados debido a una hipermetilación de la proteína VHL. Usando un fraccionamiento estándar de radioterapia luego de cada sesión se generan momentos de hipoxia y reoxigenación en el tumor, y en condiciones de hipoxia la VHL no se une a la proteína H1F1A lo que lleva a su acumulación. La acumulación de H1F1A lleva a un upregulation de varios factores proangiogénicos, como VEGF, y a un downregulation de inhibidores angiogénicos. Frente a esta situación el uso de fraccionamientos ablativos con la capacidad de provocar apoptosis endotelial en los vasos del tumor podría presentar algún beneficio (80).
Existen varios estudios retrospectivos que han analizado los efectos de la SBRT para tratar el tumor primario en cáncer renal y, por lo tanto, se han desarrollado ya algunos estudios fase 1 y 2 para investigar con mayor detalle su seguridad y eficacia. El International Radiosurgery Oncology Consortium for Kidney (IROCK) realizó un análisis agrupado de 223 pacientes tratados en 9 instituciones con SBRT con fracción única o multifracción (81). Se realizó un tratamiento de fracción única en 118 pacientes con una mediana de dosis de 25 Gy, y el resto recibió un esquema de 2 a 10 fracciones con una mediana de dosis de 40 Gy. El control local, sobrevida cáncer-específica y sobrevida global a 4 años fue de 97,8%, 91,9% y 70,7% respectivamente. Un 35,6% de los pacientes tuvo toxicidad G1-2 y sólo un 1,3% G3-4. Asimismo, hubo una leve disminución, pero significativa, en la tasa de filtración glomerular (59,9 – 54,4 ml/min/1,73m2). Estos resultados han mostrado que con SBRT se puede lograr un buen control local con baja toxicidad, convirtiendo a este tratamiento en una alternativa atractiva para pacientes no operables.
Se presentan figuras de un caso clínico de nuestro centro. Paciente de 57 años, APE: 6.5, Biopsia Gleason 7 (3+4) 2/6 sextantes. Etapificación (-), Rechaza cirugía.
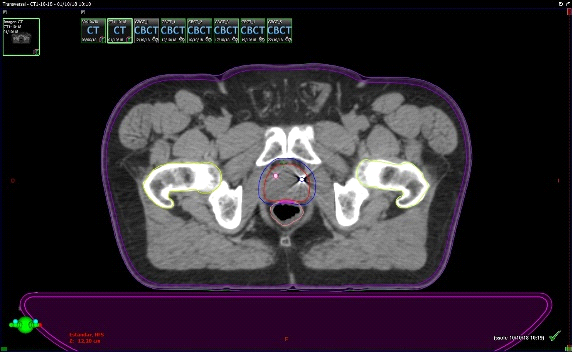
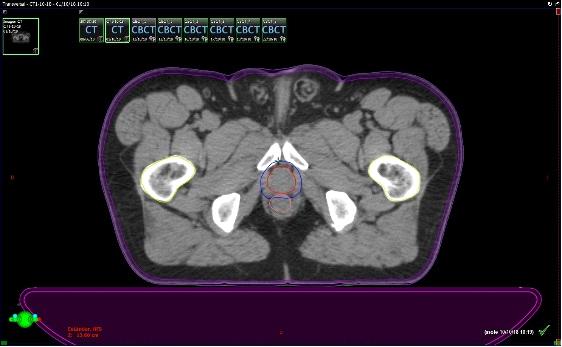
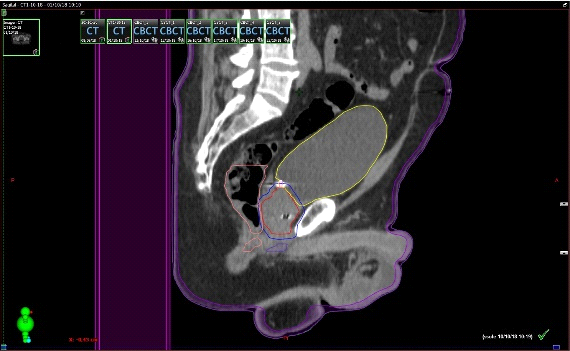
Fig. 6. Tac con fiduciales y contornos. Dosimetría: 36.25Gy en 5 Sesiones, Días alternos. Los fiduciales son los puntos blancos dentro de la próstata semilla que se implantan previamente para tener un punto de referencia local confiables al realizar imágenes diaras previo al inicio de cada sesión.
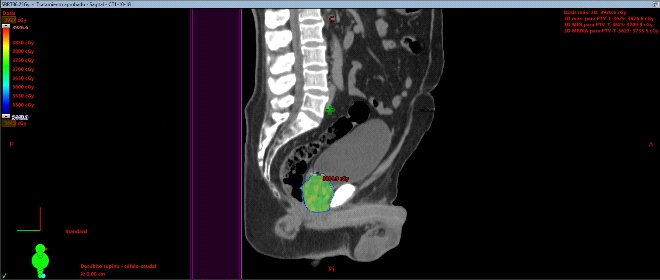
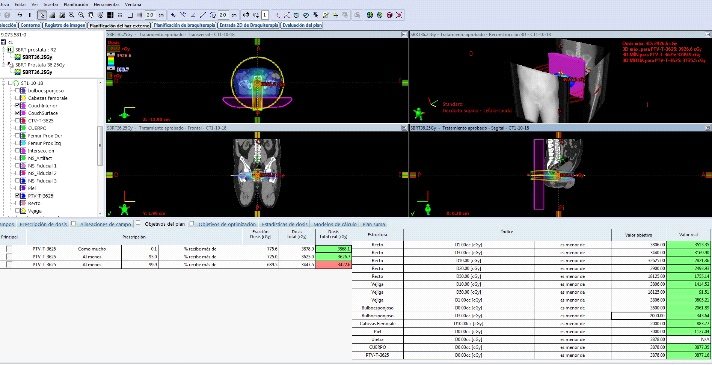
Fig. 7. Dosimetría con aprobación de parámetros de dosis en Target y órganos de riesgo. Las barras verdes, evidencian que el plan de Radioterapia estereotáxica está cumpliendo con los parámetros de seguridad sobre los órganos de riesgo con la dosis adecuado sobre la próstata. Cuando aparecen barras rojas, se pasa a un segundo nivel de seguridad, en donde las dosis del target aseguran la mínima posibilidad de toxicidad sobre los OAR.
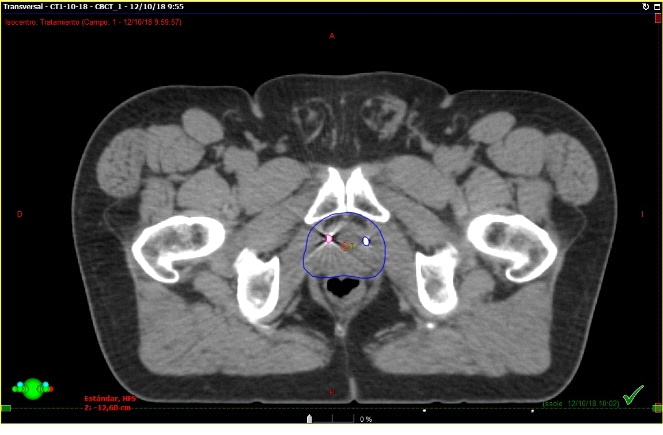
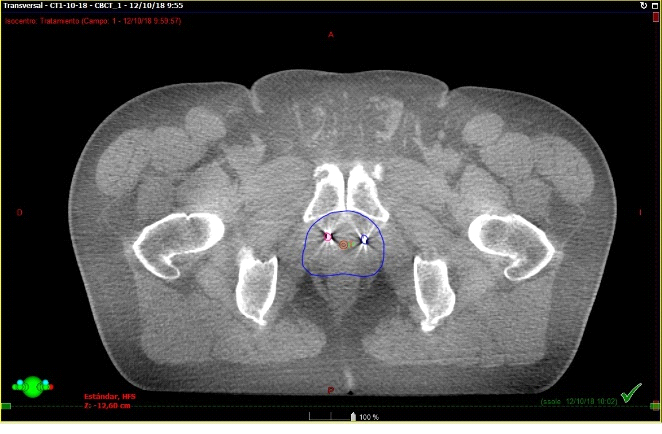
Fig. 8. Paciente en tratamiento. Esta imagen corresponde el conbeamCT que se realiza en cada sesión de tratamiento y se superpone con el TAC previo de simulación que tiene los contornos. El contorno azul fue realizado previamente en el TAC de simulación. Así sabemos que la dosis llegará sólo sobre ese sector.
BIbliografía
1. Guía NCCN y ESMO 2020 para cáncer prostático.
2. Martin RM, Donovan JL, Turner EL, et al. CAP Trial Group. “Effect of a Low-Intensity PSA-Based Screening Intervention on Prostate Cancer Mortality: The CAP Randomized Clinical Trial”. JAMA. 2018 Mar 6;319(9):883-895.
3. Freddie C. Hamdy, F.R.C.S.(Urol.), F.Med.Sci., et al. For the ProtecT Study Group “10-Year Outcomes after Monitoring, Surgery, or Radiotherapy for Localized Prostate Cancer” N Engl J Med 2016; 375:1415-1424
4. Holmberg L, Bill-Axelson A, Steineck G, et al. “Results from the Scandinavian Prostate Cancer Group Trial Number 4: a randomized controlled trial of radical prostatectomy versus watchful waiting”. J Natl Cancer Inst 2012 Dec;2012(45):230-3
5. Moschini, Zattoni F, Boorjian SA, et al. “Risk Stratification of pN+ Prostate Cancer after Radical Prostatectomy from a Large Single Institutional Series with Long-Term Followup” J Urol. 2016 Jun;195(6):1773-8.
6. Vincenzo Pagliarulo , Debra Hawes , Frank H. Brands , Susan , Lazar AA3. “Radical Prostatectomy Versus Radiation and Androgen Deprivation Therapy for Clinically Localized Prostate Cancer: How Good Is the Evidence?”. 2015 Dec 1;93(5):1064-70
7. Wallis CJD, Saskin, Nam RK. “Surgery Versus Radiotherapy for Clinically-localized Prostate Cancer: A Systematic Review and Meta-analysis”. Eur Urol. 2016 Jul; 70 (1): 21-30.
8. Pollack A Zagars GK Starkschall G et al. “Prostate cancer radiation dose response: results of the M D Anderson phase III randomized trial”. Int J Radiat Oncol Biol Phys. 2002; 53: 1097-1105
9. Peeters ST Heemsbergen WD Koper PC et al. “Dose-response in radiotherapy for localized prostate cancer: results of the Dutch multicenter randomized phase III trial comparing 68 Gy of radiotherapy with 78 Gy”. J Clin Oncol. 2006; 24: 1990-1996
10. Jackson WC, Silva J, Hartman HE, Dess RT, Kishan AU, Beeler WH, et al. «Stereotactic body radiation therapy for localized prostate cancer: A systematic review and meta-analysis of over 6,000 patients.» Eur Urol. 2019;75(3):337-346.
11. M. Roach D. Hunt C.A. Lawton I. et al. Radiation Therapy Oncology Group (RTOG) 9413: “A Randomized Trial Comparing Whole Pelvic Radiation Therapy (WPRT) to Prostate Only (PORT) and Neoadjuvant Hormonal Therapy (NHT) to Adjuvant Hormonal Therapy (AHT)” Int J Radiat Oncol Biol Phys October 1, 2013Volume 87, Issue 2, Supplement, S106–S107
12. Pisansky TM, Hunt D, Gomella LG, et al. “Duration of androgen suppression before radiotherapy for localized prostate cancer: radiation therapy oncology group randomized clinical trial 9910”. J Clin Oncol. 2015 Feb 1;33(4):332-9.
13. Carrie C, Magné N, Burban-Provost P, et al. “Short-term androgen deprivation therapy combined with radiotherapy as salvage treatment after radical prostatectomy for prostate cancer (GETUG-AFU 16): a 112-month follow-up of a phase 3, randomised trial” Lancet Oncol. 2019 Dec; 20(12):1740-1749.
14. Tendulkar RD, Agrawal S, Gao T, Efstathiou JA, et al. “Contemporary Update of a Multi-Institutional Predictive Nomogram for Salvage Radiotherapy After Radical Prostatectomy” J Clin Oncol. 2016 Oct 20; 34(30):3648-3654.
15. Nicholas D James, Matthew R Sydes, Noel W Clarke, Malcolm D Mason “Addition of docetaxel, zoledronic acid, or both to fi rst-line long-term hormone therapy in prostate cancer (STAMPEDE): survival results from an adaptive, multiarm, multistage, platform randomised controlled trial”. The Lancet. Vol 387 March 19, 2016
16. Fonteyne V, MD, Guy , Arcangely S. “Hypofractionated High-Dose Radiation Therapy for Prostate Cancer: Long-Term Results of a Multi-Institutional Phase II Trial” World J 2012 Jun 28; 4 (6): 241-6
17. Catton CN, Lukka H, Gu CS, Martin JM, et al. “Randomized Trial of a Hypofractionated Radiation Regimen for the Treatment of Localized Prostate Cancer”. J Clin Oncol. 2017 Jun 10;35(17):1884-1890
18. David Dearnaley, Isabel Syndikus, Georges Sumo,”Conventional versus hypofractionated high-dose intensitymodulated radiotherapy for prostate cancer: results from the CHHiP randomised controlled trial, Lancet Oncol 2016; 13: 43–54
19. Robert Lee, James J. Dignam, Mahul B. Amin, et al. “Randomized Phase III Noninferiority Study Comparing Two Radiotherapy Fractionation Schedules in Patients With Low-Risk Prostate” , JCO VOLUME 34 • NUMBER 20 • JULY 10, 2016
20. Incrocci L, Wortel R, Aluwini S, “Hypofractionated versus conventionalle fractiones radiotherapy for patients with localized cancer (HYPRO): final efficacy results from randomized multicenter, open label-phse 3 trial” Lanc onc, 2016 Vol 17, Iss 8, P1061-69
21. King CR. “The timing of salvage radiotherapy after radical prostatectomy: a systematic review”. Int J Radiat Oncol Biol Phys. 2012;84(1):104-111. doi:10.1016/j.ijrobp.2011.10.069
22. Seth A. Rosenthal, MD; Chen Hu, PhD; Oliver Sartor, MD; et al. “Effect of Chemotherapy With Docetaxel With Androgen Suppression and Radiotherapy for Localized High-Risk Prostate Cancer: The Randomized Phase III” NRG Oncology RTOG 0521 Trial
23. William U. Shipley, M.D.,Wendy Seiferheld, M.S., Himanshu R. Lukka, M.D., et al. For the NRG Oncology RTOG* “Radiation with or without Antiandrogen Therapy in Recurrent Prostate Cancer” N Engl J Med February 2, 2017; 376:417-428.
24. B.R; K. Winter M.G. Sanda M. Amin W.S. Bice Jr. “Initial Report of NRG Oncology/RTOG 0232: “A Phase 3 Study Comparing Combined External Beam Radiation and Transperineal Interstitial Permanent Brachytherapy With Brachytherapy Alone for Selected Patients With Intermediate-Risk Prostatic Carcinoma” Int J Radiat Oncol Biol Phys October 1, 2016Volume 96, Issue 2, Supplement, Page S4
25. W. James Morris , Scott Tyldesley , Howard H Pai , et al. “ASCENDE-RT*: A multicenter, randomized trial of dose-escalated external beam radiation therapy (EBRT-B) versus low-dose-rate brachytherapy (LDR-B) for men with unfavorable-risk localized prostate cancer”. J Clin Oncol 33, 3-3(2015).
26. Yasuo Yoshioka, MD∗,∗, Osamu Suzuki, MD∗, PhD∗ “High-Dose-Rate Brachytherapy as Monotherapy for Intermediate- and High-Risk Prostate Cancer: Clinical Results for a Median 8-Year Follow-Up”. Int J Radiat Oncol Biol March 15, 2016Volume 94, Issue 4, Pages 675–682.
27. Hauswald, Kamrava MR, Fallon JM, et al. “High-Dose-Rate Monotherapy for Localized Prostate Cancer: 10-Year Results”. Int J 2016 Mar 15;94(4):667-74..IJROBP.2015.07.2290. 2015 Aug 5
28. Matthew C. Abramowitz, Tiaynu Li, MA2Mark K. Buyyounouski, et al. “The Phoenix Definition of Biochemical Failure Predicts for Overall Survival in Patients With Prostate Cancer” CANCER January 1, 2008 / Volume 112 / Number 1
29. Pasquier D, Martinage G, Janoray G, Rojas P. “Salvage Stereotactic Body Radiation Therapy for local Prostate Cancer Recurrence After Radiation Therapy a retrospective Multicenter Study of the GETUG”. IJRORP, 2019 Nov, Vol105.
30. Weiss C, et al. “Radiochemotherapy after transurethral resection for high-risk T1 bladder cancer: an alternative to intravesical therapy or early cystectomy?” JCO 2006; 24 (15): 2318-24.
31. Dahl D, et al. “Bladder-preserving trimodality treatment for high – grade T1 bladder cancer: results from phase II protocol” NRG Oncology/RTOG 0926. JCO 2024;42(34):4095-4102
32. Mak R, et al. “Long-term outcomes in patients with muscle-invasive bladder cancer after selective bladder-preserving combined-modality therapy: a pooled analysis of Radiation Therapy Oncology Group protocols 8802, 8903, 9506, 9706, 9906, and 0233”. JCO 2014;32(34):3801-9
33. James N, et al. “Radiotherapy with or without Chemotherapy in Muscle-Invasive Bladder Cancer”. NEJM 2012;366:1477-88
34. Hall E, et al. “Chemoradiotherapy in muscle – invasive bladder cancer: 10-yr follow up pf the phase 3 randomised controlled BC2001 trial”. Eur Urol 2022;82:273-9
35. Arcangeli G, et al. “Radical cystectomy versus organ-sparing trimodality treatment in muscle-invasive bladder cancer: A systematic review of clinical trials”. Critical Reviews in Oncology/Hematology 2015;95:387-96
36. Zlotta A, et al. “Radical cystectomy versus trimodality therapy for muscle-invasive bladder cancer: a multi-institutional propensity score matched and weighted analysis”. Lancet Oncol 2023;24:669-81
37. Choudhury A, et al. “Hypofractionated radiotherapy in locally advanced bladder cancer: an individual patient data meta-analysis of the BC2001 and BCON trials”. Lancet Oncol 2021;22:246-55
38. Zaghloul M, et al. “Adjuvant sandwich chemotherapy plus radiotherapy vs adjuvant chemotherapy alone for locally advanced bladder cancer after radical cystectomy. A randomized phase 2 trial”. JAMA Surg 2018;153(1):e174591
39. Fonteyne V, et al. “Adjuvant radiotherapy after radical cystectomy for patients with high-risk muscle – invasive bladder cancer: results of a multicentric phase II trial”. Eur Urol Focus 2022;8(5):1238-45
40. Verghote F, et al. “Adjuvant radiotherapy after radical cystectomy for muscle – invasive bladder cancer: a phase 2 trial – Results of secondary endpoints”. Eur Urol Focus 2025. Feb 18:S2405-4569(25)00042-2.
41. Zaghloul M, et al. “The value and safety of adjuvant radiation therapy after radical cystectomy in locally advanced urothelial bladder cancer: a controlled randomized study”. Int J Rad Oncol Biol Phys 2024;120(3):658-66
42. Murthy V, et al. “Bladder adjuvant radiation therapy (BART): acute and late toxicity form a phase III multicenter randomized controlled trial”. Int J Rad Oncol Biol Phys 2025;121(3):728-36
43. “Adjuvant radiotherapy in patients with pathological high-risk bladder cancer” (GETUG-AFU 30) (Bladder-ART). NCT03333356
44. NRG-GU001. “Randomized Phase II Trial of Postoperative Adjuvant IMRT Following Cystectomy for pT3/pT4 Urothelial Bladder Cancer”. Eapen L. NCT02316548
45. Warde P, et al. “Result of a policy of surveillance in stage I testicular seminoma”. Int J Radiat Oncol Biol Phys. 1993;27:11-15
46. Papachristofilou A, et al. “Single-dose carboplatin followed by involved-node radiotherapy for stage IIA and stage IIB seminoma (SAKK 01/10): a single-arm, multicentre, phase 2 trial”. Lancet Oncol. 2022 Nov;23(11):1441-1450.
47. Fossa S.D, et al. “Optimal planning target volume for stage I testicular seminoma: A Medical Research Council Randomized Trial”. JCO 1999;17:1146-54
48. Classen J, et al. “Radiotherapy for stages IIA/B testicular seminoma: Final report of a prospective multicenter clinical trial”. JCO 2003;21:1101-6
49. Chung PW, et al. “Appropriate radiation volume for stage IIA/B testicular seminoma”. Int J Radiat Oncol Biol Phys 2003;56(3):746-8
50. Jones WG, et al. “Randomized trial of 30 versus 20 Gy in the adjuvant treatment of stage I testicular seminoma: A report on Medical Research Council Trial” TE18, European Organization for the Research and Treatment of Cancer Trial 30942. JCO 2005;23:1200-8.
51. Chung P, et al. “Stage II testicular Seminoma: Patterns of recurrence and outcome of treatment”. Eur Urol 2004;45:754-60
52. Tandstad T, et al. “Management of seminomatous testicular cancer: A binational prospective population-based study from the swedish norwegian testicular Study Group”. JCO 2011;29:719-25
53. Travis L, et al. “Second cancer among 40576 testicular cancer patients: Focus on Long term survivors”. JNCI 2005;97(18): 1354-65
54. Van den Belt-Dusebout A, et al. “Treatment – specific risks of second malignancies and cardiovascular disease in 5 year survivors of testicular cancer”. JCO 2007;25:4370-8
55. Pandey D, et al. “Prognostic factors in node‐positive carcinoma of the penis”. J Surg Oncol 2006;93(2): 133-8
56. Horenblas S, et al. “Lymphadenectomy for squamous cell carcinoma of the penis. Part 2: the role and technique of lymph node dissection”. BJU Int 2001;88(5):473-83
57. Sarin R, et al. “Treatment results and prognostic factors in 101 men treated for squamous carcinoma of the penis”. Int J Rad Oncol Biol Phys 1997; 38 (4): 713-22
58. Ozsahin M, et al. “Treatment of penile carcinoma: to cut or not to cut?”. Int J Rad Oncol Biol Phys 2006; 66 (3): 674-9
59. Hasan S, et al. “The role of brachytherapy in organ preservation for penile cancer: A meta-analysis and review of the literature”. Brachytherapy 2015;14 (4): 517-24
60. Horenblas S, et al. “Squamous cell carcinoma of the penis. III. Treatment of regional lymph nodes”. Jour urol 1993;149:492-7
61. Chen M, et al. “Contemporary management of penile cancer including surgery and adjuvant radiotherapy: an experience in Taiwan”. World J Urol 2004;22:60-6
62. International Penile Advanced Cancer Trial (International Rare Cancers Initiative Study) (InPACT). Clinical Trials.gov Identifier: NCT02305654
63. Korzeniowski M, et al. “Contemporary role of radiotherapy in the management of penile cancer”. Transl Androl Urol 2017;6(5):855-67
64. Muneer A, et al. Penile cancer: ESMO – EURACAN Clinical Practical guidelines for diagnosis, treatment and follow up. ESMO open 2024;9(7):103481
65. National Comprehensive Cancer Network Guidelines NCCN, Penile Cancer. Version 2.2025.
66. Mittal R, et al. “Recommendations and clinical validation of inguinal clinical target volume delineation in penile cancer”. Int J Rad Oncol Biol Phys 2021;111(3):741-53
67. Verhoeven RHA, et al. “Scrotal cancer: incidence, survival and second primary tumours in the Netherlands since 1989”. BJC 2010;103:1462-6
68. Bouhout T, et al. “Leiomyosarcoma of scrotum: case report”. Pan African Medical Journal 2018;31:238
69. St. Claire K, et al. “Extramammary Paget disease”. Dermatology Online Journal 2019;25(4):1
70. Hata M, et al. “Postoperative radiation therapy for extramammary Paget’s disease”. BJD 2015;172:1014-20
71. Özkur E, et al. “Primary scrotal melanoma: it is time to destigmatize genital lesions”. An Bras Dermatol 2019
72. Kupelian P, Mehta NH, King C, Steinberg M, Finkelstein SE, Fernandez E. “Stereotactic body radiation therapy for prostate cancer: rational and reasonable”. Pract Radiat Oncology. 2015; 5 (3): 188 – 92.
73. Kishan A, Dang A, Katz A et al. Long-term Outcomes of Stereotactic Body “Radiotherapy for Lo-Risk and Intermediate-Risk Prostate Cancer”. JAMA Network Open. 2019; 2 (2): e188006
74. Van As, N., et al. (2024). “PACE-B: Phase III trial of stereotactic body radiotherapy versus conventional/moderately hypofractionated radiotherapy for localized prostate cancer”. N Engl J Med, 391(15), 1413–1425.
75. Van As, N., et al. (2024). “PACE-A: An international phase III randomized controlled trial comparing stereotactic body radiotherapy to surgery for localized prostate cancer”. N Engl J Med.
76. Fuller D, Wurzer J, Shirazi R et al. “Retreatment for Local Recurrence of Prostatic Carcinoma after prior therapeutic irradiation: Efficacy and Toxicity of HDR-Like SBRT”. Int J Radiat Oncol Biol Phys. 2020 Feb 1;106(2): 291-299.
77. Pasquier D, Martinage G, Janoray G et al. “Salvage Stereotactic Body Radiation Therapy for Local Prostate Cancer Recurrence after Radiation Therapy: A Retrospective Multicenter Study of the GETUG”. Int J Radiat Oncol Biol Phys. 2019 Nov 15;105(4):727-734
78. Palma, D. A., et al. (2019). “Stereotactic ablative radiotherapy for the comprehensive treatment of oligometastatic cancers: Long-term results of the SABR-COMET phase II randomized trial”. JCO 38(25), 2830–2838.
79. Siva, S., et al. (2024). “Stereotactic ablative body radiotherapy for primary kidney cancer (TROG 15.03 FASTRACK II): A non‑randomised phase 2 trial”. Lancet Oncol, 25(3), 308–316
80. De Meerleer G, Khoo V, Escudier B et al. “Radiotherapy for renal-cell carcinoma”. Lancet Oncol 2014; 15: e170–77
81. Siva S, Louie AV, Warner A, Muacevic A, Gandhidasan S, Ponsky L, et al. “Pooled analysis of stereotactic ablative radiotherapy for primary renal cell carcinoma: a report from the International Radiosurgery Oncology Consortium for Kidney (IROCK)”. Cancer 2018;124:934–42.

