Introducción
En este capítulo se describen paso a paso diferentes aspectos de las cirugías que desarrollamos más frecuentemente y en donde la vía de abordaje laparoscópica tiene claros beneficios para nuestros pacientes. Tiene como propósito guiar en forma simple y didáctica a los urólogos en sus primeros pasos en cirugía laparoscópica, con el fin de planificar y desarrollar una estrategia quirúrgica, evitando complicaciones y frustraciones que puedan alejarlos de esta valiosa herramienta. Las sugerencias vertidas en este manual son un compendio que resume muchos años de experiencia, fraguando conceptos y fundamentos encontrados tanto en el análisis de nuestros casos como el de otros autores. Nuestros consejos no pretenden ser la “verdad revelada”. Claramente pueden existir puntos de vista divergentes que, si se apoyan en una fundamentación y conceptos atendibles, asociados a buenos resultados y reproducibles en el tiempo, deben ser considerados y utilizados de acuerdo al criterio y preferencia de cada laparoscopista. La utilidad de estos consejos está respaldada tanto por nuestros propios resultados como también por los grados de competencia y logros obtenidos por residentes de urología y urólogos que se han capacitado en programas liderados o en los que participan algunos de los autores de este capítulo. Al cabo de un año, los urólogos en una formación laparoscópica normalizada, realizan complejas cirugías con similares resultados. Una vez tomada la decisión de proyectarse como cirujano laparoscópico, es deseable tener una buena base en cirugía tradicional abierta y siempre es bueno, en un inicio, adosarse a un equipo de trabajo consolidado en cirugía laparoscópica, especialmente en un programa de enseñanza estructurado y validado. Por último, en la era robótica pudiera no ser tan “seductor” para los urólogos jóvenes capacitarse en cirugía laparoscópica. La plataforma robótica constituye una herramienta de gran valor, principalmente por su desarrollo tecnológico y la mayor facilidad que brinda a los urólogos para adquirir habilidades en cirugía mínimamente invasiva. Sin embargo, en países como Chile, a pesar de notorios avances en cuanto a accesibilidad de esta tecnología (incluyendo dos hospitales de la red pública en Santiago y otro en La Serena, además de varios centros privados y de hospitales de las fuerzas armadas), en el corto y mediano plazo seguirá siendo una minoría de nuestra población la que podrá acceder a esta tecnología. Esta realidad es compartida por la mayoría de los otros países latinoamericanos. Adicionalmente, con la experiencia de más de 20 años de cirugía robótica en el mundo, en la evaluación de las distintas variables, su ventaja respecto al abordaje laparoscópico “tradicional” sigue siendo materia de controversia en muchos procedimientos. La cirugía laparoscópica puede ser difundida y reproducida ampliamente en zonas y centros de mediana complejidad con excelentes resultados y a un costo razonable, sin la necesidad imperiosa de contar con una plataforma robótica. En lo que no hay discusión es que el mínimo trauma producido por la cirugía laparoscópica, especialmente en el abdomen superior, hacen imperativo adquirir estas habilidades a los urólogos.
Preparación pre operatoria
Como en cualquier cirugía en la cual el paciente recibirá anestesia general, deben tenerse en cuenta las comorbilidades y el uso de anticoagulantes con antelación, con el fin de optimizar la condición de salud de nuestro paciente y evitar posibles complicaciones. Excepcionalmente indicamos al paciente realizar una preparación intestinal y por lo general la recomendamos en aquellos pacientes con sobrepeso o a quienes realizaremos una linfadenectomía lumboaórtica. Esta preparación tiene por objetivo disminuir el contenido y gases del intestino para aumentar el espacio de trabajo. Recomendamos una dieta líquida 24 horas antes de la cirugía y el uso de 3 litros de polietilenglicol a tomar en 8 -10 horas. Idealmente el paciente debe estar hospitalizado para recibir el aporte de soluciones glucosalinas. Hemos observado que el polietilenglicol cumple con el objetivo de vaciar el intestino de material fecal y gas. Cuando utilizamos fosfosodas, el intestino queda limpio, pero, con abundante gas en su interior disminuyendo significativamente el tamaño del campo quirúrgico, dificultando una cirugía cómoda y segura. Rutinariamente utilizamos una profilaxis antibiótica durante la inducción anestésica. La elección de la profilaxis antibiótica debe realizarse en base a las normativas y sensibilidades antibióticas reportadas localmente. En nuestro centro, utilizamos cefalosporinas de primera generación.
Disposición del pabellón
Es de gran importancia la adecuada ubicación de los distintos equipos, consolas, fuentes de poder y del mismo equipo quirúrgico en el pabellón. En el caso de las cirugías transperitoneales, tanto el cirujano como el primer ayudante (cámara) se sitúan de frente al abdomen del paciente, y el segundo ayudante y la instrumentista por el dorso del paciente, enfrentando a los dos primeros. La torre de laparoscopía debe estar situada al frente del cirujano y detrás del segundo ayudante, con el monitor a la altura de los ojos y en una angulación cómoda con el objeto de mantener una adecuada ergonomía. Si la torre está separada de los monitores, como es el caso de nuestros pabellones, ésta debe ubicarse en el lugar en el cual genere menor interferencia para el equipo quirúrgico. El monitor esclavo debe ubicarse detrás del cirujano enfrentando al segundo ayudante e instrumentista quirúrgico. Idealmente todos los cables, fibras y conductos deben venir desde el rack hacia el cirujano y fijados en un solo punto para evitar que se produzcan enredos durante el transcurso de la cirugía. Para las cirugías con acceso retroperitoneal, se invierten las posiciones descritas (Figura 1).
Posición del paciente
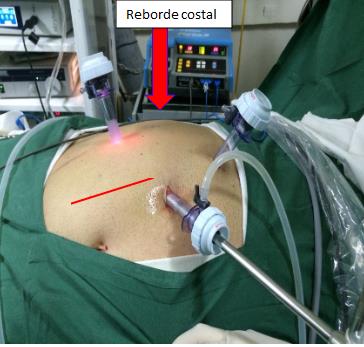
Una adecuada posición del paciente debe cumplir con dos objetivos principales: Proveer un campo quirúrgico cómodo para la ejecución de la cirugía y evitar el riesgo de complicaciones derivados de la compresión de plexos nerviosos o puntos de apoyo. La posición del paciente debe ser simple y fisiológica, evitando complejizar el acto anestésico y la utilización de elementos poco comunes dentro del pabellón. La posición varía dependiendo del territorio a abordar. En el caso de la cirugía pélvica, el paciente debe ser posicionado en decúbito dorsal con ambos brazos aducidos al costado del tronco (Figura 2). Si la cirugía es abdominal, la posición que recomendamos es la siguiente: Estando el paciente anestesiado y en decúbito dorsal, se alinea el reborde costal con el punto de quiebre de la mesa (Figura 3).
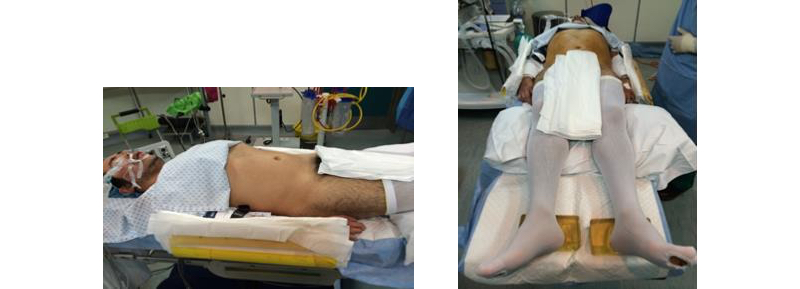
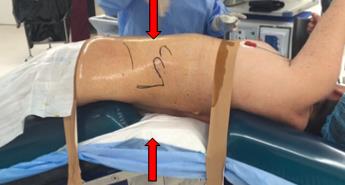
Posteriormente se rota suavemente al paciente hasta un ángulo aproximado de 45 grados(1,2). La cabeza se acomoda y posiciona de tal modo que queden sin tensión los músculos del cuello. En la cintura escapular, se apoya la escápula en la mesa de operaciones sin la necesidad de utilizar un rollo axilar. Esta posición evita cualquier tipo de daño en el plexo braquial y permite una mejor mecánica ventilatoria del paciente. En nuestra experiencia, no hemos advertido que posicionar al paciente en un ángulo de 90 grados, con respecto a la mesa quirúrgica, permita una mejor exposición del campo quirúrgico con respecto a ubicarlo en un ángulo de 45 grados. Probablemente, en cirugía robótica, en donde el espacio del dorso del paciente está completamente ocupado por la plataforma robótica e impide ubicar un ayudante en este sitio, es que se prefiera los 90° para optimizar la separación de las vísceras por gravedad. La espalda se apoya en un rollo de gel de 20 cm de diámetro (Figura 4). Cabe hacer notar que tanto el brazal como la piernera ginecológica, vienen como accesorios por defecto con la mayoría de las mesas quirúrgicas, por lo tanto, en la mayoría de los casos, están disponibles en el recinto del pabellón.
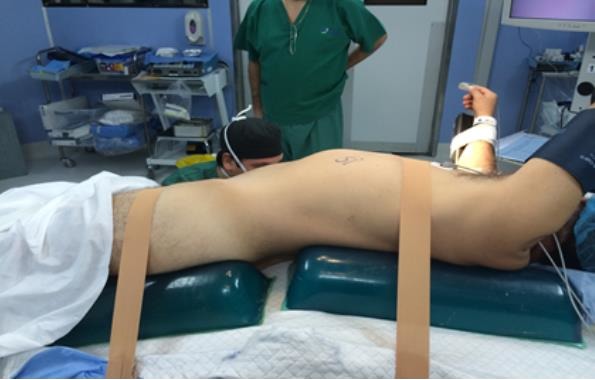
En la cadera se aplica lo mismo, dejándola a unos 45 grados. En el apoyo del glúteo superior se utiliza un rollo similar a la espalda. Es importante utilizar dos rollos separados y no uno continuo, especialmente en cirugías realizadas mediante abordaje retroperitoneal (Figura 4). Esto evita la interferencia mecánica con los instrumentos durante la cirugía. Las piernas están protegidas con medias anti embólicas y es deseable contar con botas neumáticas. Se interpone una almohada entre ambas extremidades inferiores, posicionando en semi flexión a la que se encuentra en contacto con la mesa. Los puntos de contacto con la mesa deben ser protegidos con almohadillas de gel (Figura 5)(2).
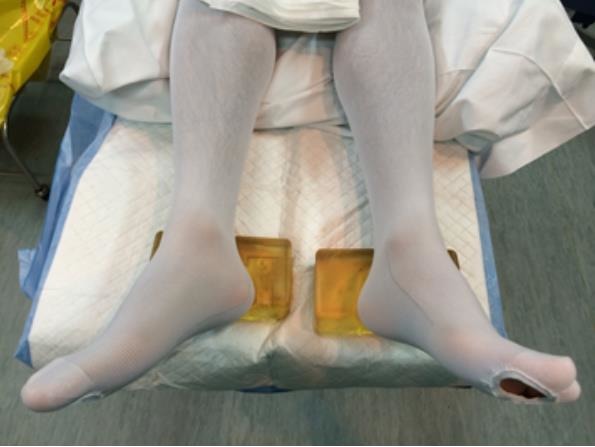
Si la cirugía se realiza mediante abordaje transperitoneal, el abdomen debe estar alineado con el borde de la mesa. En el caso del abordaje retroperitoneal, el dorso debe estar lo más cerca del borde de la mesa. No hay otras diferencias de posición entre estos distintos abordajes. El brazo inferior se apoya en su antebrazo logrando una semi flexión. El brazo superior se apoya en una piernera ginecológica tradicional. Se debe cuidar que ambos queden en una posición fisiológica de relajo. El aspecto final es como si el paciente adoptara una posición de clavado o piquero al entrar al agua (Figura 6).
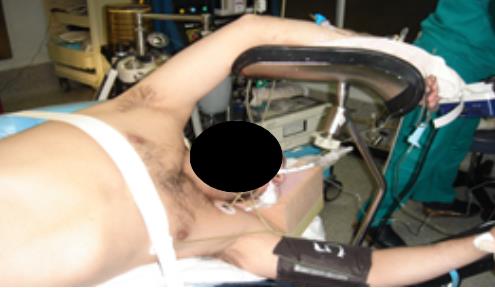
Se flexiona la mesa con el objetivo de obtener la mayor distancia entre el reborde costal y la cresta ilíaca, ampliando el campo quirúrgico. Esto adquiere la mayor relevancia cuando se trata de un abordaje retroperitoneal (Figura 7).
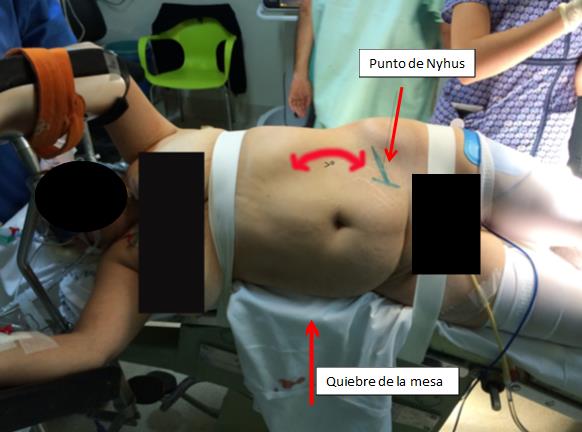
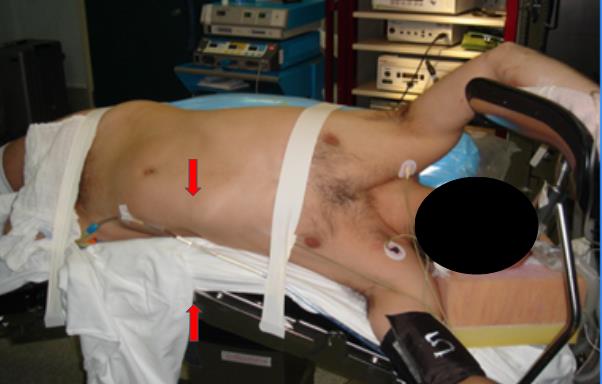
Finalmente, el paciente es fijado, sin tensión a la mesa, con tela adhesiva. Una en el tórax dejando libre el apéndice xifoides y otra en la cadera a nivel del trocánter mayor. Esto permite acceder sin interferencias a sitio de Nyhus(3), habitualmente utilizado para la extracción piezas quirúrgicas. Tan importante como la posición del paciente, es la posición corporal que adopte el cirujano. Ubicado en su punto correcto respecto del paciente, debe lograr una posición de relajo con el peso del cuerpo distribuido equitativamente en ambos pies. Se debe dejar el pedal del electrocauterio en una posición cómoda y fácil de alcanzar y utilizarlo solo cuando se requiera, evitando tener un pie sobre este y producir un desbalance. Los hombros deben estar relajados dados por la altura de la mesa quirúrgica y como mencionamos anteriormente, la pantalla idealmente debe estar a la altura de los ojos. Esta recomendación que parece tan simple, cuando no se cumple, resulta en una dolorosa y persistente contractura muscular.
Pneumoperitoneo
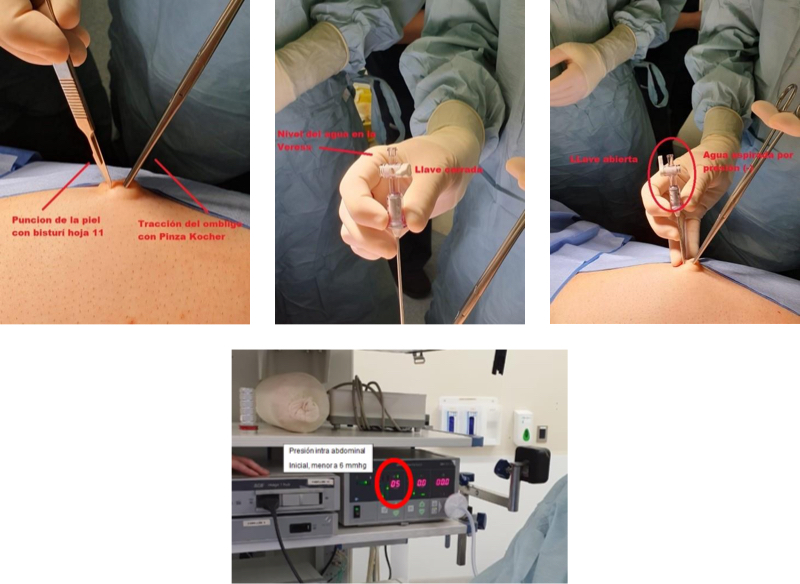
Habitualmente utilizamos una punción umbilical con aguja de Veress para realizar el pneumoperitoneo. Sujetamos el ombligo con una pinza de Kocher para traccionar la pared abdominal mientras se efectúa la punción con la aguja (Figura 8)(4). Este es el único paso “ciego” en la creación del pneumoperitoneo. Para asegurarnos que la aguja esté en la cavidad abdominal, esta es cebada con solución fisiológica (SF) y esperamos que sea absorbida por la menor presión dentro del abdomen. Confirmada esta situación, irrigamos con presión, un volumen aproximado de 10 cc de SF para desprender vísceras o epiplón de la aguja y asegurarnos de insuflar el CO2 dentro de la cavidad peritoneal. Al comenzar a insuflar CO2, la presión intra abdominal no debe ser superior a 6 mmHg(5-7). En los obesos mórbidos las presiones de inicio pueden ser superiores. Cuando se alcanzan 15 mmHg, pueden instalarse los trócares y se retira la aguja de Veress.
Vale la pena comentar que, en nuestra experiencia, hemos utilizado casi todos los otros puntos posibles de punción, (con el propósito de evitar una punción exclusiva para el pneumoperitoneo), teniendo mayores tasas de inconvenientes que utilizando la cicatriz umbilical. Pneumoperitoneo abierto En escasas oportunidades es necesario acceder a la cavidad abdominal mediante una pequeña incisión y abrir directamente el peritoneo para instalar el trocar de la cámara. Esto ocurre cuando el paciente tiene historia de múltiples cirugías previas y se corre el riesgo de lesionar en forma inadvertida una víscera adherida a la pared abdominal. Una vez instalado el trocar se ajusta a la incisión para evitar la fuga de CO2 (5-7). En nuestra práctica usamos esta técnica en no más del 1% de los casos.
Instalación de trócares
Respecto al tipo de trócares, hay una gran variedad disponible en el mercado. Preferimos que sean transparentes, con punta roma, con una válvula universal y con un sistema de retención para evitar desplazamientos y pérdidas inadvertidas del pneumoperitoneo (Figura 9). Es deseable que sean de un diámetro de 10-12 mm para proporcionar versatilidad en el uso de instrumentos de diferente diámetro, con ambas manos. La adecuada colocación de los trócares de trabajo es fundamental para una cirugía exitosa.
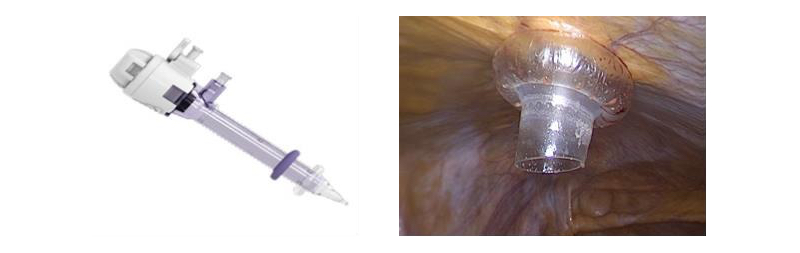
Se debe realizar una incisión holgada en la piel, evitando que quede muy ajustada al trocar, para que no se produzca un daño isquémico en ésta. Se posiciona la punta roma del trocar ejerciendo una presión suave y mantenida con un movimiento rotatorio de la muñeca hasta que, por desgaste de la aponeurosis y separación de las fibras musculares, el trocar llegue suavemente a la cavidad abdominal. Una presión excesiva podría producir una entrada violenta en el abdomen y lesionar alguna víscera. La introducción del primer trocar es ciega, los restantes se introducen controlados bajo visión directa(6). Al finalizar la cirugía es importante revisar los sitios de punción para evidenciar sangrados y controlarlos. Rutinariamente suturamos la aponeurosis de las punciones mayores a 10 mm para evitar hernias. En la piel usamos sutura intradérmica para un mejor resultado estético.
Inserción de trócares para abordaje transperitoneal
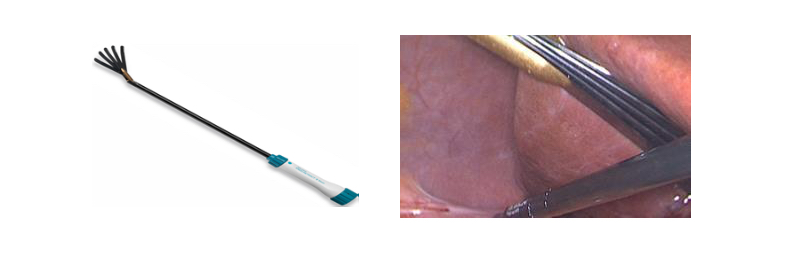
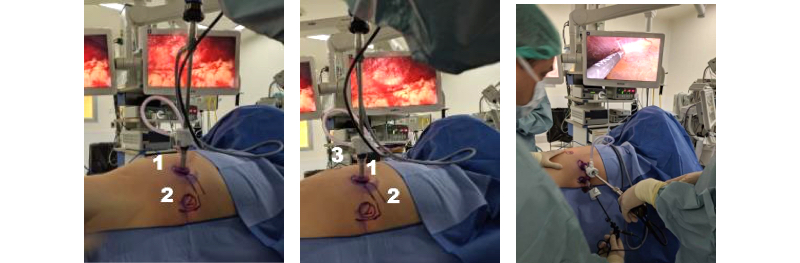
No existen normas rígidas para esto, sino más bien, depende de las preferencias y experiencia del cirujano. En nuestro caso, insertamos un primer trocar de 10-12 mm para rectal, a nivel de la 12° costilla, con el objetivo que quede situado al mismo nivel en el cual se encuentra el polo inferior del riñón. A través de este trócar introducimos una óptica de 30° (2,6). Con la ayuda de la transiluminación proporcionada por la fibra óptica, realizamos la instalación de dos trócares de trabajo de 10-12 mm, separados al menos por 8-10 cm y paralelos al reborde costal, formando un triángulo con el trocar de la cámara. Los trócares accesorios pueden variar en su diámetro dependiendo del uso que se les quiera dar. Por ejemplo, nosotros utilizamos un trocar de 5 mm para una pinza accesoria de 5 mm y uno de 10-12 mm para el separador articulado (Figuras 10 y 11).

Instalación de trócares para abordaje retroperitoneal
El espacio retroperitoneal es el ambiente natural del urólogo. Tiene la ventaja que nos permite acceder rápidamente al hilio renal evitando movilizar el intestino, por lo tanto, es ideal en pacientes con cirugías abdominales múltiples, antecedentes de peritonitis o pacientes con tumores o quistes renales de cara posterior. También es nuestro sitio de abordaje preferido para la suprarrenal izquierda. Como desventaja, presenta un reducido espacio de trabajo y los puntos de reparo anatómicos son más difíciles de visualizar(8). Los tres sitios que deben reconocerse en este acceso son: La fascia renal o de Zuckerkandl, el músculo psoas lumbar y el, a veces tenue, ligamento arqueado medial del diafragma. Perpendicular a este ligamento se encuentra en forma constante el hilio renal. Aun cuando la mayoría de las cirugías se pueden realizar por la vía trans peritoneal, dominar este acceso puede significar un menor trauma quirúrgico para el paciente y es un valioso recurso para el laparoscopista experto. En relación a la posición, el paciente se ubica en 45° con el dorso lo más cerca del borde de la mesa, mientras que los rollos de gel deben estar separados para evitar interferencias con el instrumental laparoscópico durante la cirugía (Figura 12).
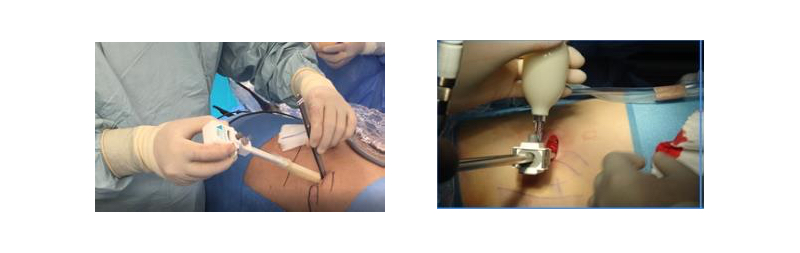
En la instalación de trócares para el acceso retroperitoneal, se utiliza como punto de referencia, el ángulo que se forma entre la 12va costilla y la musculatura paravertebral (ángulo costo vertebral). Se instala el primer trócar a 8-10 cm del punto de referencia, ingresando con la tijera cerrada para divulsionar el tejido hasta alcanzar la fascia dorso-lumbar. Luego, con el dedo índice se ingresa al espacio retroperitoneal, lo cual se confirma palpando o “enganchando” la parrilla costal. No es recomendable forzar o ampliar el trayecto con el dedo, dado que se puede producir una artrosis en la articulación distal quedando con una secuela dolorosa y permanente (Figura 13).
Posteriormente, a través del trayecto creado, se introduce el balón disector del retroperitoneo (ejemplos: Spacemaker™ Structural Balloon Trocar, Covidien; Kii® Dissecting Balloon Access Systems, Applied Medical), lo que permitirá crear un espacio exangüe, bajo visión directa, para la intervención quirúrgica (Figuras 14 y 15). El segundo trócar no debe quedar muy cerca de la musculatura paravertebral, para favorecer su movilidad durante la cirugía. Para la instalación del tercer trócar, se debe desplazar con pinza roma el borde del peritoneo hacia medial, para evitar perforaciones de este.
Asistencia de cámara
Este es uno de los elementos claves en el desarrollo de una cirugía laparoscópica. Puede hacer la diferencia entre una cirugía exitosa o sufrir frustraciones y complicaciones que pongan en riesgo al paciente. Utilizamos de rutina una óptica de 30°. Esto permite observar el campo quirúrgico con una magnificación de 20x, desde arriba, abajo y por los lados, lo que constituye una ventaja por su variabilidad de visión, aún en la era robótica. Existe una óptica de punta flexible que da una angulación de 120° y permite mirar desde atrás, pero es de difícil manejo, los instrumentos nunca van a seguir este curso y, por tanto, no la utilizamos. En nuestra experiencia, una de las principales dificultades se origina en que la cámara la maneja un par urólogo, quien pretende “operar” con la cámara y no realiza la labor de mostrar lo que el cirujano necesita ver. Considerando este punto, algunos consejos: los movimientos siempre deben ser lentos, pausados y mínimos. Se agradece la estabilidad. El campo de acción siempre debe estar en el centro de la pantalla. Si se necesita ampliar el campo para ubicar los instrumentos, se debe retroceder la cámara sin perder de vista el campo de acción, aunque el objetivo quede momentáneamente en un rincón de la pantalla. Esto permite al cirujano mantener una perspectiva espacial del abdomen. Para moverse de un punto a otro, la cámara debe retroceder lentamente, bascular hasta alinearse con el destino y acercarse lentamente. El otro punto importante es mantener el horizonte. La incomodidad que produce el perderlo, puede hacer que el cirujano cometa errores que conlleven a un accidente. La extrema cercanía del objetivo, a veces, dificulta establecer un horizonte correcto. Para orientarse, el camarógrafo puede tener en cuenta el nivel de los líquidos (sangre, agua) o tener en cuenta la posición de entrada de los instrumentos, que debe ser siempre la misma. El camarógrafo debe mantener una distancia adecuada del objetivo. Cuando el cirujano esté acomodándose o logrando una adecuada presentación, un campo amplio. Cuando diseca estructuras, un campo cercano.
Instrucciones para la técnica de nudos laparoscópicos
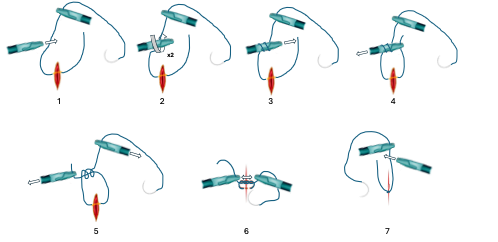
Un nudo adecuadamente confeccionado puede marcar la diferencia entre una grave complicación y un postoperatorio satisfactorio. Como se ilustra en la Figura 16, es esencial mantener ambos porta-agujas siempre en el campo de visión y cerca de la cola de la sutura donde se va a realizar el nudo.
- Realización del primer nudo (Figura 16-1 a 16-6):
- Con el porta-aguja derecho (o izquierdo si corresponde) atraviesa ambos bordes del tejido a suturar.
- Luego, con el mismo porta aguja derecho, sujeta el extremo unido a la aguja asegurándose de dejar suficiente longitud para permitir que con el porta izquierdo enrolle la hebra y logre tomar la cola libre.
- Realización del segundo nudo (Figura 16-7):
- En este caso, con el porta-aguja izquierdo toma el extremo que está unido a la aguja dejando nuevamente suficiente longitud.
- Ahora con la mano derecha enrolla la hebra y asegúrate de atrapar el extremo libre para completar el nudo.
La cantidad de nudos a realizar dependerá de las recomendaciones específicas para cada tipo de material de sutura.
Cirugías específicas
Adrenalectomía
Las glándulas suprarrenales tienen indicación de extirpación quirúrgica en tres situaciones bien definidas: Hallazgo de tumores funcionantes (incidentalomas o adenomas funcionantes), cuando el tamaño del tumor o por sus características radiológicas represente el riesgo de ser un cáncer adrenal primario o se sospeche una metástasis en la suprarrenal de otro tumor primario conocido(9,10). Los tumores funcionantes pueden llegar a ser un 15-20% de los incidentalomas y producen una morbilidad demostrada en el largo plazo, por la cual deben ser extirpados, independientes de su tamaño(10). Los adenomas no funcionantes deben mantenerse en seguimiento, debido que se ha demostrado que hasta un 10% desarrollará una hiperfunción en los próximos años(9,10). Cuando los tumores tienen un diámetro de >6 cm, tienen un riesgo de malignidad entre un 25% – 37%. Cuando tienen un diámetro >4 cm, el riesgo de malignidad es de 2% – 3%. Cuando el diámetro es de 3 cm el riesgo de malignidad es de 1% y es “dudosa” la indicación quirúrgica(11). Interesantemente, en las vesículas biliares el encontrar un pólipo de 1 cm de diámetro representa un riesgo de malignidad de un 1% y se extirpa en el 100% de los casos. Es decir para un mismo riesgo estadístico se aplican distintos criterios(12). Cabe señalar que cuando un tumor suprarrenal alcanza los 3 cm de diámetro, la glándula estará casi completamente reemplazada por este. Es claro que, mientras menor el tamaño del tumor, más fácil es la cirugía. En nuestro grupo recomendamos extirpar la glándula con un tumor mayor o igual a 3 cm de diámetro por las razones expuestas (Figura 17).
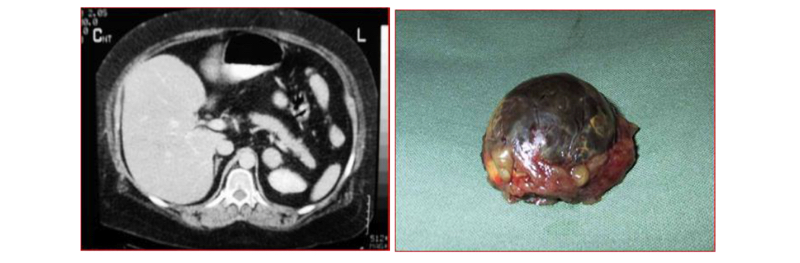
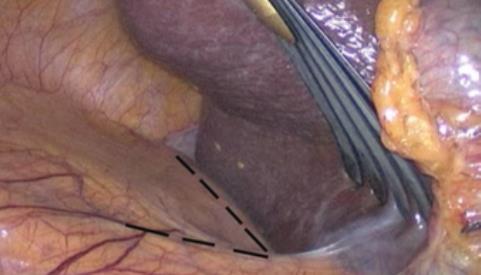
Al realizar la adrenalectomía se deben tener en cuenta dos objetivos fundamentales: Lo primero es ligar precozmente la vena suprarrenal, sin movilizar la glándula, para disminuir el riesgo de liberación de hormonas al torrente sanguíneo que puedan desencadenar una crisis hipertensiva, aun cuando no se haya demostrado la hiperfunción en la evaluación metabólica pre operatoria; lo segundo, cuando la indicación de la adrenalectomía es por sospecha de un carcinoma suprarrenal, la clave es no romper la glándula ya que tiene un riesgo de recidiva local de un 95% y la enfermedad en estas condiciones es incurable(13,14). Desde el punto de vista técnico, abordamos la glándula derecha por vía transperitoneal y la izquierda por vía retroperitoneal, empleando el principio aplicable a todas las cirugías, de lograr el mismo objetivo provocando el menor trauma quirúrgico al paciente. Para el abordaje transperitoneal del lado derecho, solo necesitamos levantar el hígado con un separador (Figura 18), exponiendo el ángulo que se forma entre la vena cava y el borde del hígado. En este punto la cava no tiene grasa y se observa por transparencia debajo del peritoneo parietal. Lograda esta exposición (a veces es necesario liberar adherencias para este efecto), se secciona superficialmente el peritoneo paralelo al borde hepático y al borde lateral derecho de la cava en forma de “siete”. En ese mismo ángulo se diseca la grasa en profundidad en dirección al músculo cuadrado lumbar y se accede precozmente a la vena suprarrenal derecha ya que es una constante anatómica. Para lograr exponer en forma adecuada este ángulo, recomendamos utilizar el separador articulado Endo RetractTM II. Hemos observado que otras formas de separar el hígado, por su peso y consistencia, son insuficientes para mostrar éste ángulo. Cuando el paciente presenta un hígado graso, recomendamos protegerlo interponiendo una gasa entre el retractor y el hígado.
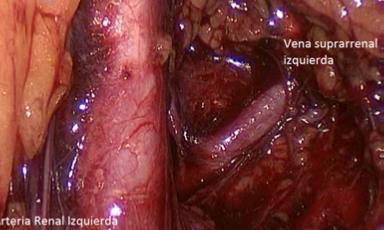
Habiendo cumplido el primer objetivo de controlar la vena suprarrenal, se disecan, controlan y seccionan las múltiples arterias que fijan la glándula, por fuera de la grasa extirpándola en bloque y cumplimos con el segundo objetivo de no comprometer la integridad del tumor durante su disección. Una vez liberada la pieza quirúrgica, esta se introduce en una bolsa de PVC para evitar la posibilidad de contaminación en el abdomen. Luego, después de revisada la hemostasia, aseo y recuento de los elementos utilizados, se retira la pieza por uno de los puertos de trabajo o por el sitio de Nyhus si el volumen de la pieza lo requiere. Para lograr una cirugía del modo descrito, recomendamos fuertemente el uso del separador Endo RetractTM II desechable, insertado desde la región lumbar derecha. Solo de esta manera levantamos el hígado en bloque permitiendo una presentación óptima del ángulo donde ubicamos la vena suprarrenal. Utilizar otro tipo de separación, como por ejemplo, una pinza desde el apéndice xifoide, anclado en la parrilla costal no logra la presentación que permite el Endo RetractTM II. Hemos observado que, al no lograr la presentación descrita, algunos urólogos compensan este déficit disecando primero la glándula dejándola fija de la vena suprarrenal para más tarde poder controlarla. De este modo, se pierde el objetivo de evitar la liberación de hormonas al torrente sanguíneo al manipular el tumor sin tener controlada la vena(15). En términos generales evitamos utilizar tecnologías que pudieran encarecer los procedimientos y que no aportan un real beneficio a la cirugía. En este caso, para el control y sección de las múltiples arterias que irrigan y fijan la glándula, utilizamos energía bipolar otorgada por una pinza de 5 mm LigasureTM que permite un proceso limpio, rápido y seguro. En el lado izquierdo, habiendo desarrollado el espacio quirúrgico con el balón disector, se secciona la fascia de Zuckerkandl para acceder al músculo psoas lumbar. Luego se asciende siguiendo el borde del psoas hacia cefálico hasta encontrar el ligamento arqueado medial del diafragma. En ese punto, invariablemente se encontrará el hilio renal ya que es una constante anatómica. Es de gran utilidad levantar o separar el riñón con una pinza o retractor ubicado desde la fosa iliaca izquierda para una buena exposición del hilio. Esta separación puede ser efectuada con una pinza de 5 mm a través de un trocar ad hoc. Con una cuidadosa disección, debemos exponer el borde cefálico de la vena renal. Desarrollado este paso, encontraremos la vena suprarrenal izquierda posada sobre el músculo psoas lumbar (Figura 19). A modo de un ejemplo didáctico, si ustedes miran el dorso de su mano izquierda con los dedos estirados, la mano y dedos corresponde a la vena renal y el pulgar a la vena suprarrenal izquierda. Es decir, hay que buscar la vena suprarrenal abajo posada sobre el psoas.
El control de la vena y la disección de la glándula son similares a lo descrito anteriormente para el lado derecho. Para este mismo efecto por vía transperitoneal, es necesario movilizar el colon descendente, seccionar el ligamento espleno renal, separar el bazo y la cola del páncreas lo que confiere al paciente un mayor trauma quirúrgico que el provocado en un acceso retroperitoneal. Cuando la glándula izquierda es de mayor volumen (Ej.; ≥ 5-6 cm), recomendamos acceder a ella por vía transperitoneal para disminuir el riesgo de ruptura. Para el lado derecho, cuando existen antecedentes de cirugías abdominales complejas, cirugía biliar y la probabilidad de extensas adherencias, la suprarrenalectomía se puede efectuar por el retroperitoneo(15). Una vez liberada la pieza, se extrae en una bolsa de PVC por un sitio de punción ampliado (habitualmente la punción utilizada para la cámara) o por el sitio de Nyhus.
Nefrectomía radical
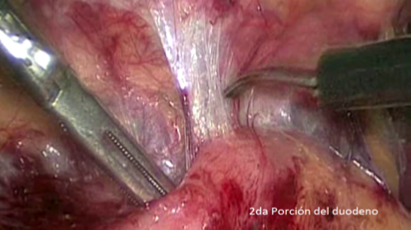
Debido a lo primitivo de los registros y comunicaciones de la época, la paternidad de la primera nefrectomía radical es controvertida. Las búsquedas muestran que la primera nefrectomía exitosa la realizó el cirujano alemán Gustav Simon en la Universidad de Heidelberg el año 1869. También hay testimonios que indican que el Dr. William Hingston, cirujano canadiense, en 1868 en el Hotel Dieu Hospital en Montreal, habría efectuado también una exitosa nefrectomía(16). Lo que sí está meridianamente claro es que 122 años después, en 1990, el Dr. Ralph Clayman en la Universidad de Washington (St. Louis), realizó la primera nefrectomía radical laparoscópica, la cual se transformó en la técnica estándar para la nefrectomía radical por cáncer(17,18). Esta cirugía puede efectuarse tanto por un acceso transperitoneal como retroperitoneal, dependiendo de las preferencias del cirujano o de las características particulares del paciente o tamaño del tumor. Cuando se realizan por el acceso transperitoneal, debe movilizarse ampliamente el colon derecho o izquierdo (incluyendo ángulos hepáticos y esplénicos), según corresponda, para extirpar en bloque la bolsa de Gerota y su contenido (Figura 20). En el lado derecho hay que hacer necesariamente una maniobra de Kocher (movilizar el duodeno) para acceder con comodidad al hilio renal (Figura 21).
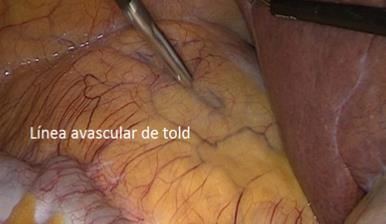
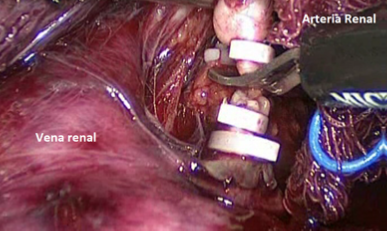
Una manera segura y sencilla de acceder al hilio renal es disecar la Gerota en su extremo caudal, separándola de su íntima unión con el músculo psoas lumbar. Una vez ubicado el hilio, este debe ser disecado para controlar por separado arteria y vena. Usamos clips de ligadura de polímeros en forma rutinaria (ejemplos: Hem-o-LockTM, Teleflex), dos proximales y uno distal (Figura 22).
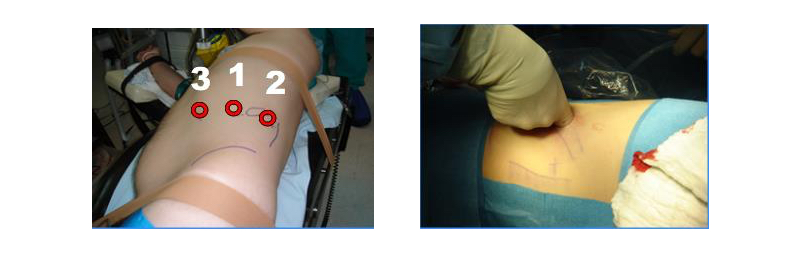
Se seccionan los vasos con tijera fría. En este punto se debe decidir preservar o no la glándula suprarrenal correspondiente o completar la disección del polo superior incluyendo la glándula en la bolsa de Gerota. En el lado izquierdo para preservar la glándula, se debe seccionar la vena renal entre la afluencia de la vena suprarrenal izquierda hacia la vena renal principal y el riñón, ubicar la cápsula renal y abandonar la glándula con la grasa que la rodea. En el lado derecho, posterior a ligar el hilio se debe ubicar la cápsula renal del polo superior dejando la glándula con la porción de grasa del polo superior que la rodea. Se completa la disección de la Gerota en forma roma. Por último se secciona el uréter y los vasos gonadales(19,20). Una vez liberada la pieza, se atrapa en una bolsa de PVC de 15 cm de diámetro y se extirpa por el sitio de Nyhus, previamente preparado (antes del pneumoperitoneo), marcando el sitio con un lápiz indeleble en la piel y disecando la fosa iliaca cuando la cirugía es retroperitoneal. Recomendamos hacer la marcación de este sitio antes de efectuar el pneumoperitoneo ya que, cambia la disposición anatómica con el abdomen insuflado. La ventaja del abordaje retroperitoneal es que se evita la disección de vísceras intraperitoneales. Como desventaja se tiene un campo quirúrgico más reducido.
Nefrectomía radical en casos complejos
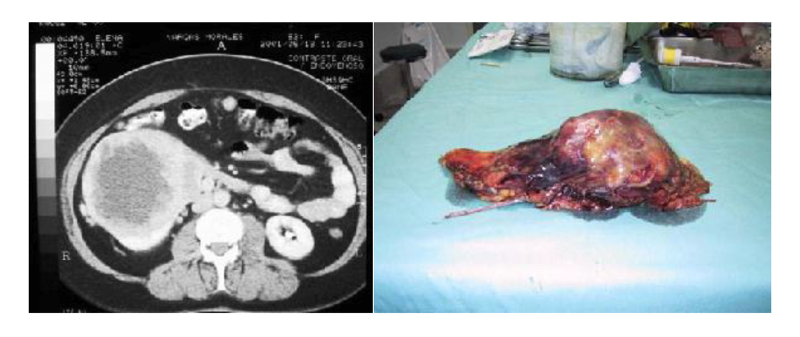
En relación al tamaño del tumor renal para la vía de abordaje, se ha demostrado que masas renales de > de 10 cm de diámetro, se pueden operar por vía laparoscópica. Determinamos que si los tumores son clínicamente localizados, el tamaño no fue un impedimento para la cirugía. Otros grupos presentaron experiencias similares y concluyeron que no hay diferencias en los resultados, tanto quirúrgicos como oncológicos(21,22) (Figura 23).
La nefrectomía radical laparoscópica en pacientes con trombo tumoral nivel I y II (T3b) es factible de realizar en manos expertas, manteniendo los principios oncológicos establecidos y la seguridad del paciente(23,24). Inicialmente, se accede por vía transperitoneal al riñón derecho, movilizando el colon y realizando una maniobra de kocher amplia para llegar sin dificultad al hilio renal y a los grandes vasos. Se debe disecar al vena cava por encima y por debajo del hilio renal, especialmente en su cara posterior. De manera habitual, se controlan y seccionan las arterias renales. Posteriormente, con pinzas atraumáticas se evalúa la posición del trombo en la cava. Se introduce una pinza Satinsky laparoscópica y se pinza parcialmente la vena cava, incluyendo el trombo. Esta maniobra evita el sangrado retrógrado por las venas lumbares que se produce al pinzar la cava en sus puntos distal y proximal a la afluencia de la vena renal. Se liga y secciona la vena renal, para tener mayor maniobrabilidad en el manejo de la vena cava. Se completa la disección de la pieza quirúrgica para tener mayor comodidad en la trombectomía. Luego, se efectúa la cavotomía con tijera fría y se extrae trombo. Finalmente, se sutura vena cava con polipropileno 4/0 y se comprueba hermeticidad (Figura 24).
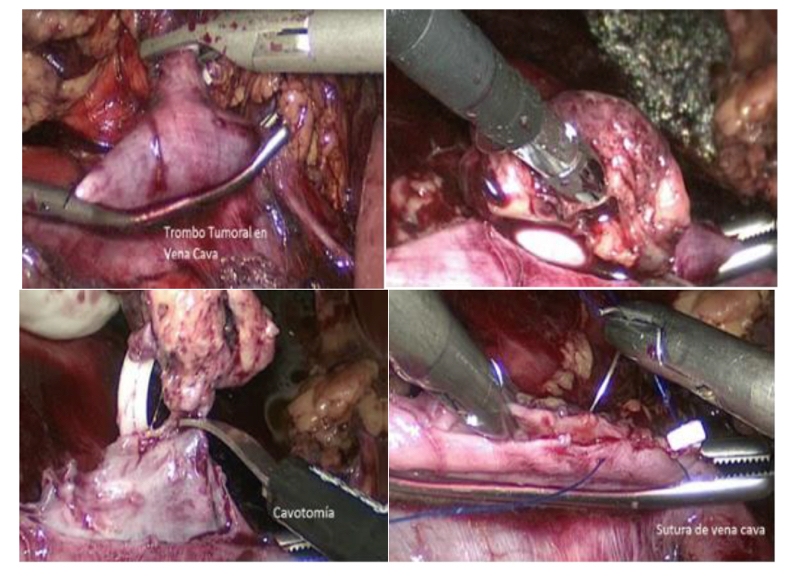
Quienes hemos tenido la experiencia de operar tumores renales con trombos en la cava, hemos sufrido el sangrado que se produce al no tener controladas las venas lumbares. Con trombos hasta nivel II según la clasificación de Novick(25) es posible realizar este procedimiento en forma segura cuando se cuenta con pinzas Satinsky laparoscópicas, disponibles en el mercado. Cuando no se cuenta con estos elementos o el trombo sobrepasa este nivel, es preferible hacer una cirugía abierta.
Nefrectomía parcial
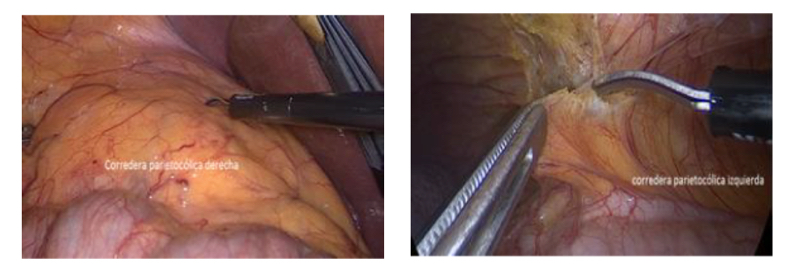
Sin duda es la técnica más demandante y compleja en nuestra práctica. También es donde hay mayor variabilidad técnica en los distintos grupos. Al no haber disponible publicaciones con el detalle de los protocolos quirúrgicos y sus resultados, explicaremos detalladamente nuestros conceptos y fundamentaciones, sin pretender una superioridad técnica respecto de otros protocolos, los cuales sólo mencionaremos. Para lograr esta cirugía con éxito se requiere considerar los objetivos de: 1) Extirpar el tumor con criterio oncológico; 2) lograr una reparación satisfactoria con el menor trauma posible y 3) evitar complicaciones que pongan en riesgo la unidad renal. Estos principios deben siempre tenerse en cuenta al planificar la cirugía, determinando la vía de abordaje, los instrumentos a utilizar y procedimientos accesorios(26,27). Habitualmente la resección del tumor y la reparación se ejecutan bajo isquemia por pinzamiento arterial, lo que otorga una mayor complejidad al procedimiento. Lo ideal es utilizar el menor tiempo de isquemia por pinzamiento arterial posible, pero, sin sacrificar los objetivos principales ni exponer al paciente a complicaciones(28). Conceptualmente preferimos referirnos a “tiempo de clampeo o pinzamiento” ya que la isquemia o daño isquémico puede transcurrir incluso posterior al despinzamiento vascular. El tiempo de pinzamiento involucra un daño tubular que habitualmente es transitorio y recuperable casi en un 100% de los casos a los tres meses de la cirugía. Esto se ha reportado en tiempos de pinzamiento cercanos a los 30 minutos, incluso en tiempos cercanos a los 60 minutos de isquemia caliente en modelos animales. En cambio, el daño isquémico producido por la reparación del defecto quirúrgico puede ser permanente e irreversible y lo peor, no advertido por el cirujano(29-32). Existen varias formas de lograr isquemia: isquemia a demanda; después de dejar preparado el hilio renal para su pinzamiento, en tumores exofíticos y fácilmente abordables, se puede iniciar la resección y pinzar la arteria cuando el sangrado impida continuar con un procedimiento seguro y cómodo. De este modo se pueden evitar algunos minutos de isquemia con un menor tiempo de pinzamiento vascular. Isquemia lograda por el “despinzamiento temprano o precoz” consiste en que, una vez resecado el tumor, se efectúa una sutura hemostática en el lecho y se despinza el hilio, continuando la reparación ahora sin isquemia por pinzamiento. Las veces que nos ha tocado observar esta maniobra, una cirugía controlada se convierte en una emergencia en que el cirujano con gran habilidad cohibe el sangrado con puntos hemostáticos previamente preparados. El problema es que tanto los puntos en el lecho del defecto quirúrgico, como los puntos hemostáticos realizados bajo una situación de emergencia, pueden provocar un mayor daño isquémico e irreversible. Nuestro grupo para estos efectos desarrolló la técnica de “reparación superficial” que describiremos más adelante. En nuestra práctica no recomendamos el despinzamiento precoz. Así como hay distintas formas de lograr la isquemia, hay varios métodos de pinzamiento: hiliar total, arterial selectivo y arterial súper selectivo. Cualquiera de estas formas, si logra un territorio exangüe para una cirugía controlada, es adecuado. Como primera opción, recomendamos un pinzamiento arterial selectivo. Si por la anatomía vascular es complejo disecar la arteria y separarla de la vena sin riesgo, recomendamos el pinzamiento hiliar total. Al incorporar la vena renal en el clampeo hiliar total, tenemos la impresión de un mayor sangrado debido a la congestión venosa. El pinzamiento arterial súper selectivo debiera reservarse para casos en que el esfuerzo quirúrgico lo justifique (monorreno, insuficiencia renal o que un estudio vascular identifique la arteria que irrigue el tumor). Los elementos para hacer el pinzamiento se pueden dividir en tangenciales y circunferenciales. Los tangenciales son las pinzas de Satinsky y las pinzas vasculares laparoscópicas tipo Bulldog. Los métodos circunferenciales están representados por el “torniquete de Rumel”. Este método probadamente produce daño en la pared vascular. Estando ampliamente disponibles los Bulldog laparoscópicos con aplicadores que permiten su introducción por trócares de 10 – 12 mm y por la razón antes mencionada, no recomendamos el uso del torniquete de Rumel(33). El abordaje lo determinamos de acuerdo a la ubicación del tumor. Si está en la cara anterior, por vía transperitoneal. Si el tumor está en la cara posterior, preferentemente abordamos la lesión por vía retroperitoneal. Esta regla tiene una excepción; los tumores ubicados en el polo superior y cara posterior. Esta ubicación, definida por nuestro grupo como uno de los tumores técnicamente más complejos, los abordamos por la vía transperitoneal. Por la vía retroperitoneal y la limitación que impone el reborde costal en la ubicación de los trócares, hace que los instrumentos queden tangenciales a la lesión, no pudiendo efectuar una resección ni reparación segura y cómoda. Para esta situación desarrollamos y protocolizamos una técnica de “rotación renal” que será descrita posteriormente(26). Con el propósito de parametrizar la dificultad o complejidad quirúrgica en una nefrectomía parcial, se desarrolló un sistema de puntaje (Renal Score) que consignamos en nuestra base de datos, pero, no lo utilizamos en las decisiones clínicas(34). Para el abordaje transperitoneal hacemos una distinción entre el lado derecho e izquierdo. Para el lado izquierdo es necesario movilizar el colon descendente incluyendo el ángulo esplénico para exponer ampliamente la Gerota. En el lado derecho, por el gran espacio que deja la corredera parietocólica, pudiera no ser necesario movilizar el colon ascendente. En este caso escindimos directamente el peritoneo y Gerota como un sólo cuerpo, llegando directamente al riñón (Figura 25).
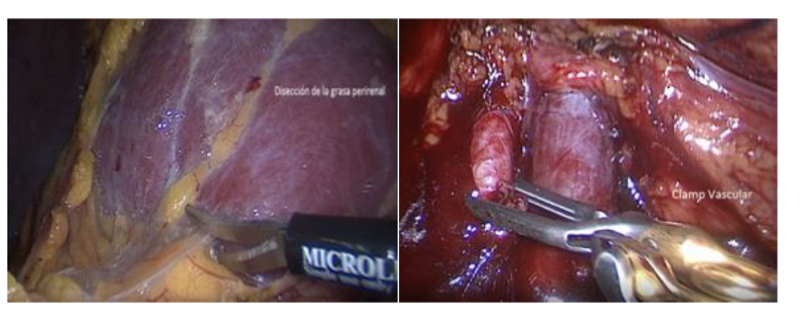
La dificultad que presenta este acceso directo es que el hilio de diseca desde el seno renal, con un mayor riesgo de provocar una lesión vascular. Para quienes tienen una menor experiencia, es recomendable hacer el camino largo, pero más seguro que es decolar el colon derecho, ubicar el plano entre la Gerota y el músculo psoas lumbar y abordar el hilio tal como fue descrito para la nefrectomía radical. Una vez expuesta la fascia de Gerota, la escindimos ampliamente de polo a polo provocándole el menor daño posible para que al posicionar nuevamente al riñón en su situación original, la podamos suturar. Como requisito para una nefrectomía parcial laparoscópica se requiere obtener una movilidad del riñón que permita posicionarlo para una resección controlada del tumor y una reparación satisfactoria. Muchas veces es necesario desprender el riñón completamente de su grasa peri renal, dejándolo fijo solo del hilio(26,35). Posicionamos el riñón de tal modo que la lesión sea resecable en forma segura y la posterior reparación sea efectuada en forma satisfactoria y cómoda. En el caso de los tumores ubicados en el polo superior y cara posterior, rotamos el riñón en 180 grados, exponiendo completamente la lesión que antes estaba arriba y detrás, quedando ahora adelante y abajo. Para lograr esta rotación ubicamos una pinza por detrás del polo superior levantándolo y simultáneamente con una pinza en la cara anterior empujamos el polo inferior(35). Una vez posicionado el riñón, efectuamos el pinzamiento vascular registrando el tiempo total. Antes de llegar a este punto, él o la instrumentista deben tener preparado las pinzas vasculares, las suturas hemostáticas y cualquier otro elemento que utilicen para la hemostasia, irrigador aspirador o instrumentos que habitualmente ocupan. Así mismo, el cirujano ya debe tener definida la estrategia de resección y de reparación. Este es el peor momento para improvisar. Rutinariamente utilizamos una pinza vascular laparoscópica tipo Bulldog adecuado para el tipo de pinzamiento; selectivo arterial o hiliar, según corresponda. Anterior a la aparición de aplicadores de pinzas laparoscópicas que caben por un trócar de 10-12 mm, preferíamos una pinza Satinsky recta por sobre pinzas pequeñas. Esto nos permite usar un puerto de 5 mm alejado de los trocares de trabajo, un control completo desde el exterior, un retiro del clamp sin riesgo de lesiones y sin necesidad de ir a buscarlos una vez terminada la cirugía. En la actualidad teniendo el aplicador antes mencionado evitamos hacer una punción exclusiva para la pinza Satinsky(35) (Figura 26).
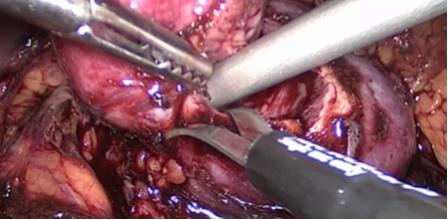
Asegurada la isquemia, resecamos la lesión con técnica de enucleación con tijera fría en la mano diestra y el aspirador (idealmente de trompeta) que permite presentarnos el sitio de sección y aspirar para obtener una visión completa durante todo el procedimiento. El segundo ayudante, con una pinza de 5 mm ubicada en el flanco, puede facilitar la presentación del tumor. Durante la disección si nos encontramos con un vaso mayor o vía urinaria, la controlamos con clips de titanio y seccionamos sobre estos para evitar perder tiempo en repararlos posteriormente. Esta técnica puede ser un poco más lenta que seccionar sobre tejido sano alejado del tumor, pero, preservamos mayor cantidad de tejido renal y se facilita la reparación sin sacrificar el resultado oncológico. En nuestra serie tenemos sólo tres recidivas locales en más de 250 casos (1,2%) (Figura 27).
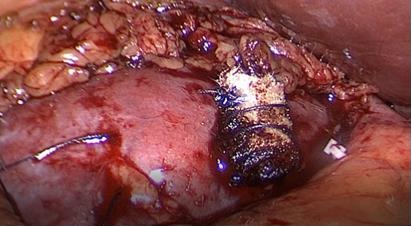
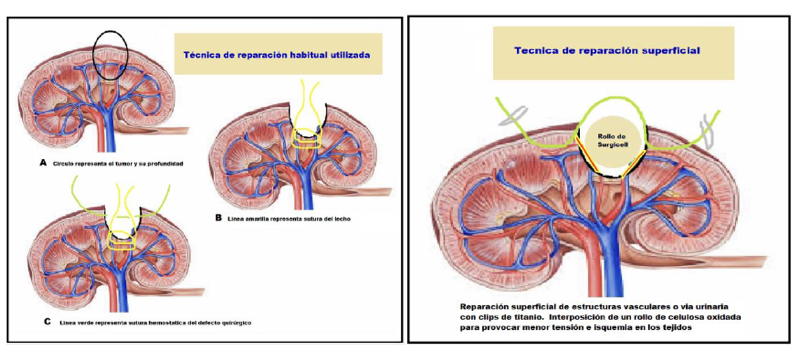
Antes de tener el dato de estas tres recidivas, liberábamos la pieza quirúrgica, abandonándola en el abdomen y comenzábamos rápidamente la reparación del defecto quirúrgico para no aumentar el tiempo de isquemia por pinzamiento. Actualmente antes de completar la resección, dejamos la pieza fijada al lecho por unos milímetros de tejido y la atrapamos en una bolsa de PVC de 10 cm. Ahora entonces, la abandonamos en el abdomen aislada en su bolsa, evitando una posible contaminación local. De rutina tomábamos varias muestras del lecho renal con una pinza saca bocado (biótomo) para un informe histológico contemporáneo. Con tantos casos realizados y siempre con biopsias negativas, no hacemos, en la actualidad, biopsia contemporánea y de paso disminuimos los costos de la cirugía. Frecuentemente electrodesecamos la superficie del lecho con energía monopolar a 100 W de potencia en modo spray(36). Rellenamos el defecto quirúrgico con un rollo de celulosa oxidada (Surgicel®), aplicamos una matriz hemostática con trombina sintética (Surgiflo®) en el fondo con una sonda de alimentación 10F y usamos una sutura hemostática con puntos separados de poliglactina 910 (Vicryl®) tensionados y asegurados con clip de ligadura de polímero (Hem-o-LockTM) en sus extremos sin cambiar las líneas de fuerza y evitamos rebanar el parénquima. Liberamos la pinza arterial y comprobamos la ausencia de sangrado (26,35). Esta reparación difiere a la que realizan muchos grupos y creemos que nuestra técnica produce un menor daño en el tejido renal que queremos preservar(37). Lo primero es que durante la resección controlamos en forma contemporánea vasos mayores y estructuras de la vía urinaria con clips de titanio, antes de seccionarlos. Otros grupos utilizan de rutina puntos en el lecho tumoral para contener el sangrado y reparar una vía urinaria inadvertidamente abierta. Con estos puntos “ciegos” se podrían incluir inadvertidamente arteriolas y venas provocando una mayor isquemia y/o favoreciendo la creación de una fístula arterio-venosa. Los puntos hemostáticos que utilizamos no se profundizan más allá de la corteza renal en donde no comprometemos la integridad de arteriolas ni vía urinaria(26,37) (Figura 28).
Realizamos aseo de la cavidad abdominal, si es necesario, con abundante agua bidestilada. Reponemos el riñón en la bolsa de Gerota, suturándola con un punto continuo de material reabsorbible. Se extirpa la bolsa con la lesión integra por un sitio de punción, si el tamaño lo permite o por el sitio de Nyhus. Se completa el procedimiento verificando la ausencia de sangrado en los sitios de punción, común a todas las cirugías. En resumen, nuestra técnica de nefrectomía parcial contempla: resección del tumor por enucleación y reparación de estructuras vasculares o vía urinaria con clips en la superficie del lecho tumoral que no comprometen otras estructuras profundas. La reparación del defecto quirúrgico con puntos superficiales separados de material absorbible sobre un rollo de celulosa oxidada. Con esto necesitamos menor tensión y provocamos menor daño isquémico (técnica de reparación superficial) (Figura 28).
Nefrectomía parcial en tumores intrarrenales
La ubicación 100% endofítica de un tumor renal es infrecuente y su manejo quirúrgico es un desafío para el urólogo. Pese a la ubicación desfavorable de estos tumores y la complejidad del abordaje, mediante una técnica quirúrgica sistemática y reglada, es posible plantear, en este complicado escenario clínico, una nefrectomía parcial laparoscópica como tratamiento alternativo a la nefrectomía radical, con iguales resultados oncológicos y un mínimo daño del parénquima renal(38). Como requisito mínimo en la planificación quirúrgica se requiere de una tomografía computada con fase contrastada de eliminación (UroTC). Las distintas fases de este estudio permiten ubicar el tumor y su relación con estructuras vasculares y de la vía urinaria. A partir de estos datos, se puede escalar en la sofisticación de la planificación desde simples mediciones hasta la impresión tridimensional en plástico del riñón comprometido. Es deseable disponer de ecografía intracorpórea laparoscópica y teniendo en cuenta la infrecuente posibilidad de una fístula arteriovenosa, contar con el apoyo de un radiólogo intervencionista. Afortunadamente en nuestro departamento contamos con todos estos elementos. Sin embargo, en muchos casos nos basamos en simples mediciones para la planificación. El objeto es determinar: La medida del tumor, la distancia desde al menos dos puntos de reparo anatómico fácilmente reconocibles y la profundidad desde la corteza al tumor. La ecografía la utilizamos para comprobar que la ubicación del tumor coincide con nuestras mediciones. Cuando determinamos la ubicación del tumor, hacemos una incisión longitudinal en la corteza (teniendo en cuenta la profundidad) que sea 1 o 2 cm superior al diámetro de la lesión por cada lado. Mientras más profundo el tumor, mayor longitud del corte. Esto nos permite abrir como un “sandwich” el parénquima y el exceso del corte, respecto de la medida del tumor, nos permite enuclearlo con comodidad. La reparación de las estructuras y del defecto quirúrgico lo realizamos de la misma manera descrita anteriormente. Al hacerlo de esta manera, con una cuidadosa disección, llegaremos directamente sobre la lesión permitiéndonos una resección controlada. Basado en estudios de daño renal en cirugía percutánea, inferimos que con un corte longitudinal se produce un menor daño que al resecar un trozo de riñón que contenga el tumor(39) (Figura 30).

Hemos realizado esta técnica en múltiples casos de tumores 100% intrarrenales. No hubo conversión a cirugía abierta ni necesidad de nefrectomía radical. Ningún paciente presentó recidiva local hasta la fecha y los parámetros quirúrgicos no variaron respecto a cirugías de tumores con una complejidad habitual(38).
Linfadenectomía lumboaórtica
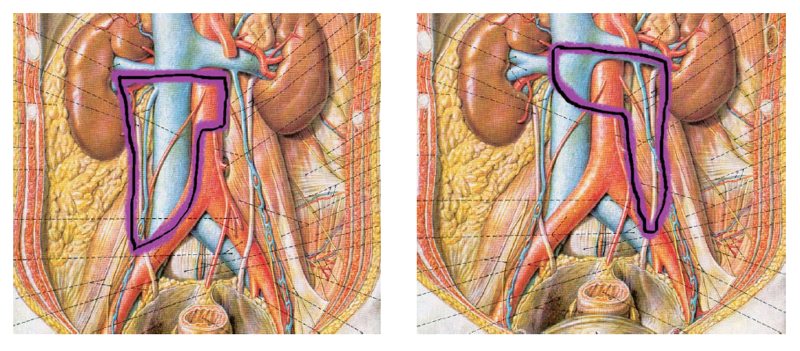
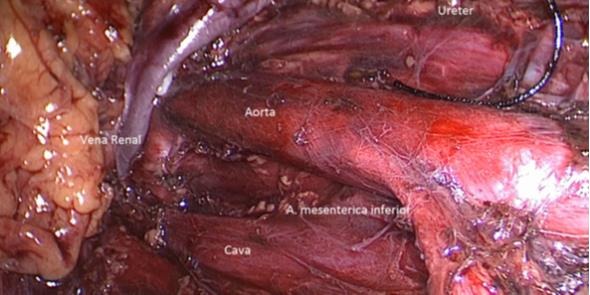
Los tumores testiculares no seminomatosos en etapa I tienen un riesgo de presentar micro metástasis en el retroperitoneo cercano al 30% de los casos, especialmente, si hay factores de riesgo en la biopsia del tumor testicular. Es hasta ahora controvertida la opción terapéutica a ejecutar y la linfadenectomía lumboaórtica (LALA) es una de ellas. También tema actual de controversia es la conveniencia de realizar la uni o bilateralidad de la linfadenectomía. La gran ventaja de la LALA es que tiene cerca de un 100% de sensibilidad y especificidad, aún en la era de la tomografía por emisión de positrones (PET) y representa una alternativa a los protocolos de observación (40-42). Sin ahondar en la controversia, explicaremos en forma sencilla esta técnica cuya mayor complejidad reside en el posible daño a un vaso mayor pudiendo transformar un procedimiento reglado en una emergencia. Otro aspecto a considerar es la edad del paciente en que la preservación de la función eyaculatoria es fundamental. En estos casos la ubicación del paciente es igual que la anteriormente descrita para la cirugía renal. Utilizamos el trócar de la cámara en la cicatriz umbilical y el trócar más caudal desplazado hacia la fosa ilíaca correspondiente. Una vez logrado el pneumoperitoneo, tan importante como la minuciosa extirpación del espécimen linfático, es lograr previamente una amplia exposición de los límites a disecar: si el límite superior es la vena renal, la disección debe abarcar al menos unos centímetros sobre el hilo renal y lo mismo para los demás límites. De esta manera se podrá efectuar un procedimiento cómodo, completo y seguro. Muchas veces se falla en estos detalles básicos que pueden frustrar el éxito de la cirugía y poner en riesgo al paciente. Indistintamente del lado, el abordaje que realizamos es transperitoneal. Hay limitadas experiencias de abordaje retroperitoneal que no han sido suficientemente reproducidas y podrían tener su espacio solo en excepcionales circunstancias(43). En ambos casos es necesario movilizar ampliamente el colon respectivo para exponer los grandes vasos y los límites de disección propuestos por Weissbach (Figura 31). Los límites superiores están determinados por el borde inferior de las venas renales y el límite inferior por el cruce del uréter sobre los vasos ilíacos. Los límites laterales están demarcados por los uréteres. En el lado derecho es necesario levantar el hígado y para esto utilizamos el Endo Retract™ II o también se puede utilizar una pinza de 5 mm desde el apéndice xifoides fijado en la pared costal. Es necesario realizar una maniobra de Kocher para movilizar el duodeno y exponer los grandes vasos al lado derecho. Logrado este tiempo, se extirpa todo el material linfático de las regiones para cava, supra cava e interaorto cava. Rutinariamente extirpamos los ganglios supra aórticos por sobre la arteria mesentérica inferior. Utilizamos una pinza y disector común para separar el espécimen linfático de las estructuras vasculares. Cuando tenemos una perfecta identificación de éstos, usamos un LigasureTM Maryland de 5 mm para sellar y seccionar los linfáticos. Evitamos seccionar los vasos lumbares ya que, dado que, de existir metástasis ganglionares, éstas se desarrollarían ventrales a los vasos(44). Una vez liberado el espécimen linfático, este se extrae en una bolsa de PVC por uno de los sitios de punción. Ocasionalmente después de establecida una rigurosa hemostasia, instalamos en el lecho quirúrgico una matriz hemostática con trombina sintética para disminuir el riesgo de un linfocele. Para el lado izquierdo realizamos el mismo procedimiento descrito anteriormente, evitando disecar y lesionar los nervios simpáticos responsables de la eyaculación anterógrada, ubicados por sobre la aorta debajo del nacimiento de la arteria mesentérica inferior (45) (Figura 32).
Varicocele y denervación testicular
En nuestro Departamento contamos con andrólogos que prefieren resolver estos casos mediante un abordaje abierto subinguinal utilizando microcirugía. Para establecimientos que no cuenten con este apoyo y equipos, una buena alternativa es la vía laparoscópica. El concepto quirúrgico aplicado al tratamiento del varicocele y el dolor testicular crónico es similar. Por esta razón la explicación siguiente es válida para ambas situaciones. El paciente se ubica en decúbito dorsal con los brazos adosados al cuerpo y con un Trendelemburg moderado. Se punciona la cicatriz umbilical con un trócar de 2 mm de diámetro. Se efectúa el pneumoperitoneo y se inspecciona la pelvis con una óptica de 2 mm de 0 grados. En la fosa ilíaca izquierda se instala otro trócar de 2 mm para una pinza ad hoc y en la fosa ilíaca derecha, un trócar de 5 mm para permitir el paso de un aplicador de clips de 5 mm. Se ubica el orificio inguinal profundo y unos 2–3 cm hacia proximal de la reflexión del conducto deferente. Sobre los vasos espermáticos se efectúa una peritoneotomía de 1 cm. Se toma el cordón en bloque y con una suave contra tracción se aísla y preserva la arteria testicular utilizando un disector tipo Maryland. El resto del cordón se clipa y secciona en bloque. Estaremos tratando todas las venas del cordón y seccionando la mayoría de los filetes nerviosos responsables en la inervación sensitiva del testículo. Solo quedarán indemne los nervios que transcurren junto con la arteria testicular que preferimos preservar. Revisión de la hemostasia con una baja presión del pneumoperitoneo y por último el retiro de los trócares bajo visión directa(46) (Figuras 32 y 33).
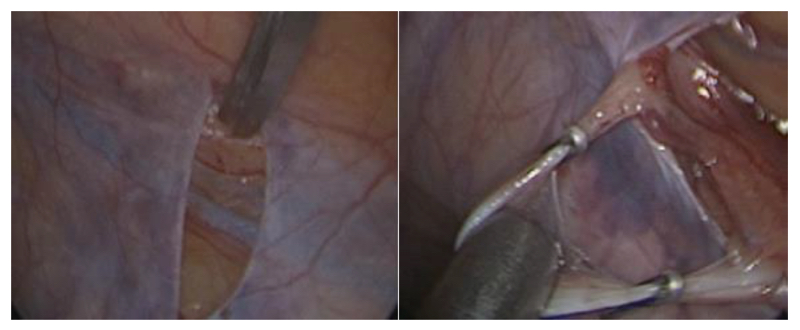
Cirugía pélvica urológica laparoscópica
En los últimos 30 años, la urología adoptó el abordaje laparoscópico (convencional o asistido por robot) con gran rapidez para patologías retroperitoneales. Sin embargo, este no ha sido el caso para patologías urológicas de la pelvis, las que, por distintos motivos, se resuelven regularmente por vía abierta o endoscópica. Existen distintas razones que explican esta situación, principalmente relacionadas con la noción de que se trata de procedimientos extremadamente complejos, con una curva de aprendizaje elevada y falta de ventajas clínicas relevantes cuando se compara con los abordajes tradicionales. La asistencia robótica ha permitido superar muchos de estos preconceptos, permitiendo al urólogo familiarizarse con procedimientos rutinarios como la prostatectomía radical, la cistectomía, la linfadenectomía pelviana, la ureterectomía y otros reconstructivos como el neoimplante ureterovesical. Gracias a esto, se ha podido verificar que el abordaje mínimamente invasivo en cirugía pélvica urológica presenta claras ventajas en cuanto a reducción de la morbimortalidad quirúrgica con menos sangrado, menor dolor postoperatorio días de hospitalización y complicaciones de corto, mediano y largo plazo(47). Por otra parte, ha habido un claro desarrollo tecnológico en relación con instrumentos e insumos en cirugía laparoscópica que ha facilitado el aprendizaje y ejecución de estos procedimientos: mejor visión con torres 4K o 3D, suturas barbadas, suturas mecánicas, trócares avanzados que no filtran, energía avanzada ultrasónica o bipolar, mejoras en el pneumoperitoneo, etc. En esta sección describiremos los detalles de algunos procedimientos quirúrgicos en patologías urológicas pélvicas clásicas, haciendo hincapié en trucos que permiten su desarrollo en forma cómoda y segura. Cabe precisar que es primordial el desarrollo de un programa de entrenamiento que permita depurar las técnicas a describir antes de iniciar un programa de cirugía pélvica urológica laparoscópica que sea exitoso.
Aspectos generales de la cirugía laparoscópica pélvica urológica
1.- Posicionamiento del paciente Habitualmente posicionamos al paciente en posición de litotomía con Trendelemburg forzado, con una angulación de 25° a 30°. La posición de litotomía permite tener la torre laparoscópica cerca y frente al cirujano y, a su vez, que la zona perineal quede fácilmente accesible para maniobras de compresión perineal. Alternativamente puede quedar con las extremidades inferiores extendidas, con abducción de la cadera (Figura 35). Es habitual encontrarnos con mesas quirúrgicas que poseen inclinómetro. Si no existe, siempre se puede echar mano a distintas aplicaciones que existen para teléfonos móviles, ampliamente disponibles hoy en día. Esta posición conlleva 2 problemas inherentes que es necesario resolver. a) Fijación: Producto de la inclinación necesaria el paciente tenderá a desplazarse hacia cefálico. El paciente puede fijarse de tres maneras:
-
- Telas adhesivas: Ampliamente disponibles, sin embargo no siempre logran su objetivo, lo que es especialmente válido en pacientes muy obesos.
- Hombreras: Relativamente disponibles en todos los centros. Presentan el problema de interferir con la posición del cirujano y/o eventualmente causar problemas de compresión del nervio supraescapular.
- Cojines especializados: Excelentes en cuanto a eficacia incluso en pacientes muy obesos con la ventaja de que no generan interferencia con la posición del cirujano ni problemas de compresión por puntos de apoyo. Su problema: el costo y poca disponibilidad. Habitualmente hay que solicitarlo como insumo (precio U$ 100-150) por paciente. Es posible, si se cuida de no mancharlo, usarlo en más de una ocasión. En nuestra institución usamos el Pink Pad® de la empresa Xodus Medical que consiste en una esponja anti-deslizante y agrega compresión suave a nivel torácico + fijador de brazos. Hay otros modelos disponibles en el mercado.
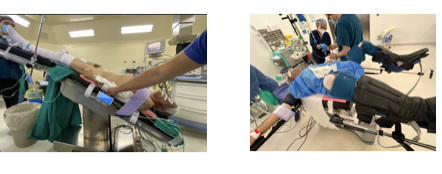
Figura 35. Posicionamiento y fijación de paciente en cirugía pélvica urológica laparoscópica.
b) Consideraciones anestésicas. La posición conlleva múltiples alteraciones fisiológicas cardiovasculares, pulmonares, nerviosas, etc. Sin embargo, las que más dificultan la labor del anestesista se relacionan con un incremento en las presiones de vía aérea, lo que dificulta una mantención adecuadamente baja de los niveles de CO2. Esto es particularmente importante en pacientes obesos (IMC mayor a 30kg/m2) y/o con patologías cardiopulmonares, especialmente aquellas con alteraciones de tipo restrictivas pulmonares (ej. fibrosis pulmonar), siendo pacientes en los que se debe considerar que quizás este no sea el mejor abordaje para este paciente. Es necesario que los pacientes que presentan estas condiciones sean conocidos con antelación por el equipo de anestesia previo a la cirugía. Además, es necesario descartar y/o tratar aquellos pacientes con glaucoma dado que puede, en cirugías prolongadas de más de 4 horas, producir neuropatía óptica isquémica, una condición que está descrita pero que no hemos visto en nuestra experiencia. En nuestro centro, los pacientes que son sometidos a estas cirugías van rutinariamente a evaluación anestésica preoperatoria, independiente de su condición previa. 2.- Posicionamiento del pabellóna)Equipo quirúrgico: Dependerá del centro y de la preferencia del cirujano. Existen principalmente dos formas: I) Escuela francesa: El cirujano opera desde el lado izquierdo (cirujanos diestros) o derecho (cirujano zurdo) con el primer ayudante al lado contrario y el asistente de cámara a nivel de la cabeza del paciente. Esta posición tiene dos ventajas: a) Es cómoda dado que el cirujano se encuentra más cerca de la pelvis y no requiere inclinarse; b) el asistente de cámara puede usar ambas manos lo que permite usar ópticas de 0º o de 30º sin dificultad. El problema de esta posición se relaciona con que el cirujano entra con ambos instrumentos desde un lado por lo que no se triangula, lo que dificulta la realización de algunos pasos en los que hay que cambiar la posición: linfadenectomía pélvica del mismo lado, anastomosis uretrovesical. Esto hace que el cirujano deba cambiar de ubicación varias veces durante el procedimiento. Además, no remeda la posición de los instrumentos de la cirugía robótica en que los brazos del cirujano principal entran un por cada lado. II) Escuela americana: El cirujano opera desde la cabeza del paciente. El primer ayudante se encuentra en un lado (habitualmente a la derecha del paciente) y maneja un instrumento y la cámara. El segundo ayudante maneja 1 o 2 instrumentos desde el otro lado (habitualmente la izquierda). Esta posición tiene dos ventajas: a) El cirujano no requiere cambiarse de posición durante la cirugía independientemente del paso que se realice; y b) presenta la misma disposición que la cirugía robótica convencional, que lo que hace más fácil remedar las técnicas que se desarrollan con robótica y facilitar la transición de la cirugía laparoscópica convencional a la robótica. Presenta dos desventajas, a nuestro juicio menores: a) el camarógrafo solo tendrá una mano para la cámara, por lo que preferimos usar óptica de 0º; y b) ergonómicamente puede ser más demandante al estar el cirujano más lejos de la pelvis, lo que puede incurrir en un mayor esfuerzo físico para mantener la posición por la duración de la cirugía. Por este motivo se debe ser estricto en la altura correcta de la mesa y que el paciente quede “en el aire” con la cabeza alejada del centro de la mesa de manera que el cirujano no esté inclinado encima del paciente. Nosotros utilizamos esta segunda posición en forma regular. b) Instrumental: La pantalla (habitualmente con la torre) se ubicará a los pies del paciente y la energía a la derecha. Es necesario coordinar con anestesia la posibilidad de estar sobre la cabeza del paciente (interferimos entre máquina de anestesia y paciente) y de que los portasueros se ubiquen adyacente a la pierna izquierda del paciente (ver imagen). Es importante además asegurar que el tubo corrugado de anestesia y los cables no interfieran en el piso con los pies de los cirujanos.
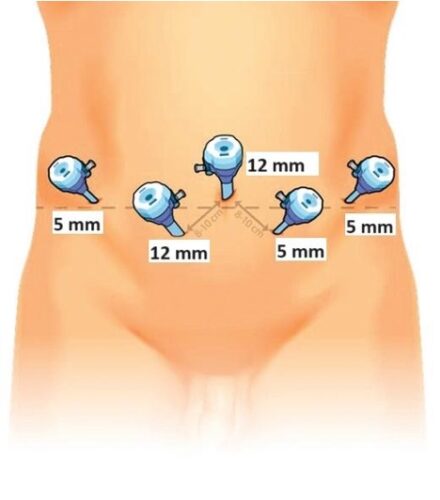
3.- Posicionamiento de los trócares Para prostatectomías habitualmente utilizamos la disposición de trócares en W (Figura 36) con 1 trócar supraumbilical de 12 mm para cámara, otro de 12 mm paraumbilical derecho y 3 trócares de 5 mm en ambos flancos y paraumbilical izquierdo. Ocasionalmente utilizamos algún trócar adicional subcostal en situaciones excepcionales (por ejemplo pacientes muy obesos o con próstatas muy grandes en que requerimos traccionar la vejiga en forma permanente). En cistectomías, los trócares deben instalarse 1 o 2 traveses de dedo hacia cefálico, con el objetivo de manipular asas intestinales con mayor facilidad.
Prostatectomía radical laparoscópica
El cáncer de próstata (CaP) es una patología frecuente, siendo la segunda neoplasia maligna más frecuente en la población masculina a nivel mundial y la primera en Chile según cifras de Globocan. El diagnóstico precoz permite establecer un tratamiento cuando la enfermedad está localizada, logrando tasas de sobrevida cáncer específica a 10 años que superan el 90% (48). La prostatectomía radical (PR) constituye uno de los tratamientos estándar, junto a la radioterapia, para el tratamiento del CaP localizado. La técnica fue descrita por primera vez en 1860 por Billroth y ya en 1940 Millin describe el abordaje retropúbico. Sin embargo, la técnica adolece de importante morbilidad relacionada con sangrado intraoperatorio, incontinencia y disfunción eréctil postoperatorias. En 1979, Walsh y Donker realizan la primera prostatectomía radical retropúbica (PRR) con control selectivo del complejo venoso dorsal, lo que reduce el sangrado(48). Finalmente, Walsh en 1982 describe la anatomía y preservación de las bandeletas neurovasculares y su rol en la mejoría de los resultados funcionales, principalmente la erección. De esta manera la PRR se convierte en el tratamiento de elección en el mundo, otorgando excelentes resultados oncológicos en pacientes con CaP localizado. En un esfuerzo por disminuir la morbilidad asociada a la PRR, Schuessler et al. presentaron el año 1992 la primera serie de casos intervenidos mediante prostatectomía radical laparoscópica (PRL) y concluyeron que no aportaba beneficios respecto a PRR y que su laboriosidad no permitiría su implantación futura. En 1998, Guillonneau et al. introducen la PRL descendente con acceso transperitoneal, técnica que ha demostrado resultados oncológicos y funcionales similares a la PRR, con menor morbilidad perioperatoria en términos de sangrado, dolor y/o estadía hospitalaria, aunque manteniendo una curva de aprendizaje prolongada(49). Posteriormente, grandes series de PRL han remedado los hallazgos de Guillonneau, considerándola una técnica demandante, con una curva de aprendizaje mayor a otras cirugías. La primera PRL en Chile fue realizada por el Dr. Octavio Castillo en el año 2000, tras lo cual la técnica logró adquirir algunos adeptos en el país, siendo paulatinamente reemplazada por la cirugía robótica con la llegada del primer robot Da Vinci a Chile en el año 2009. Desde la primera cirugía robótica realizada en Alemania en el año 2000, a través de la plataforma Da Vinci Robotic Surgical System (Intuitive Surgical, Inc., Sunnyvale, CA), la incorporación de esta técnica y su desarrollo ha sido exponencial, logrando que la prostatectomía radical asistida por robot (PRAR) sea la técnica de elección en países desarrollados. Sin embargo, esta tecnología no se encuentra disponible por su elevado costo en la mayor parte de las regiones de países subdesarrollados o en vías de desarrollo. Finalmente, dado el avance tecnológico en laparoscopía consistente en mejor visión (tecnología 4K o 3D), mejores dispositivos de energía avanzada (ultrasonido o energía bipolar avanzada), neumoperitoneo, la introducción de suturas barbadas, al alero de adelantos técnicos en cirugía robótica, algunos países han seguido desarrollando la PRL con buenos resultados y logrando curvas de aprendizaje más cortas, manteniendo resultados oncológicos y funcionales competitivos, con las ventajas propias de la cirugía mínimamente invasiva (menor sangrado, estadía hospitalaria, dolor, etc.). En el Instituto Nacional del Cáncer se ha desarrollado la técnica desde 2019 y desde el inicio pudimos corroborar estos beneficios. En nuestra publicación inicial en 2021 presentamos 43 pacientes sometidos a PRR (curva establecida) vs 57 pacientes sometidos a PRL (curva inicial) de un mismo cirujano. El grupo de PRL tuvo más pacientes de alto riesgo. Además hubo menos sangrado perioperatorio (287cc vs 577cc, p=0,0001), menos días de hospitalización (2,2 vs 4,2 días, p=0,0001), mayor realización de preservación de bandeletas neurovasculares (p=0,006) y menos días de sonda uretrovesical (p=0,0001) en el grupo PRL. La PRR mostró menor tiempo operatorio en forma significativa (220 min vs 167 min, p=0,0001). No hubo diferencias clínicamente significativas entre ambos grupos en cuanto a complicaciones totales (p=0,406) o Clavien 3-5 (p=0,350). En cuanto a la continencia, el grupo PRL mostró mejores resultados en continencia tanto social como total al retiro de sonda (inmediata) y también al mes postoperatorio (precoz). En nuestra experiencia no hubo grandes diferencias en parámetros oncológicos iniciales, sólo menor tasa de márgenes positivos totales (p=0,04) y márgenes positivos en pT2 (p=0,015) en el grupo PRL, sin diferencias significativas en pT3 (p=0,333)(50). Producto de esta supervisión de nuestros propios resultados, desde 2021 solo realizamos la técnica laparoscópica y hemos reservado el abordaje abierto para cuando no se puede hacer laparoscopía (sospecha de extenso proceso adherencial intra abdominal) o contraindicación anestésica. Sin embargo, estos pacientes habitualmente preferimos tratarlos con otra modalidad (radioterapia, vigilancia activa). A la fecha, hemos realizado más de 250 procedimientos.
a) Selección de pacientes
Como en todo orden de cosas, el diablo está en los detalles y, a pesar de que se trata de un procedimiento complejo con múltiples etapas, los principales inconvenientes o situaciones clínicas a las que nos hemos visto enfrentados no se relacionan con la técnica quirúrgica misma, sino con otras variables que hacen la cirugía más desafiante, sobre todo al inicio de la curva quirúrgica. Se debe contar con estadificación previa que incluya una resonancia de próstata y sugerimos PET CT PSMA si se trata de pacientes de riesgo intermedio desfavorable o alto. Recomendamos encarecidamente que la curva inicial (primeros 10-20 pacientes) comprenda los siguientes pacientes: a) No obesos (IMC menor a 30 kg/m2). b) Próstata con volumen estimado menor a 50cc. El tamaño de la próstata es, sino el principal,uno de los factores que más laboriosa hace a la cirugía. Además, a mayor tamaño de la próstata, mayor incidencia de lóbulos medios prominentes, con dificultad para preservación de cuello y necesidad de procedimientos de cervicoplastía adicional. c) Sin compromiso linfonodal, idealmente (no es excluyente) sin necesidad de linfadenectomía pelviana. d) Bajo compromiso tumoral local: Sin compromiso extracapsular macroscópico, especialmente a nivel del ápex, donde es más difícil ampliar la resección. Sin compromiso esfinteriano, de bandeletas neurovasculares o de recto. e) Idealmente (no es excluyente) sin cirugías previas abdominales, sobre todo abiertas.
b) Instrumental e insumos
a) Torre laparoscópica. b) Óptica de 0° o 30°. c) Caja de laparoscopía general. d) Tijera Metzenbaum. Idealmente nueva. Es clave que no tenga problemas por desgaste. Recomendamos que sea desechable. e) Pinza bipolar. Es de tremenda ayuda, sobre todo para controlar sangrados en napa como aquellos venosos perivesicales o peri prostáticos. Recomendamos una pinza plana fenestrada. f) Porta agujas. Recomendamos los que son rectos en la punta y en el mango (tipo gatillo). g) Aspirador/irrigador tipo trompeta. e) Dilatador uretral curvo tipo Benique 18-21 Fr. F) Trócares de 12 y de 5 mm. g) Energía avanzada: Especialmente útil para casos que incluyan linfadenectomía. Actualmente utilizamos la energía bipolar avanzada (ej. LigaSure™), sobre todo por la familiaridad para hacer linfadenectomía y control de pedículos prostáticos. Sin embargo, la energía ultrasónica (ej. Harmonic™) puede ser una buena alternativa si el cirujano la prefiere y está más acostumbrado. h) Sutura barbada: Utilizamos V-Loc™ 3-0 con aguja de 26 mm y hebra de 15 cm, para anastomosis uretrovesical (recomendamos que sean 2 agujas unidas por el ojal final). Usamos la misma sutura (única) si es que se realiza punto de Rocco y V-Loc™ con aguja de 37 mm para control de complejo venoso dorsal. Puede utilizarse otras marcas como Stratafix™, aunque las escamas más pequeñas dificultan la fijación de la sutura en la anastomosis uretrovesical laparoscópica. i) Sonda uretrovesical de 2 vías 16 o 18 Fr para inicio y otra nueva siliconada de 18 o 20 Fr, que quedará instalada post cirugía, idealmente con capacidad de 15 cc en su balón. j) Clips vasculares de titanio o tipo Hem-o-lok®.
c) Técnica quirúrgica
Realizamos la técnica transperitoneal con abordaje posterior, lo que hemos visto que facilita enormemente la disección de las vesículas seminales, independiente de su tamaño y/o compromiso tumoral. Con el tiempo hemos avanzado en poder realizar una mejor preservación de bandeletas neurovasculares y del complejo de la fascia endopelviana y del delantal del detrusor, o técnica DASH (por sus siglas del inglés Detrusor Apron Sparing Hood) descrito por Tewari, sin comprometer resultados oncológicos, mejorando resultados en calidad de vida (continencia y disfunción eréctil). Los pasos comprenden: a) Instalación de trócares: Como se ha descrito previamente, utilizamos configuración en W (Figura 36). Habitualmente realizamos una incisión supraumbilical por donde insertamos el trócar óptico y a través de esta realizaremos pneumoperitoneo con aguja de Veress. Recomendamos utilizar pinzas Backhaus o Kocher para levantar la pared abdominal y reducir riesgo de lesión vascular. Para verificar la posición de la aguja aspiramos con una jeringa de 10 cc (asegurarnos que no aspiramos sangre o contenido intestinal). Luego instilamos solución fisiológica que debe ingresar a cavidad peritoneal sin problemas. Posteriormente, verificamos la presión intra abdominal que no debe superar los 7 mmHg y, lo más importante, nos aseguramos de que iniciado el proceso de insuflación la curva de ascenso sea lenta. Para el primer trócar solemos utilizar una presión de neumoperitoneo de 20 mmHg que, una vez instalado el primer trócar, bajaremos a un estándar de 15 mmHg para el resto de la cirugía. Luego se instala el resto de trócares. b) Es momento de verificar que se ha instalado la sonda uretro vesical en campo quirúrgico. Habitualmente utilizamos una sonda Foley 18 Fr, con 10 cc en el balón de fijación. c) Liberación del colon sigmoides: Es útil mantenerse en el plano intraperitoneal para evitar lesionar estructuras retroperitoneales durante la disección. La liberación debe ser la suficiente para poder traccionarlo fuera del fondo de saco rectovesical y para acceder a la linfadenectomía de ser necesaria (Figura 37).
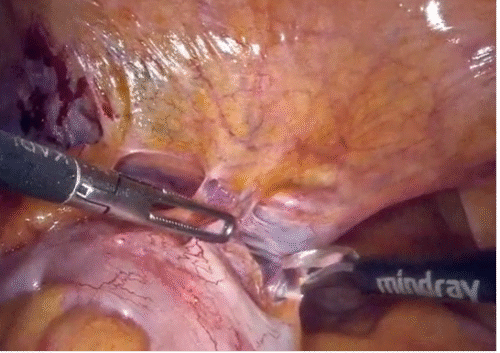
d) Abordaje posterior: Apertura del peritoneo en el fondo de saco rectovesical y disección de las vesículas seminales y conductos deferentes. Posteriormente, se realiza la apertura de la fascia de Denonvilliers, completando la disección posterior de la próstata (Figura 38). Si bien ayuda llegar lo más lejos posible (idealmente hasta la uretra), no es el objetivo llegar tan lejos, dado que posteriormente (una vez hecho el cuello vesical) tendremos más espacio y podremos realizar la disección posterior de la próstata con mayor facilidad.
e) Descenso vesical y desarrollo de espacio de Retzius (Figura 39): Se realiza la apertura del peritoneo en el uraco y lateral a los ligamentos umbilicales hasta el conducto deferente. Se desarrolla el espacio de Retzius y se reseca la grasa del dorso de la próstata.
f) Disección, preservación y apertura del cuello vesical hasta acceder al espacio posterior de las vesículas seminales. Es importante mencionar algunos consejos para ayudar en esta etapa que es clave para identificar el plano correctamente:
- Debe haberse limpiado la grasa pre prostática.
- El balón de la sonda no debe estar en el cuello sino en la cúpula vesical. Si se encuentra en el cuello, lo deforma y nos dificulta la identificación de la unión vesico-prostática.
- Identificar correctamente la unión vesico-prostática. Se utilizan 3 elementos casi siempre presentes (Figura 40):
- Identificar la unión de la proyección hacia proximal de los ligamentos pubo-prostáticos, los que forman una V.
- Identificar el “stop” del balón de la sonda al traccionarlo.
- Identificación del punto tras el cual la grasa periprostática no se sigue desprendiendo fácilmente. Cuando ya no se desprende, es grasa perivesical.
Tratamos de preservar la mayor cantidad de fibras del cuello posibles, principalmente porque nos permitirá tener un cuello pequeño que no será necesario remodelar previo a la anastomosis uretrovesical, ahorrando tiempo. Hay algún nivel bajo de evidencia que muestra que esta preservación puede mejorar la continencia precoz(51). Hay situaciones en que sabemos que una preservación de cuello suele ser imposible y habrá que hacer cistoplastía de regla:
- Antecedente de cirugía prostática previa (RTU-P, enucleación o vaporización prostática).
- Próstata muy grande, con gran lóbulo medio.
Una vez abierta la vejiga, desinflamos el balón de la sonda y tomamos la punta de la sonda con una pinza del asistente y la llevamos a nivel de la sínfisis pubiana (Figura 41). Al mismo tiempo se tracciona la sonda desde afuera del paciente. Esta maniobra levanta la próstata y facilita la sección posterior del cuello.
Incisión posterior del cuello a nivel de la mucosa. En esta etapa es clave identificar la presencia de lóbulo medio prominente. Si existe, muchas veces es difícil traccionarlo. Un truco es instalar un punto de tracción, habitualmente con Vicryl™ 0. Tras la incisión de la mucosa es clave traccionar el lóbulo medio hacia anterior con una pinza. Usamos una pinza con algún grado de agarre (tipo pinza cobra). En ocasiones suele ser necesaria la ayuda de un Beniquè para manipular la posición de la próstata. Identificación del aspecto posterior de la próstata, identificando el músculo vesico-prostático. Habitualmente corresponde a fibras longitudinales que discurren en forma vertical. Debe seccionarse cercano a la próstata. Una vez abierto este músculo nos encontraremos con el aspecto posterior de la próstata y las vesículas seminales, los cuales han sido disecados previamente. g) Control y sección de pedículos prostáticos (Figura 42) con energía bipolar avanzada o clips (Hem-o-lok™). Es importante notar que los clips vasculares (Hem-o-lok™ o también los metálicos) pueden posteriormente migrar, lo que se evidencia como un cuadro de estrechez de anastomosis, eliminación espontánea de clips o litiasis vesical. En nuestra casuística ha ocurrido en 3 casos. Habitualmente implica la necesidad de una uretrotomía endoscópica, más la remoción manual con pinza y, clínicamente, como un retroceso en la recuperación de la continencia.
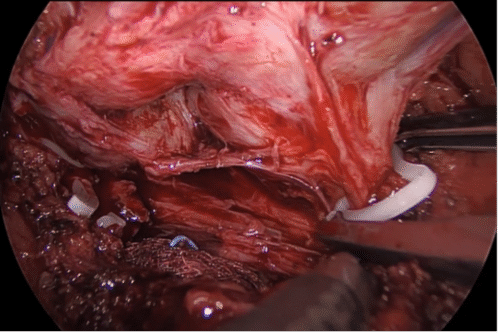
h) Preservación/resección de bandeletas neurovasculares (Figura 43). En nuestra opinión, trataremos de maximizar la preservación de bandeletas neurovasculares (BNV) siempre que sea posible, incluso en pacientes con disfunción eréctil previa dado que: a) existe evidencia de que al realizar preservación de BNV también se obtienen mejores resultados en continencia; b) es un procedimiento difícil, que en tanto más se realice, mejor resultará en los casos en que queremos ser agresivos en la preservación (pacientes jóvenes con buena función eréctil). Para su realización es clave la correcta selección de pacientes. Ésta es específica por cada lado de la próstata. Existen nomogramas que ayudan a definir la posibilidad de preservar como el PRECE (disponible en prece.it)(52). Sin embargo, creemos que la mejor herramienta es la resonancia magnética. Realizaremos preservación siempre que la resonancia muestre que ese lado no presenta sospecha de extensión extra capsular, mientras que, si es que hay sospecha, haremos una preservación discreta o más bien una resección de la BNV. La preservación de BNV es incremental y podemos realizar una preservación agresiva a nivel de la cápsula prostática (total o intrafascial), o menos agresiva entre fascia periprostática y cápsula (parcial o interfascial). Existen dos técnicas para lograrlo:
-
- Preservación anterógrada: Se realiza control con energía bipolar o clips en forma anterógrada (desde los pedículos hacia el ápex). Es más fácil y creemos que es mejor realizarla al inicio de la curva.
- Preservación retrógrada: Popularizada por Patel y Coelho, una vez desarrollado el plano posterior de la próstata, se realiza una liberación alta de la bandeleta neurovascular hasta el nivel de la cara anterolateral de la próstata, identificando el plano intra o inter fascial, y conectándolo con el plano posterior previamente disecado. De esta manera se alejan las bandeletas en forma roma y se completa el procedimiento clipando los pedículos remanentes. Ésta técnica, más difícil de ejecutar, promete ser más eficiente en proteger la bandeleta de daño térmico o mecánico y, una vez que se domina, ser más rápida que la anterógrada.
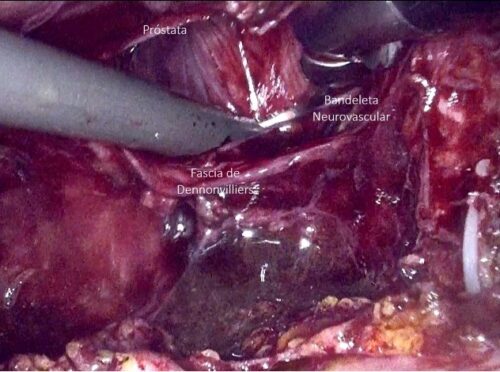
En nuestra opinión ambas son válidas, siendo la segunda la técnica que realizamos en forma rutinaria actualmente. Uso de energía: Existe evidencia de que el uso de energía a este nivel puede provocar pérdida en la calidad de la preservación de bandeletas neurovasculares, con peores resultados en continencia precoz y erecciones a 90 días. Sin embargo, en este estudio, el uso de energía fue indiscriminado tanto monopolar como bipolar. Existen varios estudios que han evidenciado que el uso de energía bipolar avanzada (técnica “Clipless”) es no-inferior en relación con los resultados de preservación de función eréctil y de continencia post cirugía. Cabe destacar que el uso de energía es más permitido cerca de la base prostática, donde las fibras nerviosas tienen una distribución más amplia y debe ser mucho más restringido o nulo cerca del ápex prostático, donde se concentran alrededor de la uretra en forma de “U”. Además, algunos autores manifiestan la preocupación sobre que el uso de clips pudiese generar un control menos preciso en algunos segmentos de la preservación, con una consecuente compresión nerviosa(53). Por este motivo hemos ido usando cada vez menos los clips, pasando a controlar los pedículos con energía bipolar avanzada (ej. Ligasure™). i) Preservación de la fascia endopelviana o técnica DASH, por sus siglas en inglés Detrusor Apron Sparing Hood (54). Se refiere a la preservación de todas las estructuras vasculares y músculo ligamentosas que se ubican entre la fascia endopelviana y el estroma fibromuscular anterior de la próstata, lo que incluye el complejo venoso dorsal profundo y la proyección de las fibras del músculo detrusor hacia distal, lo que se conoce como delantal del detrusor (detrusor apron, en inglés), así como los ligamentos pubo prostáticos. Ésta técnica descrita por Tewari, ha demostrado mejorar significativamente los resultados en continencia precoz y, desde que la realizamos regularmente, en nuestra propia experiencia también. Se fundamenta en que se preservan todas las estructuras antes descritas que cumplen un rol en la mantención de la continencia (Figura 44).
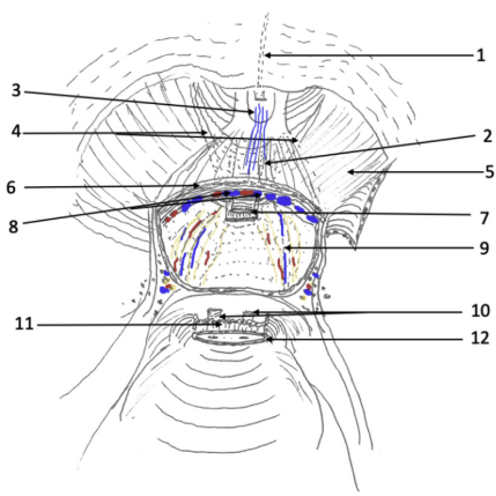
Adicionalmente hemos notado una disminución del sangrado del complejo venoso dorsal (CVD), dado que se separa de la próstata y no se secciona propiamente tal. Ocasionalmente es necesario suturar el CVD después de realizar esta técnica, la que se puede ofrecer en casi todos los casos, salvo en aquellos en que, infrecuentemente, se evidencia un compromiso extracapsular de la porción anterior de la próstata (menos del 10% de los casos). Para suturar el CVD utilizamos la sutura barbada V-Loc™ 3-0 idealmente con aguja de 37 mm (puede utilizarse la de 26 mm). Se puede anclar el punto al pubis, lo que en algunos estudios ha mostrado tener un rol en la continencia urinaria precoz. Durante esta maniobra instalamos un dilatador curvo Beniquè que permite identificar precozmente la uretra para prevenir su daño. j) Disección apical y sección de uretra. Una vez terminada la preservación de la fascia endopelviana y la eventual sutura del CVD, se realiza la disección apical. Para esto es necesario retirar el Beniquè, lo que permite que la próstata se mueva. Es clave disecar y separar el ápex de las BNV y el recto, dejando la próstata “colgando” de la uretra. Este paso es clave en la prevención de márgenes quirúrgicos positivos a nivel apical. Finalmente se diseca la uretra y se deja lo más larga posible para luego seccionarla. k) Cistoplastía. En este punto verificamos el tamaño del cuello vesical. Existen 4 alternativas: I)El cuello es pequeño y no se necesita. II) El cuello es grande pero no tanto. Lo dicta la experiencia. En este caso preferimos hacer la anastomosis uretrovesical (AUV) y finalizar con una cistorrafia anterior con la misma sutura de la AUV. III)El cuello es grande. Realizamos cistoplastía en “boca de pez” instalando puntos laterales para calibrar el cuello (Figura 45).
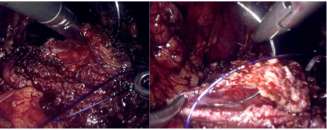
IV) El cuello es muy grande y los orificios ureterales (OOUU) están muy cerca. Ocurre cuando hay próstatas muy grandes con grandes lóbulos medios o con antecedente de resección transuretral previa. En estos casos preferimos hacer una cistorrafia posterior con el objetivo de alejar los OOUU de la AUV. l) Punto de reconstrucción posterior de placa rectouretral (Rocco). Si bien es discutible el rol que presenta en la continencia precoz, tiene algunos beneficios adicionales, pues permite fortalecer la anastomosis en su parte habitualmente más débil: la posterior; tiene un rol hemostático, controlando pequeños sangrados periuretrales que se puedan presentar; en un estudio de Coelho este punto demostró reducir la filtración al retirar la sonda uretrovesical(55). Utilizamos la técnica de Rocco modificada por Patel de doble capa. Se utiliza una sutura barbada con aguja 26 mm de 15 cm. Se toma la fascia de Denonvilliers y la placa recto uretral en 3 pasadas. Posteriormente, con la misma aguja se une el aspecto posterior del cuello vesical con la parte posterior de la uretra. m) Anastomosis uretrovesical: La realizamos con sutura barbada V-Loc™ 3-0 con aguja de 26mm con la técnica descrita por Van Velthoven. Se trata de una sutura continua con 2 hilos unidos por sus ojales quedando 1 aguja para cada lado. Se inicia a las 6 en el cuello de la vejiga y se instalan dos pasadas posteriores por cada lado (en uretra y vejiga), luego dos laterales por cada lado y luego 1 o 2 pasadas por anterior. Para esta etapa es necesario que el ayudante presente la uretra con maniobra de compresión perineal. En nuestra técnica utilizamos el dilatador Beniquè para presentar la uretra y permitir que las pasadas laterales y anteriores se pasen de una vez. La hermeticidad se corrobora con la instalación de una sonda Foley y la instilación de 150 cc. de solución fisiológica, teniendo la precaución de dejar el balón en la cúpula vesical. Los resultados de esta prueba los hemos protocolizado en 3 situaciones:
- No hay filtración. Daremos por finalizada la anastomosis. No es necesario dejar drenaje. Retiraremos la sonda al 7mo día post operatorio.
- Hay filtración que cede con tracción del balón de la sonda a nivel de la AUV. Recomendamos dejar drenaje y retirar la sonda al 10-14 día post operatorio.
- Hay filtración que no cede con la tracción del balón de la sonda. Es necesario verificar el punto de filtración y repararlo con un nuevo punto. Si esto no es posible, recomendamos desmantelar la anastomosis y realizarla de nuevo. Tras completarla, recomendamos dejar drenaje y sonda por 10 a 14 días.
n) Reconstrucción anterior: Si se ha podido preservar la fascia endopelviana (DASH) recomendamos suturar a la vejiga. Hay evidencia que muestra que esta reconstrucción puede mejorar la continencia precoz(56). o) Linfadenectomía pelviana extendida incluyendo los grupos iliaco interno, externo e iliobturatriz hasta el cruce del uréter con los vasos ilíacos, en pacientes con posibilidad de compromiso linfonodal mayor a 7% según nomograma de Briganti. p) Extracción de especímenes con bolsa endoscópica a través incisión supraumbilical. Cerraremos esta incisión y la de los puertos de sobre 10 mm con PDS® 2-0 o Vicryl™ 0 o 2-0 con aguja ⅝. También es de utilidad ocupar una aguja de Berci para el cierre de puertos, si es que está disponible. q) Infiltración de puertos con bupivacaína.
Cuidados post operatorios
El paciente se puede realimentar a las 6 hrs. del procedimiento. Utilizaremos proquinéticos y analgésicos por horario. Idealmente el paciente debe sentarse en cama el primer día. Al día siguiente, si se encuentra deambulando en forma normal e ingiriendo régimen liviano sin problemas, puede ser dado de alta. En nuestra serie, el 87% de nuestros pacientes se va al día siguiente de la cirugía. Al alta se dejará con analgésicos y profilaxis tromboembólica con heparinas de bajo peso molecular (ideal) o rivaroxaban, por 21 días si no se hizo linfadenectomía y 28 en caso de haberse realizado. Se citará a retiro de sonda uretrovesical según el protocolo descrito, habitualmente al 7º día la mayor parte de los pacientes. Luego se controlará con biopsia quirúrgica y resultado de PSA total. Apenas se retira la sonda el paciente debería comenzar con un programa de kinesioterapia de piso pelviano, que permite recuperar la continencia urinaria en forma más acelerada. En nuestro centro, todos nuestros pacientes van a una consulta preoperatoria con kinesiología y luego después del retiro de sonda.
Cistectomía radical y derivación urinaria laparoscópica
Introducción
El cáncer de vejiga es el séptimo tumor maligno más frecuente en hombres y el décimo en mujeres a nivel mundial, con una mortalidad estimada de 3,3 por 100.000 en hombres y 0,86 por 100.000 en mujeres. Este diagnóstico representa un desafío importante debido a su elevado costo sanitario e impacto en la calidad de vida de los pacientes, asociado a los tratamientos disponibles. Aproximadamente el 75% de los pacientes se presenta con enfermedad localizada, y de ellos, un 25% presenta compromiso del músculo detrusor o estadios más avanzados (T2-T4)(57,58). La cistectomía radical (CR) es el tratamiento estándar para el cáncer vesical músculo-invasor (T2-T4) y para aquellos carcinomas superficiales de alto riesgo refractarios al tratamiento con BCG. También existen indicaciones no oncológicas, como cistitis intersticial severa, cistitis actínica o tuberculosis vesical avanzada, que pueden requerir la extirpación de la vejiga y una derivación urinaria permanente(59). La CR es una cirugía de alta complejidad, que debería concentrarse en centros de alto volumen, dadas sus cifras de mortalidad perioperatoria (2-3%), complicaciones (≈60% a 90 días) y reintervención (≈10%)(60-61). Tradicionalmente realizada por vía abierta, este abordaje se ha asociado de forma consistente con mayor sangrado y más dolor postoperatorio. Sin embargo, la incidencia de otras complicaciones mayores es comparable entre ambas técnicas(62). En este contexto, el desarrollo de técnicas mínimamente invasivas —principalmente mediante cirugía laparoscópica o robótica— busca mitigar el impacto perioperatorio, especialmente en cuanto a sangrado, dolor, íleo postoperatorio y estancia hospitalaria. Ensayos clínicos aleatorizados, como MSKCC(63,64), han demostrado que la vía mínimamente invasiva es no inferior en resultados oncológicos, con tasas de complicaciones generales similares. Sin embargo, ambos estudios han recibido críticas por, entre otras cosas, haber utilizado predominantemente derivaciones urinarias extracorpóreas (ECUD), técnica asociada a mayor riesgo de estenosis ureteroileal y dolor. El desarrollo y perfeccionamiento de las técnicas de derivación urinaria intracorpórea (ICUD) ha permitido una mejora significativa en los resultados perioperatorios. Destaca en este sentido el ensayo clínico iROC, publicado en 2022(65), que comparó cirugía abierta versus mínimamente invasiva con ICUD, mostrando una diferencia significativa a favor de la cirugía mínimamente invasiva en el número de días vivo dentro y fuera del hospital a 90 días. Además hubo menor tasa de eventos tromboembólicos y complicaciones relacionadas con la herida operatoria. El objetivo de esta sección es describir de manera detallada la técnica quirúrgica de cistectomía radical y derivación urinaria intracorpórea por vía laparoscópica, incorporando la experiencia propia y derivada de la evidencia disponible, con énfasis en los aspectos técnicos que permiten optimizar los resultados perioperatorios y oncológicos.
Selección de pacientes
Sugerimos comenzar a desarrollar ésta técnica en centros de alto volumen, donde se realicen idealmente más de 15-20 cirugías anuales y después de haber experimentado una curva de prostatectomía radical laparoscópica que permita profundizar el conocimiento de la anatomía quirúrgica de la pelvis. Recomendamos optimizar parámetros generales válidos para todo paciente candidato a CR: correcto estado nutricional, hematológico, metabólico e infeccioso. El paciente debe tener imágenes de etapificación (tomografía computada de tórax, abdomen y pelvis) con no más de 3 meses de antigüedad (recomendamos 1 mes) y la evaluación de un equipo multidisciplinario (ej. comité oncológico) donde se haya discutido la pertinencia del procedimiento. Adicionalmente debe tratarse de buenos candidatos a cirugía laparoscópica:
- Sin cirugía abdominal previa extensa (peritonitis, cirugía derivativa intestinal previa, intervenciones múltiples, etc.).
- Sin problemas que excluyan la posición de Trendelemburg forzado (obesidad mórbida, enfermedades que restrinjan la capacidad pulmonar, cardiopatía no compensada, glaucoma no compensado).
- En cuanto a lo oncológico, idealmente sin compromiso de otros órganos (recto, pared abdominal, intestino delgado) o con claro compromiso linfonodal. Éste último punto es debatible y dependerá de la experiencia del centro.
- Idealmente sin prostatectomía radical o radioterapia previa por cáncer de próstata. Si bien hay pacientes en los que hemos realizado esta técnica, no recomendamos hacerlo al inicio de la curva.
Preparación del paciente
En nuestra práctica los pacientes que se someten a cistectomía radical ingresan a un protocolo de manejo perioperatorio ERAS™ (del inglés, Enhanced Recovery After Surgery). Consta de varias etapas. I) Pre-hospitalaria: a) Consejería preoperatoria: Educación sobre el proceso quirúrgico y objetivos peri-operatorios, manejo de ostomía, cese de tabaco. b) Optimización médica preoperatoria: Nutricional, anemia, comorbilidades, indicar ejercicios, cese de tabaco y alcohol. c) Screening nutricional universal:
-
-
- Baja de peso involuntaria > 5% de su peso habitual en < de 6 meses o;
- Baja ingesta oral > 7-10 días o; índice de masa corporal (IMC) < 18.5 kg/m2,
- IMC < 22 kg/m2 en mayores de 70 años; o
- Albúmina < 3.0 g/dL. En caso de salir positivo, realizar evaluación y prehabilitación nutricionales preoperatoria.
-
d) Prehabilitación kinésica: Kinesioterapia 4 semanas (mínimo). Durante la primera semana se cita dos veces, luego control una vez a la semana en hospital, además de ejercicios en domicilio. II) Hospitalaria: a) Disminuir ayuno preoperatorio: 6 horas de ayuno para sólidos, 2 horas de ayuno para líquidos claros, colación nocturna a las 9-10 PM. b) Carga de carbohidratos: Fresubin® Jucy 200 mL a las 6 AM. Kinesioterapia respiratoria preoperatoria. c) Preparación intestinal: NO utilizamos preparación intestinal. d) Tromboprofilaxis: administrar a todos los pacientes 12 horas preoperatorias por parte de anestesia (ej. Enoxaparina).
Instrumental e insumos
- Torre laparoscópica con óptica de 0º.
- Caja de laparoscopía general.
- Tijera Metzenbaum.
- Pinza bipolar.
- Porta agujas.
- Aspirador irrigador tipo trompeta.
- Trócares de 12 mm (x3) y de 5 mm (x3).
- Energía avanzada. Utilizamos energía bipolar avanzada (ej. Ligasure™) que es de gran ayuda en el control de los pedículos vesicales.
- Sutura 4-0 para anastomosis ureteroileal. Utilizamos Vicryl™, porque es más fácil de manipular que el Monocryl™, sin embargo ambas opciones son válidas.
- Sutura mecánica endoscópica como las grapadoras lineales Endo GIA™ (Medtronic) o Echelon Flex™ Endopath™ (Ethicon). Utilizamos cargas vasculares (6 cargas por cirugía).
- Sonda uretrovesical de 2 vías 18 Fr para inicio y otra nueva que quedará instalada post cirugía, idealmente con capacidad de 30 cc. en su balón que permitirá quedar a modo de drenaje.
- Catéteres ureterales Mono jota.
- Clips vasculares de titanio y Hem-o-lok™.
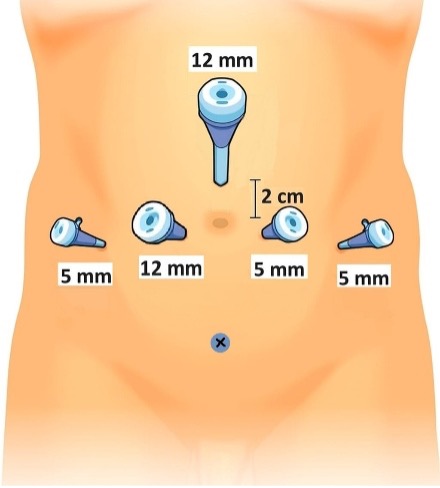
Técnica quirúrgica
a) Instalación de trócares Se instala un trócar supraumbilical para cámara aproximadamente 2 traveses de dedo por sobre el ombligo (más cefálico que PRL). Luego se instalan 4 trócares a nivel del ombligo; 2 paraumbilicales y 2 en flanco. A diferencia de la PRL, en esta cirugía los paraumbilicales pueden quedar más cefálicos, no quedando en W, sino en línea (Figura 46). Se puede utilizar el trócar paraumbilical derecho como sitio de estoma (debe ir previamente marcado), por lo que utilizamos uno de 12 mm. Adicionalmente, instalaremos un trócar suprapúbico de 12 mm en línea media para realizar algunos disparos de grapadora y para extraer la pieza quirúrgica en hombres a través de un Pfannenstiel. b) Cistectomía radical en hombres I) Liberación de adherencias, en particular liberación de colon sigmoides (Figura 47).
II) Disección ureteral (Figura 48). Comienza con la apertura del peritoneo parietal posterior sobre uréter izquierdo y disección de éste hasta la unión ureterovesical (UV) izquierda tratando cuidadosamente de preservar el tejido adiposo periureteral y de no tomarlo con pinza en lo posible. Al llegar a la unión UV se controla con un Hem-o-lok™ XL (dorado) marcado con sutura de seda o Vicryl™ que queda en el uréter y otro sin marca que queda en la vejiga. Se envía segmento a biopsia rápida. Luego realizamos lo mismo con el uréter derecho. Finalizamos esta parte con la apertura de una brecha retrosigmoidea, a la altura del promontorio del sacro, por donde pasaremos el uréter izquierdo de izquierda a derecha.
III) Disección posterior (Figura 49). Incisión en el peritoneo parietal pelviano a nivel del fondo de saco rectovesical. Se identifican y seccionan los conductos deferentes y se liberan ambas vesículas seminales (no es necesario que sea tan extenso como en prostatectomía radical). El paso clave es la disección del plano entre la cara posterior de la próstata y el recto.
IV) Disección lateral proximal. Incisión del peritoneo lateral a los ligamentos umbilicales laterales hasta la apertura de la disección posterior. Se diseca la cara lateral (habitualmente partimos por el lado derecho) de la vejiga hasta llegar a la fascia endopelviana. De esta manera quedan expuestos los pedículos superiores y medios de la vejiga, los que pasaremos a controlar con Hem-o-lok™. Existen centros donde se utiliza sutura mecánica o simplemente energía bipolar avanzada. Se repite el procedimiento a la izquierda. V) Sección del uraco y liberación vesical completa (Figura 50). Se termina de acceder al espacio prevesical y se libera la grasa del dorso de la próstata.
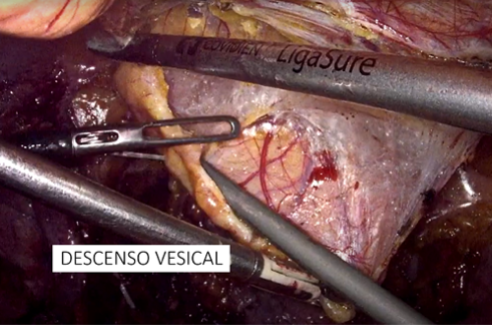
VI) Disección lateral distal (Figura 51). Se realiza apertura de la fascia endopelviana. En caso de realizarse preservación de bandeletas neurovasculares, éste es el momento. Se realiza sección de los pedículos prostáticos por ambos lados.
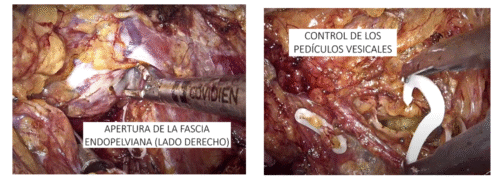
VII) Sección del complejo venoso dorsal (Figura 52) y liberación apical de la próstata, completando la liberación total de la próstata. Sutura del complejo venoso dorsal de la próstata con sutura barbada (V-Loc™ 3-0).
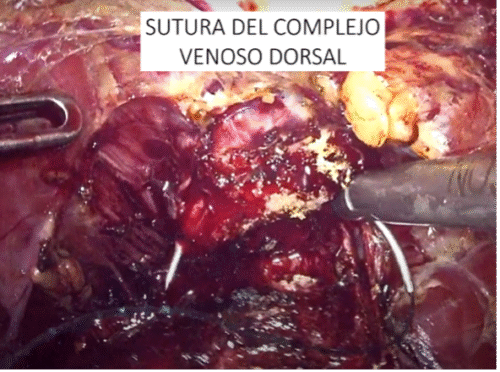
VIII) Sección de uretra (Figura 53): se retira la sonda Foley y se diseca completamente del recto. Debe dejarse un muñón uretral largo para la instalación de un Hem-o-lok™ con facilidad y que permita enviar un segmento a biopsia rápida tras seccionarla con tijera fría. Habitualmente dejamos instalada sonda calibre 20 o 22 Fr, con balón inflado en 30 o 40 cc. para hemostasia y drenaje.
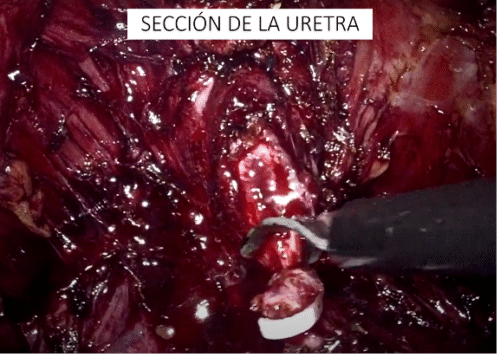
IX) Linfadenectomía pélvica bilateral (Figura 54), incluyendo los grupos: ilíaco externo, interno e ilio-obturatriz hasta el cruce con el uréter (ilíaco común). No realizamos de rutina linfadenectomía extendida en cáncer vesical, entendida como aquella que se realiza hasta la arteria mesentérica inferior y que incluye los presacros.
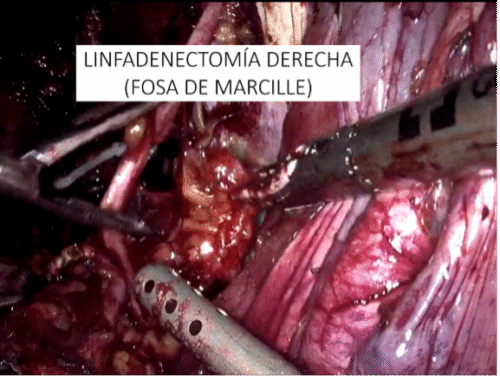
c) Cistectomía radical en mujeres I) Liberación de adherencias. II) Control con Hem-o-lok™ y sección del infundíbulo pélvico (Figura 55).
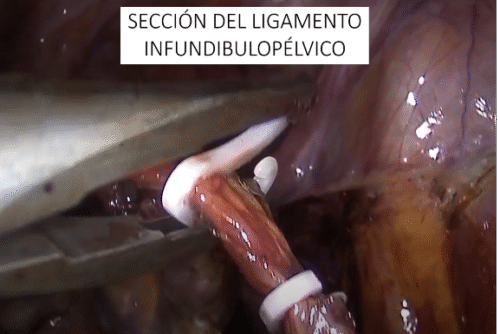
III) Sección del ligamento ancho en forma bilateral. IV) Disección ureteral hasta la unión UV de la misma manera que en hombres. Se transpone el izquierdo de izquierda a derecha. V) Disección posterior vesical. En caso de preservación de útero, se diseca el plano entre vejiga y vagina. VI) Disección lateral de la vejiga: apertura de peritoneo a lateral a ligamentos umbilicales. Se seccionan los ligamentos redondos (Figura 56). Se libera vejiga hasta la fascia endopelviana. Sección de pedículos vesicales superiores y medios.
VII) En caso de exanteración pelviana anterior (Figura 57), apertura de fondo de cúpula vaginal y sección de arteria uterina y cara lateral de vagina, dejando cara anterior de vagina en bloc con pared posterior de vejiga.
VIII) Sección de uraco y descenso vesical. IX) Apertura de fascia endopelviana y disección de cuello vesical. En esta etapa completamos la separación del plano con la vagina en caso de preservación vaginal. En caso de exanteración, se conectará con la apertura de la pared lateral de la vagina. X) Sección de la uretra (Figura 58), enviando un segmento a biopsia rápida. Se instala sonda foley igual que en hombres. Tras completar la resección se introduce el espécimen en bolsa y se extrae por vagina en caso de ser posible.
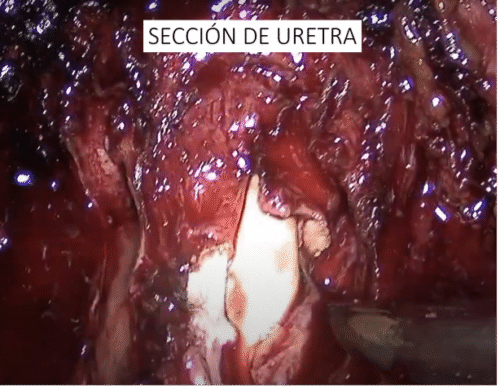
XI) Colporrafia con sutura barbada o Vicryl 0 (Figura 59). Habitualmente se sutura la cúpula a nivel suburetral y luego en forma lateral (cierre tipo “clamshell”).
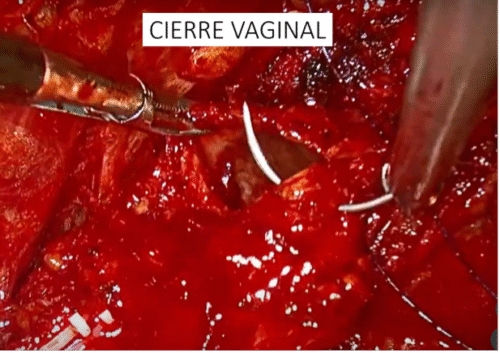
XII) Nota: En caso de preservación de órganos pélvicos recomendamos: conservar útero y ovarios y resecar las trompas de falopio. Esto para, por un lado proteger la salud cardiovascular y ósea de la mujer y, por otro, para reducir el riesgo de cáncer de ovario. d) Derivación urinaria intracorpórea tipo conducto ileal I) Se identifica la válvula ileocecal. Se mide punto a 20 cm de la válvula, para el cual se usa algún material de esa longitud. Se marca ese punto con sutura de seda 3-0. Truco: para este fin puede usarse una sutura o una gasa, nosotros utilizamos la cinta radiopaca de la compresa ya que se adhiere bien al intestino lo que facilita su medición (Figura 60).
II) Se instala trócar de 12 mm suprapúbico. A través de este se introduce sutura mecánica de 60 mm, vascular, triple línea, y se secciona intestino en punto a 20 cm de válvula ileo-cecal, dejando sutura del lado del conducto ileal (lado distal). Es importante prolongar un par de centímetros la sección en el mesenterio para facilitar la salida de cabo distal del conducto a nivel de la piel (Figura 61).
IV) Luego se miden 20 cm más con el mismo material y se secciona nuevamente con nueva carga de sutura mecánica vascular de 60 mm. V) Se realiza anastomosis intestinal latero lateral tipo Barcelona.
- Se unen ambas asas intestinales (aferente y eferente) con puntos separados de seda a nivel de borde antimesentérico (Figura 62).
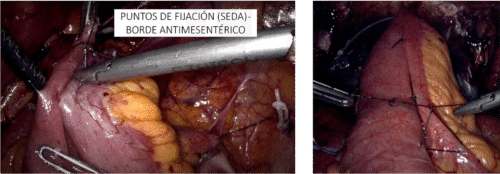
Figura 62. Puntos de fijación (seda) – borde antimesentérico. - Se abre extremo de asas justo por debajo de línea de sutura mecánica (Figura 63).
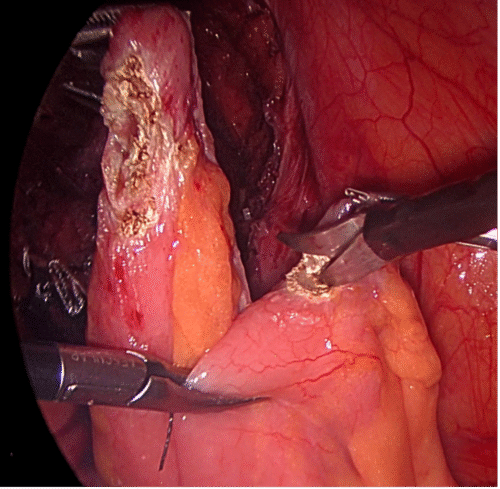
Figura 63. Apertura de extremo de asas. - Se introduce sutura mecánica de 60 mm por trocar suprapúbico y se introduce una mandíbula por asa eferente y otra por asa aferente. Se realiza primer disparo (Figura 64).
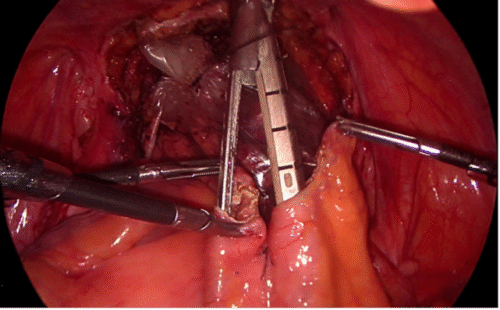
Figura 64. Primer disparo para anastomosis intestinal laterolateral (Barcelona). - Se introduce una segunda carga de 60 mm de la misma manera dejando unión de asas de aproximadamente 100 a 120 mm (Figura 65).
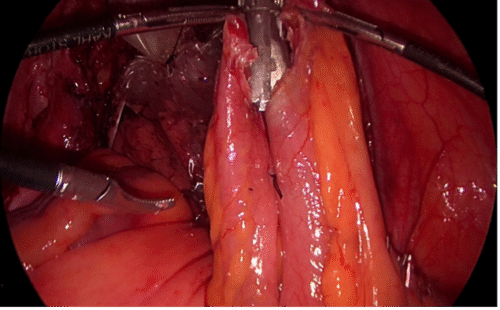
Figura 65. Segundo disparo para anastomosis intestinal laterolateral (Barcelona). - Se cierra techo de sutura con nueva carga de 60 mm (Figura 66). No es necesario realizar refuerzo de sutura si se utilizan cargas con triple línea de sutura (si recomendamos realizarlo si se utilizan cargas de doble línea).
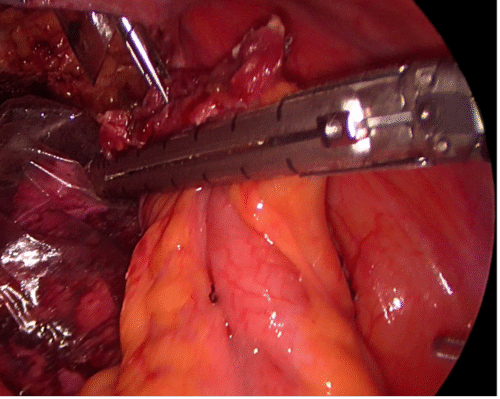
Figura 66. Cierre de techo.
VI) Cierre de brecha mesentérica con puntos separados de seda o Vicryl™ 3-0 (Figura 67).
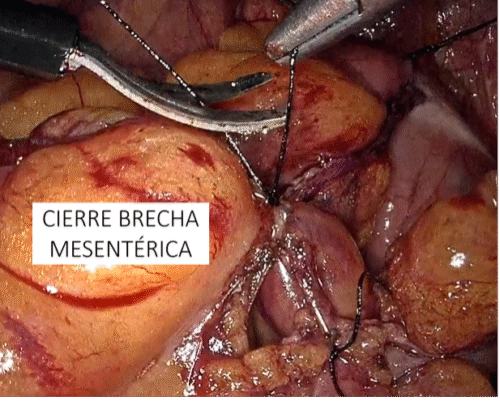
VII) Anastomosis ureteroileal izquierda término-lateral (tipo Bricker).
-
- Se resecan aproximadamente 3-4 cm de uréter distal y se espátula la cara posterior (Figura 68).
Figura 68. Espatulamiento ureteral. - Luego se realiza apertura de intestino a nivel de extremo proximal del conducto ileal, en borde antimesentérico (Figura 69).
Figura 69. Apertura intestinal. - Se realiza anastomosis ureteroileal con Vicryl 4-0 aguja RV1 tipo Van Velthoven. Se sutura la cara posterior. Luego se instala catéter monojota 6 Fr (rojo) que se pasa a través de conducto ileal. Una vez instalado, se saca extremo distal por extremo distal del conducto ileal (Figura 70).
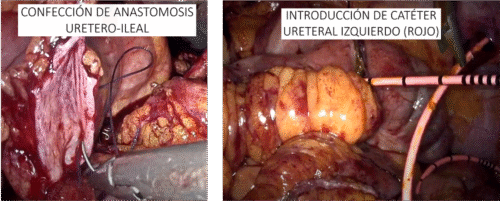
Figura 70. Anastomosis ureteroileal. - Se completa anastomosis ureteroileal.
- Se corrobora hermeticidad introduciendo solución fisiológica a conducto ileal.
- Se resecan aproximadamente 3-4 cm de uréter distal y se espátula la cara posterior (Figura 68).
VIII) Anastomosis ureteroileal derecha término-lateral (tipo Bricker). Se realizan los mismos pasos con las siguientes diferencias sólo diferenciándose en que el catéter monojota derecho es azul y se instala con guía hidrofílica a través de trocar suprapúbico. IX) Se externaliza extremo distal de conducto ileal a través de sitio de instalación de trocar supraumbilical derecho y se madura con puntos de PDS 2-0 (Figura 71).
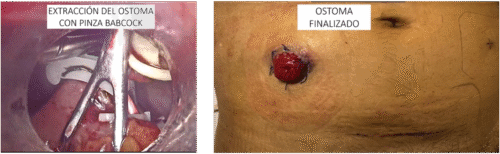
X) Se deja drenaje por sitio de trócar de flanco izquierdo. XI) Finalmente se extrae el espécimen por incisión tipo Pfannenstiel a nivel de sitio trócar suprapúbico. e) Derivación urinaria extracorpórea tipo conducto ileal En general, hemos abandonado esta técnica dado que, al dejar los uréteres más largos para la confección del conducto afuera del abdomen, suelen quedar isquémicos, lo que aumenta la tasa de estenosis ureteroileal, sobre todo a izquierda. En los casos que hemos tenido que hacerlo, por falta de sutura mecánica endoscópica, realizamos una incisión supra-infraumbilical (por donde además retiramos el espécimen) lo suficientemente grande como para realizar el conducto sin que sea necesario dejar los uréteres largos (Figura 72).
Cuidados post operatorios
1) Prevenir íleo postoperatorio
a) Proquinéticos por horario. b) Chicle, movilización activa. c) Evitar balance hídrico positivo.
2) Analgesia multimodal
a) Solución de AINES + metamizol por 3 días. b) Primer día solución EV, segundo día por horario, tercer día oral.
3) Movilización precoz: Activación general con traspaso a silla
a) Primer día: una hora (fuera de la cama). b) Segundo día: dos horas (fuera de la cama), en dos atenciones diarias. c) Tercer día: cuatro horas (fuera de la cama) en dos atenciones diarias. d) Cuarto día: alta.
4) Iniciar alimentación oral precoz
a) Primer día: 6 horas post-cirugía 300 cc. agua con maltosa dextrina fraccionado, a tolerancia del paciente. b) Segundo día: líquidos (sopa, jalea, té, jugo de cocción de fruta) + suplemento oral líquido. c) Tercer día: papilla + suplemento oral líquido. d) Cuarto día: liviano + suplemento oral líquido 200 cc x 2 veces.
5) Alta Precoz
Idealmente desde el quinto día en adelante si se cumplen los siguientes criterios: I) Dolor controlado. II) Movilización independiente. III) Tolerancia oral. IV) Tránsito intestinal positivo. V) Adecuado manejo ostoma.
5) Mantener catéteres ureterales y retirar en control precoz (7 a 10 días)
Bibliografía
- Cadeddu, J.A.; Ono, Y.; Clayman, R.V.; Barrett, P.H.; Janetschek, G.; Fentie, D.D.; McDougall, E.M.; Moore, R.G.; Kinukawa, T.; Elbahnasy, A.M.; Nelson, J.B. and Kavoussi, L.R. «Laparoscopic nephrectomy for renal cell cancer: evaluation of efficacy and safety: a multicenter experience». Urology. 52(5): 773-777, 1998.
- Duchene, D.A.; Anderson, J.K. and Cadeddu, J.A. «Laparoscopic radical nephrectomy», in «Laparoscopic atlas of urologic surgery». Bishoff, J.T. and Kavoussi, L.R., Editors. 2007, Saunders Elsevier: Philadelphia, USA. p. 70-88.
- Nyhus, L.M. «The posterior (preperitoneal) approach and iliopubic tract repair of inguinal and femoral hernias – an update». Hernia. 7(2): 63-67, 2003.
- Wolf, J.S., Jr. and Stoller, M.L. «The physiology of laparoscopy: basic principles, complications and other considerations». J Urol. 152(2 Pt 1): 294-302, 1994.
- Vilos, G.A.; Ternamian, A.; Dempster, J. and Laberge, P.Y. «No. 193-Laparoscopic Entry: A Review of Techniques, Technologies, and Complications». J Obstet Gynaecol Can. 39(7): e69-e84, 2017.
- Pickett, S.D.; Rodewald, K.J.; Billow, M.R.; Giannios, N.M. and Hurd, W.W. «Avoiding major vessel injury during laparoscopic instrument insertion». Obstet Gynecol Clin North Am. 37(3): 387-397, 2010.
- Vilos, G.A.; Vilos, A.G.; Abu-Rafea, B.; Hollett-Caines, J.; Nikkhah-Abyaneh, Z. and Edris, F. «Three simple steps during closed laparoscopic entry may minimize major injuries». Surg Endosc. 23(4): 758-764, 2009.
- Pareek, G. and Nakada, S.Y. «Laparoscopic stapling and reconstruction», in «Laparoscopic atlas of urologic surgery». Bishoff, J.T. and Kavoussi, L.R., Editors. 2007, Saunders Elsevier: Philadelphia, USA. p. 24-40.
- Young, W.F., Jr. «Clinical practice. The incidentally discovered adrenal mass». N Engl J Med. 356(6): 601-610, 2007.
- Hevia Suarez, M.; Abascal Junquera, J.M.; Boix, P.; Dieguez, M.; Delgado, E.; Abascal Garcia, J.M. and Abascal Garcia, R. «[Management of adrenal mass: What urologists should know]». Actas Urol Esp. 34(7): 586-591, 2010.
- Ioachimescu, A.G.; Remer, E.M. and Hamrahian, A.H. «Adrenal incidentalomas: a disease of modern technology offering opportunities for improved patient care». Endocrinol Metab Clin North Am. 44(2): 335-354, 2015.
- Zielinski, M.D.; Atwell, T.D.; Davis, P.W.; Kendrick, M.L. and Que, F.G. «Comparison of surgically resected polypoid lesions of the gallbladder to their pre-operative ultrasound characteristics». J Gastrointest Surg. 13(1): 19-25, 2009.
- Garrett, R.W.; Nepute, J.C.; Hayek, M.E. and Albert, S.G. «Adrenal Incidentalomas: Clinical Controversies and Modified Recommendations». AJR Am J Roentgenol. 206(6): 1170-1178, 2016.
- Autorino, R.; Bove, P.; De Sio, M.; Miano, R.; Micali, S.; Cindolo, L.; Greco, F.; Nicholas, J.; Fiori, C.; Bianchi, G.; Kim, F.J. and Porpiglia, F. «Open Versus Laparoscopic Adrenalectomy for Adrenocortical Carcinoma: A Meta-analysis of Surgical and Oncological Outcomes». Ann Surg Oncol. 23(4): 1195-1202, 2016.
- Campero, J.M., Manejo de tumores adrenales complejos: feocromocitoma maligno, cánceres bilaterales, cáncer adrenocortical, tumores metastásicos., in Simposio Latinoamericano de Urología Oncológica SLAURO 20162016: Viña del Mar, Chile.
- Moll, F. and Rathert, P. «The surgeon and his intention: Gustav Simon (1824-1876), his first planned nephrectomy and further contributions to urology». World J Urol. 17(3): 162-167, 1999.
- Clayman, R.V.; Kavoussi, L.R.; Soper, N.J.; Dierks, S.M.; Meretyk, S.; Darcy, M.D.; Roemer, F.D.; Pingleton, E.D.; Thomson, P.G. and Long, S.R. «Laparoscopic nephrectomy: initial case report». J Urol. 146(2): 278-282, 1991.
- Kerbl, D.C.; McDougall, E.M.; Clayman, R.V. and Mucksavage, P. «A history and evolution of laparoscopic nephrectomy: perspectives from the past and future directions in the surgical management of renal tumors». J Urol. 185(3): 1150-1154, 2011.
- Desai, M.M.; Strzempkowski, B.; Matin, S.F.; Steinberg, A.P.; Ng, C.; Meraney, A.M.; Kaouk, J.H. and Gill, I.S. «Prospective randomized comparison of transperitoneal versus retroperitoneal laparoscopic radical nephrectomy». J Urol. 173(1): 38-41, 2005.
- Dunn, M.D.; Portis, A.J.; Shalhav, A.L.; Elbahnasy, A.M.; Heidorn, C.; McDougall, E.M. and Clayman, R.V. «Laparoscopic versus open radical nephrectomy: a 9-year experience». J Urol. 164(4): 1153-1159, 2000.
- Conley, S.P.; Humphreys, M.R.; Desai, P.J.; Castle, E.P.; Dueck, A.C.; Ferrigni, R.G. and Andrews, P.E. «Laparoscopic radical nephrectomy for very large renal tumors (> or =10 cm): is there a size limit?». J Endourol. 23(1): 57-61, 2009.
- Luciani, L.G.; Porpiglia, F.; Cai, T.; D’Elia, C.; Vattovani, V.; Giusti, G.; Tiscione, D.; Chiodini, S.; Peschechera, R.; Fiori, C.; Spina, R.; Parma, P.; Celia, A. and Malossini, G. «Operative safety and oncologic outcome of laparoscopic radical nephrectomy for renal cell carcinoma >7 cm: a multicenter study of 222 patients». Urology. 81(6): 1239-1244, 2013.
- Desai, M.M.; Gill, I.S.; Ramani, A.P.; Matin, S.F.; Kaouk, J.H. and Campero, J.M. «Laparoscopic radical nephrectomy for cancer with level I renal vein involvement». J Urol. 169(2): 487-491, 2003.
- Steinnerd, L.E.; Vardi, I.Y. and Bhayani, S.B. «Laparoscopic radical nephrectomy for renal carcinoma with known level I renal vein tumor thrombus». Urology. 69(4): 662-665, 2007.
- Pouliot, F.; Shuch, B.; Larochelle, J.C.; Pantuck, A. and Belldegrun, A.S. «Contemporary management of renal tumors with venous tumor thrombus». J Urol. 184(3): 833-841, 2010.
- Campero, J.M.; Ramos, C.G.; Valdevenito, R.; Mercado, A. and Fulla, J. «Laparoscopic partial nephrectomy: A series of one hundred cases performed by the same surgeon». Urol Ann. 4(3): 162-165, 2012.
- Shah, P.H.; Moreira, D.M.; Okhunov, Z.; Patel, V.R.; Chopra, S.; Razmaria, A.A.; Alom, M.; George, A.K.; Yaskiv, O.; Schwartz, M.J.; Desai, M.; Vira, M.A.; Richstone, L.; Landman, J.; Shalhav, A.L.; Gill, I. and Kavoussi, L.R. «Positive Surgical Margins Increase Risk of Recurrence after Partial Nephrectomy for High Risk Renal Tumors». J Urol. 196(2): 327-334, 2016.
- Hotston, M.R. and Keeley, F.X. «Laparoscopic partial nephrectomy without ischemia». Arch Esp Urol. 66(1): 146-151, 2013.
- Becker, F.; Van Poppel, H.; Hakenberg, O.W.; Stief, C.; Gill, I.; Guazzoni, G.; Montorsi, F.; Russo, P. and Stockle, M. «Assessing the impact of ischaemia time during partial nephrectomy». Eur Urol. 56(4): 625-634, 2009.
- Desai, M.M.; Gill, I.S.; Ramani, A.P.; Spaliviero, M.; Rybicki, L. and Kaouk, J.H. «The impact of warm ischaemia on renal function after laparoscopic partial nephrectomy». BJU Int. 95(3): 377-383, 2005.
- Foyil, K.V.; Ames, C.D.; Ferguson, G.G.; Weld, K.J.; Figenshau, R.S.; Venkatesh, R.; Yan, Y.; Clayman, R.V. and Landman, J. «Longterm changes in creatinine clearance after laparoscopic renal surgery». J Am Coll Surg. 206(3): 511-515, 2008.
- Laven, B.A.; Orvieto, M.A.; Chuang, M.S.; Ritch, C.R.; Murray, P.; Harland, R.C.; Inman, S.R.; Brendler, C.B. and Shalhav, A.L. «Renal tolerance to prolonged warm ischemia time in a laparoscopic versus open surgery porcine model». J Urol. 172(6 Pt 1): 2471-2474, 2004.
- Álvarez-Barcia, A.J., Valoración del daño parietal a nivel vascular, tras la aplicación de métodos extraluminales de oclusión temporal, in Departamento de Cirugía2012, Universidad de Valladolid: Valladolid, España.
- Kutikov, A. and Uzzo, R.G. «The R.E.N.A.L. nephrometry score: a comprehensive standardized system for quantitating renal tumor size, location and depth». J Urol. 182(3): 844-853, 2009.
- Vallejo, L.; Campero, J.M.; Fulla, J.; Mülchi, C.; Valenzuela, R.; Martínez, N. and Ramos, C.G. «Nefrectomía parcial laparoscópica en tumores técnicamente complejos». Rev Chil Urol. 81(2): 11-15, 2016.
- Valdivia-Blondet, L. «Electrocirugía». Dermatol Peru. 23(1): 11-25, 2013.
- Bertolo, R.; Campi, R.; Mir, M.C.; Klatte, T.; Kriegmair, M.C.; Salagierski, M.; Ouzaid, I. and Capitanio, U. «Systematic review and pooled analysis of the impact of renorraphy techniques on renal functional outcome after partial nephrectomy». Eur Urol Oncol. 2(5): 572-575, 2019.
- Véliz, A.; Campero, J.M.; Cancino, C.; Martínez, G.; Vallejo, L.; Álvarez, E.; Chiang, H.; Fulla, J.; Guzmán, S.; Hinrichs, A.; Kerkebe, M.; Mercado, A.; Palma, C.; Ramos, C.G.; Rosenfeld, R.; Salgado, G.; Susaeta, R.; Valdevenito, R. and Zambrano, N. Nefrectomía parcial laparoscópica de tumores intrarrenales: complejo escenario quirúrgico para el urólogo. in 38º Congreso Chileno de Urología. 2016. Coquimbo, Chile.: Revista Chilena de Urología.
- Unsal, A.; Koca, G.; Resorlu, B.; Bayindir, M. and Korkmaz, M. «Effect of percutaneous nephrolithotomy and tract dilatation methods on renal function: assessment by quantitative single-photon emission computed tomography of technetium-99m-dimercaptosuccinic acid uptake by the kidneys». J Endourol. 24(9): 1497-1502, 2010.
- Richie, J.P. «Clinical stage 1 testicular cancer: the role of modified retroperitoneal lymphadenectomy». J Urol. 144(5): 1160-1163, 1990.
- Donohue, J.P.; Thornhill, J.A.; Foster, R.S.; Rowland, R.G. and Bihrle, R. «Retroperitoneal lymphadenectomy for clinical stage A testis cancer (1965 to 1989): modifications of technique and impact on ejaculation». J Urol. 149(2): 237-243, 1993.
- Corsi, O.; Rada, G. and Pena, J. «PET-CT for the management of testicular seminoma patients with post-chemotherapy residual masses». Medwave. 19(4): e7625, 2019.
- Vidal-Mora, I. and Castillo, O.A. «Linfadenectomía retroperitoneal lumboaórtica laparoscópica en cáncer de testículo». Arch Esp Urol. 63(5): 373-379, 2010.
- Holtl, L.; Peschel, R.; Knapp, R.; Janetschek, G.; Steiner, H.; Hittmair, A.; Rogatsch, H.; Bartsch, G. and Hobisch, A. «Primary lymphatic metastatic spread in testicular cancer occurs ventral to the lumbar vessels». Urology. 59(1): 114-118, 2002.
- Donohue, J.P.; Zachary, J.M. and Maynard, B.R. «Distribution of nodal metastases in nonseminomatous testis cancer». J Urol. 128(2): 315-320, 1982.
- Cadeddu, J.A.; Bishoff, J.T.; Chan, D.Y.; Moore, R.G.; Kavoussi, L.R. and Jarrett, T.W. «Laparoscopic testicular denervation for chronic orchalgia». J Urol. 162(3 Pt 1): 733-735; discussion 735-736, 1999.
- Tewari A, Srivasatava A, Menon M; Members of the VIP Team. A prospective comparison of radical retropubic and robot-assisted prostatectomy: experience in one institution, BJU International, 92: 205-210.), (Ficarra V, Novara G, Artibani W, Cestari A, Galfano A, Graefen M, Guazzoni G, Guillonneau B, Menon M, Montorsi F, Patel V, Rassweiler J, Van Poppel H. Retropubic, laparoscopic, and robot-assisted radical prostatectomy: a systematic review and cumulative analysis of comparative studies, Eur Urol 2009 May;55(5):1037-63)
- Lu-Yao GL, Albertsen PC, Moore DF, Shih W, Lin Y, DiPaola RS, Barry MJ, Zietman A, O’Leary M, Walker-Corkery E, Yao SL. Outcomes of localized prostate cancer following conservative management. JAMA, 2009. 302: 1202.
- Guillonneau B, Cathelineau X, Barret E, Rozet F, Vallancien G. Laparoscopic radical prostatectomy: technical and early oncological assessment of 40 operations. Eur Urol. 1999;36(1):14-20.
- Vilches R, Orellana S, Román J, Aliaga A, Olea M, Segebre J, Reyes D, Walton A, Vega A, Consigliere L, Bravo C. Initial experience of laparoscopic radical prostatectomy vs. The established open radical prostatectomy curve by the same surgeon.
- Ficarra V, Novara G, Rosen RC, Artibani W, Carroll PR, Costello A, Menon M, Montorsi F, Patel VR, Stolzenburg JU, Van der Poel H, Wilson TG, Zattoni F, Mottrie A. Systematic review and meta-analysis of studies reporting urinary continence recovery after robot-assisted radical prostatectomy. Eur Urol. 2012 Sep;62(3):405-17).
- Sighinolfi MC, Assumma S, Cassani A, Sarchi L, Calcagnile T, Terzoni S, Sandri M, Micali S, Noel J, Moschovas MC, Seetharam B, Bozzini G, Patel V, Rocco B. Pre-operative prediction of extracapsular extension of prostate cancer: first external validation of the PRECE model on an independent dataset. Int Urol Nephrol. 2023 Jan;55(1):93-97.
- De la Taille A., Nerve-sparing Techniques During Robot-assisted Radical Prostatectomy: Clips or Low-energy Bipolar Coagulation? Low Energy, Eur Urol Open Sci. 2022 Sep 1;44:102–103.
- Wagaskar V, Mital A, Sobotka S, Wiklund P, Martini A, Tewari A. Hood Technique for Robotic Radical Prostatectomy—Preserving Periurethral Anatomical Structures in the Space of Retzius and Sparing the Pouch of Douglas, Enabling Early Return of Continence Without Compromising Surgical Margin Rates. Eur Urol Volume 80, Issue 2 p213-221August 2021
- Coelho, Chauan S, Orvieto M, Sivaraman A, Palmer K, Coughlin G, Patel V. et al. Influence of modified posterior reconstruction of the rhabdosphincter on early recovery of continence and anastomotic leakage rates after robot-assisted radical prostatectomy. Eur Urol. 2011 Jan;59(1):72-80
- Arroyo C, Martini A, Wang J, Tewari AK. Anatomical, surgical and technical factors influencing continence after radical prostatectomy. Ther Adv Urol. 2019 Jan 8;11:1756287218813787
- International Agency for Research on Cancer. Estimated number of new cases in 2020, worldwide, both sexes, all ages. Access date December 2022.
- Comperat, E., et al. Clinicopathological characteristics of urothelial bladder cancer in patients less than 40 years old. Virchows Arch, 2015. 466: 589.
- Lenis, A.T., et al. Urinary Diversion. JAMA, 2020. 324: 2222.
- Sari Motlagh, R., et al. Impact of hospital and surgeon volumes on short-term and long-term outcomes of radical cystectomy. Curr Opin Urol, 2020. 30: 701.
- Liedberg, F., et al. Cystectomy for bladder cancer in Sweden – short-term outcomes after centralization. Scand J Urol, 2024. 59: 84.
- Schulz, G.B., et al. Surgical High-risk Patients With ASA >/= 3 Undergoing Radical Cystectomy: Morbidity, Mortality, and Predictors for Major Complications in a High-volume Tertiary Center. Clin Genitourin Cancer, 2018. 16: e1141.
- Bochner BH, Dalbagni G, Marzouk KH, Sjoberg DD, Lee J, Donat SM, Coleman JA, Vickers A, Herr HW, Laudone VP., Randomized Trial Comparing Open Radical Cystectomy and Robot-assisted Laparoscopic Radical Cystectomy: Oncologic Outcomes,Eur Urol. 2018 May 18;74(4):465–471).
- RAZOR. Parekh D. y cols., Lancet 2018; 391: 2525–36.
- Catto JWF, Khetrapal P, Ricciardi F, Ambler G, Williams NR, Al-Hammouri T, Khan MS, Thurairaja R, Nair R, Feber A, Dixon S, Nathan S, Briggs T, Sridhar A, Ahmad I, Bhatt J, Charlesworth P, Blick C, Cumberbatch MG, Hussain SA, Kotwal S, Koupparis A, McGrath J, Noon AP, Rowe E, Vasdev N, Hanchanale V, Hagan D, Brew-Graves C, Kelly JD; iROC Study Team. Effect of Robot-Assisted Radical Cystectomy With Intracorporeal Urinary Diversion vs Open Radical Cystectomy on 90-Day Morbidity and Mortality Among Patients With Bladder Cancer: A Randomized Clinical Trial. JAMA. 2022 Jun 7;327(21):2092-2103.

