Epidemiología y manejo médico
Dr. Juan Fulla O.
La litiasis es una enfermedad común de las vías urinarias. Su incidencia es muy variable y es causa de considerable morbilidad debido al dolor, hematuria o infección que puede generar. Se estima alrededor del 0.5%, con una prevalencia del 5%, y una tendencia a la recidiva del 50- 60% a los 5 y 9 años, respectivamente. Predomina en los hombres con una proporción hombre/mujer de 2/1. Puede presentarse a cualquier edad, pero es más frecuente en la tercera década de la vida, y se presenta en todas las razas, siendo menos frecuentes en individuos afroamericanos.
Su etiología aún no es absolutamente clara. En algunas formas de presentación existe un factor hereditario, como en los cálculos de cistina, ácido úrico y oxalato de calcio. En cambio, en otras, la infección urinaria, el clima y otros factores extrínsecos también pueden estar presentes. Los cálculos, en general, son cristales incluidos en una matriz orgánica. La mayoría de estos son radiopacos, porque contienen calcio, magnesio o cistina. El 70% están constituido por calcio, 7% son exclusivamente de fosfato de calcio, 5-10% contienen ácido úrico, las de fosfato-amónico-magnésico el 10-15% y las litiasis de cistina representan el 2%(1-4).
Patogenia
La patogenia de la litiasis renal es multifactorial e involucra alteraciones en mecanismos fisicoquímicos y biológicos que regulan la solubilidad de la orina. No todos los aspectos de la formación de cálculos renales son bien conocidos, ni tampoco el sitio exacto donde se inician estos.
La formación de un cálculo renal requiere necesariamente que la concentración de la sal formadora exceda su solubilidad en la orina, es decir, se encuentre en estado de supersaturación. Dependiendo de la especie predominante de la sal formadora, influirá también en su límite de solubilidad, el pH e interacciones iónicas(2-3). La etapa inicial para la formación de un cálculo renal es la aparición de la fase sólida o nido de cristales de la respectiva sal. Si cristales de una misma especie forman el nido, se habla de nucleación homogénea. Sin embargo, en una solución compleja como es la orina, cristales de un tipo pueden también arrastrar la precipitación de otros de distinto tipo. Esto último se denomina nucleación heterogénea y ha sido demostrada para la precipitación de cristales de oxalato de calcio inducida por cristales de urato monosódico o de fosfato de calcio. Una vez que se ha formado un nido, este alcanza el tamaño suficiente para alojarse en el tracto urinario gracias al crecimiento y agregación de cristales e interacciones con la pared celular.
La litogénesis renal puede obedecer también al déficit de inhibidores de la cristalización. Estas son sustancias presentes normalmente en la orina que actúan adhiriéndose a los sitios activos de los cristales, antagonizando cualquiera de las etapas de la litogénesis. Citrato y magnesio corresponden a los inhibidores mayormente demostrados(2-3). Finalmente, factores secundarios como anomalías anatómicas, infección o drogas poco solubles, pueden conducir per se a la formación de cálculos.
Tipos de patogenia
a. Saturación: Cuando la concentración de una sustancia aumenta llega un momento en que la orina es incapaz de mantenerla en solución, por lo que se inicia una nucleación espontánea del cristal y pueden agregarse entre sí, constituyendo un cálculo renal(5-6).
b. Inhibidores de la cristalización: Se unen con los distintos iones para formar complejos solubles que inhiben o retardan la cristalización. Su déficit favorece la formación de cálculos(5-6).
c. Alteración del pH urinario: Los cálculos de ácido úrico se ven favorecidos por un pH ácido, y los de estruvita por un pH alcalino. Los de oxalato cálcico no están influenciados(5-6).
d. Disminución del volumen urinario: La reducción del volumen de orina y la estasis urinaria favorecen la cristalización, ya que aumenta la concentración de las sales(5-6).
Clasificación de trastornos metabólicos asociados
Hipercalciuria(5-7)
• Con normocalcemia
- Idiopática (absortiva, renal)
- Acidosis tubular renal distal
- Otros (espongiosis, diuréticos de asa)
• Con hipercalcemia
- Hiperparatiroidismo primario
- Otros (metástasis ósea, mieloma, leucemia, linfoma)
• Hipercalciuria idiopática
Hiperoxaluria(5-7)
Producción endógena aumentada
- Hiperoxaluria primaria
- Déficit de vitamina B6
- Aporte elevado de precursores (vitamina C, etilenglicol)
Exceso de aporte o de absorción digestiva
- Hiperoxaluria entérica
- Dieta rica en oxalatos y proteínas
- Dieta pobre en calcio
• Hiperoxaluria idiopática
Hiperuricosuria(5-7)
• Ingesta elevada de proteínas y purinas
• Aumento de producción endógena de ácido úrico
Hipocitraturia(5-7)
• Acidosis tubular renal distal, tiazidas, diarrea crónica
Hipercalciuria
Definición: En condiciones de aporte normal de calcio (aproximadamente 1g/día), se define hipercalciuria (en adultos) como la excreción urinaria de más de 250 mg de calcio/24 horas en mujeres y 300 mg/24 horas en hombres o en niños como mayor a 4 mg/kg peso. Dependiendo de la literatura, afecta entre un 30-60% de los pacientes litiásicos(2,3). Su fisiopatología sigue siendo desconocida. Factores genéticos y nutricionales están asociados. Sin importar el mecanismo primario que la origina, las tiazidas tienen un efecto benéfico al disminuir la eliminación urinaria de calcio y favorecer la formación ósea. Hay 2 situaciones de hipercalciuria: con calcio sérico normal o aumentado(8).
Hipercalciuria con normocalcemia
A su vez, se divide en idiopática (absortiva o renal), acidosis tubular renal; y otros procesos, como la espongiosis renal y el uso de diuréticos de asa.
Idiopática(5-6,8): En los países industrializados es la causa más frecuente de litiasis renal, 80% de los casos de hipercalciuria. Se puede dividir en absortiva y renal.
La hipercalciuria absortiva aumenta la absorción de calcio desde el yeyuno, aumenta el calcio filtrado por el glomérulo y supresión de la hormona paratiroidea, con una reabsorción tubular disminuida de calcio, lo que da lugar a la hipercalciuria. La hipercalciuria renal se produce por un defecto tubular renal intrínseco en la excreción de calcio y disminución relativa en el calcio sérico, por lo que aumenta la hormona paratiroidea de forma secundaria, que moviliza el calcio desde el hueso e incrementa la absorción de calcio desde el intestino. Se produce un retorno a valores aumentados de calcio hacia el riñón, por lo que los túbulos renales excretan grandes cantidades de calcio.
Acidosis tubular renal distal(5-8): Existen la hereditaria y la idiopática. Producen nefrocalcinosis y litiasis renal. El defecto radica en la incapacidad de los túbulos distales para secretar hidrogeniones, provocando una acidosis metabólica secundaria, hipocitraturia, aumento de la resorción ósea y disminución de la reabsorción tubular de calcio con hipercalciuria.
Otros procesos(8): Espongiosis renal (presencia de dilatación de los túbulos colectores renales, que afectan total o parcialmente las pirámides o papilas de uno o ambos riñones y el uso de diuréticos de asa).
Hipercalciuria con hipercalcemia
La causa más frecuente es el hiperparatiroidismo primario, el 5% de todos los pacientes litiásicos lo presentan. El daño renal es secundario a hipercalcemia, que limita la capacidad de concentración del riñón y deteriora la capacidad renal de acidificar la orina(5-6).
Otras
Pueden ser: metástasis ósea por carcinoma, mieloma múltiple, linfomas, leucemias, intoxicación por vitamina D, sarcoidosis, síndrome de la leche y alcalinos, inmovilización, tirotoxicosis, enfermedad de Pager, síndrome de Cushing e insuficiencia suprarrenal(5-6).
Hiperoxaluria
El 85% del oxalato presente en la orina es derivado de producción hepática (a partir de precursores como el ácido ascórbico o vitamina C y el ácido glioxílico). Aunque el oxalato de la dieta se absorbe escasamente, no sufre metabolización y es excretado en la orina. Las causas de hiperoxaluria se dividen en(2-3):
- Hiperoxaluria por producción excesiva de oxalatos.
- Hiperoxaluria primaria: Hay un déficit enzimático que conlleva a un aumento en la excreción urinaria de oxalato, progresando hacia la nefrocalcinosis, insuficiencia renal y muerte.
- Exceso de aporte o de absorción digestiva.
- Hiperoxaluria entérica: Alteran el metabolismo del oxalato enfermedades como la diarrea crónica, enfermedad intestinal crónica, enfermedad celíaca, proliferación bacteriana o intervenciones quirúrgicas de derivación intestinal, favoreciendo la mayor absorción de oxalato en el colon.
- Régimen rico en oxalatos y en proteínas, y régimen pobre en calcio.
La causa de hiperoxaluria más importante en clínica es la entérica. Cualquier condición en que exista mala absorción de grasas, facilita la unión del calcio de la dieta a ácidos grasos y de este modo el oxalato queda libre para que se absorba. Una causa cada vez más frecuente de ocurrencia de este mecanismo es lo que se ha observado en los pacientes sometidos a cirugía bariátrica, especialmente con técnicas que tienen componente mal absortivo, como es el bypass gástrico en Y de Roux. El aporte exagerado de vitamina C (sobre 3 g/día), que se metaboliza a oxalato, también puede inducir hiperoxaluria. La hiperoxaluria primaria es muy poco frecuente y se manifiesta por litiasis, nefrocalcinosis e insuficiencia renal antes de los 5 años de edad. Entre el 2- 8% de pacientes con litiasis renal cálcica presentan hiperoxaluria(2,3,8).
Hiperuricosuria
En alrededor del 35% de los sujetos con litiasis renal se ha comunicado hiperuricosuria. En estos casos se considera como tal una excreción urinaria mayor de 600 mg/día de ácido úrico. Ello obedece a que el límite habitual de saturación urinaria para el urato monosódico (principal especie del ácido úrico presente en la orina de pH normal) es de 300 mg/litro y se considera como inhabitual la eliminación de volúmenes de orina superiores a 2 litros/día(2,3).
Su origen es multifactorial. Se favorece por un régimen rico en purinas y en proteínas animales (carnes rojas, pescado y mariscos) y también por la presencia de anomalías del metabolismo endógeno de las purinas y de la reabsorción tubular del ácido úrico (gota, síndromes mieloproliferativos, lisis celular aumentada en postquimioterapia y uso de drogas uricosúricas). El pH ácido favorece la presencia de la forma no disociada de ácido úrico(8).
Hipocitraturia
El citrato es un componente central del ciclo de Krebs y normalmente es el anión orgánico más abundante en la orina. Actualmente, el citrato es el principal inhibidor de la cristalización urinaria, susceptible de evaluación clínica. Actúa inhibiendo la formación de cálculos de oxalato y fosfato de calcio, disminuyendo la saturación de estas al unir calcio y formar complejos solubles con este o retrasando la nucleación y crecimiento de los cristales. La excreción urinaria normal de citrato oscila entre 320 a 1.200 mg/día y depende principalmente de su reabsorción tubular renal, que es regulada principalmente por el pH intracelular de la célula del túbulo renal. La hipocitraturia ha sido descrita en el 19 a 72% de pacientes con litiasis cálcica, aislada o más comúnmente asociada a otros factores de riesgo (1.4). Las causas de hipocitraturia son síndrome de mala absorción, insuficiencia renal, acidosis tubular renal distal, hipokalemia (por acidosis intracelular), uso de tiazidas (por hipokalemia asociada) e infección urinaria (por consumo del citrato por los gérmenes). Sin embargo, la causa más frecuente es idiopática, que se relacionaría con deficiencias congénitas de las enzimas que regulan el metabolismo renal del citrato(2,6,8).
Tipos de cálculos
Litiasis de calcio
Son las más frecuentes (80%). El calcio es el principal ion presente en los cristales urinarios. Algo más del 95% del Ca filtrado en el glomérulo se reabsorbe, y menos del 2% se excreta por la orina. El 85% de etiología desconocida. Son más frecuentes en varones (3:1), con mayor incidencia entre los 30-40 años. Muy frecuente la recidiva, presentan un 50% de recurrencias a los 5 años(3,7). Existe un grupo de pacientes en los que no se demuestra ninguna anomalía, pero que son formadores de cálculos. Este grupo representa aproximadamente el 20% de los pacientes con litiasis cálcica (litiasis cálcica idiopática)(7).
Litiasis de ácido úrico
Es un ácido débil que a pH urinario acido es muy insoluble y cristaliza. Existen factores de riesgo (3,7):
– Hiperuricemia (el 10-20% de los pacientes gotosos presentan litiasis de ácido úrico)
– Disminución del volumen urinario
– Edad avanzada
– Consumo elevado de proteínas animales y purinas
Litiasis de fosfato de amonio magnesiano (estruvita)
Es una litiasis infecciosa por gérmenes ureolíticos. Es más frecuente en mujeres (3-5:1) y corresponden al 10-20% de las litiasis. Presentan mayor incidencia cerca de los 40 años y las tasas de recurrencia son del 35% a los 5 años(9). La infección urinaria está presente hasta en el 90% con gérmenes ureolíticos como Proteus spp. Son cálculos grandes (cálculos coraliformes), puede alcanzar grandes tamaños adoptando la forma de la pelvis y de los cálices renales (coraliformes). Característicamente no son muy duros y tienen una superficie irregular(9). El diagnóstico de se basa en 3 puntos:
– Presencia de un germen ureolítico en orina
– Un pH urinario superior a 7
– La presencia de cristales de estruvita en la orina
Factores favorecedores de litiasis infecciosa(9):
- Anomalías anatómicas favorecen las infecciones urinarias y el riesgo de recidiva.
- Anomalías metabólicas es un factor de riesgo para la aparición de infección urinaria, y el cálculo infectado va creciendo a expensas de la formación de diferentes capas de estruvita.
- Gérmenes ureolíticos: Proteus es el principal responsable de los cálculos infecciosos.
La ureasa en una enzima bacteriana que favorece la hidrólisis de la urea en amoníaco y en dióxido de carbono (CO2). El amoníaco capta los iones H+, se transforma en amonio y alcaliniza la orina. La elevación del pH urinario por encima de 7.5 favorece la precipitación del fosfato amónico magnésico o estruvita.
Litiasis de cistina
Se presenta en la cistinuria, afecta al transporte en la membrana celular del túbulo renal y del epitelio intestinal de los aminoácidos (cistina, ornitina, lisina y adenosina). La herencia es autosómica recesiva. La solubilidad de la cistina depende del pH, de forma que es importante alcalinizar la orina de estos pacientes para mantener un pH por encima de 7.5. Corresponde al 1% de los cálculos sin diferencias de sexos y su formación se inicia en la infancia y adolescencia(7).
Litiasis de oxalato monohidrato + ácido úrico
Estas litiasis se acompañan siempre de pH bajo con hipocitraturia. Son muy recidivantes, pero responden muy bien al citrato potásico disminuyendo las recidivas(7).
Litiasis infrecuentes
– Por alteraciones metabólicas (déficit de xantinoxidasa, déficit de adenina fosforribodiltranferasa, etc.)
– Por compuestos orgánicos (detritus celulares, colesterol, etc.)
– Por medicamentos: Estos representan el 1-2% de todos los cálculos renales(10):
- Indinavir: Es la principal causa. Este es un inhibidor de la proteasa utilizados en pacientes con VIH y produce litiasis radiotransparentes hasta en un 12-20% de los pacientes tratados. Son los únicos cálculos urinarios radiolúcidos en la TC sin contraste.
- Sulfamidas: Son causantes de litiasis renal o de insuficiencia renal aguda por cristalización de su metabolito N-acetilado en la luz tubular. Los principales factores de riesgo son la administración de dosis elevadas, su rápida acetilación hepática, el pH urinario bajo, su abundante excreción urinaria y su baja solubilidad.
- Triamtereno: Actualmente su uso ha disminuido como diurético al igual que la incidencia de sus cálculos. Su incidencia se estima en un 0.4% de todos los cálculos.
Epidemiología
La litiasis urinaria es la tercera causa de enfermedad de la vía urinaria, y su prevalencia en Chile es 5-12%. Afecta al 1-20% de la población general según las series. Se trata además de una enfermedad con tasas de recurrencia del 50%, pudiendo llegar al 70% a los 10 años. La cifra media de formación de nuevos cálculos, en pacientes que previamente han formado uno, es de aproximadamente un cálculo cada 2 o 3 años.
Se calcula que en torno al 75% de los pacientes que tienen un cálculo urinario, lo expulsarán de forma espontánea, mientras que el 25% restante requerirán de algún procedimiento urológico(3,7,11).
En el estudio epidemiológico de los factores predisponentes de la litiasis existen factores intrínsecos (propios de cada individuo) y factores extrínsecos (ambientales), además de los factores favorecedores(3,12):
Factores intrínsecos (4,7,11)
• Edad y sexo: La mayor incidencia está entre los 20 y los 50 años. Según el sexo, es de alrededor de dos hombres por cada mujer, excepto en la infancia en que son cifras similares. En la mujer son más frecuentes alteraciones metabólicas como la cistinuria y el hiperparatiroidismo primario, así como de origen infeccioso. En el hombre son más frecuentes las de oxalato cálcico y ácido úrico. Al parecer, los andrógenos aumentan la concentración plasmática de oxalato, lo cual incrementa su excreción urinaria y el depósito de cristales de oxalato de calcio a nivel renal.
• Raza: Se ha estimado que la litiasis urinaria es 3-4 veces más frecuente en la raza blanca.
• Herencia: Alrededor de un 25% de pacientes litiásicos tienen antecedentes familiares. Esta mayor incidencia familiar se debe a un defecto poligénico con penetración parcial como, por ejemplo, la acidosis tubular renal familiar, que se asocia a nefrolitiasis y nefrocalcinosis en casi el 70% de los enfermos.
Factores extrínsecos (4,7,11)
• Ingesta hídrica: Su aumento ayuda a evitar la formación de los cálculos. Un incremento de la diuresis de 800-1.200 ml/día disminuye la frecuencia de urolitiasis en un 86%.
• Dieta: Influye en la litogénesis, ya sea aumentándola o disminuyéndola. Las dietas ricas en proteínas de origen animal favorecen la hipercalciuria, la hiperuricosuria y la hiperoxaluria, con precipitación de oxalato de calcio. Los hidratos de carbono refinados se relacionan con las litiasis cálcicas porque aumentan los niveles de calcio y oxalato en la orina. La ingesta de cítricos aumenta la eliminación urinaria de sustancias que inhiben la litogénesis. Las fibras vegetales disminuyen la absorción intestinal de proteínas animales y sacarosa(13).
• Geografía: No hay duda de que la geografía es un aspecto importante, no sólo por la incidencia sino también el tipo de litiasis. Pero muchos pacientes cambian de zona geográfica y continúan con el mismo tipo de litiasis. Este hecho destaca aún más la importancia de los factores intrínsecos.
• Clima: El clima tiene su influencia en la litogénesis, hallándose más casos de litiasis en los meses calurosos, probablemente por el aumento de la transpiración que conlleva mayor concentración de la orina. Durante las estaciones estivales los cálculos de ácido úrico aumentan su incidencia, los de tipo infeccioso disminuyen, y los de oxalato cálcico y fosfato cálcico no varían su incidencia.
Factores favorecedores (4,7,11)
• Sobresaturación de las sales.
• Alteración del pH urinario: Ácido (cristalización de ácido úrico), básico (cristalización de fosfatos).
• Disminución de los inhibidores del crecimiento de los cristales: citrato, magnesio, etc.
• Disminución de los inhibidores de la agregación de los cristales: Nefrocalcina, proteína de Tamm-Horsfall, etc.
• Obstrucción de la vía urinaria o anomalías anatómicas: Como la enfermedad quística medular (ectasia túbulos renales).
• Alteraciones de los transportadores de calcio y oxalato o de los aminoglicanos del epitelio urinario.
Fases de la litogénesis
Fase de nucleación (4,8)
Si la formación del núcleo se produce en soluciones puras, dará lugar a una estructura cristalina de igual composición conocida como nucleación homogénea. Es poco usual por los valores altos de sobresaturación urinaria. La más frecuente es la nucleación heterogénea, en la que el núcleo es diferente al resto. Los principales nucleantes son: ácido úrico, fosfatos, detritus, etc.
Fase de crecimiento cristalino (4,8)
Es el paso siguiente por la disminución de los inhibidores (citrato, fitato, magnesio) y por la sobresaturación de la orina.
Fase de agregación (4,8)
Existen dos tipos.
– Primaria: Sobre cristales ya formados, se adhieren otros a la superficie de los primeros.
– Secundaria: Los cristales ya formados se unen entre ellos mediante sustancias aglutinantes, por ejemplo, en residuos postlitotricia.
Es fundamental poder diferenciar los diferentes tipos de cálculos, ya que condicionarán la evolución, el pronóstico y el tratamiento a corto, mediano y largo plazo. Para ello, es preciso informar al paciente de la necesidad de recoger el cálculo o los fragmentos (postlitotricia) para su análisis. En todos los pacientes se debe examinar al menos un cálculo, la repetición del análisis está indicada cuando se ha producido algún cambio que podría haber influido en la composición de los cálculos.
Los procedimientos analíticos de elección son (4,7):
• Cristalografía de rayos X.
• Espectrografía infrarroja: Es el método de elección para el estudio de la litiasis porque la imagen espectrografía es única para cada tipo de cálculo, además es una prueba rápida y barata.
Cuando no se recuperan cálculos su composición se puede evaluar de la siguiente forma (3,6):
• Características radiológicas de los cálculos.
• Examen microscópico del sedimento urinario para detectar cristales de estruvita o cistina.
• pH de la orina: Bajo en los pacientes con cálculos de ácido úrico y elevado en aquellos con cálculos infecciosos.
• Bacteriuria/urocultivo: Cuando un cultivo es positivo, hay que solicitar microorganismos productores de ureasa (Proteus, el más frecuente, Pseudomona Aeruginosa, Providencia y Klebsiella Pneumoniae).
Clínica
La enfermedad litiásica urinaria ha sido un problema desde siempre. Hemos pasado de una litiasis preferentemente vesical en la antigüedad, formada por urato y fosfato amónico, cuyo origen era infeccioso y nutricional, a una litiasis del mundo industrializado que se caracteriza por ser oxalocálcica y preferentemente renal. Su diagnóstico y tratamiento ha experimentado grandes avances, pues la tecnología se ha impuesto. Un gran paso fue la aparición de la cistoscopia tanto rígida como flexible, más aún con la disminución de los diámetros de los ureteroscopios. Junto a esto se fue perfeccionado la técnica de la litotricia intracorpórea (LEC). El cuadro clínico dependerá de la localización, tamaño y capacidad obstructiva del cálculo. Esta puede ser asintomática, o presentar un cólico nefrítico, hematuria o los síntomas de una infección urinaria.
Cólico nefrítico (5,14)
Es lo más frecuente. La obstrucción produce aumento de la presión intraluminal y distensión de la cápsula renal, y la irritación de las terminaciones nerviosas de la vía urinaria. Es de inicio brusco, con picos de gran intensidad. Se irradia a genitales, con agitación psicomotora, náuseas y vómitos (estimulación del plexo celíaco), y distensión abdominal por el íleo reflejo.
Hematuria (15)
Asociada al dolor y puede ser sin coágulos, recidivante y de duración variable.
Infección urinaria (5)
Especialmente a repetición y persistentes a pesar de un tratamiento antibiótico correcto. Una complicación grave es la pielonefritis con obstrucción, la cual debe ser resuelta a la brevedad. Alta es la relación entre microorganismos ureasa positivos y cálculos coraliformes, sin embargo, algunos cálculos de estruvita se pueden asociar también a ureasa negativos.
Por último, se debe señalar que en algunos casos el motivo de consulta es un hallazgo incidental de una calcificación en estudio radiológico abdominal por otros motivos.
Diagnóstico
Análisis de orina y sangre (4,7)
El estudio básico debería incluir sedimento urinario y el urocultivo cuando se sospeche de una infección urinaria. En el análisis de orina y sedimento existen una serie de parámetros que nos pueden orientar hacia la presencia de litiasis e incluso su naturaleza. El hallazgo de micro o macrohematuria apoya el diagnóstico hasta en un 70%, pero también puede estar ausente. El análisis de orina informa bacterias en orina, pH, resultado cuantitativo de hematuria y leucocituria, y presencia de cristales.
Análisis sanguíneo (4,7)
Es necesario en un cólico renal complicado, recuento leucocitario, la desviación a la izquierda y la función renal. Frente a un cuadro séptico agregar hemoglobina, hematocrito, plaquetas y coagulación.
Técnicas de imagen (4,7)
El objetivo es visualizar, enumerar, localizar, medir y obtener la máxima información del cálculo. El diagnóstico clínico ha de confirmarse mediante una técnica de imagen adecuada y su elección dependerá de: posibilidad de exponerse a irradiaciones ionizantes, al uso de medios de contraste, antecedentes de alergia, niveles elevados de creatinina, medicación con metformina, hipertiroidismo no tratado, embarazo o lactancia.
Se debe realizar estudio en:
• Formación muy recurrente de cálculos (3 cálculos en 3 años).
• Cálculos infecciosos.
• Cálculos de ácido úrico y de urato (gota)
• Niños y adolescentes
•Cálculos determinados genéticamente (Cistinuria, Hiperoxaluria 1ª, Acidosis tubular renal, Fibrosis quística)
• Hiperparatiroidismo
• Enfermedades digestivas (enfermedad de Crohn, malabsorción, colitis)
• Riñón solitario
• Fragmentos residuales de cálculos (3 meses después del tratamiento de litiasis)
• Nefrocalcinosis
• Carga litiásica elevada bilateral
• Antecedentes familiares de litiasis y otros factores de riesgo en niños formadores de cálculos o pacientes con nefrocalcinosis
Exámenes imagenológicos (16,17):
1. TAC helicoidal sin contraste (Pielotac)
Gran sensibilidad y especificidad (94-100% y 92-100%, respectivamente, para la detección de cálculo ureteral). Por esto se ha convertido en el gold standard. Realiza un barrido helicoidal con cortes de 5 mm que permite la detección de cálculos de hasta 2 mm (con la administración de contraste, permite la evaluación de la función renal).
• No requiere contraste, útil en insuficiencia renal o con alergia al mismo.
• Puede visualizar pequeños cálculos, incluso radiotransparentes, excepto el de Indinavir.
• Observan múltiples signos indirectos: dilatación pieloureteral, infiltración y edema de la grasa perirrenal o pared edematosa del uréter.
• El proceso es simple y rápido.
• Permite hacer el diagnóstico diferencial con otras patologías extraureterales.
• No requiere preparación intestinal.
2. Radiografía simple de abdomen
Es rápido, sencillo e inocuo. El 90% de los cálculos son radiopacos y por lo tanto visibles, pero la sensibilidad no supera el 60%.
3. Ecotomografía abdominal
Es rápido, económico e inocuo. Otras ventajas son valorar otros órganos (apéndice o vesícula biliar) y cálculos radiotransparentes. La ecografía aporta información morfológica, dilatación de la vía y la detección del cálculo, pero en general para cálculos mayores de 4 mm, situados especialmente en la unión pieloureteral o la unión ureterovesical, como método aislado es poco sensible. No supera el 40% para la detección de cálculos.
4. Pielografía de eliminación
Con sensibilidad y especificidad elevadas (90% y 95%, respectivamente), es relativamente inocua. Nos informa del número, tamaño, forma y situación del cálculo y estado funcional de los riñones. Puede informar retraso de la eliminación del contraste y se correlaciona bien con el grado de obstrucción, pero tiene inconvenientes, como la exposición a radiaciones ionizantes, el uso de contraste (función renal y alergia) y preparación de intestino. No se recomienda realizarla durante el cólico.
5. Pielografía retrógrada o ascendente
Sólo útil en pacientes con riñón excluido.
Estudio metabólico
En los últimos 20-30 años han existido avances notables en el manejo urológico de los cálculos renales, obteniéndose la remoción de estos con técnicas cada vez menos invasivas, como la litotricia y cirugía endoscópica, disminuyendo así la estadía hospitalaria y complicaciones de los eventos litiásicos. A pesar de ello, debe señalarse que tales avances no han modificado la evolución natural y mayoritaria de los pacientes con litiasis renal a recurrir en la formación de cálculos. De esta forma, el estudio de los factores causantes de la formación de cálculos renales y su tratamiento para prevenir la recurrencia es fundamental para el manejo integral de los pacientes con litiasis renal. Esto se traducirá inicialmente en la modificación favorable de los factores de riesgo identificables en la historia y exámenes, disminuyendo progresivamente luego la ocurrencia de nuevos eventos litiásicos sintomáticos y finalmente también la formación de nuevos cálculos renales, así como colaborando al control de la enfermedad ósea extrarrenal, que acompaña a la gran mayoría de los pacientes con litiasis renal recurrente.
No hay investigaciones que aclaren cuándo realizar el estudio de una enfermedad litiásica (si desde el primer episodio o con las recurrencias), sin embargo, dependerá principalmente si se trata de una enfermedad litiásica: no complicada (paciente libre de litiasis después de un primer cuadro o episodios muy separados) o complicada (recurrencias frecuentes con o sin fragmentos residuales, cálculos asociados a factores de riesgo específicos o pacientes con un primer episodio y fragmentos residuales)(18):
Enfermedad litiásica renal no complicada
- Análisis del cálculo.
- Análisis sanguíneo: Calcio y albúmina, creatinina, uratos.
- Análisis de orina: Primera orina de la mañana para pH, leucocitos/bacterias (cultivo de orina bacteriuria).
Enfermedad litiásica complicada
- Análisis del cálculo.
- Análisis sanguíneo: Calcio, creatinina, uratos (análisis opcional, útil si se sospecha litiasis úrica).
- Análisis de orina: Primera orina de la mañana. Recolección de orina de 24 horas, cuatro semanas después de haber eliminado el cálculo. Se determinará calcio, oxalato, citrato, urato, creatinina y volumen.
Tratamiento médico
La obstrucción ureteral aguda estimula la producción de prostaglandinas a nivel renal provocando vasodilatación capilar preglomerular, incrementando el flujo sanguíneo renal, aumentando la presión intraluminal, y provocando dolor. Además inhibe la secreción de hormona antidiurética (ADH), aumentando aún más la presión intraluminal. También pueden aparecer náuseas, vómitos y constipación por íleo reflejo, debido a la estimulación de los plexos celíaco y mesentérico. El tratamiento médico está orientado a:
a) Manejo del dolor y síntomas neurovegetativos.
b) Favorecer la eliminación del cálculo: tratamiento expulsivo.
Tratamiento farmacológico (manejo del dolor)
Antiinflamatorios no esteroidales (AINE):
Produce un potente efecto analgésico y antiinflamatorio, inhibiendo la síntesis de prostaglandinas, disminuyendo la filtración renal y reduciendo la producción de orina y de la presión intraluminal. Se recomienda el uso en bolos único de analgesia en la fase aguda del cólico renal (se puede utilizar junto algún opioide) y en el tratamiento de mantención posterior. Los AINES con mayor poder antiinflamatorio son: Naproxeno, Indometacina, Diclofenaco, y Ketoprofeno, mientras que los AINE con mayor poder analgésico son Ibuprofeno, Dipirona, Ketorolaco y Paracetamol(19-21).
– Ketoprofeno, Ibuprofeno, Naproxeno: Potentes antiinflamatorios y analgésicos, con baja incidencia de efectos adversos. El Ibuprofeno tiene muy poco riesgo gastrointestinal.
– Diclofenaco: Propiedades farmacológicas y clínicas similares al grupo anterior. Se puede utilizar por vía oral y rectal, con eficacia similar y con menos efectos adversos que la vía parenteral.
– Indometacina: Quizás el más potente inhibidor de la síntesis de prostaglandinas. Muy eficaz, pero con frecuentes reacciones adversas gastrointestinales y neurológicas.
– Dipirona: Es el analgésico no opiáceo de primera línea en muchos lugares, su eficacia es similar a otros AINES, especialmente por vía endovenosa.
– Paracetamol: Su uso en el cólico renal está poco definido y estaría indicado durante el embarazo o en casos de contraindicación a otros aines.
Opiáceos:
Excelente analgésico en el cólico renal agudo por su alta potencia y rapidez de actuación, de bajo costo, pero con el riesgo de provocar dependencia. No actúan sobre el origen fisiopatológico del dolor y presentan mayor frecuencia de reacciones adversas (vómitos). Son muy eficaces en el tratamiento del cólico renal agudo como complemento de los AINES por su acción inmediata al cese del dolor, pero sí son de corta duración(20).
Tratamiento expulsivo
La probabilidad de eliminación espontánea de los cálculos ureterales depende fundamentalmente de su tamaño, localización, de la anatomía del uréter y de los antecedentes de expulsión espontánea.
Se eliminan hasta(22):
- El 80% menores a 4 mm.
- El 60% entre 4-6 mm.
- El 20% mayores a 6 mm.
En caso de obstrucción completa las lesiones renales aparecen entre las 2 y 6 semanas. Por esta razón, las terapias expulsivas se pueden mantener por este periodo, excepto que se trate de un paciente monorreno, cólico subintrante (refractario al tratamiento analgésico), alteración anatómica que altere la expulsión o exista alguna complicación (infección, anuria, deterioro de función renal).
Indicaciones del tratamiento(22,23)
– Aumento de ingesta de líquidos que superen los 3 lt/día y garanticen una diuresis superior a 2 lt/día.
– Antiinflamatorios no esteroidales AINES, inhibidores de la COX-2: Potente efecto antiinflamatorio y reducen la contractilidad ureteral, con escasos fenómenos adversos.
– Bloqueadores alfa 1 adrenérgicos: Disminuyen el peristaltismo ureteral, especialmente en el segmento distal, aumentando la capacidad del paso de orina a través del uréter. Son eficaces y seguros en el tratamiento expulsivo de la litiasis en pacientes sin complicaciones, permitiendo aumentar la tasa de expulsión, disminuir el tiempo de la misma, los requerimientos analgésicos y la necesidad de instrumentación. Los estudios comparativos muestran una clara ventaja usando Tamsulosina 0.4 mg/día(22).
– Los calcio-antagonistas provocan relajación de la musculatura lisa ureteral. Varios estudios demuestran que, especialmente el Nifedipino 30 mg/día x 20 días, son eficaces y seguros en el tratamiento expulsivo(24).
– Los corticosteroides (antiedematoso) por sí solos no modifican la tasa ni el tiempo de expulsión, pero en todos los estudios aumentan la eficacia de los a-bloqueantes en la expulsión de las litiasis ureterales. El más usado es el Deflazacort porque es potente, bien tolerado y no necesita pauta descendente. Ej.: Deflazacort 30 mg/24 h x 10 días + Tamsulosina 0.4 mg/24 h x 20 días(23).
Indicaciones quirúrgicas en litiasis urinaria
Dr. Joaquín García G.
Como se mencionó, la prevalencia de la litiasis urinaria alcanza alrededor del 10%, por lo tanto, encontrar un paciente portador de litiasis urinaria, ya sea sintomática o asintomática será un hecho muy frecuente; tanto en la práctica de la medicina general como en la Urológica. A esto se agrega que existe un amplio espectro de presentación clínica, que va desde cálculos diagnosticados de forma incidental y por lo tanto asintomáticos; el cuadro clásico de cólico renal, que se puede acompañar de una falla renal aguda, litiasis asociadas a infección del tracto urinario no obstructiva, hasta cuadros sépticos graves como es la hidropionefrosis.
Es por tanto de vital importancia manejar las técnicas quirúrgicas que deben ser utilizadas en el momento adecuado para las diversas presentaciones clínicas, así como sus contraindicaciones y limitaciones, ya sea de la técnica y/o personales.
Para definir el momento y la técnica quirúrgica más adecuada que se ajuste al diagnóstico y realidad del paciente, es fundamental el análisis previo en particular de cada caso. Para esto usaremos:
a.- Métodos de imágenes (Ecografía, Pielotac, Urotac); Con esto identificaremos factores anatómicos del sistema colector, ubicación de la litiasis, su relación con el parénquima renal, tamaño, cantidad, lateralidad o bilateralidad y permitirá una correcta planificación pre-operatoria de la técnica quirúrgica a desarrollar.
b.- Estudios funcionales (Cintigrama renal); Para casos específicos cuando lo ameritan, por ejemplo, pacientes con funcionalidad diferencial dudosa de alguna de las unidades renales; permitiendo aclarar si es necesario tratar la litiasis o proponer un tratamiento más agresivo como una nefrectomía.
c.- Medición de parámetros inflamatorios e infecciosos, tanto en sangre como en orina (orina completa – urocultivo), que ayudaran a discernir entre un tratamiento definitivo versus el drenaje inmediato de la vía urinaria, pero que es momentáneo, en caso de litiasis obstructiva infectada(25). Debe tratar de asegurarse un cultivo de orina negativo previo a cirugías electivas, el uso de profilaxis antibiótica según la normativa de cada institución, y valorar las comorbilidades de cada paciente en particular, para ofrecer una cirugía segura.
A continuación, revisaremos cuando está indicado intervenir y cuando no, un paciente con diagnóstico de litiasis urinaria en diferentes escenarios clínicos.
Litiasis renal
1) Litiasis renal no obstructiva
a) Observación: Puede indicarse seguimiento a litiasis cáliciliares no obstructivas asintomáticas entre 5-10mm de diámetro, ofreciendo imágenes periódicas. Debe advertirse al paciente que tendrá un porcentaje de crecimiento cercano al 33% y una probabilidad de necesidad de intervención quirúrgica cercano al 11% anual(26). Debe tomarse en consideración la profesión (pilotos, camioneros, etc.) o acceso adecuado a centro capacitado en litiasis (ruralidad).
b) Manejo quirúrgico: Debe ofrecerse manejo quirúrgico para litiasis de mayor tamaño a las mencionadas en el punto anterior, excepto aquellas que sean susceptibles de ser manejadas con terapia médica (litiasis de ácido úrico), ya que existe un riesgo aproximado de un 25 % anual de necesidad de intervención quirúrgica o de presentar un episodio sintomático(27).
2) Litiasis renal obstructiva
a) No infectada: Independiente del tamaño debe ofrecerse manejo quirúrgico por el potencial riesgo de daño renal, ya sea, a través de un manejo descompresivo en aquellos que pudiesen ser candidatos a terapia médica, o manejo quirúrgico definitivo, en el resto de los pacientes.
b) Infectada: Debe indicarse la descompresión urgente de la vía urinaria, por medio de un catéter doble J o una nefrostomía percutánea, asociado a un manejo antibiótico según esquema local, ajustado luego según resultado de cultivos. Luego de controlado el cuadro séptico debe ofrecerse tratamiento definitivo según la técnica más adecuada (como se discutirá en capítulos posteriores)
c) Fragmentos residuales post tratamiento quirúrgico: Los pacientes con litiasis residual post nefrolitectomía endoscópica o percutánea deben ser sometidos a nuevos procedimientos con el fin de garantizar un “stone free status”, ya que fragmentos residuales mayores a 2 mm tienen una probabilidad de tener algún evento relacionado a estos fragmentos de un 43% en 18 meses de seguimiento(28). Porcentaje que aumenta a medida que el tamaño de los fragmentos residuales es mayor.
Litiasis ureteral
Debemos recordar, como fue mencionado previamente, la probabilidad de expulsión espontánea de una litiasis ureteral, varía de un 80% en litiasis menores de 4mm, 60 % en litiasis de 4-6mm y baja considerablemente a menos de un 20% en litiasis mayores a este diámetro. Esto debe tomarse en consideración a la hora de ofrecer tratamiento quirúrgico en un paciente con litiasis ureteral no complicada.
Las indicaciones de tratamiento quirúrgico en litiasis ureteral las podemos dividir también en diferentes escenarios clínicos:
a) Fracaso de terapia médica expulsiva: Como ya se mencionó puede ofrecerse esta terapia a pacientes con cálculos ureterales no complicados, con dolor controlado y que acepten dicha terapia, el tiempo a esperar la expulsión espontánea varía entre 30 a 45 días, superado este período o en aquellos pacientes que soliciten tratamiento quirúrgico o presenten alguna complicación secundaria a la litiasis debe ofrecerse tratamiento quirúrgico(25).
b) Cálculos con muy baja probabilidad de expulsión espontánea, basado en los porcentajes expuestos previamente, se debe ofrecer manejo quirúrgico.
c) Cálculos ureterales complicados con: Dolor no manejable, múltiples consultas en servicio de urgencia por dolor, falla renal, monorrenos, litiasis ureteral bilateral simultánea(25,29).
d) Cálculo ureteral infectado, hidropionefrosis: En este caso se debe ofrecer en forma urgente descompresión de la vía urinaria mediante un catéter doble J o una nefrostomía percutánea asociado a manejo antibiótico adecuado. Una vez superado el cuadro séptico se debe ofrecer tratamiento definitivo de la litiasis habitualmente en una segunda hospitalización(29). A pesar, que existe alguna evidencia nacional que apoyaría el tratamiento precoz de la litiasis dentro de las 48-72 post drenaje de la vía urinaria, y cumpliendo algunos criterios clínicos como estar afebril, sin taquicardia ni polipnea(30).
Elección de la técnica a utilizar
Le elección de la técnica para cada caso debe definirse considerando varias variables. Primero, considerar las características de cada paciente en particular, como comorbilidades, anatomía (tanto renal como de órganos vecinos, columna, etc.) así como tratamientos previos, y sus preferencias personales, entre otros. Segundo ver las características de la litiasis propiamente tal, tamaño o volumen, localización, cantidad, densidad. Tercer punto a considerar es la experiencia o capacidades de cada cirujano y la o las técnicas que domine, y por último la disponibilidad de instrumental, equipamiento e insumos con los que disponga la institución donde trataremos al paciente.
Hoy en día está bastante definido el lugar de cada técnica y sus recomendaciones la encontramos en todas las guías clínicas internacionales, las cuales están basadas habitualmente en la localización de la litiasis, su tamaño, densidad y la probabilidad de dejar a un paciente libre de cálculos (stone free).
Tomando en cuenta lo anterior podemos resumir:
Litiasis ureteral
Las alternativas a utilizar son: ureteroscopía semirrígida, ureteroscopía flexible y litotricia extracorpórea, ganando ventaja la ureteroscopía en cuanto a tasa libre de cálculos y menor porcentaje de retratamiento, en comparación a la litotricia extracorpórea(31).
Al comparar la ureteroscopía flexible con la ureteroscopía semirrígida en litiasis uretral proximal encontramos un porcentaje libre de cálculos de 93,4% en ureteroscopía flexible vs un 77,7% para la ureteroscopía semirrígida(32) (Tabla 1).
| Mayor porcentaje libre de cálculos | Menor porcentaje libre de cálculos | ||
| Litiasis
ureteral distal |
1. Ureteroscopía semirrígida | 2. Ureteroscopía flexible | 3.Litotricia extracorpórea |
| Litiasis ureteral proximal | 1. Ureteroscopía flexible | 2.Ureteroscopía semirrígida | 3.Litotricia extracorpórea |
Tabla 1. Elección de técnica quirúrgica en litiasis ureteral.
Litiasis renal
En este caso las alternativas a considerar son nefrolitectomía percutánea (en sus distintas versiones, estándar o miniperc), nefrolitectomía endoscópica flexible y litotricia extracorpórea. Para definir cual utilizar también debemos considerar tamaño, localización y características del paciente.
Los reportes tanto de las guías clínicas, como estudios que revisan este tema dividen las indicaciones basándose principalmente en el tamaño de la litiasis.
Para litiasis mayor a 2 cm debe indicarse como primera opción la nefrolitectomía percutánea (1,5,8), existiendo también estudios a favor de nefrolitectomía endoscópica pero que se asocia a mayor tasa de re-intervenciones y menor porcentaje de stone free(32).
Para litiasis renal con tamaño entre 1 y 2 cm fuera del cáliz inferior pueden considerarse las 3 alternativas mencionadas previamente(32). Y para litiasis menores a 1 cm, debiéramos privilegiar la cirugía endoscópica y la litotricia extracorpórea.
| Mayor porcentaje libre de cálculos | Menor porcentaje libre de cálculos | ||
| Litiasis renal mayor a 2 cm. | 1) Nefrolitectomía percutánea | 2) Nefrolitectomía endoscópica | |
| Litiasis renal 1 a 2 cm | 1) Nefrolitectomía percutánea o Nefrolitectomía endoscópica | 2) Litotricia extracorpórea | |
| Litiasis renal menor a 1 cm | 1) Nefrolitectomía endoscópica o litotricia extracorpórea. | 2) Nefrolitectomía percutánea (casos seleccionados, polo inferior anatomía desfavorable para otras técnicas) |
Tabla 2. Elección de técnica quirúrgica en litiasis renal.
Cirugía abierta y laparoscópica para litiasis urinaria
Es importante también mencionar que tanto la cirugía laparoscópica y la cirugía abierta aún tienen un rol en el manejo de la litiasis urinaria.
Hoy en día debería reservarse estos abordajes para aquellos pacientes que por alguna razón no fueran candidatos a las técnicas mínimamente invasivas, antes mencionadas, o cuando estas han fracasado. O ser consideradas como primera opción cuando es necesario realizar algún procedimiento reconstructivo asociado al tratamiento de la litiasis, ej: estenosis de la unión pieloureteral asociada a litiasis piélica, o estenosis ureteral asociadas a litiasis ureteral, etc.
Casos especiales
Variantes anatómicas
Riñón en herradura, riñón pélvico, mal rotaciones renales, derivaciones urinarias etc. son condiciones en las que está demostrado la mayor incidencia de litiasis urinaria. La recomendación en estos casos es evaluar caso a caso la anatomía del paciente y la litiasis a tratar. Tanto la nefrolitectomía endoscópica como la nefrolitectomía percutánea son seguras con una buena planificación preoperatoria(25,29,32).
Embarazadas
En el manejo de pacientes embarazadas con urolitiasis es fundamental la participación tanto del urólogo y ginecólogo como del radiólogo, es importante privilegiar el ultrasonido como método de diagnóstico y seguimiento durante el embarazo. A pesar de que está demostrado que es seguro utilizar tac de baja tasa sobretodo desde el segundo trimestre del embarazo. Es necesario informar a las pacientes del mayor riesgo de ITU durante el embarazo asociado a urolitiasis y del riesgo de parto prematuro. El manejo inicial más apropiado para el manejo de la litiasis renal y ureteral no complicada es la vigilancia activa asociada o no a terapia medica expulsiva(25,29).
Para aquellos casos que requieran manejo activo por falla del manejo del dolor, hidronefrosis progresiva o infección se puede ofrecer descompresión de la vía urinaria mediante nefrostomía percutánea o catéter doble J, ambos requieren controles y recambios frecuentes por el alto riesgo de calcificación(25,29).
La litotricia extracorpórea está contraindicada durante el embarazo, y debiéramos ofrecer una cirugía endoscópica en aquellos casos que requieran cirugía durante el embarazo, de lo contrario diferir el tratamiento definitivo de la litiasis hasta después del parto.
Litiasis en niños
Entre el 1 y 2 % del global de los casos de litiasis urinaria se diagnostica en niños. En este grupo etario hay algunos factores a considerar al momento de escoger la conducta más adecuada. Por ejemplo, está demostrado que los niños eliminan fragmentos más grandes y más fácilmente que los adultos y con menos obstrucción(29). Por lo anterior la litotricia extracorpórea tiene un rol más importante que en los adultos, logrando porcentajes libres de cálculos que van entre el 70 al 90%, incluso con cálculos hasta de 2 cm, pero con un porcentaje de retratamiento cercano al 50%. El tratamiento médico expulsivo es controversial y no está indicado de rutina.
Por otro lado, la disminución del calibre de los instrumentos tanto para nefrolitectomía percutánea (mini o microperc) como para cirugía endoscópica junto a las mejoras en los equipos láser para optimizar la litotricia intrarrenal han hecho que estas técnicas también jueguen un rol importante en el manejo de la litiasis en pacientes pediátricos(32), sobre todo en litiasis densas como cistina u oxalato de calcio monohidratado(29) . Por lo anterior se consideran ambas cirugías seguras en esta población.
Litotripsia extracorpórea
Dr. Jaime Barahona C.
Aspectos históricos
Sin duda, la litotripsia extracorpórea (LEC) ha sido un cambio revolucionario en el manejo de la urolitiasis. El desarrollo de esta tecnología se inició muchísimos años antes a partir de la observación de algunos eventos físicos, como la caída de micrometeoritos, o el impacto de proyectiles a gran velocidad, o el daño que se generan en los aviones de guerra cuando superan la velocidad del sonido. Todos estos eventos tienen algo en común: son generadores de ondas de choque.
Los primeros estudios o experimentos fueron desarrollados por un ingeniero de la empresa tecnológica alemana Dornier, aplicando ondas de choque en tejidos biológicos y estudiando sus efectos a comienzos de los 70. A fines de 1972, W. Hepp y G. Hoff, del departamento de desarrollo e investigación de la empresa Dornier, iniciaron un trabajo cooperativo preclínico para su aplicación en cálculos urinarios con los doctores E. Schmidt y F. Eisenberger de la Universidad de Múnich.
En 1974 comienza la primera fase experimental en vivo, encabezada por Ch. Chaussy, F. Eisenberger, y W. Hepp. Se buscaba destruir un cálculo intrarrenal con la exposición de una sola onda de choque generada por una bujía en una bañera con interfase acuosa. Este primer experimento fracasó por efectos dañinos en la piel, pues aún no se sabía cómo medir la expansión de la onda de choque ni cómo focalizarla en un punto(33). Al año siguiente se desarrolla la generación de ondas por un sistema piezoeléctrico y su conducción por una superficie elipsoidal que permitió converger las ondas en un punto focal a través de una interfase acuosa (bañera), minimizando la energía entregada. Durante los años siguientes, se sumó la capacidad de generar múltiples ondas de choque continuas y se mejoró la localización de los cálculos con un sistema integrado de radioscopia tridimensional (arco en C).
Con estos conocimientos se desarrolló el primer prototipo de litotriptor HM1 Dornier con un costo aproximado de 2.2 millones de dólares. El 7 de febrero de 1980, los doctores Ch. Chaussy, B. Forssmann y D. Jochan trataron al primer paciente con un cálculo piélico cuyo resultado fue exitoso, lo que motivó la publicación de esta experiencia en la revista The Lancet en diciembre de 1980. Rápidamente se popularizó la LEC en Alemania y en el resto del mundo, pero sólo 9 años después la Asociación Americana de Urología (AUA) galardonó a los doctores Chaussy, Eisenberger y Schmiedt por su enorme contribución en el campo de la Urología(34).
Aspectos físicos y biomecánicos
El principio físico de la LEC es la onda de choque. Esta pertenece al grupo de ondas mecánicas y tiene algunas características que la hacen muy particular y que la diferencian de otras ondas mecánicas, como el sonido o el ultrasonido. Comúnmente las ondas de choque son confundidas con ondas acústicas (sonido), por lo que detallaremos algunas diferencias. Las ondas acústicas y de ultrasonido son continúas, con amplitudes menores, y longitudes de onda variables. En cambio, las ondas de choque son ondas de presión únicas o pulsadas con una gran amplitud (alta energía) y corta duración (longitud de onda pequeña que se expresa en microsegundos). A su vez, los valores máximos de la presión de cada onda de choque dependen directamente del voltaje (o energía) que entrega cada generador. A modo de ejemplo, las ondas de choque generadas en un litotriptor electrohidráulico (bujía inmersa en agua) son conducidos por un reflector elipsoidal a un área de 10 a 15 mm de diámetro y, dependiendo del voltaje, se desarrollarán presiones desde los 30 a 50 megapascales (MPa)(35).
Hay dos mecanismos involucrados que explicarían la destrucción del cálculo en contacto con la onda de choque(35):
- La fractura del cálculo por la acción directa de las ondas de presión y su reflexión (fuerza tensil). Se asocia a ondas de mayor intensidad.
- La erosión causada por las burbujas de cavitación que se forman y colapsan bruscamente en la superficie del cálculo.
Esta onda de alta presión debe atravesar varios tejidos antes de llegar al cálculo, los cuales poseen distinta impedancia o resistencia. En la superficie del riñón se transmite una parte importante de la onda, pero otra más pequeña se refleja, lo que potencialmente puede producir daño a este nivel por la fuerza tensil(35).
Litotriptores
Los litotriptores tienen dos componentes que revisaremos a continuación.
Generador de ondas de choque
La generación de las ondas de choque nos permite clasificar los litotriptores en piezoeléctricos, electrohidráulicos y electromagnéticos, siendo los últimos dos los más utilizados a nivel mundial.
Los electrohidráulicos ocupan una bujía que genera la onda de choque, la cual se focaliza con una superficie elíptica y se conduce en un medio acuoso. La bujía consiste en dos electrodos que se cargan con un alto voltaje, cuya descarga eléctrica produce una explosión y evaporación del agua que la rodea. Las burbujas de agua vaporizada primero se expanden bruscamente y luego se colapsan originando una onda de choque(36,37).
Los electromagnéticos entregan pulsos de corriente almacenada en un condensador, transmitida a través de una bobina de cobre, la cual repele una membrana flexible, habitualmente de cobre. Esta vibración crea la onda de choque, que es focalizada por un lente acústico, y acoplada por un cojín de agua(38).
Sistema de localización del cálculo
La localización del cálculo es posible mediante fluoroscopía con un arco en C, y/o visualización ecográfica. Algunos litotriptores son denominados de tercera generación porque contienen ambos métodos.
Al momento de decidir ocupar un litotriptor es indispensable conocer alguna de sus características técnicas:
- Área focal: Es el volumen en el cual se concentra la presión de la onda de choque expresado en dos mediciones (ancho x largo).
- Presión máxima: Es la presión máxima capaz de generar la máquina en el área focal expresada habitualmente en unidad megapascal o bar.
- Distancia focal: Es la distancia entre el punto en que se generan las ondas y el centro del área focal.
Aspectos técnicos
La ejecución de cada LEC consiste fundamentalmente en hacer coincidir el cálculo con el punto focal del litotriptor. Cada onda se transmitirá por un medio acuoso que ofrece la menor resistencia o impedancia hasta la superficie de la piel, proceso que se denomina acoplamiento. Mientras mayor sea la superficie de acoplamiento con la piel, más eficiente será la transmisión de la onda de choque.
En general, los litotriptores electrohidráulicos se acoplan mediante un cojín lateral a la posición de descanso del paciente, en cambio, los electromagnéticos (ej. Storz) se acoplan mediante un cabezal ubicado bajo la mesa de tratamiento. Esto condiciona que en el uso de un litotriptor electrohidráulico la única posición del paciente sea decúbito ventral, en cambio en uno electromagnético se pueda optar por la posición decúbito dorsal o ventral. Para la ubicación del cálculo en el punto focal se usa comúnmente la radioscopia con un arco en C.
Con el arco en C en 0° movilizamos la mesa de tratamiento en el plano horizontal en sus dos dimensiones, y con el arco en C en 30° movemos la mesa en el plano vertical (altura de la mesa). Cuando no es posible visualizar el cálculo radioscópicamente (litiasis radiolúcida) se puede cateterizar el uréter e inyectar medio de contraste. Los litotriptores de tercera generación tienen incorporado en el cabezal de tratamiento un transductor ecográfico útil sólo para cálculos renales y dependiente de la experiencia del operador. Es necesario recordar que la transmisión intracorpórea de la onda de choque desde la piel al cálculo debe estar libre de interferencias óseas, siendo esto relevante en cálculos de uréter medio. En estos casos se optimiza la LEC modificando la posición del enfermo a decúbito ventral (prona).
Indicaciones y resultados
Para el manejo de la urolitiasis se cuenta con diferentes opciones terapeúticas, dentro de éstas destacan la ureterolitotomia endoscópica semirrigida y flexible, la litotripsia extracorpórea y la nefrolitectomia percutánea (NLP).
El éxito o tasa libre de cálculo global de la LEC varía de 72 a 90% en distintas series(38,39), cuyos resultados variarán de acuerdo al tamaño, localización y composición del cálculo, así como también de la anatomía del tracto urinario y de la experiencia del cirujano.
En cálculos ureterales de tercio medio y distal se considerarán como opciones de tratamiento la LEC y la ureteroscopía(40,41). Cabe destacar la alta tasa de éxito de la ureteroscopía (98%), que supera a la LEC (< 70%) en cálculos de uréter distal.
En el caso de las litiasis de ureter proximal, las guias europeas indican que la LEC es comparable en tasa libre de cálculo a la ureterolitotomia endoscópica flexible en el tratamiento de cálculos menores de 10 mm(42), sin embargo la ureterolitotomia endoscópica flexible posee tasas significativamente menores de retratamiento al compararla con la LEC (0,3 v/s 11%) y mejores tasas libre de cálculos en el tratamiento de litiasis > 10 mm en dicha ubicación(42).
En el caso de las litiasis renales, la ubicación y tamaño vuelven a tener un rol fundamental en la elección del tratamiento debido a que en general las litiasis caliciales asintomáticas tienen un riesgo de volverse sintomáticas que oscila entre 10-25% por año, razón por la cual, la observación pudiese ser una intervención válida para litos pequeños en dicha ubicación, sin embargo parece razonable no observar litiasis caliciales > 15 mm debido a que el riesgo de complicación e intervención se ve incrementado(43).
Para las litiasis < 20 mm ubicadas en pelvis renal, caliz superior y medio el tratamiento a través de cirugía intrarrenal retrógrada o LEC ofrece resultados equivalentes según la evidencia publicada(44), sin embargo para aquellas litiasis de caliz inferior que serán sometidas a tratamiento quirúrgico, la cirugía intrarrenal retrógrada ofrece tasas libre de cálculos significativamente mayor que aquellas sometidas a LEC, particularmente en litiasis entre 10-20 mm(45).
Factores pronósticos
El fracaso de esta técnica puede deberse a diversos factores que pudiesen clasificarse en aquellos dependientes:
Cálculo: Resulta esencial considerar el tamaño debido a que la posibilidad de fracaso aumenta con cálculos mayores a 20 mm, la localización debido a que las tasas de éxito disminuyen en aquellos ubicados en caliz inferior y la composición dado que a mayor densidad cálcica topográfica expresada en unidades de Hounsfield (UH), tendremos menor fragmentación del cálculo. La radiodensidad medida en la tomografía axial computada guarda inversa relación con la probabilidad de fragmentación del cálculo en la litotripsia. Numerosos trabajos han concluido que cálculos con radiodensidad mayor a 1000 UH requieren un mayor número de ondas de choque para ser fragmentados y se asocia a una menor tasa de éxito(46). Aquellos cálculos con menos radiodensidad son más fáciles de fragmentar pero, por otra parte, son más difíciles de visualizar radioscópicamente y se debe complementar con medio de contraste endovenoso o pielografía ascendente.
Paciente: Pueden afectar el resultado factores anatómicos como el riñón en herradura, obstrucción de la unión pieloureteral, estrecheces ureterales, morfología y angulaciones de los cálices. Particularmente los cálculos de cáliz inferior con ángulo infundibulopélvico < 70°, ancho infundibular < 5 mm, y largo infundibular > de 3 cm se asocian a una alta tasa de fracaso de LEC(47). En relación a la composición corporal del paciente, el principal factor en contra es la obesidad debido al aumento de la distancia piel – cálculo, distancia que corresponde al promedio de la medición en tres ejes: horizontal, vertical y diagonal. Si este promedio es mayor de 10 cm es un predictor de fracaso(48) y, por el contrario, si este promedio es menor de 8.3 cm la tasa de éxito es significativamente mayor(49). Otro factor pronóstico indirecto relacionado con la distancia piel-cálculo es la distancia desde el generador de la onda de choque a la superficie de la piel. Dado que la distancia focal es siempre la misma, cuanto mayor sea la distancia del generador a la piel, menor será la distancia de la piel al cálculo. En litotriptores Storz esto se traduce como la altura de la mesa y a mayor altura menor es la distancia de la piel al cálculo, y mayor es la tasa de éxito de la LEC(50).
Parámetros onda de choque: Se debe considerar el número de ondas de choque que serán administradas por minuto (se recomienda utilizar 1-1,5 Hz) y la energia utilizada en cada golpe. En relación a la energía se sabe que partir con menor energia e ir incrementando la potencia en forma gradual, puede lograr mayor vasoconstricción durante el procedimiento, previniendo de esta forma la lesión renal sin comprometer los resultados de la técnica en cuanto a la fragmentación de la litiasis(51).
Optimización LEC
Disminuir frecuencia de golpes: Como fue mencionado previamente, la recomendación actual es utilizar una frecuencia entre los 1-1,5 Hz para disminuir complicaciones, sin comprometer resultados(52,53).
Uso de litotriptores con mayor área focal: El área o zona focal es el volumen donde se focaliza la mayor presión de la onda de choque. Un estudio in vitro(54) demostró que litotriptores con área focal de mayor tamaño y menor energía serían más eficientes y más seguros. Esto se debería a que los cálculos están en constante movimiento (por la respiración) y con una mayor área focal se perderían menos golpes. Algunos litotriptores permiten elegir entre dos modalidades de área focal. Sugerimos elegir siempre la de mayor tamaño.
Acoplamiento adecuado: El acoplamiento de la membrana a la piel debe realizarse acuciosamente evitando la presencia de bolsillos de aire entre ambos. Para rellenar este espacio se puede ocupar un gel o agua. Pishchalnikov(55) demostró in vitro que pequeños bolsillos de aire en el acoplamiento podían modificar significativamente la eficiencia de la LEC, reduciendo hasta en un 40% la fragmentación de los cálculos de mayor tamaño.
Control del procedimiento: Resultados son operador dependiente y la experiencia clínica genera mejores resultados. Durante el procedimiento el control cuidadoso de la localización por imágenes contribuye a mejorar la calidad del resultado(56).
Anestesia eficiente: En una LEC pueden ocuparse potencialmente todas las técnicas anestésicas, desde una sedación hasta una anestesia general o una técnica regional. El tipo de litotriptor puede condicionar y restringir el abanico de opciones anestésicas. Aquellas máquinas con mayor superficie de acoplamiento y mayor zona focal inducen menos dolor, siendo susceptible el uso de una sedación, en cambio, aquellas con menor superficie de acoplamiento y menor zona focal son más dolorosas y por lo tanto requieren una anestesia general o regional si la ubicación del cálculo lo permite. Múltiples trabajos han demostrado los beneficios de usar anestesia general en la LEC, mejorando la tasa de éxito en hasta un 10% en comparación con las otras técnicas anestésicas. Esto se debería a la inmovilidad y mayor número de golpes que efectivamente dan en el blanco.
Si se utiliza anestesia general se sugiere reducir la amplitud ventilatoria. Independientemente de la técnica anestésica ocupada, se recomienda posicionar el cálculo en el foco durante la fase espiratoria, ya que permanecerá ahí por un lapso de tiempo mayor.
Antibióticos profilácticos: No están recomendados de rutina, sin embargo, se recomienda su administración con grado de recomendación 1a en el caso de colocación interna de stent, litiasis infectadas o bacteriuria.
Terapia médica expulsiva (TME): La mayoria de los estudios aleatorizados controlados apoyan el uso de TME post LEC ureteral y/o renal para mejorar expulsión e incrementar tasas libres de cálculos. Además, podría disminuir los requerimientos analgésicos (57).
Medidas físicas: La percusión mecánica, con diuresis forzada e inversión postural del paciente, se han utilizado para asistir el paso de los fragmentos de cáliz inferior postlitotripsia. En un trabajo prospectivo se sometió a un grupo post-LEC de cáliz inferior a una terapia de 4 sesiones en promedio, que consistió en ingerir 500 ml de agua previo a la terapia, y en posición prona con Trendelemburg forzado de 45° se le aplica percusión manual mecánica continua en el flanco durante 10 minutos. Este grupo mostró una tasa de éxito de 62% en comparación con el grupo control de un 35%(58).
Contraindicaciones y complicaciones
Existe contraindicación de realizar LEC en las siguientes condiciones(59):
- Embarazo, debido a los posibles efectos sobre el feto.
- Diátesis hemorrágica, deben compensarse al menos 24 hrs antes y 48 hrs después del tratamiento.
- Infecciones urinarias no controladas.
- Malformaciones esqueléticas severas y obesidad severa que dificultan la identificación del cálculo.
- Aneurisma arterial en la vecindad del cálculo.
- Obstrucción anatómica distal a la litiasis.
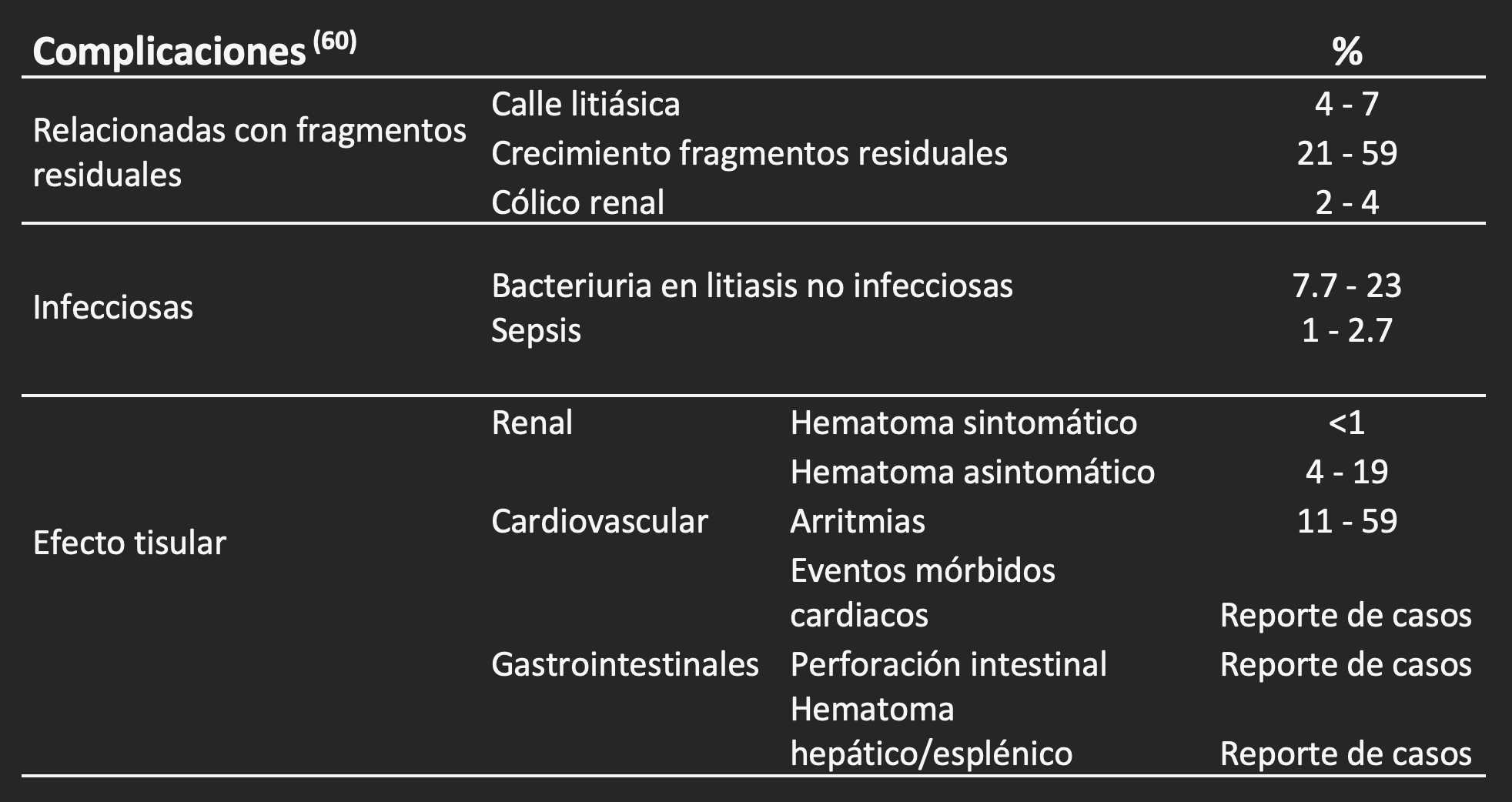
Complicaciones derivadas del paso de los fragmentos: Esta complicación ocurre comúnmente cuando los fragmentos resultantes son de un tamaño mayor de 4 mm y en su descenso obstruyen la vía urinaria alta. Los factores responsables de una fragmentación insuficiente son la volumetría y composición de los cálculos. Los cálculos de ácido úrico, estruvita y oxalato de calcio dihidratado se fragmentan bien, a diferencia de los de fosfato de calcio dihidratado (brushita), oxalato de calcio monohidratado, y cistina, cuyos fragmentos suelen ser de mayor tamaño. En cuanto al volumen, aquellos cálculos menores de 2 cm tendrán un éxito de 66-90%, y este desciende a un 40-70% en cálculos de 2 a 3 cms(61).
El apilamiento de fragmentos o calle litiásica (steinstrasse) ocurre en 4-7% de los pacientes, elevándose a 5-10% en cálculos mayores de 2 cm y a 40% en mayores de 3 cm. El catéter ureteral doble J no evitaría la ocurrencia de la calle litiásica(62). Hay distintas opciones terapéuticas para este problema. Aquellos casos asintomáticos se pueden observar usando alfa bloqueadores o corticoides para promover la expulsión de los fragmentos. En aquellos casos sintomáticos con calle litiásica menor de 2.5 cm se puede intentar manejo conservador con antiinflamatorios, resolviéndose espontáneamente en más de la mitad de los casos. Si el dolor no cede y mide más de 2.5 cm, se recomienda realizar una ureterolitotomía endoscópica o repetir la LEC. Si la calle litiásica se asocia a fiebre, se sugiere instalar un catéter ureteral Pigtail o una nefrostomía percutánea.
Complicaciones infecciosas: Al penetrar las ondas de choque en el riñón, estas podrían causar ruptura de pequeños vasos que pueden potencialmente facilitar el paso a la sangre de gérmenes presentes en la orina o en los cálculos. Debemos diferenciar la infección con una respuesta inflamatoria local de una sepsis que se caracteriza por un síndrome de respuesta inflamatoria sistémica. Se ha descrito una frecuencia mayor de sepsis en pacientes con cálculos de estruvita de baja densidad o cálculos múltiples. Afortunadamente, la sepsis post-LEC es baja. Para evitarla debemos usar terapia antibiótica previa en pacientes con urocultivo (+) o en pacientes con cálculos coraliformes, o de estruvita de baja densidad cálcica.
Hematomas: Los hematomas sintomáticos subcapsulares, perirrenales o intrarrenales son infrecuentes, ocurriendo en menos del 1% de los pacientes. En cambio, los hematomas pequeños subclínicos detectados por estudios imagenológicos tienen una prevalencia de hasta un 25%(63). En general, los hematomas perirrenales se resuelven en pocos días, a diferencia de los subcapsulares que se reabsorben lentamente en lapsos de hasta 6 meses.
Múltiples factores de riesgo se han asociado a la ocurrencia de hematomas subcapsulares(62): alteraciones de coagulación, uso de anticoagulantes (Neosintron) o antiagregantes plaquetarios (aspirina), hipertensión (PA > 160/110), diabetes mellitus y edad > 65 años. Por lo tanto, se recomienda: evitar el uso de aspirina durante la semana previa a la LEC, usar heparina de bajo peso molecular en remplazo de Neosintron, elegir otras alternativas terapéuticas en pacientes con coagulapatías, y estabilizar a pacientes con presión arterial > 160/100. Existe evidencia que la baja frecuencia e intensidad escalonada ascendente de las ondas de choque, así como realizar una pausa de 2-3 minutos después de los primeros golpes, lograrían reducir los hematomas subcapsulares como consecuencia del efecto vasoconstrictor renal autonómico generado por los primeros golpes de baja intensidad(64).
Arritmias: Su prevalencia varía de un 11 a 59% en las distintas publicaciones, siendo las extrasístoles ventriculares las más frecuentes. No se ha relacionado esta arritmia con la edad, ubicación o tamaño del cálculo, modalidad de anestesia, número de golpes o tipo de litotriptor(65). La solución es fácil, acoplando las ondas de choque a los latidos cardíacos (complejo QRS del ECG). La portabilidad de marcapaso no contraindica la LEC, pero se recomienda evaluación cardiológica previa.
Conclusiones
La LEC corresponde a una opción terapéutica que no puede faltar debido a su demostrada eficacia y baja tasa de complicaciones, sin embargo, la miniaturización de los accesos en NLP permite tratar litiasis de menor tamaño, y a su vez la ureteroscopía flexible litiasis de mayor tamaño con eficacia demostrada en cálculos de hasta 3 cm gracias a los avances relacionados con la durabilidad y digitalización de los equipos.
Lo previamente expuesto, sumado al mayor desarrollo tecnológico y adiestramiento de los urólogos en estas últimas dos técnicas ha generado una disminución en la indicación de LEC a nivel mundial.
Se concluye por tanto que resulta casi imposible en la actualidad generar un algoritmo único de tratamiento, basándose exclusivamente en el tamaño de la litiasis, debiendo incluir en la decisión final de la técnica ha utilizar las características y expectativas propias de cada paciente, la expertiz del cirujano y la disponibilidad técnica en el centro.
Nefrolitectomía Percutánea
Dr. Felipe Águila B., Dr. Fernando Marchant G.
Introducción
La Nefrolitectomía Percutánea (NLP) es una técnica quirúrgica endourológica que se utiliza para el tratamiento de litiasis renales.
La cirugía se inicia con la instalación de un catéter ureteral externalizado. Éste permite contrastar la vía urinaria superior e identificar en la fluoroscopía, la pelvis y los cálices del riñón a tratar. Posteriormente se realiza una punción renal bajo rayos y/o dirigida por ecografía, hacia la papila renal del cáliz escogido para ingresar. Obtenido este acceso, se avanza una guía hidrofílica y se procede a la dilatación del trayecto percutáneo, lo que permitirá la instalación de una camisa (amplatz) que comunicará la piel con el cáliz y dará acceso al nefroscopio, equipo operado por el urólogo para la fragmentación y extracción de la litiasis a tratar.
La NLP es una técnica urológica antigua. El crédito de la primera extracción de cálculos por vía percutánea se atribuye a Rupel y Brown en 1941. Resurge en 1955, cuando el urólogo estadounidense Goodwin volvió a describirla, aunque dejándola en manos de los radiólogos(66). La introducción del ultrasonido en la práctica clínica, a comienzos de 1980, tuvo un significativo impacto en la ejecución de procedimientos percutáneos en Europa. En muchos países europeos los urólogos tuvieron acceso directo al ultrasonido, despojando a los radiólogos de la punción y apoderándose por completo del procedimiento de la nefrostomía percutánea, mientras que en Norteamérica el procedimiento sigue dependiendo en gran medida, hasta el día de hoy, de los radiólogos(66).
Recién en 1976, Fernström (radiólogo) y Johansson (urólogo) reportaron los tres primeros casos exitosos de nefrostomías percutáneas seguidas de dilatación del trayecto por varios días, y extracción de cálculos bajo control fluoroscópico. Si bien inicialmente la NLP generó gran interés entre los urólogos, el desarrollo de la litotricia extracorpórea (LEC) por ondas de choque relegó a la NLP a segundo plano y en muchos centros cayó en desuso. Sin embargo, con los años fueron quedando en evidencia las limitaciones de la LEC, en particular frente a cálculos grandes y complejos, lo que abrió nuevamente el paso a la NLP. Dicha técnica se ha ido reinventando con la introducción de nuevos instrumentos, accesorios y tecnologías que le han permitido reducir su morbilidad, incrementar su efectividad y volver a posicionarse como alternativa de primera línea en el manejo de algunos cálculos del tracto urinario alto(66).
Indicaciones
La cirugía renal percutánea ha demostrado ser una técnica segura y efectiva para el tratamiento de litiasis renales. Se considera de elección en cálculos definidos como de gran tamaño o de morfología coraliforme, como también en vías urinarias complejas (malformaciones congenitas o adquiridas). La tomografía computarizada (TC) de abdomen y pelvis sin contraste es fundamental para evaluar la indicación y planificación de la técnica.
Los factores considerados para su indicación incluyen características del cálculo (tamaño, forma, composición, ubicación), características del paciente (hábito corporal, anomalías renales) y falla previa de otras modalidades de tratamiento (LEC, ureteroscopía flexible o cirugía abierta). Sin embargo, el factor más determinante en la indicación de la modalidad de tratamiento es el tamaño del cálculo(67-69).
Las guías clínicas de grandes sociedades científicas como la Americana (American Urological Association AUA) y la Europea (European Association of Urology EAU) resumen las indicaciones de la siguiente manera:
- Cálculos de gran tamaño:
Mayores a 2 cm en la pelvis renal o cálices medios o superiores.
Mayores a 1,5 cm en cáliz inferior. - Cálculos de morfología coraliforme.
- Cálculos de menor tamaño o no coraliformes con características desfavorables para otros métodos quirúrgicos (malformaciones urinarias, divertículos, cálices complejos por ancho, largo y angulación, litiasis muy duras o falla de otro tratamiento endourológico)
Respecto a las contraindicaciones para la NLP se encuentra(70):
- Embarazo.
- Desórdenes de la coagulación.
- Infecciones del tracto urinario no tratadas.
- Sospecha de tumor en el trayecto percutáneo.
- Colon retrorrenal (sin embargo, este punto se puede manejar con el alejamiento del asa intestinal via laparoscópica o abierta antes de la punción renal).
Estudios preoperatorios
Antes de realizar una NLP es importante realizar una buena evaluación preoperatoria del paciente. Se debe explicar el procedimiento, tiempo de estadía hospitalaria proyectada, estudios preoperatorios, firma del consentimiento informado y en casos especiales evaluación por otras especialidades antes de la cirugía, como cardiología o anestesia. En los exámenes de laboratorio básicos, se solicitan estudios que evalúen la coagulación del paciente, función renal y estatus urinario. Este último es muy importante, ya que en muchos pacientes es difícil o imposible negativizar el urocultivo, requiriendo manejos especiales de antibióticos para evitar fiebre o sepsis en el postoperatorio(71,72).
Las imágenes renales son fundamentales para la planificación de la cirugía. El examen que entrega información adecuada de la morfología del paciente, anatomía renal, relaciones de órganos vecinos y características del cálculo, es la TC de abdomen y pelvis sin contraste(73). En la mayoría de los casos se puede programar la cirugía con un TC sin contraste, pero en casos seleccionados se debe solicitar un TC contrastado, con fases de excreción tardía (UroTC). En otros pacientes con atrofia cortical significativa se sugiere complementar el estudio con un cintigrama renal estático, que informe de la función renal diferencial y captación del radioisótopo por parénquima.

Nefrolitometría
La nefrolitometría es una manera objetiva de poder comparar pacientes, otorgándole puntaje a las características renales y de la litiasis, que permiten indicar la complejidad del caso a operar.
Un tipo de sistema de medición es el S.T.O.N.E Score, acrónimo que resume las 5 variables de comparación (S= Tamaño, T=Distancia piel-cálculo, O= grado de obstrucción, N= número de cálices comprometidos, E= densidad)(74).
Otros sistemas de puntuación y medición muy utilizados, son el Guy’s Score (75) y el CROES Score(76). Todos observan características similares, y permiten homogenizar y describir los casos tratados, al momento de estudios de investigación. Del punto de vista clínico, permite explicar al paciente la complejidad de su propio caso, lo que podría tener implicancias en complicaciones y necesidad de procedimientos auxiliares.
Posición del paciente
La posición del paciente en la NLP ha sido motivo de amplias discusiones que comparan efectividad y seguridad del procedimiento. En líneas generales existen dos posiciones en la cirugía renal percutánea: la posición prona y la posición supina.
La NLP en prono es la forma en que históricamente se realizaba esta cirugía, teniendo toda la región posterior a disposición del cirujano. Lo anterior permite una gran versatilidad para acceder al riñón de forma percutánea, facilita el acceso por el polo superior, mantiene una distención más estable de la pelvis y cálices renales. Posibilita ingresar por un trayecto más corto a los cálices posteriores, pasando por la línea avascular de brodel(77). El prono puede ser simple o flectado; este último implica angular a nivel de la pelvis 30º al paciente. Esto permite ampliar el campo operatorio aún más, separando el espacio entre la cresta ilíaca y la última costilla(78,79).
En 1987, Valdivia-Uría describre la modificación de la técnica clásica(80), poniendo al paciente en decúbito supino, elevando el flanco. Esta modificación no requería cambiar de posición al paciente, disminuye las complejidades anestésicas del prono como la ventilación y daños posicionales, y facilitaba el acceso retrógrado en técnicas combinadas. Este cambio impulsó, en los años posteriores, muchos adeptos que fueron cambiando desde el prono al supino. Se describieron modificaciones como la separación de las piernas y leve lateralización del paciente (posición Valdivia-Galdakao) que fueron facilitando la cirugía, ampliando la posibilidad de acceder de forma retrógrada o laparoscópica y manteniendo los beneficios anestésicos logrados al no pronar al paciente(81-83). Actualmente muchos autores consideran que la posición en supino es el nuevo estándar para realizar la NLP por los beneficios antes nombrados(84), siendo igualmente segura y permitiendo la misma efectividad (tasa libre de cálculos) que la clásica posición en prono.
Técnica quirúrgica
Podemos dividir la NLP clásica en 3 momentos:
- Tiempo vesical.
- Tiempo renal.
- Finalización.
Tiempo vesical
En este momento de la cirugía, con el paciente anestesiado y en la posición escogida (prono o supino), se realiza la uretrocistoscopía, en la cual se inspecciona la vejiga, se buscan los orificios ureterales y se asciende el catéter ureteral que permitirá en el tiempo renal, la opacificación de la vía urinaria de forma retrógrada para resto de la cirugía.
Se puede también instalar un catéter doble jota contralateral, o tratar litiasis vesical o ureteral. Tambien en este punto de la cirugía se puede instalar la vaina ureteral, lo que permitirá realizar un abordaje combinado (ECIRS)(83).
La pielografía inicial es muy importante ya que permite evaluar por primera vez la forma de la vía urinaria con contraste de forma dinámica. Nos da a conocer la posición y radioopacidad de la litiasis, el largo y ancho de los infundíbulos, los diferentes ángulos infudibulocaliciliares, la presencia de dobles sistemas y las distancias en los diferentes puntos del riñón. Con esta información el endourólogo puede replanificar la cirugía, instrumental e insumos que va utilizar.
Tiempo renal
El tiempo renal es la parte más importante de la cirugía. Antes de iniciar cualquier maniobra invasiva, se debe chequear que todo en el pabellón se encuentra preparado. Se debe tener una conversación fluida con el anestesista respecto a movimientos renales con la respiración, sangrado y dificultades en las diferentes etapas.
Podemos dividir este momento de la cirugía en:
- Punción renal
- Dilatación del trayecto
- Exploración
- Litotripsia intracorpórea
- Extracción de fragmentos
Punción renal
La punción renal es uno de los pasos críticos de esta cirugía. Considerando factores anatómicos del paciente, características de la litiasis y de la vía urinaria, el urólogo decide el cáliz a puncionar. Se busca un acceso percutáneo transpapilar para trabajar en el eje del cáliz y disminuir complicaciones hemorrágicas. Sin embargo, algunos estudios recientes sugieren similitudes al ingresar de forma no transpapilar(85). Se ocupa habitualmente una aguja 18 G con mandril desmontable, cuya punta puede ser biselada o en forma de diamante.

Realizar una punción renal implica conocer la anatomía específica del paciente a operar. Existen factores como la movilidad renal con la respiración, la angulación pielocaliciar, la ocupación del cáliz con litiasis y la obesidad que dificultan aún más el procedimiento. La simulación quirúrgica en sus distintas facetas ha tenido un nicho de desarrollo justamente en la punción renal, recomendándose para cirujanos en entrenamiento, con tal de disminuir la curva de aprendizaje(86).
La manera en la que se punciona un riñón se pueden clasificar en técnicas sin apoyo imagenológico, como es la punción anatómica descrita en la literatura (no utilizada en NLP) y aquellas que se realizan con la orientación de algún método de imágenes (TC, resonancia nuclear magnética, ecotomografía o fluoroscopía), existiendo también abordajes mixtos como ecotomografia-fluoroscopía o endoscopía-fluoroscopía.
La manera en que tradicionalmente se realiza la punción y también la forma más ampliamente usada, es con apoyo fluoroscópico. A traves del cateter ureteral previamente instalado en el tiempo vesical se instila medio de contraste de forma retrograda, con esto se podrá ver en la pantalla del fluoroscopio los cálices y pelvis renal. Con el fin de disminuir el uso de radiación ionizante, el apoyo ecográfico único está ganando cada vez más adeptos(87).
La metodología de punción tanto en supino como en prono varía dependiendo de la posición del paciente (supino o prono), pudiéndose clasificar en(88):
Técnicas Monoplanares
- Rayo 0º AP.
Técnicas Biplanares
- Rayo 0º-90º.
- Rayo 0º-30º.
- Triangulación.
- Ojo de buey.

Dilatación del trayecto
Posterior a la punción del o los cálices escogidos, se procede con la dilatación del trayecto percutáneo. Antes de iniciar esta maniobra se debe decidir el diámetro del acceso. Tradicionalmente se dividen en(89):
- NLP tradicional (22-30 fr).
- Miniperc (14-20 fr).
- Ultraminiperc (11-13 fr).
- Microperc (4,85 fr).
Un trayecto más grande disminuye la presión intrarrenal durante la cirugía y permite extracción de fragmentos más grandes, pero se asocia a mayor morbilidad y complicaciones. El tener instrumental e insumos cada vez más pequeños junto al advenimiento del láser de Holmio, han permitido la miniturización del acceso. Si bien suele tener un mayor tiempo operatorio, logra una tasa de estado libre de cálculos y porcentaje de complicaciones comparables a la NLP estándar, con menor dolor postoperatorio, menor porcentaje de transfusiones y una menor estadía hospitalaria.
Esta técnica utiliza el acceso convencional al sistema colector, con una aguja de 18 G. Luego de pasar 2 guías hacia el uréter se utiliza una vaina de trabajo de menor calibre (13 F), sin requerir dilatación secuencial.
Posterior a la Miniperc se ideó la Microperc, que es una técnica que reduce aún más el diámetro del acceso renal. Se realiza el acceso percutáneo bajo una guía óptica con una aguja 16 G, se remueve el bisel interior de la aguja, dejando la vaina externa de 4.85 F. Se une un conector de 3 vías al extremo proximal de la vaina, para permitir la irrigación, el paso de una fibra láser de 200 μm y una micro-óptica. Esta técnica podría tener ventaja en cálculos de tamaño intermedio del polo inferior, porque permite una visión directa del cálculo y una limpieza activa de los fragmentos con irrigación presurizada(89-91).
Históricamente se han utilizado diferentes métodos para la dilatación del tracto de nefrostomía, incluyendo los dilatadores fasciales metálicos telescópicos de Alken y los plásticos secuenciales de Amplatz, así como la dilatación mediante uso de balón. Todos los métodos utilizados son efectivos.
La correcta dilatación es fundamental para el éxito del procedimiento. Se debe realizar cuidadosamente procurando no provocar lesiones y sangrados. Al llegar al diámetro de dilatación escogido, se instala la vaina de Amplatz. Ésta debe quedar dentro del cáliz, sirviendo de comunicación y elemento de exploración. También es un elemento hemostático bloqueando el parénquima de entrada.
Se debe previamente considerar la distancia entre la piel y el cálculo, y en pacientes obesos se debe utilizar equipos e insumos de largos especiales.
Exploración
Una vez instalado el Amplatz se mantiene y protege la guía de seguridad, la cual puede quedar instalada por dentro o fuera de la vaina de exploración. El nefroscopio o mininefroscópio se introduce a la vía urinaria con irrigación, la cual debe estar a una temperatura adecuada. La exploración, movimientos y maniobras dentro del riñón deben ser cuidadosas, procurando siempre no lastimar la mucosa y generar sangrados que dificulten la visión.
El cirujano debe tener control de todos los factores intraoperatorios desde este momento, procurar tener espacio y altura de mesa operatoria adecuados, buena visibilidad de la pantalla, irrigación constante y acceso fácil al instrumental sin conflictos de movimiento. Recomendamos considerar el suelo del pabellón como otro campo operatorio, ordenar cables eléctricos y enchufes, evitando en todo momento un pabellón inundado con líquido de irrigación.
El acceso al riñón será habitualmente por la papila del cáliz escogido. Colorantes como el índigo carmín o el azul de metileno pueden ayudar a guiar la exploración. También se ha descrito el apoyo exploratorio con instrumental flexible por vía percutánea o retrógrada(92).
Litotripsia intracopórea
La litiasis puede ser tratada de dos maneras: vaporizar o pulverizar el lito con ultrasonido o láser de Holmio, o fragmentarla en trozos para su extracción activa. El segundo método es el más utilizado, pudiendo realizarse con litotriptor pneumático o láser de Holmio.
Láser de Holmio: Se utiliza una fibra adecuada al canal de trabajo del nefroscopio. Las fibras gruesas degradan la litiasis de forma más eficiente. Si se realiza pulverización habitualmente se prefiere poca energía (J), alta frecuencia (Hz) y pulsos largos (mS). Cuando se desea fragmentar la litiasis con láser de Holmio se invierten los ajustes, aumentando la energía y ocupando pulsos cortos.
Litotripsia ultrasónica: Es un método rápido y seguro en el que se aplica la energía a través de una varilla por el canal de trabajo que degrada la litiasis por la punta. Los equipos tienen aspiración incorporada. Equipos de última generación pueden además, impactar la litiasis, similar a la energía pneumática. Tiene limitaciones en cálculos muy duros.
Litotripsia pneumática: La litotripsia pneumática es un método efectivo para litiasis duras. Ocupa aire comprimido el cual, a través de un sistema cerrado y regulable, golpea el mango del instrumento haciendo percutar una varilla que se introduce por el canal de trabajo. Es un sistema con larga vida útil y con poco costo de mantenimiento.
Cualquiera sea el método escogido, la litotripcia intracorpórea es un paso importante y delicado de la cirugía. Se debe evitar en todo momento injurias en la vía urinaria con varillas o fibra láser(93).
Extracción de fragmentos
La extracción de fragmentos se puede realizar con pinzas metálicas o canastillos. En algunos casos se pueden aspirar desde el Amplatz o con varillas por el canal de trabajo.
Las pinzas de extracción tienen distintas puntas (rectas, tridentes) y los canastillos para percutánea tienen hebras metálicas o de nitinol. Se recomienda la extracción programada de litiasis desde las más cercanas a la salida interna del Amplatz hasta las más alejadas, para evitar efecto de arrastre masivo. Nunca se debe forzar la extracción de una litiasis. Esta maniobra puede provocar la salida brusca de la camisa de exploración y/o dejar un fragmento intraparenquimatoso o extrarrenal.
Finalización
La finalización de una cirugía renal percutánea puede ser porque termina la extracción de fragmentos o también porque, de forma programada, se decide realizarla en dos tiempos (considerando tiempo operatorio o sangrado intraoperatorio).
Clasicamente al finalizar la NLP se instala una sonda de drenaje (nefrostomía) desde el acceso percutáneo. Tendrá por finalidad ayudar a hacer hemostasia, separar la vía urinaria del parénquima sangrante (cuando se usa sondas con balón) y drenar la orina en las primeras horas del post operatorio.
En casos especiales, cuando se sospecha migración de fragmentos al uréter, se advierten perforaciones importantes de la vía urinaria o cuando el parénquima renal es delgado, se puede instalar un catéter doble jota anterógrado antes de finalizar el procedimiento.
La necesidad de dejar una nefrostomía ha sido ampliamente cuestionada, dado que la mayoría de los pacientes no presentan un sangrado postoperatorio significativo, perforación pelvicaliceal y no requieren una segunda revisión. En este contexto, Wickham fue el primero en omitir el uso de una sonda de nefrostomía posterior a una NLP en 1984. Sin embargo, esta propuesta no tuvo mayor aceptación hasta que Bellman et al. introdujeron el término de NLP “Tubeless” en 1997. Ellos realizaron un estudio con 50 pacientes sometidos a NLP, de los cuales 30 fueron manejados con un catéter ureteral doble J y un tubo de nefrostomía de 22F que fue removido a las 2 o 3 horas y 20 pacientes que fueron manejados sólo con un catéter doble J (denominado grupo “Tubeless”). El grupo “Tubeless” presentó menor estadía hospitalaria, menor requerimiento analgésico y retorno más rápido a la actividad normal, sin un aumento en la tasa de complicaciones (comparado con el grupo de nefrostomía estándar).
El catéter doble J utilizado en las NLP “Tubeless” no está exento de morbilidad (dolor, infección, sangrado) y requiere de un procedimiento cistoscópico adicional para ser retirado. Ante esto, se ha propuesto el uso de un catéter ureteral externalizado durante el primer día postoperatorio, el cual puede ser retirado fácilmente antes del alta. La evidencia disponible que compara estas dos estrategias no sugiere superioridad de un tipo de catéter sobre el otro. En experiencias nacionales se afirma que ambas estrategias son al menos equivalentes en términos de morbilidad postoperatoria inmediata. Es por eso que, ante iguales resultados, se recomienda el uso de un catéter ureteral externalizado(93-95) durante el primer día postoperatorio.
Últimamente ha surgido el concepto de NLP “Totalmente Tubeless”, lo que implica no utilizar drenaje urinario interno ni externo. Se ha descrito que esta estrategia podría tener resultados comparables a las estrategias más convencionales en casos sin sangrado.
En la actualidad, se acepta que la realización de NLP “Tubeless” en pacientes seleccionados reduce la morbilidad. Es por eso que se plantea que el uso de un tubo de nefrostomía luego de una NLP debe estar reservado para pacientes en quienes se requiera más de un acceso, en quienes haya ocurrido una perforación significativa del sistema colector, un sangrado intraoperatorio significativo o tengan necesidad de realizar una segunda revisión. Dicho de otro modo, la NLP “Tubeless” se recomienda para pacientes con acceso percutáneo único, sin perforación pelvicaliceal, sangrado intraoperatorio no significativo y sin evidencia de fragmentos residuales que justifiquen la necesidad de una segunda revisión.
Evaluación de la tasa libre de cálculos (stone free ratio)
Uno de los aspectos más importantes del por qué la NLP se mantiene como una técnica endourológica válida, en tiempos de la ureteroscopía flexible digital descartable y equipos láser cada vez más eficientes, es su capacidad para dejar al paciente libre de cálculos en un solo procedimiento.
La evaluación de este punto es importante, ya que permite conocer la necesidad de procedimientos complementarios como otro tiempo percutáneo precoz o en diferido, asi como LEC o ureteroscopía flexible.
En el intraoperatorio se ha planteado la realización de fluoroscopía con magnificación del campo renal, lo cual tiene un mayor rendimiento en litiasis densas radiopacas. A lo anterior se puede agregar la revisión por cálices con instrumental flexible desde el Amplatz (nefroscopía flexible) obteniendo una buena precisión al compararlo con TC postoperatorio(96).
La ECIRS permite de forma muy eficiente la evaluación intraoperatoria de litiasis residuales(93). A diferencia de la nefroscopía clásica a través del Amplatz, este procedimiento complementario y simultáneo tendría mayor capacidad de exploración de cálices paralelos al Amplatz.
La realización de TC intraoperatorio también es una opción (Dyna CT) en casos complejos con difícil exploración endoscópica. Sin embargo, el exceso de exposición a radiación ionizante reserva estos métodos, aún no tan expandidos en el mundo urológico, para casos seleccionados(97,98).
Un TC en el postoperatorio es el método más empleado para evaluar el stone free ratio, ya que es el único método con suficiente precisión para evaluar fragmentos menores de 4 mm. No obstante, su uso no está excento de controversia al exponer al paciente a más radiación. La realización de TC de baja dosis es una opción válida, ya que disminuye de forma importante la cantidad de mSv absorbidos. Este examen de imagen también permite evaluar el trayecto percutáneo, ubicación de la nefrostomía, objetivar colecciones perirrenales, litiasis ureterales, coágulos en la pelvis renal y otras complicaciones intraoperitoneales.
Complicaciones
Si bien la NLP es considerada un procedimiento bastante seguro, se pueden presentar complicaciones. Se reportan tasas que van del 20 al 80% de los pacientes. Un estudio realizado por el CROES con 5.803 pacientes reportó una tasa de complicaciones generales de 21.5%. De las complicaciones, la gran mayoría fueron menores, entre las que podemos mencionar filtración por el tubo de nefrostomía (15%) y fiebre de corta duración (10-30%)(99,100).
Las complicaciones mayores generalmente están asociadas a la realización del acceso percutáneo hacia el sistema colector y pueden incluir la lesión de órganos adyacentes, violación del espacio pleural, sangrado o infección. Las comorbilidades como insuficiencia renal, diabetes, obesidad mórbida y enfermedad pulmonar, entre otras, aumentan el riesgo de complicaciones. Muchas complicaciones pueden ser manejadas en forma conservadora (ej.: sangrado, fiebre) o mínimamente invasiva (ej.: drenaje pleural, embolización renal selectiva) si son reconocidas precozmente.
Lesión pleural: Se describe una tasa general de daño pleural de 0.3-1%, pero hay estudios que mencionan hasta un 12.5%. La incidencia es mayor en caso de acceso por sobre la undécima costilla. Estos pacientes, en su mayoría, son tratados en forma conservadora, siendo unos pocos los que requieren drenaje pleural. La injuria pleural puede producir hidrotórax, hemotórax, neumotórax, combinaciones de estos (hemoneumotórax o hidroneumotórax) o empiema. De estos, el hidrotórax (debido al fluido de irrigación en el espacio pleural) es el más común. Esta complicación suele manifestarse en forma sintomática en el postoperatorio y es evidenciable mediante una radiografía de tórax(101).
Lesión de órganos adyacentes: El daño a órganos sólidos es menos frecuente que la lesión pleural. Puede ocurrir una lesión al bazo o al hígado, pero suele estar asociado a casos de visceromegalia. La perforación colónica se reporta en menos del 1% de los casos. El riesgo de perforar el colon está asociado a una punción muy lateral a la línea axilar posterior. Este diagnóstico debe ser sospechado en caso de presentar en el intraoperatorio o postoperatorio inmediato diarrea o hematoquecia, signos de peritonitis, o paso de gas o heces a través del tracto de nefrostomía. La lesión de duodeno es aún menos frecuente. La mayor parte de las lesiones intestinales pueden ser manejadas de manera conservadora mediante un adecuado drenaje urinario, drenaje del colon (bajo fluoroscopía se deja la sonda de nefrostomía con balón inflado en el colon), reposo digestivo y antibióticos de amplio espectro(102).
Sangrado: El sangrado puede ocurrir durante todo el procedimiento, pero una hemorragia aguda debida a lesión de grandes vasos o de la vena renal es poco común y ocurre en menos del 0.5% de los casos. La mayoría de estas lesiones ocurren durante el acceso percutáneo. La tasa de trasfusión, que en un comienzo se describía como un 11%, ha disminuido en forma importante. Estudios recientes describen que la tasa de hemorragia que requiera transfusión o embolización es menor al 1%. Se ha descrito que la realización de múltiples punciones, la inexperiencia del cirujano, el acceso a polo superior, la litiasis coraliforme y ser monorreno, son factores que aumentan el riesgo de un sangrado mayor. El beneficio de usar agentes hemostáticos en cierre del trayecto de punción con el fin de evitar complicaciones hemorrágicas no ha logrado ser demostrado con evidencia contundente(103).
Sepsis/Síndrome de respuesta inflamatoria sistémica (SRIS): La incidencia de fiebre en el postoperatorio ocurre hasta en un 30%, pero la tasa de sepsis es más baja, entre un 0 a un 3% de los pacientes tratados en forma apropiada con antibióticos preoperatorios. El problema es que cuando ocurre sepsis la tasa de mortalidad es alta (66-80%). Diferentes análisis revelaron que el género femenino, múltiples punciones renales, cálculos de estruvita, cultivos positivos de la litiasis o de la orina de la pelvis renal, inmunosupresión, e insuficiencia renal, se asocian al desarrollo de SRIS posterior a una NLP(104).
Generalmente, los resultados de los cultivos obtenidos en la cirugía no están disponibles al momento de iniciar antibioterapia en el post operatorio y los organismos suelen ser diferentes a los aislados en el cultivo de orina preoperatorio. Alrededor de un 30% de los pacientes con cultivo de orina de pelvis renal positivo presentan cultivos preoperatorios negativos. Cuando el cultivo preoperatorio es positivo, sólo un 64% presenta el mismo microorganismo aislado en cultivo de pelvis renal. Un escenario similar ocurre al cultivar la litiasis: un 25% de los pacientes con cultivo positivo de la litiasis presenta un cultivo de orina preoperatorio negativo. Las diferencias entre los cultivos dificultan la apropiada elección del antibiótico preoperatorio y hace que el tratamiento de una sepsis post-NLP sea un importante desafío(105, 106).
Obstrucción o lesión del sistema colector renal: La lesión del sistema colector en una NLP ocurre hasta en un 8% de los pacientes. La extravasación y absorción de fluidos a consecuencia de esto puede llevar a una anormalidad de electrolitos, cambio en el estado mental o sobrecarga de volumen intravascular. El uso de fluoroscopía para el acceso renal percutáneo puede disminuir el riesgo del daño al sistema colector. La obstrucción del sistema colector asociado a la NLP es anormal, pero podría resultar a consecuencia de avulsión o estenosis ureteral, edema de la mucosa, coágulo sanguíneo o estenosis infundibular(99,100).
Disfunción renal: No es común y generalmente es secundaria a otras complicaciones. Por ejemplo, un sangrado intra o postoperatorio podría producir una disminución del flujo renal lo que podría derivar en una insuficiencia renal transitoria. Otro ejemplo sería la disfunción renal derivada de una angioembolización durante el tratamiento de una complicación hemorrágica, dado que este procedimiento puede producir un infarto de parénquima.
Muerte: Complicación poco frecuente, con tasas de 0.1-0.7%. La muerte asociada a NLP generalmente se encuentra en relación a complicaciones como embolia pulmonar, infarto agudo al miocardio (IAM) o sepsis severa. La embolia pulmonar y el IAM ocurren en menos del 3% de los pacientes sometidos a NLP(99,100).
Ureterorenoscopía en el tratamiento de litiasis ureteral y renal
Dr. Ricardo Susaeta C.
Introducción
La ureteronefroscopía se define como la exploración endoscópica del uréter, pelvis renal y cálices renales, generalmente en forma retrógrada desde el tracto urinario inferior o en algunos casos en forma anterógrada (Ej: Ureteroscopía desde un acceso percutáneo). Esta técnica es en la actualidad la más usada para el tratamiento de las litiasis urinarias(107). Lo anterior se debe al gran avance tecnológico de las últimas décadas en cuanto a resolución de la imagen, miniaturización y capacidad de deflexión activa de los instrumentos, gran variedad de insumos (Ej: canastillos, pinzas) y el desarrollo del láser Holmium para la litotripsia endoscópica.
En 1912 Young realizó, por casualidad, la primera ureteroscopía en un niño de 2 meses de edad llegando a visualizar por primera vez los cálices renales endoscópicamente(108). Pasaron muchos años antes de que se realizaran procedimientos ureteroscópicos, ya que existía la preocupación de dañar el uréter y la visión de los equipos era deficiente.
El sistema de lentes de Hopkins, desarrollado en 1956(109) permitió mejorar la visualización en instrumentos de menos diámetro, haciendo posible que se realizaran las primeras ureteroscopías rígidas con esta tecnología en 1977(110). Tres años después, Pérez-Castro y Martínez-Piniero desarrollaron la técnica gracias a los avances por parte de Karl Storz Endoscopy, de instrumentos de diferente longitud, (25-54 cms), diámetros variables (9 -16 fr) y canal de trabajo para el uso de pinzas, guías cepillos etc(111).
Al igual que en los adultos, en 1988 se publicaron resultados de ureteroscopías en uréteres distales en niños, con muy buenos resultados y tazas libres de litiasis de hasta 92% en un procedimiento y 100% en dos procedimientos(112).
Si bien los ureteroscopios semirrígidos reemplazaron a los rígidos con una flexión de hasta 5 cms(113) pudiendo acomodarse mejor al uréter, no era suficiente para acceder a los cálices renales. Si bien, los semirigidos mejoraron la capacidad de acceso al uréter proximal y pelvis renal, permitiendo el manejo endoscópico de tumores uroteliales altos en pelvis renal y cálices superiores, no era suficiente para acceder a tumores o cálculos caliciliares medios o de polo inferior. Debía existir un instrumento flexible para acceder a todo el árbol urinario. Gracias al desarrollo de la fibra óptica, iniciado a mediados del siglo 19 y con la demostración de la transmisión de imágenes por Heinrich Lamm en 1930(114) se desarrolló la ureteroscopía flexible.
En la década de los 60’ otras especialidades experimentaron con endoscopios flexibles y Marshall realizó en 1960 la primera ureteroscopía flexible durante una cirugía abierta. En 1962 se realizó la primera ureteroscopia por acceso transuretral con un fibroscopio 9 fr pero contaba sólo con deflexión pasiva y sin canal de trabajo(115). Uno de los problemas más evidentes era la imposibilidad de deflectar activamente la punta del ureteroscopio.
Takagi et al(116) fueron los primeros en lograr dirigir la punta del ureteroscopio, lo que permitía pensar en realizar procedimientos terapéuticos. En los años 80’ se desarrollaron instrumentos que permitieron mantener el ureteroscopio estable en el uréter mientras se trabajaba en la pelvis renal, tal como vainas rígidas y se trabajó en mejorar la irrigación durante los procedimientos con la incorporación de un segundo canal de trabajo en el ureteroscopio(117).
Otro avance significativo fue obtener una capacidad de deflexión activa suficiente para abordar los cálices renales. Midiendo los ángulos de una anatomía normal se decidió que los ureteroscopios flexibles debían lograr al menos 175 grados en la punta(118). De esta forma, se desarrollaron ureteroscopios flexible capaces de deflectar pasiva y activamente para lograr acceder a las áreas menos accesibles como es el polo inferior. Independiente del tipo de ureteroscopio, el desafío era realizar el tratamiento de litiasis urinaria en forma mínimamente invasiva ya que la litotripsia extracorpórea ofrecía un método no invasivo, pero menos efectivo.
En este capítulo revisaremos las indicaciones en el tratamiento quirúrgico de las litiasis ureterales y renales, según normas de consenso internacionales y sus resultados clínicos, el instrumental e insumos requeridos para el tratamiento de litiasis y recomendaciones prácticas para realizar esta técnica en forma segura y eficiente. Si bien, primero se abordará la ureterolitectomía semirrígida (URS), incluiremos algunos conceptos compartidos con el manejo de litiasis ureterales con ureteroscopía flexible (fURS) y litiasis renales a través de una nefrolitectomía endoscópica retrógada flexible (RIRS).
Litiasis ureterales
Indicaciones
Lo primero que hay que considerar cuando uno se enfrenta a una litiasis ureteral es si es posible que sea eliminada espontáneamente y no requiera de un procedimiento activo. Se estima que aproximadamente un 95% de las litiasis ureterales menores de 4 mm de diámetro serán eliminadas en los siguientes 40 días desde el diagnóstico.
No hay un consenso sobre la definición de un cálculo “pequeño”, ya que cualquier cálculo menor de 1 cm podría ser eliminado, especialmente si tiene un diámetro menor a 6 mm. Si bien el tamaño es relevante, es importante considerar las diferencias entre individuos y las características anatómicas de cada paciente(119).
Las indicaciones de ureterolitectomía endoscópica son básicamente aquellos pacientes con pocas probabilidades de eliminación espontánea, persistencia del dolor a pesar de un tratamiento adecuado, persistencia de la obstrucción de la vía urinaria y presencia de insuficiencia renal secundaria, ya sea por litiasis ureteral bilateral o paciente monorreno(120).
Es importante mencionar que en caso de sospechar la presencia de una complicación como es una infección urinaria asociada a la obstrucción o insuficiencia renal aguda, la desobstrucción de la vía urinaria no necesariamente debe ser lograda con la extracción de la litiasis, sino también puede obtenerse con la instalación endoscópica de un catéter ureteral (Doble J o “pig tail”) o una nefrostomía percutánea. Una vez lograda la compensación metabólica del paciente y tratada la infección, se podrá realizar la ureterolitectomía.
Si no existe una indicación clara de cirugía, se puede indicar un tratamiento médico expulsivo especialmente en el caso de litiasis ureterales distales con el uso de alfa bloqueadores (Ej: Tamsulosina). Se ha demostrado la eficacia de alfa bloqueadores como tratamiento expulsivo de litiasis ureterales distales (121-123), pero también existe evidencia que beneficia a litiasis en cualquier tramo ureteral(124). Si bien se ha puesto en duda su rol en litiasis distales < de 5 mm, se recomienda su uso en litiasis > 5 mm(125).
El paciente debe estar informado de que es posible que requiera de un tratamiento quirúrgico y que debe mantenerse en contacto con el médico. Es fundamental que el paciente esté muy bien informado de las opciones de tratamiento con sus costos y beneficios, ya que en muchas ocasiones un mismo caso puede ser tratado en forma adecuada tanto de forma conservadora o quirúrgica. Es así como una litiasis ureteral distal de 3 mm de diámetro puede tratarse con analgésicos y tratamiento expulsivo, privilegiando menor grado de invasividad, pero con el riesgo de evolucionar con dolor o alguna complicación. Por otro lado, un paciente puede preferir una uretrerolitectomía endoscópica por el simple hecho de querer evitar otro cólico renal, privilegiando efectividad, pero exponiéndose a eventuales complicaciones del acto quirúrgico. El consentimiento informado más importante es el que se logra de una buena comunicación médico paciente y en caso de realizar un tratamiento expulsivo ambulatorio, mantenerse en contacto con el paciente y que cuente con un servicio de urgencia en caso de ser necesario.
La ureterolitectomía endoscópica (URS) es una de las técnicas más usadas en la actualidad para el manejo activo de litiasis ureterales en cualquier ubicación. Lo anterior se debe al desarrollo de instrumental miniaturizado con bajas tasas de complicación y gran eficiencia(126). Si bien es cierto que los cálculos ureterales distales y tercio medio son los ideales para abordar con un ureteroscopio semirrígido, es posible tratar cálculos proximales de esta forma(127). En caso de no acceder con el ureteroscopio semirrígido, los ureteroscopios flexibles pueden ser utilizados para tratamiento de litiasis ureterales proximales con muy buenos resultados, especialmente con instrumentos digitales(128).
Si bien la litotripsia extracorpórea (LEC) sigue siendo una opción no invasiva para el tratamiento de litiasis ureterales, la ureteroscopía ha pasado a ser la técnica de preferencia. En la Figura 6, podemos observar que ambas técnicas son recomendadas a la par, pero no considera las Unidades Hounsfield de la litiasis. En caso de ser una litiasis con más de 1000 unidades Hounsfield (UH), la probabilidad de fragmentación con una LEC baja significativamente y debiéramos considerar al tratamiento endoscópico como la primera opción.

Cuando comparamos la tasa libre de litiasis para ambas técnicas, estas son bastante parecidas, pero a favor de la URS, especialmente en litiasis de mayor volumen (129-130). Si bien la URS está asociada a mayor tasa de complicaciones, estas se han reducido significativamente en cantidad y gravedad (Mayoría Clavien -Dindo I) gracias a la miniaturización y técnicas más depuradas(131).
La URS es más exitosa que la LEC en el tratamiento de litiasis ureterales < de 10 mm en un solo procedimiento en cualquier segmento ureteral(132). Sin embargo, en litiasis ureterales proximales >10 mm la URS no es más eficiente que la LEC, por lo que esta última es una buena opción a no ser que la litiasis tenga un coeficiente de atenuación (Unidades Hounsfield) mayor a 900-1000 UH. Si bien la URS requiere de menos cantidad de procedimientos por litiasis tratada, el tiempo de hospitalización es más prolongado que la LEC(133).
Desde el punto de vista económico, se han realizados estudios que comparan a largo plazo la URS y la LEC. Dichos estudios confirman que la ureteroscopía es más costo efectiva, ya que requiere de menos procedimientos para lograr un estado libre de cálculos(134-135).
Técnica quirúrgica: Consideraciones generales
Antes de realizar una Ureterolitectomía Semirrígida (URS) o una Nefrolitectomía Endoscópica Retrógrada Flexible (RIRS), debemos informar al paciente y a sus familiares de la naturaleza de su problema, de las opciones de tratamiento antes mencionadas, del tiempo más probable de hospitalización y recuperación, de las molestias inherentes de la técnica y las posibles complicaciones. Si cumplimos con lo anterior, podremos darle al paciente una expectativa realista de esta opción de tratamiento, podremos enfrentar eventuales complicaciones con mayor tranquilidad y evitar problemas médico legales.
Antes de indicar una URS es importante contar con un diagnóstico adecuado de la ubicación del cálculo, tamaño de la litiasis y considerar el volumen como un factor importante, la distancia de la piel al cálculo y la densidad del cálculo expresada en Unidades Hounsfield (UH). Esta información se logra con la realización de un scanner abdominal y pelviano sin medio de contraste(136). Es importante considerar la realización de este examen con protocolos de baja dosis de exposición que pueden lograr imágenes de buena calidad y disminuir la dosis de rayos que suele ser alta en los pacientes con patología litiásica(137,138). En casos con antecedentes de malformaciones congénitas del tracto urinario, cirugías previas o un scanner sin contraste que no puede asegurar que la calcificación descrita se trata de una litiasis ureteral, es conveniente realizar un scanner con medio de contraste antes de la cirugía endoscópica.
En el caso de las litiasis renales, si el scanner sin medio de contraste no nos asegura que la litiasis está situada en las cavidades del sistema colector pielo caliciario, es importante considerar realizar un scanner con medio de contraste y placas tardías para poder tener una noción lo más exacta posible de la anatomía del sistema colector. Lo anterior se debe aplicar con mayor razón en pacientes con antecedentes quirúrgicos previos o aquellos con malformaciones congénitas o variantes anatómicas y así decidir su manejo (Figura 7).

Otro ejemplo típico de lo anterior es aquellos pacientes que tienen una litiasis generalmente en el polo superior y que en el scanner abdominal sin medio de contraste se ubica en una posición inhabitual y cercana a la corteza renal. Con el uso de medio de contraste hacemos el diagnóstico de un divertículo caliciliar. Este diagnóstico más depurado nos ayuda a tomar la decisión de observar, continuar con el plan de RIRS o si es más adecuado realizar un abordaje percutáneo del divertículo caliciliar.
Debemos considerar la comorbilidad del paciente y realizar una evaluación preoperatoria que al menos incluya un examen de orina completo y urocultivo, evaluación de la función renal, descartar alteraciones de coagulación, evaluar el índice de masa corporal (IMC) y evaluar si el paciente está en tratamiento anticoagulante. En todo caso, si bien existe una mayor posibilidad de complicaciones en pacientes con discrasias sanguíneas o en tratamiento anticoagulante/antiplaquetario, es razonable realizar una URS o RIRS en estos pacientes(139).
La URS semirrígida es una buena opción para pacientes con IMC > 30 kg/m2, con tasa libre de cálculo y complicaciones comparable a la LEC. Con un IMC > 35 kg/m2 la tasa de complicaciones aumenta al doble (140).
No existen contraindicaciones específicas para realizar una URS, RIRS o una ureteroscopía flexible (fURS) aparte de consideraciones generales relacionadas a la anestesia o infección urinaria concomitante. En general, se recomienda una anestesia general para ambas técnicas, pero la URS y la fURS pueden también realizarse con anestesia regional e incluso con una sedación en mujeres con litiasis ureteral distal(141). En caso de tratarse de una litiasis ureteral proximal impactada y de alto volumen, con un sistema colector dilatado o cuando no es posible el acceso retrógrado, es conveniente considerar la opción de una ureterolitectomía endoscópica anterógrada por acceso percutáneo(142-144).
Debido que el objetivo principal de una URS es la desobstrucción de la vía urinaria, debemos advertir al paciente que es posible que no se logre extraer la litiasis en una primera intervención y será necesario dejar instalado un catéter doble j por una semana para luego realizar la cirugía definitiva. Este procedimiento llamado “pre stenting” o cateterización ureteral previa, no es algo que hacemos de rutina, pero que el paciente debe considerar como una posibilidad. El “pre stenting” facilita la manipulación de las litiasis ureterales, mejora la tasa libre de cálculos y reduce las complicaciones intraoperatorias(145,146). Se ha comprobado que el uso de un catéter ureteral posterior a una cirugía ureteral poco traumática, con extracción completa de la litiasis no es indispensable(147).
Una opción intermedia y que realizamos con cierta frecuencia en las URS es la instalación de un catéter ureteral exteriorizado y fijo a la sonda uretrovesical y que es retirado a las 24 hrs junto a la sonda foley (147). El paciente debe saber que el uso de un catéter doble J, generalmente por 1 o 2 semanas, es una posibilidad cierta en el postoperatorio y que no se puede predecir con absoluta seguridad si se utilizará o no. Se recomienda su utilización cuando existe un trauma ureteral evidente, cuando hay fragmentos residuales, sangrado significativo, perforación ureteral, infección urinaria o embarazo. En caso de dudar en su utilización, creemos que es preferible instalar un catéter doble J “de más”, que “de menos”. El paciente debe saber que su instalación puede significar molestias de variada cuantía y que se ha demostrado que disminuyen significativamente con alfa bloqueadores como la tamsulosina 0,4 mg al día hasta el retiro del catéter(149, 150).
Planificación de la ureteroscopía
La URS/fURS y la RIRS son cirugías que “comienzan” cuando se realiza la solicitud de pabellón. Es en ese instante cuando debe existir claridad del endourólogo tratante de cuáles serán los requerimientos para realizar una cirugía de bajo riesgo, cómoda para todo el equipo y así no se transforme en una mala experiencia. Debido que el tratamiento de la litiasis urinaria nos puede sorprender con inconvenientes inesperados, es necesario disponer de elementos que eventualmente no necesitaremos, pero que pueden significar el éxito y evitar complicaciones.
Antes de iniciar la cirugía es muy importante que exista un equipo afiatado y familiarizado con esta técnica ya que requiere de una metodología muy precisa y de mucha paciencia. Debe considerarse como parte del “equipo” no solo al ayudante y la instrumentista especializados en endourología sino a todas las personas que hacen posible este tipo de cirugía. Es así como el personal de esterilización, bodega, traslado de los equipos, enfermera a cargo del pabellón, auxiliares de pabellón que manipulan estos equipos frágiles y da alto costo, el anestesiólogo y el tecnólogo de rayos deben conocer la técnica, la posición del paciente, el tipo de mesa radiolucida a utilizar y conocer los insumos que se utilizarán. Tanto la URS/fURS como una RIRS puede ser realizada por un urólogo y una instrumentista, pero en general la realizamos dos endourólogos y una instrumentista.
Revisaremos paso a paso cómo realizamos esta técnica en nuestra unidad de litiasis e incluiremos trucos y recomendaciones. Muchos de estos pasos son comunes entre la ureteroscopía semirrígida y flexible. De hecho, en prácticamente todas las ureteroscopías flexibles utilizamos el ureteroscopio semirrígido para explorar y dilatar el uréter.
Ureterolitectomía endoscópica semirrígida y flexible (URS y fURS) y nefrolitectomía endoscópica retrógrada flexible (RIRS): Consideraciones y pasos a seguir
Pabellón
Antes de ingresar al paciente a pabellón debemos solicitarle firmar un consentimiento informado, asegurarnos que él y su acompañante entienda de qué se trata la cirugía y cumplir con las normas de seguridad establecidas. Es muy importante contar con un pabellón cómodo y con los equipos necesarios para realizar la técnica. La Figura 8 muestra la disposición del pabellón con los elementos básicos para la realización de la cirugía. Tanto para la ureteroscopía semirrígida como para la flexible, usamos esta misma conformación independiente del lado en que se encuentre el cálculo. La mesa quirúrgica debe ser radiolúcida y adaptable para pacientes de diferente estatura. En nuestro caso, nos asiste un tecnólogo de rayos que debe evaluar que exista un espacio adecuado para el arco en C y cubrir tanto la pelvis como la zona lumbar del paciente.

La Figura 9 muestra al equipo quirúrgico que se posiciona entre las piernas del paciente en posición de litotomía clásica y con una mesa a los pies del paciente, hacia su lado izquierdo y que topa con la mesa quirúrgica. Esta mesa es adaptable en su altura y queda como prolongación de la mesa quirúrgica.
Cuando queremos manipular la guía hidrofílica existe el riesgo que se deslice y salga del uréter. Para evitar esto, se extiende la guía desde el meato ureteral y se hace descansar sobre la mesa al mismo nivel del meato lo que evita su deslizamiento y perdida de posición. Esto es muy relevante cuando queremos instalar un doble j o instalar una vaina de acceso. La arsenalera se ubica detrás de esta mesa.
A la derecha del paciente se posiciona una mesa donde se instala el ureteroscopio flexible en caso de utilizarlo (Figura 10). La enfermera, idealmente especializada en endourología, debe conocer el diagnóstico y estar familiarizada con el procedimiento y funcionamiento del instrumental.
La instrumentista o arsenalera debe ser entrenada previamente y los conocimientos ser traspasados por otra arsenalera en pabellón. Creemos que debe existir un equipo de arsenaleras capacitadas en endourología ya que el cuidado del instrumental es vital para la duración de estos. Todos los miembros del equipo participante deben contar con trajes plomados para protección de rayos, que incluya protección cervical para aquellos que estén cercanos al paciente.

Profilaxis antibiótica
En nuestra práctica habitual realizamos un examen de orina completo y un urocultivo, en lo posible no más alejado de una semana de la cirugía. Si el urocultivo es negativo no existe un acuerdo absoluto sobre la necesidad de profilaxis antibiótica, pero nuestro protocolo incluye el uso de una cefalosporina de primera generación aplicada durante la hora previa a la cirugía (Ejemplo: Cefazolina 1 gr EV).
Posición del paciente y anestesia
La posición del paciente para esta cirugía es la litotomía clásica (Figura 8), con la pelvis al borde de la mesa quirúrgica y las extremidades inferiores en pierneras tipo Allen, que en lo posible puedan ser corregidas en su posición durante la cirugía. Es importante consultar al paciente si existe algún tipo de dificultad en la movilidad de sus caderas o cirugías previas que no permitan la abducción de las caderas y flexión de las rodillas. El cambio de posición de las caderas, bajo anestesia, debe ser muy cuidadoso para evitar complicaciones articulares. No creemos necesaria la hiperflexión de una de las caderas dependiendo de la lateralidad del cálculo, ya que no siempre es necesaria para una cómoda manipulación del instrumental endoscópico y acceso ureteral. Tampoco hacemos diferencia entre géneros para el posicionamiento del paciente. Es muy importante proteger las zonas de apoyo y adaptar las pierneras al paciente y no viceversa.
Utilizamos medias antiembólicas y compresión neumática en aquellos pacientes de mayor riesgo de enfermedad tromboembólica o si prevemos una cirugía prolongada. Del punto de vista anestésico, creemos que debe realizarse con anestesia general ya que el tiempo operatorio puede ser impredecible. Por otro lado, al utilizar anestesia regional los movimientos respiratorios pueden interferir en las litiasis de uréter proximal cercanas al riñón o que se desplacen al riñón durante la cirugía. El uso de apnea momentánea puede ayudar significativamente en la eficacia de la cirugía, especialmente al realizar litotripsia endoscópica(151,152).
Endoscopía inicial
Como regla general consideramos que debemos tratar de tener a mano la mayor variedad de instrumental posible. De esta forma podemos ofrecer a nuestros pacientes una cirugía “a la medida”, con óptimos resultados y máxima seguridad. Sin embargo, debemos racionalizar el uso del instrumental, debido al alto costo, tanto del instrumental reutilizable como los desechables. Para su uso más eficiente es vital poner en práctica el concepto “de menos a más”: en la solicitud de pabellón sugerimos pedir todo lo necesario para diferentes escenarios y a medida que avanza la cirugía indicamos cuál instrumental o insumos abrimos según la necesidad.
Cistoscopía
Este es un paso que tradicionalmente hemos realizado para evaluación ureteral, prostática, posicionamiento y características de los meatos ureterales, evaluación vesical y exploración en búsqueda de litiasis vesicales o ureterales recién expulsadas. Creemos que puede ser de gran beneficio cuando se trata de pacientes masculinos con antecedentes de hipertrofia prostática y especialmente con lóbulo medio hipertrófico. En estos pacientes puede ser dificultoso el acceso ureteral. En el caso de tener un paciente con catéter doble J previamente instalado, realizamos una cistoscopía para extraer parcialmente el doble J e instalar la guía de seguridad por método de Seldinger a través del catéter. Otra razón para realizar una cistoscopía al inicio de la cirugía es cuando hay antecedentes de cáncer vesical previo para inspeccionar la vejiga. Si se trata de un paciente joven y sin antecedentes previos con una litiasis ureteral, se puede iniciar la endoscopía sólo con el ureteroscopio y de esta manera realizar una cistoscopía más restringida e instalar la guía de seguridad directamente.
Guía de seguridad
Si bien existen publicaciones que han demostrado buenos resultados en ureterolitectomías sin el uso de guías de seguridad (153-155), creemos que lo más recomendable es usar siempre una guía de seguridad. Sabemos que podría estar de más, pero no sabemos cuándo tendremos un accidente y quedemos imposibilitados de instalar una doble J. Normalmente utilizamos una guía hidrofílica de punta recta de 0,035 pulgadas y si es necesario, una guía del mismo diámetro, pero de cuerpo más rígido y punta flexible que puede permitir sobrepasar las litiasis impactadas con más facilidad (Figura 11).

Utilizamos un catéter ureteral de punta recta de 6 french que ayuda en la introducción de la guía hidrofílica. Dependiendo de la disposición del meato ureteral podemos usar un catéter ureteral de punta curva o una guía de seguridad de punta curva para lograr el acceso al uréter intramural (Figura 12). En general, es el ayudante el que empuja la guía, por lo que debemos estar coordinados y controlar el avance inicial por el uréter distal bajo visión radioscópica con imágenes estáticas o en tiempo real de muy corta duración, especialmente si hay alguna dificultad en el ascenso. Si bien es infrecuente, existen uréteres que prácticamente hacen una vuelta en “U”, lo que pudiera predisponer a la perforación del uréter distal incluso con una guía de punta flexible. Si existe un tope de la guía, se puede utilizar un catéter ureteral con punta de cono y realizar una pielografía ascendente desde el meato, que permite el avance del medio de contraste sin refluir hacia la vejiga y así evaluar el trayecto ureteral y asegurarnos que ascendemos hacia la pelvis renal con seguridad.

Existen diversos tipos de catéteres ureterales que pueden facilitar el ascenso de guías en caso de uréteres tortuosos (Figura 13). Lo anterior debe ser realizado con suavidad para evitar perforaciones y ascenso de la litiasis hacia el riñón. Una vez instalada la guía recomendamos retirar el endoscopio, asegurar la posición de la guía de seguridad con una imagen estática de radioscopía, introducir la guía en su reservorio original y dejarla fija al muslo del paciente.

Ureteroscopía
Equipos
En la actualidad lo más usado para un acceso ureteral retrógrado es el ureteroscopio semirrígido, ya que posee cierta flexibilidad de su vaina, permitiendo acomodarse mejor al trayecto ureteral. Existen ureteroscopios semirrígidos de diferentes diámetros en su punta (1,3 mm a 2,4 mm) que incluyen óptica miniaturizada, canal de trabajo que permite el paso de instrumental (pinzas, canastillos, guías de seguridad, etc.) e irrigación continua para mejorar la visibilidad. La conexión del ureteroscopio a una cámara permite visualizar el campo operatorio endoscópico en una pantalla que aumenta la imagen aproximadamente 16 veces (Figura 14).

Irrigación
La irrigación con suero fisiológico no debe estar a mayor altura que unos 40 cms de agua para evitar la hiperpresión del sistema y a temperatura ambiente. Recomendamos tener siempre a mano algún sistema de bombeo mano asistida (Figura 15) para irrigar con más efectividad. En caso de utilizarlo, el cirujano debe liderar el grado de irrigación utilizando la llave de paso del ureteroscopio dosificando la irrigación. El ayudante debe aplicar el bombeo manual solo si es necesario para mejorar la visibilidad, especialmente cuando hay un instrumento en el canal de trabajo. El ayudante no debe dejar de observar la pantalla para evidenciar el grado de retropulsión que ejerce sobre la litiasis. La presión de la cavidad estará relacionada a la fuerza que ejerza el ayudante con su mano(156), especialmente cuando el canal de trabajo está vacío.
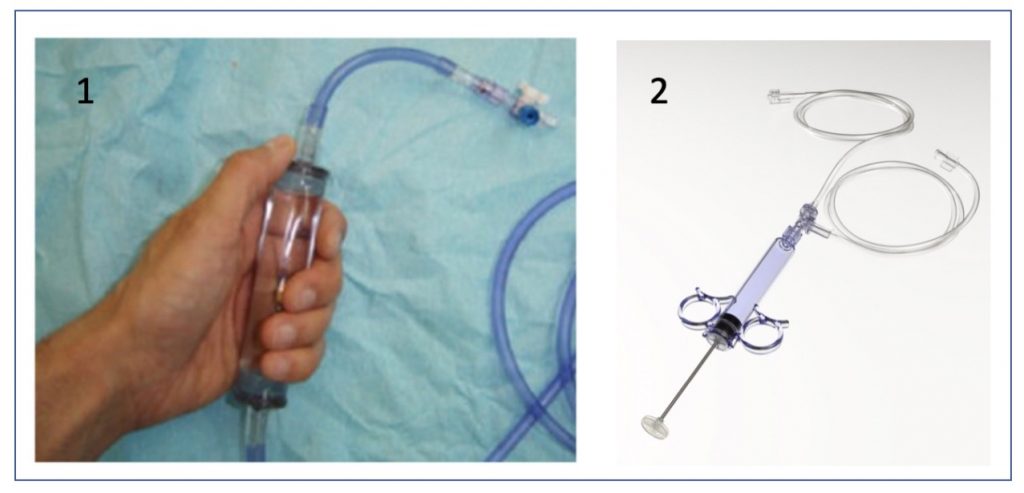
Acceso ureteral
Una vez que se tiene visualizado el meato ureteral es importante considerar si se trata de un meato y uréter distal con antecedentes previos de cirugía endoscópica ya que puede haber quedado más amplio o por el contrario más estrecho por cicatrización. Esto nos da una idea de lo que podríamos encontrar.
Idealmente es bueno contar con ureteroscopios semirrigidos de diferente calibre para adaptarnos a diferentes situaciones. En nuestra práctica contamos con un ureteroscopio semirrígido originalmente destinado al uso infantil de 4,5 fr de diámetro en su punta y 6 fr en su extremo proximal (4,5 – 6,0 fr) y 40 cms de largo. Este instrumento nos permite realizar ureteroscopía semirrígida en todo el trayecto ureteral casi siempre sin necesidad de dilatación ureteral con gran facilidad para vencer el meato y trayecto intramural utilizando solo una guía de seguridad. Una desventaja de este ureteroscopio “punta de aguja”, en relación a ureteroscopios de 6 – 7,5 fr y 8 – 9,8 fr, es que no se pueden utilizar pinzas reesterilizables y la irrigación es de menor flujo.
En el caso de la irrigación, también se debe aplicar el concepto “de menos a más” y muchas veces se puede acceder al uréter distal sin necesidad de gran flujo, observando el peristaltismo ureteral y el flujo de orina desde el riñón. Para eso hay que esperar dichas dilataciones para ascender secuencialmente. Otra opción es pulverizar la litiasis hasta obtener fragmentos menores de 1 mm, sin necesidad de extraerlos ya que son de fácil eliminación, especialmente si queda un catéter ureteral tipo doble J.
En caso de no lograr superar el meato o el uréter distal se puede dilatar en forma activa o en forma pasiva. Si bien no usamos ni recomendamos el uso de balón dilatador ureteral en forma rutinaria, creemos que es necesario tenerlo dentro del armamento ureteroscópico para casos especiales. No hay trabajos prospectivos que demuestren ventajas en su uso rutinario, pero sí hay evidencias de que la presencia de un catéter ureteral previo, por una semana, hace más fácil el acceso y disminuye la necesidad de dilatación con balón(156).
Es importante considerar que la dilatación activa con dilatadores en serie, coaxiales o con balón tiene un 5% de riesgo de perforación ureteral(157). Por otro lado, el uso de stents ureterales previo a la cirugía está asociado a menor cantidad de complicaciones y mayor tasa libre de litiasis(158). En nuestra práctica diaria no recomendamos el uso rutinario de doble J previo a una ureterolitectomía retrógrada en cualquier posición ureteral, ya que preferimos intentar la extracción de la litiasis, advirtiéndole al paciente que existe la posibilidad de sólo instalar un doble J y realizar una ureterolitectomía en una semana con un uréter dilatado(159, 160).
En caso de no poder negociar el meato ureteral, con una guía instalada en la pelvis renal instalamos una segunda guía, ya sea de 0,035 pulgadas o una más fina, de 0,025 pulgadas, hasta la pelvis renal. De esta manera intentamos un ascenso con la segunda guía en el canal de trabajo. Es importante considerar que esto hace que la punta del ureteroscopio pueda erosionar la mucosa. Una opción es rotar el ureteroscopio para intentar evitar lo anterior.
Otro punto a considerar es asegurarse que la guía ascienda a la pelvis, sin perforar la mucosa ureteral en la zona donde está impactada la litiasis, para luego reingresar al lumen. Si ascendemos con el ureteroscopio sin considerar esta opción, podemos perforar el uréter. En cualquiera de las etapas anteriores es importante no dudar en realizar una pielografía ascendente, ya sea a través del ureteroscopio semirrígido o instalando un catéter ureteral, ya que esto nos dará una idea más precisa del trayecto ureteral, acodaduras y posibles perforaciones inadvertidas.
Si no es posible ascender con la guía en el canal de trabajo, pasamos al siguiente paso que es instalar ambas guías y luego intentar el acceso entre ambas guías con la técnica del “riel”, lo que produce una dilatación y un paso más fácil del ureteroscopio hasta la litiasis. Una vez visualizada la litiasis, podemos retirar una de las guías (preferimos dejar instalada la guía de 0,035 pulgadas) y así dejar más espacio luminal.
Extracción de la litiasis ureteral
El paciente debe estar informado que el principal objetivo de la cirugía es la desobstrucción de la vía urinaria para el manejo del dolor, protección de la función renal y anticipación a complicaciones derivadas de una litiasis con pocas probabilidades de expulsión espontánea.
Las litiasis ureterales pueden ser extraídas directamente o posterior a su fragmentación, o bien, se puede realizar la pulverización para su posterior eliminación espontánea. El no extraer todos los fragmentos pudiera significar un aumento de la tasa de retratamiento y rehospitalización y menor tasa libre de litiasis (161).
Dependiendo del tipo de ureteroscopio semirrígido, tamaño de la litiasis y ubicación, será la elección del método a utilizar. En el caso de litiasis ureterales distales menores de 5 mm que no han sido expulsadas espontáneamente, podemos encontrarnos con un uréter que si bien permite el paso retrógrado y llegar hasta el cálculo, no permitirá la extracción in toto con el cálculo atrapado en la pinza o el canastillo. En este caso, recomendamos la fragmentación o pulverización de la litiasis en el uréter dilatado (a proximal de la posición inicial del cálculo) y dilatación del uréter distal avanzando el ureteroscopio hacia el uréter proximal, donde aprovechamos de confirmar que no existan fragmentos ascendidos en forma inadvertida. Posteriormente, realizamos el retiro de fragmentos ya sea con pinzas de extracción o canastillo.
Con respecto al uso de pinzas, se pueden reemplazar por algún canastillo (canastillo “tipless”, de apertura frontal y lateral, o tipo paracaídas en caso de necesidad de retirar múltiples fragmentos). El canastillo tipo «paracaídas” es muy útil cuando nos encontramos en una porción dilatada del uréter donde se realizó la fragmentación de la litiasis. Sin embargo, es importante considerar el diámetro ureteral distal por donde extraeremos el canastillo para no exceder este diámetro y arriesgar que se atasque en el uréter y se produzca una lesión ureteral.

Logrado lo anterior, evaluamos si el tramo de uréter manipulado presenta inflamación o erosión significativa para decidir si dejamos un catéter ureteral y de qué tipo. Si la cirugía fue prolongada, el uréter está muy inflamado, vemos erosiones o alguna perforación, instalamos un doble J entre 4,8 y 6 fr de diámetro que se retira una semana posterior a la cirugía. Si el uréter no está significativamente inflamado, la cirugía fue corta y no hay perforaciones, otra alternativa es dejar un catéter ureteral recto de 6 fr de diámetro en la pelvis renal y exteriorizado por la uretra, drenando a través de la sonda uretrovesical y se retira junto a esta a las 24 hrs. En el caso de pacientes que se realizan una URS y que ya tenían un doble J instalado, generalmente no recomendamos dejar un catéter ureteral posoperatorio ya que el uréter está previamente dilatado y se puede evitar la molestia del doble J por una semana.
Uno de los problemas más temidos por el urólogo durante la ureterolitectomía endoscópica es la migración de fragmentos de litiasis hacia el uréter proximal o hacia la pelvis renal y no poder extraerlos durante la cirugía. Este problema se relaciona en parte por una mala técnica en el uso de la irrigación con suero fisiológico, la utilización de algunos instrumentos que facilitan este problema (como son los litotriptores neumáticos) o el uso incorrecto de los parámetros de energía utilizados con el láser Holmium como fuente de energía.
Existen dispositivos para evitar la migración de fragmentos (Figura 17). Si bien han demostrado ser muy eficientes y seguros(162-165), hemos dejado de utilizarlos debido a las siguientes razones:
Utilizamos únicamente láser Holmium en las URS y con parámetros de energía que disminuyen la retropulsión (baja energía, alta frecuencia y pulso largo), usamos la irrigación solo cuando es necesario y si es necesario, drenamos el uréter con la llave de salida para favorecer el flujo hacia distal. Por otro lado, controlamos la migración hacia proximal evaluando la posición de la litiasis con radioscopía y acomodando la litiasis lo más distal posible para continuar la litotripsia. Lo anterior sirve especialmente en litiasis ureterales de uréter medio y distal. En el caso de litiasis ureterales proximales, sin litiasis renales concomitantes y de volumen alto (1 cm de diámetro mayor o más), intentamos realizar la litotripsia in situ.
Existen ocasiones en que no se logra realizar una URS en el uréter proximal con un ureteroscopio semirrígido, ya que no es capaz de acomodarse a la angulación ureteral, ya sea por una próstata aumentada de volumen o por dificultad en sobrepasar los vasos ilíacos. Esto se supera utilizando un ureteroscopio flexible y un láser Holmium, que han demostrado tener gran éxito en el tratamiento de litiasis ureterales proximales y con bajas tasas de complicaciones en litiasis < de 20 mm. Las tasas de fracaso o retratamiento son mayores con ureteroscopios semirrígidos que con ureteroscopios flexibles(166).

Hay que considerar que el uréter proximal es la porción del uréter con la pared más fina, por lo que tiene más riesgos de perforación. Por lo anterior, si la litiasis no está impactada, muchas veces preferimos movilizar la litiasis a algún cáliz del polo superior que permita trabajar con el ureteroscopio flexible. De esta forma realizamos la litotripsia con escasa deflexión y con espacio suficiente para contener los fragmentos, trabajar con mayor comodidad, seguridad para el paciente y para el endoscopio. En el caso que la litiasis esté impactada en el uréter proximal con hidroureteronefrosis proximal, o cuando el uréter no puede ser abordado en forma retrógrada, una muy buena opción es realizar una ureterolitectomía endoscópica anterógrada o la ureterolitectomía laparoscópica(167-173).
Fragmentación y pulverización de la litiasis
El dispositivo que ha demostrado mejores resultados para la fragmentación y/o pulverización de las litiasis es el láser de Holmium, que es capaz de fragmentar cálculos de cualquier composición y en forma segura. (Figura 18)(174).

Provee de una energía pulsátil a una longitud de onda de 2100 nm y es invisible al ojo humano. Las litiasis son destruidas por un efecto foto térmico y la radiación emitida es absorbida por agua contenida en la litiasis, lo que crea una presión de vapor que fragmenta la litiasis(175-177). Si bien es importante contar con el láser Holmio para cualquier ureterolitectomía endoscópica, nuevamente debemos ir “de menos a más” y abrir la fibra del láser cuando estemos seguros de que hemos llegado a la litiasis y están dadas las condiciones de usarlo. Esto nos ahorra el costo de fibras desechables de alto valor y la reesterilización de las fibras reutilizables, con el consiguiente riesgo de daño durante ese proceso.
Al realizar una ureterolitectomía semirrígida, podemos utilizar una fibra de mayor diámetro (Ej: 365 um), pero debemos considerar que es posible que sea necesario utilizar una fibra más fina (Ej: 200 o 273 um) si fuese necesario utilizar un ureteroscopio flexible en la misma intervención. De esta forma tendremos una deflexión adecuada y no se verá afectada la irrigación. Otro aspecto a considerar al elegir el diámetro de la fibra es la eficiencia de esta. Se ha demostrado que si bien las fibras más gruesas logran crear una fisura más amplia y las más finas fisuras más profundas, no existe diferencia significativa en la capacidad de volumen ablativo(178,179). A pesar de que las fibras más finas se degradan más rápido y son más frágiles, estas permiten una mejor irrigación y menor repropulsión al realizar la litotripsia ureteral. Es por lo anterior que siempre recomendamos usar una fibra de 272 um al usar el ureteroscopio semirrígido(180,181).
Recomendamos instalar el equipo de láser Holmium cercano a la mesa lateral de trabajo, con la pantalla a la vista del cirujano y así controlar los parámetros de energía durante la cirugía. La fibra debe manipularse previniendo su quiebre y en caso de ser reutilizable, tener la longitud suficiente para acceder al cálculo y no quedar muy tensa ya que puede dañar el endoscopio, si es accidentalmente traccionada e introducida en el endoscopio durante la activación del láser.
Una vez elegida y abierta la fibra, es muy práctico enrollar la sobrante, posicionarla sobre la mesa y sujetarla con gasas cuadradas mojadas que evitan su desplazamiento. Los fabricantes recomiendan retirar las coberturas de la fibra con una tijera de cerámica.
Se ha comprobado que las fibras son más eficientes cuando están recubiertas en la punta y que cortando la fibra con tijeras de metal, el ras de la cubierta no causa un desmedro en su efectividad y se logra disminuir su degradación(182,183). La fibra debe instalarse en el canal de trabajo, sin ser activada y avanzada hasta ser visualizada cubriendo un cuarto de la pantalla para así evitar daño al endoscopio. Si bien esta es una recomendación para los ureteroscopios flexibles, es una medida de seguridad que debemos tener presente también en ureteroscopía semirrígida(184).
El láser Holmium posee tres parámetros que el cirujano puede modificar: La energía (jouls, J), la frecuencia (Hertz, Hz) y la duración del pulso emitido (corto: 180 – 330 us o largo: 650 – 1215 us). La multiplicación de los jouls y Hertz da como resultado el poder total en Watts (Jouls x Hertz = Watts).
La capacidad de destrucción del láser se asocia principalmente a la energía del pulso (J) y a la duración del pulso emitido. Mientras más Jouls sean emitidos y menor sea la duración del pulso, mayor será el poder de destructor del láser(185). Si aplicamos una mayor frecuencia (Hz), menos energía (J) y mayor duración del pulso lograremos fragmentos más pequeños y estaremos pulverizando (“dusting”) el cálculo para disminuir su volumen. Si aplicamos menor frecuencia (Hz) y mayor energía (J) con una duración más corta del pulso, lograremos fragmentos más grandes que deberán ser extraídos por canastillos (“Basketing”)(186).

Catéter doble J postoperatorio
Existen múltiples estudios prospectivos y randomizados que demuestran que el uso rutinario de doble J en el postoperatorio no es necesario en cirugías no complicadas con extracción completa de la litiasis. Esto se debe a que en estos casos la morbilidad postoperatoria puede ser mayor por el uso del doble J (187,188). A pesar de lo anterior, aproximadamente el 80% de los urólogos instalan un doble J posterior a una ureteroscopía no complicada(189). Se recomienda el uso de doble J postoperatorio en pacientes con mayor riesgo de complicaciones: fragmentos residuales, sangrado, presencia de perforaciones o erosiones significativas, infección urinaria concomitante, embarazo o cuando se realiza una ureteroscopía bilateral(190,191).
Si lo utilizamos, es importante advertir con anterioridad al paciente de las eventuales molestias causada por el doble J. Es muy difícil predecir cómo será la tolerancia y no hay evidencias claras de cuál tipo de doble J produce menos molestias. En general dejamos el doble J por 7 a 10 días y utilizamos alfa bloqueadores de regla(192,193) y analgésicos o anticolinérgicos en caso necesario.
Nefrolitectomía endoscópica retrógrada flexible: RIRS
En los últimos años ha habido grandes avances tecnológicos en endourología pero especialmente en relación a la nefrolitectomía endoscópica retrógrada flexible (RIRS). Estos avances están desafiando las guías que evaluaremos a continuación ya que en algunos centros se están realizando RIRS como tratamiento de primera línea en litiasis > de 20 mm de diámetro, debido a los avances en la calidad óptica, capacidad de deflección y fuentes de energía más eficientes (194,195). Si bien estos avances son significativos, en la actualidad no se recomienda realizar una RIRS como tratamiento de primera línea para litiasis > 20mm ya que la tasa libre de litiasis disminuye significativamente y es altamente probable que se necesite más de un tratamiento para lograrlo(196,197).
Antes de realizar una nefrolitectomía endoscópica debemos considerar si el paciente requiere o no un tratamiento activo de su litiasis renal. Si esta no es obstructiva, es asintomática y pequeña, no se puede predecir su historia natural y el riesgo de progresión es en general incierto. Por lo anterior, las opciones que tenemos a mano son la observación, el tratamiento médico o la extracción quirúrgica. No existe un consenso en cómo observar una litiasis renal asintomática, pero se ha sugerido que las litiasis de polo inferior menores de 10 mm pueden ser observadas anualmente y si existe crecimiento, realizar observaciones más seguidas decidiendo una extracción de la litiasis si su crecimiento es > 5 mm(198).
En caso de decidir observar una litiasis asintomática, es importante informar al paciente que existe un 10 a un 25 % de riesgo por año de tener un episodio sintomático y una probabilidad acumulada de tener un evento sintomático de 48,5 % a cinco años(199, 200). Si bien existen algunos que promueven realizar tratamiento activo de litiasis asintomáticas caliciliares, los datos no son concluyentes(201,202).
En la Figura 20 se describen las indicaciones de tratamiento activo de litiasis renales según la guías europeas de manejo de litiasis, muy coincidentes con las guías americanas(203-205).
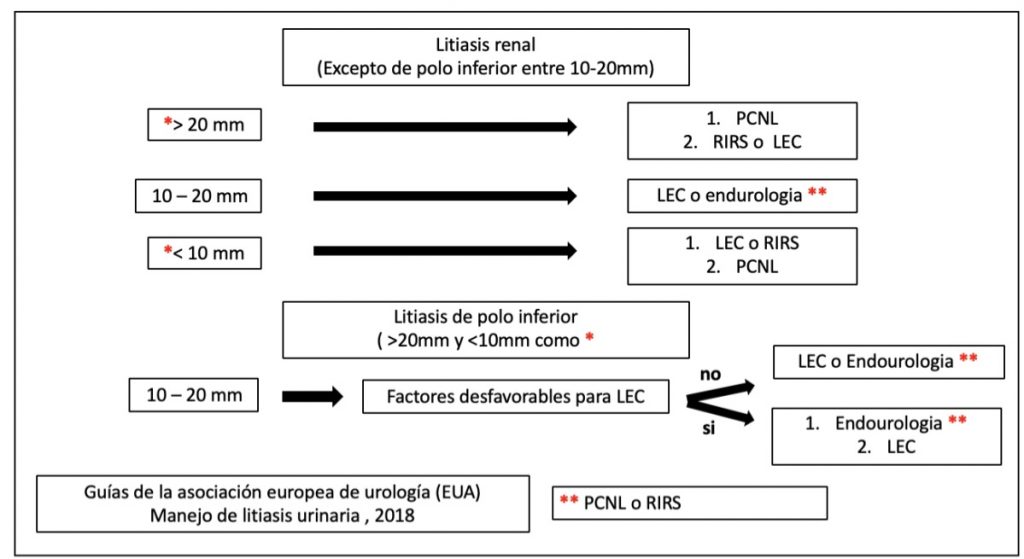
Dependiendo de la ubicación, densidad (UH) y tamaño de la litiasis, las asociaciones Americana (AUA) y Europea (EAU) sugieren cuál es la técnica más adecuada para el tratamiento de las litiasis renales. Ambas coinciden en que el tratamiento de elección en una litiasis mayor a 2 cms sigue siendo la cirugía percutánea (PCNL)(206), pero obviamente en caso de que no existan las condiciones adecuadas, se puede recurrir a la ureteroscopía flexible (fURS) e incluso a la LEC. Existen evidencias que si bien una PCNL tendrá más complicaciones que una RIRS(207) estas son Clavien G1 con solo un 7% de tasa de transfusión. Las litiasis > 20 mm que no puedan ser tratadas con PCNL, pueden ser tratadas con fURS, pero existe mayor riesgo de necesitar más de una cirugía y es necesario utilizar catéter doble J postoperatorio. En litiasis renales sintomáticas menores de 20 mm, la indicación actual es la LEC o RIRS, a diferencia de guías previas que ponían a la RIRS como segunda opción. Esto se debe a los buenos resultados y seguridad que ha demostrado la RIRS(208).
Obviamente que la PCNL, especialmente con la existencia de técnicas menos invasivas (mini perc), es una segunda opción cuando no existen las condiciones necesarias para la RIRS.
En el caso de las litiasis de polo inferior, tanto la EAU como la AUA, hacen algunas diferencias con respecto al manejo debido a la dificultad técnica de acceso endoscópico como a la capacidad de eliminación de fragmentos posterior al tratamiento. Las litiasis menores de 10 mm y las mayores de 20 mm tienen las mismas indicaciones que en el resto del riñón. Sin embargo, en las litiasis de polo inferior entre 10 y 20 mm, la EUA hace una distinción dependiendo si existen o no condiciones anatómicas favorables o desfavorables. Estas últimas son la presencia de una litiasis de oxalato de calcio monohidrato, brushita o cistina, ángulo agudo infundíbulo pélvico o un infundíbulo largo (>10 mm) y estrecho (<5 mm). En estos casos sugiere realizar una técnica endourológica ya sea RIRS o PCNL. En caso de haber condiciones favorables, tanto la LEC como la endourología (RIRS o PCNL) son opciones aceptables. Sin embargo, si bien la LEC tiene buenas tasas libre de litiasis en cálculos < 20mm en pelvis y cálices medios y superiores, tiene peores resultados en litiasis de polo inferior(209-211).
En cuanto a la decisión de cual técnica ocupar, es importante considerar que existen otros factores que no aparecen en estas tablas. Una distancia piel/litiasis mayor de 10 cms, un coeficiente de atenuación mayor a 900-1000 UH, presencia de alteraciones de la coagulación o que requiera tratamiento anticoagulante continuo, hacen menos efectiva la opción de una LEC incluso en litiasis < 10 mm. La RIRS debiera ser la técnica de primera línea en pacientes con alteraciones de coagulación sin tratamiento o que requieran tratamiento anticoagulante o antiplaquetario continuo.
Tal como se mencionó, se debe considerar la opinión del paciente y cuáles son sus expectativas. Creemos que el tratamiento realizado debe adaptarse a las condiciones de la patología litiásica que enfrentamos y no solo depender de la técnica o el instrumental que el cirujano domina. Para esto, es importante no dominar solo una técnica y contar con equipamiento que se adapte a las necesidades intraoperatorias. Por ejemplo, es posible que una cirugía planificada como RIRS no logre obtener una tasa libre de litiasis aceptable debido al volumen litiásico a no ser de que se prolongue excesivamente la cirugía. Para evitar lo anterior, podemos agregar un acceso percutáneo y transformar esa cirugía en una cirugía combinada (ECIRS). El paciente debe saber que existe esta opción que, si bien pudiera significar complicaciones, lograría mejores resultados en un solo acto quirúrgico(212).
Con respecto a las contraindicaciones de la fURS, no existen causas formales para realizar este procedimiento excepto consideraciones generales como las anestésicas o la presencia de una infección urinaria no tratada.
Técnica quirúrgica
En esta sección abordaremos la técnica completa de la RIRS con especial foco en trucos y recomendaciones prácticas ya que muchos de los aspectos generales ya fueron tratados previamente.
Comenzamos la cirugía con el mismo instrumental que la URS (Figura 21) y vamos agregando insumos a medida que avanzamos. Tal como mencionamos previamente, nuestro primer paso posterior a la instalación de una guía de seguridad es la ureteroscopía semirrígida para inspeccionar el uréter y realizar una dilatación ureteral pasiva. La hora del inicio de la endoscopía ureteral debe ser registrada para no excedernos en el tiempo operatorio y evitar exponer al paciente a las complicaciones inherentes a cirugías prolongada más allá de 2 hrs de duración. Tratamos de no prolongar la cirugía y preferimos realizar una ureterolitectomía en dos tiempos si es necesario.
La inspección nos permite poder elegir la vaina de acceso más adecuada para cada caso(213). Durante la ureteroscopía semirrígida podemos realizar una pielografía ascendente y evaluar el trayecto ureteral, presencia de acodaduras o áreas más estrechas del uréter (Figura 22). En caso de no realizar una ureteroscopía semirrígida previa, y hemos decidido utilizar una vaina de acceso, se instala una segunda guía de acceso 0,035 pulgadas para ascender la vaina. También existe la opción de utilizar una vaina que puede ser instalada con una guía de seguridad sin la necesidad de una segunda guía(214,215).


De ser necesaria la dilatación ureteral para ascender la vaina de acceso, se puede utilizar un catéter de doble lumen 10 fr. que dilatará el uréter y permitirá la instalación de la segunda guía y nos da la posibilidad de realizar una pielografía ascendente por el segundo canal (Figura 23). Otra forma de lograr una dilatación secuencia es utilizar el conductor de la vaina de acceso por sí solo a través de la guía y posteriormente intentar ascender la vaina completa.
Recomendamos contar con balones de dilatación ureteral en caso necesario, pero no los utilizamos en forma rutinaria. Creemos que si después de intentar dilatar suavemente de la forma antes descrita no logramos un ascenso suave y sin resistencia, preferimos instalar un doble J y diferir la nefrolitectomía endoscópica. En un 1-37% de las veces no es posible acceder al uréter proximal en una ureteroscopía sin dilatación previa(216,217).

Vaina de acceso ureteral
Si bien la RIRS puede realizarse sin el uso de una vaina de acceso, recomendamos utilizarla porque permite realizar múltiples pasadas para extracción de fragmentos, permite buen flujo de salida de la irrigación y de esta forma disminuye la presión intrarrenal durante el procedimiento(218-220).
La elección de la vaina de acceso dependerá de las características del uréter. Por ejemplo, si no ha sido intervenido previamente y se trata de un paciente joven, no será prudente utilizar una vaina 12 -14 fr o de diámetro mayor. En general las vainas que utilizamos son de 10,7 – 12,7 fr. Recomendamos utilizar la vaina más pequeña posible, pero que permita la extracción de fragmentos de buen tamaño y logre mantener la presión intra renal baja(221,222).
En el caso de pacientes masculinos utilizamos una vaina de acceso de 45 cms de largo y de 35 cms en mujeres. De esta forma podemos abarcar prácticamente todo el uréter y tener menos uréter expuesto al roce de los canastillos y fragmentos extraídos. Es recomendable instalar la vaina suavemente y asegurarse de que no existan litiasis o fragmentos ureterales que pudieran lesionar el uréter. La posición ideal de la vaina de acceso para iniciar la ureteroscopía flexible es que la punta quede en el uréter proximal, pero sin sobrepasar la unión pieloureteral, ya que este segmento del uréter es el más frágil y susceptible de sufrir una avulsión. Una vez que hemos instalado la vaina de acceso solicitamos el ureteroscopio flexible (Figura 24).

En la actualidad existen muchos modelos de ureteroscopios flexibles reutilizables, tanto análogos como digitales, que permiten realizar una RIRS en forma satisfactoria (Figura 25). Cuando elegimos un equipo debemos asegurarnos de que cuente con algunas características básicas, tanto para los equipos análogos como los digitales: deflexión en dos sentidos de 2700, un diámetro máximo de aproximadamente 8,5 fr., un canal de trabajo de 3,4 fr., amplitud de campo y fuente de luz que nos asegure buena visibilidad y nitidez de la imagen.
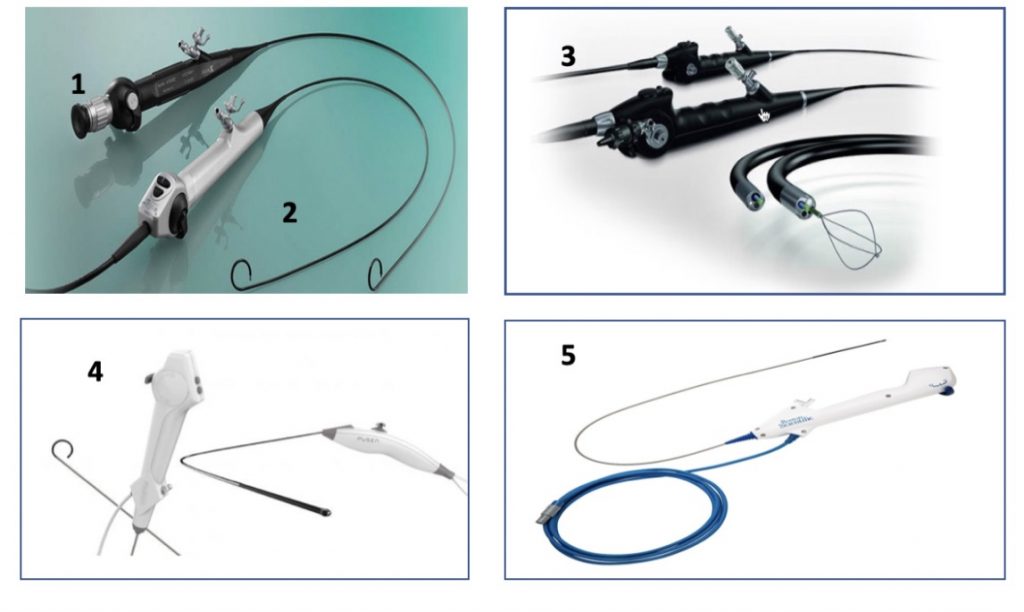
Los equipos análogos son en general de menor diámetro y logran una deflexión más completa en su punta, ya que no cuentan con un chip digital en su punta. Esto es una gran ventaja en relación a los ureteroscopios digitales, por lo que recomendamos contar siempre con un ureteroscopio análogo dentro del armamento. Es importante contar con más de un ureteroscopio disponible en caso de que el instrumento falle durante la cirugía y tener contabilizadas sus usos, ya que el promedio de vida útil de un ureteroscopio digital reutilizable, esterilizado en óxido de Etileno, es de aproximadamente unos 20 usos.
En los últimos años se ha desarrollado fuertemente el uso de ureteroscopios flexibles desechables con excelentes resultados, tanto en estudios in vitro como en estudios clínicos(223). Creemos que la opción de utilizar estos equipos desechables pueden no solo ser considerados como equipos de reserva a los reutilizables, sino que pueden llegar a ser una muy buena opción de primera línea en centros con menos experiencia y número de casos anuales, así como también en centros docentes.
Existen estudios que han evaluado el costo beneficio de la utilización de ureteroscopios flexibles desechables versus reutilizables y se ha observado que en aquellos centros que no realizan más de 90 casos al año, el costo beneficio es mayor al utilizar equipos desechables(224).
El aspecto más relevante en el cuidado de los equipos reutilizables es el cuidado intraoperatorio que considera un manejo adecuado por parte del cirujano. En la Figura 26 presentamos algunas recomendaciones intraoperatorias que ayudan a preservar el ureteroscopio en buenas condiciones. Otro aspecto importante en el cuidado de estos equipos es la capacitación permanente que deben recibir las personas que los manipulan, desde el lavado posterior a su uso, traslado, empaquetado, tipo de reservorio en que se esteriliza y el tipo de esterilización. El equipo médico y los representantes de la marca utilizada deben estar en permanente comunicación con el área de esterilización para capacitar constantemente a los encargados de su cuidado.
Al iniciar la ureteroscopía flexible debemos primero explorar las cavidades renales en forma exhaustiva para familiarizarnos con la anatomía y los espacios que existen. Lo anterior se debe a que una vez iniciada la litotripsia se puede perder visibilidad debido al sangrado y a la arenilla en suspensión. Al explorar el riñón derecho, los cálices se ven a la izquierda de la pantalla y la muñeca derecha que sujeta el ureteroscopio debe estar girada en supinación. Al explorar el riñón izquierdo, los cálices se ven a la derecha de la pantalla y la mano rotará en pronación (Figura 27).
Al encontrar la litiasis, decidiremos donde tratarla. Si la litiasis está ubicada en un cáliz inferior y se puede movilizar hacia un cáliz superior, debemos tratar de reubicarla usando un canastillo y realizar la litotripsia en el cáliz superior más adecuado (Figura 28). Ojalá no ubicarla en un sistema caliciliar muy amplio para que los fragmentos se mantengan juntos. La posición de Trendelemburg puede permitir que los fragmentos no migren hacia el polo inferior y lograr retirarlos en su totalidad, al mismo tiempo que los fragmentos remanentes pueden eliminarse con mayor facilidad.
La exploración debe ser realizada con el canal de trabajo vacío para optimizar la irrigación y aprovechar al máximo la deflexión del ureteroscopio. Si el sistema colector es muy complejo, o existen alteraciones anatómicas o cicatrices previas, es recomendable realizar la exploración identificando la posición del ureteroscopio con imágenes de rayos estáticas, sin medio de contraste.

La revisión exhaustiva del scanner preoperatorio, ya sea con o sin medio de contraste, es necesaria para tener una composición de lugar preestablecida. Si no podemos ubicar una litiasis que es radiopaca, puede tratarse de un cáliz con un infundíbulo largo y/o estrecho o podemos estar en presencia de un divertículo caliciliar o una calcificación parenquimatosa no diagnosticada. En ese caso podemos realizar una pielografía retrógrada con medio de contraste diluido para evitar la mala visibilidad que crea el medio de contraste y así poder guiarnos radioscópicamente hasta el cáliz adecuado (Figura 29).

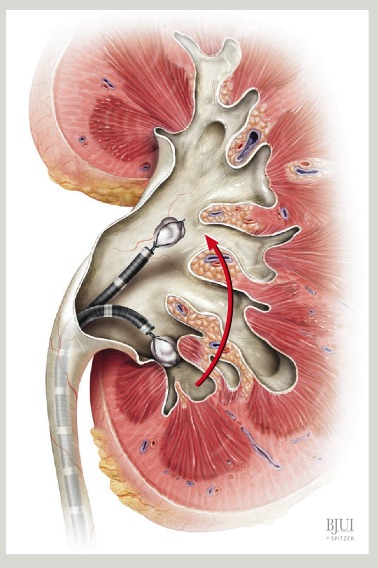

El láser Holmium se utiliza de la misma forma que en una URS, pero obviamente estaremos enfrentados a espacios más amplios y a litiasis de mayor volumen. Si se trata de una litiasis de alto volumen intentaremos reducirlo con parámetros de pulverización y así obtener arenilla y fragmentos menores de 2 mm que generalmente se eliminan espontáneamente. Para esto utilizamos la llamada técnica “pintando el cálculo”, moviendo la fibra por la superficie y evitando quedarse siempre sobre la misma zona, para así evitar fragmentarlo desde un principio y obtener demasiados fragmentos a extraer.
Si fragmentamos la litiasis debemos calcular el tamaño de los fragmentos en relación al instrumental (punta del láser) y calcular qué fragmentos de 3 mm pueden ser extraídos por una vaina de 10,7- 12,7 fr. Esto puede tardar muchísimo tiempo, por lo que la combinación de las dos técnicas hace más eficiente el procedimiento(225). Estas dos técnicas se pueden complementar con la técnica del “popcorn”, que es activar el láser en un espacio acotado (ej. en un cáliz) donde los fragmentos chocan repetidamente con la punta del láser y se va reduciendo el volumen(226). Para realizar «popcorn» se debe utilizar alta energía (1 joul), alta frecuencia (10-20 Hz) y pulso largo.
Durante una RIRS utilizamos fibras de 200 o 273 um, ya que nos permite una mejor deflexión y como analizamos previamente, la efectividad de la litotripsia es comparable con fibras de mayor diámetro. Además, el canal de trabajo queda con más espacio para la irrigación, lo que es vital para mantener una visión aceptable en las cavidades renales. Una vez terminada la pulverización y fragmentación, debemos revisar las cavidades en búsqueda de fragmentos mayores a 2 mm. Actualmente se considera a un paciente “libre de litiasis” cuando los fragmentos residuales son < 2 mm y no <4 mm como se consideraba hasta hace poco. Lo anterior ha cambiado la efectividad de la RIRS al plantearse un objetivo tan desafiante. Mas aún, existen reportes recientes que informan tasas libres de cálculos de no más de 70% en RIRS con técnica de “basketing” y retiro agresivo de fragmentos con hasta 30 maniobras de extracción de fragmentos con canastillos(227).
El retiro de fragmentos se realiza con canastillos de nitinol que deben ser escogidos según la necesidad. Es así como podemos utilizar canastillos de apertura frontal/lateral que nos permiten tomar, en general, fragmentos individuales y canastillos tipo “paracaídas”, que nos permiten tomar varios fragmentos más pequeños a la vez. Es importante calcular el diámetro del cálculo tomando como referencia el tamaño de la fibra del láser (1/3 de mm aprox) para determinar si el fragmento pasa por la vaina de acceso. En caso de no poder pasar y chocar contra la entrada a la vaina, podemos soltar un poco el canastillo sin botar el fragmento. Esta maniobra cambia la disposición espacial del fragmento en el canastillo y muchas veces nos permite pasar por la vaina. Si eso no da resultado, debemos repetir la litotripsia hasta obtener fragmentos de menor tamaño.
La extracción de los fragmentos debe ser una maniobra suave, sin fricción y siempre debe realizarse bajo visión directa para evitar daño ureteral(228). Al igual que en la URS, la irrigación debe ser a la menor presión posible por lo que hay que mantener el suero fisiológico a baja altura. La presión ejercida por el ayudante con bombas manuales debe ser usadas con mucha cautela. Con respecto a maniobras para mejorar la visión durante una RIRS, en general es suficiente mantener la irrigación y aplicar una leve presión en pulsos suaves, lo que mejorará la visión. No recomendamos realizar aspiraciones forzadas para intentar mejorar la visión ya que en general empeora la situación, debido al efecto de vacío que puede aumentar el sangrado.
Cálculos de polo inferior
Especial consideración debemos tener cuando debemos abordar un cálculo de polo inferior con un ureteroscopio flexible. En estos casos debemos considerar el uso de un ureteroscopio análogo, ya que se ha demostrado que pueden acceder más fácilmente a los cálices inferiores en ángulo agudo(229). Ya hemos mencionado que en lo posible debemos tratar de ubicar la litiasis en el polo superior para hacer más fácil y efectiva la litotripsia, la extracción con canastillo, proteger el instrumental y favorecer la eliminación de arenilla y fragmentos por tener un paso más directo al uréter(230). Si la litiasis es > a 10 mm puede no ser posible relocalizarlo antes de la litotripsia y tendremos que realizarla in situ, con posible daño del equipo y la fibra por una deflexión prolongada. En estos casos es muy importante evitar avanzar la fibra del láser con el ureteroscopio deflectado, ya que podemos dañar el equipo perforándolo en la curva distal(231).
Una vez avanzada la fibra hasta la punta, podemos deflectar e ir en búsqueda de la litiasis. Existen fibras diseñadas para crear menos fricción y avanzarlas con el ureteroscopio deflectado sin dañar el canal de trabajo. Se trata de fibras con la punta “ball -tip” o punta roma. Sin embargo, estas fibras pierden su conformación rápidamente luego de la activación(232,233). La técnica utilizada en nuestra práctica, de cortar la punta con tijeras de metal al ras de la cobertura. Se ha demostrado que de esta forma tampoco se dañan los ureteroscopios si se manipula en forma suave(234).
Otra precaución que hay que tomar es la energía que aplicamos con una fibra deflectada. Se ha comprobado que las fibras de 272 um se quiebran más fácilmente si se usan parámetros de alta energía (jouls) en vez de frecuencia elevada con baja energía (dusting). Por lo anterior, si la litiasis es muy grande para movilizarla desde el polo inferior al superior, se recomienda pulverizarla en el polo inferior hasta reducirla a un volumen que permita trasladarla al polo superior. En esa posición se eleva la energía en jouls para fragmentarla y retirar los fragmentos (235).
Cuando estamos tratando cálculos renales o de uréter proximal podemos tener inconvenientes para realizar la litotripsia con láser Holmium debido a la incursión respiratoria del riñón. Por esta razón podemos utilizar la apnea para abolir estos movimientos. Existen protocolos de anestesia que permiten hasta 5 min de apnea, por lo que es muy importante la coordinación con el anestesiólogo(236).
Litiasis en divertículo renal
Se inyecta medio de contraste en forma retrógrada por el ureteroscopio instalado en la pelvis renal para identificar el cuello del divertículo. En lo posible se instala la guía de seguridad dentro del divertículo y se hace una incisión del cuello diverticular para acceder y tratar la litiasis. En caso de no poder identificar el ostium, se mezcla medio de contraste e índigo carmín y se inyectan en la pelvis renal hasta que se opacifica el divertículo. Posteriormente, se lava la cavidad con abundante suero fisiológico. Una vez que se limpia la cavidad se observa la zona donde se identificó el divertículo para ver filtración de índigo carmín por el ostium para realizar la incisión y tratamiento de la litiasis(237).
Ureterolitectomía endoscópica en el embarazo
Si una paciente embarazada tiene un cólico renal y no responde al tratamiento del dolor, tiene hidronefrosis severa o síntomas de parto prematuro, debemos tener una conducta activa y descomprimir el sistema colector ya sea con una doble J o una nefrostomía(238,239). Lamentablemente, existe mayor tendencia a la incrustación de los catéteres durante el embarazo, por lo que se requiere su cambio más frecuente de lo habitual(240). Por lo anterior, la ureteroscopía es una buena opción ya que permite menor cantidad de cambios de catéteres y menos molestias urinarias, con muy buenos resultados(241).
Complicaciones
Si bien la ureteroscopía es una técnica mínimamente invasiva, no está exenta de complicaciones. Es considerada una técnica con bajas complicaciones, pero algunos casos pueden evolucionar con complicaciones graves.
En una reciente y extensa revisión de la literatura concerniente a complicaciones en ureteroscopía, De Coninck et al reportan las complicaciones más frecuentes del intra y postoperatorio(242). En esta extensa revisión, la complicación más frecuente es la molestia producida por el doble J postoperatorio (1,1 – 88%), lo que se puede prevenir al no instalar de rutina un catéter ureteral en casos de ureteroscopías no complicadas. Las lesiones ureterales tales como erosiones, falsas vías y perforaciones se reportan con una incidencia entre 0,13 y 62% y generalmente se resuelven con la instalación de un catéter ureteral al finalizar la cirugía. La migración de litiasis hacia proximal le sigue con una incidencia de 0,1 y hasta 59% de los casos, pero se puede prevenir con las maniobras mencionadas en este capítulo. Otra complicación intraoperatoria que se da con una incidencia de 1 a 37 % es la dificultad del acceso ureteral. El manejo de este tipo de complicación se resuelve simplemente instalando un catéter ureteral y volver una semana después para realizar la ureterolitectomía, con el uréter dilatado o realizando mínima dilatación. La migración del catéter ureteral a proximal puede suceder entre 0,1 y 19%; se previene utilizando catéteres de un largo adecuado al paciente y asegurándose de que quede en la pelvis renal, no en el polo superior y que quede suficiente cantidad de catéter en la vejiga. El reflujo vesicoureteral postoperatorio es infrecuente (0,07 -20%) y se previene evitando la dilatación de la unión vesicoureteral.
Algo bastante común y que observamos en el intraoperatorio es la hematuria (0,1 – 19,9%). Esta se evita usando baja presión de irrigación intraoperatoria y si persiste, y no se recupera la visión, se debe instalar un catéter ureteral y suspender la cirugía. Ya hemos mencionado la forma de prevenirlo usando ureteroscopios lo más pequeños posibles, mantener una presión intrarrenal baja, evitar aplicar energía en la mucosa, evitar aspiración en el sistema y en lo posible no operar con anticoagulantes/antiplaquetarios.
La fiebre y las infecciones (0,2 – 15%) se previene con profilaxis antibiótica, evitando urinomas, hematomas subcapsulares o perforaciones. Con respecto al dolor y el cólico renal postoperatorio, tiene una incidencia de 1,1 a 10,2 % y se evita con el uso de stent ureteral y no usando una vaina ureteral en todos los casos. En ureteroscopía en embarazadas, el parto prematuro es desencadenado con una incidencia de 4,3 a 8,7 %, por lo que se recomienda enfrentar estos casos en forma multidisciplinaria.
Afortunadamente las complicaciones más graves o con secuelas importantes son muy infrecuentes. La urosepsis se presenta con una incidencia de 0,12 a 4,3%. Es vital reconocerla precozmente, iniciar tratamiento inmediatamente, asegurarse de drenar en forma efectiva la vía urinaria y realizar tratamiento basado en cultivos de orina y hemocultivos. La estrechez ureteral post operatoria es infrecuente (0,1 a 3%) y se puede prevenir evitando traumatismos ureterales y perforaciones, lesiones térmicas, no dejando cuerpos extraños, evitando isquemia ureteral o infección. Con una incidencia de 0,3 a 2,5 % se producen obstrucciones ureterales o “Steinstrasse”, lo que podemos prevenir, evitando edema ureteral excesivo o dejando muchos coágulos ureterales. La temida avulsión ureteral es extremadamente infrecuente (0,04 – 0,9%) y podemos prevenirla extrayendo solo pequeños fragmentos, siempre bajo visión directa, conocer las maniobras cuando se atasca un canastillo y siempre saber la posición del endoscopio durante la endoscopía, no aplicar fuerza y adaptar el instrumental a la anatomía y no viceversa.
Otras raras complicaciones son los catéteres ureterales abandonados y se pueden evitar con un buen registro de los pacientes y buen seguimiento. Los casos de muerte en relación a la ureteroscopía suman 21 a la fecha y su prevención se basa en estar atento a posibles complicaciones graves para diagnosticarlas a tiempo.
Láser en litiasis
Dr. Christopher Valenzuela
Introducción
LASER es un acrónimo del inglés y sus letras significan Light Amplification by Stimulated Emission of Radiation (Amplificación de luz por emisión estimulada de radiación). Esto surge a partir de un dispositivo que es capaz de transformar distintos tipos de energía en radiación electromagnética con distintas longitudes de onda. La Real Academia de la Lengua Española lo define como “un dispositivo que, basado en la emisión inducida, amplifica de manera extraordinaria un haz de luz monocromático y coherente”(243).
En la primera mitad del siglo XIX, los avances teóricos y experimentales se limitaron a describir el comportamiento de la luz explicando sus características ondulatorias, pero no se había revelado su naturaleza, siendo incapaces de reconocer cuáles eran los mecanismos que la generaban. Esta situación cambia cuando entre 1860-1870 el físico escocés James Clerk Maxwell unifica los conceptos de electricidad, magnetismo y óptica. Describió la luz como una doble onda que se propaga mediante campos eléctricos y magnéticos acoplados, que se encuentran en fase y cuyos planos de propagación son paralelos, que viajan como ondas a una velocidad igual a velocidad conocida de la luz. De este modo la radiación electromagnética se propaga sin un soporte del medio material. Las radiaciones electromagnéticas constituyen un gran espectro que se clasifican de mayor a menor frecuencia en función de su longitud de onda (de menor a mayor).
La emisión estimulada es un concepto descrito por Albert Einstein(244) en su publicación “Sobre la teoría cuántica de la radiación”. Este considera estudios previos realizados por físico alemán Max Planck en 1900, quien explica e investiga la interacción entre la radiación y la materia, y los procesos de emisión espontánea e inducida de radiación por átomos y moléculas; esto produce un intercambio de energía a través de “pequeños paquetes» descritos como “cuanto de energía” que más tarde serán conocidas como “cuanto de luz” (en alemán: Lichtquant) o fotón (del griego phôs que significa “luz”) término acuñado más tarde por Gilbert N. Lewis; fisicoquímico estadounidense(245). Así Planck y Einstein permiten explicar la interacción de la radiación con la materia y definir al fotón como energía en forma de radiación electromagnética diminuto, discreto y cuantificado(246).
Albert Einstein es quien postula dos principios fundamentales de la Teoría de Emisión Espontánea:
- Primer principio emisión espontánea: Es un proceso aleatorio; un átomo en un estado excitado puede transitar a un estado de menor energía de forma aleatoria, liberando un fotón en cualquier dirección. Siendo un proceso incoherente entre átomos, esto es una radiación emitida con una dirección y fase aleatorias (Figura 30).
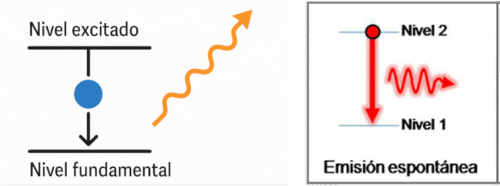
- Segundo principio de emisión estimulada: Es un proceso coherente e inducido por un fotón externo; un átomo en un estado excitado interactúa con un fotón de la misma frecuencia que el fotón que podría emitir de manera espontánea, pudiendo este ser inducido a emitir un segundo fotón, que será idéntico al incidente en términos de frecuencia, fase y dirección. Este proceso permite la amplificación de luz, como ocurre en un láser (Figura 31).
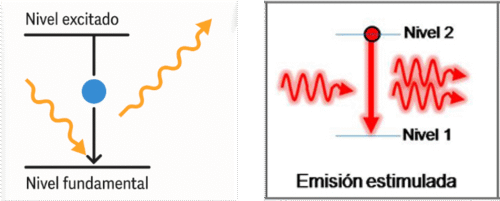
Con esto en 1960, tras 43 años desde la teoría de la emisión espontánea de Einstein, en manos del físico judío norteamericano Theodore Maiman, se desarrolló el primer láser en el mundo. Este, basado en los modelos teóricos de láser desarrollados por Townes y Shawlow en EE.UU.(247), y simultáneamente Basov y Projorov en la URSS; se realiza el primer láser de rubí para uso en medicina(248).
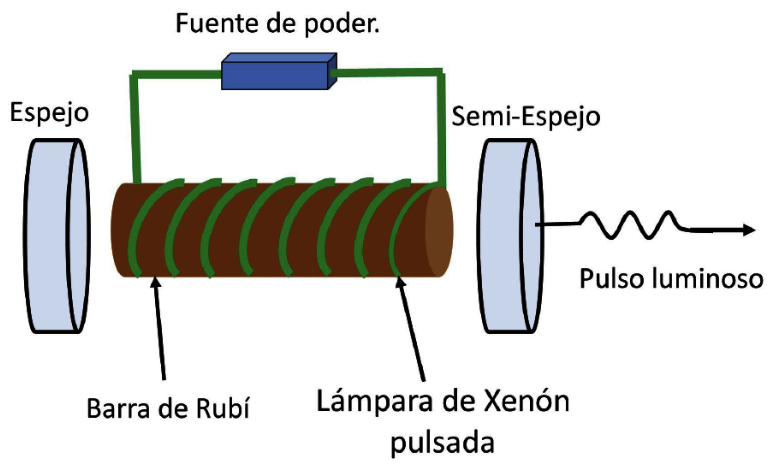
Posteriormente a la formación del primer láser se comenzó a desarrollar el uso de láseres con diferentes medios de amplificación y sistemas de bombeo. Es así como en 1961 se desarrolla el primer prototipo de láser; en manos del físico iraní Javan y cols, en donde el medio de amplificación utilizado fue un gas(249). Este fue el láser de Helio-Neón, operando en onda continua a 1153 nm. Esto generó un impulso para el desarrollo de nuevos avances y tecnologías. Fue así como L. Snitzer logró ejecutar un láser utilizando una varilla de vidrio dopada con Neomidio trivalente, consiguiendo además emisión de láser de onda continua(250). Este trabajo dio pie a la generación de láseres de fibra óptica dopadas con alguna “tierra rara” (Neodimio, Tulio, Erbio, Iterbio, entre otras) y bombeadas por un diodo.
Por otra parte, basándonos en física cuántica y el modelo atómico de Bohr de 1913, sabemos que a nivel atómico los electrones se encuentran “girando” alrededor de un núcleo que está compuesto por neutrones y protones, permaneciendo en ondas estacionarias sin capacidad de emitir radiaciones de manera continua. La energía cinética del electrón se equilibra con la atracción electroestática del núcleo (carga positiva) con el electrón (carga negativa). Los cambios o “saltos” de electrones a niveles de energía superiores o inferiores suponen absorción o liberación de energía electromagnética en forma de “cuantos” (fotones de luz).
Cuando aplicamos energía al medio, los átomos del medio se excitan y sus electrones suben a niveles de energía más altos. Cuando aplicamos luz por un medio excitado, los electrones se desexcitan y nos dan luz a cambio (fotón de luz). Este fenómeno ocurre en cadena producto de la inducción de un fotón liberado y la consecuente estimulación al resto. Estos fotones “extras” desexcitan más electrones y nos dan más fotones a cambio. Como la luz rebota en los espejos el proceso se repite hasta que tenemos una luz muy pura: Luz coherente (Figura 33).
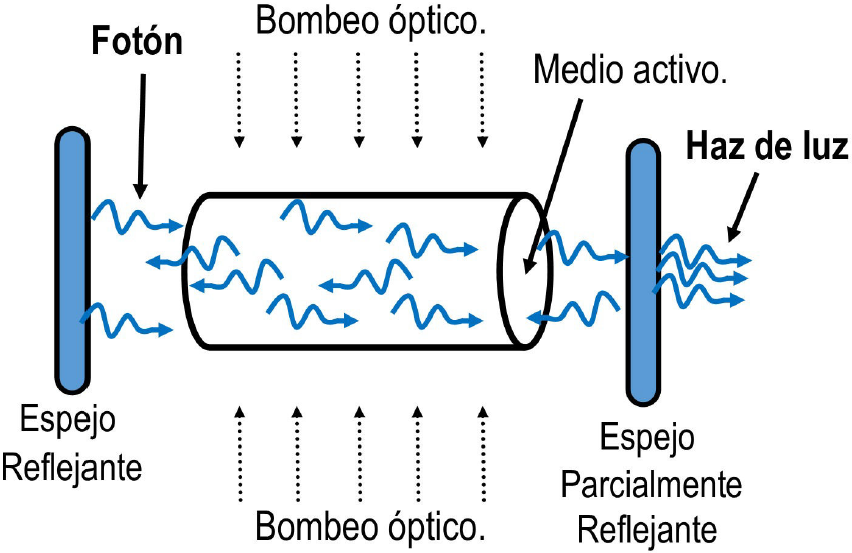
Los láseres están compuestos principalmente por tres elementos:
- Medio activo: Es el medio en el cual se produce la amplificación óptica o generación de radiación estimulada de la luz. Puede ser de material sólido (Cristal YAG, fibra dopada con tulio), liquido o gaseoso (ej., argón, CO₂).
- Sistema de bombeo: Es la fuente de energía que excita el medio para amplificar la radiación.
- Resonador óptico o cavidad resonante: Es aquella que amplifica la luz emitida por el medio. Está compuesto típicamente por dos espejos; estos cumplen la función de permitir que la luz se mantenga circulando a través del medio activo el mayor número de veces posible a distintas longitudes de onda de acuerdo a las características de los espejos (reflectividad, material o curvatura principalmente) Uno de los espejos es parcialmente transparente o semi-reflectante, por el cual parte de la luz amplificada sale del resonador en forma de luz laser.
Es importante saber que el láser, al igual que la luz, se refleja, se refracta y viaja a 3 x 10-8 m/s, pero a diferencia esta, presenta tres características que son propias de la luz láser:
- Coherencia: sus haces de luz son coherentes (todos los fotones emitidos están en la misma fase, lo que le confiere una gran potencia de acción)
- Unidireccionales o colimado: El haz no se dispersa a medida que se aleja de la fuente, como ocurre con el resto de haces luminosos.
- Monocromáticos: Si hacemos pasar el haz a través de un prisma, el haz entrante en él y el saliente serán idénticos (todos los fotones tienen la misma longitud de onda).
Con frecuencia ocurre que los láseres están compuesto de dos sustancias. Se entiende que si existen dos sustancias, entonces existirían dos tipos de fotones con longitudes de onda distintas. Lo que ocurre es que uno de los componentes se usa como fuente de fotones para estimular al otro componente (con longitudes de onda distintas), siendo este último quien producirá el haz del láser, por ende las propiedades que tendrá el láser van a depender de dicha longitud de onda.
Por otra parte, es relevante comprender como interactúa el láser en los tejidos en términos de profundidad de penetración, efectos térmicos y reflexión, y la relevancia clínica que esto tiene. De ese modo, se debe tener en cuenta que la absorción es la interacción más importante de la luz láser con los tejidos, la cual ocurre mediante cromófobos corporales, siendo estos el agua, la melatonina y la sangre. Es así que al ser absorbida se libera energía que genera calor, y dependiendo de la cantidad de calor emitida, se logrará coagulación o vaporización como efecto clínico. La profundidad de la absorción depende de la longitud de onda del láser(251). En la Figura 34 se muestra el espectro de absorción de la melanina, la hemoglobina y el agua para longitudes de onda específicas.
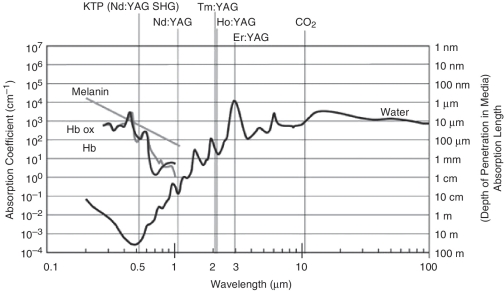
A la fecha se han explorado múltiples opciones y aplicaciones posibles de la energía láser en urología, logrando que esta tecnología evolucione obteniendo distintos grados de aplicabilidad segura y eficaz.
Tipos de láser:
Los láseres se pueden clasificar según el tipo de material (láseres de estado sólido, láseres de líquido, láseres de gas, láseres de semiconductores o diodo y láseres de electrones libres), según potencia (alta o baja potencia), según tipo o frecuencia de emisión del láser (pulsado o continuo).
A continuación vemos la clasificación según el tipo de material:
- Láseres de estado sólido: el medio utilizado en este tipo de láseres consiste en material láser distribuido en una matriz sólida, por ejemplo, los láseres de rubí o neodimio-YAG (granate de aluminio y itrio). Estos proporcionan las emisiones de mayor energía y habitualmente funcionan con pulsos(252).
- Láseres de gas: el medio de un láser de gas puede ser un gas puro, una mezcla de gases o incluso un vapor metálico, que suele estar contenido en un tubo cilíndrico de vidrio o cuarzo, con dos espejos situados en sus extremos. Los láseres de helio y helio-neón; He-Ne, son los láseres de gas más comunes. Se caracterizan por ser estables en frecuencia y con mínima dispersión. También existen el láser de Argón y CO2 que más comúnmente son utilizados en la industria. Este último es una luz invisible cercano al infrarrojo (versatilidad para grabar y cortar diversos materiales orgánicos y marcar otros materiales metálicos y minerales) con una longitud de onda de 10600 nm generando fotocoagulación y fotovaporización de los tejidos en un espesor de 0,5 a 1 mm de profundidad(253).
- Láseres de semiconductores: o láseres de diodo utilizan un material semiconductor como medio activo, conformado por varias capas de semiconductores con diferentes propiedades de conducción eléctrica, siendo el arseniuro de galio el más utilizado. Se utilizan principalmente en marcado láser, corte y soldadura, así como en sistemas de impresión y escaneo. El haz de luz que produce presenta una longitud de onda comprendida entre 805-1000 nm.
- Láseres líquidos: láseres en los cuales el medio más común son tintes inorgánicos cumarina o rodamina B, contenidos en recipientes de vidrio. Presentan longitud de onda variable dependiendo del agente ocupado; la cumarina verde produce una luz con una longitud de onda de 504 nm y es utilizado principalmente en ablación de lesiones vasculares y litotripsia extracorpórea teniendo como desventaja la necesidad de recambio de tinte producto del desgaste a diferencia de otros láseres sólidos(254).
- Láseres de electrones libres: son un tipo de láser en el cual el medio activo es un haz de electrones acelerados y su interacción con un campo magnético ondulante permite generar radiación coherente(255).
¿Cómo actúa un láser para el tratamiento de la litiasis urinaria?
La desintegración de los cálculos mediante litotripsia láser se produce a través de una combinación de dos efectos:
- Efecto fototérmico: Los fotones emitidos por el láser son absorbidos por la litiasis y por el agua que la rodea, y convertidos en calor. El agua atrapada en la piedra se vaporiza (descomposición química del cálculo y burbujas de vapor microscópicas), agrietándose y provocando microfisuras en la piedra, mientras que el agua adyacente a la piedra se vaporiza y provoca expansión de gas que fractura la piedra. Para que este efecto sea reproducido, se requiere contacto íntimo o muy cercano con la litiasis.
- Efecto fotomecánico: Se complementa a la acción fototérmica, donde los fotones absorbidos por el agua crean una burbuja esférica microscópica que colapsa y genera fuerzas de cavitación y ondas de choque, creando un efecto termomecánico que fractura el cálculo, generando fragmentos más pequeños. No requiere, necesariamente, mantener contacto con la litiasis.
De este modo se entiende que la interacción entre ambos efectos es un proceso sinérgico, el cual depende en gran medida de la longitud de onda del láser y la potencia máxima configurada, pero por sobre todo, del coeficiente de absorción de la energía en el agua, siendo esta el cromóforo principal debido a su alta concentración, tanto en los cálculos como en los tejidos circundantes.
Mientras mejor es la absorción de la energía en agua, mayor es la conversión a vapor y por ende la expansión de gas, lo que conlleva a mayor microfracturas del cálculo (mejora la ablación de la piedra).
La absorción de la energía del láser de TFL es 4,5 veces mayor en el agua que el láser Ho: YAG (Figura 35). Esto nos permitiría inferir las propiedades que podría presentar el TFL comparativamente con otras opciones de láser, pero es importante distinguir que la versatilidad de los láser en la urología nos da la opción de elegir aquel que se pueda adecuar a la mejor opción terapéutica y clínica para el paciente. Es por ello que es relevante entender y conocer algunos términos teóricos importantes al momento de elegir una opción.
Terminología
Con la introducción del láser (y la ureteroscopía) para el tratamiento de la litiasis urinaria, ha habido cambios en los patrones terapéuticos, siendo una herramienta relevante (sobre todo en los últimos 35 años) que ha permitido ser de gran importancia en la industria médica. Es por ello que es fundamental y relevante conocer algunos conceptos básicos.
El primer concepto importante es saber que la emisión de energía de un láser puede ser continua o pulsada, siendo esta última la opción adecuada para el tratamiento de la litiasis, con ciertos matices(256). El láser pulsado produce pulsos de energía (o ráfagas de luz) en el tiempo sin producción de luz entre cada pulso(257).
Entendiendo el concepto de pulsos de energía, ahora debemos conocer los siguientes conceptos para configurar un láser para litotripsia láser endocorpórea que son relevantes:
- Frecuencia (Hz): Número de pulsos por segundo.
- Periodo: es el tiempo transcurrido entre el inicio de un pulso láser y el inicio del siguiente (Figura 37).
- Ancho de pulso (μs): Duración de cada pulso único. Es el tiempo efectivo medido a lo largo del pulso durante un período (Figura 38).
- Pulso largo: 50% menor retropulsión, 60% más efectivo en ablación de litiasis. Pulso largo > 800 μs.
- Pulso corto: 200-400 μs.
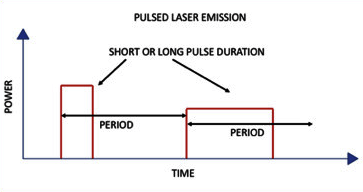
- Energía de pulso: emitida desde la punta del láser. Intensidad de un pulso láser durante un periodo. La cantidad de energía suministrada durante un periodo también suele representarse como el área bajo la curva (AUC). Se representa en Joules (J).
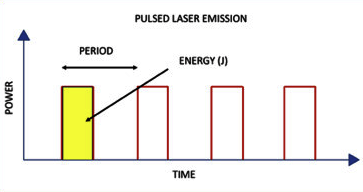
- Potencia: Es el producto de Energía (Joules) x Frecuencia (Hertz) y se representa en Watts de energía.
POTENCIA (W): ENERGIA (J) x FRECUENCIA (Hz)
Se puede subdividir en tres entidades distintas:
-
- Peak Power (PP): nivel máximo de potencia durante el pulso.
- Instantaneous Power: nivel de potencia en un instante dado del pulso
- Average power (AP): potencia normalmente anunciada por el generador láser.
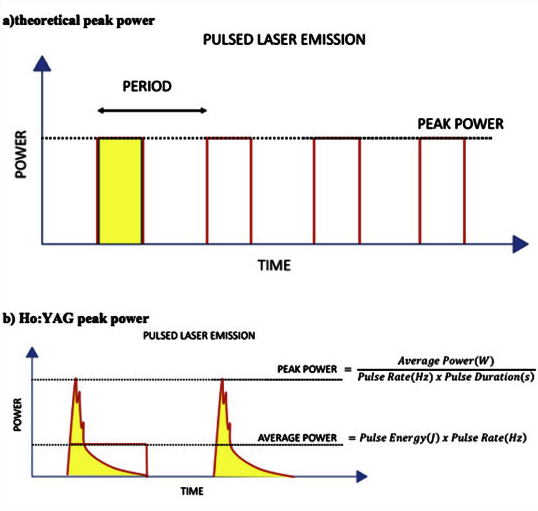
- Modulación de pulso: Afecta aspectos como la retropulsión y la capacidad de las piedras para fragmentarse. Se caracteriza por presentar pulsos de láser dobles (Figura 41).
A continuación se presenta un resumen de los principales parámetros del láser pulsado (258) (Figura 42).
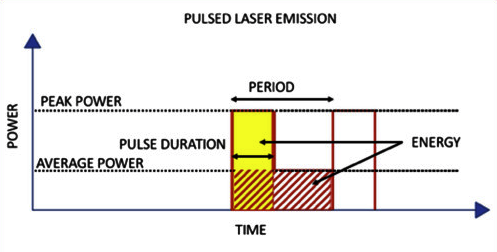
Generalidades
Tras considerar estos conceptos básicos se entiende que la interacción de un láser con el cálculo depende de múltiples factores que son críticos para asegurar el éxito quirúrgico; siendo estos la potencia del láser (J), la frecuencia (Hz), ancho de pulso (corto o largo) y la densidad de la potencia (Watts/cm2. Este concepto es relevante al momento de elegir una fibra de láser, ya que el diámetro de la fibra determina la directamente la densidad de energía entregada; esto es, la energía suministrada por pulso por mm2 de superficie de fibra. Por ello es que, a menor diámetro de fibra, con misma energía la densidad será mayor debido a su superficie más pequeña (Figura 43).
A) Usando un solo pulso 1J, se obtienen diferentes densidades de energía de acuerdo con la densidad de la fibra. Una fibra láser de 273 micrones (área de la sección 0,058 mm2) tendrá una densidad de 1J/0,058 mm2 = 17 J/mm, mientras que una más pequeña (fibra de 150 micrones) tendrá una densidad de energía de 3,3x (56 J/mm2).
B) Se requieren niveles de energía más bajos para alcanzar el mismo nivel de densidad de energía cuando se usan fibras más pequeñas(258).
También sabemos que el éxito de la cirugía de litiasis endocorpórea depende del cromóforo en el que estemos trabajando (como describimos más arriba) y en los últimos años el concepto de modulación de pulso ha permitido considerar nuevas herramientas a la hora de ajustar los parámetros críticos del láser para tratar una piedra. Esto subraya que el láser ideal para la litotripsia es aquel que coincide con precisión con las propiedades físicas del cromóforo objetivo para lograr el máximo efecto con un impacto mínimo fuera del objetivo. De este modo, una longitud de onda que se acerque al peak de absorción del agua para el láser a considerar (ya sea TFL ℷ = 1940 nm, Tm:YAG ℷ = 2013 nm o Ho:YAG ℷ = 2100 nm) es un determinante directo de la eficiencia y la seguridad de la cirugía. Su alta absorción por el agua significa que la energía láser se convierte rápida y eficientemente en calor dentro de la matriz acuosa del cálculo y su entorno fluido inmediato.
Esta transferencia de energía localizada conduce a una rápida vaporización y fragmentación (efecto fototérmico), pero, de manera crucial, la poca profundidad de penetración asociada con la alta absorción de agua significa que la energía se limita en gran medida al objetivo, minimizando la propagación térmica y el daño colateral al urotelio circundante(251).
Láser Holmium (Ho:YAG)
El Holmio u Holmium, derivado del latín Holmia, que significa Estocolmo (lugar donde fue descubierto), pertenece a la familia de los lantánidos y corresponde al elemento químico N.º 67 con un peso atómico de 164,93 Dalton. Se describe como suave, maleable y de color plateado metalizado brillante, siendo altamente magnético.
El láser Ho:YAG (Holmio: Itrio-Aluminio-Granada) es un láser pulsado de estado sólido con una longitud de onda de 2100 a 2120 nm dentro del espectro infrarrojo, que consiste en un cristal de itrio, aluminio y granate (YAG : Yttrium Aluminum Garnet) dopado con iones de holmio(259, 260). Este presenta una absorción elevada en agua, lo que se traduce en que el principal mecanismo a través del cual se produce la desintegración de los cálculos sea producto del efecto fototérmico principalmente (261,262), además tiene una baja profundidad de penetración en los tejidos(263) menor a 0.5mm, lo que lo hace particularmente efectivo para procedimientos endourológicos sin provocar daño significativo cuando la punta de la fibra láser contacta tejido urotelial. Presenta un rango de energía de pulso de 0.2 – 6.0 J, rango de duración de pulso 0.05–1 ms y duración máxima de pulso 120 Hz.
Este láser es bombeado por una lámpara de destello. Esta fuente de luz excita iones de Holmio dentro del cristal YAG liberando fotones con una longitud de onda de 2120nm. Esta luz emitida se refleja en el espejo e presenta interacción con iones de holmio presentes en el cristal YAG. Esta acción de reflexión repetitiva se conoce como fenómeno de «amplificación de la luz por emisión estimulada de radiación (LASER)». Una apertura transitoria de la cavidad libera la radiación en forma de un rayo láser pulsado (Figura 44).
Fig. 44. Representación esquemática laser Ho:YAG
Existen láseres de baja potencia (LP-Ho:YAG) y de alta potencia (HP- Ho:YAG), siendo los de baja potencia los primeros que se comercializaron en mercado con potencia de 15-20 Watts. La estructura interna del láser se organiza en cavidades. La potencia máxima por cavidad es de 30 watts, teniendo los LP-Ho:YAG 1 cavidad mientras que los HP-Ho:YAG 4 cavidades idénticas apiladas.
Fig. 45. Representación esquemática de los generadores láser de Holmio:YAG (264)
La cantidad de energía emitida de estos láseres y en consecuencia el calor generado, evidencia uno de sus principales problemas, el cual requiere un sistema de refrigeración por compresión de vapor para mantener una temperatura aceptable. Es por ello que los láseres HP- Ho:YAG son más grandes y ruidosos en comparación con LP-Ho:YAG (237).
Algunos de los laser de Ho:YAG disponibles del mercado:
| Laser | Características |
 |
Litho EVO (Quanta System) MasterPULSE: Modulación de pulso permite reducir retropulsión y modular el efecto de incisión en tejido (mejoraría hemostasia) Vapor Tunnel: Modulación del pulso genera burbujas más largas capaces de extenderse más lejos creando un canal de conexión con la piedra objetivo, garantizando un suministro de energía mejorado y, por lo tanto, una emisión efectiva y rápida de la misma. |
 |
Laser Clast 35 (EMS): Hasta 5 J para fragmentar incluso los cálculos más duros. Hasta 30 Hz para acelerar el tratamiento. Pulso corto y largo para permitir el mejor modo de litotricia posible. |
 |
Lumenis Pulse 30H (Boston Scientific): Potencia media: 30 W – Fuente de láser: Holmio:YAG – Longitud de onda: 2,1 µm – Energía de pulso: 0,2-5 J – Tasa de repetición: 3-25 Hz. |
 |
Lumenis Pulse 50H (Boston Scientific): Potencia media: 50 W – Fuente de láser: Holmio:YAG – Longitud de onda: 2,1 µm – Energía de pulso: 0,2-3,5 J – Tasa de repetición: 5-25 Hz. |
 |
Lumenis Pulse 100H (Boston Scientific): Potencia media: 100 W – Fuente de láser: Holmio:YAG – Longitud de onda: 2,1 µm – Energía de pulso: 0,2-3,5 J – Tasa de repetición: 5-53 Hz. |
 |
Lumenis Pulse 120H con Tecnologia MOSES (Boston Scientific): Potencia media: 120 W – Fuente de láser: Holmio:YAG – Longitud de onda: 2,1 µm – Energía de pulso: 0,2-6,0 J – Tasa de repetición: 5-120 Hz. |
 |
CyberHo (QuantaSystem): Potencia 152 W- Frecuencia hasta 100Hz – Energía de Pulso 5 J |
 |
Cyber Ho con Quanta Magneto Technology: es el último avance en urología, que combina la potencia del Holmio con la gran capacidad de pulverización del TFL en un sistema láser “todo-en-uno”, ofreciendo una eficacia y flexibilidad mayor.
El primer láser de holmio capaz de domar el peak power del holmio, convirtiéndola en una duración de pulso mucho más larga que proporciona la pulverización superior del TFL. |
Con la aparición del láser Ho:YAG, después de otros láseres como Nd:YAG, el CO 2, el fosfato de titanilo y potasio, el triborato de litio y los láseres de diodo, éste se posicionó como un láser sólido más óptimo para el tratamiento de la litiasis urinaria. Además, por ser un láser pulsado, a diferencia de los láseres continuos iniciales, evitan que mediante la generación continua de energía se emita más calor y provoque daño urotelial (265). Pero para llegar a ser lo que hoy representa el Ho:YAG ha tenido que pasar por distintos procesos evolutivos. Inicialmente la posibilidad de ajuste de parámetros permitía manipular solo la energía (J) y la frecuencia de pulso (Hz) para calcular la potencia (W) (como lo describimos arriba). Hace más de 20 años (2012-2013) en manos de Rocamed y EMS incorporan una verdadera mejora tecnológica; concepto de pulso largo (266). La posibilidad de modificar la longitud de pulso trae consigo alternativas de tratamiento con distintos resultados. Los primeros láseres basalmente se limitaban a longitudes de pulso cortas, en donde la energía suministrada por un pulso de laser ocurre durante un periodo corto de tiempo (aprox 300 micras), mientras que con longitudes de pulso largas (más de 600 micras) se entrega la misma cantidad de energía, pero en un periodo de tiempo mayor. Distintos autores han realizado estudios comparativos explicando las características que tiene el ajuste a misma potencia del tipo de pulso. Se demostró que la longitud de pulso es inversamente proporcional al volumen de ablación de la piedra (267). Se confirmó una relación lineal negativa entre la duración del pulso y el volumen de ablación; es decir, a medida que aumenta la duración del pulso, disminuye el volumen de ablación (p < 0,00001). Con comparaciones de longitudes de pulso extremas (150 um vs 800 um) se obtuvo una diferencia media del 60,6 % mayor en el volumen de ablación, a favor del modo de pulso ultracorto (p < 0,00001). Mientras que por otra parte otros autores mediante investigaciones in vitro no mostraron diferencias significativas entre el modo de pulso corto y el modo de pulso largo, ni en las tasas de fragmentación ni en el número y tamaño de los fragmentos; constatando que a mayor duración de pulso existe menor retropulsión del cálculo (268) y una menor degradación de la punta de la fibra láser (269).
Con estos 3 parámetros ajustables, el endourólogo tiene la posibilidad de generar múltiples opciones de configuración para el láser Ho:YAG, con lo cual surgen diferentes técnicas de fragmentación:
- Polvoreado (Dusting): Consiste en la elaboración mediante la litotricia con láser de polvo fino que pueda ser eliminado espontáneamente sin la necesidad del uso de cesta. Se describe la técnica como movimiento continuo de la punta de la fibra del láser sobre la superficie de la piedra sin contactarla; como estar pintándola (painting) (270). Algunos autores in vitro han descrito criterios para definir “dust”. Así describen que deben cumplir 3 criterios:
- 1. Flotación espontánea bajo irrigación a través de un ureteroscopio flexible (presión de irrigación de 40 cmH₂O);
- 2. Tiempo medio de sedimentación >2 segundos a través de 10 cm de solución salina;
- 3. Capacidad de aspiración completa a través del canal de trabajo de un ureteroscopio flexible de 3,6 french. (271)
Un diámetro de cálculo de 250 μm se considera el tamaño a partir del cual flotan los fragmentos para todos los tipos de cálculos estudiados excepto los cálculos infectados (estruvita, 125 μm) (30). La configuración consiste en usar baja energía (~ 5Hz), frecuencia alta (15-20Hz) y pulso largo (800 microsegundos) con una potencia total de 7,5 – 10 W (272)
- Fragmentación (Fragmenting): Esta modalidad de tratamiento consiste en generar fragmentos más grandes. La configuración que se describe es energía alta (1.5 -2Hz), con baja frecuencia (5Hz) y pulso corto (200 microsegundos). Estos fragmentos residuales pueden ser retirados con algún tipo de cesta.
- Efecto Popcorn: o efecto palomitas de maíz, podría considerarse una mezcla entre las anteriormente descritas (Figura 17). La configuración del láser es alta energía (1-1,5 J), alta frecuencia (15-20 Hz) y pulso largo (600 microsegundos). Posteriormente algunos autores describen el efecto Pop-dusting con mejor capacidad de producir polvo (273,274)
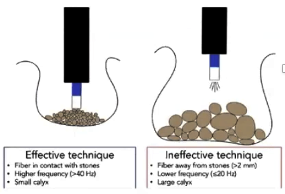 |
Técnica Efectiva:
|
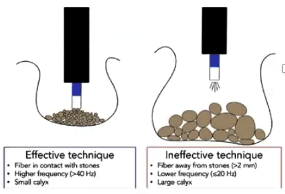 |
Técnica Inefectiva:
|
Fig. 46. Factores a considerar para realizar técnica de Popcorn (275)
Lo concreto es que no existen parámetros estandarizados para el tratamiento de la litiasis endocorpórea. Existen muchos factores que van a determinar el éxito quirúrgico como lo son la experiencia del operador, la elección del equipo, las condiciones intraoperatorias (reconocimiento del cálculo y su anatomía intrarrrenal/ureteral, la visualización, el aumento progresivo de la energía, etc)
Modulación de pulso
Con el avenimiento de la tecnología de laser de alta potencia el 2017 surge en manos de Boston Scientific el láser Lumenis Ho:YAG 120W con Tecnología Moses. Este efecto surge como nuevo parámetro al momento de configurar el láser donde incorpora el concepto de modulación de pulso.
El parámetro cambia la configuración de la burbuja, buscando una orientación energética más eficiente:
- Transmisión de energía optimizada, con mejor ablación de la piedra.
- Menos migración de la piedra
- Menos retropulsión y más control; y en consecuencia menor tiempo operatorio.
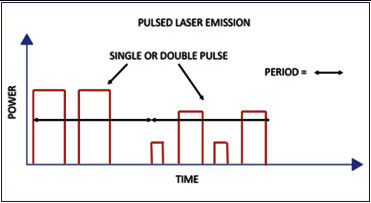
Fig. 47. Esquema modulación pulsos
En la Figura 47 se grafica la modulación de pulso con Tecnología Moses en el cual existe 1 pulso modulado en 2 subpulsos con diferente peak power (257).
- Un pulso “corto”; pulso de iniciación de baja energía (aproximadamente 20% de la energía total) que debe generar la burbuja de agua.
- Un pulso largo; pulso con toda su fuerza y más energía después de la expansión completa de la burbuja de vapor.
Esto explica con la tecnología Moses modifica la forma en la que se administra la energía al cálculo mediante la modulación de los 2 pulsos descritos de diferente intensidad. Un primer pulso de menor energía seguido de un segundo pulso que alcanza el objetivo con una atenuación y disipación de calor menor al agua circundante. Este fenómeno de «separación de las aguas» para una transmisión de energía más eficiente es lo que se conoce como «Efecto Moses».
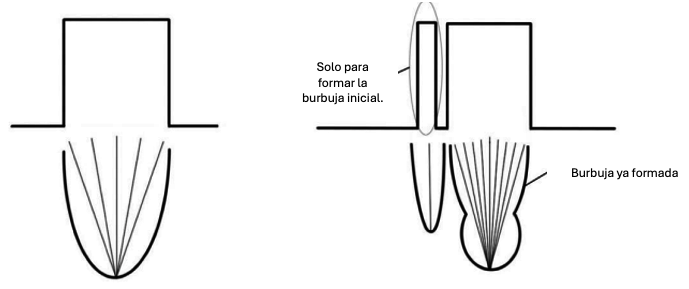
Efecto Moses Tecnología Moses
Fig. 48. Efecto Moses: Toda la energía se entrega en una sola explosión. La mayor parte de la energía se desperdicia en la formación de la burbuja y es absorbida por el agua. Tecnología Moses: La energía se libera en dos ráfagas. La primera, para formar la burbuja. La segunda, para atravesarla.
Lumenis ofrece en su laser Moses primera generación dos modos: Moses Contact MC y el Moses Distance MD; el modo MC diseñado para cirugías a ≤1 mm de distancia, mientras que el modo MD para 2 mm de distancia. Posteriormente el año 2020 lanza la versión 2.0 que incluye el modo “Optimed Moses”, el cual predefine automáticamente la modalidad al usar litotripsia de alta frecuencia (mayor a 80Hz) en láseres de alta potencia (120W).
La tecnología MOSES demuestra una reducción de casi el 20% en el tiempo del procedimiento, una mejora del 33% en la eficiencia de fragmentación y una reducción del 50% en la retropulsión de cálculos en comparación con los láseres de holmio regulares (276). Aunque estudios in vitro y preclínicos han demostrado tasas de reducción de retropulsión y ablación más eficiente (277), las conclusiones sobre beneficios in vivo son variables sin diferencias estadísticamente significativas como el Stone free.
Otras modulaciones de pulso
- Virtual Basket ™ (Quanta System): La tecnología Virtual Basket permite una modulación de pulso similar a la Tecnología Moses. Esta está compuesto por una emisión de doble pulso, combina una baja retropulsión con un efecto de succión de fragmentos, en donde el primer pulso genera una burbuja de vapor, seguido de un segundo pulso que mueve a través de la burbuja para alcanzar el objetivo. Esta modalidad permite la entrega de energía más eficiente. Estudios comparativos con y sin Tecnología Virtual Basket se asocian a menos retropulsion, menos y tiempos de fragmentación y cirugía significativamente menores (278).
- Vapor Tunnel ™ (Quanta System): Un pulso largo y especifico de alta energía genera una burbuja de vapor que conecta la punta de la fibra con la superficie del cálculo (vaporización del agua en el medio). Se caracteriza por operar con un peak power mínimo lo que permite que el canal de vapor generado por la burbuja sea más prolongado. Una vez que la burbuja llega al cálculo, se produce la ablación mediante la transmisión directa de energía láser. Como la burbuja no colapsa mientras tanto, se evita la retropulsión. La formación de la burbuja prolongada favorece la ablación fina y minimiza la retropulsión, lo que trae consigo reducción del tiempo de tratamiento (279).
- Master Pulse ™ (Quanta System): Se trata de una función intuitiva que ayuda a modificar el corte de tejido o reducir la retropulsión de la piedra. En lugar de probar varias configuraciones, se comienza con la configuración deseada y luego proporciona 7 niveles de ancho de pulso para ajustar con precisión el efecto de la emisión láser en función de la retroalimentación visual.
- BubbleBlast (Quanta System): Tecnología que modifica la transmisión del pulso del láser Ho:YAG creando burbujas desde la punta de la fibra de laser, las cuales ejercen un efecto mecánico más fuerte contra el cálculo. Mientras que la tecnología Virtual Basket ™ y Vapor Tunnel ™ se enfocan en la formación de un canal de vapor para una entrega de energía más eficiente y una reducción de la retropulsión, la tecnología Bubbleblast parece centrarse en un componente mecánico más pronunciado en la interacción con el cálculo.
- Advanced Mode™ (Dornier): Tecnología patentada por Dornier con su laser Medilas® H Solvo® 35, que cuenta con 6 opciones de configuración que buscan proporcionar una variedad de opciones de tratamiento para cálculos o tejidos blandos. Dentro de estas opciones, Advanced Mode ™ crea un efecto de “vacío de agua” que canaliza la energía del láser directamente para la superficie de la piedra, reduce la expansión lateral de la burbuja de vapor, transfiriendo movimiento mínimo para la piedra cuando la burbuja de vapor entra en colapso.
- Stabilization Mode™ (Olympus): Tecnologia de Olympus con su laser EMPOWER H65/H100 que genera un efecto de “canal de vapor” que conceptualmente es similar a Tecnología MOSES (280)

Fig. 49. Evolución de Tecnología de Modulación de Pulso (281)
Laser Fibra de Tulio
El Tulio o Tulium, derivado de un nombre griego antiguo derivado de Escandinavia o Islandia, Thule. Pertenece a la familia de los lantánidos y corresponde al elemento químico N.º 69, con un peso atómico de 168.93 Dalton. Se describe como suave, maleable y de color gris-plateado
El láser de fibra de Tulio (TFL: Thulium Fiber Laser) es un láser que puede operar en modo continuo o modo pulsado, que opera con longitudes de onda entre 1908 y 1940 nm, cuya energía se genera a partir de una fibra de sílice dopada con iones de Tulio en lugar de un cristal YAG dopado con iones.
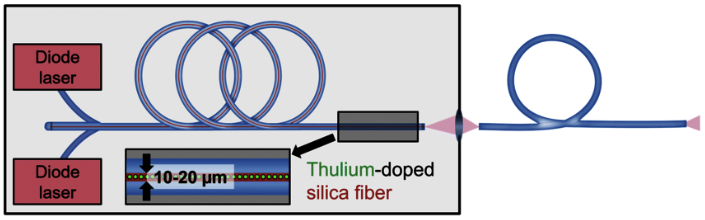
Fig. 50. Representación esquemática de un láser de fibra de tulio.
El bombeo láser se logra modulando electrónicamente láseres de diodo múltiples (recuadros rosas), el cual mediante el bombeo continuo alcanza una alta potencia (peak power hasta 500 W), a diferencia de las lámparas de flash o destello de los láseres Ho:YAG. Esto reduce el peak power (PP) pero permite un suministro de energía eficiente con mejor ablación y menor retropulsión de cálculos (282). Se utiliza una fibra de sílice enrollada de manera muy compacta dopada con tulio, de 10 a 20 µm de diámetro y 10 a 30 m de longitud como medio de ganancia para la generación de un haz láser. El haz láser uniforme en el conector de salida permite acoplarse directamente y entregarse a otra fibra láser, la cual puede tener diámetros de hasta 50 µm (azul) a diferencia de los 200 µm para Ho:YAG.
Dada que el TFL tiene una longitud de onda variable (entre 1908-1940nm), presenta una absorción de la energía en el agua de 4,5 veces mayor que el láser Ho:YAG (283), por ende, menor disipación de calor y en consecuencia un umbral de ablación teórico menor (284). Este coeficiente de absorción en el agua mayor, traduce que algunas implicaciones:
- Primero: TFL puede ablacionar un volumen de cálculo mucho mayor usando el mismo ajuste de parámetros que un láser Ho:YAG.
- Segundo: TFL puede lograr los mismos resultados de ablación de un calculo que un láser Ho:YAG usando ajustes de energía mucho más bajos (aproximadamente 4 veces menor)
- Tercero: Emana de lo anterior, dado su capacidad ablativa con igual tasa y menor energía, en que el TFL es menos propenso a la retropulsión (285).
Por otro lado el TFL ofrece una amplia gama de ajustes de energía (0.025–6.0 J), frecuencia o tasa de repetición por pulso (hasta 2200 Hz), duración de pulso cortas y largas (0.05–12 ms) y potencia media de 2 – 60w, además de fibras láser operativas más pequeñas (diámetro del núcleo de 50-150 µm) (Figura 51)
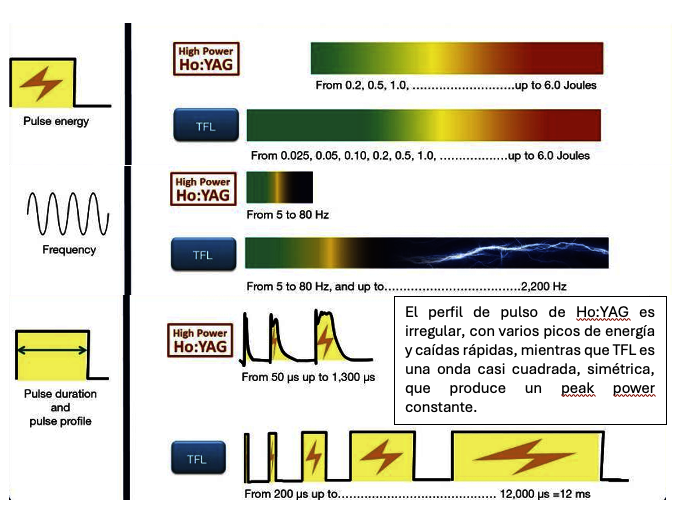
Fig. 51. Comparación de especificaciones de configuración del laser
Como sistema de refrigeración utiliza un simple ventilador (a diferencia de Ho:YAG que requiere un sistema por compresión de vapor) (286), similar a los que presenta los PC, siendo un generador mucho más silencioso, y esto determina que su arquitectura no se vea afectada por el aumento de temperatura. Los generadores de TFL son más pequeños, más resistentes a impactos externos y más ligeros, por lo tanto una consola más pequeña permite una maniobrabilidad más fácil en el quirófano, además de sumarse la particularidad de requerir toma de corriente estándar. El equipo TFL es siete veces más pequeño y ocho veces más ligero que un sistema láser Ho:YAG de alta potencia, y consume nueve veces menos energía. (Figura 52 y 53) Según revisión sistémica el TFL no es inferior a Ho:YAG (287).
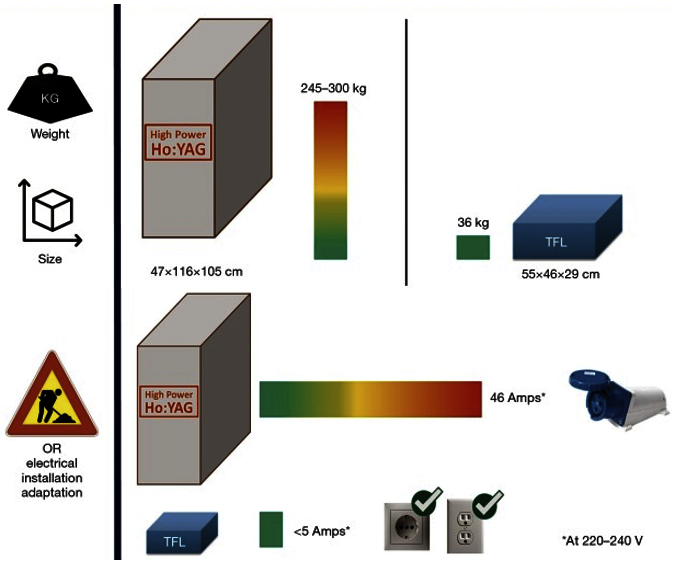
Fig. 52. Comparación en tamaño y toma de corriente
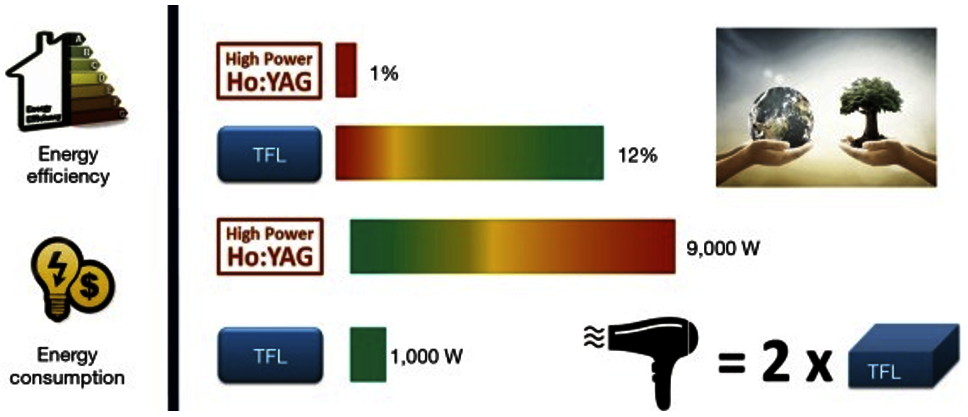
Fig. 53. Comparación en eficiencia energética y consumo de energía.
Algunos de los TFL disponibles del mercado:

Soltive Premium (Olympus) (60 W) |

Soltive Pro (Olympus) (35 W) |

Urolase SP (IPG Medical) (60 W) |

Laser Clast Thulium Power (EMS) (60 W) |

Sirius (Rocamed) (60 W) |

Fiber Dust® (QuantaSystem) (60 W) |

Fiber Dust PRO (QuantaSystem) (60 W) |

Pulvis (Wolf) (60 W) |

Drive (Coloplast) (60 W) |

MultiLASE (Storz) (60 W) |
Al comparar la tasa de stone free entre Ho:YAG y TFL, esta favorece a este último en cirugía intrarrenal retrograda renal con mejor tasa (OR 3.14, 95% CI: 1.69-5.68; p < 0.001), probablemente debido a la posibilidad de realizar mejor limpieza tras producir fragmentos más pequeños (micropolvo), sin encontrar diferencias significativas para litiasis ureterales ni para accesos anterógrados mediante cirugía renal percutánea. Además, no se encontró diferencia estadísticamente significativa con respecto a tiempo operatorio ni tiempo de uso de laser (288).
Si bien los láseres de fibra de tulio presentan múltiples cualidades que lo enmarcan como una opción superior a Ho:YAG, aun se necesitan más estudios para comprender mejor su uso en litotricia.
Laser Thulium:YAG pulsado (pTm:YAG)
Tm-YAG es un láser sólido pulsado que utiliza un cristal YAG dopado con tulio como medio activo estimulado con diodos, que emite una longitud de onda de 2013 nm en el espectro infrarrojo, peak power ajustable (≥ 1000 W) y un diámetro mínimo de fibra de 200 μm (similar a Ho:YAG, pero mayor que TFL: 150 μm). A pesar de que la longitud de onda está cerca de Ho-YAG, el pTm:YAG está mucho más cerca del peak de absorción de agua, con un coeficiente de absorción 2-3 veces mayor (288) (Figura 54)
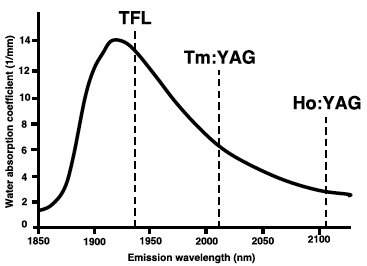
Fig. 54. Longitud de onda de emisión y coeficientes de absorción de agua de láseres de fibra de tulio, Ho:YAG y Tm:YAG.
Presenta 3 diferencias principales con el Ho:YAG (289):
- Primero: si bien ambos presentan cristal YAG, éste está dopado con diferentes elementos: Holmio vs Tulio.
- Segundo: El pTm:YAG es un láser bombeado por diodos a diferencia de Ho:YAG que es por lámpara.
- Tercero: El bombeo por diodos y dopaje por tulio otorga cierta estabilidad a los cristales previniendo el sobrecalentamiento, dado que el diodo pulsado mejora la eficiencia del haz láser al disminuir la cantidad de luz transformada en calor.
El sistema de refrigeración consiste en un sistema de refrigeración por agua con ventilador. Una cavidad puede generar una potencia total de 100W (a diferencia de Ho:YAG que genera 30W por cavidad), por ende se infiere que el ruido emitido es similar a laser Ho:YAG de baja potencia (30 W).
La tecnología láser de cristal YAG dopado con tulio en sus inicios se desarrolló con modo de acción continuo los cuales sustentaron su uso para el tratamiento de obstrucción del tracto urinario inferior y tumores vesicales. Actualmente existen en el mercado 2 láseres pTm:YAG; Dornier MedTech Laser 100W (Wessling, Alemania) y LISA laser RevoLixHTL (Alemania) (Figura 26). El láser p-Tm:YAG de Dornier ofrece 120W de potencia con frecuencias de 1 a 200 Hz y posibles energías de pulso desde 0,1 J hasta 3 J (290) provocando ablación mediante efecto fototérmico (al igual que Ho:YAG). Aunque parte del mecanismo de pulsación y principios técnicos son los que se disponen por la compañía, parece ser una alternativa interesante para el tratamiento de litiasis asi como tratamiento en tejidos. El peak power del pulso p-Tm:YAG (1300–3700 W) declarada por la compañía es sustancialmente menor que la del láser Ho:YAG (1800–14500 W), pero aún mayor que la del láser TFL (500 W) (291), lo que teoricamente podria traer consigo estudios clinicos que demuestren menor retropulsion que Ho:YAG.
| p-Tm:YAG laser | p-Tm:YAG laser |

Dornier-Thulio |
LISA laser RevoLixHTL |
Fig. 55. Opciones Thulium:YAG pulsado
Estudios in vitro han también comparado visualmente la burbuja del laser frente a Ho:YAG, evidenciando que su burbuja no es esférica, menos ancha y con la formacion final de un cono que se extiende desde la punta de la fibra laser hasta el otro extremo de la burbuja de gas siendo mas larga, lo que se explica debido a un largo de pulso mucho mayor: 100–4750 μs en p-Tm:YAG frente a 50–1000 μs en Ho:YAG (292) (Figura 56). Con respecto a la retropulsión otro estudio evidencia que presenta pulsos de menor energía con duraciones de pulso mas largas, lo que traduce menor retropulsion comparado con Ho:YAG (293).

Fig. 56. Caracterización de la burbuja
Otro estudio in vitro que busca caracterizar el pulso del láser (forma, duración y peak power) y riesgo de fractura de la fibra; concluyendo un perfil de pulso uniforme en todos los modos preestablecidos disponibles (“flex short pulse,” “flex long pulse,” “dusting,” “captive,” and “standard fragmenting”, excepto “Soft tissue” elegible para tejidos) y un peak power entre 564 a 2199 W, y no se produjo fractura de la fibra.
En la siguiente figura podemos ver los pre-ajustes que propone Dornier para cada una de las modalidades descritas (Figura 57).
| Modulación de pulso | Energia (J) | Frecuencia (Hz) |
| Dusting | 0.1 – 0.15 – 0.2 – 0.4 – 0.5 | 25 – 50 – 75 – 100 – 150 – 200 – 250 – 300 |
| Standard fragmenting | 0.6 – 0.8 – 1.0 – 1.2 – 1.5 – 2.0 | 5 – 10 – 15 – 20 |
| Captive | 0.6 – 0.8 – 1.0 – 1.2 – 1.5 – 2.0 – 2.5 | 5 – 10 – 15 – 20 |
| Soft tissue | 0.2 – 0.3 – 0.4 | 75 – 100 – 125 – 150 |
| Flex short pulse | 0.6 – 0.8 – 1.0 – 1.2 – 1.5 – 2.0 | 5 – 10 – 15 – 20 – 25 – 50 |
| Flex long pulse | 0.1 – 0.15 – 0.2 – 0.4 – 0.5 – 0.6 – 0.8 – 1.0 – 1.2 – 1.5 – 2.0 – 2.5 | 5 – 10 – 15 – 20 – 25 – 50 – 75 – 100 – 125 – 150 – 200 – 250 – 300 (por encima de 0.6J desde 25Hz) |
Fig. 57. Combinaciones disponibles según modulación de pulso en p-Tm:YAG
Otro autor compara volúmenes de ablación con Ho:YAG y TFL, evidenciando solo diferencias significativas a favor de TFL para litiasis duras (294). Por otra parte, se realizó análisis in vitro de la capacidad de generar polvo usando potencia total de 10W con configuración de laser a distintas energías y frecuencias (0,1J – 100Hz, 0,4J – 25Hz y 2,0J – 5Hz) para 7 tipos de cálculos de distinta composición; resultando en que el láser p-Tm:YAG es capaz de desempolvar las siete composiciones habituales de cálculos urinarios humanos, con una producción de partículas de polvo ≤ 250 µm (295).
Teóricamente su absorción en el agua (84 % mayor que Ho:YAG y 50 % menor que TFL) (Figura XXX) y su peak power se encuentra en un rango intermedio entre Ho:YAG y p-Tm:YAG, con un perfil uniforme y estable sin el sobreimpulso inicial que produce el Ho:YAG (296) (Figura 58), proponiendo múltiples modalidades de pulso con el fin de minimizar la retropulsión. Por otro lado in vitro se ha descrito que tiene mejor fragmentación que Ho:YAG y mejor polvoreado que TFL con menor retropulsión, convirtiéndolo teóricamente con un láser que parece seguro y eficaz en el tratamiento de la litiasis.
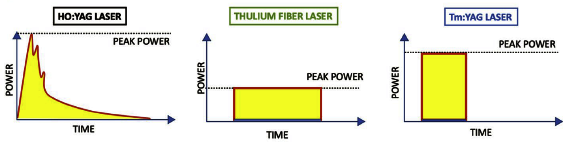
Fig. 58. Perfiles de pulso de laser Ho:YAG, Thulium Fiber Laser y Tm:YAG pulsado
A pesar de que se requieren más estudios clínicos y comparativos para definir el rol del láser p-Tm:YAG en el tratamiento de cálculos, así como la configuración óptima del láser, éste podría representar una opción intermedia buena entre las tecnologías Ho:YAG y TFL para el tratamiento de cálculos renales. Realizar una comparación con su mejor configuración ayudaría al cirujano a elegir la opción más adecuada de laser para el tratamiento de cálculos, tanto para procedimientos endoscópicos como percutáneos.
A continuación, presentamos una tabla con las especificaciones de la tecnología de los 3 láseres descritos en este capítulo:
| Holmium:YAG laser (Ho:YAG) | Thulium fiber laser (TFL) | Thulium:YAG laser (Tm:YAG) | |
| Longitud de onda (nm) | ℷ = 2120 nm | ℷ = 1940 nm | ℷ = 2013 nm |
| Modo de emisión | Pulsado | Pulsado o continuo | Pulsado |
| Medio de ganancia | Cristal solido (contiene iones de Holmio) | Fibra óptica de sílice dopada químicamente (grosor 10-20 μm) | Cristal solido (contiene iones de Tulio) |
| Generación de la radiación laser | Lampara de destello | Diodo laser electrónicamente controlado | Diodo altamente eficientes |
 |
 |
 |
|
| Coeficiente de absorción de agua | 26 cm-1 | 114 cm-1
∼ 4x vs Ho:YAG |
52 cm-1
∼ 2x vs. Ho:YAG |
| Profundidad de penetración en el
tejido (mm) |
∼ 0.4 | ∼ 0.1 | ∼ 0.2 |
| Rango energía de pulso (J) | 0.2 – 6.0 | 0.025 – 6.0 | 0.1 – 2.5 |
| Duración de pulso (µs) | 50 – 1000
(0.05 – 1.0 ms) |
50 – 12000
(0.05 – 12 ms) |
100 – 4750 (LISA)
150 – 1200 (Dornier) |
| Peak power máximo (W) | 1800 – 14500 | 500 | 1300 (LISA)
3700 (Dornier) |
| Perfil o forma de pulso | Irregular y puntiagudo | Ondas cuadradas simétricas y constantes | Regular y puntiagudo |
| Frecuencia de pulso máxima (Hz) | 120 | 2000 | 300 |
| Potencia máxima (W) | 20-150 | 60 | 150 (LISA)
100 (Dornier) |
| Diámetro de fibra laser más delgada | 200 µm | 150 µm | 200 µm |
| Sistema de enfriamiento | Baja potencia
Alta potencia
|
Ventilador | Sistema de refrigeración de agua autónomo con ventilador |
| Resistencia a choques externos | Baja | Alta | Baja |
| Peso (Kg) | 245 – 300 | 40 | 97 – 108 |
Fig. 59. Especificaciones Tecnología laser
Conclusión
El desarrollo de la tecnología láser desde sus inicios, y sobre todo durante los últimos años no ha pasado desapercibido para el desarrollo del área médica y particularmente para el tratamiento de la litiasis urinaria. Hoy es una herramienta necesaria con muchos sistemas de excelencia disponibles. Pese a esto sabemos que hoy el láser Ho:YAG el estándar de oro para el desarrollo de la litotricia endocorporea, sin embargo, dado la aparición y avances en el desarrollo de nuevas tecnologías con resultados prometedores, podríamos en el futuro próximo contar con un nuevo estándar de oro. A la hora de elegir un sistema de trabajo se hace relevante la importancia de entender las múltiples configuraciones que tenemos a disposición para tratar un paciente; concepto de potencia, frecuencia, energía y longitud de onda, así como también modulación de pulso, son herramientas que nos permiten configurar mejor las opciones para ofrecer un tratamiento ajustado a la necesidad del paciente. Lo más importante es comprender el funcionamiento para que esto nos permita guiar la elección del láser en base a nuestro objetivo. Como fin último ajustarlo a la búsqueda del láser ideal para litotricia; que sea eficaz, seguro, capaz de tratar cálculos de todos los tamaños y composiciones, rentable y que se integre perfectamente en el quirófano.
Miniaturización en Cirugía Percutánea
Dr. Juan Francisco de La Llera
Hospital San José
La cirugía renal percutánea es una alternativa de tratamiento quirúrgico para la litiasis renal. Cuando se revisa históricamente el número de procedimientos realizados, éste no ha variado significativamente en las últimas décadas. Distinto es el caso de la cirugía endoscópica retrograda, en la cual se ha visto un aumento de hasta el 250% de los casos (297). Es decir, la cirugía renal percutánea se ha establecido como una cirugía de nicho, para litiasis renales de cierto tamaño o no abordables adecuadamente en forma endoscópica o mediante litotricia extracorpórea. Respecto a la indicación quirúrgica, cabe destacar que el concepto de diámetro mayor de litiasis ha ido cambiando a uno de volumen total por ser una mejor representación de la carga litiásica de los pacientes.
Inicialmente descrita en 1976 por Fernstrom y Johansson (298), Alken en 1981, Segura en 1982 y Clayman en 1984 refinan y establecen la técnica quirúrgica definitiva de la cirugía renal percutánea. Al poco tiempo de su descripción, la técnica demostró tener menor morbilidad y estancia hospitalaria que la cirugía abierta. Con dicha técnica los tractos renales percutáneos se dilatan hasta 30 French. Esta dilatación permite la entrada y salida del instrumental junto con un flujo de irrigación de solución fisiológica que permite la visualización, fragmentación y extracción de la litiasis (Figura 60 y 61).

Fig. 60. Nefroscopio utilizado para cirugía renal percutánea

Fig. 61. Set de dilatadores percutáneos hasta 30 French
A pesar de ser una técnica mínimamente invasiva y con menos morbilidad que la cirugía abierta, la cirugía renal percutánea no está exenta de complicaciones (299). Diversos estudios buscaron establecer estos factores de riesgo de complicaciones y como se podría disminuir su incidencia. Una de estas complicaciones, que puede llegar a ser muy grave, es el sangrado que se produce por la punción y dilatación de los tractos. En 2004 se publica el primer estudio prospectivo que estableció que la disminución de los tamaños de los tractos renales percutáneos disminuye el sangrado perioperatorio (300). Este estudio de 236 pacientes sometidos a 301 NLPC estableció que a menor tamaño del tracto renal percutáneo menor era el sangrado intraoperatorio. Dado estos hallazgos, comienza un mayor desarrollo de la miniaturización de los tractos renales percutáneos.
Inicialmente descrita en 1998, la minipercutánea es una técnica quirúrgica que disminuye el tamaño del tracto en una cirugía renal percutánea. Su técnica estándar fue descrita en 2001 con un nefroscopio 12 French y una camisa de 15 French.
Tradicionalmente, se emplea este término en tractos de hasta 20 French. Cuando se comparan los resultadas con la técnica estándar, la cirugía minipercutánea demuestra resultados similares en tasa libre de cálculo en litiasis de hasta 2 cms con menos complicaciones asociadas (301). Además, la cirugía minipercutánea generalmente tiene menor estadía hospitalaria y permite una cirugía “tubeless”. Sin embargo, cabe destacar que, en litiasis mayores de 2 cm y mayormente sobre los 4 cms, la cirugía percutánea standard tiene una mayor tasa libre de cálculos (Figura 62).

Fig. 62. Equipo de cirugía renal minipercutanea desechable con set de dilatadores
Los avances tecnológicos permitieron ir reduciendo cada vez más los trayectos percutáneos y miniaturizando los equipos empleados en dicha cirugía. Es así como en 2011 se publica en Journal of Urology el primer reporte de nefrolitotomía percutánea de un solo paso. Esta técnica, denominada microperc, utilizó una aguja con una cámara de 4,85 French que permitía realizar el acceso percutáneo en un solo tiempo con un trayecto milimétrico (302). Este estudio consistió en un reporte prospectivo de 10 pacientes. A pesar de ser viable técnicamente, esta cirugía fue limitada a cálculos de pequeño volumen y en los cuales no se presentaba sangrado intraoperatorio. Dado que su indicación era solo para un subgrupo de pacientes con litiasis renal no se difundió ampliamente. Concomitantemente se desarrollaron los ureteroscopios y vainas flexibles los cuales permiten tratar litiasis de pequeño y mediano tamaño sin puncionar ni dilatar el riñón, con menor sangrado perioperatorio y menor estadía hospitalaria.
En 2013 se describe por primera vez la técnica ultra miniperc o superminiperc (303). Esta técnica consiste en la punción y dilatación de un tracto renal percutáneo hasta 14 French. En este estudio se operaron 36 pacientes con un nefroscopio 6 French en camisa 11-13 French utilizando para la pulverización y fragmentación un láser de Holmium. Este estudio objetivó una buena tasa libre de cálculos al mes postoperatorio (96%) con baja tasa de complicaciones (16,7%). Esta cirugía demostró ser mínimamente invasiva pero efectiva para el tratamiento de cálculos menores de 2 cm de diámetro. En ella se logran combinar los beneficios de una técnica mínimamente invasiva con los resultados de la cirugía minipercutánea, haciéndola atractiva como alternativa quirúrgica para litiasis renales de tamaño pequeño y mediano.
Respecto a cuál es el gold standard de tratamiento para la litiasis renal, esto va a depender del volumen de la litiasis y su ubicación. En cálculos mayores de 2 cms, y sobre todo mayores de 4 cms, la nefrolitotomía percutánea clásica aún tiene una mayor tasa libre de cálculos cuando se compara con la técnica minipercutánea o super minipercutánea. Bajo los 2 cms, las técnicas mínimamente invasivas como minipercutánea o super minipercutánea tiene tasas libres de cálculos similares, pero con menos morbilidad asociada. Existen estudios que demuestran que en litiasis menores a 4 centímetros tanto minipercutánea como super minipercutánea tienen tasas libres de litiasis comparables con menor estadía hospitalaria en esta última (304). Por lo tanto, la técnica final a utilizar debe ser individualizada para cada paciente tomando en consideración sus riesgos y beneficios.
Bibliografí
—
Bibliografía
-
- Lancina M.: Litiasis urinaria. Presente y futuro. Actas Urol Esp. 2005;29(4).339-344.
- Turk C., Knoll T., Petrik A., Sarica K., et al. Guía Clínica sobre la Urolitiasis. EUA 2010.
- Menon M., Parulkar B., Drach G. Urinary lithiasis: etiology, diagnosis and medical management. In: Campbell’s Urology, 8th ed. Edited by P. C. Walsh
- Menon M., Resnick M. Litiasis urinaria: etiología, diagnóstico y manejo médico. En:Walsh PC, Retik AB, Vaughan ED, Wein AJ, editors. Campbell: Urología. Buenos Aires: Médica Panamericana; 2004. pp. 3539- 3626.
- Shokeir A. Renal colic: new concepts related to pathophysiology, diagnosis and treatment. Curr Opin Urol. 2002;12(4):263-269.
- Shokeir A. Renal colic: pathophysiology, diagnosis and treatment. Eur Urol. 2001;39(3):241-249.
- Tiselius G., Ackermann D., Alken P., Back C., et al. Guidelines on urolithiasis. European Association of Urology (EAU), 2005.
- Travaglini F., Bartoletti R., Gacci M., Rizzo M. Pathophysilogy of reno-ureteral colic. Urol Int. 2004; 72 Suppl 1:20-3.
- Rieu P. Infective lithiasis. Ann Urol (Paris), 2005. 39(1): pp. 16-29.
- Servais A., Daudon M, Knebelman B. Drug induced renal calculi. Ann Urol (Paris), 2006. 40(2): pp. 57-68
- Tiselius H. Stone incidence and prevention. Braz J Urol. 2000; 26: 452-462.
- Lancina J., Rodríguez G., Novas S., Rodríguez I., et al. Factores de riesgo metabólico en urolitiasis cálcica según el sexo y edad de los pacientes. Actas Urol Esp. 2002; 26: 111-120
- Siener R., Schaden N., Nicolay C., von Unruh G., et al. The efficacy of dietary intervention on urinary risk factors for stone formation in recurrent calcium oxalate stone patients. J Urol. 2005 May; 173 (5): 1601-5.
- Millán F. Cólico renal: Revisión de la literatura y evidencia científica. Actas Urol. Esp 2006;30(3):268-280.
- Bove P, Kaplan D, Dalrymple N, Rosenfield A., et al. Reexamining the value of hematuria testing in patients with acute flank pain. J Urol. 1999 Sep; 162(3 Pt 1):685-7.
- Miller O., Rineer S., Reichard S., Buckley R., et al. Prospective comparison of unenhanced spiral computed tomography and intravenous urogram in the evaluation of acute flank pain. Urology. 1998 Dec; 52(6):982-7.
- Yilmaz S., Sindel T., Arslan G., Ozkaynak C., et al. Renal colic: comparison of spiral CT, US and IVU in the detection of uretheral calculi. Eur Radiol. 1998; 8(2):212-
- Tiselius H. Metabolic evaluation of patients with stone disease. Urol Int, 1997. 59(3): pp. 131-41.
- Davenport K, Timoney A., Keeley F. Conventional and alternative methods for providing analgesia in renal colic.BJU Int. 2005;95(3):297-300.
- Holdgate A., Pollock T. Systematic review of the relative efficacy of non-steroidal anti-inflammatory drugs and opioids in the treatment of acute renal colic. BMJ. 2004;12;328(7453):1401.
- Holdgate A., Pollock T. Nonsteroidal anti-inflammatory drugs (NSAIDs) versus opioids for acute renal colic. Cochrane Database Syst Rev. 2005; 18;(2):CD004137.
- Yilmaz E., Batislam E., Basar M., Tuglu D., et al. The comparison and efficacy of 3 different alpha1-adrenergic blockers for distal ureteral stones. J Urol. 2005 Jun;173(6):2010-2.
- Beach M., Mauro L. Pharmacologic expulsive treatment of ureteral calculi. Ann Pharmacother. 2006 Jul-Aug;40(7-8):1361-8. Epub 2006 Jul 18.
- Porpiglia F., Ghignone G., Fiori C., Fontana D., et al. Nifedipine versus tamsulosin for the manage- ment of lower ureteral stones. J Urol. 2004 Aug;172(2): 568-7.
- Aua guidelines, Surgical Management of Stones: AUA/Endourology Society Guideline (2016)
- Inci, K., et al. Prospective long-term followup of patients with asymptomatic lower pole caliceal stones. J Urol, 2007. 177: 2189.
- Burgher, A., et al. Progression of nephrolithiasis: long-term outcomes with observation of asymptomatic calculi. J Endourol, 2004. 18: 534.
- Raman JD et al. Natural history of residual fragments following percutaneous nephrostolithotomy. J Urol. 2009 Mar;181(3):1163-8. doi: 10.1016/j.juro.2008.10.162. Epub 2009 Jan 18.
- EAU Guidelines on Urolithiasis 2018
- Astroza et al, Early ureteroscopic treatment in patients with urosepsis associated with ureteral calculi is a safe approach. A pilot study, Cent European J Urol. 2019; 72(2): 163–168.Published online 2019 May 30. doi: 10.5173/ceju.2019.1890
- Rodríguez-Monsalve Herrero M1 et al, Retrograde intrarenal surgery: An expanding role in treatment of urolithiasis..Asian J Urol. 2018 Oct;5(4):264-273. doi: 10.1016/j.ajur.2018.06.005. Epub 2018 Jun 22.
- Drake T., Grivas N., Dabestani S., Knoll T., Lam T., Maclennan S. What are the benefits and harms of ureteroscopy compared with shock-wave lithotripsy in the treatment of upper ureteral stones? A systematic review. Eur Urol. 2017;72:772–786.
- Porpiglia F., Ghignone G., Fiori C., Fontana D., et al. Nifedipine versus tamsulosin for the management of lower ureteral stones. J Urol. 2004;172(2): 568-7.
- Epochs in Endourology. Extracorporeal shockwave lithotripsy (ESWL):a chronology. C.Chaussy,M.D., F.Eisenberger, M.D. y B. Porssmann, PhD. Journal of Endourology. Vol 21, number 11, November 2007 (1249-1253).
- Kidney damage in extracorporeal shock wave lithotripsy: a numerical approach for different shock profiles. Biomech Model Mechanobiol (2009) 8: 285-299.
- Begun F. Equipment for extracorporeal shock wave lithotripsy. In: Smith A.D.:Textbook of Endourology. Philadelphia:W.B. Saunders, 1997; 586- 599.
- Eisenberger F., Miller K., Rassweiler J. Stone Therapy in Urology. New York: Thieme Medical Publishers, 1991, 36-44.
- Chaussy C., Schmiedt E., Jochan D., Brudel W., et al. First clinical experience with extracorporeally induce destruction of kidney stones by shock waves. J. Urol. 1982; 127:417-20.
- Lingerman J., Newman D., Metz J., et al. Extracorporeal shock wave lithotripsy: the Methodist Hospital of Indiana experience. J. Urol. 1986; 135:1134-7.
- Tizelius H., Ackermann D., Alken P., Buck C., et al. Working Party on Lithiasis,European Association of Urology. Guidelines on urolithiasis. Eur Urol 2001; 40: 362-71.
- Turk C., Skolarikos A., Neisius A., Petrik A., Seitz C.C., Thomas K., et al. EAU Guidelines on Urolithiasis 2018; 27.
- Scales CD Jr., Lai JC., Dick AW., et al JAMA Surg 2014;149:648–53.
- Bultitude M., Smith D., Thomas K., Contemporary Management of Stone Disease: The New EAU Urolithiasis Guidelines for 2015. European Urology 2016; 69:483–484.
- Turk C., Skolarikos A., Neisius A., Petrik A., Seitz C.C., Thomas K., et al. EAU Guidelines on Urolithiasis 2018; 30.
- Donaldson J., Lardas M., Scrimgeour D., Stewart F., MacLennan S., et al. Systematic Review and Meta-analysis of the Clinical Effectiveness of Shock Wave Lithotripsy, Retrograde Intrarenal Surgery, and Percutaneous Nephrolithotomy for Lower-pole Renal Stones. European Urology 2015; 67:612–616.
- El.Assy A., Abou- El Ghar M., El Nahas A., et al. Multidetector computed tomography: role in determination of urinary stones composition and disintegration with extracorporeal shockwave lithotripsy an in vitro study. Urology 2011; 77 (2): 286 – 90.
- Ghoneim I., Ziada A., Elkatib S. Predictive
factor of lower calyceal stone clearance after extracorporeal shockwave lithotripsy (eswl): a focus on the infundibulopelvic anatomy. Eur Urol 2005; 48: 296-302. - Pareek G., Hedican S., Lee F., et al. Shockwave lithotripsy success determined by skin to stone distance on computed tomography. Urology 2005; 66(5): 941-4.
- Patel J., Kozakowski K., et al. Skin to stone distance is an independent predictor of stone free status following shockwave lithotripsy. J Endourol 2009; 23(9): 1383-5.
- Ossandon E., Recabal P., Acevedo C., Flores J., et al. The lithotripsy table height: a novel predictor of outcome in shockwave lithotripsy. Int Braz J Urol. 2011;37(3):355-61;discussion 361.
- Skuginna V., Nguyen D., Seiler R., Kiss B., Thalmann G. Beat Roth Does Stepwise Voltage Ramping Protect the Kidney from Injury During Extracorporeal Shockwave Lithotripsy? Results of a Prospective Randomized Trial. European Urology 2016; 69:267–273.
- Li, W.M., et al. Clinical predictors of stone fragmentation using slow-rate shock wave lithotripsy. Urol Int, 2007. 79: 124.
- Yilmaz, E., et al. Optimal frequency in extracorporeal shock wave lithotripsy: prospective randomized study. Urology, 2005. 66: 1160.
- Pishchalnikov Y., Vonderhaar R., Williams J., et al. The advantage of a broad focal zone in SWL: in vitro stone breakage comparing two electromagnetic lithotripters. J Urol 2008; 179: 464-5.
- Pishchalnikov Y., Neucks J., Vonderhaar R., et al. Air pockets trapped during routine coupling in dry head lithotripsy can significantly decrease delivery of shockwave energy. J Urol 2006;176(6 Pt 1): 2706-10.
- Logarakis, N.F., et al. Variation in clinical outcome following shock wave lithotripsy. J Urol 2000; 163: 721.
- Bonkat, G., et al., EAU Guidelines on Urological Infections, in EAU Guidelines, Edn. published as the 32nd EAU Annual Meeting, London, E.A.o.U.G. Office, Editor. 2017, European Association of Urology Guidelines Office: Arnhem, The Netherlands.
- Chian E., Hwee S., Kay Lu., Liang S., et al. Randomized controlled study of mechanical percussion, diuresis, and inversion therapy to assist passage of lower pole renal calculi after shockwave lithotripsy. Urology 2005; 65(6): 1070- 4.
- Turk C., Skolarikos A., Neisius A., Petrik A., Seitz C.C., Thomas K., et al. EAU Guidelines on Urolithiasis 2018; 25.
- Turk C., Skolarikos A., Neisius A., Petrik A., Seitz C.C., Thomas K., et al. EAU Guidelines on Urolithiasis 2018; 18.
- Chaussy E., Schuller J. Extracorporeal shockwave lithotripsy (eswl) for treatment of urolithiasis. Urology, 1984, vol 23, n°5, 59-66.
- Bierkens A., Hendrikx A., Lemmens W., and Debruyne F. Extracorporeal shockwave lithotrips for large renal calculi.: the role of ureteral stones. A randomized trial. J Urol, 1991, vol 145, n°4, pp 699-702.
- Dhar N., Thorntoy J., Carafo M., Streem
S. A multivariate analysis of risk factors associated with subcapsular hematoma formation following electromagnetic shockwave lithotripsy. J. Urology 2004, vol 172, n° 6, pp 2271-2274. - Mc Ateer J., Evan A., Williams J., Lingeman J. Treatment protocols to reduce renal injury during shockwave lithotripsy. Curr
Opin Urol, 2009, 19:192-195. - Zanetti G., Ostini F., Montanari E., et
al. Cardiac dysrhythmias induced by extracorporeal shockwave lithotripsy. J.of Endourol 1999, vol. 13, n°6, pp.409-412. - Alken P. The Early History of Percutaneous Nephrolithotomy (PNL). En: C. M. Scoffone, A. Hoznek, C. M. Cracco. Springer. Supine Percutaneous Nephrolithotomy and ECIRS. France, 2014. p. 5-14.
- Türk C., Knoll T., Petrik A., et al. Guidelines on Urolithiasis. EAU Guidelines Office. EAU Guidelines. Arnhem, The Netherlands, 2018.
- Ganpule A., Desai M.: PNL. Indications and Guidelines: Urolithiasis. En: C. M. Scoffone, A. Hoznek, C. M. Cracco. Springer. Supine Percutaneous Nephrolithotomy and ECIRS. France, 2014. p. 25-32.
- Sabler IM, Katafigiotis I, Gofrit ON, Duvdevani M. Present indications and techniques of percutaneous nephrolithotomy: What the future holds?. Asian J Urol. 2018;5(4):287–294. doi:10.1016/j.ajur.2018.08.004
- Antonelli J., Pearle M. Advances in percutaneous nephrolithotomy. Urol Clin North Am 2013; 40(1): 99-113.
- Rashid, A. O., & Fakhulddin, S. S. (2016). Risk factors for fever and sepsis after percutaneous nephrolithotomy. Asian Journal of Urology, 3(2), 82–87. doi:10.1016/j.ajur.2016.03.001
- Rivera, M., Viers, B., Cockerill, P., Agarwal, D., Mehta, R., & Krambeck, A. (2016). Pre- and Postoperative Predictors of Infection-Related Complications in Patients Undergoing Percutaneous Nephrolithotomy. Journal of Endourology, 30(9), 982–986. doi:10.1089/end.2016.019.
- Sloth S., Sloth P. Imaging in Percutaneous Nephrolithotomy. En: C. M. Scoffone, A. Hoznek, C. M. Cracco. Springer. Supine Percutaneous Nephrolithotomy and 69. ECIRS. France, 2014. p. 57-78.
- S.T.O.N.E. nephrolithometry: novel surgical classification system for kidney calculi. Zhamshid Okhunov, Justin I. Friedlander, Arvin K. George, Brian D. Duty, Daniel M. Moreira, Arun K. Srinivasan, Joel Hillelsohn, Arthur D. Smith, Zeph Okeke Urology. 2013 Jun; 81(6): 1154-1159. Published online 2013 Mar 26.
- The Guy’s stone score–grading the complexity of percutaneous nephrolithotomy procedures. Kay Thomas, Naomi C. Smith, Nicholas Hegarty, Jonathan M. Glass Urology. 2011 Aug; 78(2): 277–281. Published online 2011 Feb 17.
- A nephrolithometric nomogram to predict treatment success of percutaneous nephrolithotomy. Arthur Smith, Timothy D. Averch, Khaled Shahrour, Dedan Opondo, Francisco P. J. Daels, Gaston Labate, Burak Turna, Jean J. M. C. H. de la Rosette, CROES PCNL Study Group J Urol. 2013 Jul; 190(1): 149–156. Published online 2013 Jan 23.
- de la Rosette JJ, Tsakiris P, Ferrandino MN, Elsakka AM, Rioja J, Preminger GM. Beyond prone position in percutaneous nephrolithotomy: a comprehensive review. Eur Urol. 2008;54:1262–1269
- Duty B., Okhunov Z., Smith A., Okeke Z. The debate over percutaneous nephrolithotomy positioning: a comprehensive review. J Urol2011; 186(1): 20-5.
- DasGupta R., Patel A. Percutaneous nephrolithotomy: does position matter? prone, supine and variations. Curr Opin Urol 2013; 23(2): 164-8
- Valdivia-Urìa JG, Lachares Santamaría E, Villarroya Rodríguez S, et al. Percutaneous nephrolithectomy: simplified technic (preliminary report) Arch Esp Urol. 1987;40:177–180
- Sofer M, Tavdi E, Levi O, et al. Implementation of supine percutaneous nephrolithotomy: a novel position for an old operation. Cent European J Urol. 2017;70(1):60–65.
- Gonzalez m, Garcia f, Jurado A, Damia O, Daels F, Galdakao modified supine Valdivia position for percutaneus nephrolithotomy Rev. Arg. de Urol. · Vol. 74 (1) 200
- Cracco, Cecilia & Scoffone, Cesare. (2011). ECIRS (Endoscopic Combined IntraRenal Surgery) in the Galdakao-modified supine Valdivia position: A new life for percutaneous surgery?. World journal of urology. 29. 821-7.
- Giusti, Guido, and Silvia Proietti. “Supine PCNL is the way to go!.” Central European journal of urology vol. 70,1 (2017): 66-67.
- Kallidonis, P., Kyriazis, I., Kotsiris, D., Koutava, A., Kamal, W., & Liatsikos, E. (2017). Papillary vs Nonpapillary Puncture in Percutaneous Nephrolithotomy: A Prospective Randomized Trial. Journal of Endourology, 31(S1), S–4–S–9.
- Noureldin, Y. A., and Andonian, S. Simulation for percutaneous renal access: Where are we? J Endourol. 2017; 31:S10–S19
- Chu C, Masic S, Usawachintachit M, et al. Ultrasound-Guided Renal Access for Percutaneous Nephrolithotomy: A Description of Three Novel Ultrasound-Guided Needle Techniques. J Endourol. 2016;30(2):153–158. doi:10.1089/end.2015.0185
- Miller, N. L., Matlaga, B. R., & Lingeman, J. E. (2007). Techniques for Fluoroscopic Percutaneous Renal Access. The Journal of Urology, 178(1), 15–23. doi:10.1016/j.juro.2007.03.014
- Wright A, Rukin N, Smith D, De la Rosette J, Somani BK. ‘Mini, ultra, micro’ – nomenclature and cost of these new minimally invasive percutaneous nephrolithotomy (PCNL) techniques. Ther Adv Urol. 2016;8(2):142–146. doi:10.1177/1756287215617674
- Wezel F., Mamoulakis C., Rioja J., et al. Two contemporary series of percutaneous tract dilation for percutaneous nephrolithotomy. J Endourol 2009; 23(10): 1655-61
- Wezel F., Mamoulakis C., Rioja J., et al. Two contemporary series of percutaneous tract dilation for percutaneous nephrolithotomy. J Endourol 2009; 23(10): 1655-61
- Sabler, I. M., Katafigiotis, I., Gofrit, O. N., & Duvdevani, M. (2018). Present indications and techniques of percutaneous nephrolithotomy: What the future holds? Asian Journal of Urology, 5(4), 287–294. doi:10.1016/j.ajur.2018.08.004
- Marchant F., Recabal P., Fernandez M. I.,et al. Postoperative morbidity of tubeless versus conventional percutaneous nephrolithotomy: a prospective comparative study. Urol Res 2011; 39(6): 477-81.
- Mercado A., Fernandez M., Recabal P., et al. Immediate postoperative morbidity in patients with indwelling double-J stent versus overnight-externalized ureteral catheter after tubeless percutaneous nephrolithotomy: a prospective, randomized study. Urolithiasis 2013; 41(3): 253-6.
- De Cogain M., Krambeck A. Advances in tubeless percutaneous nephrolithotomy and patient selection: an update. Curr Urol Rep 2013; 14(2): 130-7.
- Portis, Andrew J et al. “Intraoperative fragment detection during percutaneous nephrolithotomy: evaluation of high magnification rotational fluoroscopy combined with aggressive nephroscopy.” The Journal of urology 175 1 (2006): 162-5; discussion 165-6 .
- Vicentini, F. C., Botelho, L., Braz, J., Almeida, E. S., & Hisano, M. (2017). Use of the Uro Dyna-CT in endourology – the new frontier. International braz j urol : official journal of the Brazilian Society of Urology, 43(4), 762–765. doi:10.1590/S1677-5538.IBJU.2016.0413
- Baralo, Bohdan & Samson, Patrick & Hoenig, David & Smith, Arthur. (2019). Percutaneous kidney stone surgery and radiation exposure: A review. Asian Journal of Urology. 10.1016/j.ajur.2019.03.007.
- Taylor E., Miller J., Chi T., Stoller M. Complications associated with percutaneous nephrolithotomy. Transl Androl Urol 2012; 1(4): 223-228.
- Michel M., Trojan L., Rassweiler J. Complications in percutaneous nephrolithotomy. Eur Urol 2007; 51(4): 899-906; discussion 906
- Maheshwari P., Mane D., Pathak A. Management of pleural injury after percutaneous renal surgery. J Endourol 2009; 23(10): 1769-72.
- Traxer O. Management of injury tothe bowel during percutaneous stone removal. J Endourol 2009; 23(10): 1777-80.
- Rastinehad A., Andonian S., Smith A., Siegel D. Management of hemorrhagic complications associated with percutaneous nephrolithotomy. J Endourol 2009; 23(10): 1763-7.
- Negrete-Pulido O., Gutierrez-Aceves J. Management of infectious complications in percutaneous nephrolithotomy. J Endourol 2009; 23(10): 1757-62.
- Dasgupta R., Grabe M. Preoperative. antibiotics before endourologic surgery: current recommendations. J Endourol 2009; 23(10): 1567-70.
- MariappanP.,SmithG.,BariolS.,etal.Stone. and pelvic urine culture and sensitivity are better than bladder urine as predictors of urosepsis following percutaneous nephrolithotomy: a prospective clinical study. J Urol 2005; 173(5): 1610-4.
- Geraghty R, Jones P, Somani B. Worldwide trends of urinary stone disease treatment over the last two decades: a systematic review. J Endourol 2017;31(6): 547–56. 58.
- (Young HH, McKay RW. Congenital valvular obstruction of the prostatic urethra. Surg Gynecol Obstet 1929;48:509).
- Wickham JEA, Miller RA. Endoscopic instruments and their accessories. In: Wickham JEA, Miller RA, editors. Percutaneous renal surgery. New York: Churchill Livingstone; 1983. p. 45–74).
- Goodman T. Ureteroscopy with pediatric cysto- scope in adults. Urology 1977;9(4):394.)
- Perez-Castro EE, Martinez-Piniero JA. Transure- thral ureteroscopy—a current urological procedure. Arch Esp Urol 1980;33(5):445–60.).
- Schuster TG, Russel KY, Bloom DA, Koo HP, Faerber GJ. Ureteroscopy for the treatment of urolithiasis in children. J Urol 2002;167:1813.
- Dretler SP, Cho G. Semirigid ureteroscopy: a new genre. J Urol 1989;141:1314.),
- Hecht J. City of light: the story of fiber optics. New York: Oxford University Press; 1999. p. 365.)
- Marshall VF (1964) Fiber optics in urology. J Urol 91:110–114 ).
- Takagi T, Go T, Takayasu H, Aso Y. A small caliber fiberscope for visualization of urinary tract, biliary tract, and spinal canal. Surgery 1968;64: 1033)
- Bagley DH, Huffman JL, Lyon ES. Combine rigid and flexible ureteropyeloscopy. J Urol 1983;130: 243. /Takagi T, Go T, Takayasu H, Aso Y. Fiberoptic pyeloureteroscope. Surgery 1971;70:661.)
- Grasso M, Bagley D. A 7.5/8.2F actively deflect- able, flexible ureteroscope: a new device for both diagnostic and therapeutic upper urinary tract endoscopy. Urology 1994;43(4):435. ).
- Preminger, G.M., et al. 2007 Guideline for the management of ureteral calculi. Eur Urol, 2007. 52: 1610.
- Preminger GM, Tiselius HG, AssimosDG. American Urological Association Education and Research, Inc; European Association of Urology. 2007 Guideline for the Management of ureteral calculi. 16. Eur Urol 2007; 52(6): 1610-1631.
- Yilmaz, E., et al. The comparison and efficacy of 3 different alpha1-adrenergic blockers for distal ureteral stones. J Urol, 2005. 173: 2010.
- Wang, H., et al. Comparative efficacy of tamsulosin versus nifedipine for distal ureteral calculi: a meta-analysis. Drug Des Devel Ther, 2016. 10: 1257.
- Liu, X.J., et al. Role of silodosin as medical expulsive therapy in ureteral calculi: a meta-analysis of randomized controlled trials. Urolithiasis, 2017.
- Hollingsworth, J.M., et al. Alpha blockers for treatment of ureteric stones: systematic review and meta-analysis. BMJ, 2016. 355: i6112.
- Pickard, R., et al. Medical expulsive therapy in adults with ureteric colic: a multicentre, randomised, placebo-controlled trial. Lancet, 2015. 386: 341.
- Wu CF, Shee JJ, Lin WY, Lin CL, Chen CS. Comparison between extracorporeal shock wave lithotripsy and semirigid ureterorenoscope with Holmium: YAG laser lithotripsy for treating large proxima ureteral stone. J Urol 2004; 172: 1899 – 1902.
- Preminger, G.M., et al. 2007 Guideline for the management of ureteral calculi. Eur Urol, 2007. 52: 1610..
- Wendt-Nordahl, G., et al. Do new generation flexible ureterorenoscopes offer a higher treatment success than their predecessors? Urol Res, 2011. 39: 185
- Yang, C., Li, S., & Cui, Y. (2016). Comparison of YAG Laser Lithotripsy and Extracorporeal Shock Wave Lithotripsy in Treatment of Ureteral Calculi: A Meta-Analysis. Urologia Internationalis, 98(4), 373–381
- Xin Cui, Fan Ji, Hao Yan, Tong-wen Ou, Chun-song Jia, Xin-zhou He, Wei Gao, Qi Wang, Bo Cui, and Jiang-tao Comparison Between Extracorporeal Shock Wave Lithotripsy and Ureteroscopic Lithotripsy for Treating Large Proximal Ureteral Stones: A Meta-analysis Wu Urology, 85(4), 748–756.
- Cui, X., et al. Comparison between extracorporeal shock wave lithotripsy and ureteroscopic lithotripsy for treating large proximal ureteral stones: a meta-analysis. Urology, 2015. 85: 748.).
- Preminger GM, Tiselius HG, Assimos DG et al: 2007 guideline for the management of ureteral calculi. J Urol 2007; 178: 2418.
- Drake, T., et al. What are the Benefits and Harms of Ureteroscopy Compared with Shock-wave Lithotripsy in the Treatment of Upper Ureteral Stones? A Systematic Review. Eur Urol, 2017. 72: 772.
- Lotan Y, Cadeddu JA, Roehrborn CG. Management of ureteral calculi: a costo comparison and decisión making análisis. J Urol 2002; 167: 1621- 1629./.
- Kappor DA, Leech JE, Yap WT. Cost and efficacy of extracorporeal shock wave lithotripsy versus ureteroscopy in the treatment of lower ureteral calculi. J Urol 1992; 148: 1095 – 1096.
- Worster, A., et al. The accuracy of noncontrast helical computed tomography versus intravenous pyelography in the diagnosis of suspected acute urolithiasis: a meta-analysis. Ann Emerg Med, 2002. 40: 280.
- Kluner, C., et al. Does ultra-low-dose CT with a radiation dose equivalent to that of KUB suffice to detect renal and ureteral calculi? J Comput Assist Tomogr, 2006. 30: 44.
- Thomson, J.M., et al. Computed tomography versus intravenous urography in diagnosis of acute flank pain from urolithiasis: a randomized study comparing imaging costs and radiation dose. Australas Radiol, 2001. 45: 291.
- Turna, B., et al. Safety and efficacy of flexible ureterorenoscopy and holmium:YAG lithotripsy for intrarenal stones in anticoagulated cases. J Urol, 2008. 179: 1415.
- Shii, H., et al. Outcomes of Systematic Review of Ureteroscopy for Stone Disease in the Obese and Morbidly Obese Population. J Endourol, 2016. 30: 135.
- Cybulski, P.A., et al. Ureteroscopy: anesthetic considerations. Urol Clin North Am, 2004. 31: 43.
- Sun, X., et al. Treatment of large impacted proximal ureteral stones: randomized comparison of percutaneous antegrade ureterolithotripsy versus retrograde ureterolithotripsy. J Endourol, 2008. 22: 913.
- Moufid, K., et al. Large impacted upper ureteral calculi: A comparative study between retrograde ureterolithotripsy and percutaneous antegrade ureterolithotripsy in the modified lateral position. Urol Ann, 2013. 5: 140./
- Topaloglu, H., et al. A comparison of antegrade percutaneous and laparoscopic approaches in the treatment of proximal ureteral stones. Biomed Res Int, 2014. 2014: 69194.
- Assimos, D., et al. Preoperative JJ stent placement in ureteric and renal stone treatment: results from the Clinical Research Office of Endourological Society (CROES) ureteroscopy (URS) Global Study. BJU Int, 2016. 117: 648./
- Jessen, J.P., et al. International Collaboration in Endourology: Multicenter Evaluation of Prestenting for Ureterorenoscopy. J Endourol, 2016. 30: 268.
- Song, T., et al. Meta-analysis of postoperatively stenting or not in patients underwent ureteroscopic lithotripsy. Urol Res, 2012. 40: 67.
- Moon, T.D. Ureteral stenting–an obsolete procedure? J Urol, 2002. 167: 1984.
- Wang, C.J., et al. Effects of specific alpha-1A/1D blocker on lower urinary tract symptoms due to double-J stent: a prospectively randomized study. Urol Res, 2009. 37: 147.
- Lamb, A.D., et al. Meta-analysis showing the beneficial effect of alpha-blockers on ureteric stent discomfort. BJU Int, 2011. 108: 1894.
- Park HK, Paick SH, Oh SJ, Kim HH (2004) Ureteroscopic litho- tripsy under local anesthesia: analysis of the effectiveness and patient tolerability. Eur Urol 45(5):670–673.
- Cybulski PA, Joo H, Honey RJ (2004) Ureteroscopy: anesthetic considerations. Urol Clin N Am 31(1):43–7, viii
- Ulvik O, Rennesund K, Gjengsto P. Ureteroscopy with and whitout safety guidewire: should the safety wire still be mandatory? J Endourol 2013; 27(10): 1197-1202.
- Dickstein RJ, Kreshover JE, Babayan RK. Is a safety wire necessary during Soutine flexible ureteroscopy?. J Endourol 2010; 24(10): 1589-1592. / Eandi, J.A., et al. Evaluation of the impact and need for use of a safety guidewire during ureteroscopy. J Endourol, 2008. 22: 1653.
- Proietti S, Dragos L, Somani BK, Butticè S, Talso M, Emiliani E, BaghdadiM, Giusti,G, TraxerO.In vitro comparison of maximum pressure developed by irrigation systems in a kidney model. J Endourol. 2017 Apr 5. doi: 10.1089/end.2017.0005. [Epub ahead of print]
- Bin X, Friedlander JI, Chuang KW. Predictive factors for intraoperative ballon dilation in semirrigid ureteroscopic lithotripsy. J Enurol 2012; 26(8): 988-991.).
- Kuntz NJ, Neisius A, Tsivian M, Ghaffar M, Patel N, Fer- randino MN et al (2015) Balloon dilation of the ureter: a contemporary review of outcomes and complications. J Urol. 194(2):413–417 .
- Jessen JP1, Breda A2, Brehmer M3, Liatsikos EN4, Millan Rodriguez F2, Osther PJ5, Scoffone CM6, Knoll T1. International Collaboration in Endourology: Multicenter Evaluation of Prestenting for Ureterorenoscopy. J Endourol. 2016 Mar;30(3):268-73.
- Assimos, D., et al. Preoperative JJ stent placement in ureteric and renal stone treatment: results from the Clinical Research Office of Endourological Society (CROES) ureteroscopy (URS) Global Study. BJU Int, 2016. 117: 648./
- Jessen, J.P., et al. International Collaboration in Endourology: Multicenter Evaluation of Prestenting for Ureterorenoscopy. J Endourol, 2016. 30: 268.
- Randomized Trial of Stone Fragment Active Retrieval Versus Spontaneous Passage During Holmium Laser Lithotripsy for Ureteral Stones .Oscar Schatloff,* Uri Lindner, Jacob Ramon and Harry Z. Winkler .T, J Urology, Vol. 183, 1031-1036, March 2010 .
- (Desai MR, Patel SB, Desai MM. The Dretler stone cone: a device to prevent ureteral stone migration—the initial clinical expe- rience. J Urol. 2002;167:1985-1988.
- Rane A, Bradoo A, Rao P. The use of Novel Reverse Thermosensitive polymer to pre- vente ureteral stone retropulsion during intracorporeal lithotripsy: A randomized controlled trial. J Urol 2010: 183: 1417-1423.
- Pagnani CJ, El Akkad M, Bagley DH. Prevention of Stone Migration with the Accordion during endoscopic ureteral lithotripsy. J Endourol 2012; 26(5): 484-488./.
- Salvadó JA, Saavedra A, Astroza G. Uso rutinario del dispositivo antimigratorio Accordion® para prevenir la retropulsión de cálculos ureterales durante la litotripsia intracorpórea con laser Holmium: ¿ Se justifica su uso?. Rev Chil Urol; en prensa
- Perez Castro E, Osther PJ, Jinga V et al: Differences in ureteroscopic stone treatment and outcomes for distal, mid-, proximal, or multiple ureteral locations: the Clinical Research Office of the Endourological Society ureteroscopy global study. Eur Urol 2014; 66: 102.
- Wang, Q., et al. Rigid ureteroscopic lithotripsy versus percutaneous nephrolithotomy for large proximal ureteral stones: A meta-analysis. PLoS One, 2017. 12: e0171478. /.
- Wang, Y., et al. Comparison of the efficacy and safety of URSL, RPLU, and MPCNL for treatment of large upper impacted ureteral stones: a randomized controlled trial. BMC Urol, 2017. 17: 50. /.
- Wu, T., et al. Ureteroscopic Lithotripsy versus Laparoscopic Ureterolithotomy or Percutaneous Nephrolithotomy in the Management of Large Proximal Ureteral Stones: A Systematic Review and Meta-Analysis. Urol Int, 2017. 99: 308.
- Sun, X., et al. Treatment of large impacted proximal ureteral stones: randomized comparison of percutaneous antegrade ureterolithotripsy versus retrograde ureterolithotripsy. J Endourol, 2008. 22: 913./.
- el-Nahas, A.R., et al. Percutaneous treatment of large upper tract stones after urinary diversion. Urology, 2006. 68: 500. /.
- El-Assmy, A., et al. Extracorporeal shock wave lithotripsy of upper urinary tract calculi in patients with cystectomy and urinary diversion. Urology, 2005. 66: 510. /.
- Moufid, K., et al. Large impacted upper ureteral calculi: A comparative study between retrograde ureterolithotripsy and percutaneous antegrade ureterolithotripsy in the modified lateral position. Urol Ann, 2013. 5: 140./. Topaloglu, H., et al. A comparison of antegrade percutaneous and laparoscopic approaches in the treatment of proximal ureteral stones. Biomed Res Int, 2014. 2014: 691946
- Gupta PK (2007) Is the holmium:YAG laser the best intracor- poreal lithotripter for the ureter? A 3-year retrospective study. J Endourol 21(3):305–309.
- Rassweiler J, Rassweiler MC, Klein J (2016) New technology in ureteroscopy and percutaneous nephrolithotomy. Curr Opin Urol 26(1):95–106 /.
- Zhong P, Tong HL, Cocks FH, Pearle MS, Preminger GM (1998) Transient cavitation and acoustic emission produced by different laser lithotripters. J Endourol 12(4):371–378 /.
- Rassweiler JJ, Klein J (2016) Re: update on lasers in urology. Cur- rent assessment on holmium:yttrium-aluminum-garnet (Ho:YAG) laser lithotripter settings and laser fibers. Eur Urol 70(3):538–539.
- Kronenberg P, Traxer O (2014) In vitro fragmentation efficiency of holmium:yttrium-aluminum-garnet (YAG) laser lithotripsy—a comprehensive study encompassing different frequencies, pulse energies, total power levels and laser fibre diameters. BJU Int 114(2):261–267 /.
- Wezel F, Häcker A, Gross AJ, Michel MS, Bach T (2010) Effect of pulse energy, frequency and length on holmium:yttrium-alu- minum-garnet laser fragmentation efficiency in non-floating arti- ficial urinary calculi. J Endourol 24(7):1135–1140.
- Bach T, Geavlete B, Herrmann TR, Gross AJ (2008) Working tools in flexible ureterorenoscopy—influence on flow and deflec- tion: what does matter? J Endourol 22(8):1639–1643 /.
- Pasqui F, Dubosq F, Tchala K, Tligui M, Gattegno B, Thibault P, Traxer O (2004) Impact on active scope deflection and irrigation flow of all endoscopic working tools during flexible ureteroscopy. Eur Urol 45(1):58–64 )
- Kronenberg P, Traxer O (2015) Are we all doing it wrong? Influ- ence of stripping and cleaving methods of laser fibers on laser lithotripsy performance. J Urol 193(3):1030–1035/
- Haddad M, Emiliani E, Rouchausse Y, Coste F, Berthe L, Doizi S, Butticè S, Somani B, Traxer O (2017) Impact of laser fiber tip cleavage on power output for ureteroscopy and stone treatment. World J Urol 35(11):1765–1770 .
- Talso M, Emiliani E, Haddad M, Berthe L, Baghdadi M, Montan- ari E, Traxer O (2016) Laser fiber and flexible ureterorenoscopy: the safety distance concept. J Endourol 30(12):1269–1274
- Kronenberg P, Traxer O (2015) Update on lasers in urology 2014: current assessment on holmium:yttrium-aluminum-garnet (Ho:YAG) laser lithotripter settings and laser fibers. World J Urol 33(4):463–469 /.
- Spore SS, Teichman JM, Corbin NS, Champion PC, Williamson EA, Glickman RD (1999) Holmium:YAG lithotripsy: optimal power settings. J Endourol 13(8):559–566.
- Song, T., et al. Meta-analysis of postoperatively stenting or not in patients underwent ureteroscopic lithotripsy. Urol Res, 2012. 40: 67. /
- Haleblian, G., et al. Ureteral stenting and urinary stone management: a systematic review. J Urol, 2008. 179: 424
- de la Rosette J, Denstedt J, Geavlete P, Keeley F, Matsuda T, Pearle M, Preminger G, Traxer O, CROES URS Study Group (2014) The clinical research office of the endourological society ureteroscopy global study: indications, complications, and out- comes in 11,885 patients. J Endourol 28(2):131–139 .
- Assimos D, Krambeck A, Miller NL, Monga M, Murad MH, Nel-son CP, Pace KT, Pais VM Jr, Pearle MS, Preminger GM, Razvi H, Shah O, Matlaga BR (2016) Surgical management of stones: American Urological Association/Endourological Society Guide- line, PART I. J Urol 196(4):1153–1160 /
- Assimos D, Krambeck A, Miller NL, Monga M, Murad MH, Nel- son CP, Pace KT, Pais VM Jr, Pearle MS, Preminger GM, Razvi H, Shah O, Matlaga BR (2016) Surgical management of stones: American Urological Association/Endourological Society Guide- line, PART II. J Urol 196(4):1161–1169
- Wang, C.J., et al. Effects of specific alpha-1A/1D blocker on lower urinary tract symptoms due to double-J stent: a prospectively randomized study. Urol Res, 2009. 37: 147.
- Lamb, A.D., et al. Meta-analysis showing the beneficial effect of alpha-blockers on ureteric stent discomfort. BJU Int, 2011. 108: 1894.
- Binbay, M., et al. Is there a difference in outcomes between digital and fiberoptic flexible ureterorenoscopy procedures? J Endourol, 2010. 24: 1929./. Wendt-Nordahl, G., et al. Do new generation flexible ureterorenoscopes offer a higher treatment success than their predecessors? Urol Res, 2011. 39: 185./.
- Geraghty, R., et al. Evidence for Ureterorenoscopy and Laser Fragmentation (URSL) for Large Renal Stones in the Modern Era. Curr Urol Rep, 2015. 16: 54.
- Zheng, C., et al. Retrograde intrarenal surgery versus percutaneous nephrolithotomy for treatment of renal stones >2 cm: a meta-analysis. Urol Int, 2014. 93: 417./.
- Karakoyunlu, N., et al. A comparison of standard PCNL and staged retrograde FURS in pelvis stones over 2 cm in diameter: a prospective randomized study. Urolithiasis, 2015. 43: 283.
- Inci, K., et al. Prospective long-term followup of patients with asymptomatic lower pole caliceal stones. J Urol, 2007. 177: 2189.
- Burgher, A., et al. Progression of nephrolithiasis: long-term outcomes with observation of asymptomatic calculi. J Endourol, 2004. 18: 534./.
- Hubner, W., et al. Treatment of caliceal calculi. Br J Urol, 1990. 66: 9.
- Glowacki, L.S., et al. The natural history of asymptomatic urolithiasis. J Urol, 1992. 147: 319./.
- Collins, J.W., et al. Is there a role for prophylactic shock wave lithotripsy for asymptomatic calyceal stones? Curr Opin Urol, 2002. 12: 281.
- Türk C, Neisius A, Petřík A, Seitz C, Skolarikos A, Tepeler A, Thomas K (2017) EAU Guidelines on Urolithiasis.Accessed Oct 2017/.
- Assimos D, Krambeck A, Miller NL, Monga M, Murad MH, Nelson CP, Pace KT, Pais VM Jr, Pearle MS, Preminger GM, Razvi H, Shah O, Matlaga BR (2016) Surgical mmanagement of stones: American Urological Association/Endourological Society Guide- line, PART I. J Urol 196(4):1153–1160 /.
- Assimos D, Krambeck A, Miller NL, Monga M, Murad MH, Nel- son CP, Pace KT, Pais VM Jr, Pearle MS, Preminger GM, Razvi H, Shah O, Matlaga BR (2016) Surgical management of stones: American Urological Association/Endourological Society Guide- line, PART II. J Urol 196(4):1161–1169 .
- Karakoyunlu N, Goktug G, Sener NC et al: A comparison of standard PCNL and staged retrograde FURS in pelvis stones over 2 cm in diameter: a prospective randomized study. Urolithiasis 2015; 43: 283.
- De S, Autorino R, Kim FJ et al: Percutaneous nephrolithotomy versus retrograde intrarenal surgery: a systematic review and meta-analysis. Eur Urol 2015; 67: 125.,
- Matlaga BR, Jansen JP, Meckley LM et al: Treatment of ureteral and renal stones: a systematic review and meta-analysis of randomized, controlled trials. J Urol 2012; 188: 130.
- Sahinkanat, T., et al. Evaluation of the effects of relationships between main spatial lower pole calyceal anatomic factors on the success of shock-wave lithotripsy in patients with lower pole kidney stones. Urology, 2008. 71: 801. /.
- Preminger, G.M. Management of lower pole renal calculi: shock wave lithotripsy versus percutaneous nephrolithotomy versus flexible ureteroscopy. Urol Res, 2006. 34: 108. /.
- Zheng, C., et al. Extracorporeal shock wave lithotripsy versus retrograde intrarenal surgery for treatment for renal stones 1-2 cm: a meta-analysis. Urolithiasis, 2015. 43: 549.
- Wen, J., Xu, G., Du, C., & Wang, B. (2016). Minimally invasive percutaneous nephrolithotomy versus endoscopic combined intrarenal surgery with flexible ureteroscope for partial staghorn calculi: A randomised controlled trial. International Journal of Surgery, 28, 22–27.
- Giusti G, Proietti S, Villa L, Cloutier J, Rosso M, Gadda GM, Doizi S, Suardi N, Montorsi F, Gaboardi F, Traxer O (2016) Cur- rent standard technique for modern flexible ureteroscopy: tips and tricks. Eur Urol 70(1):188–194.
- Doizi S, Knoll T, Scoffone CM, Breda A, Brehmer M, Liatsikos E, Cornu JN, Traxer O (2014) First clinical evaluation of a new innovative ureteral access sheath (Re-TraceTM): a European study. World J Urol 32(1):143–147
- Breda A, Emiliani E, Millán F, Scoffone CM, Knoll T, Osther PJ, Liatsikos E (2016) The new concept of ureteral access sheath with guidewire disengagement: one wire does it all. World J Urol 34(4):603–606
- Hudson RG, Conlin MJ, Bagley DH (2005) Ureteric access with flexible ureteroscopes: effect of the size of the ureteroscope. BJU Int. 95(7):1043–1044
- Hubosky SG, Healy KA, Grasso M, Bagley DH (2014) Accessing the difficult ureter and the importance of ureteroscope miniaturi- zation: history is repeating itself. Urology. 84(4):740–742
- Newman RC, Hunter PT, Hawkins IF, Finlayson B (1987) The ureteral access system: a review of the immediate results in 43 cases. J Urol 137(3):380–383/.
- Rehman J, Monga M, Landman J, Lee DI, Felfela T, Conradie MC, Srinivas R, Sundaram CP, Clayman RV (2003) Characteriza- tion of intrapelvic pressure during ureteropyeloscopy with ureteral access sheaths. Urology 61(4):713–718 /.
- Auge BK, Pietrow PK, Lallas CD, Raj GV, Santa-Cruz RW, Preminger GM (2004) Ureteral access sheath provides protection against elevated renal pressures during routine flexible uretero- scopic stone manipulation. J Endourol 18(1):33–36 .
- Al-Qahtani SM, Letendre J, Thomas A, Natalin R, Saussez T, Traxer O (2014) Which ureteral access sheath is compatible with your flexible ureteroscope? J Endourol 28(3):286–290
- Emre Sener T, Cloutier J, Villa L, Marson F, Butticè S, Doizi S, Traxer O (2016) Can we provide low intrarenal pressures with good irrigation flow by decreasing the size of ureteral access sheaths? J Endourol 30(1):49–55.
- Assimos DG. First Clinical Evaluation of a New Single-Use Flexible Ureteroscope (LithoVue™): A European Prospective Multicentric Feasibility Study.J Urol. 2017 Mar;197(3 Pt 1):737
- Christopher J. Martin , Sean B. McAdams , Haidar Abdul-Muhsin , Victoria M. Lim , Rafael Nunez-Nateras , Mark D. Tyson , Mitchell R. Humphreys The Economic Implications of a Reusable Flexible Digital Ureteroscope: A Cost- Benefit Analysis J Urol. 2017 Mar;197(3 Pt 1):730-735.
- Chawla SN, Chang MF, Chang A, Lenoir J, Bagley DH (2008) Effectiveness of high-frequency holmium:YAG laser stone frag- mentation: the “popcorn effect”. J Endourol 22(4):645–650.
- Emiliani E, Talso M, Cho SY, Baghdadi M, Mahmoud S, Pin- heiro H, Traxer O (2017) Optimal settings for the noncontact holmium:YAG stone fragmentation popcorn technique. J Urol 198(3):702–706
- Pearle, M. S. (2016). Is Ureteroscopy as Good as We Think? The Journal of Urology, 195(4), 823–824.
- Preminger GM, Tiselius HG, Assimos DG, Alken P, Buck AC, Gallucci M, Knoll T, Lingeman JE, Nakada SY, Pearle MS, Sarica K, Türk C, Wolf JS Jr, American Urological Association Educa- tion and Research, Inc, European Association of Urology (2007) 2007 Guideline for the management of ureteral calculi. Eur Urol 52(6):1610–1631 .
- Dragos LB, Somani BK, Sener ET, Buttice S, Proietti S, Plou- midis A, Iacoboaie CT, Doizi S, Traxer O (2017) Which flexible ureteroscopes (digital vs. fiber-optic) can easily reach the difficult lower pole calices and have better end-tip deflection: in vitro study on K-box. A PETRA evaluation. J Endourol 31(7):630–637 .
- Auge, B.K., et al. Ureteroscopic management of lower-pole renal calculi: technique of calculus displacement. J Endourol, 2001. 15: 835.
- Seto C, Ishiura Y, Egawa M, Komatsu K, Namiki M (2006) Dura- bility of working channel in flexible ureteroscopes when inserting ureteroscopic devices. J Endourol 20(3):223–226 .
- Shin RH, Lautz JM, Cabrera FJ, Shami CJ, Goldsmith ZG, Kuntz NJ, Kaplan AG, Neisius A, Simmons WN, Preminger GM, Lip- kin ME (2016) Evaluation of novel ball-tip holmium laser fiber: impact on ureteroscope performance and fragmentation efficiency. J Endourol 30(2):189–194 /.
- Kronenberg P, Traxer O (2016) Lithotripsy performance of spe- cially designed laser fiber tips. J Urol 195(5):1606–1612.
- Baghdadi M, Emiliani E, Talso M, Servián P, Barreiro A, Orosa A, Proietti S, Traxer O (2017) Comparison of laser fiber pas- sage in ureteroscopic maximum deflection and their influence on deflection and irrigation: do we really need the ball tip concept? World J Urol 35(2):313–318.
- Doizi S., Traxer O., Flexible ureteroscopy: technique, tips and tricks. Urolithiasis. 2018 Feb;46(1):47-58.
- Emiliani E, Talso M, Baghdadi M, Ghanem S, Golmard J, Pin- heiro H, Gkentzis A, Butticè S, Traxer O (2016) The use of apnea during ureteroscopy. Urology 97:266–268
- Sejiny M, Al-Qahtani S, Elhaous A, Molimard B, Traxer O (2010) Efficacy of flexible ureterorenoscopy with holmium laser in the management of stone-bearing caliceal diverticula. J Endourol 24(6):961–967
- Tsai, Y.L., et al. Comparative study of conservative and surgical management for symptomatic moderate and severe hydronephrosis in pregnancy: a prospective randomized study. Acta Obstet Gynecol Scand, 2007. 86: 1047.
- Mokhmalji, H., et al. Percutaneous nephrostomy versus ureteral stents for diversion of hydronephrosis caused by stones: a prospective, randomized clinical trial. J Urol, 2001. 165: 1088.
- Ngai, H.Y., et al. Double-J ureteric stenting in pregnancy: A single-centre experience from Iraq. Arab J Urol, 2013. 11: 148.
- Teleb, M., et al. Definitive ureteroscopy and intracorporeal lithotripsy in treatment of ureteral calculi during pregnancy. Arab J Urol, 2014. 12: 299.
- Vincent De Coninck · Etienne Xavier Keller ., Bhaskar Somani., Guido Giusti Silvia Proietti Moises Rodriguez‐SocarrasMaria Rodríguez‐Monsalve · Steeve Doizi · Eugenio Ventimiglia1· Olivier Traxer Complications of ureteroscopy: a complete overview World Journal of Urology Received: 6 October 2019 / Accepted: 5 November 2019.
- Real Academia Española RAE. 2001. 2001. Real Academia Española.
- Einstein A. Bemerkungen zu Zur Quantentheorie der Strahlung. Phys Z [Internet]. 1917 [cited 2025 May 26];18:121–8. Available from: http://nausikaa2.rz-berlin.mpg.de/digitallibrary/digilib.jsp?fn=
- Lewis GN. Lewis-1926-photon.pdf. 1926. p. 874–5.
- Gross AJ, Herrmann TRW. History of lasers. World J Urol. 2007;25(3):217–20.
- Schawlow AL, Townes CH. Infrared and optical masers. Physical Review. 1958;112(6):1940–9.
- Maiman TH. Stimulated Optical Radiation in Ruby. Nature Publishing Group. 1960;
- Javan A, Bennett WR, Herriott DR. Population inversion and continuous optical maser oscillation in a gas discharge containing a He-Ne mixture. Phys Rev Lett. 1961;6(3):106–10.
- Snitzer E. Optical maser action of Nd+3 in a barium crown glass. Phys Rev Lett. 1961;7(12):444–6.
- Teichmann HO, Herrmann TR, Bach T. Technical aspects of lasers in urology. World J Urol. 2007;25(3):221–5.
- Vázquez Alba Joaquín Carballido Rodríguez D, España Correspondencia M. Monográfico: ENDOUROLOGÍA Y LÁSER FUNDAMENTOS DEL LÁSER Y SU APLICACIÓN EN UROLOGÍA. Arch Esp Urol. 2008;61:965–70.
- Lobik L, Ravid A, Nissenkorn I, Kariv N, Bernheim J, Katzir A. Bladder welding in rats using controlled temperature CO2 laser system. Journal of Urology. 1999;161(5):1662–5.
- Teichman JMH, Vassar GJ, Bishoff JT, Bellman GC. Holmium:YAG lithotripsy yields smaller fragments than lithoclast, pulsed dye laser or electrohydraulic lithotripsy. Journal of Urology. 1998;159(1):17–23.
- Potter KS, Simmons JH. Optical gain and lasers. Opt Mater (Amst) [Internet]. 2021 Jan 1 [cited 2025 Jun 2];369–428. Available from: https://www.sciencedirect.com/science/article/abs/pii/B9780128186428000077
- Pal D, Ghosh A, Sen R, Pal A. Continuous-wave and quasi-continuous wave thulium-doped all-fiber laser: implementation on kidney stone fragmentations. Appl Opt. 2016;55(23):6151.
- Panthier F, Doizi S, Corrales M, Traxer O. Pulsed lasers and endocorporeal laser lithotripsy. Progres en Urologie [Internet]. 2021;31(8–9):451–7. Available from: https://doi.org/10.1016/j.purol.2020.11.008
- Panthier F, Abid N, Hoznek A, Traxer O, Meria P, Almeras C. 2022 Recommendations of the AFU Lithiasis Committee: Laser – utilization and settings. Progres en Urologie. 2023;33(14):825–42.
- Ventimiglia E, Traxer O. www.caunet.org. 2000. Principios de litotricia con láser.
- Tzelves L, Somani B, Berdempes M, Markopoulos T, Skolarikos A. Basic and advanced technological evolution of laser lithotripsy over the past decade: An educational review by the european society of urotechnology section of the european association of urology. Turk J Urol. 2021;47(3):183–92.
- Chan KF, Vassar GJ, Pfefer TJ, Teichman JMH, Glickman RD, Weintraub ST, et al. Holmium:YAG laser lithotripsy: A dominant photothermal ablative mechanism with chemical decomposition of urinary calculi. Lasers Surg Med. 1999;25(1):22–37.
- Vassar GJ, Chan KF, Teichman JMH, Glickman RD, Weintraub ST, Pfefer TJ, et al. Holmium:YAG lithotripsy: Photothermal mechanism. J Endourol. 1999;13(3):181–90.
- van Leeuwen TG, van der Veen MJ, Verdaasdonk RM, Borst C. Noncontact tissue ablation by Holmium: YSGG laser pulses in blood. Lasers Surg Med. 1991;11(1):26–34.
- Traxer O, Keller EX. Thulium fiber laser: the new player for kidney stone treatment? A comparison with Holmium:YAG laser. World J Urol [Internet]. 2020;38(8):1883–94. Available from: https://doi.org/10.1007/s00345-019-02654-5
- Kronenberg P, Somani B. Advances in Lasers for the Treatment of Stones—a Systematic Review. Curr Urol Rep. 2018;19(6).
- Kronenberg P, Traxer O. Update on lasers in urology 2014: current assessment on holmium:yttrium–aluminum–garnet (Ho:YAG) laser lithotripter settings and laser fibers. World J Urol. 2015;33(4):463–9.
- Kronenberg P, Traxer O. Pi-05 Ultra-Short, Short, Medium and Long-Pulse Laser Lithotripsy Performance. Journal of Urology [Internet]. 2016;195(4S):e410. Available from: http://dx.doi.org/10.1016/j.juro.2016.02.1210
- Bader MJ, Pongratz T, Khoder W, Stief CG, Herrmann T, Nagele U, et al. Impact of pulse duration on Ho:YAG laser lithotripsy: fragmentation and dusting performance. World J Urol. 2015;33(4):471–7.
- Sroka R, Pongratz T, Scheib G, Khoder W, Stief CG, Herrmann T, et al. Impact of pulse duration on Ho:YAG laser lithotripsy: treatment aspects on the single-pulse level. World J Urol. 2015;33(4):479–85.
- Doizi S, Keller EX, De Coninck V, Traxer O. Dusting technique for lithotripsy: what does it mean? Nat Rev Urol [Internet]. 2018;15(11):653–4. Available from: http://dx.doi.org/10.1038/s41585-018-0042-9
- Moretto S, Quarà A, Zorzi F, Bravo-Balado A, Madden A, Cabrera J, et al. Stone dust in endourology: a systematic review of its definition, management, and clinical impact. BJU Int. 2025;1–13.
- Keller EX, De Coninck V, Doizi S, Daudon M, Traxer O. What is the exact definition of stone dust? An in vitro evaluation. European Urology Supplements [Internet]. 2019;18(1):e484. Available from: https://doi.org/10.1016/S1569-9056(19)30363-X
- Pietropaolo A, Jones P, Whitehurst L, Somani BK. Role of ‘dusting and pop-dusting’ using a high-powered (100 W) laser machine in the treatment of large stones (≥ 15 mm): prospective outcomes over 16 months. Urolithiasis [Internet]. 2019;47(4):391–4. Available from: http://dx.doi.org/10.1007/s00240-018-1076-4
- Aldoukhi AH, Roberts WW, Hall TL, Ghani KR. Holmium Laser Lithotripsy in the New Stone Age: Dust or Bust? Front Surg. 2017;4(September):1–6.
- Aldoukhi AH, Black KM, Ghani KR. Emerging Laser Techniques for the Management of Stones. Urologic Clinics of North America. 2019;46(2):193–205.
- Ibrahim A, Elhilali MM, Fahmy N, Carrier S, Andonian S. Double-Blinded Prospective Randomized Clinical Trial Comparing Regular and Moses Modes of Holmium Laser Lithotripsy. J Endourol. 2020;34(5):624–8.
- Elhilali MM, Badaan S, Ibrahim A, Andonian S. Use of the Moses Technology to Improve Holmium Laser Lithotripsy Outcomes: A Preclinical Study. J Endourol. 2017;31(6):598–604.
- Bozzini* G, Besana U, Calori A, Antonelli D, Chisena SA, Maltagliati M, et al. Pd23-01 “Virtualbasket” Ureteroscopic Holmium Laser Lithotripsy: Intraoperativa and Early Postoperative Outcomes. Journal of Urology. 2020;203(Supplement 4):2020.
- Morini* E, Sighinolfi MC, Beaptiste Roche J, Bozzini G, Romero Otero J, Inzillo R, et al. Mp69-01 “Vaportunnel” Ureteroscopic Holmium Laser Lithotripsy: Intraoperative and Early Postoperative Outcomes. Journal of Urology. 2020;203(Supplement 4):2020.
- Olympus OEHLPB. EMPOWER Laser Systems – Stabilization Mode. https://medical.olympusamerica.com/sites/default/files/us/files/pdf/Empower-Family-Brochure.pdf [Internet]. 2018; Available from: https://medical.olympusamerica.com/sites/default/files/us/files/pdf/Empower-Family-Brochure.pdf
- Corsini C. Is Pulse Modulation the Future of Laser Technology in Endourology: Evidence from a Literature Review – Section of EAU Endourology. Eur Urol Focus. 2024;
- Andreeva V, Vinarov A, Yaroslavsky I, Kovalenko A, Vybornov A, Rapoport L, et al. Preclinical comparison of superpulse thulium fiber laser and a holmium:YAG laser for lithotripsy. World J Urol [Internet]. 2020;38(2):497–503. Available from: https://doi.org/10.1007/s00345-019-02785-9
- Traxer O, Keller EX. Thulium fiber laser: the new player for kidney stone treatment? A comparison with Holmium:YAG laser. World J Urol [Internet]. 2020;38(8):1883–94. Available from: https://doi.org/10.1007/s00345-019-02654-5
- Blackmon RL, Irby PB, Fried NM. Comparison of holmium:YAG and thulium fiber laser lithotripsy: ablation thresholds, ablation rates, and retropulsion effects. J Biomed Opt. 2011;16(7):071403.
- Kronenberg P, Traxer O. The laser of the future: Reality and expectations about the new thulium fiber laser-a systematic review. Transl Androl Urol. 2019;8(Suppl 4):S398–417.
- Jackson SD, Lauto A. Diode-pumped fiber lasers: A new clinical tool? Lasers Surg Med. 2002;30(3):184–90.
- Uleri A, Farré A, Izquierdo P, Angerri O, Kanashiro A, Balaña J, et al. Thulium Fiber Laser Versus Holmium:Yttrium Aluminum Garnet for Lithotripsy: A Systematic Review and Meta-analysis. Eur Urol. 2024;85(6):529–40.
- Ventimiglia E, Robesti D, Bevilacqua L, Tondelli E, Oliva I, Orecchia L, et al. What to expect from the novel pulsed thulium:YAG laser? A systematic review of endourological applications. World J Urol [Internet]. 2023;41(11):3301–8. Available from: https://doi.org/10.1007/s00345-023-04580-z
- There W. Laser , Thulium : YAG . 2020;2:1165–7.
- Petzold R, Miernik A, Suarez-Ibarrola R. In Vitro Dusting Performance of a New Solid State Thulium Laser Compared to Holmium Laser Lithotripsy. J Endourol. 2021;35(2):221–5.
- Ventimiglia E, Villa L, Doizi S, Briganti A, Proietti S, Giusti G, et al. Laser Lithotripsy: The Importance of Peak Power and Pulse Modulation. Eur Urol Focus [Internet]. 2021;7(1):22–5. Available from: https://doi.org/10.1016/j.euf.2021.01.012
- Petzold R, Suarez-Ibarrola R, Miernik A. Gas Bubble Anatomy during Laser Lithotripsy: An Experimental in Vitro Study of a Pulsed Solid-State Tm:YAG and Ho:YAG Device. J Endourol. 2021;35(7):1051–7.
- Petzold R, Miernik A, Suarez-Ibarrola R. Retropulsion force in laser lithotripsy—an in vitro study comparing a Holmium device to a novel pulsed solid-state Thulium laser. World J Urol [Internet]. 2021;39(9):3651–6. Available from: https://doi.org/10.1007/s00345-021-03668-8
- Chicaud M, Kutchukian S, Berthe L, Corrales M, Solano C, Candela L, et al. In Vitro Comparison of Pulsed-Thulium:YAG, Holmium:YAG, and Thulium Fiber Laser. J Endourol. 2024;38(12):1427–35.
- Kwok JL, Ventimiglia E, De Coninck V, Corrales M, Sierra A, Panthier F, et al. Pulsed thulium:YAG laser—ready to dust all urinary stone composition types? Results from a PEARLS analysis. World J Urol [Internet]. 2023;41(10):2823–31. Available from: https://doi.org/10.1007/s00345-023-04549-y
- Chicaud M, Corrales M, Kutchukian S, Solano C, Candela L, Doizi S, et al. Thulium:YAG laser: a good compromise between holmium:YAG and thulium fiber laser for endoscopic lithotripsy? A narrative review. World J Urol [Internet]. 2023;41(12):3437–47. Available from: https://doi.org/10.1007/s00345-023-04679-3
- Geraghty RM, Jones P, Somani BK. Worldwide Trends of Urinary Stone Disease Treatment Over the Last Two Decades: A Systematic Review. J Endourol. 2017 Jun;31(6):547-556. doi: 10.1089/end.2016.0895. PMID: 28095709.
- Fernström I, Johansson B. Percutaneous pyelolithotomy. A new extraction technique. Scand J Urol Nephrol. 1976;10(3):257-9. doi: 10.1080/21681805.1976.11882084. PMID: 1006190.
- Labate G, Modi P, Timoney A, Cormio L, Zhang X, Louie M, Grabe M, Rosette On Behalf Of The Croes Pcnl Study Group J. The percutaneous nephrolithotomy global study: classification of complications. J Endourol. 2011 Aug;25(8):1275-80. doi: 10.1089/end.2011.0067. Epub 2011 Jul 13. PMID: 21751882.
- Kukreja R, Desai M, Patel S, Bapat S, Desai M. Factors affecting blood loss during percutaneous nephrolithotomy: prospective study. J Endourol. 2004 Oct;18(8):715-22. doi: 10.1089/end.2004.18.715. PMID: 15659890
- ElSheemy MS, Elmarakbi AA, Hytham M, Ibrahim H, Khadgi S, Al-Kandari AM. Mini vs standard percutaneous nephrolithotomy for renal stones: a comparative study. Urolithiasis. 2019 Apr;47(2):207-214. doi: 10.1007/s00240-018-1055-9. Epub 2018 Mar 16. PMID: 29549382
- Desai MR, Sharma R, Mishra S, Sabnis RB, Stief C, Bader M. Single-step percutaneous nephrolithotomy (microperc): the initial clinical report. J Urol. 2011 Jul;186(1):140-5. doi: 10.1016/j.juro.2011.03.029. Epub 2011 May 14. PMID: 21575966.
- Desai J, Zeng G, Zhao Z, Zhong W, Chen W, Wu W. A novel technique of ultra-mini-percutaneous nephrolithotomy: introduction and an initial experience for treatment of upper urinary calculi less than 2 cm. Biomed Res Int. 2013;2013:490793. doi: 10.1155/2013/490793. Epub 2013 Jul 24. PMID: 23984372; PMCID: PMC3741699.
- Liu Y, AlSmadi J, Zhu W, Liu Y, Wu W, Fan J, Lan Y, Lam W, Zhong W, Zeng G. Comparison of super-mini PCNL (SMP) versus Miniperc for stones larger than 2 cm: a propensity score-matching study. World J Urol. 2018 Jun;36(6):955-961. doi: 10.1007/s00345-018-2197-7. Epub 2018 Jan 31. PMID: 29387932.

