SÍNTOMAS DEL TRACTO URINARIO INFERIOR EN EL HOMBRE E HIPERPLASIA PROSTÁTICA BENIGNA
INTRODUCCIÓN Y NOMENCLATURA
Clásicamente, los síntomas urinarios bajos en el hombre se atribuían casi en forma exclusiva a la próstata y se agrupaban bajo el término “prostatismo”, clasificándolos en irritativos y obstructivos. No obstante, hoy se reconoce que estos síntomas no son exclusivos del sexo masculino, ni necesariamente derivan de la próstata o de una obstrucción del tracto de salida vesical. De hecho, dicha nomenclatura generaba una comprensión limitada de la fisiopatología y conllevaba resultados terapéuticos insatisfactorios (1).
Para abordar estas limitaciones, durante la International Consensus Conference on BPH realizada en Mónaco en 1995 se adoptó una nueva terminología de consenso, que ha sido revisada y actualizada en diversas guías y consensos posteriores, como los de la International Continence Society (ICS) y la European Association of Urology (EAU) (1-2). A continuación, se describen los principales términos y su significado:
- Síntomas del tracto urinario inferior (STUI) o Lower Urinary Tract Symptoms (LUTS): corresponden a manifestaciones relacionadas con el tracto urinario inferior, que pueden originarse en la vejiga, próstata, uretra, estructuras vecinas y/o piso pélvico adyacente. Incluso pueden ser referidos desde órganos con inervación compartida, como el ureter. Sus causas son igualmente variadas, incluyendo obstrucción del tracto de salida vesical, infección, neoplasia, litiasis, vejiga neurogénica, poliuria de causa renal, causas psicogénicas, uso de fármacos (2) entre otras.
- Síntomas de almacenamiento: son los LUTS que ocurren durante la fase de llenado de la vejiga, sustituyéndose la antigua denominación de “síntomas irritativos”, término que sugería la presencia de inflamación. Incluyen aumento de frecuencia miccional, nocturia, urgencia, incontinencia y alteraciones de la sensibilidad vesical, entre otros.
- Síntomas de vaciamiento: son los LUTS que ocurren durante la fase de vaciado vesical o micción, reemplazando la denominación de “síntomas obstructivos”. Esto se debe a que, en ocasiones, los síntomas se explican por hipoactividad del detrusor y no necesariamente por obstrucción. Comprenden el flujo miccional débil, latencia, disuria de esfuerzo, intermitencia, goteo terminal, retención de orina, entre otros.
- Síntomas postmiccionales: se presentan al finalizar la micción. Incluye la sensación de vaciamiento vesical incompleto y goteo post miccional.
- Hiperplasia prostática benigna (HPB): describe un patrón histológico característico de proliferación benigna del tejido prostático. Aunque está presente en 80% de los hombres mayores de 80 años (3), sólo la mitad de ellos tienen la próstata aumentada de volumen y sólo un 25% manifiestan LUTS.
- Crecimiento prostático benigno (CPB): hace referencia a la evidencia clínica o por imágenes de un aumento del volumen prostático, sin implicar un diagnóstico histopatológico.
- Obstrucción al tracto de salida vesical o Bladder Outlet Obstruction (BOO): es un diagnóstico urodinámico que indica una dificultad al vaciado vesical, caracterizado por un aumento anormal de presión del detrusor, asociado a una disminución significativa del flujo urinario. Sus causas pueden incluir estenosis de cuello vesical, hiperplasia de la próstata, estenosis uretral o de meato uretral, entre otras.
- Obstrucción prostática benigna: corresponde a la BOO causada específicamente por el crecimiento prostático benigno.
- Vejiga hiperactiva u Overactive Bladder (OAB): es el diagnóstico clínico de urgencia miccional, con o sin urgeincontinencia. Puede o no confirmarse mediante cistometría, evidenciando hiperactividad del detrusor.
- Hiperactividad del detrusor: diagnóstico urodinámico constatado por la presencia de contracciones involuntarias del detrusor durante la cistometría de llenado. Puede o no asociarse a manifestaciones clínicas como urgencia y urge-incontinencia.
EPIDEMIOLOGÍA DE LUTS
La prevalencia de los síntomas del tracto urinario inferior (LUTS) varía significativamente entre los estudios, reflejando diferencias en las metodologías y poblaciones analizadas. El estudio EPIC, con más de 19,000 participantes de cinco países, reportó que el 64.3% de los adultos presentó al menos un LUTS, siendo la nocturia el síntoma más frecuente en hombres (48.6%). Además, observó una prevalencia mayor de síntomas de almacenamiento (51.3%) frente a los de vaciado (25.7%), con un incremento en todas las categorías de síntomas conforme aumenta la edad (4).
El estudio BACH, realizado en una muestra representativa de 5,502 adultos en el área de Boston, encontró que la prevalencia de LUTS moderados a severos varía entre el 18.7% y 35%, dependiendo de la edad. También reportó que muchos LUTS son igual de prevalentes en hombres y mujeres, con síntomas como la frecuencia urinaria diurna y la urgencia más frecuentes en mujeres (5).
Estudios más recientes, como el de Agarwal et al. (6), analizaron una muestra poblacional de 3,727 personas en Finlandia, destacando que los síntomas de almacenamiento, como la urgencia urinaria y la incontinencia por urgencia, son percibidos como los más molestos a nivel individual. Por ejemplo, el 11.5% de los encuestados calificó la urgencia urinaria como severamente molesta.
Los LUTS tienen un impacto significativo en la calidad de vida, como lo demuestran diversos estudios poblacionales. El EpiLUTS Study (Coyne et al., 2009) evidenció que los LUTS severos afectan múltiples dimensiones del bienestar físico y mental, mientras que el Health Professionals Follow-up Study (Welch et al., 2002) encontró que estos pacientes experimentan niveles reducidos de energía y función emocional, comparables a otras condiciones crónicas como diabetes. Estudios posteriores han confirmado su impacto negativo en la productividad laboral y función sexual (7-10).
Múltiples factores de riesgo se han asociado al desarrollo y exacerbación de los LUTS, dentro de los cuales encontramos a la diabetes mellitus, enfermedad cardiovascular, síndrome metabólico, envejecimiento obesidad, sedentarismo y disfunción eréctil.
ETIOLOGÍA DE LOS LUTS
Como se discutió previamente, los LUTS carecen de especificidad, pudiendo ser la manifestación de una extensa variedad de patologías diferentes (ver gráfico 1) e incluso, en un mismo paciente, pueden coexistir más de una causa que expliquen los síntomas.
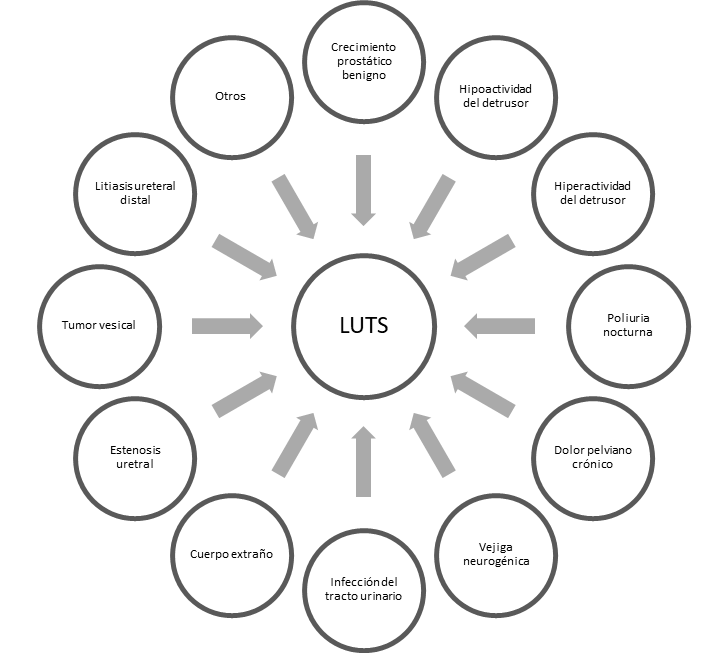
Gráfico 1: Etiología de LUTS (modificado de EAU Guidelines 2019)
El CPB tiene un conocido rol en el desarrollo y progresión de los LUTS, pero es muy probable que los factores que conducen al desarrollo de éste también tengan un impacto en otros aspectos de la función del tracto urinario inferior.
EPIDEMIOLOGÍA HPB
La HPB es una alteración frecuente en el hombre, cuya prevalencia aumenta junto con la edad. Si se considera la HPB histológica, su prevalencia crece desde un 8% en hombres entre 31 y 40 años, 40-50% entre 51 y 60 años, y sobre 80% en mayores de 80 años (7). El incremento en la expectativa de vida hace aún más importante esta condición del hombre mayor, desde el punto de vista epidemiológico. Tiene un impacto negativo significativo en la calidad de vida de las personas afectadas. La mortalidad es rara, estimándose en 0.5-1.5/100.000 para países desarrollados en los años 80, según la OMS (8). La historia familiar tiene significancia, ya que se ve más HPB en hombres cuyos padres tuvieron cirugía prostática antes de los 50 años (9). No hay estudios de prevalencia nacionales, pero en la actualidad representa la segunda causa de egresos hospitalarios por patología genitourinaria en hombres en Chile.
ETIOLOGÍA HPB
En la HPB se produce una proliferación benigna estromal (fibroblastos y miofibroblastos) y epitelial de la zona transicional. Este proceso inicia hacia la cuarta década de vida con la formación de pequeños nódulos hiperplásicos y experimenta un mayor desarrollo hacia la sexta década. Estos nódulos pueden generar grados variables de obstrucción infravesical.
La etiología de la HPB permanece parcialmente desconocida. Se ha propuesto la existencia de reactivación de procesos embrionarios, probablemente desencadenada por una combinación de factores como andrógenos, estrógenos, interacciones estromales-epiteliales, factores de crecimientos y neurotransmisores.
- Andrógenos: son necesarios para el crecimiento y desarrollo prostático, desempeñando un rol importante en la proliferación e inhibición de la apoptosis de células prostáticas. En individuos castrados previo a la pubertad y en pacientes con alteración de la producción de testosterona y falla de su receptor, no hay desarrollo de HPB. Sin embargo, los andrógenos solo tienen un rol permisivo en la HPB, ya que los niveles de andrógenos prostáticos no son significativamente diferentes entre tejido prostático hiperplásico y tejidos normales. Además, los hombres sometidos a terapia androgénica suplementaria no muestran una mayor incidencia de HPB (10-12).
- Estrógenos o desbalance andrógeno/estrógeno: podrían ser significativos, apoyados en dos observaciones.
- La relación testosterona/estradiol disminuye sostenidamente en el hombre envejeciendo (13).
- La modificación experimental de niveles de estradiol en animales puede producir HPB (14).
Adicionalmente, se ha observado una relación entre obesidad y HPB, que podría representar el desbalance estrógeno/testosterona visto en individuos obesos, resultante del aumento de la aromatización periférica de la testosterona.
- Inflamación: la inflamación prostática es una característica común de las próstatas adultas. Estudios in vivo e in vitro han identificado complejas redes de citoquinas y factores de crecimientos involucradas en la inflamación prostática. Este proceso inflamatorio lleva a daño tisular y un proceso de reparación crónico, que estimularía en forma persistente a las células prostáticas estromales y epiteliales (15).
La biopsia prostática de 8224 hombres participando del ensayo REDUCE (Reduction by Dutasteride of prostate Cancer Events) mostró inflamación en más de tres cuartos de las muestras. La inflamación también se correlacionó con progresión sintomática, riesgo de retención urinaria y necesidad de cirugía (16).
El origen de la inflamación prostática es probablemente multifactorial. Existe evidencia de reflujo urinario hacia los conductos prostáticos, colonización e infección bacteriana en muestras prostáticas quirúrgicas, aún con orina preoperatoria estéril. Otras causas de inflamación son mecanismos autoinmunes, stress oxidativo, constituyentes dietarios nocivos e inflamación sistémica asociada al síndrome metabólico (17).
- Síndrome metabólico: se ha asociado al desarrollo y progresión de HPB. Diversos estudios han identificado una correlación entre CPB e índice de masa corporal (18). Los mecanismos propuestos incluyen:
- Mayor tasa de aromatización de la testosterona.
- Inflamación tisular y estrés oxidativo asociados a la obesidad.
Otros estudios muestran que los hombres con HPB tienen mayor incidencia de diabetes mellitus que la población general y que se asocia con LUTS más severos (19).
FISIOPATOLOGÍA
El CPB genera un aumento de la resistencia uretral debido a un componente estático, asociado al aumento del volumen prostático, y un componente dinámico, relacionado con el incremento del tono del músculo liso prostático mediado por receptores adrenérgicos α-1. Es importante destacar que el tamaño prostático no siempre se correlaciona con la presencia de obstrucción, ya que otros factores, como el componente dinámico, las variaciones anatómicas del lóbulo medio y la rigidez de la cápsula prostática, tienen un papel relevante.
El aumento de la resistencia en el tracto de salida vesical induce una hipertrofia vesical compensadora, caracterizada por el engrosamiento del músculo detrusor y la acumulación de colágeno, lo que inicialmente permite un vaciado completo. Sin embargo, este proceso de compensación conlleva alteraciones celulares musculares y de la matriz extracelular que, con el tiempo, derivan en hiperactividad y alteración de la contractilidad vesical. Estas modificaciones, sumadas a los cambios propios de la edad en la vejiga y el sistema nervioso, contribuyen a la aparición de síntomas del tracto urinario inferior (LUTS).
Con el tiempo, este mecanismo compensador puede fallar, lo que se traduce en vaciamiento incompleto, residuo vesical significativo y dilatación vesical, con alteración irreversible de la capacidad contráctil.
Progresión y Factores de Riesgo
La duración de la fase de compensación es variable, donde la progresión de la enfermedad y de los síntomas asociados tiende a ser gradual, influenciada por factores como la edad, la severidad inicial de los síntomas, un flujo urinario máximo <10 ml/s, volumen prostático >30 ml y niveles de PSA >1.6 ng/ml (20).
El volumen prostático (VP) es quizás el factor más estudiado como factor de riesgo de progresión de la HPB. Los hombres con VP >30ml tienen 3,5 veces mayor probabilidad de tener síntomas moderados a severos, 2,5 veces de tener flujo disminuido y 3-4 veces mayor probabilidad de retención aguda de orina, respecto a los con VP <30ml (21).
Complicaciones
Las complicaciones asociadas al CPB incluyen infección urinaria, formación de litiasis vesical, hematuria, insuficiencia renal post-renal y retención urinaria aguda. Su frecuencia e impacto clínico dependen de la severidad de la obstrucción y del manejo oportuno de los síntomas.
EVALUACIÓN CLÍNICA
Como se comentó previamente el CPB se hace clínicamente relevante si se asocia a LUTS molestos. Sin embargo, no todos los hombres con CPB tienen LUTS, y algunos pacientes con LUTS no tienen CPB. La evaluación clínica tiene tres objetivos principales:
- Descartar diagnósticos diferenciales distintos al CPB en pacientes con LUTS
- Establecer la severidad de los síntomas.
- Identificar a los pacientes con riesgo de progresión rápida y de complicaciones, que pudieran beneficiase de un tratamiento precoz.
Historia
Busca identificar la presencia de causas potenciales de LUTS o factores que los puedan estar exacerbando, considerando causas médicas, quirúrgicas, neurológicas, farmacológicas, hábitos, etc.
Las guías EAU 2024 y AUA 2023 recomiendan el uso de un cuestionario estandarizado. El IPSS (International Prostate Symptom Score) permite definir severidad de los síntomas y evaluar respuesta al tratamiento, pero no tiene valor diagnóstico ni se correlaciona con grado de obstrucción. Este score consiste en siete preguntas sobre síntomas miccionales, que otorgan puntaje final de 0-35 y establecen categorías de sintomatología: 0-7 leve, 8-19 moderada, 20-35 severa. Una octava pregunta indaga sobre la calidad de vida. Puede ser autoaplicado o integrado a la consulta.
Las cartillas o diarios miccionales consisten en un registro detallado del horario y volumen de cada micción durante un período de 3 a 7 días. Son especialmente útiles en la evaluación de pacientes con nicturia y/o síntomas de almacenamiento.
Examen físico
Las guías EAU 2024 recomiendan incluir un examen físico como parte de una evaluación integral del paciente, abarcando la inspección abdominal, genital y el tacto rectal. Aunque el tacto rectal no tiene una buena correlación con el tamaño exacto de la próstata, puede ser útil para diferenciar entre próstatas mayores y menores de 50 g (22).
Por su parte, la guía AUA 2023 sugiere realizar un examen físico como un principio clínico general, sin emitir recomendaciones específicas sobre el uso del tacto rectal.
Además, se debe considerar la realización de un examen neurológico en pacientes seleccionados.
Laboratorio
Se recomienda realizar un estudio básico no invasivo en todos los pacientes, reservando estudios adicionales para casos con duda diagnóstica o previo a resolución quirúrgica.
Examen de orina:
Aunque no contribuye directamente al diagnóstico de CPB, es útil para descartar causas alternativas de LUTS, como infecciones urinarias, hematuria de origen no prostático, glucosuria y proteinuria. Las guías EAU 2024 y AUA 2023 recomiendan su inclusión rutinaria en la evaluación inicial del paciente con LUTS.
Antígeno prostático específico (APE):
En el contexto de estudio de LUTS, existen múltiples potenciales razones para solicitarlo. En primer lugar, como screening de cáncer de próstata (ver discusión en capitulo correspondiente). En segundo lugar, en ausencia de cáncer, el APE puede predecir el tamaño prostático. En este sentido, se han establecido puntos de corte que sugieren un volumen prostático superior a 40 ml: valores de APE >1.6 ng/ml, >2.0 ng/ml y >2.3 ng/ml para hombres con HPB y edades mayores de 50, 60 y 70 años, respectivamente23. Además, el APE predice el riesgo de cambio de sintomatología, calidad de vida, flujo máximo urinario, progresión clínica, riesgo de retención urinaria y necesidad de cirugía (23-26).
La guía EAU 2024 recomienda solicitarlo en paciente donde el diagnóstico de cáncer prostático modifica la conducta y en pacientes donde el APE ayude en la definición de tratamiento. La guía AUA 2023 no establece recomendación, sin embargo, si es utilizado para la toma de decisiones terapéuticas.
Evaluación de función renal:
el CPB no es por sí solo una causa primaria de enfermedad renal crónica (ERC). Sin embargo, la obstrucción del tracto urinario, retención urinaria recurrente o crónica y altos volúmenes residuales post-micción en aumento (PVR) incrementan el riesgo de disfunción renal. En estos pacientes, la hipertensión y la diabetes son factores más influyentes en la progresión de la ERC que el agrandamiento prostático. Las guías EUA 2024 recomiendan su evaluación en forma selectiva en pacientes considerados de riesgo. La guía AUA 2023 no establecen recomendación al respecto.
Uroflujometría:
Es un estudio no invasivo utilizado para evaluar la micción en pacientes con LUTS. Permite cuantificar el flujo urinario en función del tiempo, obteniendo los siguientes parámetros:
- Volumen miccional: se recomienda un volumen orinado mínimo de 150 mL para obtener mediciones más reproducibles.
- Flujo máximo (Qmax): su valor orienta sobre la posible obstrucción del tracto de salida vesical. Un Qmax <10 mL/s sugiere una “alta” probabilidad de obstrucción, con una especificidad del 70%, una sensibilidad del 47% y un valor predictivo positivo (VPP) del 70%.
Con un punto de corte de <15 mL/s, la sensibilidad aumenta al 82% y la especificidad desciende al 38%, con un VPP del 67%.
- Morfología de la curva: la forma de la curva (campana, meseta, intermitente, etc.) puede orientar sobre la etiología de la alteración del flujo. Una curva en “forma de campana” con un Qmax >15 mL/s se asocia a una micción considerada normal.
Sin embargo, es importante destacar que la uroflujometría, por sí sola, no permite establecer si la alteración del flujo es consecuencia a una obstrucción del tracto de salida vesical o a un déficit de contractilidad vesical. Además, un Qmax >15 mL/s no excluye la presencia de obstrucción, ya que los mecanismos compensadores pueden mantener flujos normales a pesar de la misma.
Las guías EAU 2024 recomiendan su medición inicial y antes de una intervención quirúrgica, mientras que las de la AUA 2023 la consideran opcional en el estudio inicial, pero lo recomienda previo a resolución quirúrgica.
A continuación, se muestran 3 ejemplos de UFM:

Fig. 1. UFM paciente sano

Fig. 2. UFM paciente en tratamiento por CPB.

Fig. 3. UFM paciente con estenosis uretral.
Orina residual postmicción (RPM):
Es un parámetro comúnmente evaluado en el estudio de LUTS y puede medirse de manera no invasiva mediante ecografía o de forma invasiva con cateterismo vesical. Su elevación puede deberse a una obstrucción del tracto de salida o una disfunción del detrusor. Sin embargo, no hay un consenso sobre el umbral que define un RPM patológico, habiéndose propuesto distintos puntos de corte, entre ellos: >50 ml, >200 ml y 10-20% de la capacidad funcional vesical. Alternativamente, se ha propuesto que la relación [RPM / capacidad vesical total] y la eficiencia de vaciamiento vesical ([volumen miccional/capacidad vesical total] × 100) podrían aportar mayor valor a la evaluación del RPM (27-28).
Existe limitada evidencia que respalde una relación directa entre un RPM elevado y complicaciones como retención aguda de orina, infecciones urinarias, la necesidad de cirugía y los resultados postquirúrgicos (29-30). Sin embargo, su monitorización en el tiempo podrías ser más útil, particularmente para la detección de pacientes en riesgo de retención aguda de orina y necesidad de cirugía.
En cuanto a su medición, las guías EAU 2024 recomiendan su medición, mientras que las de la AUA 2023 la consideran opcional.
Estudio flujo presión:
Si bien es el Gold Standard para el diagnóstico de obstrucción al tracto de salida, su uso se reserva para casos en que existe duda diagnóstica, ya que es un estudio invasivo y costoso.
Las guías EAU 2024 y AUA 2023 sugieren su realización en casos seleccionados.
Imágenes:
Evaluación de vía urinaria superior:
Dado que los pacientes con LUTS no presentan mayor frecuencia de alteraciones en vía urinaria superior (31), solo estaría recomendada en casos seleccionados.
La guía AUA 2023 no establece recomendación especifica. La guía EAU 2024 recomienda débilmente el uso de ecografía renal en pacientes con RPM elevado, hematuria e historia de urolitiasis.
Ecografía de pelvis:
La ecografía prostática tiene como objetivo principal determinar el volumen prostático, parámetro fundamental para decidir la modalidad terapéutica médica o quirúrgica. Puede realizarse por vía transabdominal o transrectal, siendo esta última más precisa. Estudios muestran que la ecografía transabdominal sobrestima en promedio un 55% el volumen prostático, mientras que la transrectal lo subestima solo en un 4.4% (32), siendo esta última considerada más confiable para decisiones quirúrgicas.
Además del volumen prostático, la ecografía permite evaluar:
- Índice de protrusión prostática (IPP): por vía transabdominal y con vejiga llena con 150 ml, se mide la distancia entre el cuello vesical y la cima del lóbulo medio prostático. Se categoriza como leve (<5 mm), moderado (5-10 mm) y severo (>10 mm). Se correlaciona significativamente con el riesgo de obstrucción infravesical, eficacia de la prueba miccional, riesgo de retención urinaria aguda y falla del tratamiento médico (33).
- Grosor de pared vesical y grosor de detrusor: aunque teóricamente útiles en la predicción de obstrucción infravesical, actualmente su medición carece de estandarización suficiente para ser recomendada rutinariamente.
- Además, es útil en la identificación de potenciales indicaciones quirúrgicas como la presencia de divertículos, cálculos vesicales y patología vesical asociada.
La Guía EAU 2024 recomienda de manera débil la realización de una ecografía en la evaluación inicial antes de iniciar tratamiento médico y con fuerte recomendación antes de cirugía. La guía AUA 2023 recomienda estudios imagenológicos previos al tratamiento quirúrgico.
Cistoscopía:
No se considera como un estudio de primera línea, pero en casos seleccionados permite obtener información relevante de la anatomía prostática (lóbulo medio, grado de obstrucción, distancia veru-cuello) y comorbilidades (estenosis uretral, cáncer vesical, divertículos y litiasis vesicales).
La guía EAU 2024 recomienda su uso previo al tratamiento quirúrgico si su realización generará un cambio en la conducta. La guía AUA 2023 establece la cistoscopía como una técnica alternativa para la medición del tamaño prostático previo a la resolución quirúrgica.
TRATAMIENTO
El tratamiento de los LUTS secundarios a hiperplasia prostática benigna abarca desde conducta expectante hasta tratamiento farmacológico y opciones quirúrgicas. La selección del tratamiento óptimo depende tanto de factores clínicos objetivos como de las preferencias del paciente, destacando la severidad de los síntomas, impacto de estos en su calidad de vida, función sexual, el riesgo de progresión y complicaciones asociadas.
La estratificación de pacientes según la severidad de síntomas establecida por el IPSS permite orientar el tratamiento. En pacientes con síntomas leves y con mínimo impacto sobre su calidad de vida, se recomienda conducta expectante con seguimiento clínico periódico. Aquellos con síntomas moderados o con afectación significativa de la calidad de vida deben iniciar modificaciones en su estilo de vida y tratamiento farmacológico, con ajustes progresivos según la respuesta clínica observada.
En pacientes que no experimentan mejoría suficiente con medidas conservadoras o farmacológicas, presentan intolerancia o efectos adversos al tratamiento médico, o buscan una solución más definitiva, debe considerarse la opción quirúrgica. Esta decisión deberá ser tomada mediante un proceso de toma de decisiones compartido, considerando tanto las indicaciones clínicas como la expectativa del paciente frente a los potenciales beneficios y riesgos asociados.
1) Observación:
La mayoría de los pacientes con LUTS leves a moderados, sin complicación y no muy molestos por sus síntomas o que no les ocasionan problemas en su calidad de vida, pueden ser manejados con observación vigilada. La distinción en categorías de IPSS establece severidad y permite detectar a los pacientes con riesgo de desarrollar complicaciones.
La observación evita el tratamiento en pacientes donde los síntomas permanecen estables o remiten en el tiempo. Aproximadamente 85% de los hombres en observación no progresan a un año de control, llegando a 65% a los 5 años.
Es importante considerar el RPM en este manejo terapéutico, ya que su incremento puede ser índice inicial de una vejiga en descompensación, pero aún poco sintomática.
Observación incluye:
- Información al paciente sobre los objetivos del seguimiento
- Tranquilizar, destacando ausencia de cáncer prostático
- Control periódico con UFM y RPM, IPSS y APE.
- Cambios de estilo de vida:
- Reducir líquidos cuando sea conveniente (antes de dormir o ir a lugares públicos).
- Evitar o moderar cafeína o alcohol.
- Micción relajada, sin apuro, o doble vaciado vesical.
- Ordeñe uretral final para evitar goteo post miccional.
- Técnicas de distracción, que ayuden a controlar síntomas de almacenamiento.
- Reeducación vesical, tratando de aumentar los intervalos intermiccionales.
- Revisión de medicamentos que afecten la micción; adecuación de dosis u horario.
- Advertencia sobre riesgo de empeoramiento de síntomas con el uso de anticolinérgicos, simpáticomimeticos, antidepresivos tricíclicos, etc.
- Corregir constipación, evitar permanencia prolongada en cama y estimular actividad física. Evitar sobrepeso.
- Evitar frío, stress, nerviosismo.
- Proveer asistencia cuando existan limitaciones a la movilidad, movilidad manual restringida o del estado mental.
2) Tratamiento médico
2.1) Bloqueadores adrenérgicos Alfa 1
Drogas disponibles: Actualmente, cinco bloqueadores de receptores alfa-1 de acción prolongada han sido aprobados para el tratamiento de la Hiperplasia Prostática Benigna (HPB): terazosina, doxazosina, tamsulosina, alfuzosina y silodosina [notar que silodosina puede no estar disponible en algunos países].
Mecanismo de acción y selectividad de receptores: Actúan corrigiendo el componente dinámico de la obstrucción a la salida de la vejiga a través de la inhibición del efecto de la noradrenalina en las células del músculo liso. Permiten la relajación del músculo liso en el cuello vesical, cápsula prostática y uretra prostática.
Existen tres subtipos de receptores alfa-1: 1A, 1B y 1D.
Terazosina, doxazosina y alfuzosina antagonizan los tres subtipos.
Tamsulosina muestra mayor selectividad por los subtipos 1A y 1D.
Silodosina se considera un antagonista más específico del receptor 1A.
El subtipo 1A representa alrededor del 70% de los adrenorreceptores en el tejido prostático, mientras que el 1B se ubica principalmente en el músculo liso vascular. El receptor 1D, menos abundante en la próstata, también se encuentra en el músculo detrusor de la vejiga y en la región sacra de la médula espinal.
Eficacia: Los bloqueadores alfa 1 (BA1) parecen tener una eficacia comparable entre sí, aunque existen pocos estudios que los comparen directamente. La evidencia disponible indica que estas drogas son más efectivas que el placebo, con una eficacia muy similar entre ellas. En hombres tratados, el puntaje de síntomas (IPSS) se reduce entre un 30 y 40%, mientras que el flujo urinario máximo aumenta entre un 20 y 25%. (34-35).
Los BA1 mejoran tanto los síntomas de almacenamiento como de vaciamiento del tracto urinario inferior. Estudios con seguimientos menores a un año muestran que su eficacia no se ve afectada por el tamaño prostático; sin embargo, a largo plazo, parecen ser más efectivos en próstatas pequeñas (≤40 ml). Es importante destacar que estas drogas no reducen el riesgo de retención aguda de orina ni la necesidad de cirugía prostática, aunque los beneficios en síntomas y flujo urinario se mantienen al menos durante los primeros cuatro años (36).
Tolerabilidad y seguridad: Los efectos adversos más frecuentes son la hipotensión ortostática y los mareos. Si bien la hipotensión puede ser beneficiosa en pacientes mayores con hipertensión, se recomienda un monitoreo cuidadoso. Tamsulosina, alfuzosina y silodosina presentan menor riesgo de hipotensión en comparación con doxazosina y terazosina.
Otros efectos secundarios incluyen congestión nasal y astenia. En cuanto a la función sexual, tamsulosina y silodosina pueden alterar la eyaculación. Un estudio demostró que la tamsulosina redujo el volumen del eyaculado en más del 90% de los pacientes, y un 35% presentó aneyaculación (37).
Un efecto adverso importante asociado al uso de BA1 es el síndrome del iris laxo intraoperatorio (SILI), descrito en el contexto de la cirugía de cataratas. Aunque este fenómeno ha sido observado con todos los alfa bloqueadores, se ha reportado con mayor frecuencia en pacientes tratados con tamsulosina. No está claro si esto se debe a un mayor riesgo intrínseco o simplemente a su uso más extendido. Por precaución, se recomienda evitar iniciar tratamiento con BA1 en pacientes con cirugía de cataratas programada, y considerar suspenderlo previamente, aunque no existe consenso respecto al tiempo ideal de suspensión (38).
Consideraciones prácticas: Los BA1 constituyen el tratamiento farmacológico de primera línea para hombres con síntomas del tracto urinario inferior (LUTS) secundarios a hiperplasia prostática benigna (HPB). Solo doxazosina y terazosina requieren ajuste de dosis al inicio del tratamiento, mientras que tamsulosina y alfuzosina no lo necesitan. Gracias a su rápido inicio de acción, en pacientes con síntomas intermitentes se puede considerar un esquema de tratamiento también intermitente.
Se recomienda usar en pacientes con LUTS moderados a severos.
2.2) Inhibidores de la 5-Alfa reductasa
Drogas disponibles: Actualmente existen dos inhibidores de la 5 alfa reductasa (I5AR) aprobados para el tratamiento de la hiperplasia prostática benigna (HPB): finasteride y dutasterida.
Mecanismo de acción: Estos fármacos actúan reduciendo el tamaño de la glándula prostática, con una mejoría clínica que suele evidenciarse tras 6 a 12 meses de tratamiento. La enzima 5 alfa reductasa convierte la testosterona en dihidrotestosterona (DHT), principal andrógeno responsable del crecimiento prostático. La isoenzima tipo 2 se encuentra principalmente en la próstata, folículos pilosos y tejidos sensibles a andrógenos, mientras que la tipo 1 predomina en hígado, piel y, en menor proporción, también en la próstata (39).
Finasteride inhibe selectivamente la isoenzima tipo 2, mientras que dutasteride bloquea ambas isoenzimas (tipo 1 y 2) con similar eficacia. Ambos fármacos inducen apoptosis de las células epiteliales prostáticas, lo que lleva a una reducción del volumen prostático entre un 15 y 25%, así como una disminución del antígeno prostático específico (APE) de aproximadamente 50% luego de 6 a 12 meses. Este efecto reductor puede intensificarse con tratamientos prolongados (40-41).
Eficacia: mejoría clínica comienza a observarse a partir de los 6 a 12 meses de tratamiento. Entre los 2 y 4 años de uso continuo, los I5AR logran una reducción del IPSS del 15 al 30%, una disminución del volumen prostático del 18 al 28% y un incremento del flujo urinario máximo de 1,5 a 2,0 ml/s (36-26). Su efecto es especialmente significativo en próstatas mayores de 40 ml, donde también se ha observado una reducción en la incidencia de hematuria macroscópica secundaria a HPB (en el caso de finasteride) (43).
Además, los I5AR disminuyen el riesgo a largo plazo (>1 año) de desarrollar retención urinaria aguda y de requerir cirugía prostática. Estos beneficios se manifiestan incluso en próstatas algo menores a 40 ml (26, 44-45).
Tolerabilidad y seguridad: Los principales efectos adversos son de índole sexual, incluyendo disminución de la libido, disfunción eréctil y alteraciones de la eyaculación (como eyaculación retrógrada, aneyaculación o reducción del volumen seminal). La incidencia de estos eventos varía entre un 4 y 13%, siendo más frecuentes durante el primer año de tratamiento y tendiendo a estabilizarse posteriormente (26, 41).
Consideraciones prácticas: Los I5AR están indicados principalmente en pacientes con LUTS moderados a severos y agrandamiento prostático clínicamente significativo. Dado su inicio de acción lento, se recomiendan como terapia a largo plazo. Es importante tener en cuenta su impacto sobre los niveles séricos de APE, especialmente al realizar tamizaje para cáncer de próstata.
Asimismo, se ha observado que estos fármacos podrían reducir el sangrado intraoperatorio durante la resección transuretral de la próstata, posiblemente debido a una disminución de la vascularización prostática. Su uso está especialmente indicado en pacientes con factores de riesgo de progresión de la enfermedad, como un volumen prostático mayor a 40 ml y APE superior a 1.4–1.6 ng/ml (36).
2.3) Antagonistas de receptores muscarínicos
Drogas disponibles: Las drogas antimuscarínicas aprobadas para el tratamiento de LUTS/OAB son: Oxibutinina, Solifenacina, Tolterodina, Cloruro de Trospio, darifenacina y fesoterodina [notar que silodosina puede no estar disponible en algunos países].
Mecanismo de acción: Los antimuscarínicos actúan bloqueando la acción de la acetilcolina en el sistema nervioso central y periférico, inhibiendo de forma competitiva sus receptores en las neuronas vesicales. Aunque se han identificado cinco subtipos de receptores colinérgicos en el músculo detrusor, los más relevantes son los subtipos M2 y M3. A pesar de que los receptores M2 predominan en la vejiga, los M3 son los principales responsables de la contracción del músculo detrusor.
Eficacia: Tanto la tolterodina como la fesoterodina han demostrado eficacia como monoterapia en hombres con síntomas de llenado vesical sin obstrucción al flujo urinario (47-48). Ensayos controlados con placebo han demostrado que la tolterodina reduce significativamente la urgeincontinencia y la frecuencia miccional. También se observó una reducción del tenesmo vesical asociado a la micción (49-50)
Aunque la nicturia, el tenesmo vesical y el IPSS se redujeron en la mayoría de los casos, estos parámetros no alcanzaron significación estadística en la mayor parte de los ensayos. Sin embargo, cuando el resultado del tratamiento se estratificó en función de la concentración de PSA (volumen prostático), tolterodina redujo significativamente la frecuencia diurna, la frecuencia miccional durante 24 horas y los síntomas de ocupación vesical en el IPSS en los varones con una concentración de APE inferior a 1,3 ng/ml, lo que indica que los hombres con próstatas más pequeñas podrían beneficiarse en mayor grado de los medicamentos antimuscarínicos (50).
Tolerabilidad y seguridad: En general, los antagonistas muscarínicos presentan buen perfil de tolerancia. Los efectos adversos más frecuentes son: sequedad de boca (16%), mareo (5%), estreñimiento (4%), infecciones respiratorias altas (3%) y dificultad miccional (2%). En pacientes sin obstrucción, el aumento del residuo post miccional (RPM) fue mínimo y comparable al placebo.
En hombres con obstrucción al flujo urinario, estos fármacos no se recomiendan por el riesgo teórico de disminuir la contractilidad vesical y provocar retención urinaria. Sin embargo, un estudio controlado de 12 semanas con tolterodina en pacientes con obstrucción leve a moderada mostró un aumento del RPM (49 vs. 16 ml) sin incremento en los episodios de retención urinaria aguda (3% en ambos grupos). Urodinámicamente, la tolterodina aumentó el volumen vesical antes de la primera contracción del detrusor y la capacidad cistométrica máxima, y redujo el índice de contractilidad vesical, sin alterar el flujo urinario máximo.
Consideraciones prácticas: Aunque la evidencia proviene mayoritariamente de estudios con tolterodina y fesoterodina en varones mayores con LUTS y síntomas de vejiga hiperactiva, es probable que otros antimuscarínicos presenten eficacia y perfiles de efectos adversos similares.
Las guías de la AUA recomiendan precaución con el uso de anticolinérgicos en pacientes con RPM mayor a 250–300 ml. Por su parte, las guías de la EAU sugieren su uso principalmente en pacientes con síntomas de almacenamiento y no en aquellos con RPM superior a 150 ml.
2.4) Inhibidores de la fosfodiesterasa 5
Drogas disponibles: Actualmente, existen tres inhibidores de la enzima fosfodiesterasa 5 (IPDE5) aprobados para el tratamiento de la disfunción eréctil: sildenafil, vardenafil y tadalafilo. Aunque los tres han sido incluidos en estudios clínicos para el tratamiento de los síntomas del tracto urinario inferior (LUTS) en hombres, únicamente el tadalafilo ha sido aprobado para su uso en pacientes con UOB secundaria a HPB.
Mecanismo de acción: Los IPDE5 aumentan la concentración intracelular de guanosín monofosfato cíclico (GMPc), prolongando su efecto fisiológico. Esto induce la relajación del músculo liso en el detrusor, la próstata y la uretra (51), contribuyendo a la mejoría de los LUTS. El tratamiento crónico con estos fármacos también podría mejorar la perfusión y oxigenación del tracto urinario inferior, así como reducir la inflamación crónica en la próstata y la vejiga (52). Sin embargo, el mecanismo exacto por el cual los IPDE5 ejercen su efecto sobre los LUTS aún no se comprende completamente.
Eficacia: Los inhibidores de la fosfodiesterasa tipo 5 (IPDE5) han demostrado una mejoría significativa de los síntomas del tracto urinario inferior (LUTS), tanto en la fase de almacenamiento como de vaciamiento, así como en la calidad de vida de los pacientes (53,54). Estudios controlados aleatorizados frente a placebo han evidenciado que todos los IPDE5 pueden reducir el puntaje del IPSS entre un 17 % y un 37 %, aunque sin cambios clínicamente relevantes en el flujo máximo (Qmax) en la mayoría de los casos (55). Cabe destacar que la magnitud de la mejoría sintomática medida por el IPSS es comparable a la obtenida con los bloqueadores α1, sin observarse diferencias significativas entre ambos grupos terapéuticos (56-59).
Tolerabilidad y seguridad: El uso de tadalafilo puede asociarse a efectos adversos como cefalea (2–3 %), dorsalgia, mareos y dispepsia. Está contraindicado en pacientes que utilizan nitritos, debido al riesgo de hipotensión severa. También se contraindica en hombres con enfermedades cardiovasculares, incluyendo infarto al miocardio en los últimos 90 días, angina inestable, insuficiencia cardíaca descompensada en los últimos seis meses, arritmias no controladas, hipotensión (<90/50 mm Hg), hipertensión no controlada y accidente cerebrovascular en los últimos seis meses (59).
Consideraciones prácticas: Actualmente, el uso diario de tadalafilo en dosis de 5 mg es el único IPDE5 aprobado para el tratamiento de los LUTS en hombres, con o sin disfunción eréctil. Los pacientes que más se benefician de esta terapia son hombres jóvenes, con bajo índice de masa corporal (IMC) y síntomas urinarios severos (55). No existe evidencia suficiente que permita evaluar su eficacia y tolerabilidad en tratamientos a largo plazo mayor de un año. Además, la información disponible sobre la reducción del volumen prostático es limitada y no existen datos concluyentes sobre su impacto en la progresión de la enfermedad.
2.5) Agonistas beta 3
Mecanismo de acción: Los receptores beta-3 adrenérgicos son los principales receptores presentes en el músculo liso del detrusor. Su estimulación favorece la relajación del detrusor durante la fase de llenado vesical, lo que incrementa la capacidad vesical y reduce la sensación de urgencia miccional, aunque el mecanismo exacto aún no se encuentra completamente dilucidado.
Eficacia: Mirabegron 50 mg es el primer agonista beta-3 (AB3) aprobado para el tratamiento de la vejiga hiperactiva (OAB). Su eficacia ha sido confirmada en múltiples ensayos clínicos aleatorizados con resultados favorables en la reducción de la frecuencia urinaria, urgencia, urgeincontinencia y nicturia (60-61). Un metaanálisis con más de 10.000 pacientes (27% hombres) mostró beneficios significativos frente a placebo y tolterodina, incluyendo aumento del volumen urinario evacuado y mejoría en la percepción del tratamiento (62). Otros estudios también han demostrado su efectividad en pacientes que ya estaban tomando alfa bloqueadores y que persistían con LUTS, sin verse afectado el vaciamiento vesical (63).
Tolerabilidad y seguridad: Mirabegron presenta un perfil de tolerabilidad y adherencia superior al de los antimuscarínicos, con menor incidencia de sequedad bucal y constipación (64). Los eventos adversos más frecuentes incluyen hipertensión arterial, infección del tracto urinario, cefalea y nasofaringitis (65-66). Debido a su potencial efecto hipertensivo, está contraindicado en pacientes con hipertensión arterial severa no controlada, recomendándose la monitorización periódica de la presión arterial durante el tratamiento. En varones con obstrucción confirmada, los estudios urodinámicos no evidenciaron deterioro en el Qmax ni en el volumen residual postmiccional (67). El incremento del PVR fue clínicamente insignificante y los casos de retención urinaria fueron infrecuentes (<1%) (68).
Consideraciones practicas: Aunque la mayoría de los estudios se han realizado en población femenina, existe evidencia que respalda el uso de mirabegron en hombres con síntomas del tracto urinario inferior (LUTS), especialmente cuando predominan los síntomas de almacenamiento. Su combinación con bloqueadores alfa, como la tamsulosina, no modifica el perfil de seguridad conocido (69). No obstante, aún se requieren estudios de mayor tamaño y específicamente diseñados para la población masculina a fin de consolidar esta evidencia.
Recomendaciones: Actualmente, se recomienda el uso de mirabegron en pacientes con síntomas del tracto urinario inferior (LUTS) de moderada a severa intensidad, cuando predominan los síntomas de almacenamiento, aunque con un grado de recomendación débil (70).
2.6) Terapia combinada: bloqueadores Alfa-1 con inhibidores de 5-Alfa reductasa
Drogas disponibles: La terapia combinada consiste en la administración conjunta de un BA1 y un I5AR. El efecto clínico del BA1 se manifiesta rápidamente (horas a días), proporcionando alivio sintomático precoz, mientras que el beneficio del I5AR aparece tras varios meses de tratamiento, debido a la reducción progresiva del volumen prostático.
Mecanismo de acción: El objetivo de la combinación es potenciar los beneficios de ambas clases farmacológicas: aliviar los síntomas de forma inmediata y, a largo plazo, prevenir la progresión de la enfermedad.
Eficacia: Varios estudios han evaluado la eficacia de la terapia combinada en comparación con la monoterapia con BA1, I5AR o placebo (71- 74). Los primeros ensayos, con seguimientos de 6 a 12 meses, demostraron que los BA1 eran superiores a finasteride como monoterapia para la reducción de los LUTS, y que la terapia combinada no era superior a la monoterapia con BA1(72).Posteriormente, estudios a largo plazo, como el MTOPS a 4 años (74) y el CombAT a 2 y 4 años (73), confirmaron los beneficios de la combinación. En el estudio CombAT, que incluyó pacientes de edad avanzada, con mayor volumen prostático y niveles elevados de APE, el tratamiento combinado fue superior a la monoterapia tanto en la reducción de síntomas como en la mejora del Qmax. Además, la combinación redujo de manera significativa el riesgo de RAO y la necesidad de cirugía.
Estudio CombAT (73): La combinación fue superior a cualquiera de las monoterapias en mejoría de síntomas y flujo urinario desde el noveno mes. Redujo el riesgo relativo de RAO en un 67,8%, la necesidad de cirugía en un 70,6% y la progresión de síntomas en un 41,3% en comparación con tamsulosina sola tras cuatro años de tratamiento.Estudio MTOPS (74): La combinación redujo el riesgo de progresión clínica en un 66% frente a placebo. Finasteride solo o combinado, disminuyó significativamente el riesgo de RAO y necesidad de cirugía a los 4 años.
Tolerabilidad y seguridad: La terapia combinada presenta una mayor frecuencia de efectos adversos en comparación con la monoterapia. Los efectos secundarios son los habituales de los BA1 y los I5AR, incluyendo mareos, hipotensión ortostática, disminución de la libido y disfunción eyaculatoria. La mayoría de los efectos adversos se presentan durante el primer año de tratamiento (74).
Consideraciones prácticas: La terapia combinada proporciona una mejoría superior de los síntomas del tracto urinario inferior, aumenta el Qmax y ofrece una mejor prevención de la progresión de la enfermedad en comparación con la monoterapia. No obstante, su uso se asocia a una mayor tasa de efectos adversos. Por ello, se recomienda reservar la terapia combinada para hombres con LUTS moderados a severos y riesgo de progresión de la enfermedad (mayor volumen prostático, PSA elevado, edad avanzada). Debe plantearse únicamente en contextos de tratamiento a largo plazo (más de 12 meses). En hombres con síntomas moderados, la suspensión del BA1 después de seis meses de combinación puede considerarse segura, siempre y cuando los síntomas permanezcan controlados.
2.7) Terapia combinada: bloqueadores Alfa-1 con antagonistas de receptores muscarínicos.
Drogas disponibles: Esta terapia combinada consiste en el uso de un alfa bloqueador en conjunto con un antimuscarínico. Sin embargo, no todas las combinaciones posibles han sido estudiadas en trabajos clínicos.
Mecanismo de acción: El tratamiento combinado con un alfa bloqueador y un antagonista de los receptores muscarínicos intenta antagonizar los receptores adrenérgicos alfa 1 y los receptores colinérgicos muscarínicos (M2 y M3) en las vías urinarias inferiores, de modo que se emplea la eficacia de ambos grupos terapéuticos para lograr efectos sinérgicos.
Eficacia: Ensayos clínicos y metaanálisis han demostrado que la terapia combinada con BA1 y antimuscarínicos ofrece una mejoría modesta en comparación con la monoterapia con BA1 o placebo. Se ha observado una reducción marginal en la frecuencia miccional, la nicturia, la urgencia urinaria y el puntaje del IPSS, junto con una minima mejoría, pero significativa en la calidad de vida (75).La adición de un antimuscarínico en hombres que presentan síntomas de almacenamiento persistentes a pesar del tratamiento con BA1 también ha evidenciado reducciones discretas en el número de micciones diarias, aunque se asocia a un mayor riesgo de efectos adversos (76).
Tolerabilidad y seguridad: Reacciones adversas de ambas drogas han sido reportadas en tratamiento combinado. El principal efecto adverso reportado en todos los trabajos usando terapia combinada fue la xerostomía. Algunos trabajos demostraron aumento en el RPM con el uso de terapia combinada sin ser clínicamente significativos. El riesgo de retención aguda de orina es bajo (77-78).
Consideraciones prácticas: La terapia combinada con BA1 y antimuscarínicos se recomienda cuando los síntomas de almacenamiento no se controlan de forma adecuada con BA1 en monoterapia. Durante este tratamiento, se sugiere evaluar el RPM para identificar un posible aumento o la presencia de retención urinaria, aunque el riesgo de retención urinaria aguda es bajo en hombres con un RPM inferior a 150 mL.
2.8) Terapia combinada: bloqueadores Alfa-1 con inhibidores de la fosfodiesterasa tipo 5.
Mecanismo de acción: La terapia combinada con BA1 e IPDE5 busca mejorar de forma más eficaz los LUTS. Esta combinación actúa de manera sinérgica, relajando el músculo liso del tracto urinario inferior y mejorando la función endotelial, lo que favorece tanto el vaciamiento vesical como la función eréctil.
Eficacia: Una revisión Cochrane como un metaanálisis de 55 estudios confirmaron que esta combinación ofrece mayores beneficios en la mejoría del IPSS que cualquier otra monoterapia o combinación terapéutica (79-80). Estudios prospectivos han validado estos hallazgos, mostrando mejoras en la calidad de vida, en el puntaje IIEF-5 y en el Qmax con el uso conjunto de IPDE5 y BA1(81-82).
Tolerabilidad y seguridad: No se han reportado eventos adversos graves asociados al uso combinado de IPDE5 y BA1. Los ensayos clínicos comparativos entre monoterapia y terapia combinada han mostrado una incidencia similar de efectos adversos en ambos grupos, lo que sugiere una buena tolerancia de la combinación (83).
Consideraciones prácticas: La combinación de BA1 y IPDE5, en comparación con la monoterapia con BA1, proporciona una mejoría superior en los LUTS, calidad de vida, función eréctil y el Qmax, sin aumentar la incidencia de efectos adversos. Los datos disponibles indican que los hombres más jóvenes, con bajo índice de masa corporal y LUTS más severos, podrían ser los que más se beneficien de esta asociación (55). No obstante, se requieren estudios con muestras más amplias y seguimientos a largo plazo para confirmar estos hallazgos.
2.9) Fitoterapia y extractos de plantas
Los productos fitoterapéuticos son un grupo heterogéneo de extractos de plantas que se utilizan para intentar mejorar los LUTS secundarios a HPB. Dentro de estos compuestos podemos mencionar Cucurbita pepo (pepas de calabaza), Hypoxis rooperi (patata silvestre africana), Pygeum africanum (corteza del ciruelo africano), Secale cereale (polen de centeno), Serenoa repens (Saw Palmetto) y Urtica dioica (raíces de la ortiga mayor).
El uso de la fitoterapia sigue siendo controversial debido a las diferentes concentraciones de principios activos presentes en distintas marcas del mismo producto. Por consiguiente, no parece que estén justificados metaanálisis de extractos de la misma planta y los resultados de estos análisis han de interpretarse con precaución.
El comité de guías clínicas europeas no emite recomendaciones específicas sobre la fitoterapia como tratamiento de LUTS en hombres debido a la heterogeneidad de los productos y los problemas metodológicos relacionados con los estudios publicados.
3) Tratamiento quirúrgico
Ya desde principios del siglo XX se describieron técnicas quirúrgicas para el manejo de la hiperplasia prostática, algunas de las cuales persisten hasta ahora como excelentes opciones de tratamiento.
Desde un principio el enfrentamiento fue mediante cirugía abierta (adenomectomia transvesical y/o transcapsular (técnica de Millin)84. Ambas tienen en común la enucleación completa del tejido hiperplásico, y sus resultados a largo plazo son de los mejores, con tasas de retratamiento por recidiva obstructiva menores al 1%.
Fue a contar de los años 30 que se van agregando técnicas endoscópicas gracias al desarrollo de la cistoscopía. Estas técnicas reemplazan la enucleación mediante cirugía abierta por la resección y coagulación del tejido. En principio utilizando energía eléctrica (resección transuretral de próstata monopolar y bipolar), a la cual se le agrega posteriormente la utilización de energía láser para vaporizar tejido. Se consigue de esta manera recuperación más rápida, menor sangrado y menor tiempo de uso de sonda uretral. Sin embargo, los resultados a largo plazo, principalmente en pacientes con próstatas grandes (mayores de 70 – 80cc) no eran los mejores dada la alta tasa de retratamiento por recidiva obstructiva.
En 1995 en Nueva Zelandia se comienzan a desarrollar técnicas de enucleación por vía endoscópica, las que permiten obtener los resultados a largo plazo de la cirugía abierta, pero con las ventajas de la vía endoscópica (ausencia de herida de piel, menos tiempo de uso de sonda y alta precoz). Son estas técnicas de enucleación endoscópica las que se han posicionado como nuevo Gold estándar para el manejo quirúrgico de la hiperplasia prostática benigna.
A continuación, se desarrollan las técnicas quirúrgicas más utilizadas, con una descripción general de sus resultados e indicaciones.
3.1) Adenomectomía abierta
Corresponde a la técnica más antigua descrita para el manejo de este cuadro, y que sigue plenamente vigente al día de hoy. Puede practicarse vía transvesical (descrita por Freyer) o vía retropúbica transcapsular (Millin). Tiene dentro de sus ventajas la simplicidad en su implementación (requiere instrumental básico para cirugía abierta) lo que le da su disponibilidad prácticamente universal (84-85). Sin embargo, su morbilidad elevada en comparación con las técnicas de enucleación endoscópicas la posicionan detrás de estas en las guías clínicas.
Indicaciones: Principalmente pacientes con volúmenes prostáticos mayores de 70 – 80 cc. En volúmenes menores, la Resección Trans Uretral (RTU) de próstata tiene ventajas en cuanto a la morbilidad perioperatoria y al requerimiento de sonda uretral.
También es posible resolver con estas técnicas la presencia de litiasis vesical, concomitante con la hiperplasia obstructiva.
Resultados: Sus resultados son de los mejores y suelen mantenerse a lo largo del tiempo (reducción de síntomas en 63 a 86%, aumento del flujo máximo en 375%, reducción de residuo postmiccional en 86 a 98%). Dentro de sus desventajas están la larga estadía postoperatoria (promedio 5,4 días), requerimiento prolongado de sonda uretral (4,1 a 4,4 días) y moderado riesgo de sangrado, con una tasa de transfusión de entre 6,8 y 8,2% de los pacientes operados (86-87).
3.2) RTU prostática monopolar y bipolar
Fue descrita en 1932 por Martin (88). Ampliamente enseñada en los programas de formación de urología, es prácticamente universal. Requiere cierto instrumental específico para esta técnica (óptica, resectoscopio, asa de resección, fuente de luz, idealmente cámara y monitor). Se acepta que los volúmenes tratables con esta técnica son entre 30 y 80 cc, pero el límite superior no está definido por estudios adecuados, y más bien corresponde a una opinión de expertos. A mayor volumen prostático, mayor es el riesgo de sangrado (tasa de transfusión de 2,9%) y de síndrome post RTU (dado por hemodilución e hiponatremia, secundarias a la absorción de agua libre al intravascular; afecta al 1% de los casos). Para disminuir este riesgo de complicaciones, y permitir abordar mayores volúmenes, se ha desarrollado la RTU con corriente bipolar.
Indicaciones: Permite tratar próstatas con volúmenes entre 30 y 70 a 80 cc (dependiendo de la habilidad del cirujano). Volúmenes mayores eventualmente podrían ser tratados con la misma técnica, pero los resultados a largo plazo podrían no ser los mejores.
Resultados: Ambas técnicas tienen una eficacia demostrada mediante metaanálisis, reduciendo en un 70% la sintomatología medida mediante escala de síntomas IPSS, y aumentando el flujo máximo en 125%, sin existir diferencias significativas entre ambas (70).
A largo plazo el riesgo de complicaciones incluye incontinencia urinaria (2,2%), retención urinaria, estenosis de cuello e infección urinaria (4,7%), estenosis uretral (3,8%), eyaculación retrógrada (65%) y disfunción eréctil (6,5%)(89-90).
3.3) Incisión prostática transuretral (Transurethral incision of the prostate -TUIP)
Descrita por Orandi en 1969, se considera la terapia de elección en caso de pacientes con LUTS refractarios a manejo médico, y con volumen prostático menor de 30 cc y sin lóbulo medio. Simple de realizar, consiste básicamente en practicar dos incisiones que van desde el cuello vesical hasta el veru montanum, llegando a plano capsular, sin resecar tejido alguno.
3.4) Cirugía prostática mediante láser
LASER (Ligth Amplification by Stimulated Emission of Radiation) es un tipo de energía que es absorbida por el tejido provocando aumento de temperatura, lo que provoca desde coagulación hasta evaporación del tejido. Esta absorción es mediada por un cromóforo (estructura química capaz de absorber una determinada frecuencia de luz, los más conocidos son la hemoglobina y el agua). El sistema más empleado en la Urología corresponde al láser de Neodimio-Itrio-Aluminio-Granate (Nd-YAG). Este es la base a la cual se le adicionan distintos cristales que permiten generar las distintas energías (cristal de Holmium, Thulium, Potasio titanyl fosfato (KTP), litio triborato (LBO).
3.4.1) Vaporización con láser verde:
Corresponde al láser de neodimio YAG al que se adiciona un cristal de KTP, o uno de LBO, lo que transforma la longitud de onda del Nd-YAG desde 1064 a 532 nm. Esto permite que sea absorbido por la hemoglobina, actuando como un cromóforo intracelular, y no por el agua. A la fecha está disponibles el láser verde de 180 W XPS (LBO).
La técnica habitual emplea fibras de disparo lateral, que permite aplicar la energía directamente sobre el tejido prostático a tratar generando vaporización. Esta técnica no reseca tejido, por lo que no hay muestra para anatomía patológica.
La evidencia mayor hasta la fecha compara RTUp con láser KTP 80 W, no encontrándose diferencias significativas en flujo máximo y mejoría de síntomas. Tiene una tasa de retratamiento de 7.7% a 5 años debido a recidiva obstructiva por adenoma91. Esta técnica permite tratar cualquier volumen prostático (en teoría), pero en volúmenes mayores de 80cc los resultados disminuyen a largo plazo92. Existe evidencia de menor tiempo de uso de sonda y de estadía hospitalaria en ablación con láser vs RTUp. También hay evidencia de la seguridad de su uso en pacientes en tratamiento anticoagulante (93-94).
3.4.2) Enucleación prostática mediante láser (EEP)
Así como la adenomectomía abierta, es posible enuclear el tejido prostático de la zona central, pero mediante procedimiento endoscópico. Técnica descrita en 1983 por Hiraoka (95). Fue hasta 1993 que se popularizó la enucleación endoscópica con la publicación de Fraundhorfer y Gilling, en que muestran sus resultados mediante enucleación endoscópica con uso de láser de holmium (96). Tras esto, el uso de otras plataformas de energía para enucleación endoscópica de próstata se fue ampliando, hasta encontrar en la actualidad publicaciones de enucleación endoscópica de próstata con láseres de Holmio, Tulio, Fibra de Tulio, Tulio pulsado, y Verde; y con uso de energía bipolar. Todas tienen en común la factibilidad de abordar próstatas de cualquier tamaño (incluso mayores de 80 cc), con resultados a largo plazo similares a la cirugía abierta, pero con menor morbilidad perioperatoria.
Holmium: Con una longitud de onda de 2140 nm, el láser de Holmium es un láser de entrega pulsada, cuyo cromóforo es el agua. Tiene una profundidad de penetración de 0.5 mm. Descrita por Gilling en 1993 (97), la enucleación prostática con láser de Holmium (HoLEP) ha acumulado evidencia que demuestra su seguridad para el tratamiento quirúrgico de la hiperplasia de próstata, independiente del tamaño de esta. Los elementos en contra de esta técnica son el mayor tiempo quirúrgico requerido (principalmente en los casos iniciales, que va disminuyendo notablemente según la experiencia del cirujano), la curva de aprendizaje (aproximadamente 30 casos) y la necesidad de equipamiento adecuado (láser, morcelador). En próstata grandes (mayores de 80 cc) la evidencia habla de resultados equivalentes a los obtenidos con cirugía abierta, pero con menos requerimiento de sonda uretral (22.5 horas vs 150 horas para cirugía abierta) y menor estadía hospitalaria (27.5 horas vs 196 horas para cirugía abierta). También la necesidad de transfusión se reduce desde 9.8% en cirugía abierta vs 0.84% en HoLEP (92).
Thulium: El láser de tulio (Tm: YAG) se introdujo en la cirugía urológica de tejidos blandos en 2005. Emite energía láser en forma de onda continua a una longitud de onda de 2013 nm. La enucleación endoscópica de próstata mediante láser de Thulium (ThuLEP) se introdujo en 2010 por Herrmann et al (98). Con similares resultados, la sensación intraoperatoria es que el láser de Thulium vaporiza más tejido al contacto, por lo que algunos cirujanos lo prefieren para hacer una técnica mixta de “vapoenucleación”.
Fibra de Thulium: Primeras publicaciones de este láser son relativamente recientes (2020). Es un láser pulsado que tiene algunas diferencias con respecto al laser de holmio, principalmente su capacidad de emisión de pulsos de energía muy baja (hasta 0.025 J), y tasas de repetición extremadamente altas (hasta 2000 Hz), junto a la posibilidad de uso de fibras más finas (150 µm). Estas ventajas le dan posiblemente mejor hemostasia que el láser holmio para enucleación prostática, pero su emisión del pulso tiene menor potencia pico (500 W vs 2000 W del holmio), lo que podría generar distintos efectos al momento de enuclear, preferido por algunos cirujanos y evitado por otros. Esto no determina diferencias en los resultados finales en pacientes sometidos a enucleación endoscópica de próstata (99-100).
Verde o Greenlight: Tradicionalmente utilizado para fotovaporización prostática, el láser verde se ha utilizado para enucleación prostática desde al año 2010, cuando Fernando Gómez Sancha publica sus resultados de una técnica mixta de vapoenucleación con láser verde, siguiendo luego con enucleación total y posteriormente con el desarrollo de enucleación prostática con técnica en bloque (en una pieza, sin incisiones intraprostáticas como las técnicas previamente desarrolladas) (101). Con resultados similares a la enucleación con Holmium, está dentro de las opciones para realizar enucleación endoscópica (102).
Enucleación prostática con energía bipolar: Con el desarrollo de enucleación con diferentes plataformas láser, el interés por buscar otras fuentes de energía llevó al desarrollo de enucleación con asa bipolar, publicada inicialmente en 2006. Comparada con la enucleación con láser de holmio, mostró resultados similares, con beneficios económicos evidentes al prescindir de equipamiento láser (103).
3.5) Técnicas emergentes
En la búsqueda de nuevas técnicas y equipamientos para manejar la hiperplasia prostática benigna, el foco se ha puesto en facilitar el aprendizaje (dado que las técnicas de enucleación endoscópica requieren un aprendizaje estimado de 30 casos), en ofrecer alternativas ambulatorias y de rápido reintegro laboral, y en posibilidad de preservación de eyaculación (aunque las técnicas endoscópicas permiten ciertas variaciones técnicas para preservar eyaculación, sus resultados suelen ser pobres).
Aquablation: Técnica desarrollada a partir de la utilización de una plataforma robótica (Procept Biorobotics), la ablación prostática mediante jet de agua es una técnica endoscópica, controlada mediante ultrasonido transrectal, en la cual una consola controla la emisión de jets de agua a altísima velocidad, que van destruyendo el tejido hiperplásico previamente diagramado en la consola. Tiene 2 ventajas principales: reproducibilidad, dado que es un procedimiento robotizado, está altamente estandarizado, con mínimo margen de error, controlado paso a paso por la consola encargada de emitir los jets de agua. Y es muy rápida, con tiempos promedios de 15 minutos desde la planificación ecográfica hasta la instalación de la sonda uretral (104-105).
Rezum: Aprobada por la FDA el 2015, la inyección intraprostática de vapor de agua (REZUM) consiste en la aplicación de pequeñas dosis controladas de vapor de agua a alta temperatura en puntos precisos del tejido prostático adenomatoso, que provoca en los siguientes días necrosis tisular con atrofia y disminución del volumen. Procedimiento ambulatorio, bajo sedación, tiene como principal ventaja la preservación de eyaculación en hasta un 95% de los pacientes tratados. El inconveniente es que requiere sonda uretral por al menos 3 días, dado el riesgo de retención urinaria post procedimiento. Apta para próstatas de hasta 80 – 90 cc, tiene una tasa de retratamiento a 5 años de 4%.
Urolift: Consiste en la aplicación de ganchos de nitinol por vía endoscópica, los que comprimen el tejido prostático desde la luz hacia la cápsula, otorgando un alivio inmediato de los síntomas obstructivos. Procedimiento ambulatorio, bajo sedación, usualmente sin requerimiento de sonda uretral, permite un inmediato retorno a actividades habituales. En todos los pacientes se mantiene eyaculación anterógrada. La mejoría de los parámetros obstructivos (síntomas y flujo máximo) alcanza al 50% de los valores pretratamiento.
COMENTARIOS:
Los mejores resultados quirúrgicos a largo plazo, en cuanto a mejoría de síntomas y grado de desobstrucción, son los obtenidos mediante cirugía abierta y la enucleación prostática mediante láser. Es la ENUCLEACIÓN del tejido hiperplásico lo que otorga ventaja por sobre el resto de las alternativas quirúrgicas. Esto está demostrado en volúmenes prostáticos mayores de 80 cc.
La tabla 1 muestra un resumen de artículos publicados que comparan técnicas aplicables en este grupo de pacientes (92).
| Técnica | Disminución APE (%) | Mejoría síntomas IPSS (puntos) | Mejoría
Qmáx (ml/seg) |
Horas de sonda uretral | Horas de hospitalización |
| Transvesical | 77,7 | -17,7 | 12,8 | 150 | 196 |
| EEP | 90 | -16 | 18,7 | 22,5 | 27,5 |
| Vaporización laser | 51,5 | -13,6 | 9,2 | 23,5 | 29,5 |
Tabla 1: Resultados a 1 año con 3 técnicas distintas, para próstatas mayores de 80 cc.
| Técnica | Tamaño prostático recomendado (cc) | Anestesia requerida | Horas de sonda uretral | Horas de hospitalización |
| Transvesical | Mayor de 80 | Espinal o general | 150 | 196 |
| Resección endoscópica | Menor de 80 | Espinal | 48 a 72 | 72 a 96 |
| Enucleación endoscópica | Independiente | Espinal o general | 22,5 | 27,5 |
| Vaporización laser | Menor de 80 | Espinal o general | 23,5 | 29,5 |
| Aquablation | Independiente | Espinal o general | 24 a 48 horas | 48 |
| Rezum | Menor de 80 (en estudio) | Local + sedación | 3 a 5 días | Ambulatorio |
| Urolift | Menor de 80 | Local + sedación | Sin sonda | Ambulatorio |
Tabla 2: Tamaño prostático recomendado, anestesia, uso de sonda y modalidad de ingreso de paciente para distintas técnicas quirúrgicas en hiperplasia prostática benigna
CONCLUSIÓN
Sin duda la hiperplasia prostática benigna es una de las patologías a las que con mayor frecuencia se ve enfrentado el urólogo. Los conocimientos de su fisiopatología, clínica y manejo tanto médico como quirúrgico, son pilar fundamental de nuestra práctica diaria.
Disponemos de nuevas alternativas terapéuticas farmacológicas y quirúrgicas. El conocimiento de la distribución de los receptores adrenérgicos y el descubrimiento de los bloqueadores apropiados, aunado a la inhibición de la utilización intracelular de la testosterona, significó un enorme avance en el manejo médico de la HPB. En la actualidad permite que pacientes que antes habrían debido someterse a una operación, convivan largamente con síntomas perfectamente tolerables, difiriendo e incluso evitando definitivamente una cirugía. Por otra parte, la creciente disponibilidad de láser, así como los buenos resultados y seguridad que ofrece su uso, lo posicionan en un lugar relevante dentro de las técnicas que perdurarán en el tiempo, así como lo hicieron la cirugía abierta y la RTUP.
Pese a los avances, técnicas de larga utilización como la cirugía abierta y la RTUP, han permitido durante décadas y hasta el presente, resolver prácticamente la totalidad de los casos. Seguirán siendo seguramente las más aplicadas, mientras que técnicas con uso de láser y nuevas tecnologías están cada vez más incorporadas a la práctica habitual.
En nuestra realidad local, como centro formador de nuevos especialistas, la incorporación de la EEP, en particular HoLEP, ya es rutinaria, constituyendo prácticamente la totalidad de la cirugía de hiperplasia prostática. Actualmente está incorporándose al currículum de los residentes de la especialidad, ya que estamos convencidos que es la técnica de elección y que los futuros urólogos deben dominarla.
BIBLIOGRAFIA
Abrams P, Cardozo L, Fall M, et al. The standardisation of terminology of lower urinary tract function: report from the Standardisation Sub-Committee of the International Continence Society. Neurourol Urodyn. 2002;21(2):167-178. PMID: 11857671
- Gratzke C, Bachmann A, Descazeaud A, et al. EAU guidelines on the assessment of non-neurogenic male lower urinary tract symptoms including benign prostatic obstruction. Eur Urol. 2015;67(6):1099-1109. PMID: 25530072
- Kok Bin Lim, Epidemiology of clinical benign prostatic hyperplasia, Asian Journal of Urology, Volume 4, Issue 3, 2017,Pages 148-151,ISSN 2214-3882.
- Debra E. Irwin, Ian Milsom, Steinar Hunskaar, Kate Reilly, Zoe Kopp, Sender Herschorn, Karin Coyne, Con Kelleher, Christian Hampel, Walter Artibani, Paul Abrams, Population-Based Survey of Urinary Incontinence, Overactive Bladder, and Other Lower Urinary Tract Symptoms in Five Countries: Results of the EPIC Study, European Urology, Volume 50, Issue 6, 2006, Pages 1306-1315.
- Kupelian V, Wei JT, O’Leary MP, Kusek JW, Litman HJ, Link CL, McKinlay JB; BACH Survery Investigators. Prevalence of lower urinary tract symptoms and effect on quality of life in a racially and ethnically diverse random sample: the Boston Area Community Health (BACH) Survey. Arch Intern Med. 2006 Nov 27;166(21):2381-7. doi: 10.1001/archinte.166.21.2381. PMID: 17130393.
- Agarwal, A., Eryuzlu, L., Cartwright, R., Thorlund, K., Tammela, T., Guyatt, G., Auvinen, A., & Tikkinen, K. (2014). What Is the Most Bothersome Lower Urinary Tract Symptom? Individual- and Population-level Perspectives for Both Men and Women. European Urology, 65, 1211 – 1217.
- Coyne, K., Wein, A., Tubaro, A., Sexton, C., Thompson, C., Kopp, Z., & Aiyer, L. (2009). The burden of lower urinary tract symptoms: evaluating the effect of LUTS on health‐related quality of life, anxiety and depression: EpiLUTS. BJU International, 103. https://doi.org/10.1111/j.1464-410X.2009.08371.x.
- Welch, G., Weinger, K., & Barry, M. (2002). Quality-of-life impact of lower urinary tract symptom severity: results from the Health Professionals Follow-up Study.. Urology, 59 2, 245-50 . https://doi.org/10.1016/S0090-4295(01)01506-0.
- Kim, T., Han, D., Ryu, D., & Lee, K. (2015). The Impact of Lower Urinary Tract Symptoms on Quality of Life, Work Productivity, Depressive Symptoms, and Sexuality in Korean Men Aged 40 Years and Older: A Population-Based Survey. International Neurourology Journal, 19, 120 – 129. https://doi.org/10.5213/inj.2015.19.2.120.
- Kannan, H., Radican, L., Turpin, R., & Bolge, S. (2009). Burden of illness associated with lower urinary tract symptoms including overactive bladder/urinary incontinence.. Urology, 74 1, 34-8.
- Fu, X., Wang, Y., Lu, Y., Liu, J., & Li, H. (2024). Association between metabolic syndrome and benign prostatic hyperplasia: The underlying molecular connection. Life Sciences. Disponible en: ScienceDirect.
- Silver, S. V., Tucker, K. J., Vickman, R. E., & Lanman, N. A. (2024). Characterization of prostate macrophage heterogeneity, foam cell markers, and CXCL17 upregulation in a mouse model of steroid hormone imbalance. Scientific Reports.
- Bélanger A, Candas B, Dupont A, et al. Changes in serum concentrations of conjugated and unconjugated steroids in 40- to 80-year-old men. J Clin Endocrinol Metab. 1994. doi:10.1210/jcem.79.4.7962278
- Coffey DS, Walsh PC. Clinical and experimental studies of benign prostatic hyperplasia. Urol Clin North Am. 1990.
- Russo GM and GI. Lower Urinary Tract Symptoms and Benign Prostatic Hyperplasia From Research to Bedside.; 2018
- Nickel JC, Roehrborn CG, O’Leary MP, Bostwick DG, Somerville MC, Rittmaster RS. The Relationship between Prostate Inflammation and Lower Urinary Tract Symptoms: Examination of Baseline Data from the REDUCE Trial. Eur Urol. 2008. doi:10.1016/j.eururo.2007.11.026
- De Marzo AM, Platz EA, Sutcliffe S, et al. Inflammation in prostate carcinogenesis. Nat Rev Cancer. 2007. doi:10.1038/nrc2090
- Giovannucci E, Rimm EB, Chute CG, et al. Obesity and benign prostatic hyperplasia. Am J Epidemiol. 1994. doi:10.1093/oxfordjournals.aje.a117206
- Hammarsten J, Högstedt B. Clinical, anthropometric, metabolic and insulin profile of men with fast annual growth rates of benign prostatic hyperplasia. Blood Press. 1999. doi:10.1080/080370599438365.
- Netto NR, Lopes De Lima M, Netto MR, Levi D’Ancona CA. Evaluation of patients with bladder outlet obstruction and mild international prostate symptom score followed up by watchful waiting. Urology. 1999. doi:10.1016/S0090-4295(98)00475-0
- Anderson JB, Roehrborn CG, Schalken JA, Emberton M. The progression of benign prostatic hyperplasia: Examining the evidence and determining the risk. Eur Urol. 2001. doi:10.1159/000052475
- Roehrborn CG, Girman CJ, Rhodes T, Hanson KA, Collins GN, Sech SM, Jacobsen SJ, Garraway WM, Lieber MM. Correlation between prostate size estimated by digital rectal examination and measured by transrectal ultrasound. Urology. 1997 Apr;49(4):548-57. doi: 10.1016/s0090-4295(97)00031-9. PMID: 9111624
- Roehrborn CG. Definition of at-risk patients: Baseline variables. BJU Int. 2006. doi:10.1111/j.1464-410X.2006.06098.x
- Roehrborn CG, Boyle P, Bergner D, et al. Serum prostate-specific antigen and prostate volume predict long-term changes in symptoms and flow rate: Results of a four-year, randomized trial comparing finasteride versus placebo. Urology. 1999. doi:10.1016/S0090-4295(99)00232-0
- Djavan B, Fong YK, Harik M, et al. Longitudinal study of men with mild symptoms of bladder outlet obstruction treated with watchful waiting for four years. Urology. 2004. doi:10.1016/j.urology.2004.08.049
- McConnell JD, Roehrborn CG, Bautista OM, et al. The Long-Term Effect of Doxazosin, Finasteride, and Combination Therapy on the Clinical Progression of Benign Prostatic Hyperplasia. N Engl J Med. 2003. doi:10.1056/NEJMoa030656
- Rubilotta, E., Balzarro, M., Trabacchin, N., Righetti, R., D’Amico, A., Blaivas, J., & Antonelli, A. (2021). Post-void residual urine ratio: A novel clinical approach to the post-void residual urine in the assessment of males with lower urinary tract symptoms. Investigative and Clinical Urology, 62, 470 – 476. https://doi.org/10.4111/icu.20200560
- Abrams, P. Bladder outlet obstruction index, bladder contractility index and bladder voiding efficiency: three simple indices to define bladder voiding function. BJU Int, 1999. 84: 14.
- Hecht SL, Hedges JC. Diagnostic Work-Up of Lower Urinary Tract Symptoms. Urol Clin North Am. 2016. doi:10.1016/j.ucl.2016.04.002
- Wasson JH, Reda DJ, Bruskewitz RC, Elinson J, Keller AM, Henderson WG. A comparison of transurethral surgery with watchful waiting for moderate symptoms of benign prostatic hyperplasia. N Engl J Med. 1995. doi:10.1056/NEJM199501123320202
- Koch WFRM, El Din KE, De Wildt MJAM, Debruyne FMJ, De La Rosette JJMCH. The outcome of renal ultrasound in the assessment of 556 consecutive patients with benign prostatic hyperplasia. J Urol. 1996. doi:10.1016/S0022-5347(01)66589-3
- Stravodimos KG, Petrolekas A, Kapetanakis T, et al. TRUS versus transabdominal ultrasound as a predictor of enucleated adenoma weight in patients with BPH: A tool for standard preoperative work-up? Int Urol Nephrol. 2009. doi:10.1007/s11255-009-9554-9
- Rieken M, Presicce F, Autorino R, Denunzio C. Clinical significance of intravesical prostatic protrusion in the management of benign prostatic enlargement: A systematic review and critical analysis of current evidence. Minerva Urol e Nefrol. 2017. doi:10.23736/S0393-2249.17.02828-4
- Djavan B, Chapple C, Milani S, Marberger M. State of the art on the efficacy and tolerability of alpha 1-adrenoceptor antagonists in patients with lower urinary tract symptoms suggestive of benign prostatic hyperplasia. Urology. 2004. doi:10.1016/j.urology.2004.07.031
- Michel MC, Mehlburger L, Bressel HU, Goepel M. Comparison of tamsulosin efficacy in subgroups of patients with lower urinary tract symptoms. Prostate Cancer Prostatic Dis. 1998. doi:10.1038/sj.pcan.4500267
- Roehrborn CG, Siami P, Barkin J, et al. The Effects of Combination Therapy with Dutasteride and Tamsulosin on Clinical Outcomes in Men with Symptomatic Benign Prostatic Hyperplasia: 4-Year Results from the CombAT Study. Eur Urol. 2010. doi:10.1016/j.eururo.2009.09.035
- Bapir, R., et al. Effect of alpha-adrenoceptor antagonists on sexual function. A systematic review and meta-analysis. Arch Ital Urol Androl, 2022. 94: 252.
- Chatziralli IP, Sergentanis TN. Risk factors for intraoperative floppy Iris syndrome: A meta-analysis. Ophthalmology. 2011. doi:10.1016/j.ophtha.2010.08.039
- Andriole G, Bruchovsky N, Chung LWK, et al. Dihydrotestosterone and the prostate: The scientific rationale for 5α-reductase inhibitors in the treatment of benign prostatic hyperplasia. J Urol. 2004. doi:10.1097/01.ju.0000139539.94828.29
- Rittmaster RS, Norman RW, Thomas LN, Rowden G. Evidence for atrophy and apoptosis in the prostates of men given finasteride. J Clin Endocrinol Metab. 1996. doi:10.1210/jcem.81.2.8636309
- Naslund MJ, Miner M. A review of the clinical efficacy and safety of 5α-reductase inhibitors for the enlarged prostate. Clin Ther. 2007. doi:10.1016/j.clinthera.2007.01.018
- Nickel JC, Gilling P, Tammela TL, Morrill B, Wilson TH, Rittmaster RS. Comparison of dutasteride and finasteride for treating benign prostatic hyperplasia: The Enlarged Prostate International Comparator Study (EPICS). BJU Int. 2011. doi:10.1111/j.1464-410X.2011.10195.x
- Donohue JF, Sharma H, Abraham R, Natalwala S, Thomas DR, Foster MC. Transurethral prostate resection and bleeding: A randomized, placebo controlled trial of the role of finasteride for decreasing operative blood loss. J Urol. 2002. doi:10.1016/S0022-5347(05)64287-5
- McConnell JD, Bruskewitz R, Walsh P, et al. The effect of finasteride on the risk of acute urinary retention and the need for surgical treatment among men with benign prostatic hyperplasia. N Engl J Med. 1998. doi:10.1056/NEJM199802263380901
- Tacklind J, Fink HA, Macdonald R, Rutks I, Wilt TJ. Finasteride for benign prostatic hyperplasia. Cochrane Database Syst Rev. 2010. doi:10.1002/14651858.CD006015.pub3
- Thompson IM, Goodman PJ, Tangen CM, et al. The influence of finasteride on the development of prostate cancer. N Engl J Med. 2003. doi:10.1056/NEJMoa030660
- Athanasopoulos A, Chapple C, Fowler C, et al. The role of antimuscarinics in the management of men with symptoms of overactive bladder associated with concomitant bladder outlet obstruction: An update. Eur Urol. 2011. doi:10.1016/j.eururo.2011.03.054
- Dmochowski R, Abrams P, Marschall-Kehrel D, Wang JT, Guan Z. Efficacy and Tolerability of Tolterodine Extended Release in Male and Female Patients with Overactive Bladder. Eur Urol. 2007. doi:10.1016/j.eururo.2006.10.005
- Chapple CR, Roehrborn CG. A shifted paradigm for the further understanding, evaluation, and treatment of lower urinary tract symptoms in men: Focus on the bladder. Eur Urol. 2006. doi:10.1016/j.eururo.2006.02.018
- Kaplan SA, Roehrborn CG, Abrams P, Chapple CR, Bavendam T, Guan Z. Antimuscarinics for treatment of storage lower urinary tract symptoms in men: A systematic review. Int J Clin Pract. 2011. doi:10.1111/j.1742-1241.2010.02611.x
- Giuliano, F., et al. The mechanism of action of phosphodiesterase type 5 inhibitors in the treatment of lower urinary tract symptoms related to benign prostatic hyperplasia. Eur Urol, 2013. 63: 506. https://pubmed.ncbi.nlm.nih.gov/2301816
- Vignozzi, L., et al. PDE5 inhibitors blunt inflammation in human BPH: a potential mechanism of action for PDE5 inhibitors in LUTS. Prostate, 2013. 73: 1391. https://pubmed.ncbi.nlm.nih.gov/23765639
- Sairam K, Kulinskaya E, McNicholas TA, Boustead GB, Hanbury DC. Sildenafil influences lower urinary tract symptoms. BJU Int. 2002. doi:10.1046/j.1464-410X.2002.03040.x
- Mulhall JP, Guhring P, Parker M, Hopps C. Assessment of the impact of sildenafil citrate on lower urinary tract symptoms in men with erectile dysfunction. J Sex Med. 2006. doi:10.1111/j.1743-6109.2006.00259.x
- Pattanaik, S., et al. Phosphodiesterase inhibitors for lower urinary tract symptoms consistent with benign prostatic hyperplasia. Cochrane Database Syst Rev, 2018. 11: CD010060. https://pubmed.ncbi.nlm.nih.gov/30480763
- Guo, B., et al. Comparative Effectiveness of Tadalafil versus Tamsulosin in Treating Lower Urinary Tract Symptoms Suggestive of Benign Prostate Hyperplasia: A Meta-Analysis of Randomized Controlled Trials. Med Sci Monit, 2020. 26: e923179. https://pubmed.ncbi.nlm.nih.gov/32327621
- Oelke M, Giuliano F, Mirone V, Xu L, Cox D, Viktrup L. Monotherapy with tadalafil or tamsulosin similarly improved lower urinary tract symptoms suggestive of benign prostatic hyperplasia in an international, randomised, parallel, placebo- controlled clinical trial. Eur Urol. 2012. doi:10.1016/j.eururo.2012.01.013
- Gacci M, Corona G, Salvi M, et al. A systematic review and meta-analysis on the use of phosphodiesterase 5 inhibitors alone or in combination with α- blockers for lower urinary tract symptoms due to benign prostatic hyperplasia. Eur Urol. 2012. doi:10.1016/j.eururo.2012.02.033
- EMA. Tadalafil Lilly : EPAR – Product Information. EMA, 2017. EMEA/H/C/004666 – R/0008.
- Chapple CR, Kaplan SA, Mitcheson D, et al. Randomized double-blind, active-controlled phase 3 study to assess 12-month safety and efficacy of mirabegron, a β3-adrenoceptor agonist, in overactive bladder. Eur Urol. 2013. doi:10.1016/j.eururo.2012.10.048
- Yamaguchi O, Marui E, Igawa Y, Takeda M, Nishizawa O, Ikeda Y OS. Efficacy and Safety of the Selective β3 -Adrenoceptor Agonist Mirabegron in Japanese Patients with Overactive Bladder: A Randomized, Double-Blind, Placebo-Controlled, Dose-Finding Study. Low Urin Tract Symptoms. 2015.
- Sebastianelli A, Russo GI, Kaplan SA, et al. Systematic review and meta- analysis on the efficacy and tolerability of mirabegron for the treatment of storage lower urinary tract symptoms/overactive bladder: Comparison with placebo and tolterodine. Int J Urol. 2018. doi:10.1111/iju.13498
- Matsuo T, Miyata Y, Kakoki K, et al. The efficacy of mirabegron additional therapy for lower urinary tract symptoms after treatment with α1-adrenergic receptor blocker monotherapy: Prospective analysis of elderly men. BMC Urol. 2016. doi:10.1186/s12894-016-0165-3
- C Chapple CR, Nazir J, Hakimi Z, et al. Persistence and Adherence with Mirabegron versus Antimuscarinic Agents in Patients with Overactive Bladder: A Retrospective Observational Study in UK Clinical Practice. Eur Urol. 2017. doi:10.1016/j.eururo.2017.01.037happle, C.R., et al.
- Randomized double-blind, active-controlled phase 3 study to assess 12-month safety and efficacy of mirabegron, a beta(3)-adrenoceptor agonist, in overactive bladder. Eur Urol, 2013. 63: 296. https://pubmed.ncbi.nlm.nih.gov/23195283
- Khullar, V., et al. Efficacy and tolerability of mirabegron, a beta(3)-adrenoceptor agonist, in patients with overactive bladder: results from a randomised European-Australian phase 3 trial. Eur Urol, 2013. 63: 283.
- Nitti, V.W., et al. Urodynamics and safety of the beta(3)-adrenoceptor agonist mirabegron in males with lower urinary tract symptoms and bladder outlet obstruction. J Urol, 2013. 190: 1320. https://pubmed.ncbi.nlm.nih.gov/23727415
- Herschorn, S., et al. Efficacy and safety of combinations of mirabegron and solifenacin compared with monotherapy and placebo in patients with overactive bladder (SYNERGY study). BJU Int, 2017. 120: 562. https://pubmed.ncbi.nlm.nih.gov/28418102
- Van Gelderen M, Tretter R, Meijer J, et al. Absence of clinically relevant cardiovascular interaction upon add-on of mirabegron or tamsulosin to an established tamsulosin or mirabegron treatment in healthy middle-aged to elderly men. Int J Clin Pharmacol Ther. 2014. doi:10.5414/CP201979
- EAU Guidelines. Edn. presented at the EAU Annual Congress Paris April 2024. ISBN 978-94-92671-23-3.
- Debruyne FMJ, Jardin A, Colloi D, et al. Sustained-release alfuzosin, finasteride and the combination of both in the treatment of benign prostatic hyperplasia. Eur Urol. 1998. doi:10.1159/000019706
- Kirby RS, Roehrborn C, Boyle P, et al. Efficacy and tolerability of doxazosin and finasteride, alone or in combination, in treatment of symptomatic benign prostatic hyperplasia: The Prospective European Doxazosin and Combination Therapy (PREDICT) trial. Urology. 2003. doi:10.1016/S0090-4295(02)02114-3
- Roehrborn CG, Siami P, Barkin J, et al. The Effects of Combination Therapy with Dutasteride and Tamsulosin on Clinical Outcomes in Men with Symptomatic Benign Prostatic Hyperplasia: 4-Year Results from the CombAT Study. Eur Urol. 2010. doi:10.1016/j.eururo.2009.09.035
- McConnell JD, Roehrborn CG, Bautista OM, et al. The Long-Term Effect of Doxazosin, Finasteride, and Combination Therapy on the Clinical Progression of Benign Prostatic Hyperplasia. N Engl J Med. 2003. doi:10.1056/NEJMoa030656
- Van Kerrebroeck, P., et al. Combination therapy with solifenacin and tamsulosin oral controlled absorption system in a single tablet for lower urinary tract symptoms in men: efficacy and safety results from the randomised controlled NEPTUNE trial. Eur Urol, 2013. 64: 1003. https://pubmed.ncbi.nlm.nih.gov/23932438
- Lenfant, L., et al. Role of Antimuscarinics Combined With Alpha-blockers in the Management of Urinary Storage Symptoms in Patients With Benign Prostatic Hyperplasia: An Updated Systematic Review and Meta-analysis. J Urol, 2023. 209: 314. https://pubmed.ncbi.nlm.nih.gov/36395428
- Athanasopoulos A, Chapple C, Fowler C, et al. The role of antimuscarinics in the management of men with symptoms of overactive bladder associated with concomitant bladder outlet obstruction: An update. Eur Urol. 2011. doi:10.1016/j.eururo.2011.03.054
- Kaplan SA, Roehrborn CG, Abrams P, Chapple CR, Bavendam T, Guan Z. Antimuscarinics for treatment of storage lower urinary tract symptoms in men: A systematic review. Int J Clin Pract. 2011. doi:10.1111/j.1742-1241.2010.02611.x
- Tu, Y.-K., et al. Combination alpha blocker and phosphodiesterase 5 inhibitor versus alpha-blocker monotherapy for lower urinary tract symptoms associated with benign prostate hyperplasia: A systematic review and meta-analysis. Urological Science, 2020. 31: 99.
- Fan, Z., et al. Comparative Efficacy of Different Drugs for Lower Urinary Tract Symptoms due to Benign Prostatic Hyperplasia: A Bayesian Network Meta-Analysis. Front Pharmacol, 2022. 13: 763184. https://pubmed.ncbi.nlm.nih.gov/35330833
- Sebastianelli, A., et al. Outcomes of combination therapy with daily tadalafil 5 mg plus tamsulosin 0.4 mg to treat lower urinary tract symptoms and erectile dysfunction in men with or without metabolic syndrome. Minerva Urol Nephrol, 2021. 73: 836.
- Nagasubramanian, S., et al. Tamsulosin and placebo vs tamsulosin and tadalafil in male lower urinary tract symptoms: a double-blinded, randomised controlled trial. BJU Int, 2020. 125: 718.
- Chen, P.-C., et al. Combination alpha blocker and phosphodiesterase 5 inhibitor versus alpha-blocker monotherapy for lower urinary tract symptoms associated with benign prostate hyperplasia: A systematic review and meta-analysis. Urological Science, 2020. 31: 99.
- Millin T. RETROPUBIC PROSTATECTOMY A NEW EXTRAVESICAL TECHNIQUE. REPORT ON 20 CASES. Lancet. 1945. doi:10.1016/S0140-6736(45)91030-0
- Freyer PJ. TOTAL ENUCLEATION OF THE PROSTATE: A FURTHER SERIES OF 550 CASES OF THE OPERATION. BMJ. 1919. doi:10.1136/bmj.1.3031.121
- Serretta V, Morgia G, Fondacaro L, et al. Open prostatectomy for benign prostatic enlargement in southern Europe in the late 1990s: A contemporary series of 1800 interventions. Urology. 2002. doi:10.1016/S0090-4295(02)01860-5
- Naspro R, Suardi N, Salonia A, et al. Holmium Laser Enucleation of the Prostate Versus Open Prostatectomy for Prostates >70 g: 24-Month Follow-up. Eur Urol. 2006;50(3):563-568. doi:10.1016/j.eururo.2006.04.003
- Martin HW. Cysto-Urethroscopic Resection of the Prostate. Cal West Med. 1932.
- Mamoulakis C, Ubbink DT, de la Rosette JJMCH. Bipolar versus Monopolar Transurethral Resection of the Prostate: A Systematic Review and Meta-analysis of Randomized Controlled Trials. Eur Urol. 2009. doi:10.1016/j.eururo.2009.06.037
- Geavlete B, Georgescu D, Multescu R, Stanescu F, Jecu M, Geavlete P. Bipolar plasma vaporization vs monopolar and bipolar TURPA prospective, randomized, long-term comparison. Urology. 2011. doi:10.1016/j.urology.2011.03.072
- Hai MA. Photoselective Vaporization of Prostate: Five-year Outcomes of Entire Clinic Patient Population. Urology. 2009. doi:10.1016/j.urology.2008.08.502
- Sáez ID. Best surgical treatment for very large benign prostatic obstruction. World J Clin Urol. 2014;3(3):370. doi:10.5410/wjcu.v3.i3.370
- Sandhu JS, Ng CK, Gonzalez RR, Kaplan SA, Te AE. Photoselective laser vaporization prostatectomy in men receiving anticoagulants. J Endourol. 2005. doi:10.1089/end.2005.19.1196
- Chung DE, Wysock JS, Lee RK, Melamed SR, Kaplan SA, Te AE. Outcomes and complications after 532 nm laser prostatectomy in anticoagulated patients with benign prostatic hyperplasia. J Urol. 2011. doi:10.1016/j.juro.2011.04.068
- Hiraoka Y. A new method of prostatectomy, transurethral detachment and resection of benign prostatic hyperplasia. J Nippon Med Sch. 1983;50(6):896-898. doi:10.1272/jnms1923.50.896
- Fraundorfer MR, Gilling PJ. Holmium:YAG laser enucleation of the prostate combined with mechanical morcellation: Preliminary results. Eur Urol. 1998. doi:10.1159/000019535
- Gilling PJ, Cass CB, Cresswell MD, Fraundorfer MR. Holmium laser resection of the prostate: Preliminary results of a new method for the treatment of benign prostatic hyperplasia. Urology. 1996. doi:10.1016/S0090-4295(99)80381-1
- Herrmann TRW, Bach T, Imkamp F, et al. Thulium laser enucleation of the prostate (ThuLEP): transurethral anatomical prostatectomy with laser support. Introduction of a novel technique for the treatment of benign prostatic obstruction. World J Urol. 2010;28(1):45-51. doi:10.1007/s00345-009-0503-0
- Ledezma et al, Rev. SCHU 2022; 87 (4): 46- 47).
- Morozov et al, J Endourol 2020
- Gomez Sancha F. V44 GREENLEP, GREENLIGHT LASER ENUCLEATION OF THE PROSTATE. Eur Urol Suppl. 2010. doi:10.1016/s1569-9056(10)61081-0
- Huet R, Baron M, Nouhaud F-X, et al. PD27-04 ENDOSCOPIC ENUCLEATION OF THE PROSTATE USING 532NM GREEN LASER (GREENLEP) COMPARED TO HOLMIUM LASER SYSTEM (HOLEP): MULTICENTER EVALUATION OF THE LEARNING CURVE IN THE SURGICAL TREATMENT OF BENIGN PROSTATE OBSTRUCTION. J Urol. 2017. doi:10.1016/j.juro.2017.02.1225
- Neill MG, Gilling PJ, Kennett KM, et al. Randomized trial comparing holmium laser enucleation of prostate with plasmakinetic enucleation of prostate for treatment of benign prostatic hyperplasia. Urology. 2006. doi:10.1016/j.urology.2006.06.021
- Gilling P, Reuther R, Kahokehr A, Fraundorfer M. Aquablation – Image-guided robot-assisted waterjet ablation of the prostate: Initial clinical experience. BJU Int. 2016. doi:10.1111/bju.13358
- Hwang EC, Jung JH, Borofsky M, Kim MH, Dahm P. Aquablation of the prostate for the treatment of lower urinary tract symptoms in men with benign prostatic hyperplasia. Cochrane Database Syst Rev. 2019. doi:10.1002/14651858.CD013143.pub2

