ANATOMÍA FUNCIONAL Y FISIOLOGÍA DEL TRACTO URINARIO INFERIOR
El tracto urinario inferior, cuya función es el almacenamiento y la eliminación de la orina, está compuesto por dos elementos funcionales: vejiga y uretra, con sus mecanismos esfinterianos.
La vejiga consta de múltiples fibras de músculo liso o detrusor, cubierto externamente por adventicia y serosa en el fondo vesical, y recubierto internamente por submucosa y epitelio transicional. Dicha estructura le permite distenderse hasta cuatro veces su tamaño de reposo sin aumentar la tensión lineal. Esto para cumplir con la tarea de acumular volúmenes progresivos de orina, manteniendo una baja presión de llene, hasta que sea un momento adecuado para orinar[1], [2].
La uretra es una estructura tubular, de aproximadamente 3 cm de largo en la mujer y 18 cm en el hombre, cuya estructura varía según el nivel estudiado, pero, en general, consta de los siguientes elementos: una capa externa de músculo estriado (llamada también esfínter urogenital), una capa intermedia de músculo liso que se continúa con las fibras vesicales y se distribuyen de forma longitudinal (las fibras más internas) y circular (las fibras más externas), además de una submucosa y mucosa.
La uretra femenina se encuentra en estrecha relación con la pared anterior de la vagina. Por una parte, la uretra proximal y media, con mayor movilidad, es fácilmente separable de la vagina mientras que, en la uretra distal, más fija, ambas estructuras se funden. La uretra masculina se origina en la vejiga, atraviesa la glándula prostática y después de cruzar el piso pélvico y el periné corre a lo largo de toda la longitud del pene, terminando en el meato uretral. La membrana perineal, o aponeurosis perineal media, divide la uretra masculina en anterior y posterior. La uretra posterior está formada por el segmento que se extiende desde el cuello de la vejiga hasta el esfínter uretral externo y comprende la uretra prostática y la uretra membranosa. La uretra anterior se extiende desde la porción distal del esfínter uretral externo hasta el meato urinario y se divide en uretra bulbar, peneana y fosa navicular[1], [3].
Ciclo miccional
Si bien los fenómenos fisiológicos que permiten mantener tanto la continencia como la micción en el ser humano son complejos y no del todo conocidos aún, el ciclo miccional proporciona un concepto simple y esquemático que orienta a su comprensión y nos permite una aproximación clínica. Este consta de dos fases que son continencia y micción, cuyas principales características describimos a continuación:
Fase de continencia: Corresponde a más del 99% del tiempo y está determinada por la relajación de la vejiga y la contracción de la uretra, y los mecanismos de continencia anexos a ella (cuello vesical y esfínter estriado). El fenómeno, llamado acomodación, permite que los volúmenes progresivos de orina en la vejiga no repercutan en un significativo aumento de presión de la misma, lo que se debe en gran parte a las propiedades viscoelásticas de la vejiga. Además, durante esta etapa del ciclo existe una constante información al sistema nervioso central respecto al volumen intravesical. Esto permite el desarrollo de reflejos fisiológicos que evitan el escape involuntario de orina, como el reflejo guardián, que aumenta el tono del esfínter estriado en relación al aumento del volumen vesical.
Fase de micción: Temporalmente abarca menos del 1% del ciclo y se caracteriza por la relajación de la uretra y sus mecanismos anexos, y la simultánea contracción del detrusor. Junto con la acción de la gravedad y la sumatoria de la presión intraabdominal, determinan una diferencia de presiones que permite la eliminación de la orina. Esta coordinación está determinada a nivel del sistema nervioso central (SNC) y su ejecución está a cargo del sistema nervioso periférico.
Describiremos brevemente la participación de cada uno (Figura 1)[4]
Sistema nervioso central: Consta de 3 principales centros de control.
Corteza cerebral: A nivel de la corteza del lóbulo frontal encontramos la primera zona de control, de predominio inhibitorio (promueve la continencia), que permite integrar los ámbitos emotivos y sociales a la “decisión de orinar”.
Tronco encefálico: El “centro pontino” de la micción, que son en realidad varios núcleos funcionales integrados. Tiene en global un rol efector (promueve la micción) y también determina la información aferente que logra ascender hasta el encéfalo respecto al volumen vesical.
Los núcleos medulares: Dan origen a los nervios periféricos y su principal función es facilitar y ejecutar el reflejo miccional.
Sistema nervioso periférico: Ejecuta reflejos que permiten la coordinación del almacenado y vaciado de la vejiga a través de los nervios somáticos y nervios autonómicos tanto simpáticos como parasimpáticos.
Los nervios somáticos se originan en los centros medulares a nivel sacro (raíces dorsales de S2 a S4). Sus neuronas transcurren por el nervio pudendo y utilizan el neurotransmisor acetilcolina para estimular los receptores nicotínicos presentes en el esfínter externo. Su principal rol radica en contraer la musculatura estriada, aumentando la presión uretral y promoviendo la continencia. Sus fibras sensitivas entregan información al SNC respecto al cuello vesical y la uretra.
Los nervios autonómicos simpáticos se originan en la médula a nivel toracolumbar (raíz dorsal de T10 a L2). Sus neuronas, posterior a las sinapsis que se realizan principalmente en la cadena paravertebral, transcurren por el nervio hipogástrico y utilizan el neurotransmisor noradrenalina para estimular los receptores alfa a nivel del cuello vesical y esfínter uretral interno, gatillando su contracción y beta a nivel del cuerpo de la vejiga promoviendo su relajación. Este fenómeno es esencial durante la fase de continencia. Las aferencias del nervio hipogástrico, por otro lado, contribuyen a la sensación de llene vesical.
Los nervios autonómicos parasimpáticos nacen desde la médula a nivel sacro (raíz dorsal de S2 a S4), viajan por el nervio pélvico y establecen sinapsis en su mayoría, con los ganglios intramurales de vejiga y uretra. Las neuronas eferentes postganglionares liberan principalmente acetilcolina, que estimula receptores muscarínicos y a través de estos la contracción de las fibras del detrusor. También liberan óxido nítrico, cuyo efecto directo es la relajación de la musculatura uretral. De similar forma, el nervio pélvico es la principal ruta de información aferente con relación a la distención vesical.[5]
Pared Vesical: La pared y mucosa vesical forman un complejo sistema regulado por funciones y señales endocrinas, paracrinas, neurológicas y hormonales. A manera de ejemplo podemos destacar que la distensión del detrusor produce ATP que al unirse al receptor purinérgico P2X2/3 genera contracción muscular, estimulando el vaciado vesical.[5] Así mismo el urotelio genera distintos mediadores tanto inhibidores de la contracción del detrusor, por ejemplo, PGD2 [6], [7] y posee receptores excitatorios, que interactúan con sustancias como ATP y pueden ser inhibidos por, vanilloides (capsaicina) y resiniferatoxina[6] [7], [8]. La lámina propia es también metabólicamente activa, generando mediadores que han hecho que se plantee la posibilidad de que actúe como un centro de control entre la mucosa y el detrusor.[8]
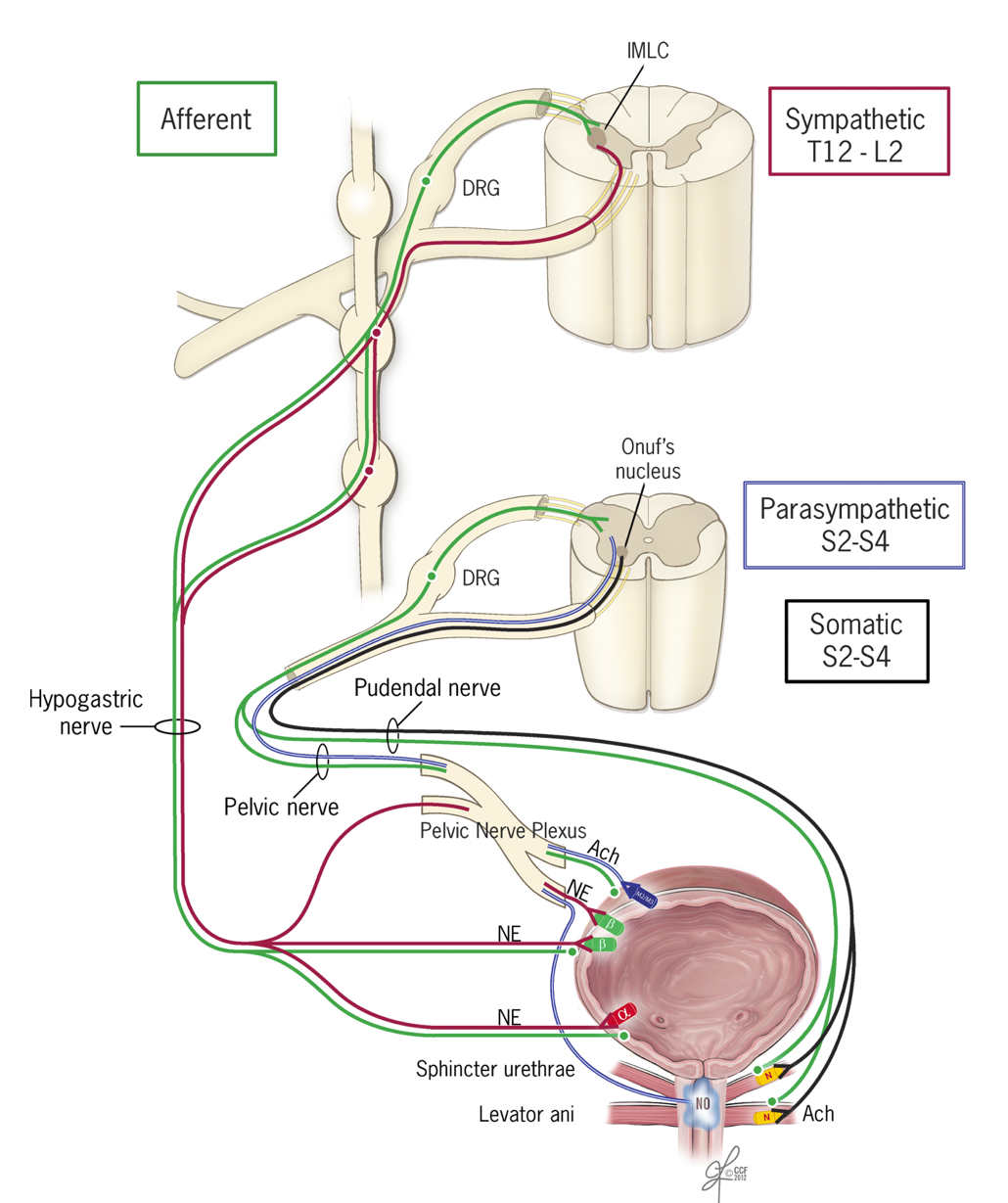
Fig. 1. Principales rutas de control neurológico del ciclo miccional[9].
MECANISMOS DE SOPORTE DE LA VEJIGA Y URETRA
La posición de la vejiga y de la uretra depende de sus conexiones con otras estructuras, órganos, fascias y ligamentos, y a través de estas con la pelvis ósea. Este soporte determina tanto su morfología como su función (6). Los principales elementos que determinan el soporte del tracto urinario inferior corresponden a (Figura 2):
Fascia endopélvica: Amplio y complejo sistema de tejido conectivo que tiene zonas más laxas y zonas más fibrosas llamadas ligamentos, dentro de los que destacan los ligamentos cardinales y uterosacros. Esta estructura compleja se sostiene mediante su unión a las paredes laterales de la pelvis a nivel del arco tendíneo de la fascia endopélvica. Sus principales zonas funcionales corresponden a (7):
Parametrio, que le da suspensión al útero y ha sido denominado nivel I de De Lancey.
Paracolpo, que permite la fijación lateral que sostiene vagina, vejiga y recto y corresponde al nivel II de De Lancey. La porción de la fascia endopélvica que se denomina fascia pubocervical, o vésico vaginal, es la principal encargada del soporte de la vejiga. Sus lesiones se asocian a la aparición de prolapso genital del compartimiento anterior (cistocele) y a algunas disfunciones vesicales como hiperactividad idiopática del detrusor.
Nivel de fusión, que da soporte a la uretra, cuya disfunción causa la incontinencia urinaria de esfuerzos.
Diafragma pélvico: Dependiendo del autor, considera exclusivamente el músculo elevador del ano (MEA) o incluye, en un sentido más amplio y funcional, los tres fascículos del MEA más el músculo coccígeo, así como sus fascias circundantes. De forma operativa se pueden agrupar en:
- Fascículos que forman el hiato urogenital (pubococcígeo y puborrectal del MEA). Estos permiten la amplia comunicación, en reposo, de uretra, vagina y recto con el exterior. Ante la inminencia de un fenómeno que cause hiperpresión abdominal, como Valsalva o tos, si los músculos se encuentran sanos y el reflejo guardián conservado, se contraen contra el pubis causando un desplazamiento hacia anterior del cuerpo perineal y una disminución en el diámetro del hiato genital con cierre secundario de la uretra.
- Fascículos que forman el plató de los elevadores (isquiococcígeo del MEA y músculo coccígeo).
- Fascículos más amplios y posteriores que se funden en el rafe anococcígeo. Su rol es el de dar soporte mecánico al recto, vagina, útero y vejiga, debido a que estas estructuras se encuentran, en reposo, con una angulación oblicua hacia posterior. Durante la actividad hiperpresiva, cuando el hiato se desplaza hacia el pubis, aumenta la angulación de estos órganos aumentando la presión sobre el plató de los elevadores.
- Membrana perineal y músculos genitales externos: Corresponden a los músculos transverso profundo y superficial, así como bulbo esponjoso e isquiocavernoso. Dentro de sus principales funciones está dar soporte y continencia a la uretra, participar en la formación del cuerpo perineal y dar morfología y simetría a los genitales externos.
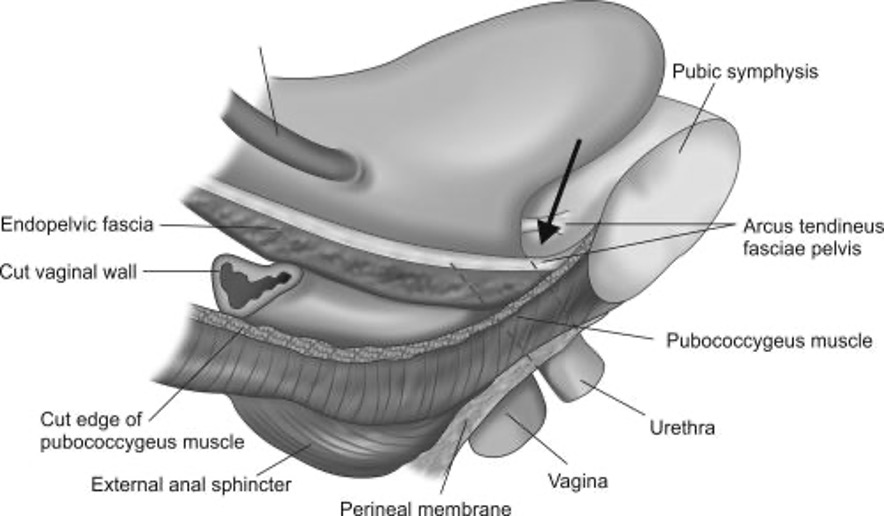
Fig. 2. Estructuras de soporte de vejiga y uretra.[10]
DISFUNCIONES VESICALES
El funcionamiento del aparato vésicoesfinteriano tiene como objetivo el eficiente almacenamiento de orina durante la fase de continencia y el vaciado vesical completo y periódico durante la micción[11]. Cualquier alteración en el funcionamiento del detrusor o del tracto de salida durante última fase puede llevar en último término a la retención completa de orina[12]. A continuación, trataremos las causas funcionales más frecuentes de retención urinaria.
Antes de hablar de retención urinaria, debemos comprender que el vaciado vesical es el resultado de la acción de la fuerza expulsiva ejercida sobre la orina en contraposición a la resistencia del tracto urinario inferior. La fuerza expulsiva tiene dos componentes, la presión generada por el detrusor al contraerse y la fuerza ejercida por el abdomen sobre la vejiga. La resistencia del tracto de salida está dada por componentes activos y pasivos; el cuello vesical, la uretra proximal, esfínter externo y uretra distal. Por este motivo toda retención urinaria significará un desbalance entre estos dos sistemas[11], [13].
Alteraciones del detrusor
Las alteraciones vesicales durante la fase miccional implican una disminución de la capacidad del detrusor para contraerse eficientemente, ya sea por falta de trabajo muscular propiamente tal o por aumento de la viscoelasticidad de la pared vesical, como lo que se observa en la presencia de un divertículo vesical de gran volumen.
Como ya se dijo, la fuerza expulsiva se contrapone a la resistencia del tracto de salida, por lo tanto, una contracción poco eficiente puede ser capaz de vaciar completamente la vejiga si la resistencia uretral es suficientemente baja. Este fenómeno lo observamos en algunas mujeres que orinan principalmente gracias a la apertura esfinteriana. En la figura 3 podemos observar un ploteo publicado por Park y cols., en 2016, comparando flujo máximo y presión de detrusor a flujo máximo. Se muestran casos en pacientes clasificadas como “sin disfunción miccional” (+, residuo post miccional menor a 100 mL), que se registraron flujos máximos de más de 35 cm de agua con presiones del detrusor a flujo máximo cercanas a 0 cm de agua [14]. Esto nos sugiere que se requiere escaso aporte en forma de contracción del detrusor si la resistencia del tracto de salida en suficientemente baja.
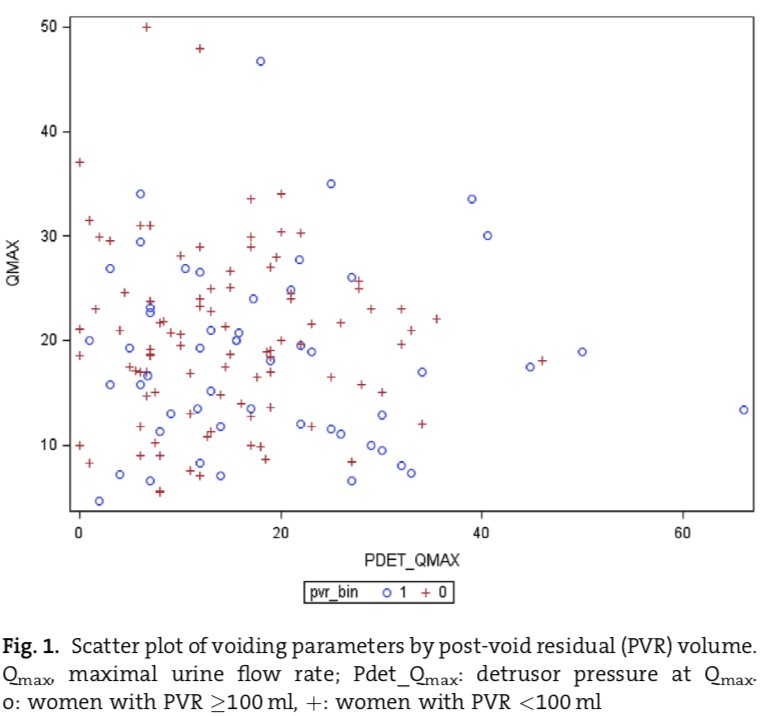
Fig. 3. Park y cols, 2016. Se grafican presiones de detrusor a flujo máximo de distintas pacientes. Nótese que en pacientes que presentan residuos post miccionales menores a 100 mL (+) se pueden observar casos en que la presión del detrusor a flujo máximo es 0 o cercana a 0. PVR: volumen residual post miccional, Qmax: flujo máximo urinario, Pdet_Qmax: presión detrusor con Qmax, O: mujeres con PVR mayor o igual 100 mL, +: mujeres con PVR menor a 100 mL.
Alteraciones del tracto de salida
Al hablar de alteraciones del tracto de salida nos referimos a condiciones que aumenten la resistencia de la uretra y el aparato esfinteriano, que corresponde a las distintas uropatías obstructivas bajas. Nuevamente tenemos que observar este fenómeno como un desbalance en el equilibrio entre fuerza expulsiva de la vejiga y resistencia del tracto urinario, pudiendo observar en ciertos pacientes vaciado vesical completo y flujo urinario aparentemente normal, pero a expensas de un trabajo exagerado del detrusor.
En la figura 4 observamos un trazado urodinámico de la fase de vaciado de un paciente de 14 años que logra vaciado completo con altas presiones del detrusor.
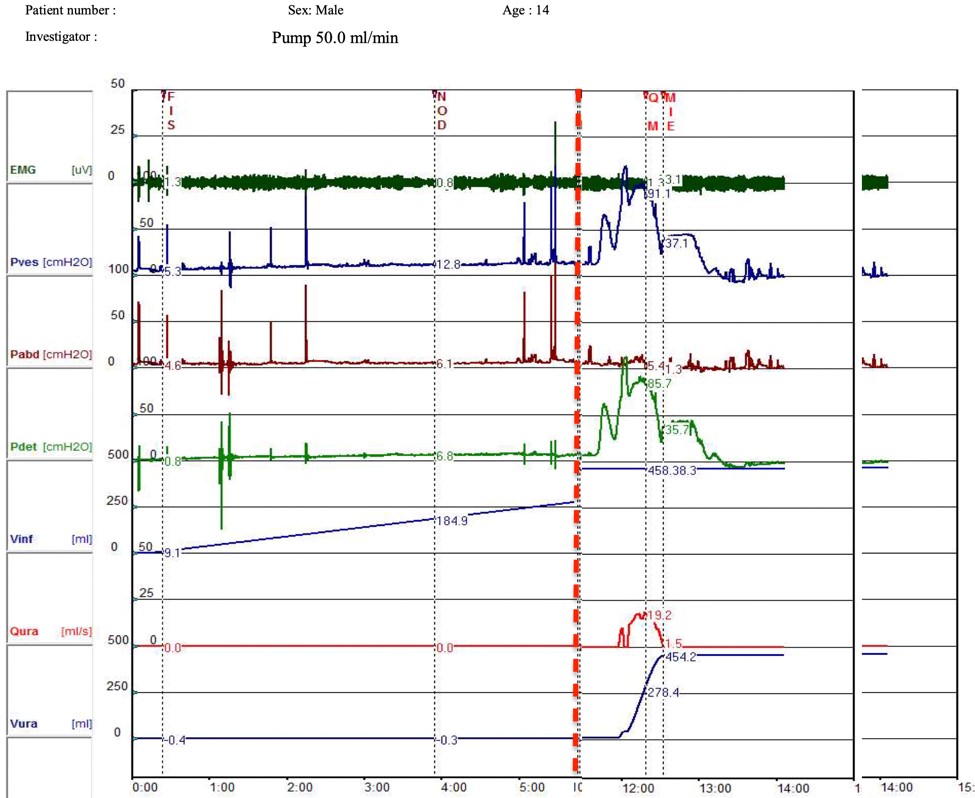
Fig. 4. Trazado urodinámico (recortado). Se observa que una vez terminado el llene, a 460 mL, se inició el vaciado observando flujo máximo de 19 mL/s y presión de detrusor a flujo máximo de 86 cm de agua, solo dejando 5 mL como residuo post miccional.
Vejiga hipoactiva y detrusor hipoactivo
A diferencia de vejiga hiperactiva y detrusor hiperactivo, ambas situaciones que típicamente afectan la fase de continencia, vejiga hipoactiva y detrusor hipoactivo afectan la fase de vaciado o miccional. Comparativamente son entidades a las que se la has dedicado escasos estudios y que permanecen subdiagnosticadas.
Tomando como referencia lo reportado por la Sociedad Internacional de Continencia (ICS), hablaremos de vejiga hipoactiva como el cuadro caracterizado por chorro urinario lento, vaciado con vacilación o necesidad de pujar para orinar con o sin sensación de vaciado incompleto, que puede presentarse acompañado por síntomas de fase de almacenamiento.
En cuanto a los diagnósticos urodinámicos, detrusor hipoactivo se define como una contracción de fuerza y / o duración reducida, que resulta en un vaciado de la vejiga prolongado y / o una incapacidad para lograr el vaciado completo de la vejiga dentro de un intervalo de tiempo normal. Adicionalmente, detrusor acontráctil se define como aquél que no se puede demostrar que se contraiga durante los estudios urodinámicos.
Adicionalmente la ICS agrupa los síntomas predominantemente de miccionales en ausencia de infección o una evidente patología distinta a obstrucción como: “síntomas del tracto urinario inferior sugerentes de obstrucción del tracto de salida”.[15]
A manera de resumen conceptual, la tabla 1 muestra las distintas alteraciones del vaciado enfocadas desde el punto de vista de disfunción del detrusor o del tracto de salida[12].
Recordemos que todas las alteraciones del de la fase miccional nos pueden conducir en último término a retención urinaria y alteración del sistema urinario superior.
| Alteraciones miccionales. | |
| Detrusor.
Disminución o ausencia de la contractilidad del detrusor. |
Tracto de salida.
Uropatía obstructiva baja. |
|
• Activas.
• Pasivas.
• Inhibición psicógena. |
Tabla 1. Posibles alteraciones durante la fase miccional del detrusor y del tracto de salida[2].
En la tabla 2 se esquematizan conceptualmente las causas de detrusor hipoactivo según lo publicado por Yoshida y Yamaguchi en 2014[16].
| Detrusor
Hipoactivo |
|
| Tipo. | Causas |
| Idiopática | Envejecimiento normal.
Causa desconocida en población joven. |
| Neurogénico | Enfermedad de Parkinson
Diabetes Mellitus Síndrome de Guillain-Barré Esclerosis múltiple Hernia de disco espinal-lumbar / lesión de la médula espinal / congénita. Obstrucción congénita del tracto de salida. |
| Miogénica | Obstrucción del tracto de salida.
Diabetes. |
| Iatrogénica | Prostatectomía radical
Cistectomía radical Histerectomía radical Medicamentosa. Resección pelviana anterior, resección abdomino-perineal. |
Tabla 2. Esquematización de las causas de detrusor hipoactivo.
Retención aguda de orina
La retención aguda de orina es definida por la Sociedad Internacional de Continencia (ICS) como la presencia de una vejiga palpable, percutible y dolorosa cuando el paciente no es capaz de orinar espontáneamente.[2], [17][18]
Las causas del tracto de la salida que pueden generar retención urinaria aguda son catalogadas como uropatía obstructiva y esquemáticamente las podemos dividir por nivel de afectación en:[19]
Causas de Retención urinaria
obstructiva
| Nivel | Origen |
| Vejiga | Cálculos, tumores, hemorrágica. |
| Próstata | Adenoma de próstata, cálculos, abscesos, tumores. |
| Uretra. | Estreches/estenosis, cálculos, divertículos, valvas uretrales, abscesos periuretrales. |
| Genitales externos masculinos. | Fimosis, parafimosis, estenosis de meato. |
| Genitales femeninos. | Vaginitis atrófica, vulvovaginintis, prolapso de órgano pélvico. |
| Todo nivel. | Tumores abdominales o pélvico, aneurisma aórtico, fractura de pelvis. |
Tabla 3. Causas de Retención urinaria obstructiva
Dentro de las causas que afectan el detrusor, se deben destacar los fármacos con efecto anticolinérgico como antimuscarínicos, atropina, ciclopentolato, ipratropio, escopolamina, antihistamíncos, analgésicos opioides, benzodiacepinas, antidepresivos, antisicóticos, antiparkinsonianos, anti arrítmicos, alfa agonistas como fenilefrina o pseudoefedrina, beta agonistas como isoprotenerol, epinefrina, norepinefrina y relajantes musculares como baclofeno o ciclobenzaprina.
Al realizar la evaluación de nuestros pacientes debemos estar alerta de una posible falla renal o presencia de infecciones que gatillen el cuadro, como una prostatitis aguda.
La imagenología ayudará a identificar sobredistensión vesical e hidronefrosis, siendo de gran utilidad el ultrasonido focalizado o métodos más complejos como tomografía computarizada y resonancia magnética.
El tratamiento se basa en la descompresión vesical con drenaje de la vía urinaria. Cuando es posible identificar una causa farmacológica, por ejemplo, después del uso de anestesia espinal o agonistas alfa adrenérgicos, generalmente es necesario esperar que finalice el efecto de estos fármacos para recuperar la función vesical normal, pudiendo ser necesaria la cateterización vesical.
Se puede cateterizar la uretra con un catéter con balón de retención (sonda Foley) o un catéter para uso intermitente (ej. Sonda nelaton). Si no es posible utilizar la vía uretral, se deberá instalar un catéter suprapúbico, idealmente guiado por ultrasonido[19]. En caso de que la retención aguda de orina sea el resultado final de un proceso crónico, recomendamos utilizar un catéter que se pueda dejar en forma permanente hasta que se pueda resolver el cuadro de base[20].
Especial atención debemos poner en pacientes que por causas ambientales sufran retenciones de orina. Esto sucede por ejemplo en pacientes que habitualmente orinan en el baño y producto de una hospitalización deben orinar en cama o en presencia de otras personas. En esta situación intentaremos adecuar los factores ambientales para favorecer el vaciado vesical.
En los casos que se produzca una retención urinaria por descompensación aguda secundaria a crecimiento prostático benigno, el uso de tamsulosina previo al retiro del catéter ha aumentado las posibilidades de orinar espontáneamente luego de la retención[21], [22], idealmente en esquemas cortos de menos de tres días.
Retención crónica de orina
Existen cuadros que generan dificultad permanente del vaciado. Muchos son de origen neurológico por lo que parte importante de nuestro manejo será descartar enfermedades que generen vejiga neurogénica hipoactiva.
Cuadros funcionales como el envejecimiento normal está mencionado como una causa de pérdida de función del detrusor]. En pacientes sintomáticos mayores de 65 años, se detectó hipoactividad del detrusor en 40% de los hombres y 13 % de las mujeres[14], [23], [24], pero no es posible tener una cifra clara de su real prevalencia.[25]
En adultos mayores se describe el cuadro caracterizado por hiperactividad del detrusor con alteración de la contractilidad, DHIC por su sigla en inglés. Esta condición se caracteriza por urgencia miccional y aumento de frecuencia miccional secundaria a hiperactividad del detrusor durante la fase de llene, pero al momento de orinar el detrusor no genera una contracción adecuada. En este cuadro los pacientes pueden experimentar tanto incontinencia de orina como retención urinaria[23].
En mujeres destaca el síndrome de Fowler, una alteración que no permite el vaciado vesical correcto por una alteración en la función y anatomía del esfínter estriado. No está clara la causa, pero se plantea que existe una sobreestimulación esfinteriana por información aferente aberrante como también alteración de factores hormonales que interactúan en la función del tracto urinario inferior. El cuadro clínico clásico se caracteriza por retención urinaria sin aparente explicación en mujeres jóvenes que puede estar acompañado de síndrome de ovario poliquísitico. Esta retención puede ser gatillada por un evento agudo, por ejemplo, una cirugía, encontrando un gran residuo post miccional, mayor a 1000 mL. Los estudios urodinámicos muestran vejigas de gran capacidad con disminución de la sensibilidad vesical. Durante la micción se observa disminución de la capacidad de contracción del detrusor con flujo urinario bajo o ausente. Si se realiza video urodinamia durante la micción se observará cuello vesical abierto con una zona estrecha a nivel del esfínter. El perfil uretral mostrará una presión máxima de cierre uretral elevada. La electromigrafía esfinteriana con aguja concéntrica debería mostrar el patrón característico de descargas repetitivas complejas y ráfagas de desaceleración. El tratamiento consiste en el vaciado vesical que se puede lograr con cateterismo limpio intermitente, sin embargo, el uso de neuromodulación sacra permitiría mejorar significativamente el vaciado con menor necesidad de realizar cateterismo intermitente[26], [27].
Otra entidad similar es la micción disfuncional. A diferencia del síndrome de Fowler, en este cuadro se observa un flujo urinario intermitente o fluctuante secundario a una contracción involuntaria tanto del esfínter urinario externo como de los músculos del piso pélvico durante la micción. Se cree que corresponde a un comportamiento aprendido luego de un evento gatillante como puede ser una infección urinaria, trauma, inflamación o un evento con impacto psicológico[28], [29]. El estudio urodinámico muestra durante el llene capacidad cistométrica conservada, sensación normal. Durante el vaciado se observa bajo flujo con alta presión del detrusor y aumento de la actividad electromiográfica perineal. En la videourodinamia se puede observar dilatación de la uretra proximal y contracción intermitente de la zona esfinteriana y el piso pélvico. El tratamiento consiste en rehabilitación del piso pélvico junto con terapia cognitiva y farmacológica.[26]
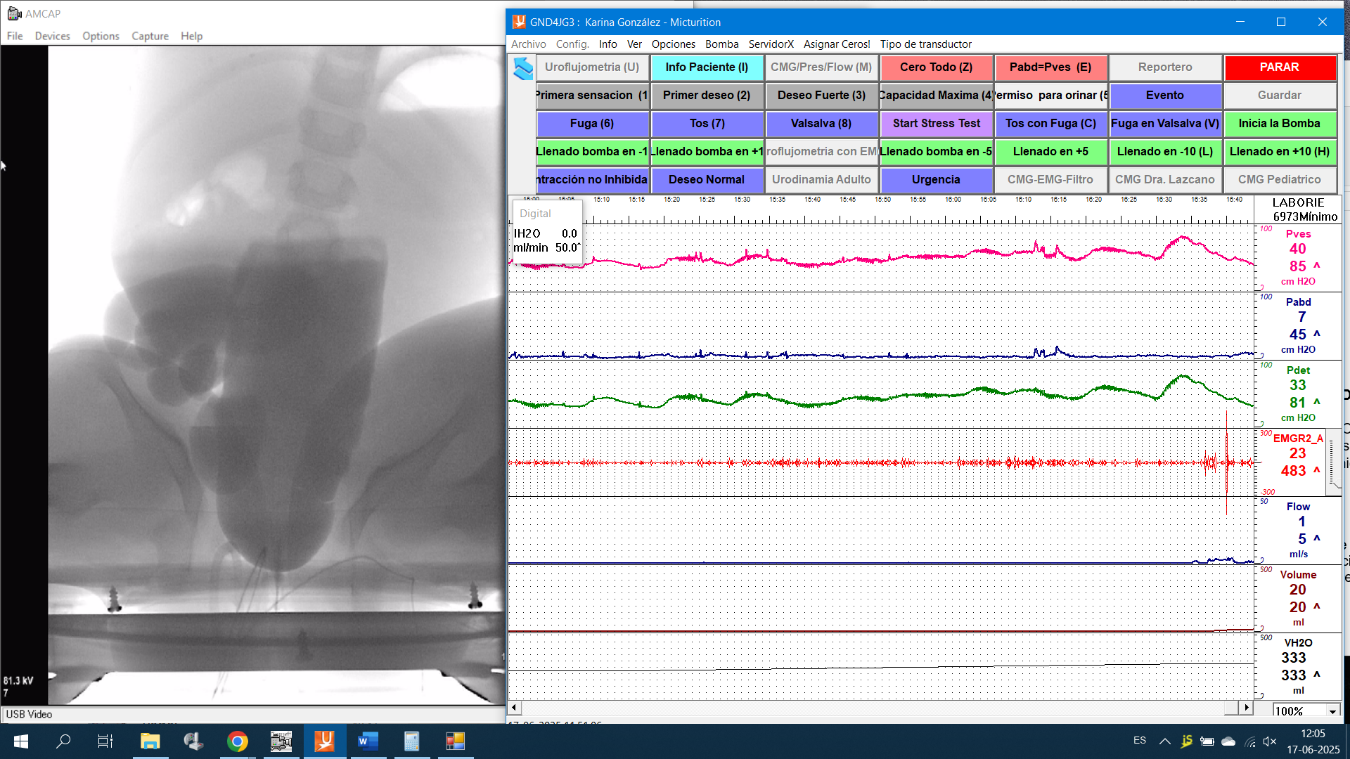
Figura 5. Registro de video urodinamia que muestra vaciado obstructivo con ausencia de apertura del esfínter externo de una mujer adulta con diagnóstico de micción disfuncional.
En niños destaca el síndrome de Hinman como alteración funcional del vaciado vesical. Se describe como una vejiga neurogénica no neurogénica que se caracteriza por disfunción miccional sin evidente causa de origen neurológico. Su severidad puede llevar a la falla renal terminal[30]. Se considera una expresión extrema de la micción disfuncional pero recientemente se han observado alteraciones a nivel del plexo lumbosacro que la podrían catalogar como una alteración neurológica del tracto urinario inferior[31].
Retención urinaria neurogénica
Hablamos de disfunción neurogénica del tracto urinario inferior o vejiga neurogénica ante cualquier alteración neurológica conocida sistema nervioso central, periférico o autonómico que tenga impacto en el aparato vésicoesfinteriano[32]. Debido a las repercusiones que pueden tener estas patologías en nuestros pacientes, nuestras acciones estarán enfocadas con los siguientes objetivos:
Realizar un manejo acorde a los objetivos del paciente.
Eliminar o controlar la aparición de infecciones.
Preservar la función del tracto urinario superior.
Mantener una vejiga de baja presión que permita un adecuado vaciado. Evitar el uso de catéteres permanentes[33], [34]
En la tabla 4 se enumeran las principales causas de alteración neurológica del tracto urinario inferior:
Enfermedades neurológicas que afectan el
tracto urinario inferior.
| Causas Suprapontinas | Accidentes Vasculares
Traumatismo encéfalo craneano Enfermedades degenerativas Enfermedad de Parkinson Atrofia multisistémica Enfermedad de Alzheimer, Hidrocefalia, hidrocefalia normotensiva Parálisis cerebral Neoplasias |
| Causas infrapontinas – suprasacras | Desmielinización
Esclerosis múltiple Mielitis transversa Trauma medular Lesiones vasculares Malformaciones arterio-venosas, Infartos medulares Neoplasias Metástasis Disfunción primaria Disfunción hereditaria Paraparesia espástica hereditaria Paraparesia espástica tropical (HTLV-1) Espina bífida |
| Causas infrasacras | Daño de cauda equina
Diabetes mellitus Causas hereditarias Neuropatía motora sensorial hereditaria. Cirugía pélvica. |
Tabla 4. Alteraciones neurológicas con repercusión en el tracto urinario inferior [26].
La evaluación urológica temprana de estos pacientes tendrá como objetivo el determinar el grado de impacto que la enfermedad basal ha tenido en el tracto urinario. En este sentido la evaluación clínica integral apoyada por estudios de laboratorio, imágenes y estudios urodinámicos es primordial. Estos pacientes se presentan con grados variables de retención urinaria, siendo en general el cateterismo vesical limpio intermitente la opción más adecuada para vaciar la vejiga, debiendo recurrir a otros métodos solo si no existe mejor alternativa.[33], [34]
Dentro de las nuevas alternativas la neuro modulación sacra y periférica podrían tener buenos resultados en restaurar la función del tracto urinario en los pacientes neurogénicos[35]. [34]. Por otra parte, especialmente en pacientes con lesiones medulares completas y detrusor hiperactivo, la estimulación eléctrica de raíces sacras anteriores (SARS) ha logrado recuperar la micción en pacientes seleccionado[36].
Uropatía inducida por ketamina
La ketamina es un antagonista glutamatérgico del receptor NMDA de origen sintético. Su uso médico ha sido históricamente la inducción y mantención anestésica, pero ha tomado inesperada relevancia recientemente por su uso como droga recreativa debido a su capacidad de producir alucinaciones. Los efectos tóxicos del abuso de ketamina incluyen daños a diversos órganos, incluyendo sistema cardiovascular, respiratorio, hepático y urinario. Las manifestaciones clínicas pueden incluir disminución de la capacidad vesical, con engrosamiento de la pared vesical en pacientes con sintomatología severa. En estos casos se puede observar pancistitis aguda con inflamación que se extiende a los uréteres o al peritoneo, con dilatación y engrosamiento de la pared ureteral, reflujo vesicoureteral e hidronefrosis. Histológicamente se puede observar denudación epitelial, ulceración y hemorragia, infiltración de eosinófilos, linfocitos, células plasmáticas y mastocitos en la mucosa, submuscosa y el músculo detrusor, que producen mediadores inflamatorios que aumentan el daño de la pared. Se puede producir fibrosis submucosa, hipertrofia muscular y depósito de colágeno en la pared vesical.
Los mecanismos fisiopatológicos no son completamente conocidos, pero contribuyen en el daño vesical factores como producción de factor antiproliferativo, ATP, aumento de estrés oxidativo, dañando el urotelio. Existe disminución de la expresión de E-cadherina, que podría contribuir a la alteración de la barrera urotelial. La fibrosis e inflamación de la lámina propia se asocian con la activación de la ciclooxigenasa-2, el óxido nítrico sintetasa, la inmunoglobulina E y TGF-β1. Su acción sobre el receptor NMDA contribuye a generar lesiones microvasculares. Altera la membrana basal inhibiendo la acción de la proteina quinasa B y del receptor muscarínico. Además, la ketamina afecta las alteraciones neuropatológicas de la vejiga al regular la señalización dependiente del NMDAR y del factor neurotrófico derivado del cerebro. Los síntomas más frecuentes incluyen aumento de frecuencia miccional, urgencia miccional, dolor suprapúbico, nocturia, disuria y con menor frecuencia, hematuria macroscópica, incontinencia urinaria o daño del tracto urinario superior, con hidroureteronefrosis, reflujo vesicoureteral, estenosis ureteral, llegando incluso a falla renal.
El tratamiento debe ser interdisciplinario, incluyendo a urólogos, especialistas en adicciones y especialistas en dolor. La suspensión del consumo es un requisito fundamental para el manejo de la patología urinaria. La sola suspensión del consumo puede mejorar la sintomatología entre 50 y 80%. EL tratamiento farmacológico de primera línea incluye antinflamatorios y anticolinérgicos. Como segunda línea se pueden usar opiáceos junto a pregabalina y pentosan polisulfato para intentar restaurar la capa de glicosaminoglicanos de la mucosa vesical. Existen esquemas de tratamiento con instilaciones vesicales, principalmente con glicosaminoglicanos, pero también pueden incluir anestésicos locales y antiinflamatorios esteroidales. El tratamiento quirúrgico incluye la hidrodistensión vesical, inyecciones de toxina botulínica, aunque pueden ser necesarias ampliaciones vesicales o derivaciones urinarias.[37], [38], [39]
Bibliografía
[1] Lee. Richter, R. Sussman, E. Timbrook Brown, R. R. Dmochowski, and A. Wein, “Pathophysiology and Classification of Lower Urinary Tract Dysfunction,” in Campbell Walsh Wein Urology, 13th ed., Elsevier, 2026, ch. 120, p. 3612.
[2] Chiang H, Landerer E, Chiang F, and aufman A., “Estandarización de la terminología de la función del tracto urinario inferior: Reporte del subcomité de estandarización de la International Continence Society (ICS).,” Rev Chil Urol, vol. 71, pp. 79–94, 2006.
[3] S. Hunskaar, G. Lose, D. Sykes, and S. Voss, “The prevalence of urinary incontinence in women in four European countries,” BJU Int, vol. 93, no. 3, pp. 324–330, Feb. 2004, doi: 10.1111/j.1464-410X.2003.04609.x.
[4] N. Yoshimura and M. B. Chancellor, “Neurophysiology of lower urinary tract function and dysfunction.,” Rev Urol, vol. 5 Suppl 8, no. Suppl 8, pp. S3–S10, 2003.
[5] J. P. Valdevenito S. et al., “Fisiología del tracto urinario inferior,” Revista Hospital Clínico Universidad de Chile, vol. 24, no. 3, pp. 235–45, Sep. 2013, doi: 10.5354/2735-7996.2013.73293.
[6] N. N. Guan, L. E. Gustafsson, and K. Svennersten, “Inhibitory Effects of Urothelium‐related Factors,” Basic Clin Pharmacol Toxicol, vol. 121, no. 4, pp. 220–224, Oct. 2017, doi: 10.1111/bcpt.12785.
[7] N. N. Guan, K. Svennersten, P. J. de Verdier, N. P. Wiklund, and L. E. Gustafsson, “Prostaglandin D2 effects and DP1 /DP2 receptor distribution in guinea pig urinary bladder out-flow region,” J Cell Mol Med, vol. 21, no. 2, pp. 234–243, Feb. 2017, doi: 10.1111/jcmm.12959.
[8] K. E. Andersson and K. D. McCloskey, “Lamina propria: The functional center of the bladder?,” Neurourol Urodyn, vol. 33, no. 1, pp. 9–16, Jan. 2014, doi: 10.1002/nau.22465.
[9] C. A. Unger, E. Tunitsky-Bitton, T. Muffly, and M. D. Barber, “Neuroanatomy, neurophysiology, and dysfunction of the female lower urinary tract: A review,” Female Pelvic Med Reconstr Surg, vol. 20, no. 2, pp. 65–75, 2014, doi: 10.1097/SPV.0000000000000058.
[10] J. O. L. DeLancey, “Structural support of the urethra as it relates to stress urinary incontinence: The hammock hypothesis,” Am J Obstet Gynecol, vol. 170, no. 6, pp. 1713–1723, Jun. 1994, doi: 10.1016/S0002-9378(94)70346-9.
[11] J. T. WEI and J. O. L. DE LANCEY, “Functional Anatomy of the Pelvic Floor and Lower Urinary Tract,” Clin Obstet Gynecol, vol. 47, no. 1, pp. 3–17, Mar. 2004, doi: 10.1097/00003081-200403000-00004.
[12] H. Chiang, Susaeta R., Valdevenito R., R. Rosenfeld, and Carlos. Finsterbusch, “Incontinencia Urinaria,” REV. MED. CLIN. CONDES, vol. 24, no. 2, pp. 219–227, 2013.
[13] A. J. Wein, D. K. Newman, and A. L. Smith, “Lower Urinary Tract Function and Dysfunction; Urinary Incontinence CHAPTER 14,” in Penn Clinical Manual of Urology, Elsevier, Ed., 2024, ch. 14.
[14] J. Park, J. P. Lavelle, and M. H. Palmer, “Voiding dysfunction in older women with overactive bladder symptoms: A comparison of urodynamic parameters between women with normal and elevated post‐void residual urine,” Neurourol Urodyn, vol. 35, no. 1, pp. 95–99, Jan. 2016, doi: 10.1002/nau.22689.
[15] C. R. Chapple et al., “Terminology report from the International Continence Society (ICS) Working Group on Underactive Bladder (UAB).,” Neurourol Urodyn, vol. 37, no. 8, pp. 2928–2931, Nov. 2018, doi: 10.1002/nau.23701.
[16] M. Yoshida and O. Yamaguchi, “Detrusor underactivity: The current concept of the pathophysiology,” LUTS: Lower Urinary Tract Symptoms, vol. 6, no. 3, pp. 131–137, 2014, doi: 10.1111/luts.12070.
[17] P. Abrams et al., “The standardisation of terminology in lower urinary tract function: report from the standardisation sub-committee of the International Continence Society,” Urology, vol. 61, no. 1, pp. 37–49, Jan. 2003, doi: 10.1016/S0090-4295(02)02243-4.
[18] C. D’Ancona et al., “The International Continence Society (ICS) report on the terminology for adult male lower urinary tract and pelvic floor symptoms and dysfunction,” Neurourol Urodyn, vol. 38, no. 2, pp. 433–477, Feb. 2019, doi: 10.1002/nau.23897.
[19] M. Billet and T. A. Windsor, “Urinary Retention,” Emerg Med Clin North Am, vol. 37, no. 4, pp. 649–660, Nov. 2019, doi: 10.1016/j.emc.2019.07.005.
[20] D. H. Hernandez, R. B. Tesouro, and D. Castro-Diaz, “Urinary retention,” Urologia Journal, vol. 80, no. 4, pp. 257–264, Oct. 2013, doi: 10.5301/RU.2013.11688.
[21] Elisabeth M. Sebesta, Casey Kowalik, Alan J. Wein, and Roger R. Dmochowski, “Neuromuscular dysfunction of the lower urinary tract,” in Campbell-Walsh-Wein urology, Elsevier, 2026, p. 3612.
[22] E. Fisher, K. Subramonian, and M. I. Omar, “The role of alpha blockers prior to removal of urethral catheter for acute urinary retention in men,” Cochrane Database of Systematic Reviews, vol. 2014, no. 11, Jun. 2014, doi: 10.1002/14651858.CD006744.pub3.
[23] C. R. Powell, “Aging and Geriatric Urology,” in Campbell Walsh Wein Urology, 2026, ch. 120. [Online]. Available: https://www.cdc.gov/
[24] S. J. Jeong et al., “Prevalence and Clinical Features of Detrusor Underactivity among Elderly with Lower Urinary Tract Symptoms: A Comparison between Men and Women,” Korean J Urol, vol. 53, no. 5, p. 342, 2012, doi: 10.4111/kju.2012.53.5.342.
[25] N. I. Osman, F. Esperto, and C. R. Chapple, “Detrusor Underactivity and the Underactive Bladder: A Systematic Review of Preclinical and Clinical Studies.,” Eur Urol, vol. 74, no. 5, pp. 633–643, Nov. 2018, doi: 10.1016/j.eururo.2018.07.037.
[26] N. I. Osman and C. R. Chapple, “Fowler’s syndrome—a cause of unexplained urinary retention in young women?,” Nat Rev Urol, vol. 11, no. 2, pp. 87–98, Feb. 2014, doi: 10.1038/nrurol.2013.277.
[27] X. Gamé and C.-J. Fowler, “Le désordre primaire de la relaxation sphinctérienne ou syndrome de Fowler,” Progrès en Urologie, vol. 20, no. 8, pp. 553–559, Sep. 2010, doi: 10.1016/j.purol.2010.03.005.
[28] Y.-H. Fan, A. T. L. Lin, H.-M. Wu, C.-J. Hong, and K.-K. Chen, “Psychological Profile of Female Patients with Dysfunctional Voiding,” Urology, vol. 71, no. 4, pp. 625–629, Apr. 2008, doi: 10.1016/j.urology.2007.11.063.
[29] K. V Carlson, S. Rome, and V. W. Nitti, “Dysfunctional voiding in women.,” J Urol, vol. 165, no. 1, pp. 143–7; discussion 147-8, Jan. 2001, doi: 10.1097/00005392-200101000-00035.
[30] S. B. Bauer, “The Hinman Syndrome.,” J Urol, vol. 197, no. 2S, pp. S132–S133, Feb. 2017, doi: 10.1016/j.juro.2016.11.026.
[31] S. Tiryaki, C. Eraslan, T. Soyer, C. Calli, I. Ulman, and A. Avanoglu, “Nonneuropathic Neuropathic Bladder—Is it Really Nonneuropathic?,” Journal of Urology, vol. 201, no. 4, pp. 802–809, Apr. 2019, doi: 10.1016/j.juro.2018.09.046.
[32] D. P. Patel, J. B. Myers, and S. M. Lenherr, “How to Measure Quality-of-Life Concerns in Patients with Neurogenic Lower Urinary Tract Dysfunction,” Urologic Clinics of North America, vol. 44, no. 3, pp. 345–353, Aug. 2017, doi: 10.1016/j.ucl.2017.04.002.
[33] U. Nseyo and Y. Santiago-Lastra, “Long-Term Complications of the Neurogenic Bladder,” Urologic Clinics of North America, vol. 44, no. 3, pp. 355–366, Aug. 2017, doi: 10.1016/j.ucl.2017.04.003.
[34] D. A. Ginsberg et al., “The AUA/SUFU Guideline on Adult Neurogenic Lower Urinary Tract Dysfunction: Treatment and Follow-up,” Nov. 01, 2021, Wolters Kluwer Health. doi: 10.1097/JU.0000000000002239.
[35] P. G. Barboglio Romo and P. Gupta, “Peripheral and Sacral Neuromodulation in the Treatment of Neurogenic Lower Urinary Tract Dysfunction,” Urologic Clinics of North America, vol. 44, no. 3, pp. 453–461, Aug. 2017, doi: 10.1016/j.ucl.2017.04.011.
[36] T. Guiho et al., “Sacral Anterior Root Stimulation and Visceral Function Outcomes in Spinal Cord Injury–A Systematic Review of the Literature Over Four Decades,” Jan. 01, 2022, Elsevier Inc. doi: 10.1016/j.wneu.2021.09.041.
[37] J. Zhou, C. Scott, Z. R. Miab, and C. Lehmann, “Current approaches for the treatment of ketamine-induced cystitis,” Mar. 01, 2023, John Wiley and Sons Inc. doi: 10.1002/nau.25148.
[38] X. Xie et al., “Molecular pathways underlying tissue injuries in the bladder with ketamine cystitis,” Jul. 01, 2021, John Wiley and Sons Inc. doi: 10.1096/fj.202100437.
[39] A. Bourillon et al., “Management of ketamine cystitis: National guidelines from the French Association of Urology (CUROPF/CTMH),” Nov. 01, 2024, Elsevier Masson s.r.l. doi: 10.1016/j.fjurol.2024.102754

