INTRODUCCION
Tradicionalmente, el cáncer de próstata se ha tratado mediante Prostatectomía radical con o sin linfadenectomía o la irradiación de toda la glándula prostática. Aunque estos métodos son eficaces para controlar la enfermedad, pueden afectar las estructuras que rodean la próstata, las cuales son fundamentales para el control urinario y la función eréctil. Como consecuencia, muchos pacientes sobrevivientes de cáncer de próstata enfrentan efectos secundarios a largo plazo y una disminución en su calidad de vida.
Este dilema se vuelve cada vez más complejo tanto para los pacientes como para sus urólogos y médicos tratantes, especialmente ahora que estudios a largo plazo —como ProtecT clinical trial, con seguimiento de 15 años y que comparó vigilancia activa, prostatectomía radical y radioterapia— han demostrado que la mortalidad específica por cáncer de próstata se mantiene baja sin importar el tratamiento elegido
Con el objetivo de mantener un buen control del cáncer y, al mismo tiempo, reducir el daño a estas estructuras, la comunidad urológica ha comenzado a desarrollar y aplicar técnicas que se enfocan únicamente en las áreas de la próstata donde está localizado el tumor, dejando el resto de la glándula bajo vigilancia activa. A esta estrategia se le conoce como «terapia focal».
Esta terapia se ha hecho posible en las últimas dos décadas gracias a los avances en las técnicas de imagen diagnóstica, especialmente resonancia de próstata y más recientemente PET CT y en las biopsias, que permiten localizar con precisión las áreas afectadas por el cáncer dentro de la glándula. Además, el desarrollo de energías y métodos de entregar esa energía en una forma precisa y dirigida únicamente las zonas comprometidas.
Por muchos años la próstata fue la única neoplasia maligna de órganos sólidos que se biopsia a ciegas» mediante 6 a 12 muestras a varias regiones dentro de la próstata, con la esperanza de identificar el cáncer, si existe. Aunque sistemática de forma, las biopsias son esencialmente aleatorias, ya que no están dirigidas a objetivos específicos dentro de la próstata.
Históricamente, la obtención de imágenes para el cáncer de próstata ha sido un desafío debido a su ubicación profunda dentro de la pelvis, la complejidad de la anatomía zonal prostática y su naturaleza multifocal. Sin embargo, los grandes avances en las capacidades de resonancia en los últimos años y la clasificación de PIRADS estandarizando los reportes de dicho estudio han permitido la caracterización más precisa de las lesiones cancerosas.
La lógica detrás de la terapia focal parece relativamente simple, apuntando a la parte cancerosa predefinida del órgano mientras se evita el tejido no afectado; sin embargo, la selección, ejecución y sobre seguimiento ha sido algo más complicado.
Es crucial la selección del paciente apropiado teniendo en consideración factores como el antígeno prostático específico (PSA), los resultados histopatológicos de la biopsia, la Resonancia multiparamétrica, la esperanza de vida e importantemente: las preferencias del paciente.
Después de la selección, sigue siendo difícil localizar, visualizar y caracterizar las áreas significativas del tumor y enfocar el área con precisión con la modalidad ablativa más adecuada. Finalmente, después del tratamiento focal, es difícil evaluar la eficacia de este mediante la interpretación de los resultados de PSA, imágenes y biopsias durante el seguimiento.
Pero debemos seguir trabajado para aclarar esas dificultades: Decidir “qué hacer” después de que a un paciente le diagnostican cáncer de próstata no es fácil. Muchos de estos hombres no tenían ningún síntoma previo ni señales de que algo andaba mal, así que el diagnóstico los toma completamente por sorpresa. Además, cuando empiezan a escuchar sobre las opciones de tratamiento, también se enteran de los posibles efectos secundarios que pueden afectar la micción, la función sexual o el funcionamiento intestinal, lo que les genera aún más ansiedad.
En general, lo que la mayoría de los pacientes quiere es tratar el cáncer de forma efectiva, pero al mismo tiempo buscan una alternativa que les permita mantener una buena calidad de vida. Como futuros urólogos, es clave entender ese equilibrio y acompañarlos bien en el proceso de decisión.
BIOPSIA POR FUSION
Introducción
Uno de los aspectos clave para poder implementar con éxito la terapia focal (FT) en el tratamiento del cáncer de próstata (CaP) es lograr una alta concordancia y una correcta estratificación de riesgo entre la biopsia inicial y la anatomía patológica final. Es fundamental reducir al mínimo los casos en que el puntaje de Gleason o el volumen tumoral resultan ser mayores en la pieza quirúrgica que en la biopsia, fenómeno conocido como upgrading . Esto asegura que los pacientes seleccionados para FT estén bien categorizados y que el tratamiento se dirija exactamente al lugar y extensión real del cáncer.
En la práctica clínica habitual, la sospecha de cáncer de próstata se confirma con una biopsia de 12- 18 cilindros guiada por ecografía transrectal (TRUS), el disparo es dirigido a diversas regiones de la próstata de manera sistemática. Estas biopsias son, en esencia, a ciegas y aleatorias por naturaleza, ya que no están dirigidas a un objetivo específico, sino a varias regiones geográficas de la próstata. El uso generalizado de la detección de antígeno prostático específico (PSA) y TRUS- biopsia de próstata dirigida, ha dado como resultado el sobrediagnóstico y el sobretratamiento de los cánceres de próstata de bajo riesgo y la sub-detección / sub-tratamiento de los cánceres de alto riesgo, lo que lleva a un tratamiento injustificado, sin beneficio definitivo en términos de sobrevida global del paciente o sobrevida libre de metástasis.
La introducción de la resonancia magnética multiparamétrica (mpMRI) ha revolucionado la forma en que visualizamos el cáncer, ya que ayuda a delinear y caracterizar lesiones específicas que son potencialmente malignas. Basándose de las imágenes de mpMR, un procedimiento reproducible, llamado biopsia guiada por fusión MRI / TRUS, ha surgido como una opción para una biopsia de próstata más precisa.
TRUS ofrece la capacidad de obtener imágenes en tiempo real, pero está limitada por una resolución espacial deficiente y una baja sensibilidad para el cáncer de próstata, ya que las lesiones a menudo pueden parecer isoecoicas en las imágenes de TRUS, lo que hace que sea difícil distinguirlas del fondo (1). Por el contrario, las imágenes de RM presentan lesiones prostáticas con detalles precisos y tienen una alta sensibilidad, pero no ofrecen la capacidad de adquisición de imágenes en tiempo real y orientación para la biopsia de manera oportuna o rentable. Los desarrolladores han creado estratégicamente plataformas de «fusión» para combinar imágenes de MRI y TRUS, lo que permite al urólogo acceso a la información esencial que ofrecen ambas modalidades (2). Una biopsia de fusión dirigida permite el muestreo de regiones específicas dentro de la próstata con lesiones identificadas en MRI, proporcionando así la posibilidad futura de eludir la necesidad de biopsias aleatorias «ciegas» en toda la glándula. (Figura 1).
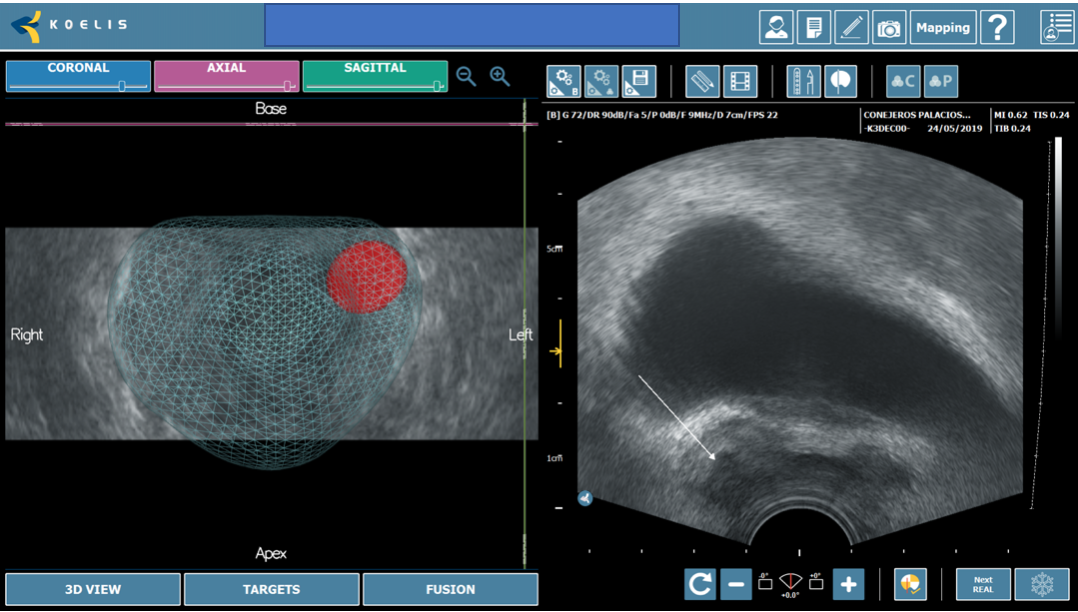
Fig. 1. Biopsia por fusión. Correlación entre zona hipoecoica marcada en base derecha (flecha) con zona sospechosa marcada en resonancia (estrella).
Resonancia multiparamétrica de próstata
La resonancia magnética multiparamétrica (mpMRI) es actualmente la mejor herramienta de imagen disponible para detectar y localizar el cáncer de próstata dentro de la glándula prostática. Esta técnica tiene una mayor sensibilidad para identificar tumores prostáticos de mayor tamaño y riesgo, en comparación con los cánceres de bajo grado. Si la mpMRI revela una zona sospechosa de contener cáncer, se recomienda realizar una biopsia dirigida para obtener una muestra del área en cuestión. Esta biopsia permite confirmar si se trata de un tumor prostático y evaluar su grado de agresividad.
La resonancia magnética de la próstata y la biopsia de próstata guiada se describieron por primera vez a fines de la década de 1980 (3). En los primeros días, se usaba estrictamente como una herramienta de estadificación para los cánceres de próstata diagnosticados por biopsia antes de la cirugía. Resultó tener una utilidad limitada. No fue sino hasta finales de la década de 1990 que se reconoció el potencial de la MRI para localizar tumores dentro de la próstata.
En la última década, la resonancia magnética ha evolucionado para incluir una combinación de secuencias anatómicas y funcionales, creando la llamada resonancia magnética multiparamétrica (mpMRI). Cuando se usa en combinación con TRUS para biopsias, este método ha demostrado una mayor detección de cánceres clínicamente significativos y una detección reducida de cánceres clínicamente insignificantes en pacientes después de una biopsia guiada sistemática negativa previa (4-5). Estos resultados prometedores han llevado a una mayor aplicación de mpMRI en el tratamiento de pacientes sospechosos de cáncer de próstata después de biopsias sistemáticas negativas y en la definición de candidatos para la vigilancia activa y tratamiento focal.
El desarrollo de la mpMRI en los últimos años y las pautas de tratamiento actuales, progresivamente han ido incorporando su uso. En 2015, se publicó la versión 2 del Sistema de informe y diagnóstico de imágenes de próstata (PI-RADS), que creó estándares para el rendimiento y la presentación de informes. La versión más reciente V2.1 data de marzo de 2019. La versión 3 no está disponible todavía, pero probablemente traerá inteligencia artificial y redefinición de nomenclatura y secuencias preponderantes.
Adquisición de imágenes
La resonancia magnética multiparamétrica consiste en una combinación de dos secuencias anatómicas (ponderada en T1 (T1W) y ponderada en T2 (T2W)) y dos secuencias funcionales (imagen ponderada por difusión o DWI) y resonancia magnética con contraste dinámico (DCE-MRI). La RM espectroscópica, ya no se incluye en los protocolos de rutina, ya que proporciona una ganancia mínima y requiere experiencia especializada y cantidades considerables de tiempo de imagen (6). A medida que mpMRI ha comenzado a desempeñar un papel más importante en la estadificación local, el seguimiento y la recurrencia, el énfasis se ha desplazado hacia la obtención de mejores imágenes, con buena resolución espacial y temporal y alta relación señal-ruido (7). Para alcanzar estos objetivos, se deben observar algunos pasos clave, como la preparación del paciente y el uso correcto del equipo con protocolos optimizados.
Preparación
Las pautas de PI-RADSv2 definen varios aspectos básicos de la preparación del paciente. Por ejemplo, se recomienda un PSA reciente del paciente, el historial de PSA, los hallazgos del examen rectal digital, el historial de biopsias y el historial familiar antes del examen.
Muchos pacientes que se someten a resonancia magnética para evaluar el cáncer de próstata también son pacientes que se han sometido a una biopsia de próstata previa. La hemorragia de tales biopsias es una fuente de artefactos en las imágenes y puede simular cánceres en las imágenes T2W. En general, se aconseja que la resonancia magnética se retrase al menos 6 semanas después de la biopsia, o el tiempo necesario para que se resuelva la hemorragia residual. Una resonancia magnética ponderada en T1 puede verificar rápidamente la presencia de hemorragia y, si está presente, el paciente debe reprogramarse.
La peristálsis intestinal y las heces o el aire en el recto también pueden comprometer la calidad de la imagen debido al movimiento (que causa el desenfoque de la imagen) y debido a los artefactos de susceptibilidad (que causa la distorsión de la imagen) principalmente en DWI. Para resolver este desafío, se aconseja al paciente que evacue su recto antes de la imagen y se le puede ofrecer un agente antiespasmódico.
Finalmente, para evaluar las vesículas seminales, se recomienda que los hombres eviten la eyaculación durante 3 días antes de la RM para que las vesículas seminales estén distendidas de manera óptima (8).
Equipo
Hay dos problemas importantes del equipo relacionados con la RM de próstata: la intensidad de campo de la unidad de RM y el uso de bobinas endorrectales (ERC). La intensidad de campo mínima recomendada para el diagnóstico de cáncer de próstata es 1.5 tesla (T). Los escáneres 3 T tienen mejores relaciones señal / ruido, y esto permite obtener imágenes de mayor resolución en menos tiempo. La mayoría de los centros expertos utilizan 3 T, aunque se pueden obtener imágenes muy aceptables a 1,5 T, dependiendo de la calidad y la edad de la unidad de resonancia magnética individual y la atención con la que se utiliza.
Todas las secuencias de pulso se pueden obtener con bobinas de superficie de matriz en fase externa o una bobina endorrectal (ERC), debido a los inconvenientes de este último, que incluyen un costo mayor y la incomodidad del paciente con la inserción, ha caído en desuso.
Interpretación
Hay patrones de señal característicos en cada secuencia de la resonancia magnética multiparamétrica que son indicativos de malignidad. Algunos se consideran «dominantes» dependiendo de la ubicación de la lesión dentro de la glándula; sin embargo, todos los datos de cada secuencia deben considerarse al menos al interpretar estos estudios. Por ejemplo, en la zona periférica, DWI se considera «dominante», mientras que en la zona de transición T2W se considera «dominante».
Un cáncer típico dentro de la próstata parece hipointenso en la resonancia magnética T2W, con baja señal en el mapa de ADC pero alta señal en DWI de alto valor b. La imagen típica aumenta su intensidad después de la administración de contraste en DCE-MRI.
La interpretación de mpMRI se ha mejorado mediante la adopción de las pautas PI-RADSv2. En PI-RADSv2, se asigna una puntuación de 1 a 5 a cada lesión. Si la lesión está en el PZ, la puntuación depende en gran medida de la puntuación DWI y menos en T2W y DCE-MRI. (figura 2)
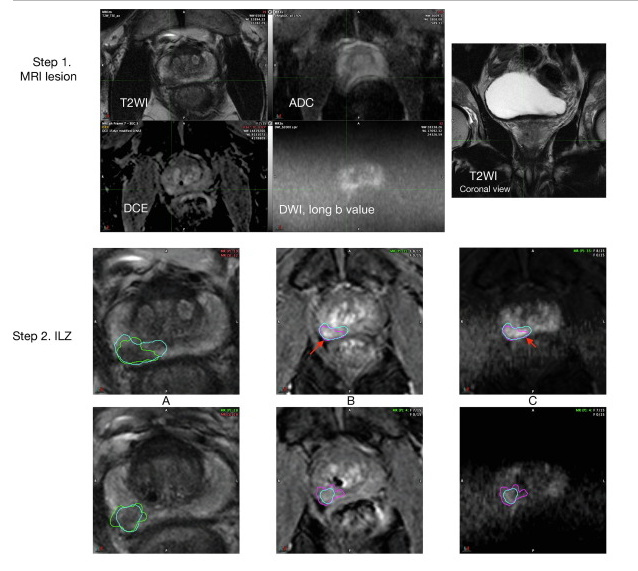
Fig. 2. European Urology Open Science, Volume 72, February 2025, Pages 36-41
Consideraciones específicas con respecto a la resonancia magnética multiparamétrica en la terapia focal
Si bien la detección, caracterización y estadificación del cáncer de próstata son primordiales en la evaluación del paciente general con cáncer de próstata, los volúmenes tumorales precisos son particularmente importantes para la planificación de la terapia focal.
La mayoría de los expertos en el campo de la mpMRI de próstata y la urología coincidieron en que 0,5 ml es el «límite inferior de una tasa de detección confiable en los tumores de Gleason 6». Los tumores de Gleason 7 pueden ser posibles de detectar a volúmenes más pequeños, aunque esto no está ampliamente aceptado. Si bien mpMRI detecta con precisión los tumores de próstata clínicamente significativos, existe el riesgo de subestimación y sobreestimación cuando se usa mpMRI para estimar el volumen del tumor.
Se han realizado estudios para determinar qué secuencia es más precisa para la evaluación del volumen tumoral, aunque existen algunas diferencias en los resultados. Por ejemplo, Bratan et al. han demostrado que ninguna secuencia de mpMRI es superior para estimar con precisión los volúmenes tumorales; sin embargo, el «mayor volumen determinado en las imágenes de cualquiera de las secuencias de pulso MR individuales» fue menos probable que conduzca a una subestimación del volumen tumoral (9). Por el contrario, Mazaheri et al. descubrieron que DWI más T2WI mejoraron significativamente la precisión de la medición del volumen del tumor de próstata en la zona periférica (10).
El problema de la subestimación del volumen tumoral puede mitigarse mediante el uso de un margen de tratamiento de al menos 9 mm alrededor de las lesiones visibles en mpMRI (11), teniendo en consideración la dirección de la potencial diseminación. (figura 3). No es necesario decir que un margen de 9 mm es muy extenso, y se necesita más trabajo para garantizar que los tamaños de las lesiones mpMRI y las zonas de tratamiento estén mejor delineadas, especialmente si esto se va a utilizar como una modalidad de diagnóstico para planificar y monitorear la terapia focal.
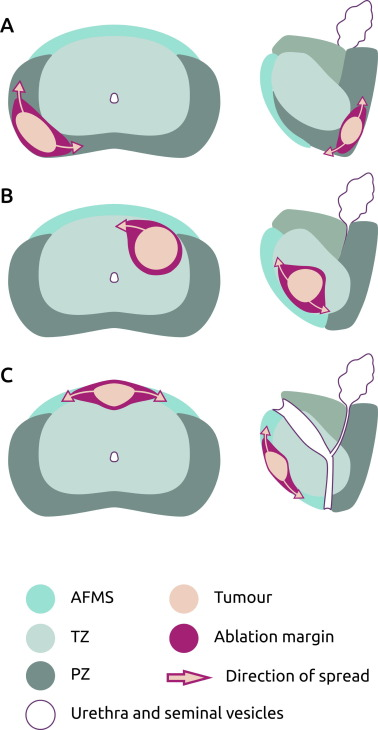
Fig 3. European Urology Open Science, Volume 72, February 2025, Pages 36-41
Técnicas de biopsia dirigida por imágenes de resonancia magnética
Actualmente se utilizan tres métodos de guía de MRI para la realización de una biopsia de próstata dirigida: fusión cognitiva, biopsia directa guiada por MRI (biopsia «interna») y biopsia guiada por fusión MRI / TRUS (registro basado en software).
Biopsia de próstata dirigida por resonancia magnética en el resonador.
Descrita por primera vez en 2000 (11), la biopsia de próstata dirigida por resonancia magnética en el interior del resonador se realiza bajo guía de resonancia magnética mientras el paciente está en el imán (interior) y permite la visualización directa en tiempo real de la anomalía de la RM como, así mismo, la aguja.
A pesar del éxito inicial con varios estudios que demuestran su eficacia, la biopsia guiada por resonancia magnética no se ha aceptado clínicamente debido a varias limitaciones. En primer lugar, el procedimiento es relativamente largo y a menudo requiere sedación ya que los pacientes deben permanecer quietos durante todo el procedimiento. Además, la técnica es costosa y requiere personal capacitado y equipos especializados seguros para MR. Por último, la biopsia se realiza en el departamento de radiología y, por lo tanto, interfiere con el flujo de trabajo normal del día a día.
Biopsia de próstata guiada por TRUS-MRI con registro cognitivo
La biopsia de próstata guiada por MRI-TRUS con registro cognitivo (o «visual») requiere que el urólogo que realiza la biopsia revise o tenga en cuenta los hallazgos de mpMRI para registrar cognitivamente la ubicación sospechosa del objetivo en las imágenes TRUS en tiempo real y, posteriormente, guiar manualmente la aguja al sitio correspondiente del objetivo.
La precisión de esta técnica depende de la habilidad del operador, además de la precisión de mpMRI para detectar PCa. Con el avance de la mpMRI, este método descrito a principios de la década de 2000 se ha utilizado ampliamente. En manos experimentadas se ha demostrado que este enfoque tiene una precisión de hasta el 82% en el muestreo del objetivo correcto, siendo los tumores anteriores los más difíciles (12). Esta puede ser la técnica más utilizada debido a su simplicidad tecnológica y la no necesidad de equipos costosos adicionales. Además de los complejos desafíos técnicos y cognitivos de esta técnica, existen otras limitaciones. Específicamente, las imágenes mpMRI pueden reflejar una apariencia geométrica diferente de la próstata en comparación con las imágenes TRUS en tiempo real, el grado de distensión de vejiga y / o recto y el grado de distorsión de la sonda de ultrasonido, lo que dificulta el registro espacial. La experiencia, el conocimiento de la topografía zonal y los puntos de referencia anatómicos son fundamentales para una focalización exitosa (13).
Varios estudios han comparado la fusión cognitiva con la técnica de biopsia sistemática convencional y con las plataformas de registro basadas en software. Haffner y col. demostró, en una cohorte de 555 pacientes con sospecha de cáncer de próstata, que la biopsia de fusión cognitiva tenía una mayor precisión de detección del cáncer clínicamente significativo en relación con la biopsia sistemática extendida que involucra 10-12 núcleos (p <0.001) (13). Además, la biopsia dirigida con registro cognitivo detectó un 16% más de cánceres de grado 4/5 y una carga tumoral cuantificada con mayor precisión (p = 0,002).
Del mismo modo, Park et al. demostró en una evaluación prospectiva en pacientes con PSA elevado y sin antecedentes de biopsia que la fusión cognitiva tenía tasas de detección de cáncer más altas (29.5% vs.9.8%, OR3.9, p = 0.03) en relación con la biopsia TRUS sola (14).
En el ensayo prospectivo PROFUS, Wysock et al. comparó los resultados de la biopsia dirigida entre la biopsia de fusión por resonancia magnética / ecografía y la biopsia de fusión cognitiva y encontró tasas de detección de cáncer similares para todos los cánceres (32.0% frente a 20.3%, p = 0.1374) y la suma de Gleason ≥7 (26.7% frente a 15.1 %, p = 0,0523) (15).
Otro estudio comparó la biopsia de fusión MRI / TRUS dirigida (tanto la fusión cognitiva como la basada en software) con la biopsia sistemática guiada por TRUS en un ensayo prospectivo de 95 pacientes que tenían imágenes sospechosas en mpMRI (16); descubrieron que las tasas de positividad para el cáncer de próstata (69% frente a 59%, p=0.033) y la calidad de muestreo (longitud máxima del cáncer por núcleo, grado de Gleason) fueron superiores con la biopsia dirigida en comparación con la biopsia sistemática, independientemente de la visión (cognitiva) – registro basado o registro asistido por software.
Los resultados con la biopsia de fusión cognitiva son mixtos, ya que algunos estudios han demostrado que la biopsia de fusión cognitiva no es mejor que la biopsia TRUS sistemática. Delongchamps y col. probó la precisión de la biopsia dirigida visual en 127 pacientes y no encontró diferencias en comparación con la biopsia sistemática con respecto a la tasa de detección de cáncer (p = 0,66) (17). En la única evidencia de Nivel I hasta la fecha que compara la biopsia de fusión cognitiva con la biopsia sistemática TRUS de 10 a 12 núcleos. Tonttila et al. no encontraron diferencias en las tasas de detección de cáncer tanto para los cánceres generales (64% frente a 57%, p=0.5) como clínicamente significativos (55% frente a 45%, p = 0.8); por lo tanto, los autores concluyeron que la RM de próstata adicional antes de la biopsia de próstata no agregaba un valor significativo (18). Sin embargo, en lugar de inferir que no se logra ningún beneficio de la resonancia magnética, este estudio puede indicar que existe un beneficio limitado en pacientes sin biopsia.
Por último, en comparación directa de MRI / Fusión TRUS versus registro cognitivo, un estudio encontró que el registro cognitivo es inferior a la fusión MRI / TRUS basada en software, ya que menos del 50% de las lesiones de cáncer de próstata clínicamente significativas se muestrearon con éxito con registro cognitivo, independientemente del nivel de experiencia (19).
La biopsia de fusión cognitiva depende en gran medida del operador y requiere un amplio conocimiento de la anatomía de la próstata para extrapolar la ubicación de la lesión de MRI a TRUS sin una superposición real y registro de imágenes. Un estudio destaca la dificultad para realizar el registro visual, ya que las imágenes TRUS 2D se proyectan en un patrón en forma de abanico y pueden ser marcadamente diferentes del plano de imagen axial en la resonancia magnética, lo que dificulta la estimación precisa de la ubicación de la lesión durante la biopsia TRUS (20). Esta disparidad de imagen es más evidente en la base anterior y las lesiones apicales anteriores.
La estimación inexacta de la localización de la lesión puede superarse parcialmente mediante la utilización de puntos de referencia anatómicos, como quistes prostáticos, nódulos de hiperplasia prostática benigna (HPB) y / o cálculos como puntos de referencia internos para ayudar a guiar aún más la aguja de biopsia. Sin embargo, estos «fiduciales internos» no siempre están presentes, y la ecogenicidad heterogénea en TRUS puede llevar falsamente al lector a registrar erróneamente las imágenes, cuyas pequeñas diferencias pueden alterar drásticamente los resultados. Como limitación final, los métodos de fusión cognitiva no ofrecen la capacidad de rastrear y registrar coordenadas de biopsia para referencia posterior.
Biopsia de próstata por fusión guiada por TRUS-MRI
La siguiente innovación tecnológica de la biopsia de próstata guiada por resonancia ha sido el advenimiento de la fusión (o «registro») de hardware y software que permite la orientación en tiempo real al registrar y superponer las imágenes de mpMRI mapeadas previamente adquiridas en las imágenes TRUS durante la biopsia. Típicamente, esto se hace delineando (o «mapeando») el margen de próstata y la lesión sospechosa en las imágenes de mpMRI. Estas imágenes se transfieren posteriormente a una estación de trabajo especializada. TRUS toma imágenes de todo el volumen de la próstata, y el software fusiona las imágenes de resonancia magnética y de ultrasonido de la próstata mediante el uso de los límites como una guía (utilizando un método fijo y / o flexible). Posteriormente, el hardware monitorea la posición de la sonda TRUS con respecto a la próstata y puede proporcionar imágenes en tiempo real para alinear la biopsia con el sitio registrado de la lesión objetivo. (Figura 4)
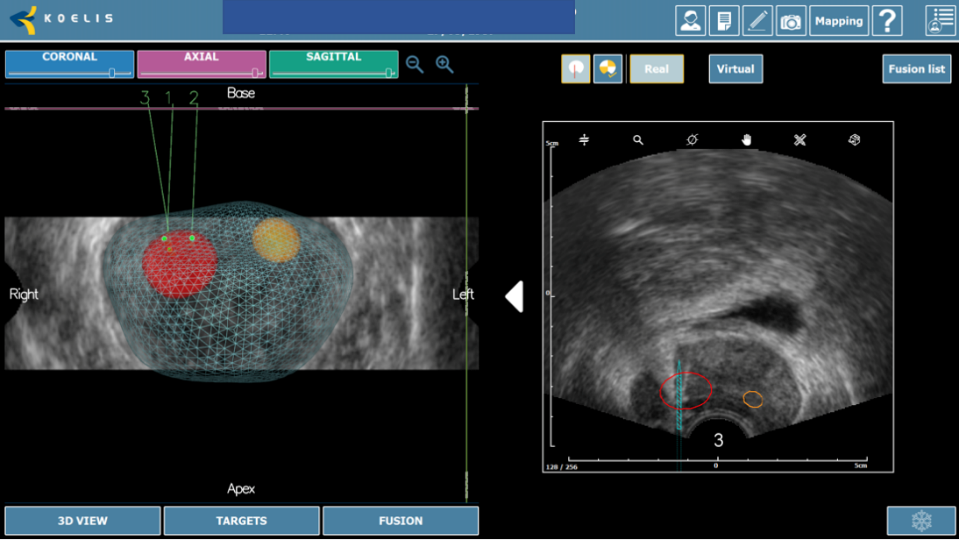
Fig. 4. Biopsia por fusión. Imagen de fusión con objetivo (izquierda). Tecnología organ based tracking para control del disparo (derecha)
En comparación con el registro cognitivo, esta técnica potencialmente ha mejorado la reproducibilidad al disminuir la dependencia del médico a la interpretación de la resonancia. Sin embargo, esta técnica requiere hardware y software especiales, capacitación e implementación meticulosa. Rara vez se visualiza la lesión de las imágenes de ultrasonido. Sin una imagen de ultrasonido que se correlacione con la anormalidad de la resonancia magnética, la precisión de esta técnica depende de numerosos factores técnicos, que pueden hacer que la focalización sea subóptima. Las limitaciones de esta técnica incluyen los costos adicionales del hardware y el software, la precisión del software de fusión, la precisión de la localización espacial de la sonda TRUS y la curva de aprendizaje y la capacitación asociadas.
Transrectal versus Transperineal: Cambio de paradigma en biopsias prostáticas
La biopsia prostática transperineal (TP) evita el recto y su flora bacteriana asociada, accediendo a la próstata a través de la piel del periné. A pesar de usar una vía diferente, permite tomar el mismo número de muestras que se recomienda para las biopsias transrectales (21). En general, a los pacientes se les administra una cefalosporina de primera generación como profilaxis antibiótica, y el riesgo de sepsis es prácticamente nulo (22). Incluso, estudios recientes han mostrado tasas similares de infección sin usar antibióticos (23).
La trayectoria de la aguja en la biopsia TP es paralela al eje longitudinal de la próstata, lo que mejora el acceso a las zonas anterior y apical (24). Estas áreas, según estudios con biopsias dirigidas por resonancia magnética (MRI in-bore), son las que con mayor frecuencia se omiten en la biopsia transrectal guiada por ecografía (TRUS) (25).
Históricamente, una de las principales desventajas de la biopsia TP era que debía realizarse bajo anestesia general en pabellón, lo que implicaba mayor uso de recursos y contribuyó a su lenta adopción a nivel mundial. Sin embargo, estudios recientes a gran escala han demostrado que se puede realizar bajo anestesia local con resultados similares en cuanto al dolor postoperatorio, tasas de complicaciones (26, 27) y diagnóstico de cáncer prostático clínicamente significativo (csPCa) (28).
En un estudio multicéntrico y aleatorizado, Hu y colaboradores asignaron a pacientes sin biopsias previas a dos grupos: uno con biopsia TP (287 casos) sin profilaxis antibiótica, y otro con biopsia transrectal (TR, 280 casos) usando profilaxis dirigida (29). En este último grupo, se realizó un cultivo rectal para detectar bacterias resistentes a fluoroquinolonas, y luego se administró el antibiótico según los resultados del cultivo. Las tasas de complicaciones infecciosas y no infecciosas, así como la detección de cáncer clínicamente significativo, fueron similares entre ambos grupos.
Mian et al. también demostraron que la tasa de infecciones era comparable entre biopsias TP sin antibióticos y biopsias TR con antibióticos (30) Si bien el enfoque TP tiene ventajas claras como un menor uso de antibióticos, menor riesgo de resistencia bacteriana y menos ingresos hospitalarios por urosepsis, suele ser más lento, requiere más personal, y en el sistema de salud de EE. UU., el reembolso al médico no es proporcional al esfuerzo.
Por otro lado, según una encuesta realizada en 2023, menos del 50% de los residentes de urología habían tenido exposición a la técnica TP durante su formación, lo que naturalmente reduce la intención de usarla una vez egresados (31) Algunos sostienen que, aunque el riesgo de infección en la técnica TR es mayor, sigue siendo bajo en centros con experiencia. De todas formas, aún se necesitan más estudios que evalúen el costo-beneficio de la TP, especialmente considerando la posibilidad de evitar completamente el uso de antibióticos en ciertos grupos de pacientes.
Indicaciones para biopsia por fusión
A medida que la adopción de la biopsia de fusión ha aumentado constantemente en los últimos años, las indicaciones para su uso se han ampliado. La biopsia dirigida actualmente tiene un papel establecido en los siguientes tres escenarios: (1) pacientes con sospecha continua de cáncer de próstata a pesar de las biopsias TRUS sistemáticas negativas previas, (2) pacientes con cáncer de próstata aparente de bajo riesgo interesado en la vigilancia activa o tratamiento focal y (3) pacientes con lesiones definidas por mpMRI en ubicaciones de la próstata que tradicionalmente se pasan por alto con una biopsia sistemática de 12 núcleos.
1.- Un estudio demostró la utilidad de la biopsia de próstata dirigida en hombres con biopsia negativa previa y PSA elevado, ya que la biopsia por fusión reveló cáncer de próstata en el 34% (36/105), y de estos, el 72% tenían enfermedad clínicamente significativa (32). Del mismo modo, Vourganti et al. mostró en una cohorte de biopsia TRUS negativa previa de 195 hombres que la biopsia de fusión MRI / TRUS detectó todos los cánceres de alto grado (21 hombres, 11%), mientras que la biopsia TRUS estándar omitió 12 de estos cánceres de alto grado (55%) (33) Además, en un estudio prospectivo realizado por Salami et al. en 140 pacientes con al menos una biopsia negativa previa, la tasa de detección para el cáncer de próstata clínicamente significativo de la biopsia por fusión fueron significativamente mayores que las de la biopsia convencional de 12 núcleos (47,9% frente a 30,7%, p <0,001) (34).
2.-Con respecto a la vigilancia activa (AS), la biopsia por fusión ha demostrado su utilidad en la confirmación elegibilidad para AS y el monitoreo continuo (35). En un estudio de 113 hombres inscritos en un protocolo AS, la biopsia de fusión confirmatoria resultó en una reclasificación en el 36% de los pacientes, incluidos 26 (23%) debido a Gleason grado 6 o superior y 15 (13%) debido a un alto volumen de enfermedad Gleason 6 (36).
De manera similar, Stamatakis et al encontró que el 29% de su cohorte (25/85 hombres) ya no cumplía con los criterios AS después de una biopsia de próstata guiada por fusión confirmada por IRM / TRUS (37). En este estudio, el número de lesiones por resonancia magnética, la densidad de la lesión y la puntuación más alta de sospecha de lesión por resonancia magnética fueron los predictores significativos de resonancia magnética de los pacientes que serían candidatos pobres para la AS. Además, en un estudio de 111 pacientes con AS, los investigadores mostraron que el uso de mpMRI con biopsia de fusión posterior aumentó significativamente la tasa de terminación de AS en relación con la biopsia de plantilla estándar sola (27 vs. 10, p = 0.015) (38).
Los primeros trabajos han demostrado un monitoreo exitoso del cáncer en pacientes con EA que usan IRM para rastrear electrónicamente sitios específicos de cáncer dentro de la próstata, permitiendo el regreso a ese sitio específico con biopsias dirigidas posteriores (39). El muestreo repetido de sitios cancerosos dentro de los objetivos de IRM tenía más probabilidades de mostrar cáncer que el muestreo de tumores en sitios sistemáticos (61% frente a 29%, p = 0,005), lo que sugiere una precisión mejorada en los métodos de muestreo asistidos por IRM sobre TRUS- métodos guiados.
Walton Díaz y col. ilustraron la utilidad de la biopsia por fusión mpMRI serie y MRI / TRUS en el seguimiento de pacientes con AS, ya que los hallazgos estables en mpMRI se asociaron con la estabilidad de la puntuación de Gleason (40). En este estudio, el número necesario para realizar una biopsia para detectar una progresión de Gleason fue de 8,74 para la biopsia sistemática de 12 núcleos frente a 2,9 para la biopsia de fusión MRI / TRUS. Si bien es necesario seguir trabajando, estos estudios iniciales ayudan a validar el uso de imágenes en serie y biopsia de fusión dirigida con un número limitado de núcleos como herramientas para monitorear a los pacientes con AS.
3.- Por último, la biopsia de fusión MRI / TRUS ha demostrado utilidad en las regiones de la próstata que generalmente se pierden con la biopsia sistemática de 12 núcleos, como la próstata anterior, las apicales distales y las regiones subcapsulares (41). Por lo tanto, la biopsia por fusión podría emplearse potencialmente en pacientes en los que las imágenes de RM ilustran la presencia de lesiones en regiones que tradicionalmente están fuera de la plantilla sistemática de biopsia de 12 núcleos.
A pesar del progreso sustancial en tan poco tiempo, hay muchas preguntas que aún quedan sin respuesta. En este momento, la mayoría de los centros realizan una biopsia sistemática además de la biopsia dirigida. Esto se hace, en parte, para comparar las dos formas de biopsia en el mismo paciente, pero también porque todavía hay una proporción de estos en los que la biopsia sistemática revela una enfermedad clínicamente significativa omitida por la biopsia de fusión dirigida. Por lo tanto, aún no se ha determinado si la biopsia dirigida se puede usar sola o como una estrategia complementaria con la biopsia sistemática.
Conclusión
La biopsia dirigida por fusión MRI / TRUS, en general, detecta más cánceres clínicamente significativos con menos muestras, que la biopsia estándar. Una crítica importante de la biopsia sistemática es la tendencia a identificar indiscriminadamente cánceres de bajo riesgo clínicamente más insignificantes y cánceres de alto riesgo menos relevantes clínicamente. Por lo tanto, la biopsia por fusión puede permitir una estratificación de riesgo más precisa y un tratamiento posterior. La utilidad clínica de la tecnología de fusión en varios escenarios es evidente, como en pacientes con antecedentes de biopsias TRUS negativas previas, pero sospecha de cáncer de próstata continua, monitoreo de pacientes en vigilancia activa, candidatos a terapia focal y estar alerta de lesiones en áreas de la próstata que tradicionalmente se pasan por alto mediante las biopsias sistemáticas.
TRATAMIENTO FOCAL
La terapia focal es una estrategia que busca tratar únicamente las zonas de la próstata donde se ha identificado cáncer agresivo, utilizando fuentes de energía altamente dirigidas como la crioterapia (que congela el tejido con temperaturas muy bajas), el HIFU (ultrasonido focalizado de alta intensidad que genera calor), láseres u otros métodos no térmicos como los pulsos eléctricos (electroporación irreversible).
Esta alternativa terapéutica se ha hecho posible en las últimas dos décadas gracias a los avances en imágenes diagnósticas y en biopsias dirigidas, que permiten localizar con mayor precisión el cáncer de próstata, además del desarrollo de tecnologías capaces de tratar de manera focal la enfermedad.
Generalmente, esta estrategia se considera adecuada en pacientes con una o dos lesiones bien definidas de cáncer prostático clínicamente significativo. Esto permite tratar el cáncer reduciendo al mínimo el daño a los tejidos circundantes, y por ende, disminuyendo los efectos secundarios—en especial, preservando la función sexual y urinaria.
De todas formas, estas técnicas aún están en estudio para comparar su eficacia a largo plazo con los tratamientos tradicionales como la prostatectomía radical o la radioterapia.
Es importante entender que los riesgos del tratamiento —como los posibles efectos secundarios a corto o largo plazo— dependen en parte del tipo de tecnología que se use. Aún se están haciendo estudios para comparar estas técnicas entre sí, pero no es fácil, porque los riesgos también cambian según las características del paciente antes del tratamiento, y según el tamaño y la ubicación del cáncer dentro de la próstata.
A principios del siglo XXI, cuando Onik y después Bahn fueron los primeros en reportar tratamientos del cáncer de próstata mediante la ablación de un hemisferio de la glándula, la única energía disponible era la crioterapia. En ese tiempo, era lo único que se podía usar para hacer terapia focal.
Desde entonces, el panorama ha cambiado bastante. Se han sumado nuevas tecnologías ablativas como el ultrasonido focalizado de alta intensidad (HIFU), la electroporación irreversible (IRE), la terapia fotodinámica (PDT), la ablación láser focal (FLA), la radiofrecuencia (RFA), la braquiterapia focal y el sistema TULSA-PRO.
Además, el enfoque se ha vuelto mucho más preciso gracias al uso de imágenes avanzadas como la resonancia magnética (RM), el micro-ultrasonido o el ultrasonido con microburbujas. Esto permite dirigir el tratamiento justo donde está el tumor, y no basarse solamente en las biopsias sistemáticas que se hacían antes, que eran más al azar.
Este cambio ha sido clave para avanzar en terapias menos invasivas y más personalizadas, algo que como futuros urólogos debemos conocer bien.
HIGH – INTENSITY FOCUSED ULTRASOUND (HIFU)
Introducción
El ultrasonido focalizado de alta intensidad (HIFU) es un tratamiento mínimamente invasivo para el cáncer de próstata localizado (PCa). Esta tecnología se desarrolló inicialmente para el tratamiento de toda la glándula, con la posibilidad de repetir el tratamiento en caso de falla. La comunidad urológica ha mostrado un creciente interés en HIFU debido a su eficacia en la destrucción del tejido prostático y sus efectos secundarios limitados. HIFU induce necrosis coagulativa de un tumor con límites precisos. Permite la destrucción de un pequeño volumen de tejido dentro de la glándula y tiene un impacto limitado a nivel del tejido circundante. Estas ventajas lo convierten en una opción ideal para el tratamiento focal de la PCa localizada.
HIFU se ha convertido en una de las alternativas más utilizadas y con mayor respaldo en la literatura para el tratamiento del cáncer de próstata localizado.
Principios físicos
HIFU convierte la energía de las ondas de ultrasonido (US) en calor, lo que da como resultado una necrosis de coagulación inmediata e irreversible con límites claramente delimitados al nivel del objetivo. Los principios básicos de HIFU se basan en la creación de ondas US emitidas por un transductor de alta potencia capaz de alcanzar intensidades más altas (100–10,000 W / cm2) que las utilizadas en diagnóstico convencional y su característica de poder ser dirigido, sin afectar los tejidos circundantes (1). HIFU es generado por un transductor piezoeléctrico. Este transductor tiene una configuración parabólica que enfoca las ondas de sonido en un punto focal fijo (Figura 5). Las características del área tratada, en términos de su tamaño y forma, dependen de algunas variables: la configuración geométrica del transductor, la intensidad acústica promedio en el tiempo, la duración y el coeficiente de absorción del tejido objetivo (1,2).
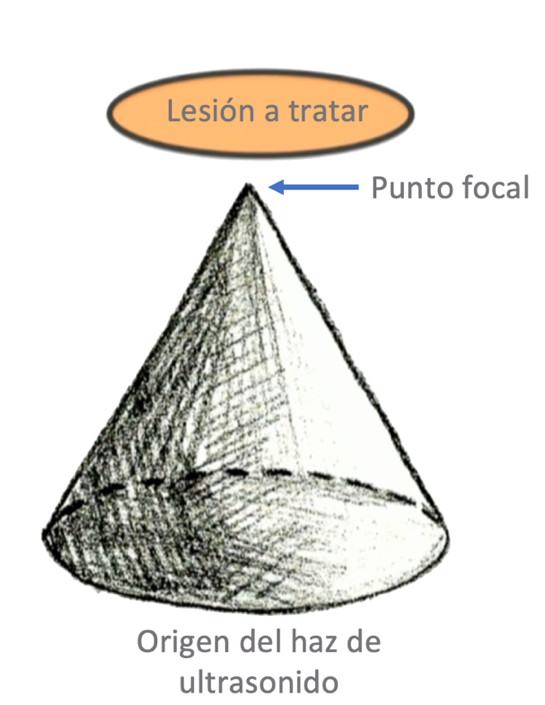
Fig. 5: Física del tratamiento con ultrasonido focalizado de alta intensidad (HIFU)
El efecto de ablación de tejido de HIFU se basa en dos mecanismos principales: un efecto térmico y un efecto mecánico. Debido a que el rayo US es concentrado en una pequeña área de tejido, produce una presión máxima en ese punto focal. Esta presión acústica crea el movimiento del tejido (dilatación y contracción), lo que resulta en una pérdida de energía que se convierte en calor, aumentando la temperatura a más de 60 ° C y provocando desnaturalización de proteínas y necrosis de los tejidos por coagulación. Debido a la caída significativa de energía fuera de la zona focal, el daño térmico más allá de los límites del tratamiento se minimiza. A intensidades más altas de pulsos acústicos, podría producirse el efecto mecánico, caracterizado por la interacción de las ondas de US con microburbujas de agua que colapsan como resultado de la compresión y expansión alternas, lo que finalmente resulta en una dispersión de energía con la consiguiente ablación de tejido, este efecto se llama cavitación (1,2). (Figura 6)
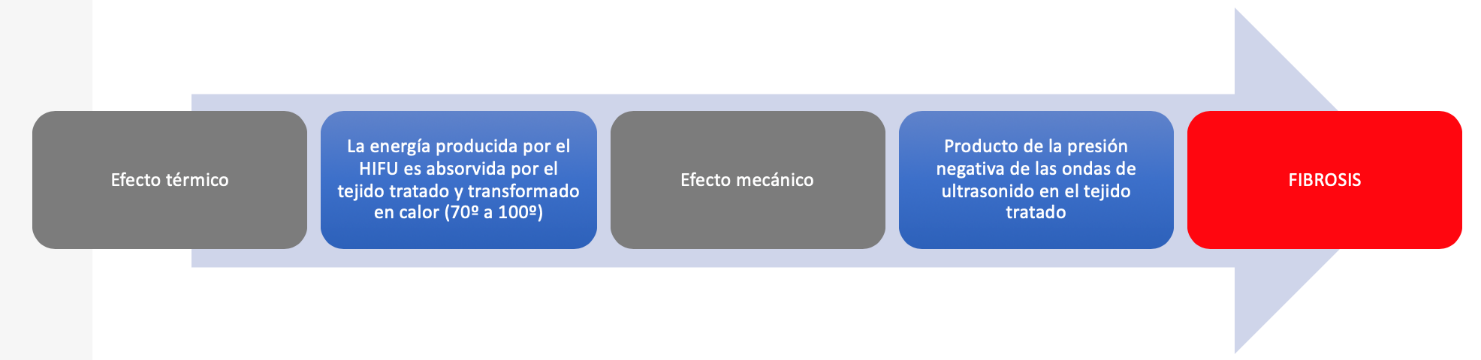
Fig. 6. Efectos producidos en el tejido a tratar mediante HIFU.
Procedimiento
El tratamiento con HIFU se realiza por vía transrectal, bajo anestesia general, en decúbito lateral derecho. Se realiza un enema la noche anterior, y profilaxis antibiótica preoperatoria. Se coloca sonda Foley, para evitar la retención urinaria postoperatoria
La próstata se escanea con la sonda de US. El operador define los contornos de la próstata y delinea las lesiones sospechosas a tratar en las imágenes de Resonancia. Los límites de la próstata se definen en la imagen en tiempo real de la próstata obtenida con la sonda trans-rectal del dispositivo. El software ejecuta automáticamente una «fusión elástica» de los dos volúmenes definidos, lo que conduce a una combinación tridimensional (3D) perfecta del volumen de RM con el volumen de la próstata en US. La misma fusión 3D se aplica al área sospechosa previamente identificada en la resonancia magnética y/o Biopsia por fusión que, por lo tanto, se puede identificar correctamente en la imagen en vivo de US. (Figura 7-8).
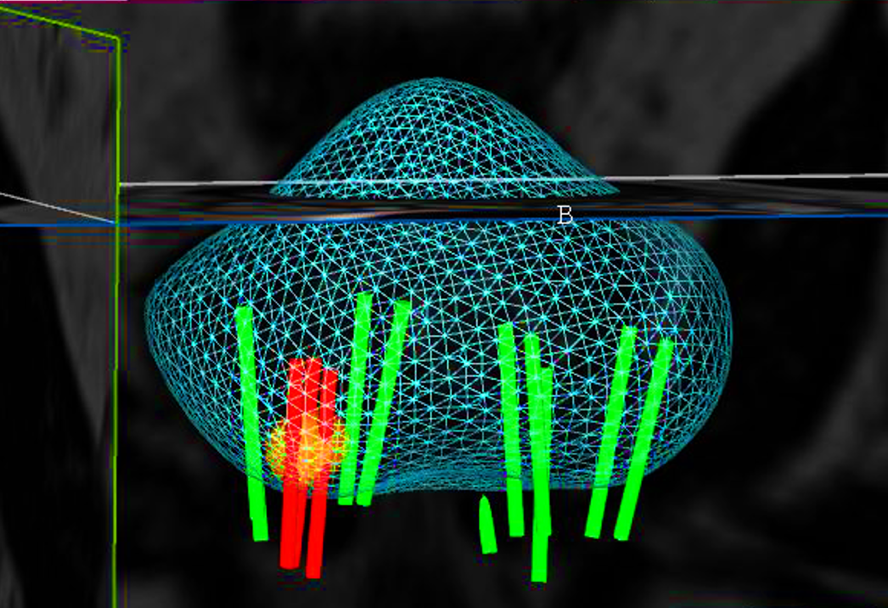
Fig. 7. Reconstrucción 3D biopsia por fusión, con cilindros negativos para cáncer(verdes), positivos (rojos) y área sospecha marcada en resonancia (amarillo).
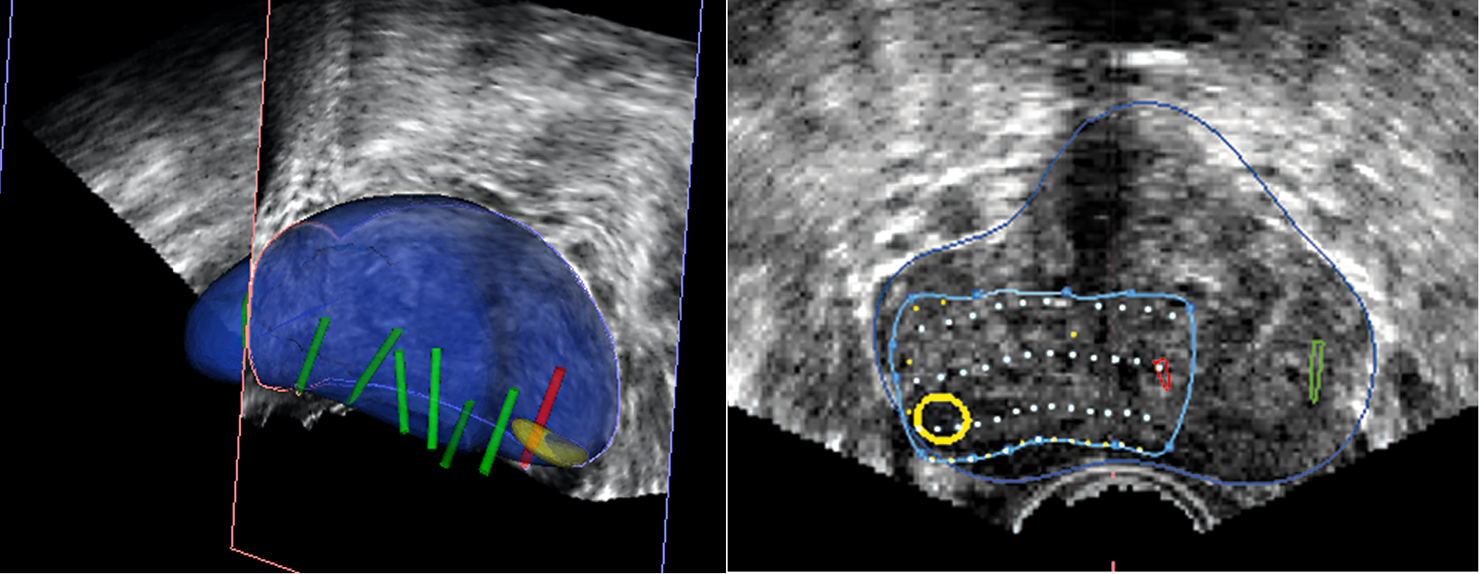
Fig. 8. Planificación de tratamiento. Dibujo de la lesión a tratar, con margen de seguridad.
Al final del tratamiento, el sistema le permite al médico evaluar los resultados finales del proceso realizando US con contraste (CEUS) (Figura 9). La imagen se puede comparar con la resonancia magnética inicial para verificar la correcta ablación de la lesión cancerosa.
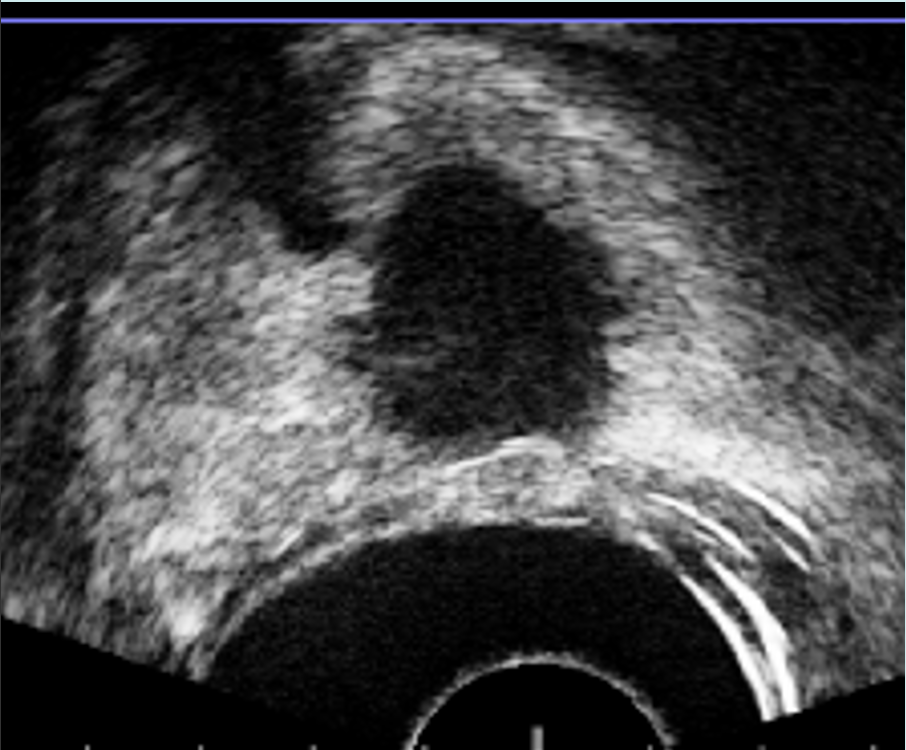
Fig. 9. Inyección de Sonovue® al finalizar el procedimiento. Se observa que la lesión tratada (flecha), está desvascularizada y no capta contraste.
Últimamente, algunos médicos han comenzado a utilizar una técnica conocida como “double tap” o “escalamiento de dosis” en HIFU, que consiste en aplicar dos pasadas de ablación focal con HIFU en la zona de interés dentro de la próstata, con el objetivo de reducir el riesgo de recurrencia del cáncer dentro del área tratada.
Esta estrategia tiene varias ventajas potenciales: permite aumentar la cantidad de energía aplicada, reducir el efecto de disipación térmica (heat-sink), compensar posibles desplazamientos o edema prostático ocurridos durante la primera pasada del tratamiento, y disminuir la probabilidad de dejar focos tumorales sin tratar (skip lesions).
Aunque desde el punto de vista teórico esta técnica parece prometedora, aún se espera evidencia más sólida que respalde su eficacia, seguridad y sus resultados oncológicos y funcionales a largo plazo.
Indicaciones
Al comienzo, la indicación de terapia focal estaba dirigido a PCa T1-2N0M0, Gleason score ≤6 que no eran candidatos o que rechazaban la cirugía radical. Sin embargo, con la acumulación de la experiencia clínica, estas indicaciones se han expandido incluyendo, en la actualidad, ablación parcial en tumor unilateral, bajo volumen, de bajo grado (T1-2aNx/0M0, PSA ≤20 ng/ml, Gleason score ≤7) y terapia de salvataje en recurrencia post Radioterapia 3.
En la selección, se deben tener en cuenta los factores clínicos y patológicos con respecto al volumen de la próstata, la localización y las dimensiones de la lesión índice o dominante, y las condiciones anómalas y comorbilidades que eventualmente dificultan el tratamiento. Aunque el gran volumen de próstata originalmente representaba una contraindicación real en el contexto del tratamiento de HIFU de glándula completa, este problema ya no es una limitación para HIFU focal, especialmente en el caso de lesiones posteriores o posterolaterales.
El tratamiento del ápice también podría tener un impacto significativo en la continencia urinaria (CU), dada la proximidad del esfínter externo al tejido extirpado. Se debe considerar un margen de seguridad de 6 mm por encima del ápice, basado en cálculos teóricos y hallazgos histológicos. Por estas razones, las lesiones puramente apicales deben tratarse con precaución para limitar el riesgo de complicaciones funcionales o sub-tratamiento.
Finalmente, existen contraindicaciones específicas para el tratamiento con HIFU. Las condiciones anatómicas o patológicas, que limitan la introducción correcta de la sonda a través del recto, representan una contraindicación absoluta. Del mismo modo, el procedimiento no debe realizarse en pacientes con una fístula rectal. La presencia de calcificaciones intrapróstatas importantes (> 1 cm) debe verse como una contraindicación relativa.
Candidatos y Contraindicaciones para HIFU:
La selección de pacientes para ablación parcial de la próstata con HIFU) sigue los principios generales de la terapia focal. En términos generales, los pacientes con cáncer de próstata localizado unilateral Grade Group (GG) 2 y 3 son considerados candidatos ideales para terapia focal, con una resonancia de próstata demostrando una lesión visible en la misma área. Estos pacientes, tienen una enfermedad clínicamente significativa pero aún localizada, lo que permite un tratamiento dirigido con intención curativa y bajo riesgo de efectos secundarios.
Las contraindicaciones específicas para el uso de HIFU son:
- Presencia de calcificaciones intraprostáticas densas o agrupaciones de cálculos mayores a 1 cm, ya sea en la zona objetivo o en el trayecto del haz de ultrasonido.
- Antecedentes médicos de fístula rectal, fibrosis o estenosis rectal. También se incluye la estenosis anal importante.
- Enfermedades inflamatorias intestinales como colitis ulcerosa o enfermedad de Crohn.
- Espesor de la pared rectal mayor a 8 mm (lo que puede dificultar la transmisión del ultrasonido y aumentar el riesgo de complicaciones).
Puramente focal, parcial (hemi-ablación) o total.
Al diagnóstico, más del 90% de los cánceres de próstata son multifocales. Una enfermedad unifocal se presenta en el 20% al 40% de los pacientes (4).
Una dicotomía se presenta, con relación a tratar solamente la lesión índice o toda la glándula. Una lesión índice única, que representa el foco de mayor volumen, a menudo predice la evolución oncológica, esto debido a que la mayoría (o todas) de las células metastásicas provienen de esta lesión (5). Esto lleva a la posibilidad de tratar solamente esta lesión índice, lo que sería suficiente para evitar la progresión de la enfermedad.
La terapia focal permite la preservación de la mayoría de tejido prostático normal, incluyendo los haces neurovasculares y mecanismos de la continencia urinaria. Adicionalmente, los avances en mpMRI y los mapas de Biopsias por fusión, definen precisamente la lesión objetivo y usando HIFU uno puede tratar solamente esa lesión o esa área a fin de mantener un margen de seguridad oncológica (Figura 8).
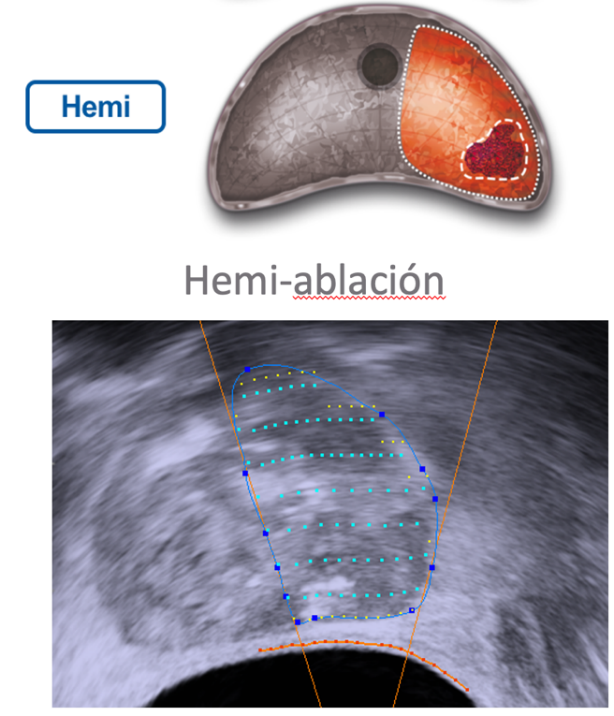
A diferencia de un tratamiento total, la hemi-ablación es la ablación de la mitad de la próstata, donde se encuentra el tumor, esta es la estrategia más utilizada en la actualidad. (Figura 10).
a b
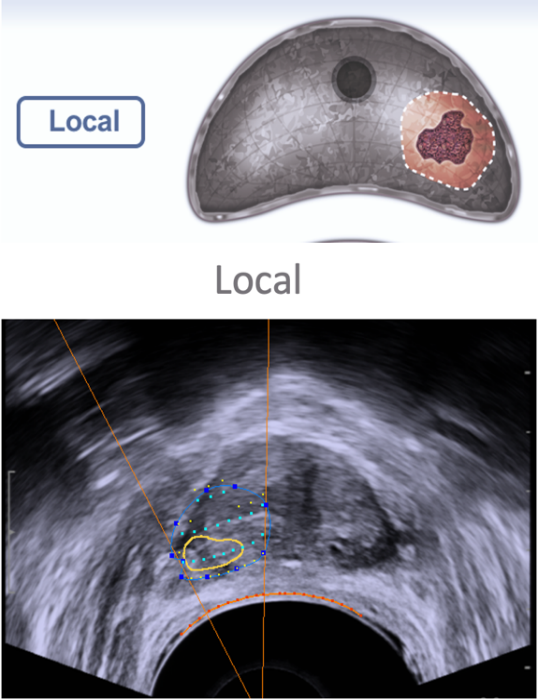
Fig. 10. Estrategias de tratamiento: a: Hemi-ablación. b: Puramente focal.
Crouzet et al, reportó su experiencia en pacientes tratados con ablación total, Todos los pacientes se trataron con Ablatherm HIFU (EDAP-TMS, Vaulx-en-Velin, Francia). Una segunda sesión de HIFU fue realizada en los pacientes con diagnóstico de recurrencia por biopsia. La sobrevida global y cáncer específica a 10 años fue de 80% y 97% respectivamente. La sobrevida libre de metástasis a 10 años fue de un 94% (6).
La mayoría de los estudios con más de 10 años de seguimiento son de tratamiento total. La experiencia con hemiablación o estrategia puramente focal es más limitada e inmadura, lo que hace necesario mayor seguimiento y análisis cuidadoso de las series reportadas antes de su masificación como alternativa equivalente a la ablación total.
Seguimiento
La estrategia para seguir los pacientes sometidos a un tratamiento focal debe ser en el contexto de estudios clínicos que aseguren mediciones alejadas que definan éxito o fracaso y que podrían motivar oportunos tratamientos de rescate (en caso necesario). á
Los resultados en relación con metástasis y mortalidad requieren un seguimiento de al menos 10 años. La cirugía radical usa un corte de PSA para definir recidiva de 0.2 ng/ml y la Radioterapia usa el consenso ASTRO Phoenix de dos consecutivas alzas del PSA sobre el valor nadir. Por otra parte, la observación activa usa parámetros clínicos, de imágenes y biopsia para definir progresión (7).
No existe un consenso universal en la definición de falla bioquímica en los pacientes tratados con HIFU. Al no existir este consenso, es mandatorio la biopsia de próstata al año de seguimiento, o antes si un ascenso en los valores de PSA lo motivan. Una mpMRI negativa puede avalar la ausencia de una enfermedad clínicamente significativa (8).
Resultados
Los tratamientos focales presentan prometedores resultados en calidad de vida, disfunción sexual y urinaria. Los resultados oncológicos, son difíciles de interpretar debido a la heterogeneidad en la selección de los pacientes y corto periodo de seguimiento.
Efectividad oncológica como estrategia primaria.
Dos revisiones sistemáticas considerando estudios publicados entre 1996 y 2020, han resumido los resultados del HIFU (ultrasonido focalizado de alta intensidad) (42, 43).
La hemiablación (tratamiento de la mitad de la próstata) se realizó en el 82% de los estudios, mientras que la ablación focal (tratamiento dirigido solo al área tumoral) se aplicó en el 29%.
En total, se analizaron 1194 pacientes, con un seguimiento mediano de 25 meses (rango de 6 a 127 meses). El rango intercuartil (RIC) para la ausencia de cáncer clínicamente significativo en el área tratada fue de 86% (84–90%)
En seis estudios se reportó una tasa de recurrencia bioquímica mediana de 9,6% (RIC: 9,1–16,3%), habitualmente definida como un aumento del PSA de 2 ng/mL sobre el nadir. Además, la tasa mediana de terapia de rescate fue de 19% (RIC: 11–27%)
Resultados funcionales
Además de los resultados oncológicos, el otro objetivo de HIFU focal para PCa es lograr buenos resultados funcionales en términos tanto de continencia urinaria (CU) como de función eréctil (FE). Todas las series publicadas informan datos de resultados funcionales evaluados con instrumentos validados internacionales, que muestran altas tasas de CU post-tratamiento y tasas variables de deterioro de EF post-tratamiento.
Después de una hemiablación, Ahmed et al. (44) evaluaron las tasas de incontinencia urinaria (utilizando el Universidad de California, Índice de Cáncer de Próstata Expandido de Los Ángeles), y no encontraron ninguna diferencia significativa entre las evaluaciones iniciales y de seguimiento de 6 meses. En general, el 90% de los pacientes estaban libres de pads y fugas a los 6 meses. Evaluaron la función urinaria utilizando el International Prostatic Symptom Score (IPSS), que mostró un puntaje significativamente menor a los 6 meses de seguimiento en comparación con la evaluación inicial. La EF se evaluó con el cuestionario del Índice Internacional de Función Eréctil (IIEF). El puntaje del dominio EF disminuyó significativamente de una línea base promedio de 20.9 a 14.3 en la evaluación de 1 mes; sin embargo, los datos mostraron una recuperación de EF sin informar diferencias en la puntuación IIEF-EF a los 12 meses de seguimiento. También se observaron resultados similares para el dominio de la función orgásmica. En general, los autores informaron un estado trifecta de continencia sin almohadillas, sin fugas, erecciones suficientes para el coito y control temprano del cáncer en el 89% de los pacientes tratados.
Resultados similares en términos de tasas de CU después del tratamiento también se informaron en una serie con un seguimiento más largo, que muestra una tasa de CU del 100% en un seguimiento medio de 10 años y el 81% de los pacientes que informaron una puntuación IPSS igual o superior a la puntuación inicial al año después del tratamiento (45).
La idea de que la preservación del tejido conduce a la preservación funcional se destacó en un estudio en el que participaron 39 pacientes tratados con ablación focal de cáncer unilateral o bilateral (46). Los autores informaron una disminución inicial de la puntuación IIEF después del tratamiento, volviendo gradualmente a la línea de base a los 12 meses, y el 89% informó una penetración exitosa a los 12 meses de seguimiento. Además, el 100% de los pacientes estaban libres de almohadillas y sin fugas a los 9 meses de seguimiento, y las puntuaciones de IPSS fueron significativamente más bajas a los 12 meses en comparación con el valor inicial, lo que muestra una mejora en los síntomas del tracto urinario inferior.
En un estudio prospectivo más reciente de 67 pacientes tratados con hemiablación HIFU, Feijoo et al. (47) informaron resultados similares en términos de CU, pero observaron un deterioro significativo de EF con la puntuación media IIEF-5 disminuyendo de 17.9 a 15.4. Solo 11 de 21 pacientes preoperatoriamente potentes (definidos como IIEF-5 ≥22) mantuvieron la potencia 3 meses después del tratamiento.
Ahmed (16) informó de tasas más bajas de EF postratamiento en una serie reciente de 56 pacientes que recibieron ablación con HIFU localizada solo en la lesión índice: el 76,9% de los pacientes tenían erecciones que permitían una penetración a los 12 meses de seguimiento. También informaron que las tasas de uso de inhibidores de fosfodiesterasa tipo 5 aumentaron de 12.7% a 42.6%. La continencia libre de fugas y almohadillas fue del 92,6% a los 12 meses de seguimiento.
Complicaciones como tratamiento primario
Los efectos adversos relacionados con HIFU incluyen: incontinencia urinaria, estenosis de cuello de vejiga o de uretra, infección al tracto urinario, fístula rectal, lesión térmica de la pared rectal, dolor, retención urinaria y disfunción erectiva. Babalola et al, reporta una incidencia de 0% a 1,6% de fistula rectal. Infección al tracto urinario varía entre un 0% y 39%. Estenosis de cuello vesical, uretral y estenosis está entre un 0% y 51,5%.
Recurrencia Local y posibilidad de retratamiento
Una preocupación inherente a la terapia focal es la recurrencia del cáncer dentro de la próstata. Los datos muestran que la tasa de recurrencia en el campo tratado es del 25% (IQR 17-37%), con una tasa de recurrencia clínicamente significativa de 12% (IQR 5-19%). Sin embargo, los tratamientos de rescate focal son viables y seguros, y no afectan significativamente la función sexual ni la continencia urinaria (48)
Una revisión sistemática de 124 estudios en 2023 reportó que los tratamientos de rescate focal se realizaron en un rango del 0-40%, mientras que los tratamientos de rescate de glándula completa se hicieron en un rango del 2-54%. Con respecto a los resultados a 7 años, la supervivencia libre de tratamiento focal de rescate fue del 43% (IC 95% 39-49%). Un 10% de los pacientes (132 hombres) requirieron tratamiento de rescate de glándula completa. De los 53 pacientes sometidos a prostatectomía radical, 9 se sometieron a esto después de una segunda sesión de HIFU focal. De 39 pacientes tratados con radioterapia, 20 habían recibido una segunda sesión de HIFU focal. La supervivencia libre de tratamiento de glándula completa y de tratamiento sistémico fue del 75% (71-80%) (49)
Los datos sugieren que los tratamientos focales adicionales son viables, seguros y solo afectan mínimamente a la función sexual y eréctil. Los tratamientos de rescate de glándula completa también parecen viables. El estudio RAFT, realizado en dos centros del Reino Unido, fue un estudio prospectivo de prostatectomía radical asistida por robot como tratamiento de rescate a una mediana de 2.1 años después de la terapia focal previa. De 23 hombres, solo uno presentó una complicación de Clase 1 según la clasificación de Clavien-Dindo, y 4 (17%) necesitaron más tratamiento en el transcurso de un año. A los 12 meses, el 74% conservó la función urinaria, pero solo el 30% conservó la función eréctil.
Una serie retrospectiva del Reino Unido comparó a 100 pacientes sometidos a prostatectomía radical de rescate contra 100 pacientes sometidos a radioterapia de rescate después de una ablación previa. El 23% y el 14%, respectivamente, necesitaron más tratamiento. El análisis más grande de un solo estudio con un seguimiento medio de 1.4 y 3.1 años después del tratamiento de rescate, respectivamente, reportó que la tasa de pacientes sin uso de pañales fue del 85% y 74%, y la función eréctil conservada fue del 21% y 73% en los grupos de cirugía y radioterapia, respectivamente.
En el registro HEAT del Reino Unido, de 1379 hombres, 252 (18%) necesitaron al menos una sesión adicional de terapia focal.
Conclusiones
El tratamiento focal con HIFU puede considerarse un tratamiento mínimamente invasivo en pacientes con PCa seleccionados. Como estrategia primaria, los resultados oncológicos de HIFU focal parecen prometedores, lo que aumenta la expectativa en obtener datos estables en seguimiento a largo plazo. Los pacientes con enfermedad de riesgo bajo a intermedio pueden ser tratados de manera segura con la ablación selectiva de las áreas cancerosas, asegurando buenos resultados funcionales y bajas tasas de morbilidad.
BIBLIOGRAFIA
1.- Egawa S, Wheeler TM, Greene DR, Scardino PT. Unusual hyperechoic appearance of prostate can- cer on transrectal ultrasonography. Br J Urol. 1992;69(2):169–74.
2.- Kongnyuy M, George AK, Rastinehad AR, Pinto PA. Magnetic resonance imaging-ultrasound fusion- guided prostate biopsy: review of technology, tech- niques, and outcomes. Curr Urol Rep. 2016;17(4):32.
3.- Hricak H, Dooms GC, Jeffrey RB, Avallone A, Jacobs D, Benton WK, et al. Prostatic carcinoma: staging by clinical assessment, CT, and MR imaging. Radiology. 1987;162(2):331–6.
4.- Siddiqui MM, Rais-Bahrami S, Turkbey B, George AK, Rothwax J, Shakir N, et al. Comparison of mr/ ultrasound fusion-guided biopsy with ultrasound- guided biopsy for the diagnosis of prostate cancer. JAMA. 2015;313(4):390–7.
5.- Filson CP, Natarajan S, Margolis DJ, Huang J, Lieu P, Dorey FJ, et al. Prostate cancer detection with mag- netic resonance-ultrasound fusion biopsy: the role of systematic and targeted biopsies. Cancer. 2016;122(6):884–92.
6.- Weinreb JC, Blume JD, Coakley FV, Wheeler TM, Cormack JB, Sotto CK, et al. Prostate cancer: sextant localization at mr imaging and mr spectroscopic imaging before prostatectomy–results of acrin pro- spective multi-institutional clinicopathologic study. Radiology. 2009;251(1):122–33.
7.- Hoeks CM, Barentsz JO, Hambrock T, Yakar D, Somford DM, Heijmink SW, et al. Prostate cancer: multiparametric MR imaging for detection, localiza- tion, and staging. Radiology. 2011;261(1):46–66.
8.- Kabakus IM, Borofsky S, Mertan FV, Greer M, Daar D, Wood BJ, Pinto PA, Choyke PL, Turkbey B. Does abstinence from ejaculation before prostate MRI improve evaluation of the seminal vesicles? AJR Am J Roentgenol. 2016;207(6): 1205–9.
9.- Bratan F, Melodelima C, Souchon R, Hoang Dinh A, Mege-Lechevallier F, Crouzet S, et al. How accurate is multiparametric MR imaging in evaluation of pros- tate cancer volume? Radiology. 2015;275(1):144–54.
10.- Mazaheri Y, Hricak H, Fine SW, Akin O, Shukla-Dave A, Ishill NM, et al. Prostate tumor volume measure- ment with combined T2-weighted imaging and diffu- sion-weighted MR: correlation with pathologic tumor volume. Radiology. 2009;252(2):449–57.
11.- Cormack RA, D’Amico AV, Hata N, Silverman S, Weinstein M, Tempany CM. Feasibility of transperi- neal prostate biopsy under interventional magnetic resonance guidance. Urology. 2000;56(4):663–4.
12.- Cerantola Y, Haberer E, Torres J, Alameldin M, Aronson S, Levental M, et al. Accuracy of cognitive MRI-targeted biopsy in hitting prostate cancer- positive regions of interest. World J Urol. 2016;34(1):75–82.
13.- Puech P, Ouzzane A, Gaillard V, Betrouni N, Renard B, Villers A, et al. Multiparametric MRI-targeted TRUS prostate biopsies using visual registration. Biomed Res Int. 2014;2014:819360.
14.- .- Park BK, Park JW, Park SY, Kim CK, Lee HM, Jeon SS, et al. Prospective evaluation of 3-T MRI per- formed before initial transrectal ultrasound-guided prostate biopsy in patients with high prostate-specific antigen and no previous biopsy. AJR Am J Roentgenol. 2011;197(5):W876–81.
15 Wysock JS, Rosenkrantz AB, Huang WC, Stifelman MD, Lepor H, Deng FM, et al. A prospective, blinded comparison of magnetic resonance (MR) imaging- ultrasound fusion and visual estimation in the perfor- mance of MR-targeted prostate biopsy: the PROFUS trial. Eur Urol. 2014;66(2):343–51.
16. Puech P, Rouviere O, Renard-Penna R, Villers A, Devos P, Colombel M, et al. Prostate cancer diagno- sis: multiparametric MR-targeted biopsy with cogni- tive and transrectal US-MR fusion guidance versus systematic biopsy–prospective multicenter study. Radiology. 2013;268(2):461–9.
17. Delongchamps NB, Peyromaure M, Schull A, Beuvon F, Bouazza N, Flam T, et al. Prebiopsy magnetic reso- nance imaging and prostate cancer detection: com- parison of random and targeted biopsies. J Urol. 2013;189(2):493–9.
18. Tonttila PP, Lantto J, Paakko E, Piippo U, Kauppila S, Lammentausta E, et al. Prebiopsy multiparametric magnetic resonance imaging for prostate cancer diag- nosis in biopsy-naive men with suspected prostate cancer based on elevated prostate-specific antigen val- ues: results from a randomized prospective blinded controlled trial. Eur Urol. 2015;69(3):419–25.
19. Cool DW, Zhang X, Romagnoli C, Izawa JI, Romano WM, Fenster A. Evaluation of MRI-TRUS fusion ver- sus cognitive registration accuracy for MRI-targeted, TRUS-guided prostate biopsy. AJR Am J Roentgenol. 2015;204(1):83–91.
20.- Kwak JT, Hong CW, Pinto PA, Williams M, Xu S, Kruecker J, et al. Is visual registration equivalent to semiautomated registration in prostate biopsy? Biomed Res Int. 2015;2015:394742.
21. Perineologic, Inventor Precision Point Transperineal Access System.
Perineologic.com/precisionpoint/
22. Pepdjonovic L, Tan GH, Huang S, Mann S, Frydenberg M, Moon D, et al. Zero hospital admissions for infection after 577 transperineal prostate biopsies using single-dose cephazolin prophylaxis. World J Urol. 2017;35(8):1199–203.
23 Basourakos SP, Alshak MN, Lewicki PJ, Cheng E, Tzeng M, DeRosa AP, et al. Role of prophylactic antibiotics in transperineal prostate biopsy: a systematic review and meta-analysis. Eur Urol Open Sci. 2022;37:53–63.
24 Grummet J. How to biopsy: transperineal versus transrectal, saturation versus targeted. What’s the evidence? Urol Clin N Am. 2017;44(4):525–34.
25. Schouten MG, van der Leest M, Pokorny M, Hoogenboom M, Barentsz JO, Thompson LC, et al. Why and where do we miss significant prostate cancer with multi-parametric magnetic resonance imaging followed by magnetic resonance-guided and Transrectal ultrasound-guided biopsy in biopsy-naïve men? Eur Urol. 2017;71(6):896–903.
26 Berquin C, Perletti G, Develtere D, Van Puyvelde H, Pauwels E, De Groote R, et al. Transperineal vs. transrectal prostate biopsies under local anesthesia: a prospective cohort study on patient tolerability and complication rates. Urol Oncol. 2023;41:388.e17.
27. Calleris G, Marquis A, Zhuang J, Beltrami M, Zhao X, Kan Y, et al. Impact of operator expertise on transperineal free-hand mpMRI-fusion-targeted biopsies under local anaesthesia for prostate cancer diagnosis: a multicenter prospective learning curve. World J Urol. 2023;41:3867.
28. Marra G, Zhuang J, Beltrami M, Calleris G, Zhao X, Marquis A, et al. Transperineal freehand multiparametric MRI fusion targeted biopsies under local anaesthesia for prostate cancer diagnosis: a mulJ
29. Hu JC, Assel M, Allaf ME, Ehdaie B, Vickers AJ, Cohen AJ, et al. Transperineal versus transrectal magnetic resonance imaging–targeted and systematic prostate biopsy to prevent infectious complications: the PREVENT randomized trial. Eur Urol. 2024;86:61.
30. Mian BM, Feustel PJ, Aziz A, Kaufman RP Jr, Bernstein A, Avulova S, Fisher HAG. Complications following transrectal and transperineal prostate biopsy: results of the ProBE-PC randomized clinical trial. J Urol. 2024;211(2):205–13.
31. Brant A, Campi R, Carrion DM, Esperto F, Sze C, Johnson JP, et al. Findings from an international survey of urology trainee experience with prostate biopsy. BJU Int. 2023;131(6):705–11.
32. Sonn GA, Chang E, Natarajan S, Margolis DJ, Macairan M, Lieu P, et al. Value of targeted prostate biopsy using magnetic resonance-ultrasound fusion in men with prior negative biopsy and elevated prostate- specific antigen. Eur Urol. 2014;65(4):809–15.
33. Vourganti S, Rastinehad A, Yerram NK, Nix J, Volkin D, Hoang A, et al. Multiparametric magnetic resonance imaging and ultrasound fusion biopsy detect prostate cancer in patients with prior negative transrectal ultra- sound biopsies. J Urol. 2012;188(6):2152–7.
34. Salami SS, Ben-Levi E, Yaskiv O, Ryniker L, Turkbey B, Kavoussi LR, et al. In patients with a previous negative prostate biopsy and a suspicious lesion on magnetic resonance imaging, is a 12-core biopsy still necessary in addition to a targeted biopsy? BJU Int. 2015;115(4):562–70.
35. Fascelli M, George AK, Frye T, Turkbey B, Choyke PL, Pinto PA. The role of MRI in active surveillance for prostate cancer. Curr Urol Rep. 2015;16(6):42.
36. Hu JC, Chang E, Natarajan S, Margolis DJ, Macairan M, Lieu P, et al. Targeted prostate biopsy in select men for active surveillance: do the Epstein criteria still apply? J Urol. 2014;192(2):385–90.
37. Stamatakis L, Siddiqui MM, Nix JW, Logan J, Rais- Bahrami S, Walton-Diaz A, et al. Accuracy of multi- parametric magnetic resonance imaging in confirming eligibility for active surveillance for men with pros- tate cancer. Cancer. 2013;119(18):3359–66.
38. Abdi H, Pourmalek F, Zargar H, Walshe T, Harris AC, Chang SD, et al. Multiparametric magnetic resonance imaging enhances detection of significant tumor in patients on active surveillance for prostate cancer. Urology. 2015;85(2):423–8.
39. Sonn GA, Filson CP, Chang E, Natarajan S, Margolis DJ, Macairan M, et al. Initial experience with elec- tronic tracking of specific tumor sites in men undergo- ing active surveillance of prostate cancer. Urol Oncol. 2014;32(7):952–7.
40. Walton Diaz A, Shakir NA, George AK, Rais- Bahrami S, Turkbey B, Rothwax JT, et al. Use of serial multiparametric magnetic resonance imag- ing in the management of patients with prostate cancer on active surveillance. Urol Oncol. 2015;33(5):202.e1–7.
41. Nix JW, Turkbey B, Hoang A, Volkin D, Yerram N, Chua C, et al. Very distal apical prostate tumours: identification on multiparametric MRI at 3 Tesla. BJU Int. 2012;110(11 Pt B):E694–700.
42 Valerio M, Cerantola Y, Eggener SE, Lepor H, Polascik TJ, Villers A, et al. New and established technology in focal ablation of the prostate: a systematic review. Eur Urol. 2017;71(1):17–34.
43 Hopstaken JS, Bomers JGR, Sedelaar MJP, Valerio M, Fütterer JJ, Rovers MM. An updated systematic review on focal therapy in localized prostate cancer: what has changed over the past 5 years? Eur Urol. 2022;81(1):5–33.
44.- Ahmed HU, Freeman A, Kirkham A, Sahu M, Scott R, Allen C, et al. Focal therapy for localized prostate cancer: a phase I/II trial. J Urol. 2011;185(4):1246–54.
45.- El Fegoun AB, Barret E, Prapotnich D, Soon S, Cathelineau X, Rozet F, et al. Focal therapy with high-intensity focused ultrasound for prostate cancer in the elderly. A feasibility study with 10 years fol- low-up. Int Braz J Urol. 2011;37(2):213–9. discussion 220-212.
46.- Ahmed HU, Hindley RG, Dickinson L, Freeman A, Kirkham AP, Sahu M, et al. Focal therapy for localised unifocal and multifocal prostate cancer: a prospective development study. Lancet Oncol. 2012;13(6):622–32.
47.- Feijoo ER, Sivaraman A, Barret E, Sanchez-Salas R, Galiano M, Rozet F, et al. Focal high-intensity focused ultrasound targeted hemiablation for uni- lateral prostate cancer: a prospective evaluation of oncologic and functional outcomes. Eur Urol. 2016;69(2):214–20.
48. Reddy D, Peters M, Shah TT, van Son M, Tanaka MB, Huber PM, et al. Cancer control outcomes following focal therapy using high-intensity focused ultrasound in 1379 men with nonmetastatic prostate cancer: a multi-institute 15-year experience. Eur Urol. 2022;81:407–13. https://doi.org/10.1016/J.EURURO.2022.01.005.
49. Nicoletti R, Alberti A, Castellani D, Yee CH, Zhang K, Poon DMC, et al. Functional outcomes and safety of focal therapy for prostate cancer: a systematic review on results and patient-reported outcome measures (PROMs). Prostate Cancer Prostatic Dis. 2023;2023:1–9. https://doi.org/10.1038/s41391-023-00698-8.

