INTRODUCCIÓN
En nuestro medio, cuando se habla de urología reconstructiva, típicamente se piensa en uretroplastía: un error frecuente que, al final del día, va en detrimento de nuestros pacientes y de nuestra especialidad.
El aumento progresivo en la expectativa de vida y en el acceso a cirugías, en el contexto de una población más informada, que aspira no solo a sobrevida, sino también a calidad de vida, han llevado a una acumulación de pacientes de distintas edades, con secuelas de enfermedades inflamatorias, iatrogénicas, traumas y asociadas al envejecimiento, que deben ser asumidas y enfrentadas.1
La disfunción del tracto urinario es compleja, por lo que se requiere un entendimiento acabado de la fisiología, la anatomía, la clínica y las expectativas del paciente para poder ofrecer tratamientos que logren mejorar tanto los outcomes duros como los subjetivos. Durante las últimas décadas, las terapias disponibles enfocadas en la calidad de vida han mostrado un enorme crecimiento.2,3 Así, avanzar hacia el concepto de “urología funcional”, permitirá formar especialistas con una mirada integral y que abarque áreas como la incontinencia masculina y femenina, cirugía de la disfunción eréctil y la Enfermedad de Peyronie, secuelas de tratamientos del cáncer, vejiga neurogénica, derivaciones urinarias, disfunción miccional, urología de transición, fístulas, divertículos uretrales, plastía genital, trauma genitourinario y, claro, estrechez uretral masculina y femenina.
En esta edición del manual actualizamos las secciones ya existentes, agregando dos nuevas secciones: reconstrucción genital masculina y patología uretral y periuretral femenina.
SECCIÓN I: ESTRECHEZ URETRAL MASCULINA
ANATOMÍA Y DEFINICIONES
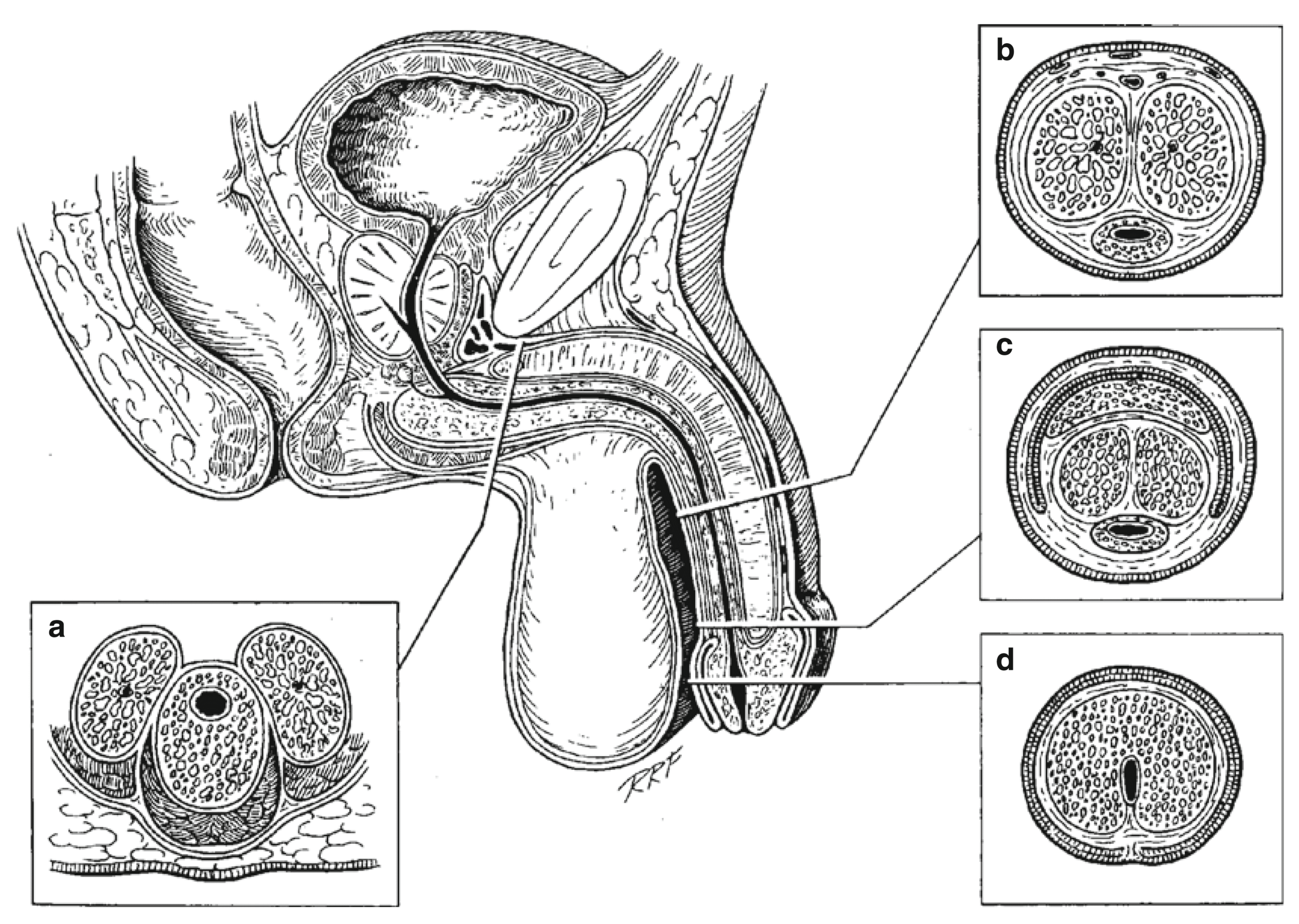
- Anatomía. La anatomía uretral y peniana se describe con el pene en erección. El cuerpo esponjoso (CE) -una estructura eréctil envuelta en una fina capa de túnica albugínea-, yace en el aspecto ventromedial de los 2 cuerpos cavernosos (CC) y contiene la uretra. El extremo distal del CE se expande para formar el glande. Hacia proximal en el periné, las cruras de los CC se separan y el espacio es ocupado por el bulbo del CE, una dilatación bilateral y también en sentido ventral y dorsal, que está envuelta por el músculo bulboesponjoso (MBE).
La uretra corresponde al lumen de un tubo epitelizado que comunica el cuello vesical con el meato. La nomenclatura de consenso según la International Consultation on Urological Diseases 2010 (ICUD)4, divide la uretra en: a) meato; b) fosa navicular, porción más distal de la uretra peniana ubicada al interior del glande y revestida por epitelio escamoso, que va desde el meato hasta la unión del epitelio escamoso estratificado con el epitelio uretral; c) uretra peniana, que se extiende desde el meato hasta el borde distal del MBE, completamente rodeada por CE, con un lumen uretral constante, centrado dentro del CE y revestido por epitelio uretral (escamoso simple); d) uretra bulbar, va desde la uretra peniana proximal hasta la membranosa distal, y cuyo lumen se dilata y se hace más dorsal dentro del bulbo del CE hacia proximal; e) uretra membranosa, va desde la bulbar proximal hasta el verumontanum, sólo está rodeada por el músculo del esfínter externo y revestida de epitelio de transición; f) uretra prostática, va desde la uretra membranosa proximal al cuello vesical y está rodeada por la próstata y revestida de epitelio de transición; g) cuello vesical, comunica la uretra prostática y la vejiga y está rodeado por fibras del músculo detrusor y variablemente por extensiones intravesicales de la próstata.
Si bien la ICUD desaconseja su uso, desde un punto de vista práctico, la uretra también puede ser dividida en: a) anterior, desde el meato hasta la uretra bulbar proximal (o membranosa distal); y b) posterior, desde la uretra membranosa distal (o bulbar proximal) hasta el cuello vesical.4 (Fig. 1).5
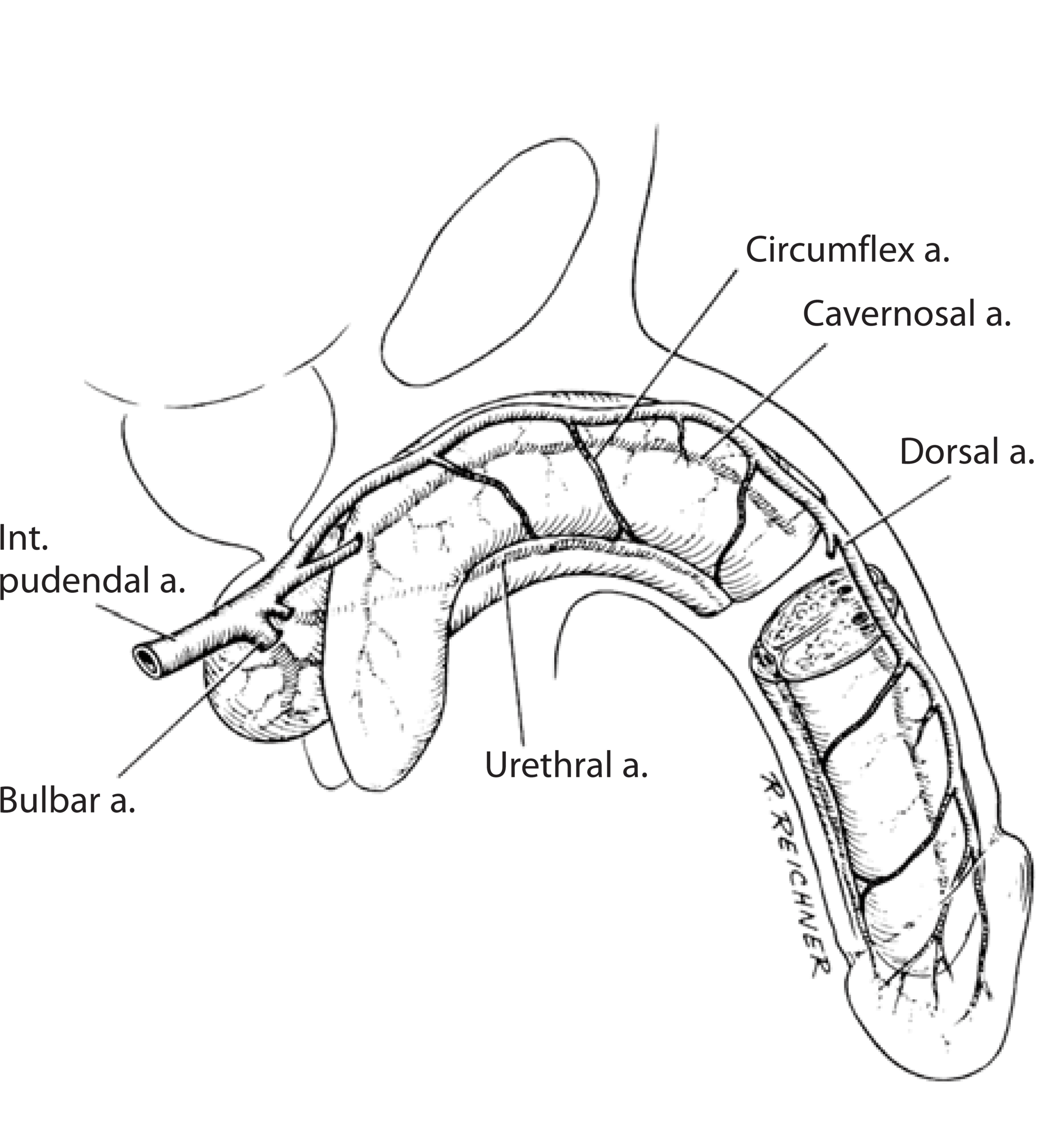
La irrigación superficial del pene proviene de ramas de la arteria femoral, tales como las arterias pudendas externa superior e inferior, que abastecen la piel y el dartos del prepucio y el escroto anterior.
Por otra parte, toda la irrigación profunda del pene y la uretra proviene de ramas de la arteria pudenda interna, incluyendo la arteria bulbar (crítica a la hora de planificar uretroplastías transectantes), la uretral, la cavernosa y la dorsal del pene. Además, se debe considerar un flujo bidireccional esponjoso-cavernoso que en circunstancias normales se produce a nivel del plexo subcoronal, justo distal a las puntas de los cavernosos. (Fig 2).6
| Figura 1. Anatomía Uretra Anterior. a) Uretra bulbar, b) Uretra peniana media, c) Uretra peniana distal, d) Fosa navicular (Tomado de Jordan, 1996)5 |
| Figura 2. Irrigación Arterial del Pene y la Uretra (Tomado de Horton et al, 1990)6 |
- Definiciones. En 2010 la ICUD estableció la terminología de consenso a utilizar: a) estrechez uretral, es la disminución de calibre en cualquier segmento de la uretra que esté rodeada por CE (toda la uretra anterior); b) espongiofibrosis, es alteración cicatricial del CE en distintos grados; c) estenosis, se reserva para la disminución de calibre de la uretra que no se encuentra rodeada de CE (toda la uretra posterior incluyendo el cuello vesical) y que no sea secundaria a una fractura de pelvis; d) lesión uretral por fractura de pelvis (PFUI, en su sigla en inglés), define ampliamente los daños secundarios al trauma pélvico, incluyendo estrecheces bulbares proximales y disrupciones uretrales (PFUDD) que por fisiopatología no corresponden a una estrechez; e) calibración uretral, es la medición del diámetro uretral.
Con respecto a las técnicas quirúrgicas, se establecen los siguientes términos: a) dilatación uretral, es el estiramiento del lumen uretral mediante diferentes técnicas; b) uretrotomía interna bajo visión directa (DVIU), es la incisión sobre el epitelio uretral y el CE subyacente, bajo endoscopía; c) excisión y anastomosis primaria (EPA), resección del segmento estrecho junto con su espongiofibrosis y reaproximación de los bordes sanos; d) injerto (graft), transferencia de tejido desde otro sitio hacia la uretra, generalmente mucosa oral, obteniendo su irrigación desde el lecho receptor; e) colgajo (flap), transferencia de tejido desde otro sitio hacia la uretra, contando con su propia irrigación proveniente de un pedículo vascular, generalmente de piel de prepucio; f) uretroplastía de aumento, corresponde a aquellos que utilizan injertos o colgajos; g) onlay, se refiere a la expansión del calibre uretral con un injerto/colgajo.4 Si bien la ICUD considera el término inlay como no aceptable, es de opinión de los autores que onlay pudiera describir una colocación sobrepuesta del injerto/colgajo en el lumen previamente abierto desde el exterior, mientras que inlay pudiera corresponder a una colocación interpuesta, con un abordaje por dentro del lumen uretral.
EPIDEMIOLOGÍA
La estrechez/estenosis (E/E) de uretra masculina se presenta en hasta un 0.6% de la población susceptible. La incidencia se ha estimado en 200-1.200 casos por 100.000 individuos, la que se incrementa dramáticamente con la edad, especialmente a partir de los >55 años y en sujetos de raza negra. En EE.UU. se estiman 1.5 millones de consultas por año, alcanzando un gasto anual de salud de US$191 millones. El gasto anual de salud de cada individuo con estrechez uretral aumenta en US$6.759.7
ETIOLOGÍA Y FISIOPATOLOGÍA
Todas las E/E provienen de daños al epitelio uretral, que llevan a extravasación urinaria y a una consecuente reacción fibrótica y reemplazo del epitelio por metaplasia escamosa. (Fig. 3).8
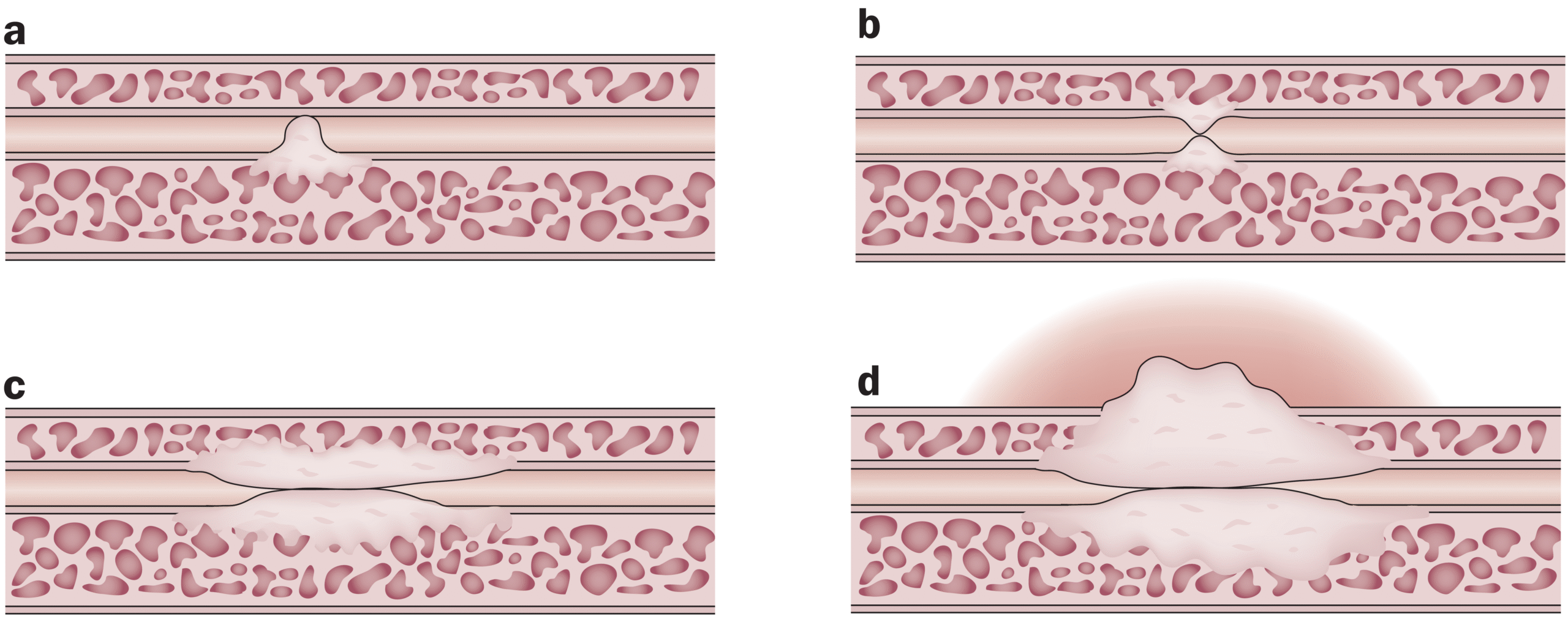
| Figura 3. Fisiopatología de la estrechez. a) Metaplasia escamosa, b) Disminución del lumen, c y d) Progresión de la espongiofibrosis (Tomado de Hampson et al, 2014)8 |
Las etiologías se dividen en: iatrogénicas, traumáticas, inflamatorias e idiopáticas. Éstas causas se presentan de manera diferente según localización, edad y nivel de desarrollo de los países. En una revisión de 1.439 pacientes atendidos en un centro italiano, mostró que un 92% de las E/E fueron anteriores, siendo cerca de la mitad bulbares y un tercio penianas, mientras cerca de un 8% fueron posteriores. (Tabla 1)9
En el caso de la estrechez de uretra peniana la mayoría fue iatrogénica (cirugías de hipospadias, sondeo uretral, cirugía transuretral) o por liquen escleroso (LS, fibrosis atrófica del epitelio con infiltración linfocítica). En el caso de la uretra bulbar, cerca de dos tercios son idiopáticas y un tercio iatrogénicas. La estenosis de uretra posterior se origina casi exclusivamente por traumas, en primer lugar, y por iatrogenia, en segundo (RTU, prostatectomía radical, radioterapia, braquiterapia). (Tabla 1)9. Estos datos varían en países en vías de desarrollo, con un predominio de las causas infecciosas y traumas.
| Variable
(% del total) |
Peniana
(30.5) |
Bulbar
(46.9) |
Panuretral
(9.9) |
Posterior
(7.8) |
TOTAL
(100)** |
| Edad (años) | 45 | 42 | 56 | 47 | 45 |
| Etiología (%) | |||||
|
57.9
2.3 24.4 12.7 2.7 |
28.7
8.8 061.8 0.7 |
28.2
0 48.6 22.5 0.7 |
25.0
72.3 0 2.7 0 |
38.6
10.8 13.5 35.8 1.3 |
| *Congénita, infección, tumor. **Se omiten 2 localizaciones menores que suman el 4.9% restante | |||||
| Tabla 1. Distribución de etiologías según localización (Adaptado de Palminteri et al, 2013)9 |
PRESENTACIÓN CLÍNICA
El motivo de consulta inicial son los síntomas del tracto urinario bajo (LUTS), en particular latencia y esfuerzo miccional, chorro débil, goteo postmiccional y sensación de vaciado incompleto.10 En la historia natural de la enfermedad se describen complicaciones tales como abscesos periuretrales, fístulas o falla renal, que hoy en día ocurren frente al mal acceso de la población a tratamientos oportunos. (Tabla 2).10,11 En cambio, en pacientes con una mediana de espera de cirugía de solo 5 meses, el 16% presentó alguna complicación: 9.1% ITU, 3.3% retención urinaria, 2.5% problemas con la sonda y dolor en 1.1%.12 En algunos casos el examen físico puede mostrar inflamación crónica en prepucio, glande y/o meato uretral, que puede corresponder a LS.13
| Complicación | Incidencia (%) |
| Vejiga de lucha | 85 |
| Retención aguda de orina | 60 |
| Prostatitis | 50 |
| Orquiepididimitis | 25 |
| Hidronefrosis | 20 |
| Absceso periuretral | 15 |
| Cálculos | 10 |
| Tabla 2. Frecuencia de complicaciones por estrechez/estenosis de uretra (Tomado de Mundy et al, 2011)10 |
EVALUACIÓN DIAGNÓSTICA
La sospecha diagnóstica debe comenzar siempre con lo más simple y menos invasivo e ir progresando según el nivel de sospecha.13
- El International Prostate Symptom Score (IPSS), es una conocida estandarización de síntomas urinarios. Es utilizada desde 1998 para E/E y su uso es fuertemente recomendado por la guías de la Société Internationale d’Urologie (SIU)14 y de la American Urological Association (AUA).15 Sin embargo, los LUTS identificados por el IPSS son inespecíficos y hasta un 21% de las E/E se presentan exclusivamente con síntomas no incluidos en dicho cuestionario. Las E/E penianas presentan más frecuentemente chorro en regadera, LS presenta más LUTS obstructivos y menos retención aguda de orina.16 Para mejorar su rendimiento en población con bajo nivel educacional existe un IPSS visual, o VPSS.17
- La uroflujometría con medición de residuo (UFM), es muy importante a la hora de objetivar una disfunción del vaciamiento vesical, cuando existe un flujo máximo <10-15 ml/seg y un residuo postmiccional (RPM) elevado. Para considerar un examen como interpretable, se deben vaciar al menos 150 ml. No obstante, la UFM/RPM por sí solos son incapaces de diferenciar una obstrucción de un detrusor hipocontráctil. La combinación de UFM con Qmax <15 + IPSS >10 alcanza una sensibilidad de 93%, especificidad 68% y un 82% de correctamente clasificados.18
- La cistoscopía es el gold standard para definir la presencia/ausencia de una E/E y la localización del cabo distal de ésta. Aunque se estableció para determinar recurrencias postquirúrgicas, la E/E se confirma con la imposibilidad del paso de un cistoscopio 16-17 Fr.19 Siempre debe realizarse para evaluar además patologías concomitantes como tumores, cálculos, tejidos con pelo (colgajos), extensión de metaplasia escamosa; y el calibre uretral. Sin embargo, en la mayoría de los casos no permite definir la longitud de la E/E y, por lo tanto, hay información faltante para planificar un tratamiento.14,15 (Fig. 4).
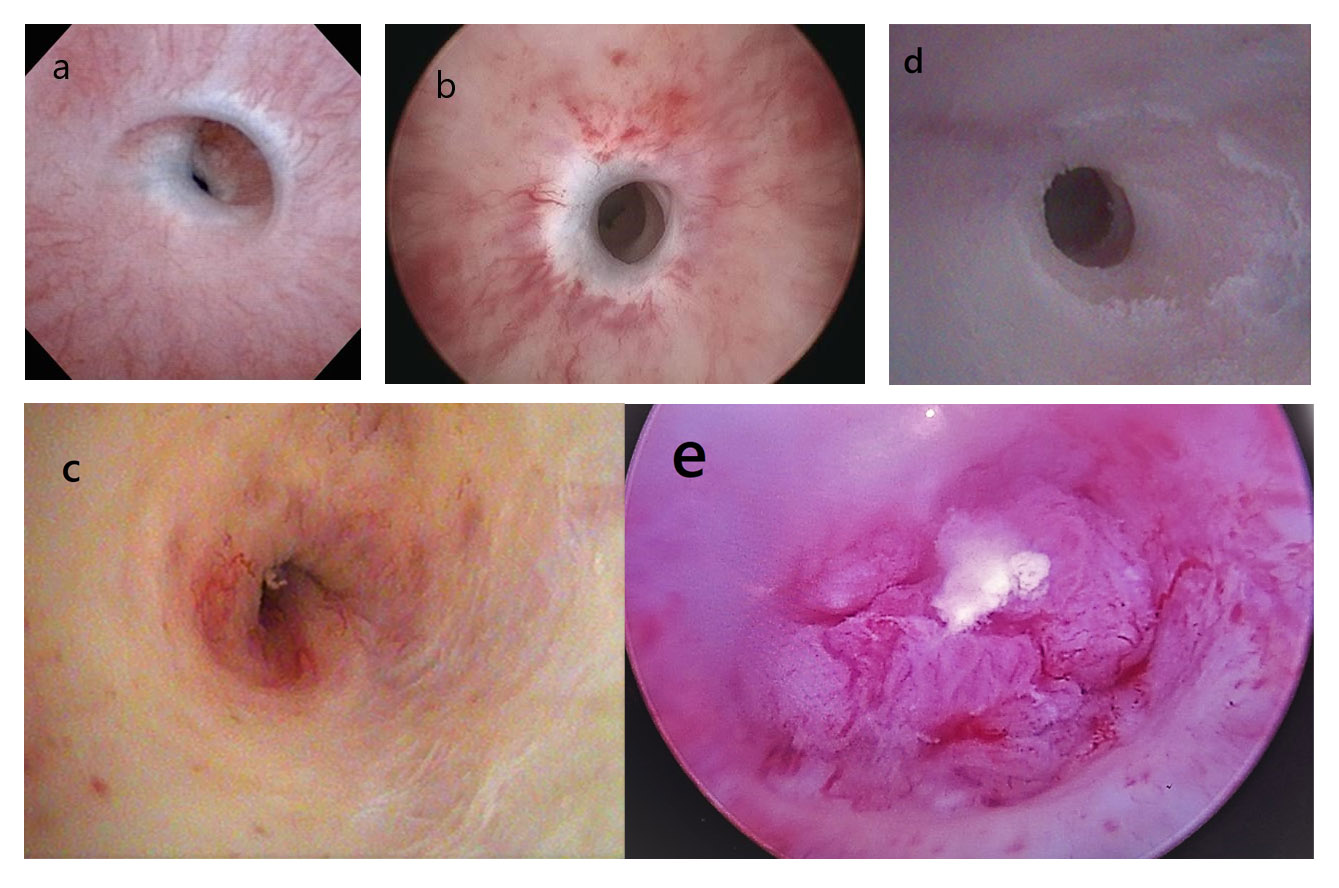
| Figura 4. Hallazgos en la cistoscopía. a) Estrechez unión penoescrotal con varios anillos. b) Estrechez bulbar media con moderada fibrosis. c) Estrechez unión bulbomembranosa con fibrosis severa y cambios post-radioterapia. d) Metaplasia escamosa y estrechez de uretra pneana. e) Hallazgo de tumor uretral durante estudio de posible estrechez uretral. |
- La uretrocistografía retrógrada/miccional (UCG), es un examen dinámico que se realiza mediante la instilación uretral de contraste hidrosoluble bajo fluoroscopía y se recomienda que siempre sea hecha por el urólogo entrenado.20 Es el examen de elección para etapificación de las E/E. La UCG se encarga de definir la longitud, ubicación, severidad y número de las E/E. Además, da información sobre fístulas, duplicación uretral, falsa vía y el status del cuello vesical. El estudio completo consta de 2 fases: la fase retrógrada dibuja la uretra anterior y la fase miccional dibuja la uretra posterior, no siendo intercambiables, como se muestra en las imágenes. La fase retrógrada debe realizarse con el paciente en decúbito lateral con inclinación de 45°, permitiendo ver un orificio obturador “ocluido” en la imagen; con la cadera inferior flectada igualmente en 45° y la cadera superior extendida, y con el pene en estiramiento. (Fig 5). La fase miccional debe hacerse con la mesa en posición vertical y el paciente con deseo miccional, haciendo el registro en forma continua. (Fig. 6).
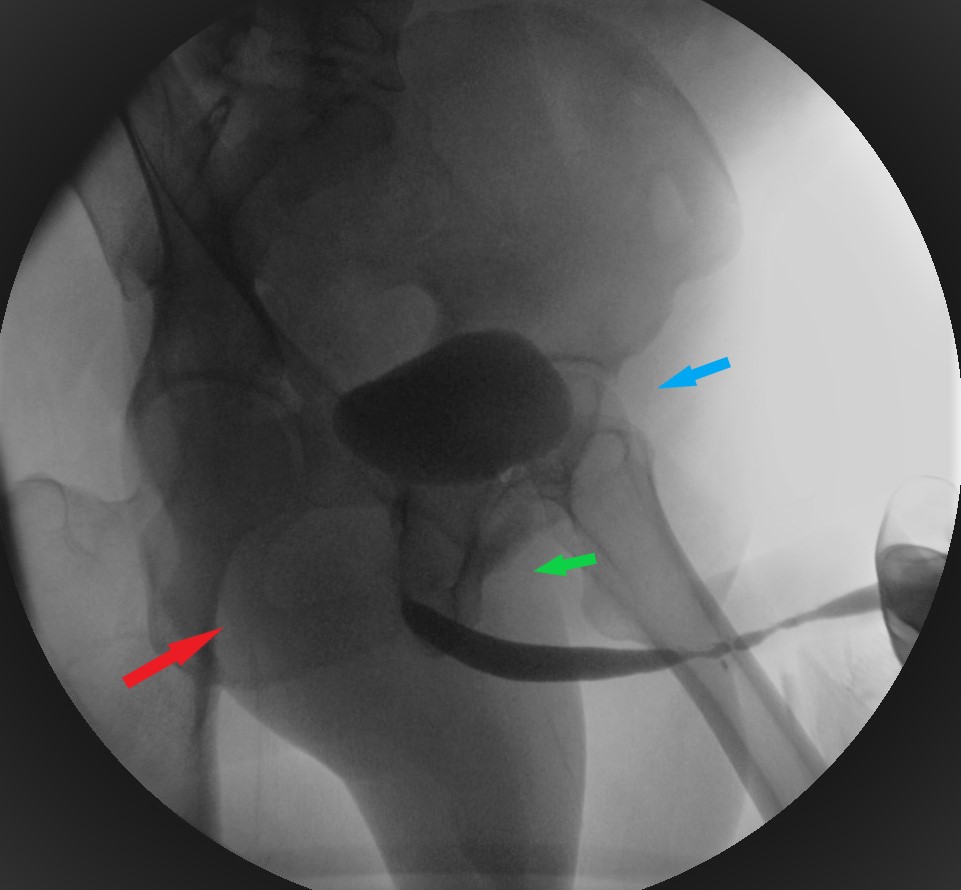
| Figura 5. Posicionamiento correcto en uretrocistografía retrógrada. Flecha celeste: flexión de cadera izquierda en 45°. Flecha roja: orificio obturador derecho se ve “abierto”. Flecha verde: orificio obturador izquierdo se ve “ocluido” debido al decúbito lateral izquierdo en 45°. |
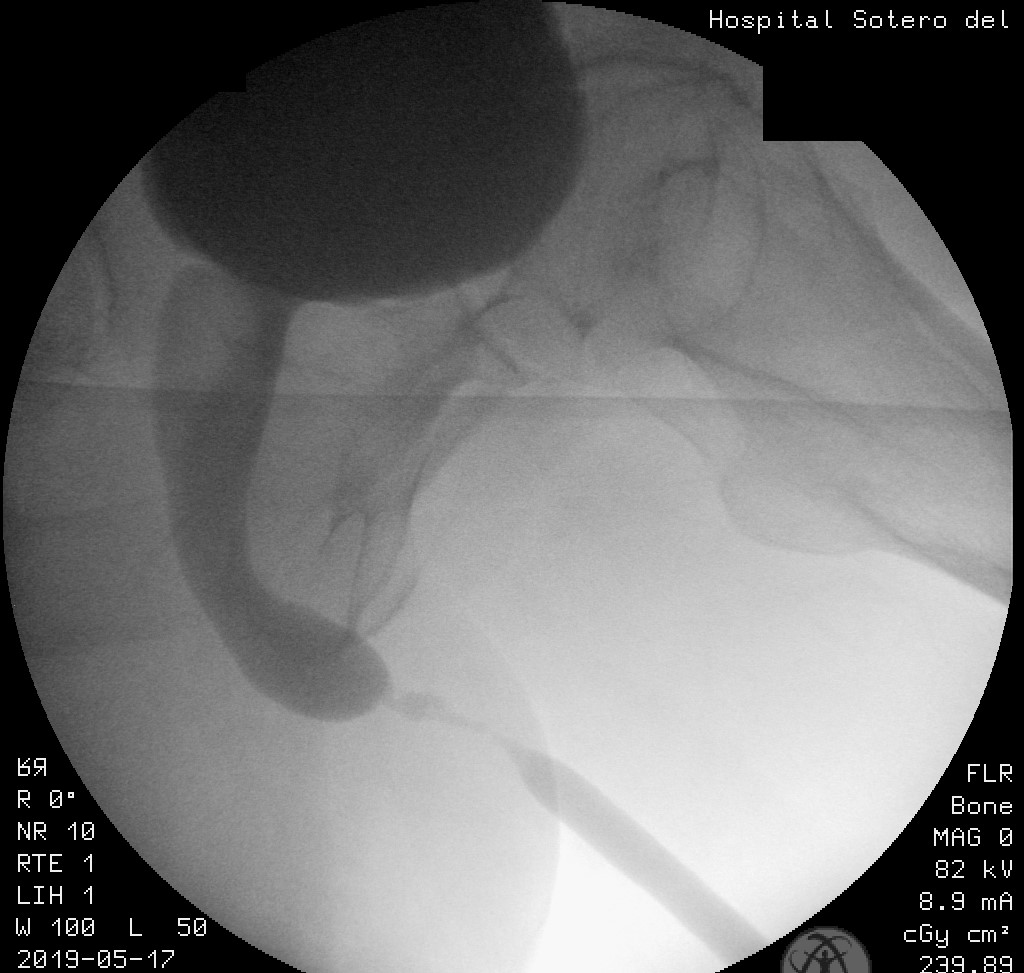
| Figura 6. Uretrocistografía en fase miccional. Se aprecia el cuello, la uretra prostática, la uretra membranosa y la bulbar proximal abiertas, mientras se evidencia una estrechez crítica de la uretra bulbar media, con dilatación proximal a la estrechez. |
- La ecotomografía uretral (EcoUx), es un examen de alto rendimiento para estudiar E/E anterior, alcanzando una sensibilidad de 98% y una especificidad de 96%, con una buena estimación de la longitud y de la espongiofibrosis al compararla con los hallazgos intraoperatorios.21–23 Sin embargo, requiere de 2 operadores, es altamente operador dependiente, necesita anestesia local o general y no tiene ningún rol en uretra posterior, por lo que sólo se recomienda en acotadas circunstancias.13
- Eco Doppler Peniano: no corresponde a un examen de rutina, pero es propuesto por algunos autores en el estudio prequirúrgico de las PFUI. Entrega información sobre la integridad de la vasculatura peniana posterior al trauma, permitiendo planificar un abordaje que consiga minimizar el impacto sobre la función eréctil, entregando además información sobre el posible éxito de la uretroplastía24.
- La tomografía computarizada (TAC) y resonancia magnética (RM), son herramientas relativamente nuevas en el estudio de la E/E. Sin embargo, por su rendimiento, complejidad y alto costo, son recomendadas como estudios complementarios en patología compleja, tales como: fístulas uretrales, divertículos, estenosis de uretra posterior, tumores de uretra y de vejiga.13,14 En el caso particular de la PFUI, la RM es una herramienta que entrega mucha información, permitiendo planificar el abordaje de la cirugía, predecir la necesidad de pubectomía y apoyar con el pronóstico de potencia sexual 25.
TRATAMIENTO
El tratamiento de la E/E es eminentemente quirúrgico, sin existir, en la actualidad, ningún tratamiento conservador que sea realmente curativo. Por otra parte, la técnica quirúrgica a usar dependerá de la etiología, de múltiples condiciones locales y variables intraoperatorias, que dificultan mucho la estandarización a priori. Se recomienda que el urólogo reconstructivo cuente con un arsenal terapéutico lo más amplio posible, para enfrentar los escenarios inesperados, que ocurren con frecuencia.
Mientras la orina esté correctamente derivada, la E/E no conlleva un riesgo vital directo (aunque sí indirecto por complicaciones de largo plazo), por lo tanto, el tratamiento definitivo está eminentemente enfocado no en la sobrevida, sino en la calidad de vida del sujeto. Así, dentro de las opciones se deberá ofrecer siempre el catéter uretral permanente, la cistostomía definitiva o bien la derivación urinaria, primando siempre la preferencia del paciente por sobre intentos heroicos de reconstrucción.
- Manejo Conservador.
- Dilatación y Uretrotomía Interna bajo visión directa (UTI). La mayoría de las veces, deben considerarse tratamientos paliativos por su alta tasa de recurrencia. La primera consiste en el paso de instrumentos de calibres progresivamente mayores por la zona estrecha (dilatadores cónicos en fosa navicular, metálicos, plásticos, beniqué, nelaton o filiformes). Se recomienda pasar una guía bajo visión endoscópica por la estrechez y luego dilatar sobre estas guías de seguridad. Por su parte, la UTI consiste en el paso de una guía de seguridad a proximal y luego hacer una incisión en la profundidad de la mucosa estenótica, alcanzando el cuerpo esponjoso subyacente, a la hora 12, hasta llegar a la túnica albugínea de los cavernosos si es necesario. La incisión puede hacerse con cuchillo frío o láser. La tasa de éxito de la dilatación y UTI son similares.8 La tasa de recurrencia a mediano plazo se ha estimado en 58% para lesiones bulbares, 84% en penianas y 89% en membranosas.26 Los casos recurrentes que van a una segunda o tercera dilatación/UTI tienen tasas de fracaso de 60-100% y 100% a los 2 años, respectivamente. En general, se recomienda realizar un solo intento de dilatación/UTI en pacientes con: E/E bulbares de <1.5 cms, sin espongiofibrosis y sin tratamientos previos.8
- Reposo Uretral. En pacientes con E/E con procedimientos recientes (dilataciones/UTI, sondeo uretral permanente o intermitente, cirugía de hiperplasia prostática, radioterapia, uretroplastías previas o PFUI), deben esperar la estabilización de la lesión antes de planificar una solución definitiva. Mantener pacientes obstruidos parcialmente (con indicación inminente de uretroplastía), ya sea orinando forzadamente por uretra o bien con una sonda uretral a permanencia, no solo no tiene sentido, sino que posterga innecesariamente el estudio y el tratamiento definitivo. Ambas situaciones mantienen falsamente permeable la uretra enferma, por lo que debería indicarse una cistostomía durante unos 2-3 meses y luego reestudiar. Esto ha mostrado un cambio en el plan quirúrgico (EPA vs uretroplastía de aumento) pre y post reposo uretral en un 47% de los casos.27
- Dilatación con Balón Medicado:
Originalmente utilizado en patología vascular, el balón medicado con paclitaxel (BMP) ha sido evaluado en múltiples estudios clínicos, incluyendo los ensayos ROBUST I, II y III y algunas RS; demostrando mejoras significativas en la reducción de la recurrencia de la estenosis y la necesidad de reintervención. Además, su perfil de seguridad y la preservación de la función sexual lo posicionan como una alternativa viable y mínimamente invasiva frente a la uretroplastía en pacientes seleccionados.
El BMP combina la dilatación neumática de alta presión con la liberación circunferencial de paclitaxel, cuyos efectos se logran mediante dos mecanismos:
- Inhibir la proliferación celular: propiedad descubierta durante la angioplastía percutánea, donde se ha usado por años para prevenir re-estenosis. Evitando la progresión del ciclo celular y reduciendo la formación de fibroblastos.
- Evitar la formación de fibrosis: inhibien el factor de crecimiento transformante beta (TGF-β).
Este mecanismo dual permite no solo la apertura mecánica del lumen uretral, sino también la prevención de la cicatrización excesiva que típicamente contribuye a la recurrencia de la estrechez.
Gracias a su elevada lipofilia, el fármaco penetra la submucosa en horas, inhibe la proliferación de miofibroblastos y reduce la síntesis de colágeno, atenuando la cicatrización concéntrica responsable de la recidiva 28.
Indicaciones actuales:
- Estenosis bulbar ≤ 3 cm, ya sea primaria o tras > 2 tratamientos endoscópicos.
- Pacientes con comorbilidades que incrementan el riesgo anestésico o que desean aplazar la uretroplastía abierta.
- Estrategia «step-up» recomendada por las Guías Europeas antes de la reconstrucción definitiva.
Escenarios adversos:
- Estenosis penianas, múltiples o > 3 cm.
- Espongiofibrosis rígida (“tubo de plomo” endoscópico).
- Antecedente de radioterapia pélvica, asociada a mayor tasa de fracaso precoz29.
- Hipersensibilidad a paclitaxel o a su excipiente.
| Variable | 12 meses | 24 meses | 60 meses* |
| Libre de reintervención | 83 % | 72 % | 72 % |
| IPSS medio | 9 | 11 | 7 |
| Qmax medio (mL/seg) | 16 | 13 | 20 |
Tabla 3. Resultados del estudio Robust I (Tomado de Delong et al, 2025)30 n = 53.
Técnica abreviada
1. Pasar guía hidrofílica y “pre-dilatar” para homogeneizar el lumen con cualquiera de los siguientes: uretrotomía interna, dilatadores secuenciales rectos o curvos o balón No-medicado.
2. Luego, sobre la misma guía, introducir BMP de 30 Fr (10 mm); e inflar a 10-12 atmósferas (ATM) durante >5 minutos, cubriendo todo el segmento estenótico y 0.5-1.0 cm extra en ambos cabos de la estrechez, sobre la uretra sana.
3. Retirar, comprobar hemostasia sin pasar el cistoscopio sobre la zona dilatada.
4. Vaciar la vejiga con una de dos opciones: sondeo aislado con Nelaton 12 Fr enhebrada sobre la misma guía hidrofílica y luego retirar (esta es la preferencia de los autores); o bien, instalar una sonda Foley 12-14Fr sobre la guía.
Seguimiento recomendado
- Flujometría + IPSS a 3, 6 y 12 meses; luego anual.
- Cistoscopia si Q<sub>max</sub> < 10 mL/s o aumento de IPSS ≥ 4 puntos.
- Tras dos recurrencias documentadas, considerar la uretroplastía abierta².
Perfil de seguridad
Disuria (12–25 %), hematuria leve (≤ 15 %) y espasmo perineal autolimitado son los eventos más frecuentes; no se han descrito toxicidades sistémicas, ya que la dosis local es ≥ 500 veces menor que la empleada en oncología31,32.
Áreas de investigación
- Retratamiento tras uretroplastía fallida: un estudio multicéntrico (n = 113) mostró 80 % de éxito funcional a corto plazo (3.5 meses)33.
- Estenosis complejas o con múltiples recidivas de tratamientos endoscópicos previos: cohorte prospectiva documenta una tasa global de reintervención del 24 % a 24 meses34.
- ROBUST III, que continuará en seguimiento hasta 5 años para validar la durabilidad de los resultados.
En síntesis, el BMP en estrechez bulbar corta, no irradiada y con fibrosis limitada, ofrece una alternativa mínimamente invasiva con eficacia demostrada hasta cinco años y bajo perfil de complicaciones. Este tratamiento no se aplica a cualquier escenario, existen factores de riesgo de fracaso y la selección rigurosa y un seguimiento estructurado son esenciales para maximizar beneficios y evitar retrasar innecesariamente la reconstrucción abierta.
- Uretroplastía. En general, el gold standard en términos de éxito, es la EPA, sin embargo, hay variadas situaciones en que los efectos colaterales la hacen poco aconsejable. Dentro de las técnicas de aumento, la evidencia favorece a los injertos de mucosa oral por sobre los colgajos de prepucio, por el mayor riesgo de complicaciones de éstos últimos, a pesar de tener similares tasas de eficacia. Para decidir la mejor técnica se consideran los siguientes factores: ubicación, longitud, grado de obliteración, etiología, continencia y cirugías previas. (Fig. 7).
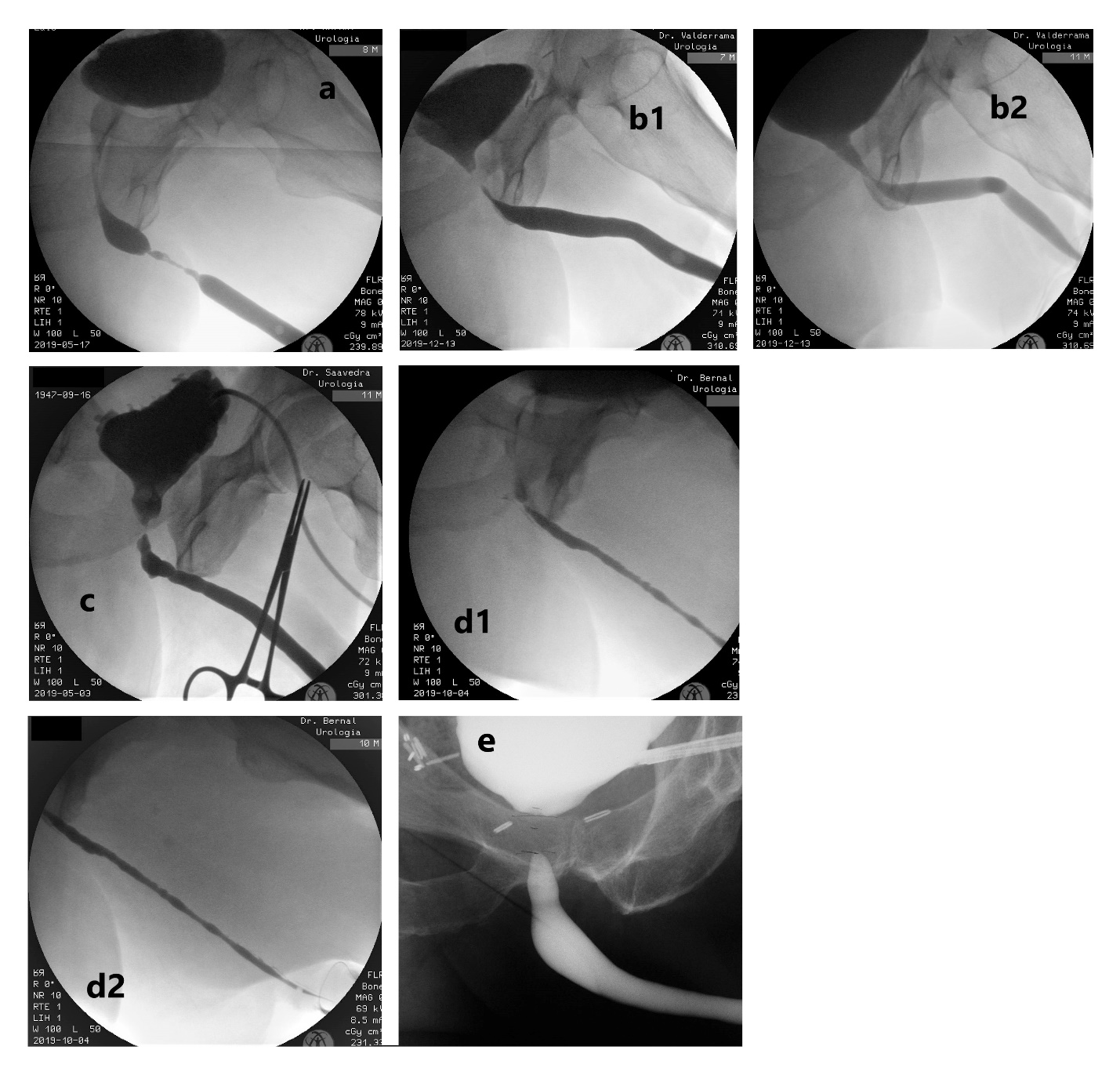
| Figura 7. Diferentes imágenes de uretrocistografía. a) Estrechez uretra bulbar media-distal. b1) Estrechez unión bulbomembranosa post-prostatectomía radical + radioterapia (fase retrógrada que no es capaz de definir ubicación real por sí sola). b2) Mismo caso anterior, donde se observa apertura adecuada de la anastomosis uretrovesical y de la uretra membranosa, definiendo la estrechez en la unión bulbomembranosa (fase miccional). c) Estudio anterógrado (por cistostomía) y retrógrado en simultáneo, evidenciando estrechez crítica de unión bulbomembranosa post adenomectomía transvesical; vejiga de lucha y cuello vesical abierto espontáneamente. d1 y d2) Panestrechez de uretra anterior, con segmento crítico en uretra bulbar proximal. e) Estudio con cistoscopía anterógrada flexible y UCG retrógrada en simultáneo, de una estenosis obliterada de la anastomosis uretrovesical post-prostatectomía radical. |
-
- Uretra anterior.
- Meato y Fosa Navicular: su manejo inicial depende, primariamente, de su etiología. El meato se puede manejar con meatotomía/meatoplastía en “V”. A pesar de su proximidad, la estrechez de fosa navicular es un fenómeno diferente. En casos idiopáticos podría intentarse una dilatación idealmente con uso de corticoides, como el clobetasol en crema o ungüento 35. Por otro lado, en los casos de estrecheces por LS, por hipospadias previas o que hayan fracasado frente a la dilatación se recomienda el uso de uretroplastías con injerto de mucosa oral.
- Uretra anterior.
En el caso de la fosa navicular no hay mayor diferencia entre la colocación dorsal o ventral del injerto, dado que el esponjoso del glande entrega un amplio soporte vascular en ambas caras. De manera destacable, durante la última década se han desarrollado técnicas transuretrales para la resolución de estrecheces de fosa navicular (Figura 8). Estas técnicas buscan disminuir las consecuencias estéticas, logrando tasas de éxito de hasta 95% 36.
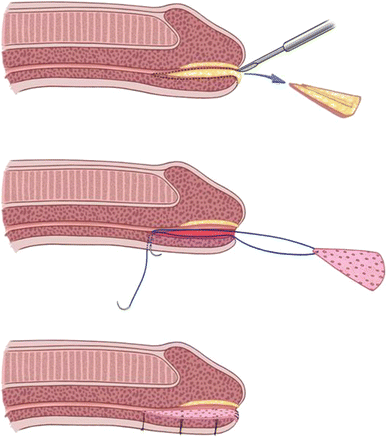
Figura 8. Técnica de injerto de mucosa oral ventral para estrechez de fosa navicular (Tomado de Daneshvar, et al 2020)36
-
-
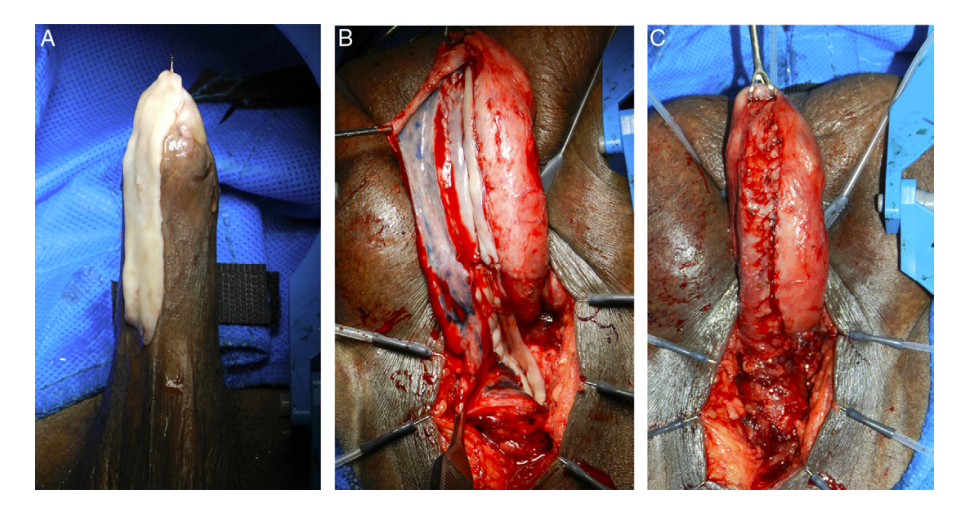
- Uretra Peniana: La EPA debe evitarse por el riesgo de curvatura peniana ventral (chordee) secundario. Si hay lumen residual, espongiofibrosis leve a moderada y no hay presencia de fístulas, cirugías previas o historia de hipospadias, puede realizarse una uretroplastía en un tiempo. El injerto puede fijarse como un inlay dorsal (Asopa) (Video 1, Fig. 9), como un onlay dorsal (Barbagli) (Fig. 10) o como un onlay dorsolateral ya sea con desforramiento o con una incisión perineal con invaginación del pene (Kulkarni) (Fig 11). En presencia de obliteración, fístulas, cirugías previas o hipospadias, se aconseja la uretroplastía en etapas (Fig. 12).37 No se recomienda el uso de onlay ventral en uretra peniana, por el riesgo de saculación y fístulas, ya que el esponjoso es de menor espesor a este nivel.
-
| Figura 9. Técnica de inlay dorsal (Asopa): Uretrotomía longitudinal ventral. Exposición de lumen y cara interna dorsal. Nueva uretrotomía longitudinal dorsal y creación del lecho para interposición del injerto. (Tomado de Horiguchi et al, 2020)38 |
-
-
- Uretra bulbar. La EPA transectante era considerada el gold standard de manera general en casos de E/E <2.0, dado que alcanza más de un 90% de éxito sin necesidad de uso de injertos39 (Fig. 13). Sin embargo, la aparición de los balones con paclitaxel y nuevos estudios en relación a las implicancias en función sexual de la EPA,han puesto en entredicho su rol preferencial. Una serie multicéntrica mostró que hasta el 14,3% de los pacientes expuestos a cirugías transectantes presentan empeoramiento en su función sexual vs el 4,3% cuando se usan técnicas no transectantes40. Por lo mismo, actualmente se mantiene como primera opción solo en etiologías traumáticas, permitiendo remover la espongiofibrosis. La técnica de anastomosis no-transectante (non-transecting) es útil en segmentos obliterados de uretra bulbar proximal y media, <2.0 cms, de origen no traumático y con espongiofibrosis leve.
-
Para estrecheces de mayor tamaño se prefieren las uretroplastías de aumento con mucosa oral, siendo planteable la anastomosis no transectante en casos proximales de hasta 4 cms. No existe evidencia de momento que sustente el uso de injertos dorsales por sobre ventrales41. (figuras 10 y 14), debiendo elegirse la técnica según la anatomía de cada caso y la experiencia del cirujano, auqnue no se recomiendan onlay ventrales ni inlay dorsal en la porción más distal porque el esponjoso es más delgado en esta porción. En casos de segmentos obliterados largos, se puede hacer una EPA ampliada con injerto, para lograr una anastomosis sin tensión, aunque esto se asocia a mayores tasas de recurrencia vs la realización de un onlay42.
La uretrostomía perineal es una excelente alternativa para pacientes con E/E de uretra anterior recalcitrantes o en pacientes añosos, con uretra posterior sana, detrusor normocontráctil y continencia conservada. (Fig. 15). No está indicada en E/E de uretra posterior, por la profundidad de la uretra y por el riesgo de lesionar el esfínter externo.
-
-
- Estrecheces panuretrales: corresponden a casos con un compromiso de más de 10 cms de uretra, pudiendo llegar a afectar toda la uretra anterior. Producidos típicamente por LS o causas iatrogénicas. En estos casos previamente se proponía la resolución en etapas, sin embargo, se demostró que esta técnica presenta mayores tasas de falla que la resolución en una etapa43 en casos no complejos.
-
Uno de los abordajes más utilizados actualmente en casos no complejos es el de Kulkarni (figura 16), donde se asegura un injerto de mucosa al meato uretral y luego se invagina a través del mismo hacia la uretra, fijándolo de manera dorsolateral. En caso de que se requiera más de un injerto, estos deben anastomosarse de manera oblicua.
En casos complejos se sigue recomendando la uretroplastía en etapas, considerando como complejos las uretras induradas a la palpación, las uretroplastías penianas recidivada y secuelas de hiposopadias operadas
| Figura 10. Técnica de onlay dorsal (Barbagli): Liberación circunferencial de la uretra. Uretrotomía longitudinal dorsal. Fijación del injerto sobre la albugínea de los cuerpos cavernosos. Sutura de los bordes de la uretra nativa a los bordes del injerto. (Tomado de Horiguchi et al, 2020)38 |
| Figura 11. Técnica de onlay dorsolateral para uretra peniana (Kulkarni): Inversión completa del pene por incisión perineal. Liberación unilateral de la uretra. Uretrotomía longitudinal unilateral. Fijación unilateral del injerto sobre la albugínea de los cuerpos cavernosos. Sutura de los bordes de la uretra nativa a los bordes del injerto. (Tomado de Kulkarni et al, 2009)44 |
| Figura 12. Técnica de uretroplastía en etapas: a) Paciente con antecedente de hipospadias con 18 cirugías previas. Flecha calipso: injerto antiguo de mucosa oral. Flecha roja: fístula uretrocutánea. Flecha amarilla: fístula uretrocutánea y vellos saliendo de flap de escroto antiguo. b) Intraoperatorio. Flecha morada: se preserva injerto antiguo en glande. Flecha verde-amarilla: se preserva segmento de injerto cutáneo antiguo en tercio medio. Flecha azul: se reseca toda la neoplaca uretral antigua estenótica y con vellos. c) Flecha morada: reconstrucción de placa con injerto de mucosa oral. Flecha gris: “collar” de mucosa oral circunscribiendo neomeato transitorio. d) Aspecto a los 3 meses postoperatorios, con neoplaca uretral amplia y neomeato amplio. |
| Figura 13. Técnica de EPA: resección completa del segmento estrecho. Espatulación dorsal en cabo distal y ventral en cabo proximal. Presentación de suturas separadas dorsales y ventrales, 8 a 10 puntos en total. Anudar primero las dorsales bajo visión y luego las suturas ventrales. (Tomado de Joseph et al, 2020)38 |
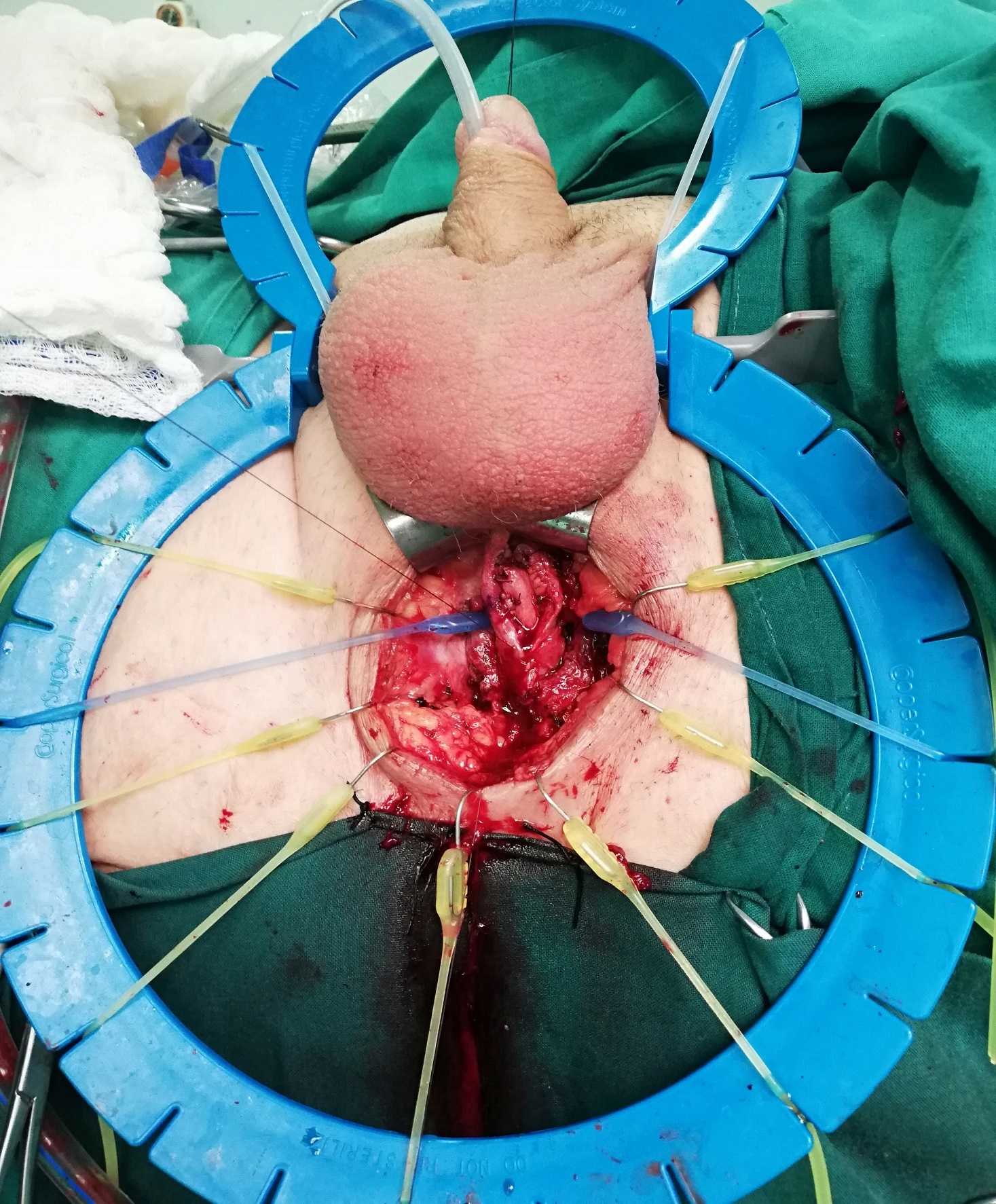
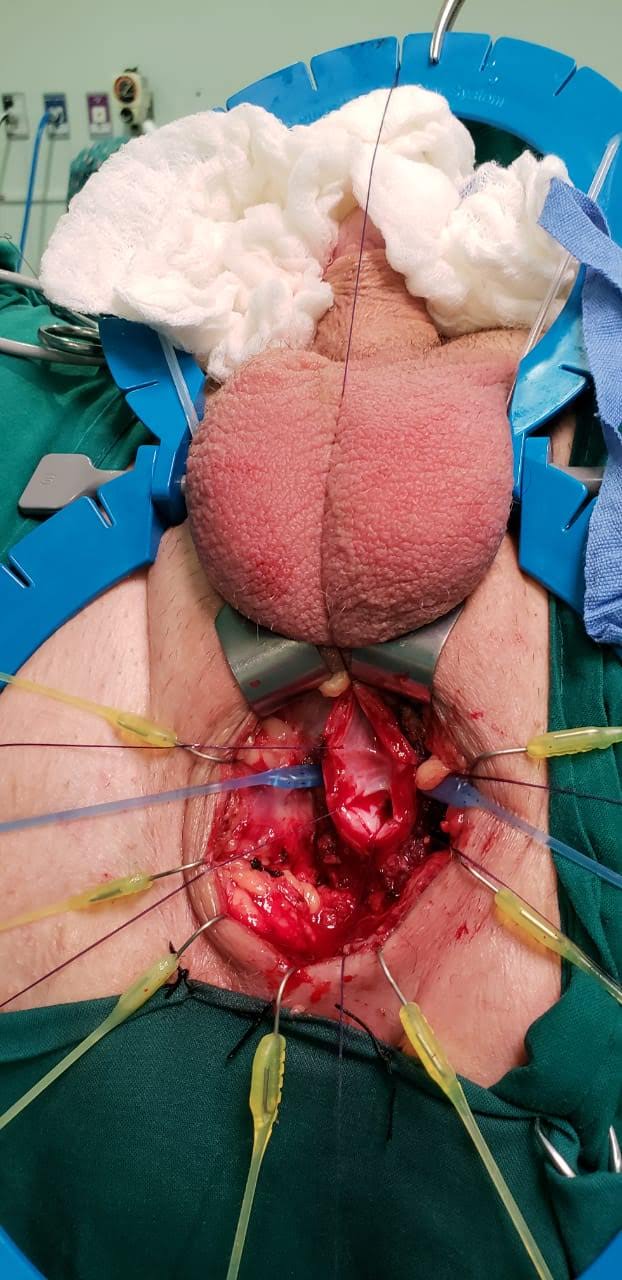
| Figura 14. Técnica de onlay ventral: a) Uretrotomía longitudinal ventral y exposición de lumen. b) Sutura de injerto de mucosa oral a mucosa de uretra nativa (3 puntos separados en ápex distal y en ápex proximal; sutura corrida a ambos lados). Luego, se cierra esponjoso sobre el injerto (no mostrado en imágenes) |
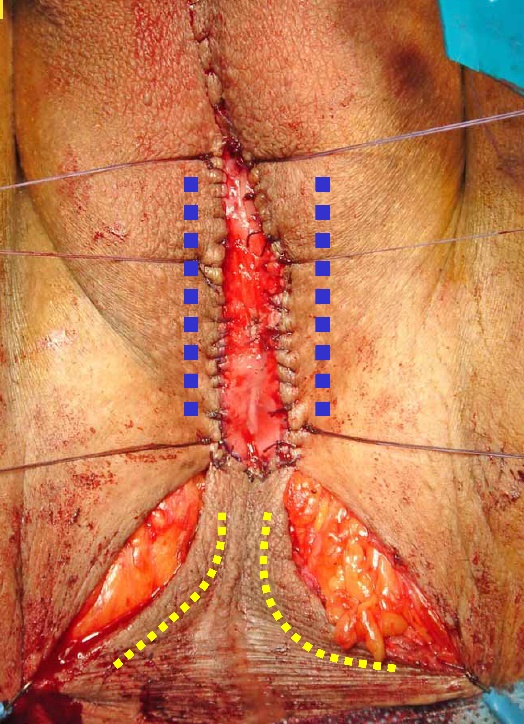
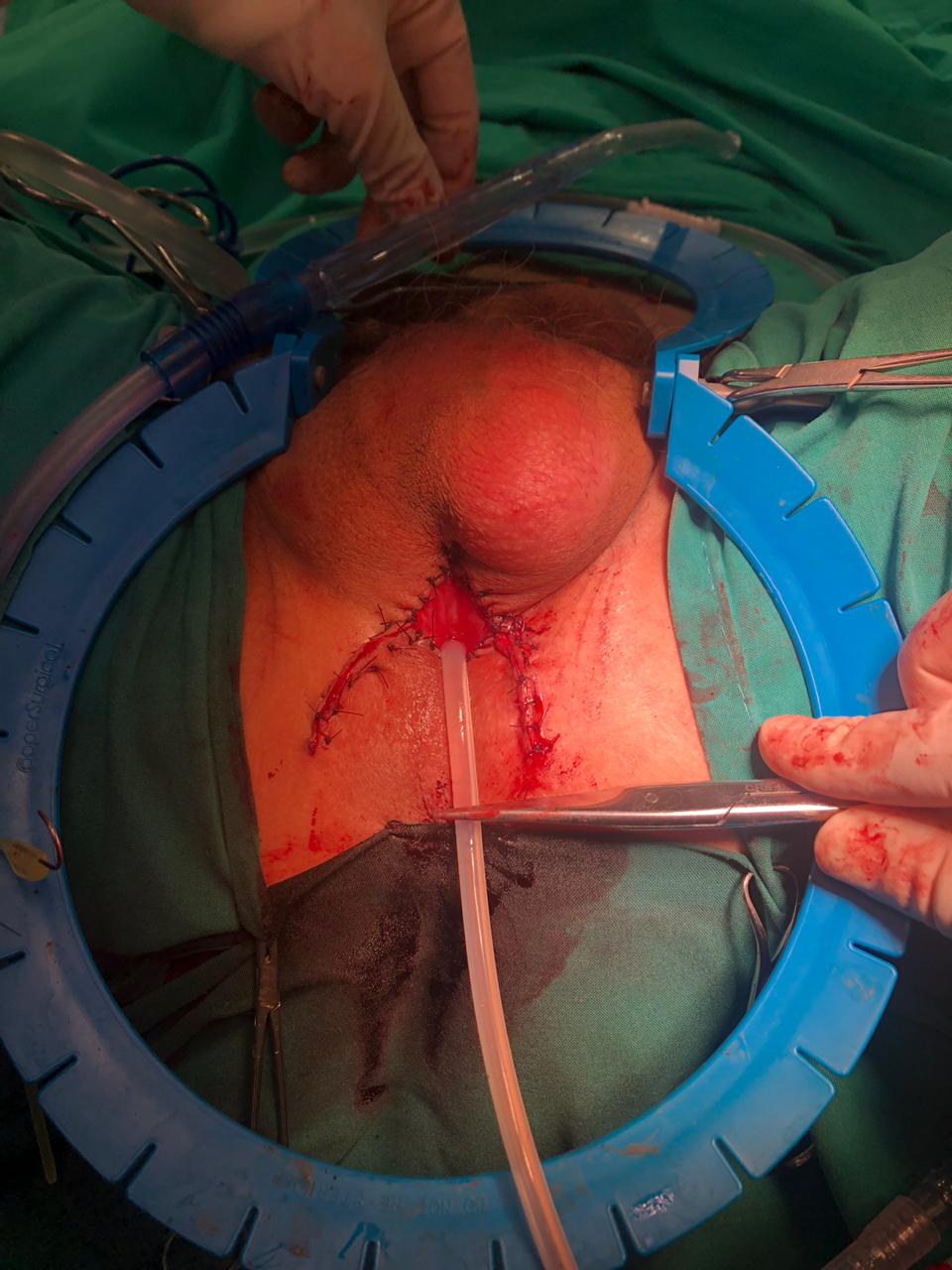
| Figura 15. Uretrostomía perineal: Incisión en lambda con uretrotomía longitudinal bulbar ventral y marsupialización de bordes a piel lateral (líneas azules) y flap de base posterior (líneas amarillas) |
| Figura 16 Técnica de Kulkarni para estrecheces panuretrales. Tomado de Kulkarni, et al, 2012 45 |
-
- Uretra posterior.
- Estenosis de la anastomosis uretrovesical (VUS, en inglés) post-prostatectomía radical (PPR). La VUS ocurre en el 1-30% de las prostatectomías. Los factores de riesgo son: edad, tabaco, obesidad, experiencia del cirujano, hematoma o urinoma postoperatorio, RTU previa, radioterapia, tumor agresivo. El manejo inicial es la dilatación/UTI bajo visión, que alcanza una tasa de éxito de 91% después de varias repeticiones, y que se puede complementar con inyección intralesional de triamcinolona o mitomicina-C, que aparentemente disminuye o retrasa la recidiva.46 En caso de falla, se debe realizar una reanastomosis (EPA) que puede ser por via perineal, abdominoperineal o robótica, que a su vez tiene un éxito inicial de 60%. En caso de falla, el manejo endoscópico puede llevar a un 95% de éxito.
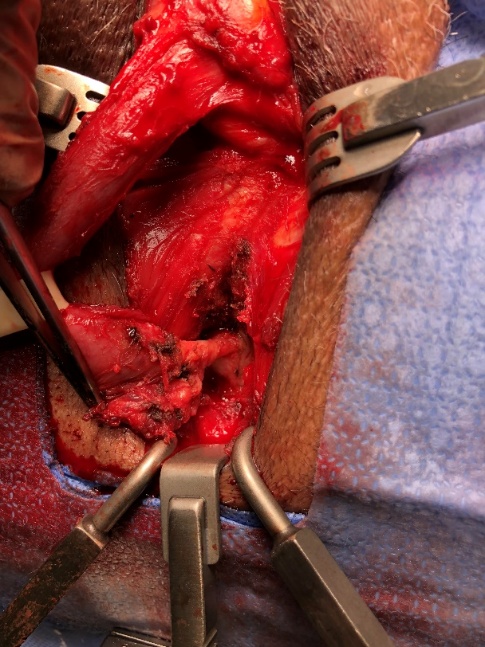 Estenosis bulbomembranosa post-radiación. Ocurre en un 4.9% de los pacientes que reciben radioterapia externa (EBRT) + braquiterapia (BT). En un 90-100% de los casos, se localiza en la unión bulbomembranosa. Puede manejarse con dilatación/UTI, con una tasa de recurrencia entre 13-49%, y que se puede complementar con inyección intralesional de triamcinolona o mitomicina-C. Dada la complejidad de estos casos, la dilatación es una opción válida en pacientes añosos o que no quieren ir a grandes cirugías, asumiendo que posiblemente requerirán varios procedimientos. La uretroplastía puede realizarse por abordaje perineal mediante EPA (éxito 70-95% a 3 años) o con aumento tipo onlay dorsal o ventral (éxito 71%). El riesgo de incontinencia de novo (10-50%) debe discutirse previamente con el paciente.47 (Fig. 17).
Estenosis bulbomembranosa post-radiación. Ocurre en un 4.9% de los pacientes que reciben radioterapia externa (EBRT) + braquiterapia (BT). En un 90-100% de los casos, se localiza en la unión bulbomembranosa. Puede manejarse con dilatación/UTI, con una tasa de recurrencia entre 13-49%, y que se puede complementar con inyección intralesional de triamcinolona o mitomicina-C. Dada la complejidad de estos casos, la dilatación es una opción válida en pacientes añosos o que no quieren ir a grandes cirugías, asumiendo que posiblemente requerirán varios procedimientos. La uretroplastía puede realizarse por abordaje perineal mediante EPA (éxito 70-95% a 3 años) o con aumento tipo onlay dorsal o ventral (éxito 71%). El riesgo de incontinencia de novo (10-50%) debe discutirse previamente con el paciente.47 (Fig. 17).
- Uretra posterior.
| Figura 17. Exposición de uretra bulbar, membranosa y ápex prostático, durante una reconstrucción de uretra posterior. |
-
-
- PFUI. Considerando que la fisiopatología de este cuadro conlleva generalmente una disrupción de la uretra y el consecuente relleno del espacio con fibrosis, debe tratarse con uretroplastía (dilatación/UTI no tienen rol curativo), la inmensa mayoría de las veces con EPA. El abordaje perineal es el habitual para uretra posterior, pero requiere de una prolija resección de todo el tejido fibrótico periuretral, haciendo difícil la preservación de vasos, nervios y esfínter. Dependiendo de la longitud del defecto, puede requerir las maniobras escalonadas de Webster para disminuir la distancia entre los cabos y lograr una anastomosis sin tensión: a) liberación de uretra bulbar, b) separación de cruras de los cavernosos, c) pubectomía inferior, d) rerouting supracrural, e) abordaje abdominoperineal con pubectomía total.48
- Estenosis del cuello vesical (BNS, en inglés). Este cuadro se presenta con próstata preservada, generalmente secundario a cirugía por hiperplasia prostática (RTU, enucleación láser o cirugía abierta). Inicialmente se ha manejado con dilatación/UTI con o sin mitomicina-C o triamcinolona, alcanzando una tasa de éxito de 75% después de <2 procedimientos consecutivos.49 Los casos refractarios han sido manejados con reconstrucción abierta por vía abdominal, tipo plastía Y-V y más recientemente por vía robótica, con tasa de éxito entre 75-100% en series pequeñas, con incontinencia de novo en 18% de los casos.50
-
SEGUIMIENTO
La forma óptima de realizar el seguimiento de pacientes post-cirugía de E/E está aún en desarrollo y discusión en la actualidad. Puesto que ningún método es suficiente por sí mismo, la recomendación más reciente es utilizar13:
- Evaluar la perspectiva del paciente, incluyendo: a) LUTS, b) calidad de vida y c) función sexual, mediante algún Patient Reported Outcome Measures (PROM).
- UFM a los 3, 6, 12 y 24 meses postoperatorios.
- Cistoscopía al menos 1 vez durante el primer año postoperatorio, para identificar recurrencias que no se detectan en los PROMs ni en la UFM.
- UCG/VCUG para etapificación, sólo en casos en que se confirme una recurrencia.
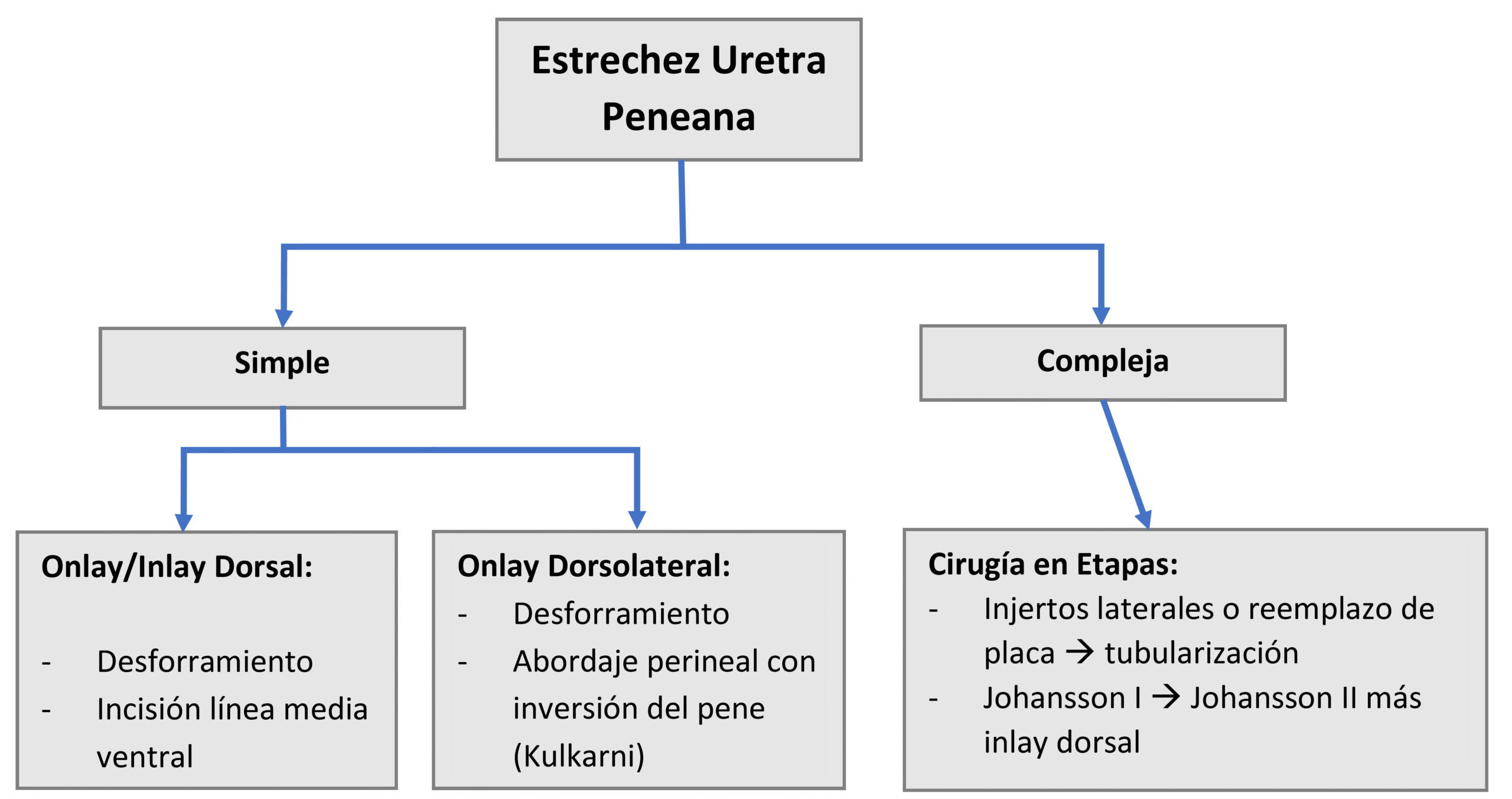
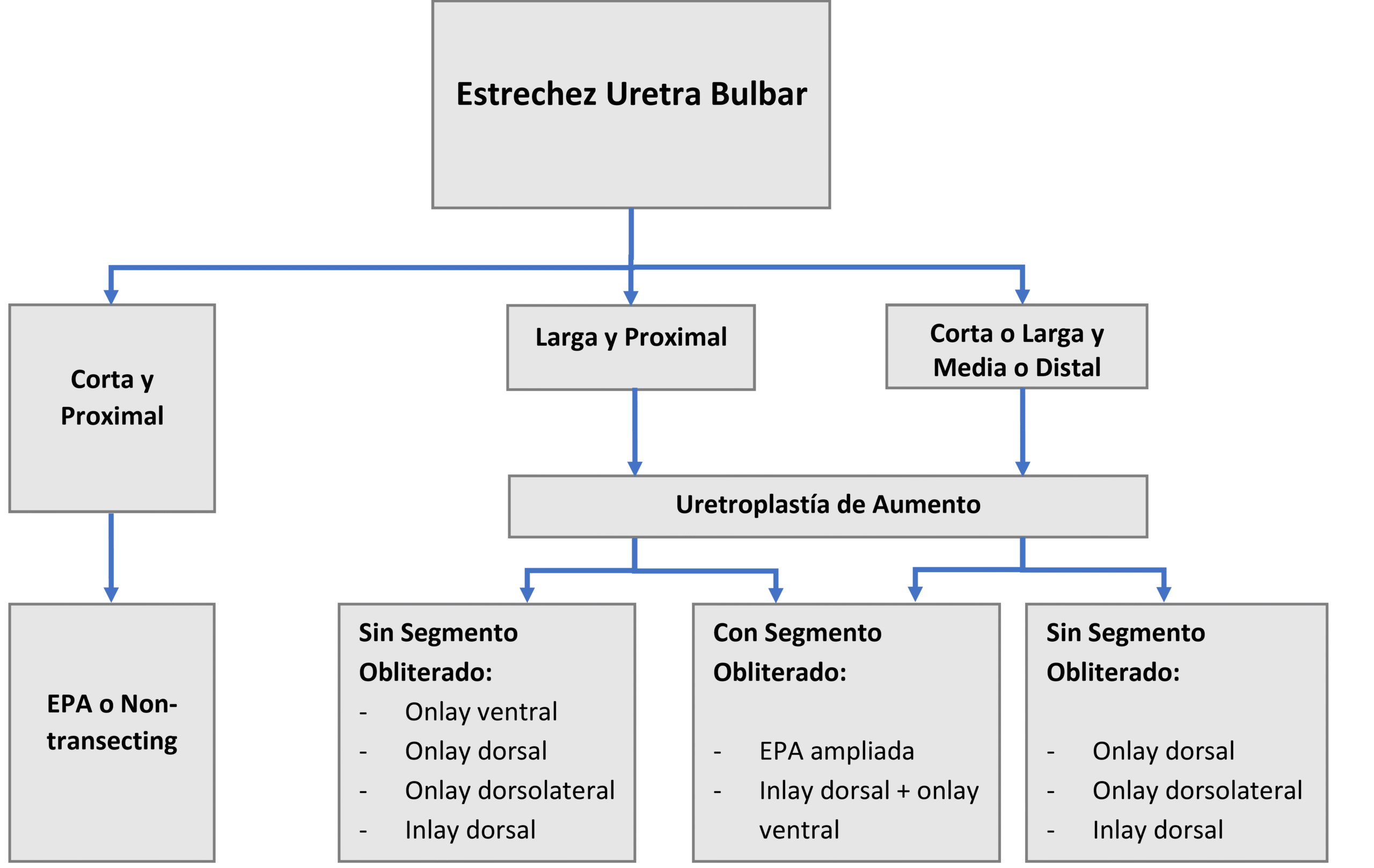
| Flujogramas para Estrechez Uretral Anterior. (Basado en Horiguchi et al, 2020)38 |
SECCIÓN II: INCONTINENCIA DE ORINA MASCULINA
DEFINICIÓN Y EPIDEMIOLOGÍA
La incontinencia de orina (IO) es la incapacidad para retener la orina. En general, se clasifica en IO de esfuerzo (IOE) cuando la pérdida de orina se asocia a movimiento o valsalva; IO de urgencia (IOU) cuando se asocia con una sensación de urgencia e IO mixta cuando hay una combinación de ambas, existiendo además otros tipos menos frecuentes. La incidencia de la IO masculina según la Sociedad Internacional de Continencia (ICS) varía entre 1 a 39%, siendo IOU 40%-80%, IO mixta 10-30% e IOE <10% 51–53.
El escape urinario se asocia a un significativo gasto económico y carga emocional como ansiedad, depresión y disminución de la calidad de vida. El 40% de los hombres informaron una frustración moderada a grande 52,54,55. Los síntomas irritativos son los más molestos para el paciente 51.
Considerando que el manejo y estudio de la IOU es similar en hombres y mujeres, en este capítulo nos centraremos en la IOE masculina post prostatectomía radical (PR)
ETIOLOGIA
La continencia es el fenómeno normal que ocurre en la fase de llenado vesical. Depende básicamente de 2 elementos: una baja presión vesical de llenado y una alta resistencia al flujo en el tracto de salida. La IO ocurre por fallas en uno o ambos elementos, cuando la presión vesical finalmente supera la resistencia de salida durante el llenado, o cuando existe una comunicación anormal entre compartimentos (tabla 3).
| Relacionadas con Esfínter | Post Prostatectomía por patología benigna o maligna prostática
RTU próstata Radioterapia Post cistectomía y neovejiga por cáncer de vejiga Post reconstrucción uretral próstato-membranosa Trauma piso pélvico Extrofia e epispadia |
| Relacionadas con Vejiga | Incontinencia por urgencia refractaria
Vejiga pequeña fibrótica |
| Fístulas | Próstato o uretro rectal
Uretro-cutánea |
| Tabla 4. Clasificación de etiología corregibles quirúrgicamente4 |
La PR es la causa más común de IOE en hombres56,57. Si bien el daño esfinteriano pareciera a priori ser el mecanismo principal de la IO en este escenario, en realidad es un cuadro multifactorial, que incluye hipocontractilidad del detrusor de novo, deficiencia intrínseca del esfínter, acortamiento de uretra membranosa, lesión de ramas del nervio pudendo y pérdida del efecto de sellado venoso56. En este sentido, una una serie urodinámica de 264 pacientes tras la prostatectomía radical (PR), mostró que un 41% presentó hipoactividad del detrusor, un 17% obstrucción y un 27% hiperactividad del detrusor 58.
Las tasas de IOE post-PR varían entre 6% y 69% 54–57. Es importante considerar que la continencia post PR no es inmediata, con una mejoría paulatina de los pacientes dentro del primer año, llegando la mayoría de ellos a ser continentes a los 12 meses2. Algunos estudios muestran que hasta el 90% de los hombres sometidos a PR logran su grado máximo de continencia a los 6 meses, presentándose una mejoría adicional solo en el 4% dentro de los próximos meses, lo que sustentaría un tratamiento precoz en pacientes con incontinencia severa 59.
Los factores de riesgo de IOE post PR incluyen edad, índice de masa corporal, menor experiencia del cirujano 51,57, próstatas más grandes y menor longitud de la uretra membranosa (medida por resonancia magnética). La preservación bilateral del haz neurovascular es la única modificación quirúrgica que ha demostrado aumentar la recuperación de la continencia.52,53,56,60
Las tasas reportadas de IO después de tratamiento primario con radiación o ultrasonido focalizado de alta intensidad (HIFU) son de 6.6-23% y de 0.5-15.4%, respectivamente.
Además, un tercio de los pacientes post-PR experimentarán recurrencia bioquímica, por lo que necesitarán radiación pélvica y aproximadamente el 33-42% de este grupo presentará IO.
La resección transuretral de próstata se asocia a IOE en el 1% y cirugía abierta por patología benigna en un 2% 53.
PREVENCIÓN
El uso de entrenamiento muscular del piso pélvico (PFTM por sus siglas en inglés) en el período previo a la PR se sustenta en que sería más difícil aprender estos ejercicios después de la cirugía debido a la inhibición muscular, cambios sensoriales y dolor dados por la terapia61. Estos tratamientos deben iniciarse 3-4 semanas antes de la intervención quirúrgica . La evidencia sobre la utilidad de estos tratamientos es inconsistente59, sin embargo, dado que no producen daños se podrían recomendar a los pacientes.
ESTUDIO
Como el diagnóstico diferencial es amplio y complejo, es importante seguir una estructura para garantizar un enfoque terapéutico adecuado. (Tabla 4)
El primer paso incluye anamnesis, examen físico y evaluación objetiva de síntomas 51,52,57.
- Anamnesis. Es esencial definir tipo de IO, su severidad (con número, tamaño y humedad de almohadillas), precipitantes, identificar síntomas de alarma como hematuria y confeccionar diarios miccionales (Anexo 1). S e recomienda el uso de cuestionarios estandarizados como IPSS, OAB, ICIQ-SF, entre otros57. (Anexo 2).
- Examen físico. El examen genital con Valsalva puede mostrar los escapes de orina, dando una noción subjetiva de la severidad de la IOE. Luego, debe centrarse en la capacidad para deambular, fuerza y coordinación de manos, presencia de globo vesical o cicatrices abdominales. El examen rectal informará la anatomía prostática, tono y capacidad para contraer el esfínter y el examen neurológico enfocado en sensación regional y debilidad de las extremidades.
- Exámenes básicos. El análisis de orina con cultivo identificará infección y hematuria, mientras la creatinina/BUN y glicemia, son útiles para sospechar posibles casos de obstrucción asociada y de poliuria.
- UFM con residuo postmiccional. Para evaluar el vaciamiento 51,53,57.
- Pruebas de toallas o pad tests. Son pruebas estandarizadas, útiles e imprescindibles para objetivar la pérdida de orina y suelen utilizarse cuando se considera tratamiento invasivo. La evidencia indica que el pad test de 24 hr es lo más fidedigno. Sin embargo, el pad test de 1 hr es el más reproducible (Anexo 3). Según la International Continence Society (ICS), éste último clasifica la IOE en base al aumento de peso del paño al final del test, en: a) leve (<10 g), b) moderada (11–50 g) y severa (>51g) 52,53,57.
- Uretrocistoscopia. Se recomienda siempre cuando el tratamiento conservador falla y se plantea manejo quirúrgico. Esto porque permite detectar condiciones asociadas que modificarían el abordaje, como estrechez o estenosis de uretra o del cuello.7,12
- Urodinamia multicanal. Debe plantearse cuando se piensa en IO de etiología multifactorial (como hipo o hiperactividad del detrusor, alteración de la acomodación o capacidad vesical), cuando el cuadro clínico es poco claro y cuando el paciente tiene trastornos neurológicos asociados 51,52,62. Aunque ninguno de los hallazgos urodinámicos ha demostrado afectar los resultados del esfínter urinario artificial (AUS), sí son muy relevantes a la hora de establecer las expectativas ante el tratamiento53,57,62.
| Evaluación | Nivel de evidencia | Grado de recomendación |
| Historia
Examen físico Urocultivo y uroanálisis Residuo postmiccional Diario miccional Prueba de almohadilla Cistoscopia Urodinamia multicanal |
1-2
1-2 1-2 1-2 1-2 1-2 2-3 3 |
A
A A A B B B C |
| Tabla 5. Recomendaciones para estudios previos a cirugía de incontinencia 53,63 |
TRATAMIENTO
- Manejo conservador.
- Debe ofrecerse a todos los pacientes incluyendo cambios en estilo de vida (micción programada, reducción de la ingesta de líquidos y reducción de irritantes de la vejiga como cafeína, alcohol, cítricos) y PFMT que ha mostrado acelerar la recuperación de continencia. 52,57
- Para tratar los síntomas de vejiga hiperactiva concomitantes se recomienda el uso de neuromodulación tibial posterior (NMTP), antimuscarínicos o toxina botulínica.2,7 No existen fármacos aprobados para uso en IOE post PR.
- Existen otras opciones paliativas, como almohadillas absorbentes, dispositivos de compresión del pene, sistemas de drenaje (tipo condón, catéteres externos, uretrales y suprapúbicos).52
- Manejo quirúrgico. La mayoría de los pacientes logran su máxima recuperación de continencia a los 12 meses de la cirugía. Si al cabo de este tiempo el tratamiento conservador ha fracasado, se recomienda el tratamiento quirúrgico52,57,62.No obstante, en pacientes con IOE severa sin mejoría significativa al cabo de 6 meses, también pueden ser candidatos para una intervención temprana 52.
El AUS AMS-800© ha sido el gold standard por décadas. Sin embargo, en los últimos años, las cintas masculinas (slings) han surgido como una opción de tratamiento relevante. (Fig. 18). Las cintas masculinas están indicadas en IOE leve/moderada y en ciertos casos de IOE severa 52,55,57.
La definición de éxito de la cirugía de IOE varía ampliamente según los estudios y se definen al menos 3 grupos: cura (0-1 almohadilla al día), mejoría (si tiene 50% menos uso de almohadillas) y fracaso (usa más del 50% de almohadillas) 52.
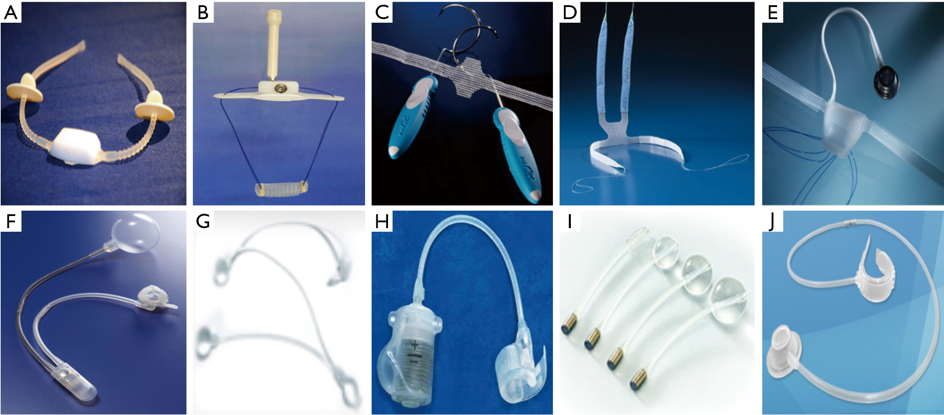
- Esfínter urinario artificial
a.1 AUS AMS-800©: Es el dispositivo más ampliamente usado y con el seguimiento más prolongado (mayor a 40 años), por lo que es considerado el gold standard para IOE masculina, de moderada a severa 52,55–57,62. Consiste en un manguito periuretral de silicona conectado a una bomba escrotal (que debe manipular el paciente para orinar) y ésta, a su vez, está conectada a un balón regulador de presión intraabdominal. Se han reportado tasas de éxito del 77.3% después de un seguimiento de más de 15 años, mientras otros trabajos muestran tasas muy variables (al medir diferentes períodos de seguimiento y definiciones de éxito) entre 4.3% y hasta 90% 55–57.
Para el uso del AUS el paciente requiere tener un nivel cognitivo y de habilidades manuales mínimas que le permita el adecuado manejo de la bomba, lo que siempre debe evaluarse previo a la cirugía. En los últimos años se han publicado series que muestran que hasta un 44% de los pacientes presentarán problemas cognitivos o motores durante la vida útil del AUS, lo que hace que esta evaluación no deba realizarse sólo en el período preoperatorio, sino que deba mantenerse durante todo el seguimiento del paciente 64.
Se instala mediante una incisión perineal, con apertura del músculo bulboesponjoso y liberación circunferencial de la uretra bulbar (generalmente proximal o media), donde se instala el manguito. El balón regulador se instala en la región inguinal, en el espacio pre-peritoneal. La bomba se instala a través de esta última incisión, disecando en forma subcutánea hasta instalarla en el escroto. El dispositivo se activa a las 4-6 semanas.
Respecto a las complicaciones, se describen: erosión uretral e infección en el 8.5%, falla mecánica en 6.2%, atrofia uretral en 7.9% y una tasa global de reoperación por cualquier motivo del 26% 56.
La vida media del dispositivo es de 5 a 7 años (72–79% de los pacientes estuvo libre de revisión a los 5 años) 62. La tasa tasas de fracaso es del 24% a los 5 años y 50% a los 10 años.
Las cirugías de revisiones incluyen: el reemplazo del/los componentes defectuosos, reposicionamiento o reducción del tamaño del manguito periuretral (downsizing), agregar otro manguito en tándem o colocar un manguito transcorporal 55.
Si el AUS está infectado se debe remover por completo y considerar reemplazarlo en una segunda cirugía después de tres meses. Si existe erosión del manguito, el AUS debiera ser removido e instalar un catéter uretral durante algunas semanas para permitir que el defecto uretral sane o bien, reconstruir la uretra al momento del retiro 52,57.
Algunos pacientes presentan “uretra frágil”, donde se incluyen los casos con antecedentes de: radiación pélvica, uretroplastía o remoción de un AUS o sling previo. Este grupo tiene mayor tasa de fracaso de AUS y cintas, y un alto riesgo de complicaciones secundarias a cirugías de IOE. Si bien AUS puede igualmente ser utilizado, se recomienda en dichos casos introducir modificaciones complejas a la técnica quirúrgica, tales como la colocación transcorporal del manguito 65.
El paciente ideal para un AUS es: IOE moderada/severa, sin “uretra frágil”, con buen vaciamiento vesical, con nivel cognitivo y destreza manual bilateral suficientes.
En pacientes con IOE y disfunción eréctil post-prostatectomia pueden considerarse cirugías de AUS y prótesis peneana de forma simultánea, con ciertas consideraciones de la técnica.
a.2. ZSI-375©: es un dispositivo pre-conectado de 2 piezas (manguito periuretral y bomba/reservorio escrotal), que no necesita implantación intraperitoneal de un reservorio. Presenta una tasa de éxito de 72% después de un seguimiento de 7 años66, pero con una elevada tasa de remoción global del 61,5% 55.
a.3 Victo+ © (previamente llamado FlowSecure, 2006): consiste en un dispositivo de silicona muy similar al AMS-800, con piezas preconectadas y prellenadas con suero fisiológico, pero que además cuenta con un balón intraabdominal que transmitiría la presión del Valsalva al manguito y que, teóricamente, permitiría mantener presiones basales menores sobre la uretra, evitando la erosión. Asimismo, cuenta con un puerto de ajuste, para agregar más volumen al sistema. Sin embargo, la evidencia disponible es aún muy escasa53,57. El trabajo más grande a la fecha corresponde a un análisis retrospectivo de 88 pacientes y con una media de seguimiento de 29 meses, que mostró una tasa de éxito de 71.4% 67
a.4 ContiClassic AUS: lanzado el 2020, es muy similar al AMS 800 pero presenta una cobertura hidrofílica y una bomba más suave, que haría la activación y desactivación del dispositivo más fácil. En un estudio que incluyó 116 hombres con 8.2 meses de seguimiento reportó una tasa de revisión del 6.9%, sin existir de momento reportes a largo plazo de su efectividad 68
B. Cintas suburetrales no ajustables.
Entregan un soporte pasivo a la uretra.El candidato ideal debe tener IOE leve a moderada, función residual adecuada del esfínter, detrusor con contracción suficiente para superar la resistencia fija de la cinta 52,57 y no tener antecedentes de radioterapia56. En pacientes con IOE persistente o recurrente después de una cinta, el AUS es lo recomendado52.
b.1 AdVance: ha sido la cinta más utilizada en todo el mundo y consiste en una malla de polipropileno que se coloca bajo la uretra bulbomembranosa por vía transobturatriz. (Fig. 17). Se estipula que no es compresiva y que actúa multifactorialmente mediante la “reubicación de la uretra” reposicionando el esfínter, aumentando el efecto de sellado venoso y el aumento de la longitud de uretra funcional 53,57, concepto que los autores no comparten.
Es importante tener en cuenta que su uso aplica principalmente a la IOE leve 69. Las tasas de curación varían entre 9% y 63% con un seguimiento de hasta 40 meses 53,57 En pacientes que han recibido radioterapia, la tasa de éxito disminuye a 35%.
La cinta AdVanceXP muestra una tasa de cura del 73.1%, una tasa de mejoría de 19.6% en pacientes con IOE leve a moderada56 y la tasa de curación aumenta a 90% en hombres que usaban 1 ó 2 pads al dia 53. Presenta bajas tasas de complicación en comparación con los AUS 70 Si falla el sling, se puede agregar una segunda cinta uretral, instalar AUS o bien un sling ajustable.
b.2: Virtue Sling: cinta suburetral con dos brazos transobturatrices y dos retropúbicos. Presenta tasas de respuesta variables, que van entre 32 a 82% dependiendo de la serie 71. Su efectividad iría decreciendo con el tiempo.
Varias otras cintas suburetrales masculinas no ajustables están en el mercado, incluido la cinta TOMS, que parecen mostrar resultados comparables, pero la evidencia es escasa.
| Figura 19. Colocación de AdVance Sling y su mecanismo de acción. (Tomado de Chung et al, 2017)15 |
- Cintas suburetrales ajustables.
Se coloca un cabestrillo/cojín suburetral superficial al músculo bulbospongoso. El método de acción es una presión permanente sobre la cara ventral de la uretra bulbar. Después de la operación, se puede ajustar la presión/tensión de la cinta para optimizar los resultados.
A diferencia de las cintas no ajustables, se pueden lograr buenas tasas de continencia también en pacientes con IOE más grave y previamente irradiados 53,57.
Las siguientes cintas ajustables están disponibles actualmente (orden alfabético): ATOMS (A.M.I., Feldkirch, Austria), Remeex (Neomedic, Barcelona, España), Vulko (Promedon, Córdoba, Argentina). La evidencia actual indica que la eficacia de las cintas es comparable. Sin embargo, existen diferencias en las tasas de complicaciones 56,57.
c.1 Argus classic / ArgusT: Estos sistemas consisten en una almohadilla silicona unida a dos cintas de silicona. El Argus clásico se implanta retropúbico y ArgusT se implanta transobturatriz. Tienen tasas de éxito comparables72 de continencia en IOE leve/moderada y varían entre 17% (definición de éxito: 0 almohadillas o 1 almohadilla de seguridad por día) y 79.2% (definición de éxito: 1 ml en prueba de almohadilla de 20 minutos) 57.
La tasa de perforación intraoperatoria de la vejiga es del 10% y las complicaciones postoperatorias incluyen dolor perineal (15-27%), retención urinaria transitoria (hasta 35%), remoción (6-10% y en un estudio fue de 35%) 53,57.
c.2 ATOMS: Es un cojín de silicona unido a 2 brazos de malla de polipropileno monofilamento que se colocan en forma transobturatriz. El cojín se ubica en la región ventral de la uretra bulbar media-proximal, sobre el músculo bulboesponjoso, el que se conserva intacto como una capa protectora adicional. (Video 2, Fig. 20). El implante está preconectado por un tubo a un puerto de titanio recubierto de silicona, que se coloca en el escrotoLJH, y esto permite el ajuste postoperatorio.

| Figura 20. Posición final de sling ajustable ATOMS en cara ventral de uretra bulbar media. |
Actualmente, es el sling ajustable con mayor evidencia publicada. Friedl et al, describe un seguimiento de 31 meses. La tasa de “secos” fue del 64% y la tasa de mejoría (secos o mejorados) fue del 90% 56. En otro estudio, tras un seguimiento medio de 16.9 meses 53,56, hubo una tasa de éxito general de 84% y 60.5% de casos definido como seco (0–1 almohadilla y menos de 15 ml/prueba de 24 horas).
En un estudio multicéntrico canadiense con 160 pacientes operados y un seguimiento de 9 meses, la tasa de continencia global fue de 80% y de mejoría de 87%. Hubo un 4% de complicaciones Clavien III y, al igual que en todos los dispositivos anti-IOE, hubo peor respuesta en pacientes con radioterapia.16 Esquinas et al realizaron una revisión sistemática y metaanálisis de 1.393 pacientes y encontraron un 67% de “secos” y un 90% de mejoría (secos o mejorados) al término de los ajustes, con un seguimiento promedio de 20.9 meses. Hubo un 16.4% de complicaciones en total, siendo de grado mayor en un 3%. Se reporta cierto grado de disestesia perineales (35.6%). La tasa de remoción del dispositivo fue de 5.8% 73. Se han notado peores resultados en aquellos pacientes irradiados, con procedimientos de rescate, incontinencia severa o urocultivos positivos. La evidencia más actual indica que la tasa de “secos” disminuye de un 76% a un 59% en pacientes sin y con radioterapia, respectivamente, aunque la tasa de “mejorados” no se modifica significativamente (92 vs 89%) 74.
c.3 Remeex: Consiste en una cinta colocada sobre la uretra bulbar conectada con monofilamentos a un Regulador suprapúbico subcutáneo. Tiene una tasa de éxito (definición de éxito: 1 pad por día) de 64.7%. Las complicaciones incluyen daño de vejiga (11%), remoción por infección o erosión uretral (6-12%) y dolor perineal 52.
D. Sistemas de globos compresivos. El sistema ProACT es un dispositivo de compresión no circunferencial que consiste en dos globos que se colocan bilateralmente en el cuello de la vejiga. Su ventaja principal es que se implanta de manera mínimamente invasiva, bajo fluoroscopía o ecografía. Las tasas de éxito varían entre 60% (definición de éxito: sin almohadilla o una almohadilla de seguridad) y 67%, mientras que otros artículos mencionan que menos del 5% de los pacientes estaban secos y el 45% seguían satisfechos con un seguimiento de 57 meses. Sus complicaciones más comunes son la perforación vesical o uretral (5.3%, infección (2.2%) y retención urinaria (1.5%).75
E. Agentes de abultamiento uretral. La eficacia es baja y la cura es rara. Solo se recomienda para pacientes con IOE leve a moderada que requieran alivio temporal de los síntomas.
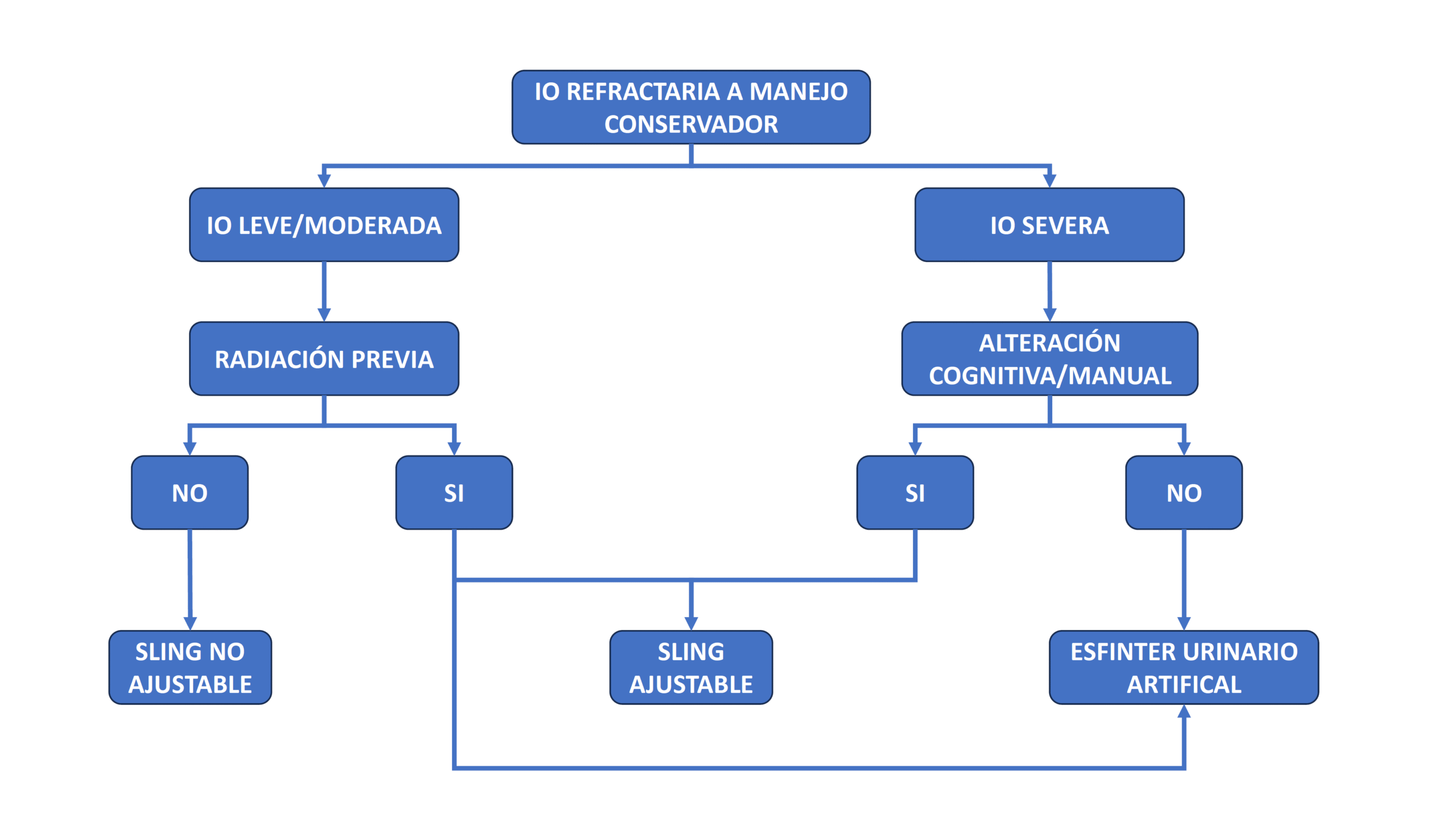
| Flujograma para Manejo Quiúrgico de IOE Masculina. (Basado en Kretschmer et al, 2016)57 |
SECCIÓN III: PATOLOGÍA URETRAL Y PERIURETRAL FEMENINA.
INTRODUCCIÓN
La patología uretral femenina es muchas veces menospreciada o subdiagnosticada.
Los síntomas del tracto urinario inferior en mujeres responden a múltiples causas, principalmente irritativas u obstructivas.
A la vez, los mismos síntomas suelen presentarse tanto en patología obstructiva, patologías inflamatorias, así como en incontinencia urinaria, tanto de orígen anatómico como funcional. Lo que refuerza que el índice de sospecha debe ser alto y la evaluación completa para ofrecer apoyo y solución a las pacientes que consultan.
Este capítulo se enfocará en la patología uretral femenina obstructiva, de origen anatómico, así como en las lesiones periuretrales La incontinencia de orina femenina será abordada en otro capítulo.
ANATOMÍA
La uretra femenina es un conducto fibromuscular corto y delgado, de aproximadamente 4 cm de longitud, que se extiende desde el cuello vesical hasta el vestíbulo vaginal. Su estructura está compuesta por capas musculares longitudinales, tanto internas como externas, las cuales disminuyen su prominencia en la porción distal, finalizando en un anillo de colágeno con limitada capacidad de distensión 76.
La uretra femenina experimenta cambios a lo largo de la vida que son en gran medida dependientes de los niveles de estrógenos. Durante la infancia y la posmenopausia, cuando los niveles de estrógenos son bajos, la mucosa uretral se vuelve más delgada, menos vascularizada y con menor contenido de glucógeno, lo que favorece la atrofia y la susceptibilidad a infecciones, entre otras. En cambio, durante la etapa reproductiva, el aporte de estrógenos mantiene una mucosa más engrosada, elástica y bien vascularizada, contribuyendo a la continencia y protección de la vía urinaria inferior frente a otras noxas.
Estructura histológica y capas anatómicas: el revestimiento interno de la uretra experimenta una transición gradual desde un urotelio de células transicionales en su porción proximal, hacia un epitelio escamoso estratificado no queratinizado en la parte distal, donde también se observa un incremento en la cantidad de glándulas uretrales. Debajo de este epitelio, se encuentra una submucosa gruesa y ricamente vascularizada. Esta capa, estrógeno dependiente, contribuye al soporte estructural y a la función miccional.
Relaciones anatómicas y soporte: el soporte anatómico de la uretra, así como de los órganos pélvicos en general, se basa en músculos y ligamentos que transmiten el peso hacia la pelvis ósea (Figura 21A).
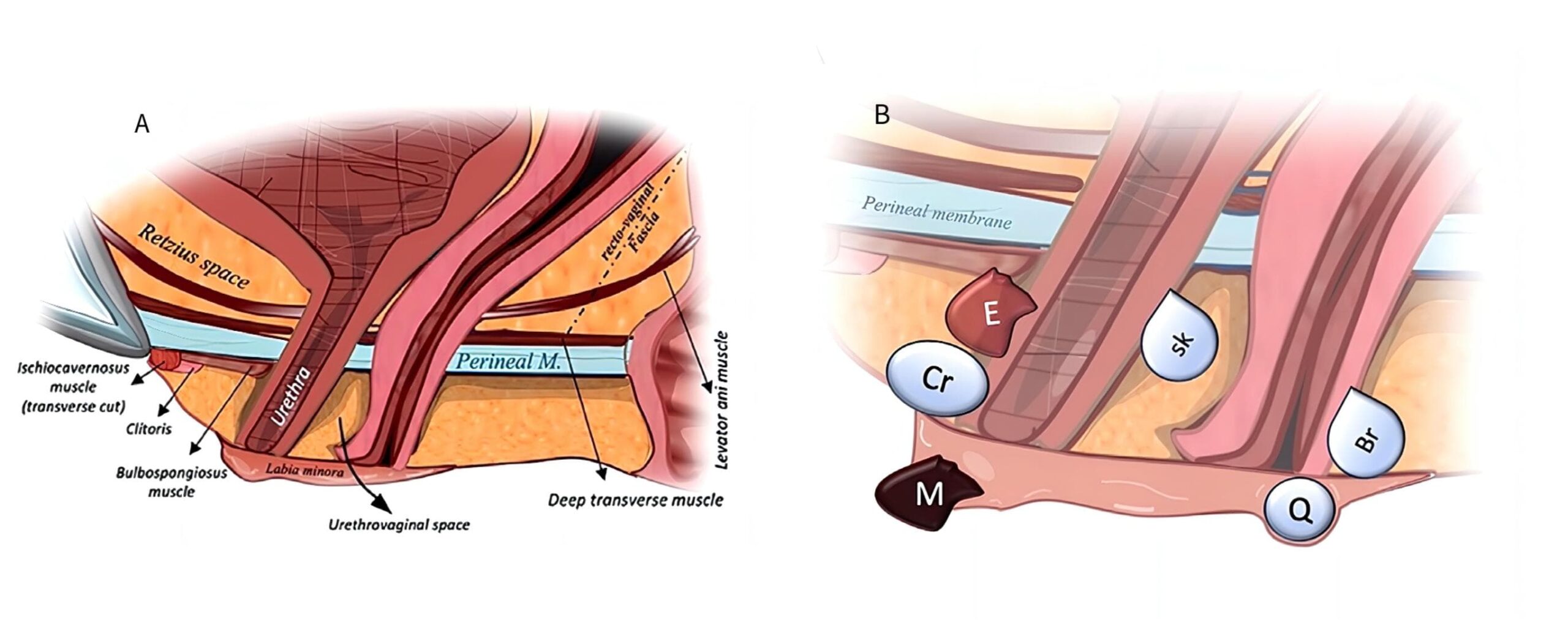
| Figura 21. A Esquema anatómico sagital de la uretra femenina y sus estructuras vecinas. B esquema de algunas lesiones parauretrales y paravaginales que se presentan por debajo de la membrana perineal: M melanoma, Cr carúncula, E carcinoma escamoso, Sk quiste de la glándula de Skene, Q quiste epidérmico y Br quiste de la glándula de Bartolino. Reproducido con autorización de los autores |
.
a. Soporte muscular: En su trayecto, la uretra femenina cruza por detrás de la sínfisis púbica, atravesando el diafragma pélvico formado por el músculo elevador del ano y la membrana perineal formada por el músculo transverso profundo y sus aponeurosis superficial y profunda. Próxima al vestíbulo vaginal, el esfínter uretrovaginal interactúa con el músculo bulboesponjoso, contribuyendo al cierre del hiato urogenital.
b. Soporte ligamentoso: forma parte del sistema de soporte pélvico o fascia endopélvica. Este sistema presenta zonas más gruesas y fibrosas que llamamos ligamentos, como por ejemplo el ligamento cardinal que sujeta el cuello del útero, y zonas más delgadas que llamamos fascias como por ejemplo la fascia vesicovaginal o pubocervical, que da soporte y separa a la uretra y a la vejiga por anterior de la vagina por posterior. Los principales ligamentos que sostienen la uretra son:
b.1 Ligamentos pubouretrales: emergen del tejido conectivo periuretral y se insertan hacia ventral en la línea blanca de la fascia pélvica parietal cerca de la sínfisis del pubis. (Nota clínica: las cintas suburetrales retropúbicas se pueden considerar un neo ligamento pubouretral).
b.2 Ligamentos uretro pélvicos: su existencia como estructura aislada es controversial. Funcionalmente llamamos así a las estructuras conectivas que suspenden a la uretra en sus aspectos dorsal y lateral y la separan de la vagina.
Componentes musculares estriados:
El esfínter uretral externo, con forma de herradura abierta hacia ventral, se sitúa en los dos tercios distales de la uretra y se encuentra firmemente anclado a la pared vaginal anterior; se considera funcionalmente parte del músculo elevador del ano. Justo por debajo, se localiza el músculo compresor uretral, un conjunto de fibras musculares que rodean la uretra esfinteriana y se origina en las ramas isquiopubianas de forma bilateral, parte funcional del músculo transverso profundo.
OBSTRUCCIÓN DEL TRACTO DE SALIDA FEMENINO
La ICS define obstrucción del tracto de salida como “obstrucción durante la micción, caracterizada por un aumento de la presión del detrusor y una reducción del flujo urinario”77. Responde a una de las causas de disfunción miccional y debe diferenciarse de las causas no obstructivas y del vaciado disfuncional.
La obstrucción en la salida de la vejiga corresponde entre el 8.3 y el 29% 78 de las pacientes con síntomas de la vía urinaria inferior. Esta variabilidad se debe a la falta de estandarización y múltiples definiciones para los mismos síntomas en las distintas series. Además, la prevalencia varía según la edad, paridad, presencia de prolapso y cirugía de incontinencia previa, entre otras.
La literatura reporta que pasan aproximadamente cinco años entre el inicio de los síntomas y el diagnóstico definitivo de obstrucción anatómica de la uretra. Por lo tanto es fundamental mantener un alto índice de sospecha.
| FUNCIONAL | ANATÓMICA |
| Obstrucción primaria del cuello vesical | Estrechez de uretra* |
| Vaciado disfuncional | Divertículo uretral * |
| Retención urinaria idiopática (Síndrome de Fowler´s) | Prolapso de órganos pélvicos |
| Aumento del tono del esfínter o músculos del piso pélvico | Sobrecorrección por malla suburetral |
| Carúncula uretral | |
| Malignidad uretral | |
| Masa parauretral | |
| Tabla 6. Causas principales de obstrucción del tracto de salida femenino (Extraída de la guía europea de STUI femeninos no neurogénicos ). | |
Anamnesis: debe incluir los antecedentes médicos y quirúrgicos, sobre todo de patologías del piso pélvico, los hábitos sexuales y urinarios y la historia de malignidad o radiación.
Tradicionalmente se describe una tríada para sospechar divertículo periuretral (3D): disuria, dispareunia y goteo postmiccional 79. Sin embargo, el síntoma más prevalente es la incontinencia de orina.
La estenosis de uretra presenta una amplia variedad de síntomas que van desde el disconfort agudo a síntomas de llenado o vaciado. Es importante mantener un alto índice de sospecha en mujeres que consultan por síntomas irritativos del tracto urinario inferior.
Examen físico general: Los hallazgos del examen físico podrían contribuir a la sospecha diagnóstica y a la planificación posterior. Se requiere realizar un examen genital cuidadoso.
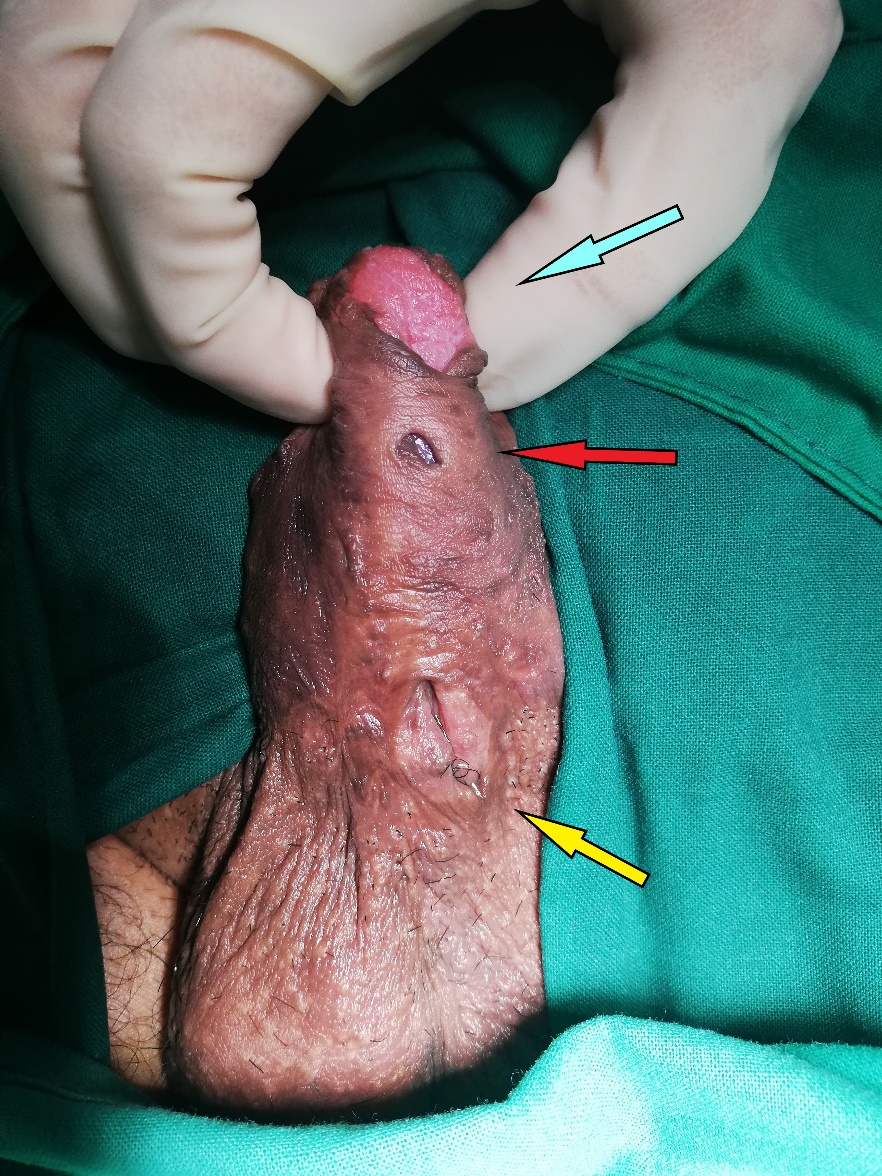
En los casos de estenosis es importante revisar la calidad del tejido urogenital, observar las características del meato y buscar dirigidamente la presencia de liquen escleroso
En el caso de lesiones periuretrales debemos describir la lesión: tamaño, consistencia, ubicación en relación al eje de la uretra (describir la hora utilizando la referencia de las manecillas de un reloj) y nivel de la uretra en la que se encuentra. Las lesiones que aparecen por sobre el diafragma urogenital tienen características diferentes a aquellas que aparecen por debajo de esta estructura, como se describe en la figura 21B.
Laboratorio e imágenes:
-
- Uroflujometría (UFM) y residuo postmiccional: Hay evidencia que sugiere una fuerte correlación entre una UFM anormal y una obstrucción confirmada a la urodinamia 80. Esto permite una adecuada aproximación inicial hacia una disfunción de vaciado y/u obstrucción.
Si bien no existen valores de corte estandarizados en mujeres, sugieren obstrucción:
-
-
- Flujo máximo (Q max) menor a 15 ml/s.
- Residuo post miccional mayor a 100ml.
- Uretrocistoscopia: Parte esencial del algoritmo diagnóstico en sospecha de obstrucción Si está disponible considerar el uso del cistoscopio pediátrico. Este estudio permite verificar la calidad del tejido; visualizar obstrucciones; proveer información de su orígen, ubicación y calibre; y permite diagnosticar cualquier comunicación anómala del tracto urinario.
-
Si la paciente ya tiene el diagnóstico de divertículo uretral o la sospecha es categórica se puede prescindir de este examen ya que es incómodo y con el diagnóstico ya consignado no cambiaría la conducta.
-
- Calibración uretral: En sospecha de estenosis, se recomienda intentar el paso de una sonda Nélaton bien lubricada 16 French, si hay resistencia o el pasaje es imposible se considera altamente sospechosa de estenosis. Es una buena forma de evaluar el tamaño uretral y el sitio de estenosis. Sin embargo, debe realizarse con mucho cuidado para evitar dilatar la misma. El diámetro uretral por sí solo no descarta necesariamente una estenosis.
- Estudio urodinámico: Es el estándar a la hora de evaluar obstrucción del tracto de salida en mujeres. Si bien la definición de obstrucción en hombres está bien establecida, en mujeres se mantiene controversial. Es un estudio útil ya que aporta distintos elementos:
Paciente obstruida: patrón de alta presión (> 25 cmH2O) y bajo flujo (<12 ml/s)
-
- Normograma de Blaivas y Groutz, si bien es el más usado puede sobreestimar obstrucción81.
- Normograma de Solomon-Greenwell 82 actualmente se considera el de mejor rendimiento para predecir obstrucción al tracto de salida (Sensibilidad: 90-94% – Especificidad: 91-93%), siendo el único validado para mujeres 83.
- Fórmula (BOOIf): PdetQmax – 2.2Qmax.
- BOOIf < 0: < 10% probabilidad de obstrucción.
- 5 < BOOIf < 18: equívoco, ≥ 50% probabilidad de obstrucción.
- BOOIf > 18: 90% probabilidad de obstrucción.
- Fórmula (BOOIf): PdetQmax – 2.2Qmax.
- Actualmente hay nuevos normogramas en proceso de validación que buscan ampliar el estudio e incluir el detrusor hipoactivo dentro de la ecuación.
Se puede mejorar el rendimiento del examen, agregando fluoroscopía y haciendo una Videourodinamia, lo que aporta información anatómica adicional como la función del cuello vesical y la localización de una posible obstrucción.
-
- Otros estudios fluoroscópicos: Para el diagnóstico de divertículo o comunicación, anómala en pacientes con sospecha de fístula vesicovaginal. Éstos estudios no son tan útiles en mujeres como hombres, porque es difícil de diferenciar la altura de la obstrucción (cuello, vesical, esfínter, uretral, piso pélvico o estenosis uretral perse). Las opciones incluyen la uretrografía retrógrada, la cistouretrografía de vaciado y la cistoscopia más UPR bilateral en sospecha de compromiso ureteral en fístula vesicovaginal.
- Electromiografía: Hay literatura que sugiere que podría ayudar a diferenciar entre una obstrucción funcional y una anatómica84 Sin embargo la evidencia es mínima y su utilidad en la clínica aún requiere más estudio.
- Ecotomografía: La utilidad del ultrasonido renal y pelviano en la patología obstructiva femenina radica en la búsqueda de complicaciones como hidronefrosis/hidroureteronefrosis y engrosamiento de la pared vesical. La ecografía de piso pélvico puede ser de utilidad en el estudio de lesiones periuretrales. Dentro de la información que puede aportar encontramos el tamaño, el número, la ubicación la conformación (sacular, herradura, circunferencial, etc) y la o las comunicaciones con el lumen uretral.
- Resonancia magnética de pelvis: Si bien no es ampliamente reconocida como gold standard, su capacidad de proporcionar una evaluación detallada y no invasiva del piso pélvico la vuelve como la herramienta diagnóstica de referencia en el diagnóstico de patología periuretral. En el caso del estudio de lesiones periuretrales se puede realizar sin contraste endovenoso ni vaginal. Es importante tener también una visión sagital. Al igual que en estudio por ultrasonido, debemos visualizar si la lesión es única o múltiple, cuál es su tamaño y forma y si presenta comunicación con la uretra. Estos elementos son fundamentales para la planificación quirúrgica. Además, permite evaluar sospecha de malignidad y presencia de cálculos, abscesos, etc.
Manejo conservador general de la patología obstructiva uretral:
Considerar en pacientes que no son candidatas a plantear manejo definitivo o como un puente a este. El objetivo del manejo es disminuir el RPM, evitar sobredistensión vesical y evitar daño en vía urinaria superior.
- Cateterismo urinario (CIL o CUP): Se puede utilizar a permanencia, o bien como complemento al manejo quirúrgico conservador de la estrechez de uretra (dilatación, uretrotomía interna o incisión del cuello vesical) 85
- Catéter uretral clampleable: Son sondas de silicona más cortas con un mecanismo de válvula que se coloca en la uretra femenina, de forma tal de que al activar la válvula la paciente se mantiene continente. El gran problema de estos dispositivos es la mala tolerancia (20% de las pacientes mantienen el catéter), sin embargo en aquellas que lo toleran tienen mejor calidad de vida. De los efectos adversos reportados se encuentra la migración del dispositivo a vejiga e ITU. Sin evidencia a largo plazo. 86
Estenosis uretral
- Definición: El diagnóstico de la estenosis uretral femenina es controversial, ya que carece de consenso y su diagnóstico debe ser multimodal. Dentro de las definiciones encontramos las siguientes, en general observaciones utilizadas por algunos autores:
- Lumen de uretra angosto que no permite pasar cistoscopio flexible 17 Fr. Sin embargo, gran parte de los estudios femeninos están hechos con diámetros de corte en 20fr.
- Lumen en el que se sienta tejido cicatrizal87.
- Estrechez de la uretra cuyo lumen no permite la instrumentalización sin lesionar el revestimiento de la mucosa uretral.
- Estrechez anatómica sintomática de la uretra que genera una dificultad para el sondeo y cuyo diagnóstico se basa en la calibración uretral, en la inspección visual o endoscópica, o en la radioscopía 88
- Etiologías: egún patología responden a lo siguiente:
- Idiopática (51.3%)
- Iatrogénica (32.8%): antecedente de cirugía o instrumentalización de la vía urinaria
- Inflamatoria (9.2%)
- Trauma (6.6%)
- Manejo con cirugía mínimamente invasiva:
- Dilatación uretral: Usualmente se dilata hasta 30-40 fr, sin existir una técnica estandarizada. En pacientes sin tratamiento previo reportan tasas de éxito de entre 43-47%, mientras que en aquellas con dilatación previa fue un 27,2%89. Por lo tanto, no se considera como una opción curativa ante la recurrencia de la estenosis. La gran complicación reportada es la incontinencia de orina de esfuerzos hasta en un 12%, sin embargo, es menor que en la uretrotomía o cirugía. El uso de balón medicado en las pacientes de sexo femenino aún es incierto, hay 2 casos reportados en la literatura, ambos con seguimiento a 6 meses el primero exitoso, el segundo con recurrencia90,91, por lo que falta evidencia para incluirlo en el arsenal.
- Uretrotomía interna (UI) bajo visión directa: No existe evidencia sólida en mujeres: las sugerencias vienen derivadas de los estudios masculinos. En este grupo, el seguimiento a largo plazo reporta mejoría en RPM y QoL. En caso de elegirse esta alternativa debe considerarse realizar la intervención seguida de un protocolo de dilataciones sucesivas. Lo anterior es porque se ha visto podría disminuir las tasas de recurrencia al compararlo con la UI sola (78.5% vs 55.4%) 91,92, 93
- Manejo quirúrgico
- Uretroplastia de aumento usando injertos o colgajos (más frecuente): Se puede utilizar tejido genital, habitualmente mucosa vaginal o tejido extragenital, habitualmente mucosa oral (figura 22). Se debe considerar la calidad del tejido genital así como el posible impacto en la función sexual. En pacientes con historia de liquen escleroso o radioterapia en la zona pélvica, no se recomienda injerto de mucosa vaginal. Las posibles zonas para obtener el injerto son: mucosa oral (yugal o sublingual), mucosa genital (vagina o vulva, considerar preparación con estrógenos) y como opciones menos habituales vejiga y bio-injertos entre otros.
- Excisión y anastomosis primaria Descrita en escasos reportes de casos. Podría considerarse en estenosis debida a fractura de pelvis mientras sea corta y se encuentre en uretra proximal o media. Hay reportes de cirugía laparoscópica asistida por robot en ubicaciones proximales.94
- Meatoplastía: En casos de estenosis de uretra distal aislada.

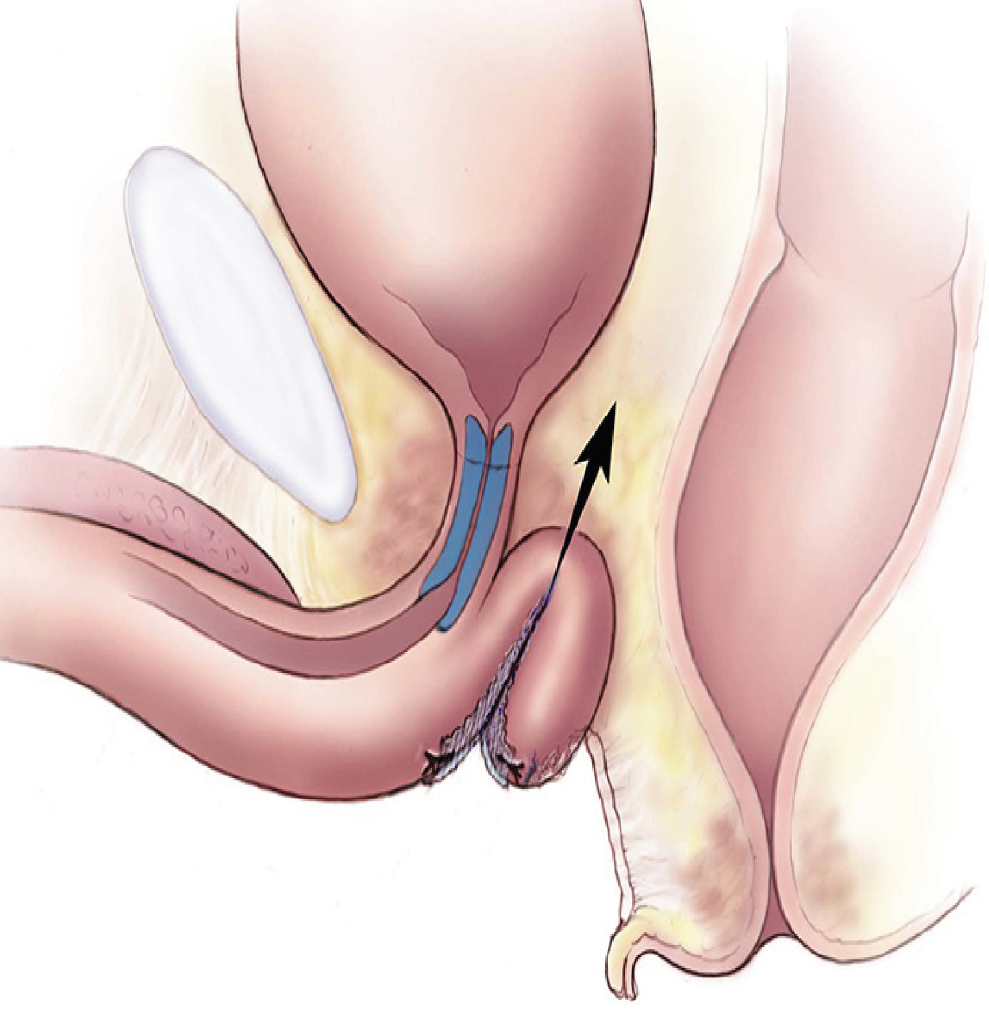
Figura 22: Esquema de técnica quirúrgica de uretroplastía dorsal con injerto para reparación de estenosis de uretra.
Resultados de la uretroplastia. Los objetivos del tratamiento quirúrgico son recuperar la función, orinar sin obstrucción mantener la continencia y preserver la función sexual.Las tasas de éxito varían entre un 85-95% dependiendo del tipo de injerto/colgajo. Sin diferencias entre técnicas.
Respecto a las complicaciones, la incontinencia de orina de novo aparece en 0.4-4.4% de los casos y las infecciones del tracto urinario en el 18%.
Abordajes en la uretroplastia. Los enfoques se describen de acuerdo a la posición relativa a la uretra:
- Abordaje dorsal o suprameatal: Considera una incisión en U invertida y disección de la cara dorsal de la uretra hasta el cuello vesical. Se considera que proporciona mejor soporte mecánico y un lecho más vascularizado para el injerto o colgajo. Presenta mayor riesgo de daño a los cuerpos cavernosos del clítoris.
- Abordaje ventral o inframeatal: Puede ser más familiar para la mayoría de los cirujanos y requiere menos movilización uretral. Sin embargo, se ha informado una mayor propensión a fístulas uretro-vaginales, aunque su frecuencia no está claramente definida.
- Abordaje circunferencial: Está menos documentado. Estaría indicado para reconstrucción completa del lumen.
DIVERTÍCULO URETRAL
Definición: Estructura quística, periuretral que contiene orina. Está confinada a la fascia pélvica, adyacente de la uretra y la conecta mediante un ostium, que puede ser uno o más de uno. El divertículo puede ser una lesión única o múltiple, de tamaño variable y configuración diversa (circular, en herradura o envolver todo el perímetro de la uretra).
Etiología: La etiología más aceptada corresponde a la inflamación crónica de las glándulas periuretrales con obstrucción de los ductos. En sus fases más avanzadas presentan abscedación y formación de cálculos.
Manejo:
El tratamiento recomendado es la excisión quirúrgica. El riesgo de neoplasia, así como la falta de elementos imagenológicos que hagan sospechar su presencia, inclinan la balanza hacia su resección quirúrgica más que a la observación. En situaciones como embarazo, se recomienda observación y cirugía diferida.
Las posibilidades quirúrgicas se pueden clasificar en excisión y opciones mínimamente invasivas, siendo la primera el gold estándar.
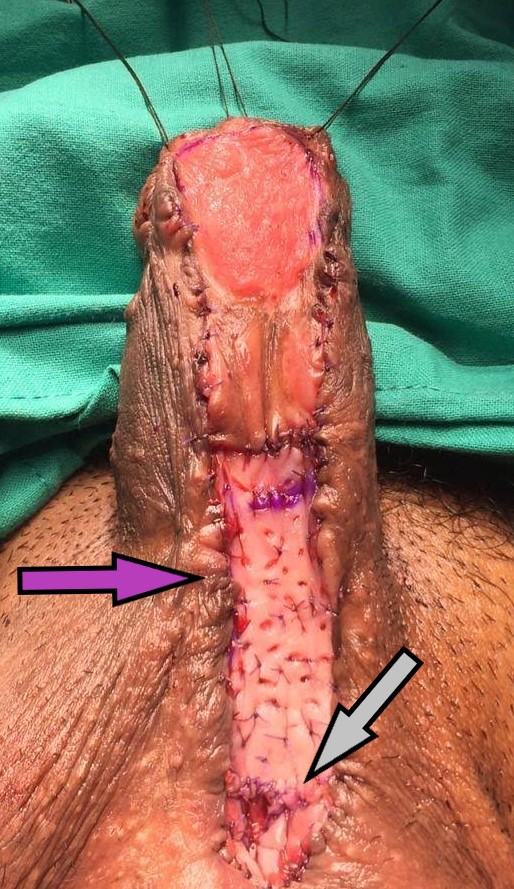
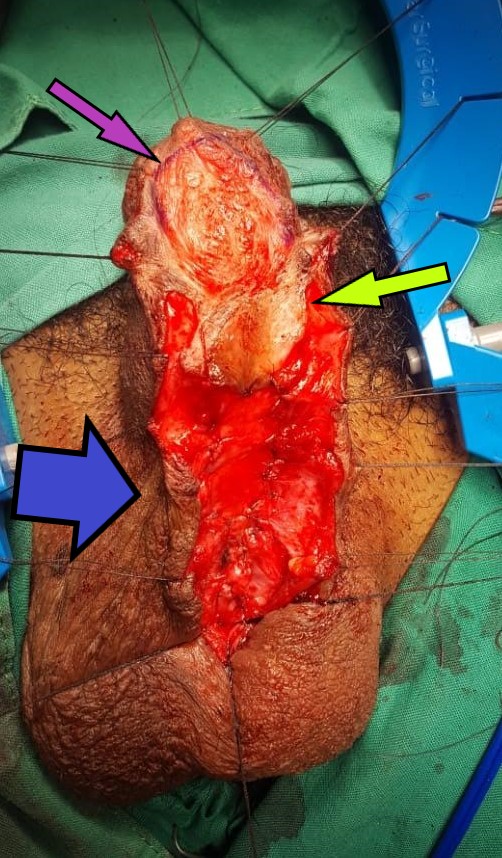
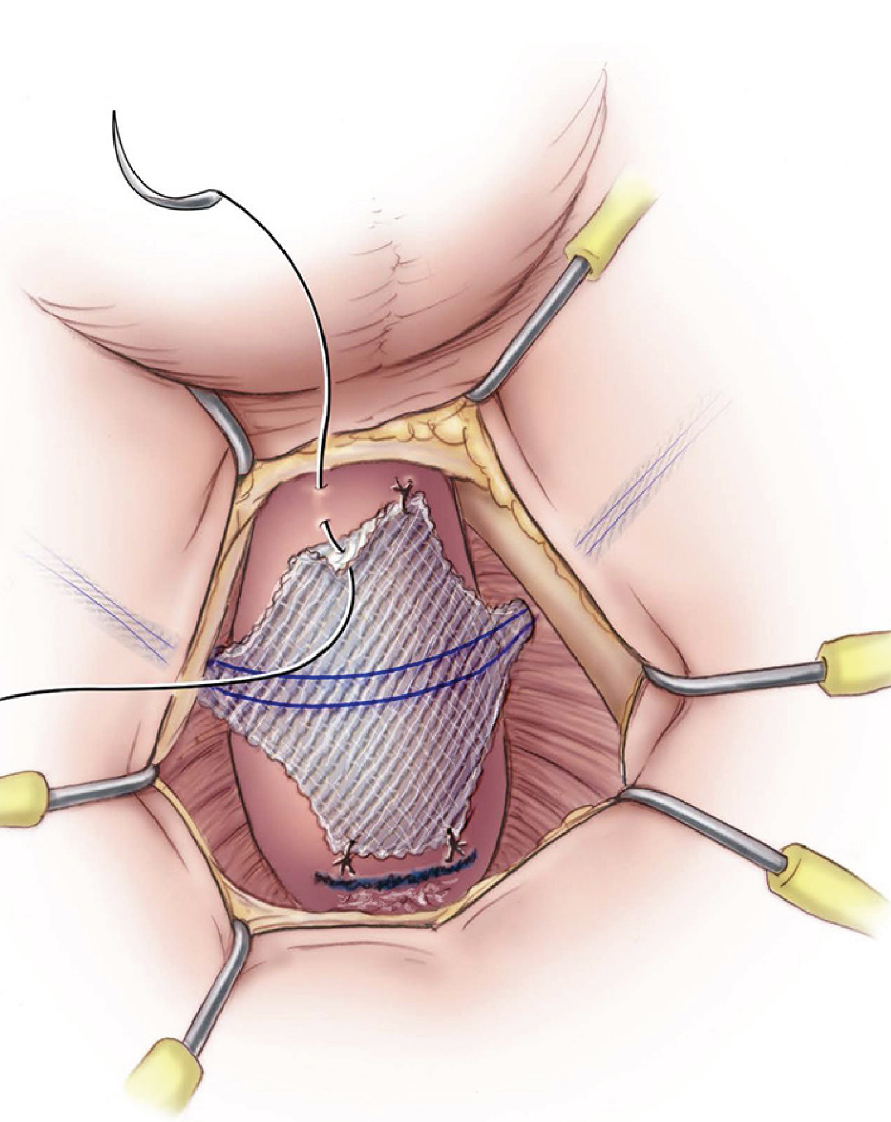
- Excisión y reparación del ostium (Figura 23): Por abordaje vaginal, ya sea una incisión lineal sobre la lesión o en U invertida, se identifica y diseca el divertículo y su ostium. Se resecan las paredes del divertículo que se envía a anatomía patológica y se cierra el ostium con material reabsorbible delgado. Se recomienda un segundo plano no superpuesto de refuerzo a nivel de la fascia vaginal y luego el cierre de la vagina. En caso de requerir irrigación adicional, se recomienda el uso en este momento de un colgajo local como la grasa del labio mayor o flap de Martius.
- Opciones mínimamente invasivas: presentan mayores tasas de recurrencia y son: la coagulación endoscópica, la marsupialización, la fulguración y la incisión simple o drenaje.
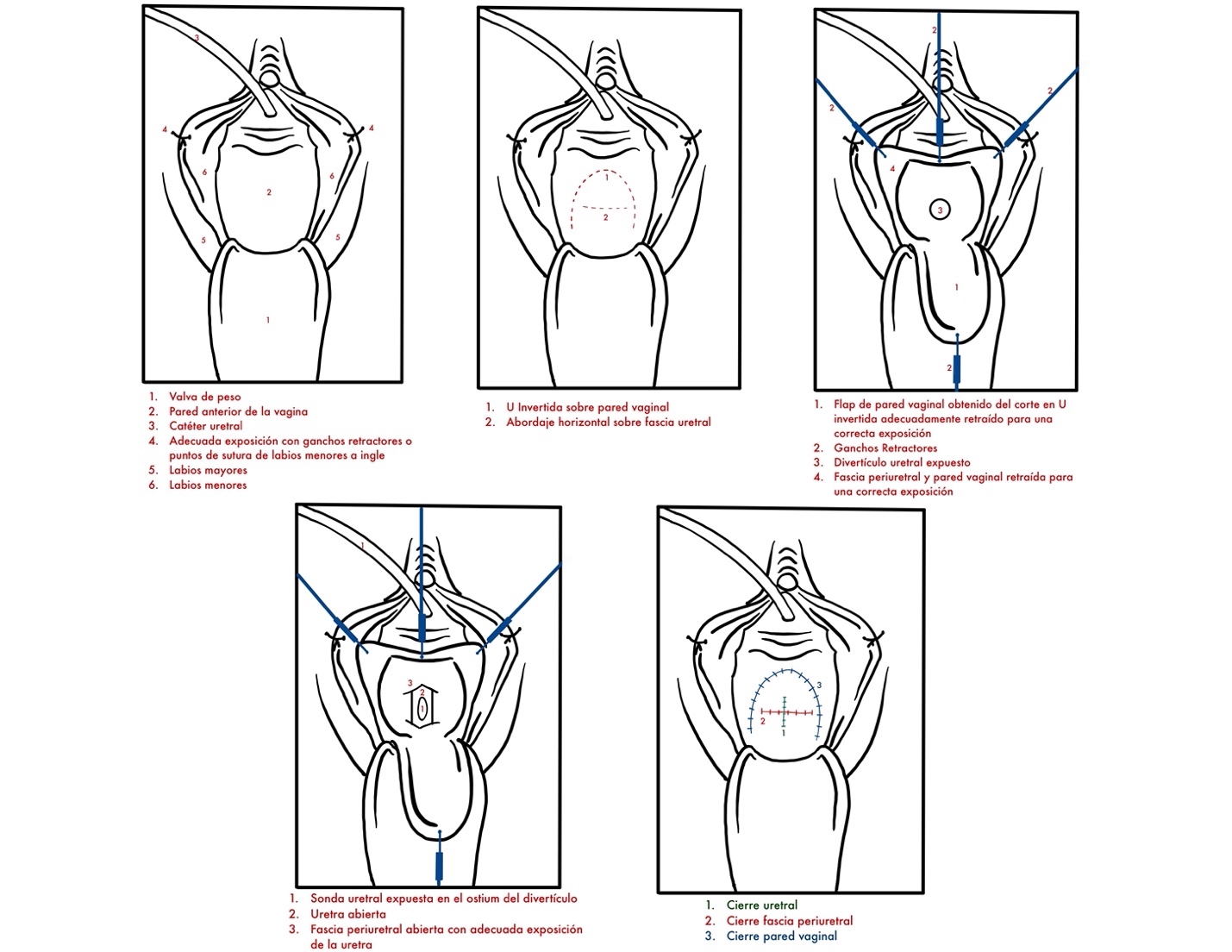
Figura 23: Esquema de técnica quirúrgica de diverticulectomía uretral (Excisìón del divertículo y reparación del ostium).
Respecto a la incontinencia, una buena sutura del defecto con adecuada reconstrucción de la fascia debería bastar para mantener a la paciente seca. En caso de decidir realizar un procedimiento anti-incontinencia de forma simultánea, tanto la suspensión del cuello vesical como el sling autólogo han demostrado ser seguras y exitosas.
Pronóstico: Los resultados varían en relación a la extensión del divertículo y de su complejidad anatómica.
- Divertículos simples: 95 – 100%.
- Divertículos con forma de herradura o U: 75%.
- Divertículo Circunferencial: 64%.
Dentro de las complicaciones se encuentran la recurrencia del divertículo y la aparición de incontinencia de orina de esfuerzo.
El estudio histopatológico puede describir metaplasia escamosa en un 31% de los casos. El hallazgo de malignidad aparece en un 6,5 a 10% y la mayoría corresponde a adenocarcinoma.
OTRAS PATOLOGÍAS
Prolapso de órganos pélvicos:
Corresponde al descenso de algún órgano de la pelvis a través del canal vaginal. El órgano más frecuentemente involucrado es la vejiga, seguido por el útero y el recto. Pueden causar obstrucción urinaria por acodamiento de la vía urinaria, por oclusión extínseca por el bulto o por un mecanismo combinado. Es una patología de muy elevada prevalencia.
Manejo conservador con Pesario vaginal. Corresponden a dispositivos de silicona que se insertan en la vagina y que buscan aliviar los síntomas y mejorar el vaciamiento vesical mediante la corrección de la obstrucción causada por el prolapso. Presenta tasa de respuesta del 94% para el manejo de obstrucción del tracto de salida en pacientes con prolapso del compartimiento anterior. Sin evidencia disponible a largo plazo.
Manejo quirúrgico. Alivia la obstrucción mediante 2 mecanismos 95. Primero corrige el angulamiento uretral provocado por el prolapso, además de aliviar la compresión uretral extrínseca. Existe abundante evidencia que sustenta la mejoría clínica y de parámetros urodinámicos en mujeres en las que se resuelve quirúrgicamente el prolapso. Los abordajes son múltiples, vaginal, abdominal abierto, laparoscópico o robótico y la elección depende de las características de la paciente (función sexual, deseo de fertilidad, patologías concomitantes, etc.) del prolapso (uno más órganos involucrados y descanso de qué magnitud) así como las preferencias del equipo quirúrgico.
Obstrucción urinaria post cirugía de incontinencia:
La obstrucción por sobrecorrección en cirugía de cinta suburetral es una complicación que oscila entre el 3 y el 9% de las mujeres operadas. Las manifestaciones pueden presentarse inmediatamente post operación o tan alejado como 3 a 5 años y abarcan síntomas de la fase de llenado (urgencia y aumento de la frecuencia) de la fase miccional (chorro débil o entrecortado, necesidad de adquirir posturas especiales para poder de orinar, sensación de vaciado incompleto) e infección urinaria recurrente/persistente.
Manejo quirúrgico con uretrolisis. El objetivo es restaurar la movilidad uretral en pacientes con obstrucción del tracto urinario secundario a cirugía de incontinencia urinaria de esfuerzo, generalmente aquellas realizadas por vía suprapúbica como colposuspensión de Burch. El procedimiento contempla la remoción de las suturas periuretrales, tejido cicatrizal y fibrosis96. La evidencia se remonta a series de casos, que reportan mejoría en vaciamiento con disminución del RPM, mejoría en síntomas, QoL y parámetros urodinámicos. Complicaciones: Incontinencia de orina de novo (39%)97.
Manejo quirúrgico con revisión de la cinta suburetral. Las alternativas incluyen la liberación, sección, remoción parcial o completa del sling. La evidencia basada en series y revisiones retrospectivas reportan adecuadas tasas de éxito (hasta 85%), sin diferencias entre las técnicas; con reducción de los síntomas, mejoría del RPM y parámetros urodinámicos. Las tasas de éxito son más elevadas en procedimientos precoces en comparación con aquellos diferidos; mallas obstructivas que llevan más de ocho años tienen respuestas significativamente más bajas.
Otras Lesiones parauretrales:
La figura 24 muestra un diagrama esquemático que resume la distribución anatómica de las lesiones parauretrales y paravaginales para facilitar el diagnóstico diferencial mediante la localización anatómica, especialmente en relación con la membrana perineal. Estas corresponden a lesiones quísticas, neoplásicas y diversas que afectan a la uretra y la pared vaginal.

Figura 24: Distribución anatómica de las lesiones parauretrales y paravaginales según localización anatómica en relación con la membrana perineal (PM, estrella). Br, quiste de la glándula de Bartholino; Cr, carúncula; Ct, carcinoma de células transicionales; Dv, divertículos uretrales; E, carcinoma de células escamosas; G, quiste del conducto de Gartner; Lm, leiomioma; M, melanoma; PM, membrana perineal; Q, quiste de inclusión epidérmica; Sk, quiste de la glándula de Skene.Reproducido con autorización de los autores.
MANEJO PERIOPERATORIO EN CIRUGÍA RECONSTRUCTIVA URETRAL FEMENINA
Tomar un urocultivo preoperatorio: no hay consenso, sin embargo, en muchos centros se exige un urocultivo negativo antes de una cirugía uretral.
En caso de estenosis, las pacientes deben permanecer libres de dilataciones al menos 3 meses antes de la cirugía.
Valorar la necesidad de cistostomía temporal. Esto como complemento del catéter uretral.
En mujeres posmenopáusicas se recomienda el uso de estrógenos vaginales.
Manejo de expectativas: en la conversación pre quirúrgica tiene que quedar claro que pueden surgir nuevos problemas como la aparición de una neoplasia, aparición de incontinencia de novo o empeoramiento de una incontinencia previa.
CUIDADOS POSTOPERATORIOS
La cirugía de uretra femenina se puede realizar en régimen de hospitalización o régimen ambulatorio en pacientes sin factores de riesgo. Considerar que puede haber incontinencia de orina de esfuerzo leve en el postoperatorio inicial posterior al retiro del catéter, que habitualmente se resuelve de forma espontánea.
Si se realiza un flap de Martius considerar dejar drenaje a la incisión vulvar por uno a dos días y o vendaje compresivo para evitar hematomas. Si bien no hay evidencia, muchos centros recomiendan dejar packing vaginal por 24 horas. Se recomienda el uso de anticolinérgicos para prevenir espasmos vesicales.
SECCIÓN IV: FÍSTULA VÉSICO VAGINAL
DEFINICIÓN Y EPIDEMIOLOGÍA
La fístula vesicovaginal (FVV) corresponde a una comunicación anómala entre la vejiga y la vagina, que puede estar formada por tejido fibroso o epitelial y que se manifiesta a través de escape involuntario permanente de orina98.
La etiología y prevalencia de las FVV varía según la población estudiada. En países desarrollados es poco frecuente y se asocia principalmente a cirugías ginecológicas o digestivas, a cáncer de la pelvis y/o radioterapia. En los países en vías de desarrollo la etiología es principalmente obstétrica y su incidencia está poco establecida; solamente en África se presentan entre 30.000 y 130.000 nuevos casos por año 99. A la fecha, no existen publicaciones que describan la realidad epidemiológica en Chile.
Las FVV se presentan como complicación postoperatoria entre el 0.5 y el 2% de las histerectomías y los mecanismos serían la lesión vesical no detectada de forma intraoperatoria o el compromiso de la pared vesical en suturas o clips98. Otras posibles causas de FVV se enumeran en la Tabla 7.
Existen múltiples clasificaciones para las FVV. El clasificarlas según criterios de severidad permitiría recomendar un determinado abordaje, así como estimar un mayor o menor riesgo de recidiva100. Estos criterios se presentan en la Tabla 8.
| Más Frecuentes | Menos Frecuentes |
| Obstétricas | Traumatismo de la Pelvis |
| Histerectomía Abdominal | Cirugía de Incontinencia de orina o prolapso |
| Histerectomía Vaginal | Tumores pelvianos avanzados |
| Otras cirugías de la pelvis | Biopsia de vagina o vejiga |
| Congénitas | |
| Radioterapia | |
| Tabla 7. Posibles causas de FVV clasificadas según frecuencia | |
| Criterio | Simples | Intermedias | Complejas |
| Tamaño | Menor a 0,5cm | 0,5 a 2 cm | Mayor a 2cm |
| Ubicación en la vejiga | Cuerpo (cúpula) | Cuello o Trígono | |
| Número de trayectos fistulosos | Uno | Más de uno | |
| Intento de reparación previo | – | + | |
| Antecedente radioterapia de pelvis | – | + | |
| Tabla 8. Clasificación de las FVV según criterios de severidad | |||
PRESENTACIÓN CLÍNICA
El principal síntoma de la FVV corresponde al escape involuntario y permanente de orina a través de la vagina. En las fístulas post quirúrgicas, este síntoma se puede presentar en el post operatorio inmediato o al retirar la sonda Foley en los raros casos de lesión importante y simultánea de vagina y vejiga. En los casos en que se produjo una lesión pequeña e inadvertida de la vejiga o se comprometió su vitalidad con suturas, la incontinencia suele presentarse entre la segunda y la cuarta semana post operatoria. La cuantía del escape puede ser variable. En lesiones pequeñas puede corresponder a una proporción menor del volumen vesical y mantenerse un ciclo miccional similar a lo normal. En lesiones de mayor tamaño, suele haber escape de gran volumen de orina que puede incluso eliminar la necesidad de orinar. Es frecuente que las pacientes reporten que la magnitud del escape involuntario de orina varía según la posición (de pie, sentada o acostada). El diagnóstico diferencial de la incontinencia postoperatoria corresponde a fístulas uréterovaginales y fístulas uretrovaginales. El absceso de la cúpula vaginal post histerectomía se puede presentar con abundante flujo y confundirse con FVV.
Otros síntomas menos frecuentes corresponden a hematuria, fiebre y dolor abdominal. La hematuria suele presentarse en el postoperatorio precoz y habitualmente es de baja cuantía. La fiebre se puede observar de forma transitoria poco antes de que comience la incontinencia producto del proceso inflamatorio local y la colección localizada de orina que luego drena por la vagina. La fiebre persistente, el dolor abdominal y el íleo suelen asociarse a uroperitoneo.
EVALUACIÓN DIAGNÓSTICA
1. Examen físico. Éste debe realizarse en posición de litotomía, con buena iluminación e idealmente disponer de un espéculo, una lámina de un espéculo abierto o una valva vaginal. El escape de orina a través del orificio fistuloso suele ser evidente a menos que se trate de un trayecto muy pequeño. Se puede llenar la vejiga con 100 a 300 ml de azul de metileno diluido para evidenciar de mejor forma el escape; también se pueden usar fenazopiridina oral o fluoresceína endovenosa antes del examen físico para teñir la orina. Si aun así no se consigue objetivar la fístula, se puede ocupar la cavidad vaginal con un tampón vaginal, tres tórulas de algodón u otro material similar y solicitar a la paciente que deambule por un periodo de una a dos horas. Si al retirarlo y revisarlo existe azul de metileno en su zona apical o media, se considera un indicador de la presencia de FVV 100.
Durante el examen genital se debe establecer el tamaño del trayecto fistuloso a nivel vaginal, la posición en la vagina (una forma fácil de objetivar es midiendo con una regla en centímetros desde el introito o las carúnculas himeneales) así como la amplitud del introito y la distensibilidad de la vagina. Estos datos serán muy valiosos al momento de decidir el abordaje quirúrgico.
2. Exámenes complementarios. La cistoscopia cumple un rol fundamental en el estudio de toda paciente con FVV (Fig. 25). Los elementos a evaluar son: número de trayectos fistulosos, tamaño de el o los orificios a nivel vesical, ubicación del orificio y su relación con los meatos ureterales y el cuello vesical, presencia de cuerpo extraño como malla o material de sutura y características generales del tejido vesical que rodea la fístula. Si no se logra visualizar la FVV en la cistoscopía, la maniobra de avanzar una guía a través del ostium vaginal puede ser de utilidad. En caso de sospecha de fístula por tumor pelviano, se recomienda tomar biopsia fría.
| Figura 25. Hallazgo del ostium vesical de una FVV en la cistoscopía.
|
- Imágenes. El estudio contrastado de la vía urinaria superior permite reconocer una posible fístula ureterovaginal, que se presenta hasta en un 10% de las pacientes con FVV 98. La cistografía de llenado y la tomografía computada (TAC) permiten objetivar el diagnóstico al visualizar la extravasación de medio de contraste desde la vejiga a la vagina. Si se utiliza TAC, otros posibles hallazgos son aire o líquido en la vagina y burbujas de aire en la vejiga. También permite evaluar las condiciones de la vejiga para planear una resolución quirúrgica (Fig. 26). Cuando hay sospecha de compromiso tumoral y/o fístulas complejas, la resonancia de pelvis contrastada puede ser de gran ayuda en la planificación quirúrgica y anticipación de las posibles complicaciones.

| Figura 26. Aspecto de una fístula vesicovaginal al TAC con contraste de llenado por la sonda uretral (cisto TAC). Se observa claramente cómo contrasta la vagina. |
TRATAMIENTO
1. Tratamiento Conservador. La derivación urinaria a través de sonda uretral, asociada al uso de antimuscarínicos orales y, en algunas series, al uso de antibióticos orales, presentaría tasas de cierre espontáneo entre 6.9 y 15% a las 8 semanas. No obstante, esta alternativa sólo es aplicable en fístulas simples; menores a 5 mm, sin isquemia tisular y sin antecedentes de radioterapia o tumor pelviano.
2. Tratamiento quirúrgico. La reparación quirúrgica diferida en al menos en 3 meses desde su aparición es el tratamiento estándar de una FVV. Las ventajas de diferir la cirugía (delimitar la lesión y disminuir el proceso inflamatorio local) deben valorarse caso a caso en relación a sus desventajas (uso prolongado de sonda, colonización de la vía urinaria, incontinencia, dermatitis urémica, etc.). Las pacientes irradiadas, con intentos fallidos previos, con compromiso intestinal (fístula entérica concomitante) y/o con plastrón pelviano, deben operarse siempre de forma diferida. Es fundamental considerar el estado nutricional perioperatorio y evaluar la disponibilidad de tejidos vecinos para usos de colgajos, de ser necesarios.
El abordaje quirúrgico puede ser vaginal o abdominal (abierto, laparoscópico o robótico) 101. La decisión se debe tomar considerando las características de la fístula, la amplitud, trofismo y elasticidad de la vagina y la experiencia del cirujano. De esta forma, algunas fístulas complejas, múltiples o fallidas, así como las pacientes que requieran un neoimplante ureterovesical por cercanía o compromiso del meato ureteral y aquellas que requieran ampliación vesical concomitante o presenten estenosis vaginal, debieran ser abordadas por vía abdominal.
Los principios quirúrgicos comunes son98:
- Disección cuidadosa para exponer la fístula (con o sin resección del trayecto fistuloso).
- Cierre en 2 a 3 planos mediante suturas reabsorbibles sin tensión, tanto a nivel vesical como vaginal, idealmente en sentidos opuestos o perpendiculares.
- Eventual movilización de un colgajo para interponer entre ambos planos.
a. Reparación Vaginal. Aunque se ha descrito la colpocleisis parcial sin resección del trayecto fistuloso (técnica de Latzco), la técnica más utilizada es la resección de la fístula, o al menos del ostium vaginal. Después del posicionamiento en litotomía y la visualización de la fístula (Fig. 27), se realiza una resección del tejido vaginal incluyendo el trayecto fistuloso (Fig. 28). La vejiga se repara luego en dos planos invaginantes con material reabsorbible 3-0 o 4-0 (Fig. 29) y posteriormente la vagina se cierra en un tercer plano con un material similar, idealmente en sentido perpendicular a la sutura vesical. Se puede interponer un colgajo de grasa de labio mayor con la técnica de Martius si se considera necesario, por ejemplo, en fístulas complejas (Fig. 30).100

| Figura 27. Visualización del ostium vaginal de una FVV durante la cirugía. |

| Figura 28. Disección y resección del ostium vaginal de una FVV durante la cirugía. |

| Figura 29. Cierre de la vejiga en 2 planos. |

| Figura 30. Preparación de Flap de Martius desde labio mayor izquierdo. |
b. Reparación Abdominal. La técnica transvesical (de O’Connor) se basa en una cistotomía amplia desde el domo vesical hasta llegar a la fístula por posterior, con adecuada visualización y eventual cateterización de los uréteres (Fig. 31). Se debe realizar una cuidadosa disección del plano vesicovaginal (Fig. 32). Cierre de la pared vaginal con material reabsorbible 3-0 y luego cierre de la vejiga con similar sutura (Fig. 33). Se puede además movilizar un colgajo de peritoneo o epiplón que se interpone entre ambas suturas.
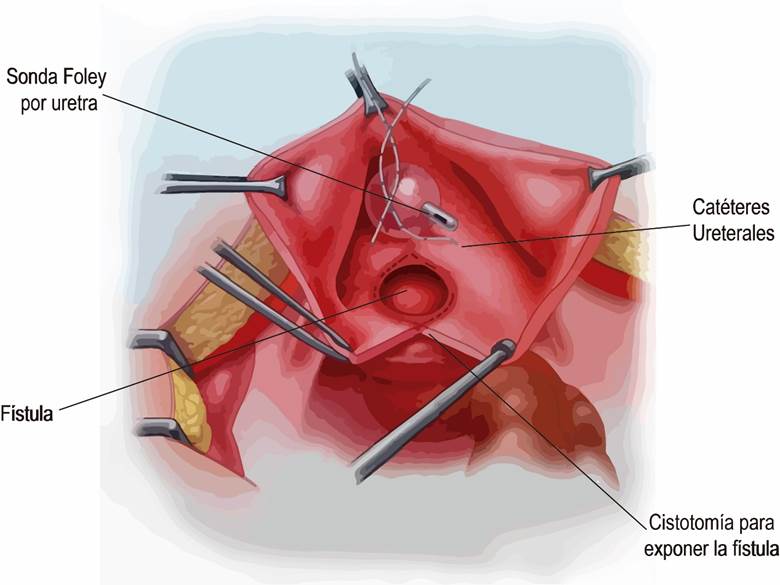
| Figura 31. Exposición transvesical de la vejiga y del ostium vesical de una FVV durante una cirugía por vía abdominal. |
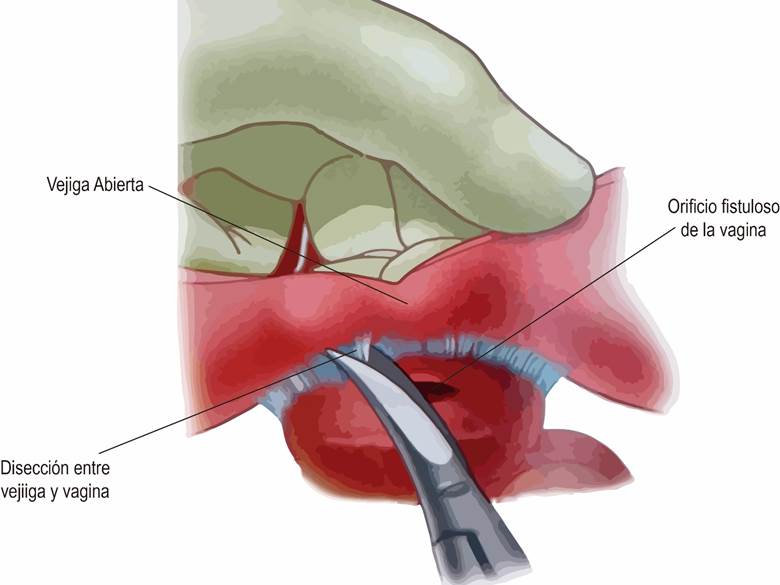
| Figura 32. Exposición y disección del trayecto fistuloso por la cara posterior de la vejiga durante el abordaje abdominal. |
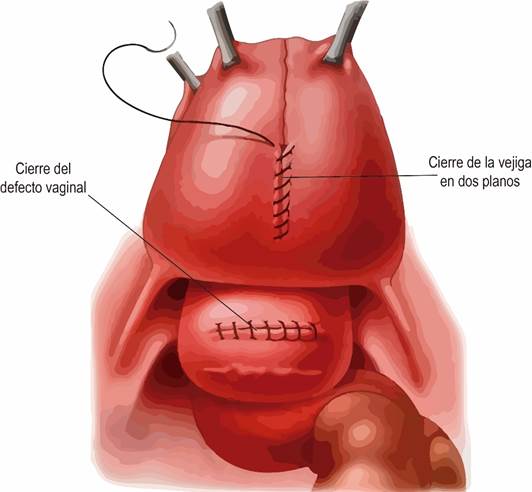
| Figura 33. Cierre de vejiga y vagina durante un abordaje abdominal. Posteriormente puede interponerse un colgajo de peritoneo o de omento. |
Las tasas de éxito para ambas técnicas oscilan entre el 75 y el 98%102 .
En el post operatorio inmediato se deja un tampón vaginal moderadamente compresivo con ungüento antibiótico por 24 horas, para evitar la formación de hematomas. Es mandatorio el uso de sonda vesical y/o cistostomía durante al menos 3 semanas. Es recomendable el uso de anticolinérgicos durante el período de sondeo, para evitar contracciones involuntarias, así como un período variable de antibióticos orales, usualmente hasta el retiro de la sonda. Algunos centros realizan siempre una cistografía de llenado por la sonda antes de retirarla y otros prefieren hacerla sólo en casos de sospecha de filtración. Es recomendable evitar la actividad sexual por al menos 6 semanas post cirugía.
SECCIÓN V: CIRUGÍA RECONSTRUCTIVA GENITAL MASCULINA
I.- GANGRENA DE FOURNIER
DEFINICIÓN Y EPIDEMIOLOGÍA
La gangrena de Fournier es una infección necrotizante de partes blandas que afecta principalmente los genitales y el periné. Su incidencia es baja, con una tasa de 1-2 casos por cada 100,000 habitantes, predominando significativamente en hombres (relación 50:1). Históricamente, su mortalidad se estimaba cercana al 50%, pero con los avances en el manejo contemporáneo, la letalidad ha disminuido a menos del 10%. 103
FISIOPATOLOGÍA
La gangrena de Fournier se desencadena por la disrupción de las barreras tisulares normales, permitiendo la entrada de bacterias al tejido subcutáneo. Las causas incluyen infecciones urinarias complicadas (estrechez uretral, abscesos periuretrales), heridas cutáneas (abscesos escrotales), patologías perirrectales, perforaciones de órganos huecos (diverticulitis) o úlceras por decúbito.
La mera presencia de bacterias en el subcutáneo no es suficiente para desarrollar la enfermedad. En la mayoría de los casos, esto genera solo un absceso o celulitis. Para que se produzca una gangrena de Fournier, el huésped debe presentar algún grado de inmunosupresión, como diabetes mellitus, infección por VIH, obesidad mórbida o uso crónico de corticoides, entre otros.
Una vez en el subcutáneo, las bacterias liberan toxinas que provocan trombosis microvascular, hipoxia localizada, proliferación anaeróbica y producción de gas, lo que incrementa el daño tisular. La pérdida del capital vascular impide la adecuada penetración de los antibióticos, haciendo fundamental el desbridamiento precoz.
PRESENTACIÓN CLÍNICA Y ESTUDIO DIAGNÓSTICO
El síntoma cardinal es el dolor desproporcionado en relación con los hallazgos del examen físico, atribuible a la isquemia tisular. El dolor puede preceder a los cambios cutáneos, como eritema, edema, crepitación subcutánea y necrosis (presente en menos del 70% de los casos). La fiebre y el compromiso sistémico son comunes.
La infección progresa rápidamente a través de los planos fasciales profundos, respetando la piel y los tejidos subcutáneos que pueden utilizarse para reconstrucción posterior. Las estructuras comúnmente comprometidas incluyen las fascias de Dartos, Colles, Scarpa y lata, mientras que las túnicas albugíneas y los testículos suelen permanecer indemnes.
Ante una sospecha clínica, el manejo debe ser inmediato. En casos dudosos, puede recurrirse a estudios de imágenes. La tomografía computada es de elección por su disponibilidad y rapidez; la resonancia magnética, aunque más sensible, es menos práctica en situaciones de urgencia.
Figura 34. Fournier escrotal con zona necrótica, flictenas, eritema y edema
SISTEMAS DE CLASIFICACIÓN
Se han propuesto distintos sistemas de clasificación para la gangrena de Fournier, con el fin de apoyar el diagnóstico, estratificar la severidad, guiar el tratamiento y definir el pronóstico. Ninguno se ha generalizado en la práctica. En términos generales podríamos dividirlos en 3 tipos.
1.- Sistemas de puntaje clínico-bioquímico:
A.- Fournier’s Gangrene Severity Index (FGSI): Herramienta pronóstica que combina signos vitales y parámetros de laboratorio; un puntaje >9 se asocia a mayor mortalidad. 104
B.- Laboratory Risk Indicator for Necrotizing Fasciitis (LRINEC): Diseñado para fascitis necrotizante; tiene un buen valor predictivo negativo para el diagnóstico (>90%), pero bajo valor predictivo positivo (~35%). 105
2.- Clasificaciones anatómicas: Basadas en la extensión de la infección o el compromiso de estructuras profundas, son útiles para la planificación quirúrgica, pero tienen escasa utilidad pronóstica.
3.- Clasificaciones microbiológicas: De interés académico, dividen la infección según los agentes causales.
Tipo 1: Polimicrobiana (característica de la Gangrena de Fournier)
Tipo 2: Monomicrobiana por gram positivos
Tipo 3: Monomicrobiana por gram negativos o Clostridium
Tipo 4: Fúngica
MANEJO
El tratamiento inicial incluye reanimación, antibioterapia de amplio espectro y desbridamiento quirúrgico urgente. Retrasar o realizar un desbridamiento incompleto incrementa significativamente el riesgo de morbimortalidad.
La resección debe extenderse hasta encontrar tejido viable y vascularizado. Históricamente, se promovía un desbridamiento agresivo, lo que dificultaba el cierre del defecto. Actualmente, se prefiere un enfoque más conservador, clasificando la piel en tres zonas según su viabilidad:
Zona 1: Piel necrótica (resección obligatoria).
Zona 2: Eritema cutáneo sobre fascia necrótica; puede conservarse si está vascularizada.
Zona 3: Tejido sano.
Antibioterapia: Se debe iniciar con una cobertura amplia, que permita cubrir gram negativos, positivos y anaerobios. El esquema empírico inicial debe ser sugerido según la microbiología local y luego ajustado a resultados microbiológicos. Algunos esquemas posibles son ampicilina/sulbactam + clindamicina; ceftriaxona + clindamicina y piperacilina/tazobactam + vancomicina
Manejo de la herida: una vez realizado el manejo inicial, el objetivo es evitar la infección secundaria del tejido sano recientemente expuesto. Para esto deben mantenerse los antibióticos, ajustándose según cultivos y realizar curaciones avanzadas.
Lo más común es utilizar vendajes húmedos con solución salina, que se pueden asociar con antisepticos como povidona o hipoclorito de sodio al 0,025%, que reclutan fibroblastos y reducen la carga bacteriana 106. Las curaciones deben realizarse una o dos veces al día, con el fin de manejar el exudado sin perjudicar la epitelización. En cada curación debe revisarse cuidadosamente la herida para confirmar la ausencia de tejido necrótico –lo cual requiere resección- y la presencia de tejido granulatorio.
El uso de sistemas de presión negativa puede ser útil en esta etapa, dado que reducen la frecuencia de las curaciones a cada 72-96 horas y favorecen la granulación y reducción del edema. Estos beneficios deben ponderarse con la imposibilidad de revisar la herida de manera más frecuente, por lo que estos sistemas deben evitarse si hay sospecha de infección macroscópica persistente.
El apoyo nutricional es crítico, dado que la presencia de una herida abierta puede producir pérdidas de más 10 g de proteínas por día, lo que compromete la correcta cicatrización. En este sentido, se recomienda realizar balances nitrogenados y seguimiento cercano por el equipo de nutrición clínica.
Tiempo del Cierre de la herida: En general se recomienda que exista una clara mejoría clínica, con descenso de parámetros inflamatorios, cobertura antibiótica efectiva por más de 72 horas, presencia de tejido granulatorio y optimización nutricional. Algunos centros recomiendan también la realización de aseos hasta presentar cultivos negativos.
Técnica de cierre de la herida: debe ser capaz de cubrir todo el tejido blando expuesto sin la amenaza de mantener tejido infeccioso bajo la piel, al mismo tiempo que preserva la función del sistema genitourinario. Corresponde a la parte menos estandarizada del manejo de la gangrena de Fournier, dado que depende del compromiso anatómico de cada caso.
En términos generales, existen 4 técnicas para cerrar los defectos en la gangrena de Fournier.
A.- Cierre por segunda intención: minimiza el riesgo de infección. Sin embargo, el tiempo requerido para que una herida cierre por segunda intención es proporcional al tamaño de la herida, pudiendo tardar de semanas a meses. Necesita de un cuidado ambulatorio adecuado, lo que puede ser difícil de lograr y exige al sistema de salud. Se puede asociar sistemas de presión negativa, que reducirían los tiempos de cicatrización.
B.- Cierre primario diferido o por tercera intención: requiere de piel vecina suficiente para aproximar los tejidos sin tensión. Se puede resecar el tejido granulatorio previamente formado, dado que puede disminuir la movilidad del tejido circundante y normalmente está colonizado con bacterias.
C.- Injerto de piel parcial -STSG por sus siglas en inglés (Split-thickness skin graft)- es el uso de piel cosechada en una parte distinta del cuerpo (típicamente del muslo), por lo que no mantiene su vascularización original. Pueden utilizarse en casos en los que no es posible cerrar utilizando piel local. A diferencia del caso anterior, los STSG pueden colocarse directamente sobre los tejidos granulatorios, aprovechando su neovascularización para facilitar que el injerto prenda.
Los injertos pueden expandirse con un “mesher o expansor” mediante la realización de múltiples cortes. Los injertos expandidos permiten cubrir un área mayor de defecto con menos cantidad de piel donante, ayuda además a disminuir la formación de colecciones bajo el injerto y aumenta la flexibilidad del tejido. Sin embargo, produce una apariencia reticulada (adecuada para el escroto), que puede ser considerada poco estética en segmentos como la piel del pene. Los STSG pueden ser manejados con gasas parafinadas o con sistema de presión negativa.
D.- Colgajos o flaps fascio-cutáneos: consiste en utilizar piel cercana (en general del muslo) a la zona a cubrir, rotándola y manteniendo su pedículo vascular. Su mayor ventaja es que presenta una calidad estética mayor y que al contar con su propia irrigación tiene menos riesgo de necrosis. Sin embargo, puede no ser posible obtenerlos dado el daño previo de estos tejidos por la misma gangrena de Fournier o por sus enfermedades previas. Además, son cirugías de mayor complejidad técnica y riesgo de complicaciones, habitualmente apoyadas por cirugía plástica.
Estas 4 técnicas pueden combinarse de manera distinta según los requerimientos del paciente, tomando algunas consideraciones especiales según las zonas anatómicas a reparar.
A.- Pene: el uso de maniobras agresivas para realizar un cierre primario puede tener consecuencias negativas para su función urinaria y sexual. En general, si hay más de un 25% de pérdida cutánea, se requiere el uso de STSG.
El uso de STSG expandido en el pene puede ayudar a la “toma” del injerto, pero deja una piel estéticamente menos apropiada (Figura 35) 93. Se puede utilizar un sistema de aspiración a presión negativa, recomendándose su uso por al menos 5 días al implantar un injerto, siempre asociado a uso de sonda Foley.
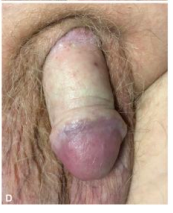
Figura 35. Aspecto postquirúrgico de STSG expandido (B) y sin expandir (D) a un año de la cirugía. Tomado de 93
B.- Escroto: a diferencia del pene, el escroto es extremadamente elástico, lo que hace más factible un cierre primario, que puede intentarse hasta con pérdidas del 50% de la piel. En casos de pérdidas mayores al 50%, lo más común es utilizar injertos, típicamente expandidos. Sin embargo, cuando se acompaña de un extenso compromiso perineal, como se explicará en el próximo punto, algunos autores prefieren el uso de colgajos.
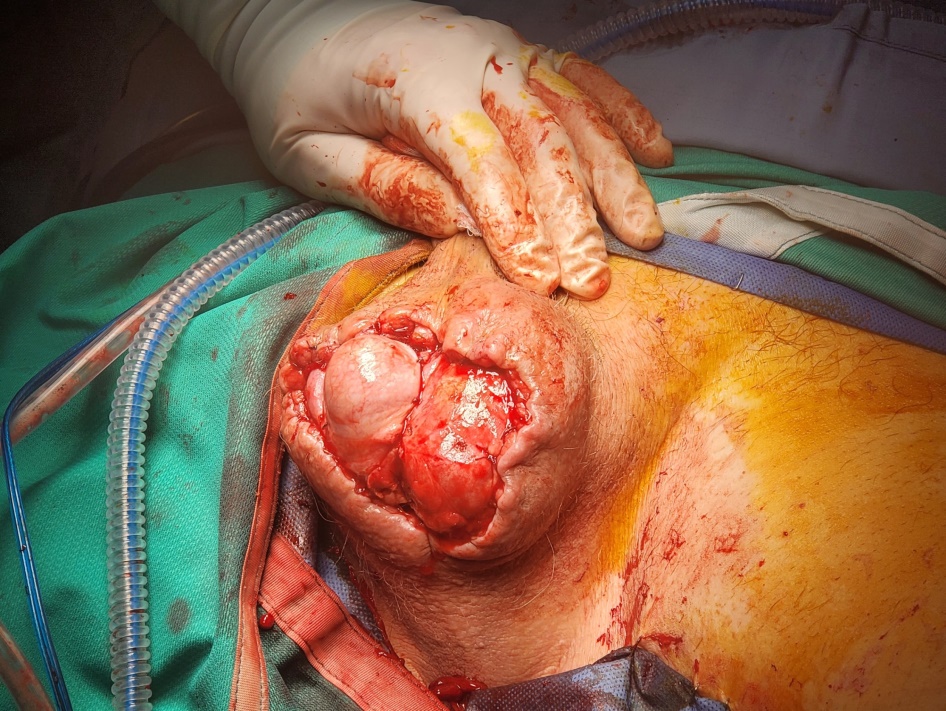
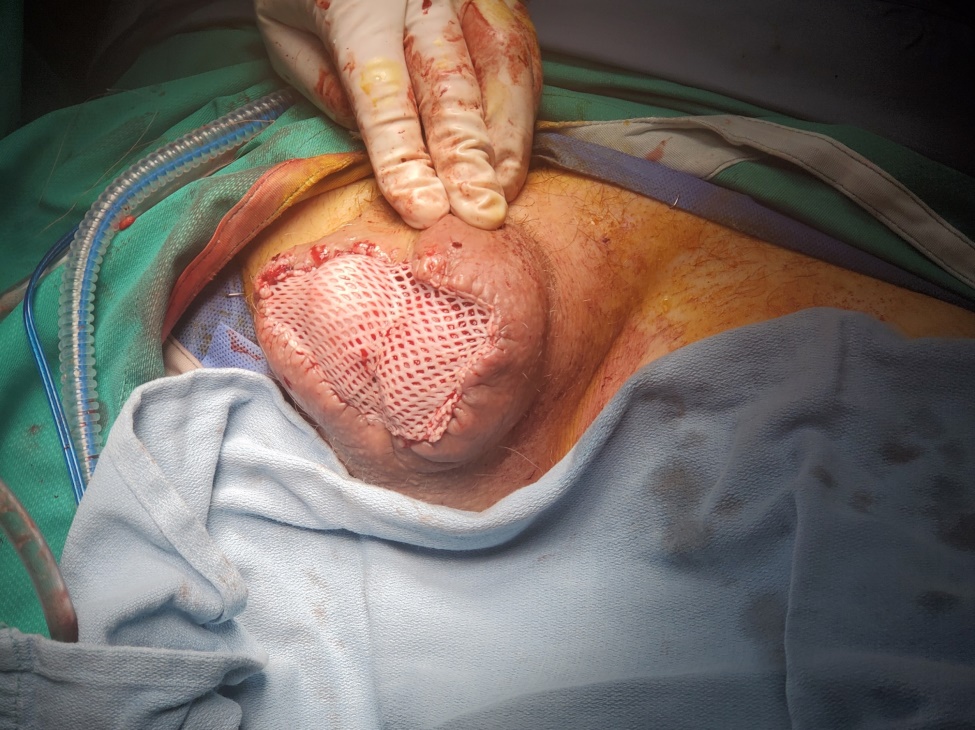
Figura 36. Defecto escrotal post Fournier, con injerto de piel parcial expandida
C.- Periné: de manera similar al escroto, el periné presenta un tejido elástico susceptible a ser cerrado de manera primaria en la mayor parte de los casos. Cuando esto no es posible, la literatura no recomienda el uso de STSG, dado que las fuerzas de cizalla del área, así como la dificultad para mantener curaciones efectivas en el periné típicamente comprometen la vitalidad de los injertos. En este sentido, se recomienda utilizar de preferencia colgajos, típicamente cosechados del muslo.
CONCLUSIONES:
La gangrena de Fournier es una afección poco frecuente que constituye una verdadera emergencia médica. Una vez superado el cuadro séptico, los pacientes suelen enfrentar compromisos funcionales urológicos significativos debido a la pérdida de tejidos blandos y piel. Es fundamental para nuestra especialidad dominar las diversas técnicas reconstructivas y tenerlas en cuenta durante la planificación de la resección de tejidos en el contexto de urgencia.
II.- PENE SUMIDO ADQUIRIDO DEL ADULTO
Figura 3: Sistema de clasificación basado en las características de 7 elementos anatómicos: panículo abdominal, escutcheon, piel peniana, piel escrotal, presencia de surco abdominal, surco pubiano y diferenciación penoescrotal. Extraido de 109
DEFINICIÓN Y EPIDEMIOLOGÍA
El pene sumido adquirido del adulto (PSAA) se define como la cobertura progresiva o el atrapamiento del cuerpo peneano por la piel y el tejido subcutáneo o graso, lo que puede provocar complicaciones dermatológicas (como irritación crónica), disfunción sexual y dificultades urinarias. Este proceso patológico se debe principalmente a dos mecanismos:
- Aumento del volumen de los tejidos blandos: causado por acumulación de grasa o drenaje linfático deficiente, que puede superar la longitud del cuerpo del pene.
- Pérdida o degeneración cicatricial de la piel peneana: generalmente secundaria a dermatitis crónicas o patologías concomitantes, como el liquen escleroso 107.
La incidencia exacta del PSAA es desconocida. Sin embargo, el aumento sostenido de la obesidad a nivel mundial, que en Chile alcanza cerca del 35% (9), sugiere que esta condición será cada vez más prevalente, exigiendo un conocimiento detallado por parte del urólogo general.
FISIOPATOLOGÍA
El PSAA puede entenderse secundario a dos grandes mecanismos: aumento del tejido adiposo/linfático y retracción cicatricial. Además, puede agregarse un tercer componente iatrogénico como una circuncisión que en casos mal seleccionados puede agravar la pérdida de piel.
En primer lugar, el desplazamiento del tejido adiposo hacia el pene empuja la fascia de Dartos, una extensión de la fascia de Scarpa, hacia distal. Dado que el pene está anclado al ligamento suspensorio, este desplazamiento conduce a su “enterramiento” (Figura 37). A medida que el pene queda funcionalmente cubierto (aunque la piel sea retráctil en etapas iniciales), la higiene local se ve comprometida. La acumulación de orina y la humedad excesiva generan un ciclo de irritación e inflamación de la piel, lo que aumenta el riesgo de infecciones bacterianas y fúngicas. Este proceso inflamatorio recurrente puede conducir a fibrosis y retracción cutánea, atrapando de manera irreversible el pene. La presencia de condiciones concomitantes como liquen escleroso y linfedema puede agravar aún más la retracción cicatricial.107
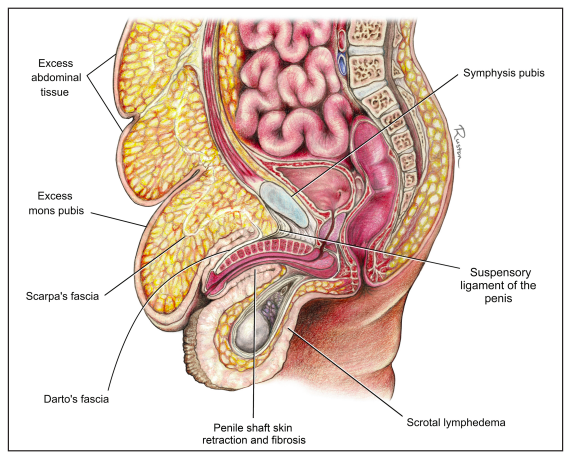
Figura 37. Esquema de pene sumido. (Tomado de Hesse et al, 2021107)
Figura 38. PSAA asociada a cicatriz anómala de circuncisión. (Tomado de Martins et al, 2020) 111
PRESENTACIÓN CLÍNICA Y ESTUDIO DIAGNÓSTICO
Además de la queja subjetiva por el impacto en la cosmesis, los pacientes con PSAA se pueden presentar con dificultad miccional, problemas para la higiene personal, dolor con la erección o micción y disfunción sexual. La anamnesis debe centrarse en la presencia de dichos síntomas, las comorbilidades y la historia de radioterapia, neoplasias, cirugías pélvicas previas, en particular circuncisión y linfadenectomía (dado que éstas últimas pueden relacionarse con linfedema genital). El examen físico es la herramienta diagnóstica principal en el PSAA. Permite orientar la etiología de la condición, evaluar condiciones mórbidas asociadas y planificar el manejo. Se debe examinar tanto de pie como en supino, levantando al panículo adiposo abdominal y la grasa púbica inmediatamente cefálica al pene (conocido en inglés como escutcheon, sería extrapolable al monte de venus en la mujer). Es importante evaluar una posible fimosis, el estado del meato (dado la común asociación con liquen escleroso), la presencia de hernias inguinal (puede requerir imagen para confirmar dado panículo abundante) y presencia de linfedema escrotal/peneano. Hasta un tercio de los pacientes con PSAA puede presentar estrechez de uretra 108 por lo cual algunos autores recomiendan realizar una uretrocistografía o cistoscopia previa a cualquier intervención, sobretodo en pacientes con evidencias de liquen escleroso. La resolución quirúrgica de la patología uretral en general debe realizarse previo a la cirugía de PSAA, dado que, por ejemplo, la presencia de un injerto de piel hace la cirugía uretral mucho más compleja.
SISTEMA DE CLASIFICACIÓN
Existen múltiples sistemas de clasificación del PSAA, sin que exista hasta ahora consenso sobre el más adecuado. En términos generales, estos sistemas consideran -en distintas combinaciones y grados de importancia- la indemnidad de la piel del pene, la presencia y contribución del escutcheon, la presencia de linfedema y la indemnidad de la piel del escroto, entre otros. Flynn et al 109 propusieron una clasificación acuciosa y sistemática del PSAA que guía para el manejo quirúrgico posterior (Figura 39)
Figura 39. Sistema de clasificación basado en las características de 7 elementos anatómicos: panículo abdominal, escutcheon, piel peniana, piel escrotal, presencia de surco abdominal, surco pubiano y diferenciación penoescrotal. (Tomado de Flynn et al , 2022) 109
MANEJO
El descenso de peso, aunque beneficioso, suele ser insuficiente para resolver completamente el impacto urinario y sexual del pene sumido adquirido del adulto (PSAA). En algunos casos, la pérdida de peso puede incluso acentuar la cobertura del pene por el tejido graso del escutcheon. Por estas razones, el tratamiento del PSAA es fundamentalmente quirúrgico.
Dado que la presentación anatómica del PSAA varía considerablemente entre pacientes, no existe un manejo estandarizado. Sin embargo, el tratamiento se basa en principios quirúrgicos clave que deben adaptarse a las características clínicas de cada caso.
- Debe liberarse el pene de los tejidos circundantes. Para esto, típicamente se descubre el glande, -si es necesario, mediante una incisión dorsal – y se manipula con un punto de tracción. Se evalúa la viabilidad de la piel del shaft y la presencia de anillos fimóticos. Toda la piel no viable o estrecha debe resecarse hasta exponer completamente el pene, preservando el ligamento suspensorio. Esto permite evaluar la longitud real del pene y la necesidad de realizar injertos cutáneos posteriores.
- Evaluar y eventualmente resecar el escutcheon. Esta resección debe evitar dañar el cordón espermático. Se recomienda uso de dispositivos de energía avanzada para manejar la hemostasia. Típicamente el cierre de piel se realiza de manera lineal con suturas separadas, previa instalación de un drenaje. La idea es recuperar el surco pubiano, para lo cual se puede fijar el tejido subcutáneo cefálico al dorso del pene al tejido sobre el pubis. En conjunto con la resección del escutcheon debe considerarse la resección del panículo adiposo abdominal, especialmente en los casos de pacientes con abdomen en delantal. Este terreno es de manejo conjunto con cirugía plástica.
- Eventual resección parcial de piel escrotal. Este exceso puede deberse a directamente a la obesidad como también a linfedema secundario.
- Eventual injerto de piel para cubrir defectos peneanos y/o escrotales. Se puede aprovechar la piel de la resección de escutcheon realizada previamente, o cosechar piel parcial con un dermátomo desde el muslo. Los injertos en el escroto usualmente se usan expandidos (con expansor o “mesher”), es decir con múltiples cortes que lo hacen parecer una malla, esto resultado en una piel rugosa similar a la piel del escroto. En el pene se usan injertos sin expandir. Los injertos se dejan cubiertos con curaciones compresivas o con presión negativa para asegurar que no se mueva o cizalle durante los primeros días.
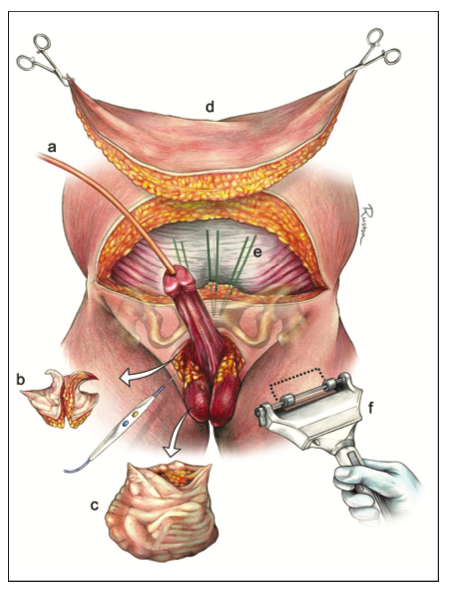
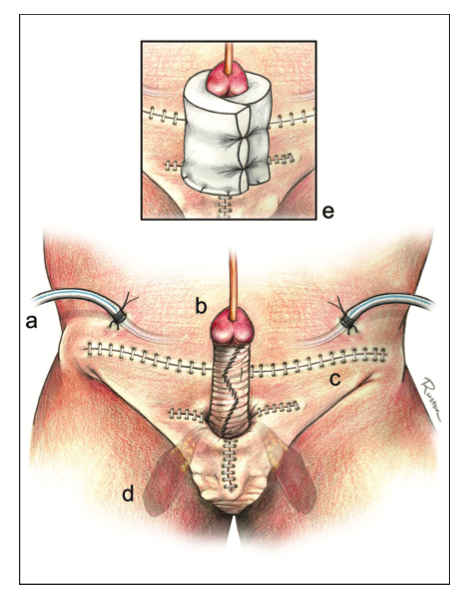
Figura 40. esquema de las etapas de la reparación del PSAA. (Tomado de Hesse et a, 2019) 107)
. 2019 Aug 22;39(9):979-988
. 2019 Aug 22;39(9):
RESULTADOS DE LA RECONSTRUCCIÓN DEL PSAA
Los pacientes con PSAA presentan una elevada carga de comorbilidades, lo que contribuye a un alto índice de complicaciones en las heridas operatorias tras la resolución quirúrgica de esta condición. Las tasas de complicaciones reportadas oscilan entre el 50% y el 80% 109. A pesar de ello, diversos estudios han demostrado que más del 85% de los pacientes someterían nuevamente al procedimiento si fuese necesario 110. Este dato refleja la satisfacción general con los resultados obtenidos, atribuible a las mejoras funcionales logradas:
-Función sexual: Entre el 41% y el 94% de los pacientes refieren una mejoría en su función sexual tras la cirugía.
-Función urinaria: Entre el 83% y el 91% de los pacientes reportan una notable mejoría en la función urinaria después del procedimiento 111
Estos resultados destacan la importancia del manejo quirúrgico adecuado del PSAA, incluso frente a los riesgos inherentes de la cirugía en esta población.
Bibliografía
1. Saavedra AA, Rourke KF. Training in reconstructive urology : the past , present and future. Transl Androl Urol. 2018;7(4):666-672. doi:10.21037/tau.2018.03.04
2. Le B, Burnett AL. Evolution of penile prosthetic devices. Korean J Urol. Published online 2015:179-186.
3. Costantini E, Lazzeri M. Lean Mean Research : The 21st Century Challenge for Urology. Eur Urol. 2010;57:980-982. doi:10.1016/j.eururo.2010.02.033
4. Latini JM, McAninch JW, Brandes SB, Chung JY, Rosenstein D. SIU/ICUD consultation on urethral strictures: Epidemiology, etiology, anatomy, and nomenclature of urethral stenoses, strictures, and pelvic fracture urethral disruption injuries. Urology. 2014;83(3 SUPPL.):S1-S7. doi:10.1016/j.urology.2013.09.009
5. Jordan G. Complications of interventional techniques for urethral stricture. In: Carson C, ed. Complications of Interventional Techniques. Igaku-Shoim; 1996:89.
6. Horton C, Stecker J, Jordan G. Management of erectile dysfunction, genital reconstruction following trauma, and transsexualism. In: McCarthy J, May J, Littler J, eds. Plastic Surgery Vol 6. WB Saunders; 1990:4215.
7. Santucci RA, Joyce GF, Wise M. Male Urethral Stricture Disease. Journal of Urology. 2007;177(5):1667-1674. doi:10.1016/j.juro.2007.01.041
8. Hampson LA, McAninch JW, Breyer BN. Male urethral strictures and their management. Nat Rev Urol. 2014;11(1):43-50. doi:10.1038/nrurol.2013.275
9. Palminteri E, Berdondini E, Verze P, De Nunzio C, Vitarelli A, Carmignani L. Contemporary urethral stricture characteristics in the developed world. Urology. 2013;81(1):191-196. doi:10.1016/j.urology.2012.08.062
10. Mundy AR, Andrich DE. Urethral strictures. BJU Int. 2011;107(1):6-26. doi:10.1111/j.1464-410X.2010.09800.x
11. Perez R, Llinares M. Complications of the lower urinary tract secondary to urethral stenosis. Actas Urol Esp. 1996;20(9):786-793.
12. Hoy NY, Chapman DW, Dean N, Rourke KF. Incidence and Predictors of Complications due to Urethral Stricture in Patients Awaiting Urethroplasty. Journal of Urology. 2018;199(3):754-759. doi:10.1016/j.juro.2017.08.113
13. Saavedra AA, Rourke KF. Clinical Presentation and Diagnostic Evaluation of Male Urethral Stricture. In: Martins FE, Kulkarni SB, Köhler TS, eds. Textbook of Male Genitourethral Reconstruction. Springer International Publishing; 2020:45-65. doi:10.1007/978-3-030-21447-0
14. Angermeier KW, Rourke KF, Dubey D, Forsyth RJ, Gonzalez CM. SIU/ICUD consultation on urethral strictures: Evaluation and follow-up. Urology. 2014;83(3 SUPPL.):S8-S17. doi:10.1016/j.urology.2013.09.011
15. Wessells H, Angermeier KW, Elliott S, et al. Male Urethral Stricture: American Urological Association Guideline. Journal of Urology. 2017;197(1):182-190. doi:10.1016/j.juro.2016.07.087
16. Nuss GR, Granieri MA, Zhao LC, Thum DJ, Gonzalez CM. Presenting symptoms of anterior urethral stricture disease: a disease specific, patient reported questionnaire to measure outcomes. J Urol. 2012;187(2):559-562. doi:10.1016/j.juro.2011.10.043
17. Wessels SG, Heyns CF. Prospective evaluation of a new visual prostate symptom score, the international prostate symptom score, and uroflowmetry in men with urethral stricture disease. Urology. 2014;83(1):220-224. doi:10.1016/j.urology.2013.08.058
18. Heyns CF, Marais DC. Prospective evaluation of the American Urological Association symptom index and peak urinary flow rate for the followup of men with known urethral stricture disease. J Urol. 2002;168(5):2051-2054. doi:10.1097/01.ju.0000034258.80769.f7
19. Erickson BA, Elliott SP, Voelzke BB, et al. Multi-institutional 1-year bulbar urethroplasty outcomes using a standardized prospective cystoscopic follow-up protocol. Urology. 2014;84(1):213-216. doi:10.1016/j.urology.2014.01.054
20. Bach P, Rourke K. Independently interpreted retrograde urethrography does not accurately diagnose and stage anterior urethral stricture: The importance of urologist-performed urethrography. Urology. 2014;83(5):1190-1193. doi:10.1016/j.urology.2013.12.063
21. Heidenreich A, Derschum W, Bonfig R, Wilbert DM. Ultrasound in the evaluation of urethral stricture disease: a prospective study in 175 patients. Br J Urol. 1994;74(1):93-98.
22. Gupta N, Dubey D, Mandhani A, Srivastava A, Kapoor R, Kumar A. Urethral stricture assessment: A prospective study evaluating urethral ultrasonography and conventional radiological studies. BJU Int. 2006;98(1):149-153. doi:10.1111/j.1464-410X.2006.06234.x
23. Mitterberger M, Christian G, Pinggera GM, et al. Gray Scale and Color Doppler Sonography With Extended Field of View Technique for the Diagnostic Evaluation of Anterior Urethral Strictures. Journal of Urology. 2007;177(3):992-997. doi:10.1016/j.juro.2006.10.026
24. Ghoneima W, Rammah AM, El gharably MA, Zamel S, Mohamed M, Torad H. Can the parameters of penile duplex assessment predict the success of urethroplasty? Afr J Urol. 2024;30(1). doi:10.1186/s12301-024-00456-9
25. Joshi PM, Desai DJ, Shah D, Joshi DP, Kulkarni SB. Magnetic resonance imaging procedure for pelvic fracture urethral injuries and recto urethral fistulas: A simplified protocol. Turk J Urol. 2021;47(1):35-42. doi:10.5152/tud.2020.20472
26. Pansadoro V, Emiliozzi P. Internal urethrotomy in the management of anterior urethral strictures: long-term followup. Journal of Urology. 1996;156:73–75.
27. Moncrief T, Gor R, Goldfarb RA, Jarosek S, Elliott SP. Urethral Rest with Suprapubic Cystostomy for Obliterative or Nearly Obliterative Urethral Strictures: Urethrographic Changes and Implications for Management. Journal of Urology. 2018;199(5):1289-1295. doi:10.1016/j.juro.2017.11.110
28. Kapriniotis K, Loufopoulos I, Apostolopoulou A. Paclitaxel-coated balloon treatment for urethral stricture disease. J Clin Med. 2025;14.
29. Castellucci R, Gatti L, Minore A. Drug-coated balloon after pelvic radiotherapy: early experience. Continence. 2023;6.
30. Delong J, Virasoro R, Pichardo M. Five-year outcomes of Optilume in recurrent bulbar stricture: ROBUST I. J Urol. 2025;213:90-98.
31. Elliott SP, Coutinho KJ, Robertson K. One-year results from the ROBUST III randomized trial. J Urol. 2022;207:866-875.
32. Vandyke ME, Morey AF, Coutinho K. Optilume drug-coated balloon for anterior urethral stricture: two-year ROBUST III results. BJUI Compass. 2024;5:366-373.
33. Vandyke M, Joshi E, Ceballos B. Optilume after urethroplasty: multicenter study. Ther Adv Urol. 2025;17.
34. Alhamdani Z, Ong S, Zhong W. Optilume® drug-coated balloon in challenging urethral stricture: prospective cohort. J Endourol. 2024;38:1192-1200.
35. Morey AF, Lin HC, DeRosa CA, Griffith BC. Fossa navicularis reconstruction: impact of stricture length on outcomes and assessment of extended meatotomy (first stage Johanson) maneuver. J Urol. 2007;177(1):184-187; discussion 187. doi:10.1016/j.juro.2006.08.062
36. Daneshvar M, Simhan J, Blakely S, et al. Transurethral ventral buccal mucosa graft inlay for treatment of distal urethral strictures: international multi-institutional experience. World J Urol. 2020;38(10):2601-2607. doi:10.1007/s00345-019-03061-6
37. Saavedra AA, Rourke KF. Characterization and outcomes of urethroplasty for hypospadias-associated urethral strictures in adults. Canadian Urological Association Journal. 2019;13(11):E335-E340. doi:10.5489/cuaj.5863
38. Horiguchi A, Shinchi M. Substitution Urethroplasty for Bulbar Urethral Strictures. In: Martins FE, Kulkarni SB, Köhler TS, eds. Textbook of Male Genitourethral Reconstruction. Springer International Publishing; 2020:191-208. doi:10.1007/978-3-030-21447-0
39. Terlecki RP, Steele MC, Valadez C, Morey AF. Grafts are unnecessary for proximal bulbar reconstruction. J Urol. 2010;184(6):2395-2399. doi:10.1016/j.juro.2010.08.034
40. Chapman DW, Cotter K, Johnsen N V, et al. Nontransecting techniques reduce sexual dysfunction after anastomotic bulbar urethroplasty: Results of a multi-institutional comparative analysis. J Urol. 2019;201(2):364-370. doi:10.1016/j.juro.2018.09.051
41. Barratt R, Chan G, La Rocca R, et al. Free graft augmentation urethroplasty for bulbar urethral strictures: Which technique is best? A systematic review. Eur Urol. 2021;80(1):57-68. doi:10.1016/j.eururo.2021.03.026
42. Redmond EJ, Hoare DT, Rourke KF. Augmented anastomotic urethroplasty is independently associated with failure after reconstruction for long bulbar urethral strictures. J Urol. 2020;204(5):989-995. doi:10.1097/JU.0000000000001177
43. Warner JN, Malkawi I, Dhradkeh M, et al. A multi-institutional evaluation of the management and outcomes of long-segment urethral strictures. Urology. 2015;85(6):1483-1487. doi:10.1016/j.urology.2015.01.041
44. Kulkarni S, Barbagli G, Sansalone S, Lazzeri M. One-sided anterior urethroplasty: A new dorsal onlay graft technique. BJU Int. 2009;104(8):1150-1155. doi:10.1111/j.1464-410X.2009.08590.x
45. Kulkarni SB, Joshi PM, Venkatesan K. Management of panurethral stricture disease in India. J Urol. 2012;188(3):824-830. doi:10.1016/j.juro.2012.05.020
46. Labossiere JR, Cheung D, Rourke K. Endoscopic treatment of vesicourethral stenosis after radical prostatectomy: Outcomes and predictors of success. Journal of Urology. 2016;195(5):1495-1500. doi:10.1016/j.juro.2015.12.073
47. Policastro CG, Angulo JC, Gomez R, Nikolavsky D. Surgical Reconstruction of Membranous Urethral Strictures Due to Radiation. In: Martins FE, Kulkarni SB, Köhler TS, eds. Textbook of Male Genitourethral Reconstruction. Springer International Publishing; 2020:285-302. doi:10.1007/978-3-030-21447-0_24
48. Gomez RG, Scarberry K. Anatomy and techniques in posterior urethroplasty. Transl Androl Urol. 2018;7(4):567-579. doi:10.21037/tau.2018.03.05
49. Redshaw JD, Broghammer JA, Smith TG, et al. Intralesional injection of mitomycin C at transurethral incision of bladder neck contracture may offer limited benefit: TURNS Study Group. J Urol. 2015;193(2):587-592. doi:10.1016/j.juro.2014.08.104
50. Kirshenbaum EJ, Zhao LC, Myers JB, et al. Patency and Incontinence Rates After Robotic Bladder Neck Reconstruction for Vesicourethral Anastomotic Stenosis and Recalcitrant Bladder Neck Contractures: The Trauma and Urologic Reconstructive Network of Surgeons Experience. Urology. 2018;118:227-233. doi:10.1016/j.urology.2018.05.007
51. Hester AG, Kretschmer A, Badlani G. Male Incontinence: The Etiology or Basis of Treatment. Eur Urol Focus. 2017;3(4-5):377-384. doi:10.1016/j.euf.2017.12.002
52. Sandhu JS, Breyer B, Comiter C, et al. Incontinence after Prostate Treatment: AUA/SUFU Guideline. Journal of Urology. 2019;202(2):369-378. doi:10.1097/ju.0000000000000314
53. Abrams P, Andersson K, Apostolidis A, et al. 6th International Consultation on Incontinence. Recommendations of the International Scientific Committee: EVALUATION AND TREATMENT OF URINARY INCONTINENCE, PELVIC ORGAN PROLAPSE AND FAECAL INCONTINENCE. Neurourol Urodyn. 2018;37(7):2271-2272. doi:10.1002/nau.23551
54. Helfand BT, Smith AR, Lai HH, et al. Prevalence and Characteristics of Urinary Incontinence in a Treatment Seeking Male Prospective Cohort: Results from the LURN Study. Journal of Urology. 2018;200(2):397-404. doi:10.1016/j.juro.2018.02.075
55. Chung E. Contemporary surgical devices for male stress urinary incontinence: a review of technological advances in current continence surgery. Transl Androl Urol. 2017;6(S2):S112-S121. doi:10.21037/tau.2017.04.12
56. Kretschmer A, Nitti V. Surgical Treatment of Male Postprostatectomy Incontinence: Current Concepts. Eur Urol Focus. 2017;3(4-5):364-376. doi:10.1016/j.euf.2017.11.007
57. Kretschmer A, Hübner W, Sandhu JS, Bauer RM. Evaluation and Management of Postprostatectomy Incontinence: A Systematic Review of Current Literature. Eur Urol Focus. 2016;2(3):245-259. doi:10.1016/j.euf.2016.01.002
58. Chung DE, Dillon B, Kurta J, Maschino A, Cronin A, Sandhu JS. Detrusor underactivity is prevalent after radical prostatectomy: a urodynamic study including risk factors. Canadian Urological Association Journal. 2012;6(1). doi:10.5489/cuaj.11038
59. Breyer BN, Kim SK, Kirkby E, Marianes A, Vanni AJ, Westney OL. Updates to Incontinence After Prostate Treatment: AUA/GURS/SUFU Guideline (2024). Journal of Urology. 2024;212(4):531-538. doi:10.1097/ju.0000000000004088
60. Ficarra V, Novara G, Rosen RC, et al. Systematic Review and Meta-analysis of Studies Reporting Urinary Continence Recovery After Robot-assisted Radical Prostatectomy. Eur Urol. 2012;62(3):405-417. doi:10.1016/j.eururo.2012.05.045
61. Manassero F, Traversi C, Ales V, et al. Contribution of early intensive prolonged pelvic floor exercises on urinary continence recovery after bladder neck‐sparing radical prostatectomy: Results of a prospective controlled randomized trial. Neurourol Urodyn. 2007;26(7):985-989. doi:10.1002/nau.20442
62. Biardeau X, Aharony S, Campeau L, Corcos J. Artificial Urinary Sphincter: Report of the 2015 Consensus Conference. Neurourol Urodyn. 2016;35(S2). doi:10.1002/nau.22989
63. Radomski SB. Practical evaluation of post-prostatectomy incontinence. Canadian Urological Association Journal. 2013;7(9-10):186. doi:10.5489/cuaj.1620
64. Zillioux J, Camacho FT, Anderson RT, You W, Rapp DE. Prevalence of Cognitive and Manual Dexterity Disorders Among Men Following Artificial Urinary Sphincter Placement. Journal of Urology. 2024;212(3):441-450. doi:10.1097/ju.0000000000004049
65. Hoy NY, Rourke KF. Artificial Urinary Sphincter Outcomes in the “Fragile Urethra.” Urology. 2015;86(3):618-624. doi:10.1016/j.urology.2015.05.023
66. Llorens C, Pottek T. Urinary Artificial Sphincter ZSI 375 for Treatment of Stress Urinary Incontinence in Men: 5 and 7 Years Follow-Up Report. Urologia Journal. 2017;84(4):263-266. doi:10.5301/uj.5000243
67. Ameli G, Hüsch T, Hübner WA, Weibl P. A new adjustable artificial urinary sphincter for male stress urinary incontinence (VictoTM): preliminary clinical results. Transl Androl Urol. 2024;13(8):1546-1554. doi:10.21037/tau-22-779
68. Wilson SK, Chung E, Langford B, et al. First safety outcomes for rigicon conticlassic® artificial urinary sphincter. Int J Impot Res. 2023;36(8):829-832. doi:10.1038/s41443-023-00748-8
69. Chung ASJ, Suarez OA, McCammon KA. AdVance male sling. Transl Androl Urol. 2017;6(4):674-681. doi:10.21037/tau.2017.07.29
70. Del Favero L, Tasso G, Deruyver Y, et al. Long-term Functional Outcomes and Patient Satisfaction After AdVance and AdVanceXP Male Sling Surgery. Eur Urol Focus. 2022;8(5):1408-1414. doi:10.1016/j.euf.2022.01.017
71. Gonzalez-Jauregui R, Nigro NN, Doersch K, Bhalla RG, Flynn BJ. The future of male stress urinary incontinence surgery. International Journal of Reconstructive Urology. 2024;2(2):182-189. doi:10.4103/ijru.ijru_31_24
72. Loertzer H, Huesch T, Kirschner‐Hermanns R, et al. Retropubic vs transobturator Argus adjustable male sling: Results from a multicenter study. Neurourol Urodyn. 2020;39(3):987-993. doi:10.1002/nau.24316
73. Doiron RC, Saavedra A, Haines T, et al. Canadian Experience with the Adjustable Transobturator Male System for Post-Prostatectomy Incontinence: A Multicenter Study. Journal of Urology. 2019;202(5):1022-1028. doi:10.1097/ju.0000000000000420
74. Esquinas C, Angulo JC. Effectiveness of Adjustable Transobturator Male System (ATOMS) to Treat Male Stress Incontinence: A Systematic Review and Meta-Analysis. Adv Ther. 2018;36(2):426-441. doi:10.1007/s12325-018-0852-4
75. Larson T, Jhaveri H, Yeung LL. Adjustable continence therapy (ProACT) for the treatment of male stress urinary incontinence: A systematic review and meta‐analysis. Neurourol Urodyn. 2019;38(8):2051-2059. doi:10.1002/nau.24135
76. Faiena I, Koprowski C, Tunuguntla H. Female urethral reconstruction. J Urol. 2016;195(3):557-567.
77. Haylen BT, De Ridder D, Freeman RM. An International Urogynecological Association (IUGA)/International Continence Society (ICS) joint report on the terminology for female pelvic floor dysfunction. Neurourol Urodyn. 2010;29:4-20.
78. Alvarez de Toledo I, DeLong J. Female urethral reconstruction: Urethral diverticulectomy, urethral strictures, vesicovaginal fistula. Urol Clin North Am. 2022;49(3):393-402. doi:10.1016/j.ucl.2022.04.004
79. Baradaran N, Chiles L, Freilich D, Rames R, Cox L, Rovner E. Female urethral diverticula in the contemporary era: is the classic triad of the “3Ds” still relevant? Urology. 2016;94:53-56.
80. Gravina GL, Costa AM, Galatioto GP, Ronchi P, Tubaro A, Vicentini C. Urodynamic obstruction in women with stress urinary incontinence–do nonintubated uroflowmetry and symptoms aid diagnosis? J Urol. 2007;178(3 Pt 1):959-963; discussion 963-4. doi:10.1016/j.juro.2007.05.057
81. Blaivas JG, Groutz A. Bladder outlet obstruction nomogram for women with lower urinary tract symptomatology. Neurourol Urodyn. 2000;19(5):553-564.
82. Solomon E, Duffy YH, Rashid M, Akinluyi T, Greenwell E. Developing and validating a new nomogram for diagnosing bladder outlet obstruction in women. Neurourol Urodyn. 2018;37(1):368-378.
83. Castro-Nuñez P, Noyola-Ávila I, Maldonado-Alcaraz E, Moreno-Palacios J, Terán Amaya FS. Solomon-Greenwell as the most accurate nomogram for female bladder outlet obstruction. Rev Mex Urol. 2023;82(6):1-5. doi:10.48193/revistamexicanadeurologa.v82i6.873
84. Brucker BM, Shah S, Mitchell S, et al. Comparison of urodynamic findings in women with anatomical versus functional bladder outlet obstruction. Female Pelvic Med Reconstr Surg. 2013;19(1):46-50. doi:10.1097/SPV.0b013e31827d87cc
85. Bailey C, Matharu G. Conservative management as an initial approach for post-operative voiding dysfunction. Eur J Obstet Gynecol Reprod Biol. 2012;160(1):106-109. doi:10.1016/j.ejogrb.2011.09.025
86. Madjar S, Halachmi S, Wald M, et al. Long–term follow–up of the in–flowTM intraurethral insert for the treatment of women with voiding dysfunction. Eur Urol. 2000;38(2):161-166. doi:10.1159/000020274
87. Turchi B, Lumen N, Verla W, Waterloos M. Female urethral stricture disease: a narrative review on diagnosis, surgical techniques and outcomes. Int J Impot Res. Published online 2025. doi:10.1038/s41443-025-01079-6
88. Saavedra Á, Brito FF, Rojas I, et al. Manejo de la estrechez uretral femenina mediante uretroplastia con injerto dorsal de mucosa oral. Rev Chil Urol. 2025;90(1). doi:10.24875/rechuro.24000035
89. Popat S, Zimmern PE. Long-term management of luminal urethral stricture in women. Int Urogynecol J. 2016;27(11):1735-1741. doi:10.1007/s00192-016-3006-8
90. Thomas HS, Stern N, Neu S, Herschorn S. Drug-coated balloon dilation for female urethral stricture. Urol Case Rep. 2025;59(102985):102985. doi:10.1016/j.eucr.2025.102985
91. Stuehmeier J, Jelisejevas LA, Kink P, Gulacsi A, Horninger W, Rehder P. Optilume® drug-coated balloon dilation in complex female urethral stricture. Urol Case Rep. 2022;41(101987):101987. doi:10.1016/j.eucr.2021.101987
92. Haq S, Shah SMA, Khan NS, Azhar K. Comparison of effectiveness of clean intermittent self catheterization with no catheterization after internal optical urethrotomy for urethral stricture. Journal of Postgraduate Medical Institute. 2019;33(1). https://jpmi.org.pk/index.php/jpmi/article/view/2395
93. Demzik A, Peterson C, Figler B. Skin grafting for penile skin loss. Plast Aesthet Res. 2020;7. doi:10.20517/2347-9264.2020.93
94. de Toledo IA, DeLong J. Female urethral stricture: techniques for reconstruction. Plast Aesthet Res. Published online 2022. doi:10.20517/2347-9264.2021.103
95. Togo M, Mizusawa T, Kato R, Suzuki K, Tsuzuki T, Komeya M. Lower urinary tract function improves after laparoscopic sacrocolpopexy for elderly patients with pelvic organ prolapse. Low Urin Tract Symptoms. 2020;12(3):260-265.
96. Mccrery R, Appell R. Transvaginal urethrolysis for obstruction after antiincontinence surgery. Int Urogynecol J Pelvic Floor Dysfunct. 2007;18(6):627-633.
97. Giannis G, Bousouni E, Mueller MD, Kuhn A. Can urethrolysis resolve outlet obstruction related symptoms after Burch colposuspension for stress urinary incontinence? Eur J Obstet Gynecol Reprod Biol. 2015;195:103-107.
98. El-Azab AS, Abolella HA, Farouk M. Update on vesicovaginal fistula: A systematic review. Arab J Urol. 2019;17(1):61-68. doi:10.1080/2090598X.2019.1590033
99. Stamatakos M, Sargedi C, Stasinou T, Kontzoglou K. Vesicovaginal fistula: diagnosis and management. Indian J Surg. 2014;76(2):131-136. doi:10.1007/s12262-012-0787-y
100. Bent AE, Cundiff GW, Swift SE. Ostergard’s Urogynecology and Pelvic Floor Dysfunction. Williams & Wilkins; 2008.
101. Iyer SM, Singh S, Srivastav A. Analysis of various surgical approaches to supratrigonal vesicovaginal fistula repair: A tertiary care centre experience. Int Urogynecol J. Published online 2025. doi:10.1007/s00192-025-06104-2
102. Ockrim JL, Greenwell TJ, Foley CL, Wood DN, Shah PJR. A tertiary experience of vesico-vaginal and urethro-vaginal fistula repair: factors predicting success. BJU Int. 2009;103(8):1122-1126. doi:10.1111/j.1464-410X.2008.08237.x
103. Arora A, Rege S, Surpam S, Gothwal K, Narwade A. Predicting mortality in Fournier gangrene and validating the Fournier gangrene severity index: Our experience with 50 patients in a tertiary care center in India. Urol Int. 2019;102(3):311-318. doi:10.1159/000495144
104. Laor E, Palmer LS, Tolia BM, Reid RE, Winter HI. Outcome prediction in patients with Fournier’s gangrene. J Urol. 1995;154(1):89-92. https://www.ncbi.nlm.nih.gov/pubmed/7776464
105. Wong CH, Khin LW, Heng KS, Tan KC, Low CO. The LRINEC (Laboratory Risk Indicator for Necrotizing Fasciitis) score: a tool for distinguishing necrotizing fasciitis from other soft tissue infections. Crit Care Med. 2004;32(7):1535-1541. doi:10.1097/01.ccm.0000129486.35458.7d
106. Erickson BA, Flynn KJ. Management of Necrotizing Soft Tissue Infections (Fournier’s Gangrene) and Surgical Reconstruction of Debridement Wound Defects. Urol Clin North Am. 2022;49(3):467-478. doi:10.1016/j.ucl.2022.04.008
107. Hesse MA, Israel JS, Shulzhenko NO, et al. The Surgical Treatment of Adult Acquired Buried Penis Syndrome: A New Classification System. Aesthet Surg J. 2019;39(9):979-988. doi:10.1093/asj/sjy325
108. Fuller TW, Pekala K, Theisen KM, Tapper A, Burks F, Rusilko PJ. Prevalence and surgical management of concurrent adult acquired buried penis and urethral stricture disease. World J Urol. 2019;37(7):1409-1413. doi:10.1007/s00345-018-2514-1
109. Flynn KJ, Vanni AJ, Breyer BN, Erickson BA. Adult-Acquired Buried Penis Classification and Surgical Management. Urol Clin North Am. 2022;49(3):479-493. doi:10.1016/j.ucl.2022.04.009
110. Voznesensky MA, Lawrence WT, Keith JN, Erickson BA. Patient-reported social, psychological, and urologic outcomes after adult buried penis repair. Urology. 2017;103:240-244. doi:10.1016/j.urology.2016.12.043
111. Martins FE, Kulkarni SB, Köhler TS. Textbook of Male Genitourethral Reconstruction. 2020th ed. Springer Nature; 2020.

