Epidemiología-Factores de riesgo
El cáncer de vejiga es una patología frecuente y se encuentra dentro de los cánceres más comunes. Ocupa el noveno lugar en incidencia absoluta mundial, siendo el sexto en hombres y decimoséptimo en mujeres (1). Existe una relación directa entre la edad y el aumento de la incidencia y mortalidad, siendo infrecuentes los casos antes de los 50 años. Es relativamente común en los ancianos, siendo la edad media de diagnóstico de 72 años para los hombres y 75 años para las mujeres (2).
Más de un 90% de las neoplasias vesicales corresponde a carcinoma urotelial y en el momento del diagnóstico aproximadamente el 75% de los pacientes corresponden a cáncer de vejiga no músculo invasor (CVNMI) (3,4).
En el año 2022 fueron diagnosticados aproximadamente 613,791 casos nuevos de cáncer vesical en todo el mundo (1) , lo que marca un alza de aproximadamente un 7% con el reporte anterior (5). Se establece que cerca de 220.000 personas murieron a causa de esta neoplasia. (5)
Las tasas ajustadas por edad de incidencia fueron casi cuatro veces mayores en hombres (9,5 por 100 000) que en mujeres (2,4 por 100 000), mientras que la mortalidad ajustada fue también significativamente superior en hombres (3,3 vs 0,9 por 100 000) (6). El cáncer de vejiga da cuenta aproximadamente del 3% de todos los nuevos diagnósticos de cáncer y del 2.3% de todas las muertes por cáncer (5).
Existe una variaciòn significativa en la presentación según diferencias raciales. La incidencia es 2 veces mayor en individuos blancos que en afroamericanos, pero estos últimos tienen peor pronóstico, presentándose con etapas más avanzadas al diagnóstico (7,8). Por lo tanto, las tasas de mortalidad son significativamente más altas en afroamericanos, pacientes ancianos y en mujeres (9,10).
Alrededor del mundo, las tasas de incidencia más altas son descritas en los hombres en el sur y el oeste de Europa, América del Norte, así como en ciertos países del norte de África o Asia occidental. Las tasas más bajas se observan en África Subsahariana, México y algunos países de Medio Oriente y Asia Central (11). La variabilidad en la incidencia mundial entre distintas zonas geográficas es en parte secundario a la diferencia en la exposición a factores de riesgo como tabaquismo, exposición ocupacional a aminas aromáticas y otros químicos, presencia de arsénico en el agua potable o por infecciones urinarias crónicas endémicas por Schistosoma haematobium, entre otras (12).
La incidencia ajustada para Chile basada en el Primer Informe de Registros Poblacionales de Cáncer de Chile, durante el quinquenio 2003-2007, se estima para el hombre en 5,1 por 100000 habs. (decimoquinto lugar) y 2,2 por 100000 habs. en mujeres (vigésimo lugar) (14).
Información aportada por la base de datos GLOBOCAN muestra una incidencia para el año 2018 en Chile de 1346 casos nuevos con un total de 618 muertes. Esto determina una tasa de incidencia ajustada por edad de 4.5 por 100000 habs. (7.4 para hombres y 2.2 para mujeres) (15). Además, la incidencia de cáncer de vejiga es mucho mayor en la Región de Antofagasta que en el resto del país, debido a la exposición crónica al arsénico (16).
El cáncer de vejiga cuenta con varios factores de riesgo conocidos. El principal es el tabaquismo, estando presente hasta en un 50 a 60% de los casos diagnosticados de cáncer vesical (especialmente para carcinoma urotelial) (17). Así, los fumadores tienen una incidencia de cáncer vesical hasta cuatro veces mayor que las personas que nunca han fumado, existiendo una relación directa entre el tiempo y la cantidad de la exposición, más aún si esta ha ocurrido desde la infancia (18). Junto con el aumento del índice paquete-año se observa aumento del riesgo de desarrollar cáncer vesical, desarrollar una etapa más avanzada y alto grado, aumento de la recurrencia y progresión y aumento de la tasa de mortalidad (19).
Entre los carcinógenos del humo del cigarrillo relacionados con el cáncer de vejiga se incluyen las aminas aromáticas como el 4-aminobifenilo, hidrocarburos aromáticos policíclicos, compuestos N-nitrosos, aminas heterocíclicas y diversos epóxidos, entre otras sustancias. El abandono del hábito tabáquico reduce el riesgo de cáncer vesical, lográndose una reducción de un 40% a los 4 años, y de un 60% a los 25 años luego de haber dejado de fumar, llegando al riesgo basal aproximadamente 30 años después de haber suspendido su consumo (19,20).
La exposición laboral a sustancias químicas ocupa el segundo lugar identificado entre los factores de riesgo de cáncer vesical, pudiendo ser responsables de aproximadamente el 20% de los casos. Dentro de las ocupaciones con mayor riesgo se encuentran aquellos trabajadores expuestos a colorantes anilínicos, a gases y hollín provenientes del carbón y petróleo, a hidrocarburos aromáticos utilizados en la industria química y asfalto, y los expuestos a hidrocarburos alifáticos y acroleína utilizados en colorantes químicos, a las N-nitrosaminas en el caucho y curación del tabaco y otros como el formaldehído. Estos pacientes podrían manifestar un cáncer vesical hasta 20 ó 30 años después. (21,22).
Las ocupaciones laborales asociadas a un mayor riesgo de cáncer vesical incluyen trabajador metalúrgico, camionero, trabajador en la producción de petróleo y carbón, mecánico de automóviles, pintor, trabajador de textiles y cuero, peluquero, trabajador en planta química, trabajador en la producción de caucho y látex, gásfiter, técnico dental y médico (21,22).
Las mujeres sometidas a radioterapia pelviana por tumores ginecológicos corren un riesgo hasta cuatro veces mayor de desarrollar cáncer vesical, sobre todo si se asocia a quimioterapia (con o sin ciclofosfamida) (23). En un estudio de cohortes poblacional realizado en EE.UU. entre 1988 y 2012, se determinó un mayor riesgo de cáncer vesical en varones tratados por cáncer de próstata sometidos a radioterapia externa o braquiterapia, no así en aquellos sometidos exclusivamente a prostatectomía radical (24).
Los pacientes tratados con ciclofosfamida tienen un riesgo hasta nueve veces mayor de desarrollar cáncer de vejiga y se ha observado que el período de latencia del cáncer vesical inducido por ciclofosfamida es relativamente corto (6 a 13 años). Ante mayores dosis de exposición, aumenta el riesgo de cáncer vesical. (23,25).
La exposición al arsénico presente en el agua incrementa el riesgo de cáncer vesical (26). En Chile, la exposición a arsénico en la Segunda Región de Antofagasta se ha correlacionado con una alta incidencia de cáncer vesical (16). En un estudio reciente se observó que estos pacientes presentan un fenotipo más agresivo con mayor proporción de diagnóstico de enfermedad localmente avanzada y de alto grado (27).
La cistitis crónica se asocia a un mayor riesgo de desarrollo de cáncer vesical. En usuarios de catéteres urinarios permanentes y en portadores de cistolitiasis por largo tiempo, se observan con mayor frecuencia neoplasias vesicales. Hasta el 10% de los parapléjicos con catéter vesical permanente desarrollan cáncer, con una notoria mayor probabilidad de carcinoma escamoso (28,29,30).
Por otro lado, la cistitis crónica producida por la esquistosomiasis se asocia principalmente con el desarrollo de carcinoma de células escamosas. En áreas con infección endémica, el carcinoma escamoso fue durante años el tipo histológico dominante. Sin embargo, con las intervenciones de salud pública y a la disminución de la prevalencia de la infección por S. haematobium en las últimas décadas, se ha visto un descenso desde un 78% en el año 1980 a un 27% en el 2005 (con incremento proporcional del carcinoma urotelial) (31).
Si bien se ha observado una ligera tendencia al desarrollo de cáncer vesical entre los familiares de pacientes con antecedentes de carcinoma urotelial y se han comunicado agrupamientos familiares, no existen pruebas epidemiológicas firmes de una causa hereditaria. Pacientes jóvenes (definir – consenso, habitualmente es <50 años) y/o con historia familiar sugerente de Síndrome de Lynch deben ser consideradosa para estudio de línea germinal y evaluación por consejería genética.. Existen varios síndromes tumorales hereditarios asociados con el desarrollo de cáncer de vejiga. Dentro de los síndromes autosómicos dominantes se encuentra el síndrome de Lynch, Muir-Torre (variante del Lynch), Peutz-Jeghers, Cowden, Li-Fraumeni (LFS), Costello y Neurofibromatosis (32).
Otras alteraciones genéticas germinales que aumentan el riesgo de padecer cáncer de vejiga son alteraciones en la metabolización de carcinógenos y por tanto en la detoxificación celular. Dos ejemplos son alteración de N-acetiltransferasa y sus genes NAT 1 y NAT 2 y la Glutatión S-transferasa y sus genes GST (33,34).
En relación con las vías moleculares, se ha descrito que el cáncer de vejiga proviene de dos vías separadas: en tumores no músculo invasores predominan mutaciones en los oncogenes FGFR3 y PIK3CA, así como la pérdida del brazo largo del cromosoma 9 (9q). En tumores músculo invasores , predominan mutaciones en los genes supresores de tumores TP53 y RB1. Recientemente el consorcio The Cancer Genome Atlas (TCGA) identificó subtipos moleculares en pacientes con enfermedad músculo invasora y demostró al menos 4grupos con diferentes alteraciones genéticas, fenotipos y pronóstico (35).
Anatomía patológica del cáncer vesical
Más del 90% de los cánceres de vejiga corresponden a carcinomas uroteliales, , diferenciándose así de otros tipos histológicos como los carcinomas escamosos o los adenocarcinomas.
En 2004, la Organización Mundial de la Salud (OMS) y la Sociedad Internacional de Patología Urológica (International Society of Urological Pathology, ISUP) publicaron una nueva clasificación para catalogar los grados de malignidad de los tumores uroteliales papilares, no invasores (es decir, sin compromiso del músculo detrusor), con la finalidad de lograr mayor uniformidad y exactitud diagnósticas y una mejor correlación con el riesgo potencial, dado que el grado de diferenciación histológica constituye el factor pronóstico más importante para la recurrencia y progresión de los tumores no músculo invasores (36). Esta clasificación fue revisada y actualizada en 2016 (37) y 2022 (38) (4ª y 5ª edición). La clasificación anterior(OMS 1973), clasificaba a las lesiones uroteliales papilares en grados, siendo estas: papilomas (grado 0), tumores bien diferenciados (grado 1), tumores moderadamente diferenciados (grado 2) y, tumores mal diferenciados (grado 3). En la clasificación OMS/ISUP actual se describen las lesiones uroteliales papilares en: neoplasia urotelial papilar de bajo potencial maligno (NUPBPM), carcinoma urotelial papilar de bajo grado (BG) y el carcinoma urotelial papilar de alto grado (AG) (37,38).
El urotelio plano puede exhibir un amplio espectro de atipia, desde reactivo a preneoplásico hasta francamente maligno. El carcinoma no invasivo de tipo plano (es decir, desprovisto de estructuras papilares), se denomina carcinoma urotelial in situ (CIS) y, por definición, es de alto grado. Este consta de células pleomórficas e hipercromáticas grandes, a menudo con pérdida de polaridad celular y apiñamiento. Puede omitirse o malinterpretarse como una lesión inflamatoria durante la cistoscopía, si no se toma biopsia. La citología urinaria es positiva en un 80-90% de los casos. Se presenta en el 25% o más de los pacientes con tumores no músculo-invasores de alto grado, puede ser invasor hasta en un 20-30% de los casos (39) y con alta frecuencia es concomitante con tumores papilares invasores (20-75%). El CIS a menudo es multifocal y si bien puede presentarse en la vejiga, también puede estar presente en el tracto urinario superior, los conductos prostáticos y la uretra prostática (40).
Según el tipo clínico, el CIS puede clasificarse en (41): Primario, que corresponde a un CIS aislado sin tumores papilares previos o concurrentes y sin CIS previo; Secundario, que corresponde a CIS detectado durante el seguimiento de pacientes con tumor previo que no era CIS y; Concurrente, que se refiere a CIS en presencia de cualquier otro tumor urotelial en vejiga.
El papiloma urotelial corresponde a una lesión papilar con un centro fibrovascular delgado cubierto por mucosa vesical normal. Se considera benigno, pues presenta una muy baja tasa de recurrencia y casi nula probabilidad de progresión.
Una NUPBPM corresponde a un tumor fibrovascular papilar recubierto de urotelio hiperplásico, que tiene un riesgo insignificante de progresión (menor al 3,7%) (42).
El carcinoma urotelial papilar de bajo grado muestra atipia celular de bajo grado sobre un cuerpo fibrovascular, mientras que el carcinoma urotelial papilar de alto grado presenta atipia moderada a severa. Este último no sólo tiene un importante riesgo de invasión, sino también un significativo riesgo de recurrencia (mayor al 50%) y de progresión futura a carcinoma músculo invasor (en hasta un 15-40% de los casos) (43).
El carcinoma urotelial invasor, de acuerdo con la nueva clasificación OMS 2022(38), debe ser siempre graduado, a pesar de que en la mayor parte de los casos es de alto grado. La identificación de algunos subtipos morfológicos es fundamental debido a las implicancias en el pronóstico y en el tratamiento.
Actualmente se reconocen los siguientes subtipos de carcinomas uroteliales (CU):
1. CU puro (más del 90 % de los casos).
2. CU con diferenciación divergente parcial (escamoso-glandular o trofoblástica).
3. CU con diferenciación divergente micropapilar.
4. CU con diferenciación divergente anidada/microquística.
5. CU con diferenciación divergente microtubular.
6. CU con diferenciación divergente anidada grande.
7. CU con diferenciación divergente plasmocitoide.
8. CU con diferenciación divergente similar a linfoepitelioma.
9. CU con diferenciación divergente de células gigantes difusa e indiferenciada.
10. CU con diferenciación divergente sarcomatoide.
11. Algunos CU con otras diferenciaciones poco frecuentes
12. CU con NE parcial (diferenciación neuroendocrina, porcentaje a indicar).
13. Carcinoma neuroendocrino puro (incluidos carcinomas neuroendocrinos de células pequeñas y grandes).
El carcinoma de células escamosas es una neoplasia primaria de origen urotelial que contiene islotes celulares queratinizados. Corresponde a aproximadamente el 5% de los tumores vesicales primarios en Occidente, mientras que en países como Egipto, donde la esquistosomiasis es endémica, puede llegar a representar hasta el 75% de los casos (44). Los carcinomas escamosos son causados habitualmente por irritación crónica de la mucosa vesical y su incidencia es aproximadamente 1,5 veces mayor en hombres que en mujeres. Su pronóstico generalmente es malo porque la mayoría de las veces se diagnostica en estadios avanzados.
Los adenocarcinomas de la vejiga corresponden a carcinomas primarios con diferenciación glandular. Constituyen el 0,55 a 2,6% de los cánceres vesicales (45, 46) y son el tipo histológico más frecuentemente asociados a las vejigas extróficas, presentándose en aproximadamente un 10% de estos casos (40, 47). Se clasifican en adenocarcinoma vesical primario, carcinoma del uraco o adenocarcinoma metastásico. Los adenocarcinomas primarios pueden presentar características entéricas, mucinosas o de células en anillo de sello. La mayoría son mal diferenciados e invasores y se diagnostican frecuentemente en estadios avanzados de la enfermedad, por lo que tienen mal pronóstico.
El carcinoma del uraco corresponde a una neoplasia maligna originada en el epitelio vestigial del uraco. La mayoría de las veces corresponden a adenocarcinomas, aunque también pueden ser carcinomas escamosos, carcinomas de células transicionales, tumores neuroendocrinos o sarcomas. Son muy infrecuentes, con una incidencia aproximada del 0,1% (48). Los pacientes con carcinoma del uraco tienen peor pronóstico que aquellos con adenocarcinomas vesicales primarios (49).
Los adenocarcinomas vesicales metastásicos pueden tener su origen en el recto, el estómago, el endometrio, la mama, la próstata y el ovario.
El subtipo micropapilar se presenta sólo en el 0,6 a 8 % de los casos, tiene la particularidad de ser bastante más frecuente en hombres que en mujeres (5-10:1) y la mayoría de las veces se diagnostica en estadios avanzados de la enfermedad (50, 51). Se distribuye en pequeños nidos y agregados de células tumorales dentro de un espacio lacunar que asemejan a la invasión linfovascular (53).
El carcinoma plasmocitoide se caracteriza por células discohesivas individuales con núcleos excéntricos y citoplasma eosinófilo, que confieren una apariencia que imita las células plasmáticas, sin embargo, las células neoplásicas son mucho más grandes y son positivas para la queratina mediante estudios inmunohistoquímicos.
Es importante destacar que el carcinoma plasmocitoide a menudo exhibe un porcentaje variable de células con vacuolas intracitoplasmáticas, con o sin mucina intracelular, que muestran la apariencia de las células en anillo de sello, por lo que debe hacerse el diagnostico diferencial con la afectación vesical secundaria por cáncer de mama lobular o cáncer gástrico de tipo difuso (es decir, células de anillo de sello) (38).
El carcinoma urotelial anidado se caracteriza por que las células tumorales se disponen de forma desordenada en nidos uroteliales pequeños y abarrotados (confluentes). Puede hacer metástasis a los ganglios linfáticos y puede tener un comportamiento clínico agresivo (38,53,54).
El carcinoma microquístico puede tener características mixtas con el carcinoma anidado, pero esa distinción no es crítica siempre que la neoplasia se reconozca como carcinoma urotelial invasivo.
La presencia de subtipos de carcinoma urotelial, sobre todo, los micropapilares, plasmocitoides, sarcomatoides y neuroendocrinos se asocian con un peor pronóstico oncológico, presentando mayor riesgo de progresión y recurrencia (55), todas con un peor pronóstico que el carcinoma urotelial clásico (56, 57,58,59).
De acuerdo con la clasificación OMS 2022 (38), todos los subtipos de carcinoma de urotelial son considerados de alto grado. La presencia de estos subtipos debe reportarse en porcentajes, lo que puede ayudar a la decisión de la mejor terapia para los pacientes.
Clínica y diagnóstico del cáncer de vejiga
La hematuria es el signo cardinal del cáncer de vejiga y en general es asintomática. La hematuria microscópica se define como la presencia de 3 o más glóbulos rojos en el examen de orina completa (60). Ante la presencia de hematuria en una cinta reactiva, el resultado debe confirmarse por medio de un examen de orina completa.
El riesgo de cáncer de urotelio es proporcional a la cuantía de la hematuria, con un riesgo de 1,3% en hematuria microscópica y hasta 6% en hematuria macroscópica (61,62). La hematuria puede encontrarse en la población general entre un 0,19 y un 21% (62,63), y considerando que su estudio se asocia a riesgos y costos, la decisión de estudiarla dependerá de los factores de riesgo individuales (64), además de la presencia o no de una causa benigna evidente. Una vez tratada la causa se debe confirmar la resolución de la hematuria, y en caso contrario, iniciar el estudio. Cabe destacar en este punto que la hematuria no debe atribuirse al uso de anticoagulantes como única causa. En términos generales, todo paciente con hematuria macroscópica debiese ser estudiado dirigidamente para descartar la presencia de un tumor urotelial.
Los tumores vesicales no musculo-invasores rara vez se presentan con dolor. La presencia de síntomas irritativos y hematuria en ausencia de infección urinaria aumenta el riesgo de cáncer de vejiga al doble, lo que se explica por el CIS (65).
El examen físico rara vez mostrará algún hallazgo en cáncer no invasor. En cáncer avanzado podremos encontrar baja de peso, anemia, dolor y/o masa palpable hipogástrica. Es recomendable realizar una palpación bimanual durante una resección transuretral (RTU), sobre todo si el tumor tiene aspecto invasor (66).
El estudio de hematuria incluye cistoscopia y tomografía computada con urografía (). Pudiese incluir citología urinaria, sobre todo ante la sospecha de CIS.
Citología
La citología urinaria consiste en la búsqueda de células con atipias en el centrifugado de una muestra de orina. Es particularmente útil en tumores de alto grado y en el CIS, que son tumores con mayor descamación, dada la falta de adhesividad entre células malignas del urotelio y entre ellas y la membrana basal, condición que no está presente en el urotelio normal (67). Es un examen atractivo ya que no es invasivo, pero dada su sensibilidad global entre 15,8. y 54,5% no se recomienda su uso para tamizaje. Por su alta especificidad de hasta 95-100% en manos expertas, es útil en el seguimiento de tumores de alto grado ya diagnosticados (65). La muestra de orina no debe ser la primera de la mañana dada la presencia de citólisis. La limitante de este examen es que es altamente operador dependiente (68).
El reporte de la citología debe ser realizado de manera estandarizada de acuerdo con el Sistema de París en las siguientes categorías (69):
1) No es posible un diagnóstico adecuado (Sin diagnóstico);
2) Negativo para CU (Negativo);
3) Células uroteliales atípicas (Atipia);
4) Sospechoso de CU de alto grado (Sospechoso);
5) CU de alto grado/G3 (Maligno).
Imagenología
Las imágenes tienen un importante rol en el diagnóstico y estadificación del cáncer de vejiga. Dentro de la información que debemos obtener es primordial determinar si la lesión es no musculo-invasora o musculo-invasora, ya que este es el principal determinante en la elección del tratamiento (70, 71). Otras características importantes que debemos tratar de establecer es la presencia de infiltración tumoral perivesical, lesiones sincrónicas en el tracto urinario superior, adenopatías regionales y metástasis a distancia (70).
Historicamente, la urografría de eliminación se usó para determinar la presencia de lesiones sincrónicas del tracto urinario superior con sensibilidad reportada de entre 50-75% para la detección de lesiones (72), sin embargo el desarrollo de la UroTAC) ha mostrado mejor rendimiento diagnóstico; con sensibilidad, especificidad y certeza de 93,5, 94,8 y 94,2% de la UroTAC versus 80,4, 81,0 y 80,9% de la urografía de eliminación (73).
La ecografía no se utiliza rutinariamente en el diagnóstico y estadificación del cáncer de vejiga, pero en la literatura existen reportes que en condiciones ideales y en operadores expertos alcanza una sensibilidad de entre 61 y 87% y especificidad de hasta 98% (70, 74). Sin embargo, presenta importantes limitaciones en la detección de lesiones pequeñas, en lesiones del domo y cuello vesical y en lesiones en placa (74), además de ser operador dependiente (70).
La UroTAC) es el método de imagen más usado en el estudio de hematuria y en pacientes con diagnóstico de cáncer de vejiga. El protocolo cuenta con fase no contrastada y fases con contraste yodado endovenoso, ya sea multifase adquiriendo fase nefrográfica y de eliminación por separado, o con protocolo split bolus en la cual se realizan dos inyecciones separadas de contraste y las imágenes se adquieren en un tiempo logrando obtener una combinación de ambas fases, lo que disminuye la radiación recibida por los pacientes, particularmente importante en pacientes jóvenes (70). Las lesiones se pueden presentar como engrosamiento parietal en forma de placa, engrosamiento nodular focal, engrosamiento difuso infiltrativo o en forma de lesiones papilares. Las lesiones son sólidas e hipercaptantes de contraste y se identifican como defectos de llene en la fase de eliminación, con reportes de alta sensibilidad y especificidad de hasta 93y 99% respectivamente (72).
Una de las limitaciones del método es su escasa capacidad de diferenciar los diferentes planos de la pared vesical, lo que se traduce en menor certeza en la estadificación local entre 40 y 88% (73). El rendimiento es menor para estadios Ta-T2 (77%), y mayor para estadíos T3-T4 (95%) (74). Otra limitación es la incapacidad de diferenciar tumor de edema y fibrosis post tratamiento. La certeza en la detección de extensión extravesical varía entre 40-92%, con baja capacidad de detectar infiltración neoplásica perivesical de bajo volumen, y de diferenciar edema post tratamiento de infiltración tumoral (73). La detección de adenopatías metastásicas tiene sensibilidad reportada variable, la cual disminuye de manera importante para micrometastasis, sin embargo, con alta especificidad. La tomografía computada también da información relevante en cuanto a presencia de metastasis abdominales.
La resonancia magnética (RM) es el mejor método de imagen para la estadificación local, ya que logra una alta resolución de contraste en tejido blandos, lo que permite detectar de mejor manera que la TC la invasión del musculo detrusor, la extensión perivesical y la invasión a órganos adyacentes (75). El protocolo consta de secuencias T2 de alta resolución de 3-4mm en al menos 2 planos (axial, coronal y/o sagital), secuencia de difusión (DWI) y estudio dinámico con contraste (Gadolinio) en secuencia T1 3D con saturación grasa, logrando una resolución espacial de 30 segundos. Las lesiones son de señal intermedia en secuencia T2 con restricción a la movilidad de protones en secuencia de difusión contrastando con la baja señal del músculo en ambas secuencias. En el estudio dinámico con contraste la capa interna normal de la pared presenta un realce precoz, previo al del tumor, este último sin embargo impregna con mayor intensidad que el músculo detrusor (76).
En 2018 fue publicado el Vesical Imaging-Reporting and Data System (VI-RADS), que busca estandarizar la adquisición y reporte de la resonancia de vejiga, mediante un enfrentamiento sistemático y definiendo el riesgo de invasión muscular, siendo aplicable a pacientes no tratados y a pacientes con RTUl diagnóstica. El sistema de puntuación va desde VI-RADS 1 al 5, lo que se traduce en “altamente improbable invasión muscular” a “alta probabilidad de invasión muscular y extravesical” respectivamente (76). Usando este método, Wang reportó un área bajo la curva ROC para invasión muscular de 0,94, con sensibilidad y especificidad para VI-RADS 3 (invasión equivoca) o mayor de 87,1 y 96,5% respectivamente (77).
Finalmente, el PET-CT con FDG tiene su principal uso en la detección de compromiso linfonodal con sensibilidad de 69% y especificidad de 95%, y de metástasis fuera de la pelvis con sensibilidad y especificad de hasta 70% y 94% respectivamente en pacientes con invasión muscular (73).
Cistoscopía
La cistoscopía es el estándar de oro en el diagnóstico del cáncer de vejiga. Permite evaluar la uretra y vejiga bajo visión directa logrando diagnosticar tumores planos y papilares pequeños que no pueden observarse en estudios de imágenes. Es un examen que requiere cierta experticia por parte del operador, un instrumento adecuado que permita observar la vejiga en su totalidad e iluminación adecuada. Es ideal disponer de un elemento flexible y de no haberlo, efectuar el estudio endoscópico con instrumento óptico de visión lateral (30º o 70 º).
La cistoscopía esta indicada en todos los pacientes con hematuria mayores de 35 años y/o que tengan factores de riesgo de cáncer urotelial (65), y permite detectar aproximadamente un 90% de tumores vesicales (78). La tasa de tumores no detectados se explica por presencia de CIS poco evidente, tumores muy pequeños, hematuria concomitante u otros problemas técnicos. Por otro lado, en ocasiones es difícil diferenciar entre procesos inflamatorios y tumores planos o no papilares.
Se han desarrollado diferentes técnicas con el objeto de aumentar el rendimiento del estudio endoscópico, y han demostrado tener impacto clínico al aumentar la tasa de detección y disminuir las recurrencias, pero no la progresión cuando se usan durante la RTU (diagnóstico fotodinámico, uso de imágenes de banda estrecha) (79).
Exámenes urinarios con biomarcadores
El objetivo de estas herramientas es ayudar en la detección de tumores vesicales de forma no invasiva y costo-efectiva, y buscan complementar o incluso reemplazar la cistoscopia. Los marcadores que han sido aprobados por la FDA mejoran la sensibilidad de la citología a expensas de la especificidad, pero no han logrado reemplazar la cistoscopia aún. Los siguientes han sido aprobados para uso clínico (80):
BTA (Bladder Tumor Antigen) stat (S 57–83%, E 60–92%) y BTA TRAK (S 66%, E 65%): Detectan el factor H del complemento en orina producido por células tumorales como mecanismo para evadir el sistema inmune. BTA stat es cualitativo, rápido y barato. BTA TRAK es cuantitativo, engorroso y requiere personal entrenado. Ambos pueden ser usados como complemento a la cistoscopía, pero no como herramienta de diagnóstico primario.
NMP 22 (Nuclear Matrix Protein) BC y BladderChek (Ambos con S 47–100%, E 78%): Detectan la proteína NMP 22 que se expresa más en células tumorales uroteliales, por lo que se libera en mayores concentraciones en orina por apoptosis tumoral. Ambos están aprobados para uso en seguimiento y el segundo para diagnóstico en pacientes con síntomas o factores de riesgo.
uCyt (S 50–100%, E 69–79%): Utiliza anticuerpos monoclonales fluorescentes para detectar células uroteliales en la citología urinaria. Tiene mejor sensibilidad y menor especificidad que la citología, y su sensibilidad aumenta con el aumento del grado histológico. Es operador dependiente y requiere equipamiento especial.
UroVysion (S 41–70%, E 80%): Usa FISH (Fluorescence in situ hybridization) para detectar aneuploidías de los cromosomas 3, 7 y 17, y pérdida de un locus del gen supresor de tumores P16. Está aprobado para diagnóstico y seguimiento, requiere equipamiento especial y personal entrenado en su interpretación. Un estudio (81) mostró que 85% de pacientes con falsos positivos presentarán tumores vesicales en los 12 meses siguientes al examen, por lo que podría identificar cambios premalignos. Además, permitiría discriminar resultados equívocos en citología, y tendría un valor pronóstico de respuesta a BCG, ya que un resultado positivo al final de BCG se asociaría a falla de tratamiento y progresión.
Existen varios biomarcadores promisorios de última generación en desarrollo que aprovechan los avances en secuenciación y bioinformática para identificar alteraciones genéticas, epigenéticas (metilación regulatoria del DNA – UroMarx, AssureMDX), transcriptómicas (estudio del set de moléculas de RNA de una célula – Cxbladder Monitor, XPERT BC Monitor) y proteómicas (ADXBLADDER), logrando mejorar la sensibilidad y especificidad. En el caso de AssureMDX, en pacientes con hematuria se logró una sensibilidad de 93%, especificidad 86%, VPN 99%, con una disminución de 77% de cistoscopias innecesarias (82). Estos marcadores requieren validación prospectiva para su uso en clínica.
Resección transuretral de vejiga
El diagnóstico definitivo estará dado por el informe histopatológico del material obtenido a través de RTU con equipo monopolar o bipolar. Los detalles de esta cirugía serán abordados más adelante en la sección de Tratamiento.
Etapificación
La clasificación TNM ha sido ampliamente aceptada para la etapificación del cáncer vesical (ver tabla), definiendo la extensión tumoral (T), la presencia de linfonodos (N) y presencia de metástasis (M). (56).
Además de la clasificación TNM, actualizada en el año 2017, es fundamental su clasificación según grado histológico, dado que afecta su progresión y recurrencia. Se debe utilizar la clasificación OMS de 2004 que ha sido actualizada en 2016 y 2022 (38). De acuerdo con esta clasificación, la profundidad y la extensión de la invasión de la lámina propia (subestadificación T1), debería ser reportada, dado que se ha demostrado 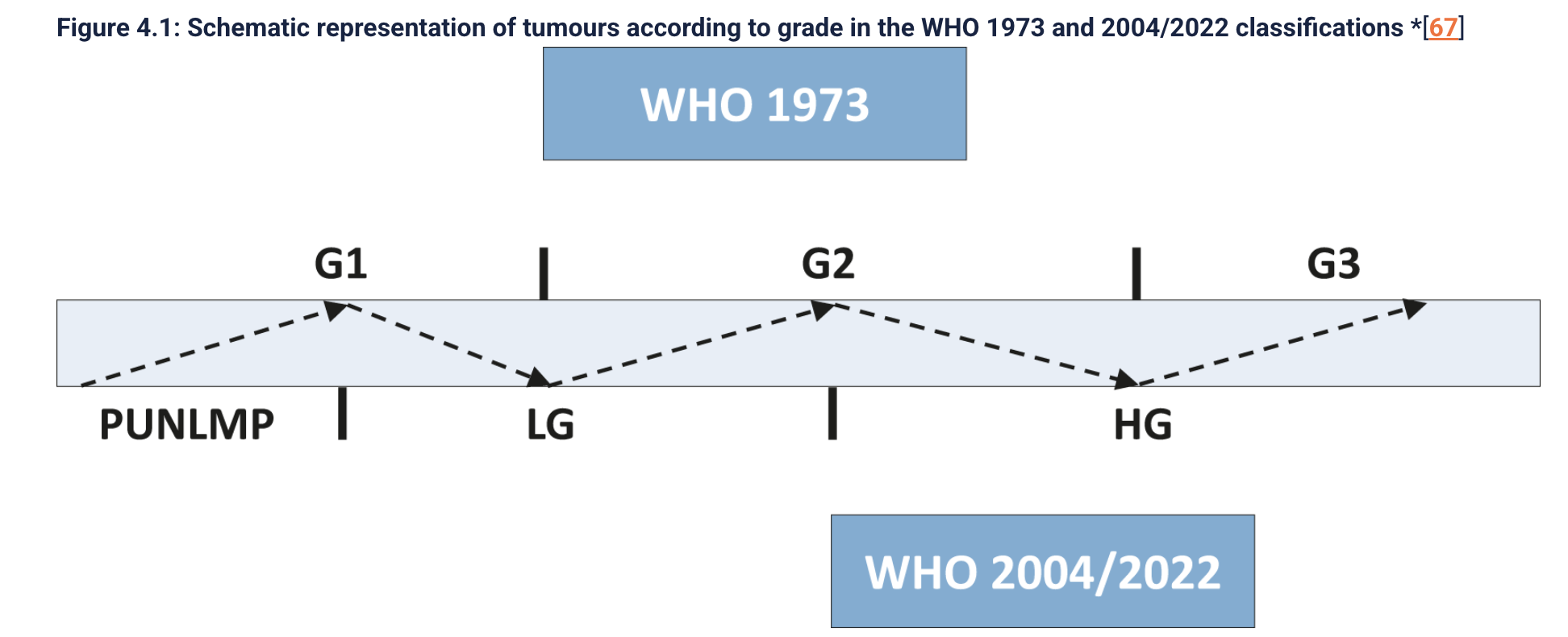 su valor pronóstico. (83)
su valor pronóstico. (83)
Fig.1 Representación esquemática de tumores de acuerdo con el grado
El método para su reporte, que aún no ha sido bien definido, podría ser basado en principios micrométricos (pT1e y T1m) o histoanatómicos (T1a/T1b) (56)
Resección quirúrgica endoscópica (RTUV)
La resección transuretral del tumor vesical (RTUV) es el pilar del diagnóstico y tratamiento del cáncer vesical. El objetivo principal de este procedimiento es realizar un correcto diagnóstico y la remoción de todas las lesiones visibles en los casos de tumores Ta o T1. En los casos de estadios mayores, la certificación del compromiso muscular es de la mayor importancia.
Aspectos técnicos
La RTUV debe ser realizada bajo anestesia espinal o general, de acuerdo con la tecnología usada en la resección (monopolar o bipolar) y las características del paciente. La anestesia regional, permite la identificación precoz de complicaciones (perforación intraperitoneal, síndrome post RTU). La anestesia general con bloqueo muscular es recomendada en caso de la presencia de tumores vesicales laterales, para disminuir la probabilidad de lesión vesical por reflejo obturador (84).
Todo paciente sometido a una RTUV debe tener un urocultivo preoperatorio y en caso de ser positivo, este debe ser tratado previo al procedimento (84). La profilaxis antibiótica está recomendada en todo paciente sometido a una RTUV, a pesar de la escasa evidencia disponible. De acuerdo con Trincheri y cols (85) el riesgo de infección urinaria post RTUV es de 39% sin el uso de antibióticos profilácticos. Mac Dermott et al encontraron una disminución de las tasas de bacteriuria en pacientes en pacientes que recibían profilaxis antbiótica previo a RTU-V (86).
Previo al inicio de la instalación de los campos estériles, la realización de una palpación bimanual meticulosa está recomendada. Esta maniobra permite precisar la presencia de una masa palpable y de su relación con estructuras vecinas (65). La persistencia de masa post RTUV y o la fijación a planos vecinos, podría sugerir la presencia de una enfermedad localmente avanzada. En caso de la presencia de un tumor pequeño o de apariencia no invasora en la cistoscopía diagnóstica, este procedimiento puede ser omitido.
La resección debe ser precedida de una cistoscopía meticulosa, con la visualización de todas las paredes vesicales, con el fin de poder identificar todas las lesiones macroscópicas y planificar el procedimiento. Debe ser realizada con un resectoscopio con óptica de 30º grados, permitiendo así la visualización del asa de resección. La vejiga debe ser llenada lo suficiente para separar sus paredes y permitir la visualización del o los tumores. El uso de resectoscopios de flujo continuo puede ayudar a disminuir los movimientos de las paredes vesicales y disminuir el adelgazamiento del detrusor que se produce con la sobredistensión vesical (87). El uso de video cámara para la RTUV permite magnificar la imagen, ayudar en la docencia, documentar los hallazgos y disminuir la exposición del cirujano a los fluidos corporales (88).
Los tumores de ≤ 3 cm, pueden ser resecados en bloque incluyendo la zona exofítica y base junto con el lecho tumoral. En el caso de tumores cuya apariencia sea de bajo grado o que tenga historia de lesiones pTa de bajo grado, una resección profunda no es necesaria (89). En tumores de mayor tamaño, la porción exofítica, los bordes del tumor y el lecho deben ser resecados de manera independiente. Esta separación es fundamental para poder realizar una correcta etapificación local y, además, asegurar la resección de toda la lesión (56). Alternativamente, para muestreo del lecho, se puede realizar una toma de biopsia fría de este.
En el protocolo operatorio, las características del tumor deben ser descritas (tamaño, número, apariencia, ubicación), al igual que si la resección de la lesión fue o no completa. Estos son algunos de los elementos para poder establecer el perfil de riesgo de los pacientes, de acuerdo con las tablas de EORTC (90). La presencia de músculo en la muestra es fundamental para la correcta etapificación y tratamiento del cáncer vesical no-músculo invasor. La ausencia de este elemento se correlaciona con enfermedad residual y con recurrencia precoz de la enfermedad (91).
La RTUV se puede realizar de la manera tradicional, con instrumentos monopolares usando soluciones de irrigación hipotónicas, o con equipos bipolares, los que permiten el trabajo con soluciones fisiológicas. La ventaja de estos últimos serían la menor tasa de complicaciones, como estimulación del nervio obturador, perforación vesical y sangrado, en comparación con el uso de energía monopolar, manteniendo la eficacia oncológica (92-94).
Nuevas tecnologías
Diagnóstico fotodinámico: El diagnóstico fotodinámico se realiza utilizando luz violeta después de la instilación de ácido 5-aminolevulínico o ácido hexaminolevulínico. Estas técnicas pretenden visualizar de mejor manera lesiones que son invisibles a la endoscopía de luz blanca tradicional. Trabajos con nivel de evidencia 2A han demostrado que la biopsia realizada con diagnóstico fotodinámico es más sensible que la convencional para la detección de tumores, especialmente para la detección de carcinoma in situ (CIS) (92 vs 71% a nivel de paciente y 93 versus 65% a nivel de biopsias) (95,96). Una revisión sistemática y análisis de 14 ensayos randomizados, que incluyó 2.906 pacientes, reportó una disminución del riesgo de recurrencia de cáncer vesical a corto y largo plazo. Sin embargo, no hubo diferencias en las tasas de progresión y mortalidad (97).
Imágenes de banda estrecha (Narrow band imaging, NBI): La mayor densidad de los vasos sanguíneos del tejido tumoral es utilizada para diferenciarlo del urotelio normal. Se usa la banda del color azul y verde que es absorbida por los vasos superficiales y subepiteliales respectivamente, permitiendo crear una imagen de alto contraste de la superficie vesical. Las tasas de detección con el uso de esta tecnología aumentarían en 14-17% en comparación a la luz blanca tradicional (98,99). Un meta-análisis reciente muestra una sensibilidad y especificidad para la detección de tumores vesicales de 94 y 85% para NBI y de 85 y 87% para la cistoscopía convencional (100). En el caso del CIS, las diferencias son más marcadas, con una sensibilidad de 93 y 77% para NBI y cistoscopía convencional (101). En el contexto de una segunda RTUV, se ha reportado hasta una 13% de mayor detección con el uso de NBI (101). Aparentemente las tasas de recurrencias y el tiempo a la recidiva serían mejores con NBI vs cistoscopía de luz blanca clásica (32% menos recurrencias y 15 meses de mayor sobrevida libre de enfermedad) (98, 99, 102). Un ensayo randomizado evaluó la reducción de las tasas de recurrencia al utilizar NBI durante la RTU V. Solo se observó un beneficio después de 3 y 12doce meses para los tumores de bajo riesgo (pTa / LG, <30 mm, sin CIS) (103).
Técnicas de alta definición: Los equipos endoscópicos de alta definición proporcionan una mejor resolución que los instrumentos tradicionales (>5 veces). Estos equipos permiten mejorar el contraste y la intensidad de la luz, pudiendo generar imágenes casi tridimensionales. Además, el filtro de la imagen, la función de zoom y el formato de 16:9, permite una mejoría de la imagen >30%, lo que se traduciría en una mejor identificación de las estructuras (104). Sin embargo, no existe evidencia suficiente que demuestre un mejor resultado clínico con el uso de estas técnicas.
Resecciones en Bloc
El problema de la correcta etapificación local y las tasas de recidivas, han motivado la creación de nuevas estrategias de resección. La resección en bloc, al tener menos manipulación y dispersión del tumor que la RTUV, teóricamente, podría mejorar los resultados de la etapificación y de las tasas de recurrencia (104). El principio de la resección en bloque es realizar una incisión alrededor del tumor con un margen de seguridad, para posteriormente remover el tumor y el lecho de manera roma. Existen diversas técnicas descritas, usando corriente monopolar o bipolar (105), láser de holmium (106), o tulium (107), o verde KTP, e inyecciones de jet de agua (108). Estas técnicas proporcionan muestras resecadas de alta calidad con la presencia de músculo detrusor en el 96-100% de los casos. (56). La superioridad de la resección en bloque en comparación con la RTUV clásica es aún debatible. De acuerdo a una revisión sistemática de 1142 pacientes (109) y un ensayo randomizado controlado de un centro (110) se demostró una tasa similar de presencia de músculo detrusor en la pieza operatoria, en ambas técnicas. Sin embargo, otro metaanálisis (111) y un ensayo controlado multicéntrico (112) mostraron una mayor tasa de presencia de músculo detrusor en el grupo de pacientes sometidos a resección en bloc versus RTUv.
En cuanto a los resultados oncológicos, dos de estos ensayos controlados aleatorizados, no mostraron diferencia en el tiempo hasta la recurrencia entre ambas técnicas (110, 112), resultados que se replican en dos revisiones sistemáticas (109,111). Sin embargo, en un ensayo controlado aleatorizado, la resección en bloque resultó en una reducción significativa de la tasa de recurrencia al año, del 38,1 al 28,5%, en pacientes con tumores < 3 cm (113).
Segunda RTUV
La persistencia de tumor residual y la subetapificación es un hecho que ha sido demostrado en pacientes con cáncer de vejiga sometidos a RTUV (114). En pacientes con tumores T1, se ha observado enfermedad residual en hasta 53% y en pacientes con tumores G3 en 41% (88, 115-120). Incluso en enfermedad pT1, el porcentaje de pacientes con enfermedad real pT2 fluctúa entre 4-50% de acuerdo con la literatura (88).
Dvirik y cols en un estudio prospectivo y randomizado, demostraron el beneficio de la segunda resección en pacientes con cáncer de vejiga no musculo invasor (119). Un total de 142 pacientes con carcinoma urotelial de vejiga pT1 de reciente diagnóstico fueron randomizados a recibir una segunda resección + mitomicina C intravesical adyuvante vs mitomicina C intravesical adyuvante sin segunda RTUV. Los pacientes con resección incompleta, CIS y con enfermedad músculo invasora fueron excluidos del estudio. Después de un seguimiento medio de 31 meses, se observó una mayor tasa de recidiva y de progresión de la enfermedad en lo pacientes que no fueron sometidos a segundaRTUV (63 vs 25% y 12 vs 4%, respectivamente).
Por estas razones una segunda RTUV está indicada en los siguientes casos (56):
RTUV inicial incompleta.
Ausencia de músculo en la muestra, con excepción de los pacientes con tumores TaG1 o CIS primario.
Todos los pacientes con diagnóstico de tumores T1.
Todos los pacientes con tumores de alto grado/G3, con excepciónn de CIS primario.
La segunda RTUV debe ser realizada dentro de las 6 semanas postoperatorias y debe incluir la resección del lecho operatorio.
Biopsias vesicales o de uretra prostática
El CIS puede manifestarse como zonas eritematosas en placas, sin embargo, puede ser completamente invisible a la cistoscopía. La biopsia randomizada de mucosa vesical no está indicada en todos los casos. En un estudio de EORTC, 393 pacientes con tumores únicos pTa o pT1, solo el 1,5% presentaron CIS en las biopsias randomizadas (122). En otros estudios, con pacientes de similares características, el CIS fue diagnosticado hasta en 14% (123,124). Las biopsias randomizadas deberían ser tomadas solamente en pacientes con citología urinaria positiva, sin tumor vesical visible (56). Las biopsias deben ser tomadas del trígono, cúpula vesical, pared vesical derecha, izquierda, anterior y posterior. En estos pacientes el tracto urinario superior debe ser estudiado en busca de tumores.
En pacientes con tumores T1G3, la incidencia de compromiso de uretra próstatica por CIS reportada es de 12% (125). El riesgo del compromiso de urotelio prostático es mayor en caso de tumores presentes en trígono, cuello vesical, CIS vesical y tumores vesicales múltiples, por lo que la biopsia en esta zona estaría indicada (126,127).
La biopsia de uretra prostática está indicada, además, cuando la citología urinaria es positiva y no hay evidencia de tumor vesical; en caso de presencia de lesiones sospechosas a nivel de uretra prostática (56) o cuando el paciente es eventual candidato a una derivación urinaria ortotópica (66).
RTUV en casos especiales
CIS extenso: Frente a la presencia de lesiones extensas sospechosas de CIS, no se recomienda una resección y cauterización amplia de estas. Se debe realizar muestreo suficiente para el diagnóstico, dado que la terapia definitiva son las instilaciones intravesicales (84).
Tumores en orificio ureteral: La resección de estos tumores debe ser realizada con corriente de corte y usando una mínima coagulación para disminuir el riesgo de estenosis. Se puede dejar instalado un catéter ureteral para evitar la obstrucción por edema. Sin embargo, no hay evidencia que esta maniobra disminuya el riesgo de estenosis (123).
Tumores en pared vesical anterior: Las lesiones en esta ubicación pueden ser desafiantes desde el punto de vista técnico. La aplicación de presión manual en la región suprapúbica puede facilitar la resección (84).
Tumores en divertículo vesical: Las lesiones que presentan esta ubicación presentan un desafío terapéutico. Debido a la ausencia de muscular propia, no se puede obtener información con respecto a la invasión de esta capa tisular. Además, resecciones profundas de estos tumores presentan un alto riesgo de perforación de la pared vesical. Se recomienda en los casos de presentar lesiones de alto grado o extensas, la realización de una tumorectomía vía abierta (diverticulectomía o cistectomía parcial) o cistectomía radical (84). Por su parte, lesiones pequeñas de bajo grado, podrían ser manejadas con resección y fulguración cuidadosa, junto a terapia intravesical cuando corresponda.
Tratamiento intravesical
Dentro de las alternativas terapéuticas del cáncer vesical no músculo invasivo, existen los tratamientos intravesicales. El objetivo de éstos, es disminuir la posibilidad de progresión y recurrencia de la enfermedad y están indicados en los pacientes con tumores múltiples, recurrencias frecuentes, enfermedad de alto grado, citología positiva post-RTU y CIS.
Los tratamientos más usados son intra Quimioterapia e Inmunoterapia.
Quimioterapia
Existen varios agentes quimioterápicos que se han utilizado para la instilación intravesical, dentro de los cuales están la mitomicina C y las antraciclinas epirrubicina y doxorrubicina, presentando similares resultados y toxicidad. Una de las más utilizada es la mitomicina C (40mg). (128). En los últimos años la gemcitabina, ha emergido como una excelente alternativa, dado su buen perfil de toxicidad. (129)
Instilación única post-RTU: Se debe efectuar dentro de las primeras 24 horas. Beneficia principalmente al subgrupo de pacientes de bajo riesgo, disminuyendo la posibilidad de recurrencia en un 14% (56, 130).
Está indicada después de toda RTUV, a menos que exista perforación evidente durante el procedimiento o que el tumor sea clínicamente músculo-invasor (56). El efecto puede explicarse por la destrucción de las células tumorales circulantes, inmediatamente después de la RTU, o como un efecto ablativo (quimiorresección) de las células tumorales residuales en el lugar de la resección y sobre pequeñas lesiones inadvertidas.
En pacientes con un puntaje EORTC para recurrencia ≥5 ( o en pacientes con tasa de recurrencia inferior a 1 año, no se ha visto beneficio de la instilación única post RTU.
Instilaciones intravesicales adyuvantes: La quimioterapia intravesical previene la recurrencia, pero no la progresión de los tumores vesicales en pacientes de alto riesgo. Por lo tanto, está indicada en tumores de bajo riesgo, pero con alta tasa de recurrencia (Por ejemplo, tumores múltiples de bajo grado – ver nomogramas) (56). No está claro aún el esquema ideal, pero habitualmente se recomienda realizar instilaciones semanales durante 6 semanas, sin necesidad de repetir dosis más adelante.
.
Inmunoterapia
En el contexto del tratamiento inmunomodulador de la enfermedad neoplásica se encuentra, como uno de los máximos exponentes, el tratamiento del carcinoma vesical con el Bacilo de Calmette-Guerin (BCG). Los mecanismos de acción intrínsecos de la BCG intravesical se caracterizan por desempeñar un papel modulador del sistema inmune y, más concretamente, de sus mecanismos efectores antitumorales. Estos mecanismos incluyen tanto elementos moleculares como celulares. A nivel molecular es conocida la participación de IL2, IL12 e INF gamma. A nivel celular, se han descrito incrementos en el número total de células Natural Killer (NK), linfocitos y monocitos.
La BCG es superior a la quimioterapia intravesical al disminuir el riesgo de progresión en un 27% y reducir en un 32% el riesgo de recurrencia, siempre y cuando se utilice el esquema de mantención, aunque con mayor toxicidad respecto a la Quimioterapia (56, 131).
La indicación de tratamiento con BCG se realiza en los tumores con alto riesgo de progresión, como el CIS, tumores de alto grado (o G3) o en recurrencias posterior a tratamiento con Quimioterapia (ver tablas de riesgo)
Esquema recomendado de BCG:
Instilación semanal por 6 semanas.
Refuerzos a los 3-6-12-18-24-30 y 36 meses (refuerzo: 1 instilación por semana, por 3 semanas).
Diversas cepas de BCG son usadas para este tratamiento (Danish, TICE, Connaught, Tokyo, etc.). En nuestro país, la más usada, corresponde a la cepa Danesa. Al parecer, el tipo de cepa no tendría influencia en los resultados oncológicos y no se ha logrado demostrar superioridad de alguna cepa sobre otra. (132)
La dosis es un aspecto fundamental en la obtención de resultados oncológicos óptimos. Se han realizado múltiples estudios, que sugieren, sin ser absolutamente categóricos, que el uso de dosis completa tendría el mejor resultado oncológico (133, 134)
La EORTC no encontró diferencias en la toxicidad entre un tercio de la dosis de BCG y la dosis completa, pero la dosis de un tercio de BCG se asoció con una mayor tasa de recurrencia, especialmente cuando se administró solo durante un año (134). El estudio CUETO comparó un tercio de la dosis con la dosis completa de BCG sin encontrar diferencias en la eficacia. Un tercio de la dosis estándar de BCG podría ser la dosis mínima eficaz para tumores de riesgo intermedio. Sin embargo, la reducción a un sexto de la dosis se asoció con una disminución de la eficacia manteniendo los niveles de toxicidad. Un metanálisis de trabajos randomizados controlados mostró que pacientes que recibieron menos de la mitad de la dosis estándar de BCG experimentaron menos eventos adversos que los grupos tratados con dosis estándar, pero presentaron una mayor tasa de recurrencias (135). Otros resultados como sobrevida global y cáncer especifica fueron similares.
Por estos motivos, la Guía de Práctica Clínica del MINSAL recomienda, para pacientes con cáncer de vejiga NMI de alto riesgo, usar BCG dosis completa y por 3 años por sobre BCG dosis no completa y/o por menos de 3 años (136).
Fallas de terapia intravesical con BCG
Es fundamental la identificación de pacientes que presentan una recurrencia de tumores durante o posterior al tratamiento con BCG, para poder plantear un tratamiento adecuado. El uso persistente de BCG, en algunos de estos pacientes se asocia con aumento del riesgo de progresión (137).
Se han definido diversas categorías en pacientes que presentan falla a BCG, para poder estandarizar los mejores tratamientos. De acuerdo con las guías EAU de cáncer vesical, se reconocen los siguientes grupos(56).
Tumor refractario a BCG:
- Si el tumor T1 alto grado/G3 está presente a los 3 meses
- Si el tumor Ta alto grado/G3 está presente después de 3 meses y/o a los 6 meses, tras la reinducción o el primer ciclo de mantenimiento.
- Si el CIS, está presente a los 3 meses y persiste a los 6 meses tras la reinducción o el primer ciclo de mantenimiento. En los pacientes con CIS presentes a los 3 meses, un ciclo adicional de BCG puede lograr una respuesta completa en más del 50 % de los casos
- Si aparece tumor de alto grado durante el tratamiento de mantenimiento con BCG*.
Tumor recidivante con BCG
- Recurrencia del tumor de alto grado/G3 tras finalizar el mantenimiento con BCG, a pesar de una respuesta inicial.
Tumores que no responden a la BCG
- Los tumores que no responden a la BCG incluyen todos los tumores refractarios a la BCG y aquellos que desarrollan recurrencia de alto grado T1/Ta dentro de los 6 meses posteriores a la finalización de una exposición adecuada a la BCG** o desarrollan CIS dentro de los 12 meses posteriores a la finalización de una exposición adecuada a la BCG.
Tumor expuesto a BCG
- Si se detecta Ta alto grado/G3 o CIS en la evaluación a los tres meses de la inducción, solo con BCG.
- Recaída tardía tras una dosis adecuada o inadecuada de BCG.
Intolerancia a la BCG.
- Efectos secundarios graves que impiden la instilación adicional de BCG antes de completar el tratamiento.
Opciones de tratamientos de pacientes con falla a BCG
Tumor que no responde a BCG: El tratamiento recomendado para los pacientes que no responden a BCG, es la cistectomía radical. (56). Existen alternativas para pacientes que deseen preservar la vejiga o que no estén en condiciones de ser sometidos a una cistectomía. Sin embargo, desde el punto de vista oncológico son consideradas inferiores (56).
Las alternativas son:
Quimioterapia intravesical secuencial, como por ejemplo gemcitabina + docetaxel (138).
Instalaciones intravesicales asistidas por dispositivos especiales (mitomicina C combinado con hipertermia inducida por microondas) (56).
Nuevas terapias, tales como pembrolizumab (139) nadofaragene firadenovec (140), erdafitinib (141) y Nagopendekin alfa-inbakicept (142)
Cistectomía radical
La cistectomía radical es el tratamiento estándar de los pacientes con cáncer de vejiga músculo invasor localizado, cuyo objetivo es la erradicación de la enfermedad loco regional (143). Esta cirugía está indicada en los pacientes con enfermedad T2-T4a, N0-Nx, M0. Además, está indicada en los casos de pacientes con tumores superficiales de alto riesgo, recidivantes, CIS resistente a BCG, tumores superficiales extensos que no pueden ser controlados con RTUV y tratamiento intravesical (144). También son indicaciones de cistectomía radical, la recurrencia de tumores tratados con cistectomía parcial, o falta de respuesta a terapia trimodal de vejiga (144). En el contexto de pacientes con enfermedad avanzada, puede ser usada como paliación de síntomas (hematuria incoercible, fístula, dolor intratable).
Técnica quirúrgica
La cirugía, clásicamente, debe incluir en el caso de los pacientes de sexo masculino la extracción de la vejiga y el tejido perivesical circundante, la próstata y vesículas seminales y uréteres distales (144). En el caso de que el paciente sea candidato a una derivación urinaria ortotópica, la preservación de la uretra membranosa, el rabdoesfínter y los nervios pélvicos, es fundamental. En pacientes con tumores unilaterales, la preservación del lado contralateral debe ser realizada (145).
Existen otras variaciones a la técnica estándar, como la preservación de partes de la próstata, y/o, vesículas seminales, cuyo fin es la preservación de funciones fisiológicas como fertilidad, potencia sexual y continencia (146). Estas variaciones deben ser juzgadas tomando en cuenta el potencial riesgo oncológico que conllevan. Se ha reportado un riesgo de cáncer de próstata incidental de 23-54%, de los que hasta un 29% serían tumores clínicamente significativos (147-149).
Ong y cols. (150) reportaron el resultado de un grupo de 31 pacientes sometidos a cistoprostatectomía radical con sustitución vesical ileal ortotópica, conservando la cápsula prostática y las vesículas seminales. Después de una mediana de seguimiento de 18 meses, el 93% de los pacientes presentaron continencia diurna completa y 79% presentaban erecciones con y sin uso de medicamentos orales. Estas variaciones técnicas no han sido evaluadas prospectivamente y su seguridad oncológica aún no está completamente definida (84).
En el caso de las pacientes de sexo femenino, la cistectomía radical incluye, además de la vejiga, la remoción de los ovarios, útero, cérvix y pared vaginal anterior (65). Sin embargo, en pacientes jóvenes o con vida sexual activa y que, desde el punto de vista oncológico presenten tumores sin compromiso invasivo en el área del trígono, o en las paredes posterior o laterales, la preservación del útero, anexos y pared vaginal anterior puede ser realizada (151).
Linfadenectomía pelviana
La linfadenectomía es parte integral del tratamiento de la enfermedad locoregional, dado que los pacientes con cáncer músculo invasor, sometidos a cistectomía radical, presentarán linfonodos comprometidos en hasta un 25% (152). Este procedimiento quirúrgico es el que permite realizar la etapificación más exacta del status linfonodal del paciente y, además, tiene un rol terapéutico. El beneficio en el pronóstico en pacientes con cáncer de vejiga músculo invasor ha sido demostrado en trabajos retrospectivos que comparan pacientes sometidos a cistectomía radical con y sin linfadenectomía (153-155).
En la literatura se han reportado diversos tipos de linfadenectomías, que varían en la extensión del territorio de linfonodos a remover. Se reconocen cuatro tipos (156,157):
Limitada (LL): comprende el tejido de la fosa obturatriz.
Standard (LS): hasta las arterias ilíacas comunes.
Extendida (LE): hasta las arterias ilíacas comunes, en el cruce con los ureteres o hasta la bifurcación de la aorta.
Super-extendida (LSE): Hasta la arteria mesentérica superior.
El límite lateral para los distintos tipos de linfadenectomías es el nervio génitofemoral, el distal la vena circunfleja, el ligamento lacunar y el linfonodo de Cloquet. El borde medial, el nervio obturador para la limitada y para las otras la pared vesical. En la linfadenectomía extendida y superextendida, el borde lateral corresponde al nervio génitofemoral, incluyendo la fosa de Marcille (dorsolateral a la bifurcación de los vasos ilíacos comunes y dorsal a la vena ilíaca externa) (158).
Durante mucho tiempo, la literatura apoyaba la realización de linfadenectomías extendidas o super extenidas, dado que había una tendencia a un mejor pronóstico oncológico y un mayor conteo de linfonodos (157, 159,160, 161). Sin embargo el estudio SWOG S10011 (162), mostró que no hay una diferencia en el pronóstico oncológico, al comparar pacientes sometidos a linfadenectomía standard versus extendida e incluso este último grupo se asocia a mayor morbi-mortalidad perioperatoria. Las recomendaciones de las guías clínicas actuales es la realización de una linfadenectomía pelviana standard (143).
El tiempo de espera para realizar la cistectomía es una variable que considerar, en el pronóstico de los pacientes con cáncer vesical músculoinvasor. Ayres y cols. (163) reportan que el retraso de la cistectomía en >90 días en pacientes con enfermedad pT2, genera un impacto en la sobrevida (n = 543; HR 1,40, 95% IC 1,10-1,79). Gore y cols. (164) evaluaron pacientes sometidos a cistectomías desde 1992 a 2001 de la base de datos SEER y encontraron que un retraso de 12 semanas en la cirugía estaba asociado a un peor pronóstico.
Cistectomía laparoscópica / laparoscópica asistida por robot
El abordaje mediante cirugía laparoscópica tradicional o asistida por robot es una alternativa realizable en pacientes con cáncer de vejiga músculo invasor. La cistectomía laparoscópica (CRL) es una técnica difícil, que requiere habilidades avanzadas y cuya curva de aprendizajes es larga (165).
Aboumazourk y cols. (166), realizaron una revisión sistemática de la literatura cuyo objetivo fue comparar los resultados de la CRL con la técnica abierta (CRA). Se incluyeron un total de 427 pacientes (211 CRL, 216 CRA). Se observó que la CRL, en comparación con la CRA, presentaba un mayor tiempo operatorio, menor sangrado, menor tiempo para la recuperación de la ingesta oral, menor requerimiento de analgésicos, menor tiempo de hospitalización y menor número de complicaciones menores. No se reportaron diferencias con respecto a número de linfonodos resecados, complicaciones mayores, márgenes positivos, resultados patológicos, recurrencias locales y a distancia. El problema principal de este metaanálisis es la inclusión de trabajos no randomizados, con número limitado de pacientes (la mayoría con menos de 20 pacientes y ninguno con más de 50 pacientes). Otros sesgos incluyen: menor edad del grupo de pacientes sometidos a CRL y menores índices de comorbilidad en el grupo CRL.
Una revisión sistemática Cochrane de 2019 que comparó los resultados de la cistectomía radical robótica con derivación urinaria extracorpórea y la cistectomía radical abierta (167). En esta revisión no se encontraron diferencias en las complicaciones, el tiempo hasta la recurrencia, la calidad de vida ni la tasa de márgenes quirúrgicos positivos, entre ambas técnicas. El abordaje robótico se asoció con una menor tasa de transfusión y una menor duración de la estancia hospitalaria (mediana de 0,7 días). Sin embargo, la certeza de la evidencia de este estudio fue muy baja a moderada.
Mas recientemente, revisiones sistemáticas y metanalisis (168, 169), junto a varios ensayos randomizados (170, 171, 172) comparando las mismas técnicas, han mostrado los siguientes resultados:
- Una discreta mayor duración de la estancia hospitalaria para la cirugía abierta (0,2 días).
- Mayor incidencia de trombosis venosa (OR: 1,8) y tasas de transfusión (0,5 unidades de sangre) para la cirugía abierta.
- Mayor duración de la cirugía para la cirugía robótica (diferencia media: 76 min).
- Sin diferencia en la tasa de complicaciones a los 90 días y en la tasa de íleo postoperatorio.
- Sin diferencia en la tasa de márgenes quirúrgicos positivos.
- Sin diferencias en la calidad de vida, excepto en el dominio de la función física, que favorece a la cirugía robótica.
- Sin diferencias en la sobrevida global (SG) y en la sobrevida libre de recurrencia (SLR) (mediana de seguimiento: 36 meses).
Para la elección de la vía de abordaje, lo esencial es la experiencia y el volumen quirúrgico del centro tratante, ya se trate de cirugía abierta o robótica (144).
El volumen quirúrgico del cirujano y del centro en el que se realiza la intervención tienen relación directa con los resultados periopertorios. Una revisión sistemática (173) reveló que un mayor número de pacientes tratados en un centro hospitalario se asocia con menor tasa de mortalidad a 30 y 90 días, menor tasa de complicaciones, menor tasa de márgenes quirúrgicos positivos y con mayor tasa de realización de linfadenectomía y neovejigas. De acuerdo con esto, la realización de 10 cistectomías radicales anuales por centro reduciría la mortalidad postoperatoria, siendo el impacto de 20 procedimientos anuales aún más significativo. Con respecto al número de casos por cirujano, la evidencia es no es consistente. De esta manera, es el volumen por centro el factor más determinante, haciendo razonable la concentración de casos en centros de referencia nacional.
Cistectomía en cáncer de vejiga sin invasión muscular
La subetapificación de pacientes con enfermedad aparentemente sin compromiso del músculo detrusor, asociado al pobre pronóstico de los pacientes que progresan a enfermedad músculo-invasora, son razones para indicar una cistectomía en pacientes con enfermedad <pT2. Los pacientes con cáncer de vejiga que progresaron hacia una enfermedad con compromiso muscular, en una revisión de 3.088 casos, presentaron una sobrevida cáncer específica de 35%, lo que es estadísticamente inferior a pacientes que debutaron con enfermedad músculo invasora (144).
La cistectomía radical, en enfermedad no músculo invasora, estaría indicada en pacientes con tumores de alto riesgo de progresión (T1, alto grado, CIS, tumores múltiples y recurrentes y de >3 cm Ta de bajo grado). La sobrevida libre de recurrencia a 10 años en este grupo de pacientes es 80% (173,174). La cistectomía está también indicada en pacientes con tumores refractarios a la terapia adyuvante con BCG (presencia de tumor de alto grado a los 3 meses, presencia de CIS a los 3 y 6 meses, presencia de tumor de tumor de alto grado durante la terapia con BCG, recurrencia de tumor de alto grado post terapia de mantención con BCG) (144).
Cuidados perioperatorios en cistectomía radical
Aporte de volumen perioperatorio: La cistectomía es una cirugía que se asocia a altos volúmenes de sangrado y, por ende, a alta tasas de transfusión de glóbulos rojos (176), por lo que varias estrategias han sido estudiadas con el fin de disminuir el sangrado intra operatorio.
Wühtrich y cols. (177) en un ensayo prospectivo y randomizado estudiaron el rol de la restricción de volumen asociado al aporte de norepinefrina en el sangrado intra-operatorio y en la tasa de transfusiones. Se incluyeron 166 pacientes sometidos a cistectomía radical, linfadenectomia pelviana extendida y derivación urinaria. El grupo sometido a restricción de volumen presentó un sangrado promedio de 800 cc y el grupo control (manejo de volumen estándar), 1.200 cc (p<0,0001), con una tasa de transfusión de 33% en el grupo 1 y 60% en el grupo 2 (p=0,0006). Los autores concluyen que el uso de restricción de volumen asociado a norepinefrina disminuye el sangrado intraoperatorio y las tasas de transfusión en estos pacientes.
Manejo gastrointestinal postoperatorio: El ileo postoperatorio es un problema frecuente en los pacientes sometidos a cistectomía radical más derivación urinaria. Se estima que la prevalencia podría llegar hasta 40% de los pacientes sometidos a estas cirugías (178). El ileo postoperatorio, está asociado a una prolongación de la estadía hospitalaria, aparición de otras complicaciones y a un potencial aumento del costo para los sistemas de salud.
Lee y cols. (179) en un estudio prospectivo, randomizado y multicéntrico, estudiaron el efecto de alvimopan en la recuperación de la función gastrointestinal en pacientes sometidos a cistectomía radical abierta. Alvimpoan es un antagonista periférico de los receptores μ opioides, que ha sido usado con éxito en la prevención del ileo post operatorio en cirugías que requieren resección intestinal (180). Un total de 277 pacientes ingresaron en el estudio (alvimopan n: 143, placebo n: 137). El grupo de alvimopan presentó una recuperación de la función gastrointestinal más rápida (5,5 vs 6,8 días p<0,0001), una menor estadía hospitalaria (7,4 vs 10,1 días p=0,051) y una menor morbilidad asociada a ileo post operatorio (8,4% vs 29% p<0,001).
El uso de goma de mascar ha sido estudiado con éxito en pacientes sometidos a cistectomía radical. En 2 estudios prospectivos y randomizados, Choi y cols. (181) y Kouba y cols. (182) reclutaron 162 pacientes para evaluar la efectividad del uso de goma de mascar en la recuperación de la función gastro intestinal. Los pacientes que usaron goma de mascar presentaron un menor tiempo a la eliminación de gases por ano (57,1 vs. 69,5 horas; 2,4 vs 2,9 días; p <0,001) y menor tiempo a la ocurrencia de movimientos gastrointestinales (76,7 vs 93,3 horas; 3,2 versus 3,9 días; p <0,001). Sin embargo, estos investigadores no lograron mostrar una menor morbilidad ni duración de la estadía hospitalaria.
ERAS (Enhanced Recovery After Surgery): Son protocolos multimodales e interdisciplinarios, cuyo objetivo es acelerar la recuperación del paciente y mejorar los resultados quirúrgicos a través de la atención perioperatoria estandarizada. En cistectomía radical, los elementos fundamentales son: consejería y educación del paciente en el preoperatorio, optimización de la condición médica preoperatoria, evitar realizar preparación intestinal, pre-carga de carbohidratos, uso de profilaxis tromboembólica, analgesia óptima, profilaxis antibiótica, uso racional de fluidos, evitar uso de sonda nasogástrica, uso de prokinéticos y goma de mascar, prevención de náuseas y vómitos post operatorios, alimentación y movilización temprana. Estas medidas han permitido disminuir la duración de la estadía hospitalaria, sin aumentar la tasa de complicaciones ni de readmisión (183).
Complicaciones postoperatorias
Las complicaciones durante el período post operatorio de una cistectomía radical, junto con una derivación urinaria, son frecuentes. Hautmann y cols. (184) reportaron en un grupo de 1.000 pacientes cistectomizados que recibieron una sustitución vesical ileal, una tasa de complicaciones a 90 días de 58%. El 36% de los pacientes presentó complicaciones menores (Clavien 1-2) y el 22% complicaciones mayores (Clavien 3-5). Las complicaciones infecciosas correspondieron a un 24%, genitourinarias 17%, gastrointestinales 15% y relacionadas a la herida operatoria 9%. La mortalidad a 90 días de esta serie fue de 2,3%. En otras series, la mortalidad a 30 días es de hasta 3 y a los 90 días hasta 5,7% (185-187).
Pronóstico
El pronóstico de los pacientes después de la cirugía depende del estadío tumoral. La sobrevida libre de recidiva, reportada a los 5 años según algunos grupos, es de 58%, con una sobrevida cáncer específica de 66% (187). Un trabajo de validación externa, de un nomograma para la predicción de la mortalidad cáncer específica, mostró una sobrevida cáncer especifica de 62% (189). En un estudio de 1.054 pacientes se reporta una sobrevida libre de recurrencia y sobrevida global a 5 y 10 años, de 68% y 66%, y de 60% y 43%, respectivamente (190).
Derivaciones urinarias
Después de la cistectomía existen tres alternativas, desde el punto de vista anatómico, para la reconstrucción del tracto urinario:
• Derivación a la pared abdominal, tales como la ureterostomía cutánea, conducto ileal o colónico, y diversas formas de derivaciones continentes heterotópicas (pouch).
• Derivación hacia la uretra, que incluye varias formas de sustituciones vesicales ortotópicas continentes anastomosadas a la uretra.
• Derivación hacia el rectosigmoides tales como la ureterosigmoidostomía.
La indicación del tipo de derivación urinaria depende de las condiciones físicas del paciente y del compromiso tumoral. El compromiso tumoral de la uretra preoperatorio o el compromiso pesquisado en el intraoperatorio son indicaciones de uretrectomía, por lo que estos pacientes no son candidatos para una reconstrucción urinaria ortotópica (143).
El compromiso uretral debe ser buscado en la zona más distal al veru montanum en los hombres y en limite distal del cuello vesical en las mujeres (144).
La presencia de compromiso ganglionar no es una contraindicación absoluta de realización de un reemplazo vesical ortotópico. Pacientes con enfermedad N1 pueden ser candidatos para esta cirugía y no así los pacientes con enfermedad N2 o N3 (144).
Los resultados oncológicos de una derivación urinaria continente y no continente son similares en cuanto a recidivas locales y o a distancia (189). Sin embargo, tumores uretrales son menos comunes en el seguimiento de pacientes después de una derivación urinaria ortotópica (190).
Los pacientes candidatos a derivación urinarias continentes deben estar motivados y ser capaces de aprender los cuidados requeridos para lograr el éxito después de esta cirugía y deben tener las destrezas manuales para poder realizar un correcto manejo de la derivación. Por estas razones son contraindicaciones para derivaciones urinarias continentes: enfermedades neurológicas y/o psiquiátricas que afecten de manera importante la capacidad motora y cognitiva, expectativa de vida limitada, alteración de la función renal y/o hepática, presencia de cáncer urotelial en los márgenes de sección y comorbilidad significativa.(84, 144) Contraindicaciones relativas son: altas dosis de radioterapia pelvianas, estenosis uretrales complejas e incontinencia urinaria por alteración esfinteriana (191, 192, 193).
La edad como criterio único no es una contraindicación para una derivación urinaria continente, En pacientes mayores de 75 años, con buen perfil de comorbilidad y buena expectativa de vida, este tipo de derivación urinaria podría ser una opción (184, 194, 195, 196).
Ureterostomía cutánea
Esta derivación urinaria consiste en llevar los extremos de los uréteres hacia la pared abdominal, siendo la forma más simple de derivación cutánea. Habitualmente está indicada en pacientes añosos o como una solución paliativa en enfermedad avanzada (197, 198). Es considerada como una intervención segura (144), en la que el tiempo quirúrgico es corto y la función renal basal no es un criterio de selección. Desde el punto de vista de la técnica, ambos uréteres pueden ser llevados a la pared abdominal de manera independiente, o se puede realizar una anastomosis termino-lateral de un uréter hacia el otro y este último llevarlo a la pared abdominal (transureteroanastomosis).
La estenosis del ostoma es una complicación frecuente y que puede ser explicada por el menor diámetro de los uréteres en comparación con un conducto ileal (144). Para disminuir la posibilidad de estenosis, se recomienda el uso de algún método de intubación (84). No existe evidencia de calidad que permita comparar la tasa de complicaciones de este tipo de derivación con otros (conducto ileal, “pouch”, reemplazo vesical ortotópico), pero la literatura sugiere que la estenosis de estoma y la infección urinaria sería más frecuente en las ureterostomías cutáneas. (199)
A pesar de las complicaciones reportadas, es una derivación urinaria que puede brindar una calidad de vida aceptable. Saika y cols evaluó la calidad de vida de pacientes >75 años, sometidos a ureterostomia cutánea, conducto ileal y reemplazo vesical ortotópico. No se observaron diferencias significativas en la calidad de vida en estos grupos (197).
Derivaciones de conductos
Son estas las derivaciones urinarias más comúnmente realizadas en la actualidad, debido a su simpleza técnica en comparación a derivaciones continentes, manteniendo buenos resultados funcionales (84). Habitualmente el conducto más usado es el ileal, pudiendo ser utilizados también el colon o el yeyuno en pacientes seleccionados (compromiso actínico de intestino o de uréteres, enfermedades inflamatorias intestinales, síndromes de intestino corto).
Los problemas teóricos asociados al uso de colon son las mayores tasas de complicaciones infecciosas post operatorias al usar el intestino grueso y la presencia de mesos más cortos con aporte vasculares críticos (144). Sin embargo, estudios que comparan las complicaciones a corto y largo plazo entre el conducto ileal y colónico, no han demostrado diferencias significativas entre ambos (200).
En una revisión de Cochrane que compara ambas técnicas, no hubo diferencias en cuanto a infecciones del tracto urinario superior ni estenosis uretero-ileales (201). Por su parte los conductos yeyunales estarían asociados a mayores alteraciones metabólicas (84).
Tecnica quirúrgica
Un segmento de 10 a 15 cm de ileon terminal es seleccionado a 10-25 cm desde la valvula ileo-cecal. El ciego e ileon terminal son movilizados. Luego, a través de transiluminacion del mesenterio se seleccionan las arcadas vasculares en la zona distal y proximal del segmento a utilizar. Se procede a seccionar el mesenterio, controlando sus vasos. Se realiza la sección del extremo proximal y distal del ileon, procediendo a aislar el segmento ileal seleccionado. La anastomosis ileo-ileal puede ser realizada con sutura manual o mecánica, de acuerdo con disponibilidad y/o preferencia del cirujano.
Posteriormente la sutura ureteroileal puede ser realizada con diversas técnicas (Bricker, Nesbitt, Wallace, etc.). El uso de stents está recomendado, dado que disminuiría las filtraciones urinarias, disminuiría la dilatación precoz del tracto urinario superior y estaría asociado a una mejor función intestinal (202). Finalmente, el segmento distal del conducto se ostomiza en el abdomen a nivel del cuadrante inferior derecho, en la zona marcada pre-operatoriamente.
Complicaciones
Las tasas de complicaciones, después de un conducto ileal son significativas y algunas potencialmente letales. La formación de abscesos a nivel de la anastomosis intestinal es de 3,6% y la fistula intestinal 2,7% (203). La presencia de filtración urinaria a nivel de la anastomosis ureteroileal, se presenta en 2-5,5% de los pacientes (202). El uso rutinario de stents ureterales ha demostrado disminuir la incidencia de filtración urinaria (200), por lo que se recomienda su uso de manera rutinaria, como fue mencionado previamente.
En el largo plazo, problemas asociados al ostoma, pueden presentarse en hasta 24% de los pacientes con seguimientos sobre 5 años (204). La estenosis del ostoma se ha descrito en 2-4% de los pacientes (144). La prevalencia de las hernias para ostomales es de 3,7 – 13,9% y se presentan con una media de 2,4 años post operatoria (203, 205).
Madersbacher y cols, reportan en una serie de 131 pacientes, con seguimiento mayor a 5 años una tasa de complicación del 66% (204). Problemas asociados al ostoma se presentaron en 24%, complicaciones intestinales en 24%, infección del tracto urinario en 23% y deterioro de la función renal en 27%. Jin y Studer reportaron los resultados de la función renal de pacientes que fueron seguidos >10 años post operatorio (206). El deterioro de la función renal se presentó en un 36% de los pacientes que recibieron un conducto ileal, siendo la obstrucción del tracto urinario el factor predictor más importante.
Reservorios heterotópicos cateterizables
Corresponden a una excelente alternativa de derivación urinaria continente en aquellos pacientes en los que la uretra no puede ser utilizada. Diversos segmentos del tracto digestivo pueden utilizarse para lograr un reservorio cateterizable de baja presión, tales como: íleon, estómago, íleon-ciego o colon sigmoides. El desarrollo de estas técnicas se inicia con el reservorio de Kock (207).
El paciente candidato a este tipo de derivación urinaria debe comprender los cuidados necesarios para lograr el éxito funcional en el largo plazo y debe tener las habilidades motoras para el auto cateterismo (144).
Entre las técnicas que más se han descrito en la literatura se encuentran: Reservorio de Kock, reservorio de Mainz, reservorio de Indiana, reservorio de Lundiana. y reservorio T.
Todas estas técnicas se basan en una combinación de distintos mecanismos de entrada, reservorio de almacenamiento y mecanismo de continencia y salida. A diferencia del conducto ileal y algunos sustitutos vesicales ortotópicos, estos reservorios cuentan con un mecanismo antirreflujo. Este es necesario, dado los frecuentes aumentos de presión dentro del reservorio secundarios a los eficientes mecanismos de continencia.
Las tasas de continencia diurna y nocturna reportadas son de alrededor de 93% (208).
Complicaciones
La litiasis es una complicación secundaria a la orina residual, infecciones crónicas, presencia de mucus y en algunos casos a la presencia de cuerpos extraños dentro del reservorio. La incidencia reportada por la mayoría de los grupos es de 5-20% (84). Sin embargo, una incidencia de hasta 44% ha sido descrita (209).
La estenosis del ostoma cateterizable es un problema frecuente, con una prevalencia reportada de 23,5% cuando se usa apéndice cecal y 15% con el uso de íleon (208).
Finalmente, la ruptura es una complicación infrecuente que se produce por una sobredistensión exagerada del reservorio. En una serie de pacientes que recibieron una derivación tipo Lundiana 4% de pacientes presentaron esta complicación, que en su mayoría debió ser tratada con cirugía abierta (84).
Derivación ureterocolónica
La derivación ureterocolónica es una técnica en la que los uréteres son anastomosados a la región rectosigmoidea, con técnica refluyente o antirreflujo.
Actualmente, es una estrategia escasamente usada dadas las altas tasas de complicaciones a largo plazo (84).
La continencia del esfínter anal, es uno de los pilares para la selección de los pacientes. La evaluación se realiza con un enema de 400-500 cc, el que debe ser retenido por al menos una hora.
Son criterios de exclusión para esta derivación: falla renal, presencia de enfermedades colonicas, irradiación previa de la pelvis (84).
Las complicaciones agudas post operatorias son: anuria, dado edema tisular post retiro de catéteres.; filtración urinaria: se presenta hasta un 3,5% de los pacientes (84).
Las complicaciones tardías son:
-Infecciones del tracto urinario alto, son de las complicaciones más frecuentes cuyas incidencias pueden llegar hast 81% de los pacientes, con el uso de técnicas de implantes ureterales refluyentes (211, 212). Las razones de la elevada incidencia de pielonefritis es la alta carga bacteriana rectal, asociado a las altas presiones durante la micción. El uso de antibióticos a permanencia se ha recomendado en este grupo de pacientes (213)
– Estenosis de la anastomosis ureterocolónica, se produce en hasta 49% de los pacientes y depende del tipo de técnica utilizada (84).
– Incontinencia: las tasas de continencia diurnas descritas fluctúan entre83-97% y las nocturnas de 58 – 92% (84).
– Neoplasias de colon. Es una de las complicaciones temidas y causa del desuso de esta técnica, que puede alcanzar hasta 15% de los pacientes (214).
Sustitutos vesicales ortotópicos
Es una de las derivaciones continentes más usadas en la actualidad. Su indicación varía de acuerdo con el lugar donde se realiza la cirugía y en algunos centros es la derivación de elección. En centros como la Universidad de Berna, Universidad de California del Sur, Manssoura y Ulm, más del 50% de los pacientes reciben un sustituto vesical ortotópico (215).
De acuerdo con información obtenida en estudios poblacionales, en Suecia en la década de 2000-2010, 16% de los pacientes recibieron una derivación ortotópica
Diversos reportes poblacionales, muestran que en Estados Unidos de Norteamérica, en el periodo comprendido entre 1998 y 2008, 6,6%-14,3% (216-218) recibieron una derivación urinaria continente. En el estudio de Gore y cols, el 59% de las instituciones estudiadas no realizaban derivaciones urinarias continentes (216). En Alemania, las tasas de reemplazos vesicales ortotópicos, son mayores que en los casos anteriores. El 30% de los pacientes operados por un cáncer de vejiga musculo-invasor, reciben una derivación ortotópica (215).
Existen diversas técnicas para la confección de un sustituto vesical ortotópico tales como (65): Camey II, reservorio de Hautmann, reservorio ileal de Kock, sustituto vesical ileal ortotópico de Studer, neovejiga ileal T-pouch, reservorio ortotópico de Mainz (Mainz III), reservorio de LeBag, reservorio de colon derecho y reservorio de sigmoides.
La derivación urinaria de Studer es una de las más usada en la actualidad (65). Para su confección se elige un segmento de ileon distal de +-54 cm, cuyo extremo distal se ubica a 25 cm de la valvula ileocecal (144). Se procede a la detubularizacion de sus 40-44 cm más distales. Los uréteres se anastomosan de manera termino lateral, en el segmento mas proximal del segmento que permanece tubularizado.
El segmento detubularizado se dobla en sí mismo para darle una forma de esferoide, el que permite una capacidad 4 veces superior con ¼ de la presión comparado al segmento nativo de forma cilíndrica (84, 144). De esta manera se puede lograr un reservorio de +- 400-500 cc.
Al usar segmentos de intestino más largos, se obtienen reservorios de mayor capacidad que si bien presentaran mejores tasas de continencia tempranas, a largo plazo se vacían de peor manera y presentaran una probabilidad mayor de ruptura (218). La micción se produce en estos pacientes gracias a la distensión de las paredes del reservorio, que activan los receptores de estiramiento de las paredes intestinales (219) por lo que los pacientes experimentan una sensación de llenado del sustituto vesical. Posteriormente una disminución de la resistencia a la salida mediante relajación del piso pélvico y disminución del tono del esfínter externo asociado a un leve pujo abdominal permite la salida de orina (84).
La continencia diurna es alcanzada previo a la nocturna, con tasas de 92 y y 76% respectivamente en el largo plazo. La preservación de nervios al momento de la cistectomía se asocia con mejores tasas de continencia diurna, no así la edad, la que se asocia a inferiores resultados (220, 221). Pacientes con diabetes mellitus tipo 2 presentan una recuperación más lenta de la continencia. Las infecciones del tracto urinario se asocian a incontinencia, por lo que episodios de deterioro de la continencia deben ser estudiados y una infección debe ser descartada (84).
La estenosis de la anastomosis ureteroileal no son frecuentes, cuando una técnica termino-lateral es usada. Studer y cols reportan una tasa de estenosis de 2,7% a largo plazo (222) Existen otras series que muestran tasas de estenosis de hasta 18% (193).
El uso de stents de protección de la anastomosis está indicado, dado que ha probado mejorar los resultados post operatorios como se mencionó previamente (202).
El uso de técnicas antirreflujo en el implante ureteroileal es un tema controversial. Diversos autores no lo recomiendan dado que por el mecanismo de llenado y vaciado de los sustitutos vesicales, el reflujo no debería ser un problema (84). Incluso con estudios cintigráficos se ha probado la ausencia de reflujo en estos pacientes (223). En un trabajo prospectivo y randomizado (USC-STAR trial), Skinner y cols, compararon los resultados de 237 pacientes sometidos a Tpouch (mecanismo antirreflujo) con 247 que recibieron un sustituto vesical ileal tipo Studer. Los autores no observaron diferencias significativas en cuanto a preservación de la función renal a 3 años plazo. Sin embargo, el grupo de T-pouch, presentó una mayor tasa de procedimientos quirúrgicos adicionales relacionados a la derivación urinaria (224).
En mujeres se pueden presentar otras complicaciones distintas al hombre. Una de estas es la fístula sustituto vesical – vagina, la que se ha descrito hasta en 5% de las pacientes (84). Para disminuir la probabilidad de ocurrencia de este problema, se debe respetar (siempre que sea posible) la pared vaginal anterior, cerrar herméticamente de cualquier incisión vaginal con material reabsorbible e interponer un flap de omento entre la vagina y el sustituto vesical. (84).
La retención urinaria es más frecuente en mujeres que en hombres. En algunas series hasta 50% de las pacientes han presentado esta complicaciónn (192). Existen diversas teorías de su etiología (acodamiento del reservorio, denervación autonómica del esfínter, alteraciones en la re-inervación), por lo que existen también diversas maneras que intentan prevenirla (llenar la pelvis posterior, fijación de reservorio, preservación de utero y sus mecanismos de fijación, etc.) El tratamiento se realiza mediante cateterismo vesical intermitente. En algunos casos la resección de pliegues uretrales redundantes a resultado exitosa) (84).
Las alteraciones hidroelectrolíticas y acido base son frecuentes en estos pacientes. Al usarse un segmento de íleon, se puede producir acidosis hipoclorémica asociado en ocasiones a hiperkalemia. En hasta un 50% de los pacientes se puede producir este trastorno (199). Para prevenirlo, se recomienda el uso de suplementación de bicarbonato de sodio, la ingesta de régimen con mayor cantidad de sal y la evitación del uso de bloqueadores de las bombas de protones gástrica (144). Por su parte los pacientes con reservorios colónicos, es frecuente encontrar acidosis metabólica hipercloremica, la que puede ser presentada en hasta 1/3 de los pacientes de manera crónica) (145).
Terapia sistémica perioperatoria
El tratamiento quirúrgico estándar para pacientes con enfermedad músculo invasora urotelial y con subtipos, es la cistectomía radical. Sin embargo, con este tratamiento la sobrevida a 5 años es aproximadamente del 50% de los pacientes (189). Para mejorar la sobrevida en pacientes con enfermedad cN0M0, se utiliza quimioterapia neoadyuvante basada en cisplatino El objetivo es tratar las micrometástasis presentes al momento del diagnóstico y solamente debe ser aplicada a pacientes aptos para cisplatino.
El uso de quimioterapia antes de la cirugía tendría las siguientes potenciales ventajas y desventajas: (144).
Ventajas
- Mejor tolerancia previo a la cirugía.
- Al administrarla más temprano, actúa sobre una carga metastásica más baja.
- Permite evaluar la sensibilidad por parte del tumor in vivo, lo que tiene significado pronóstico.
- Puede disminuir el tamaño y etapa tumoral facilitando la cirugía.
- No produciría impacto en la morbilidad perioperatoria.
Desventajas:
- Retardo del tratamiento en pacientes no respondedores a la quimioterapia.
Múltiples ensayos fase 3 y posteriores metaanálisis han demostrado el posible efecto benéfico de la neoadyuvancia con esquemas como MVAC (metotrexato, vinblastina, adriamicina y cisplatino), MVA(E)C (metotrexato, vinblastina, adriamicina, etoposido y cisplatino), CMV (cisplatino, metotrexato más vinblastina), CM (cisplatino más metotrexato), cisplatino más adriamicina y cisplatino más 5-fluorouracilo (5-FU).(225-232).
Los resultados de estos estudios muestra una mejoría absoluta del 8% en la sobrevida a los cinco años, con un número necesario a tratar de 12,5 y solo la quimioterapia combinada con cisplatino, con al menos un agente adicional, resultó en un beneficio terapéutico significativo.
Esquemas más modernos usando Gemcitabina + Cisplatino (GC) y MVAC dosis densa (ddMVAC), han mostrado resultados similares a los exhibidos por esquemas clásicos como MVAC. (232, 233. El ensayo fase III VESPER comparó regímenes de quimioterapia intensificados: seis ciclos de dose-dense MVAC (metotrexato, vinblastina, doxorrubicina y cisplatino) frente a cuatro ciclos de gemcitabina-cisplatino en el escenario perioperatorio. Los resultados evidenciaron una mayor tasa de respuesta patológica completa (ypT0: 42 % vs. 36 %) y una tendencia a mejorar la supervivencia libre de progresión a favor de dd-MVAC (234).
El ensayo fase III NIAGARA demostró que la incorporación de durvalumab en un esquema perioperatorio (neoadyuvante junto a gemcitabina–cisplatino y adyuvante tras cistectomía) se asocia a beneficios clínicamente significativos. En comparación con la quimioterapia estándar seguida de cirugía, el uso de durvalumab redujo el riesgo de eventos en un 32 % (HR 0,68; IC95%: 0,56–0,82; p<0,001) y mejoró la supervivencia global con una reducción del riesgo de muerte del 25 % (HR 0,75; IC95%: 0,59–0,93) sin comprometer la seguridad ni la factibilidad quirúrgica. Estos hallazgos posicionan al durvalumab como una estrategia potencialmente modificadora del estándar de cuidado en el manejo perioperatorio del MIBC. (235)
La quimioterapia adyuvante, post cistectomía radical en pacientes con enfermedad pT3/4 y/o N(+), sin metástasis clínicamente detectables (M0) aún es objeto de debate y puede presentar beneficios y desventajas.
Los beneficios generales de la quimioterapia adyuvante incluyen (144)
- La quimioterapia se administra tras una etapificación patológica precisa, lo que evita el tratamiento en pacientes con bajo riesgo de micrometástasis;
- No se retrasa el tratamiento quirúrgico definitivo.
Las desventajas de la quimioterapia adyuvante son:
- La evaluación de la quimiosensibilidad in vivo del tumor no es posible y el sobretratamiento es un problema inevitable;
- El retraso o la intolerancia a la quimioterapia, debido a la morbilidad postoperatoria.
A diferencia de la quimioterapia neoadyuvante, la evidencia para el uso de la quimioterapia adyuvante no es categórica. Una revisión sistemática que incluyo 945 pacientes, de 9 ensayos, mostró un HR para sobrevida global de 0,77 (IC del 95%: 0,59-0,99; p = 0,049) y para sobrevida libre de enfermedad de 0,66 (IC del 95%: 0,45-0,91; p = 0,014) con un mayor impacto en caso de presencia de N(+) (236)
El ensayo randomizado más grande, EORTC 30994, que incluyó 294 pacientes, mostró una mejoría significativa en la sobrevida libre de progresión para la quimioterapia inmediata basada en cisplatino, en comparación con la diferida (HR: 0,54, IC del 95 %: 0,4-0,73, p < 0,0001), pero sin diferencias significativas en la sobrevida global (237) En un estudio observacional que incluyó 5.653 pacientes con estadio pT3-4 o N(+), tratados entre 2003 y 2006, se registró una sobrevida global a cinco años de 37 % en el grupo de quimioterapia adyuvante, frente a 29,1 % en el grupo de observación. (HR: 0,70; IC del 95%: 0,64-0,76) (238). En otro análisis retrospectivo basado en la Base de Datos Nacional del Cáncer de EE. UU., que incluyó a 15.397 pacientes con enfermedad localmente avanzada (pT3/4) o ganglios linfáticos positivos, se demostró un beneficio en la SG en pacientes con histología urotelial (239).
La quimioterapia adyuvante es una opción que debe ser ofrecida a pacientes pT3/4 pN (+) sin quimioterapia neoadyuvante, discutiendo las limitaciones de la evidencia que apoyan esta decisión (144).
La inmunoterapia adyuvante es una estrategia relevante en el manejo del cáncer vesical músculo invasor tras la cistectomía radical. El estudio fase III CheckMate 274 evaluó nivolumab versus placebo en pacientes con alto riesgo de recurrencia y demostró una mejora significativa en la supervivencia libre de enfermedad, con un beneficio más pronunciado en aquellos con expresión positiva de PD-L1 (240). De forma complementaria, el ensayo fase III AMBASSADOR investigó pembrolizumab como tratamiento adyuvante frente a observación, mostrando una ganancia en sobrevida libre de enfermedad consistente en la población global, con una tendencia favorable en la sobrevida global, aunque con menor maduración de datos (241). En conjunto, estos estudios respaldan el rol de la inmunoterapia en reducir el riesgo de recurrencia postoperatoria en cáncer de vejiga musculo invasor, aportando evidencia robusta para considerarla como parte integral del manejo de pacientes con alto riesgo de recaída
Terapia sist[emica en cáncer vesical metastásico
El tratamiento del cáncer vesical metastásico se ha basado durante las últimas décadas en la quimioterapia basada en cisplatino, que ha demostrado un beneficio en sobrevida global. Recientemente, dos ensayos con Enfortumab Vedotin + Pembrolizumab (242) y Nivolumab + gemcitabina y cisplatino (243), mostraron resultados favorables que han generado un cambio en el paradigma del manejo de estos pacientes en diferentes guías clínicas (144), siendo estos dos tratamientos la actual primera línea en tumores metastásicos.
La combinación del anticuerpo monoclonal Pembrolizumab con Enfortumab Vedotin fue probada en el estudio fase III EV302/KEYNOTE (237). Se evidenciaron mejores tasas de sobrevida libre de progresión y de sobrevida global (12.5 versus 6.3 meses y 31.5 versus 16.1 meses respectivamente) que se extendió a todos los subgrupos de pacientes estudiados. (242)
El uso de Nivolumab en conjunto con quimioterapia (Gemcitabina + Cisplatino) y posterior mantención con Nivolumab hasta la progresión o un máximo de 24 ciclos, fue probado en comparación con quimioterapia (Gemcitabina /Cisplkatino) en un estudio fase III , (CHECKMATE 901)(243). Con beneficios en sobrevida libre de progresión y sobrevida global (mediana de 7,9 versus 7,6 meses y 21,7 versus 18,9 meses respectivamente), estes estudio permitió la aprobación de esta combinación en este escenario por la FDA en marzo 2024.
El tipo de quimioterapia a usar está basado en los criterios de elegibilidad para platino 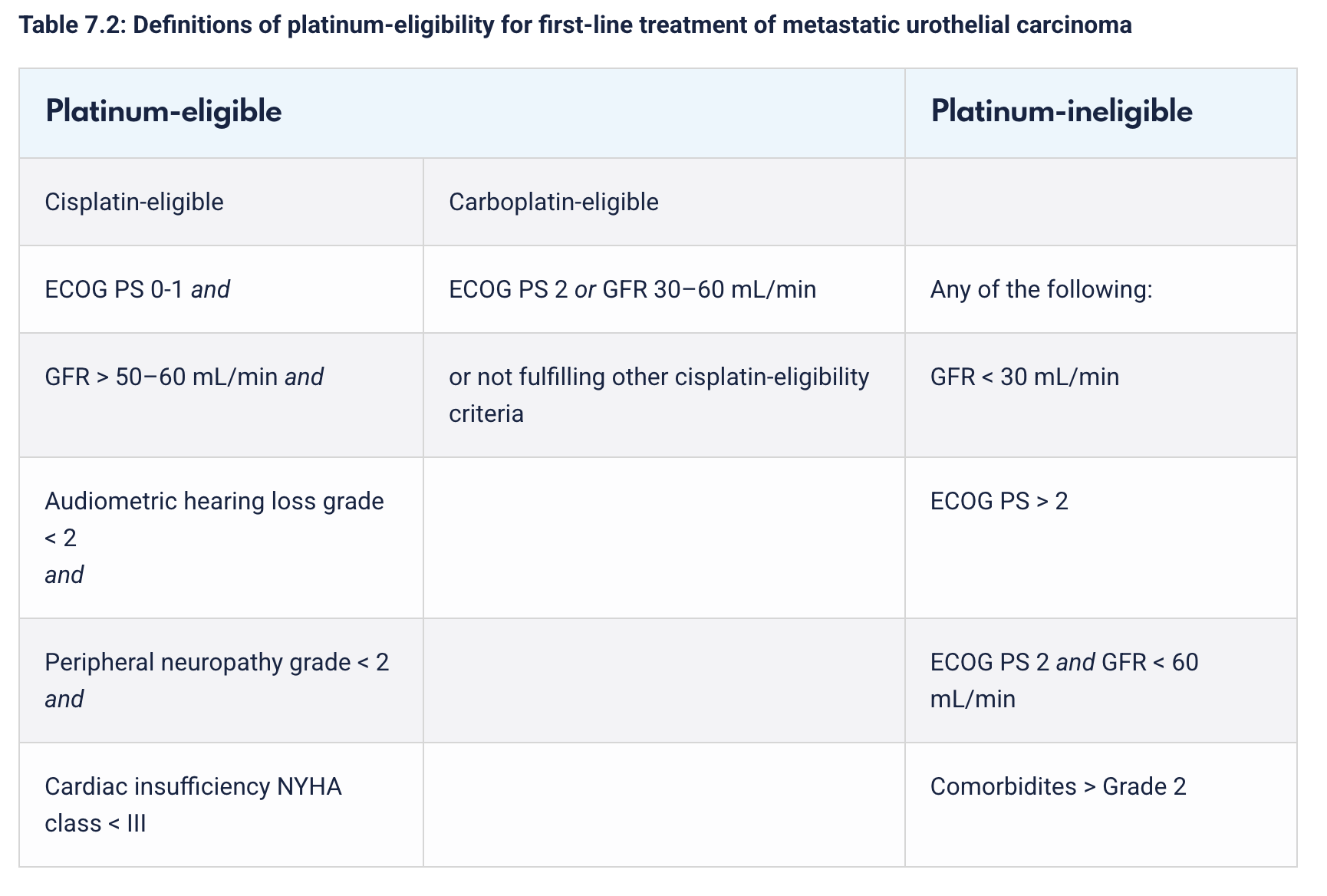 (144).
(144).
Tabla 1. Elección de Platino como primera línea en carcinoma urotelial metastásico.
La quimioterapia basada en cisplatino ha mostrado sobrevidas globales entre 12 y 14 meses (244) con tasas de repuestas de 46% para MVAC y 49% para Gem+ Cis (245). Este último esquema muestra menos toxicidad por lo que se ha convertido en el estándar (246).
La quimioterapia con carboplatino en comparación con cisplatino muestra resultados inferiores. Un análisis comparativo de cuatro ensayos aleatorizados de fase II de quimioterapia combinada de carboplatino vs. cisplatino demostró menores tasas de respuesta completa y de sobrevida global para carboplatino (247) En pacientes que presentan respuesta completa o parcial, o bien enfermedad estable después de tratamiento con Gemcitabina + platino, la adición de Avelumab como mantención, demostró un beneficio en sobrevida global (248), por lo que se considera el tratamiento estándar en pacientes que responden a quimioterapia.
Los pacientes que no son aptos para cisplatino, pero sí para carboplatino (aproximadamente 50% de pacientes M+) (249) deben recibir quimioterapia combinada con Gemcitabina y carboplatino.
Los pacientes no aptos para cisplatino ni carboplatino (no aptos para platino) pueden ser considerados para inmunoterapia con pembrolizumab (250) o atezolizumab (251).
La estrategia de inmunoterapia de mantención tras quimioterapia de primera línea ha demostrado un impacto clínico significativo. El ensayo fase III JAVELIN Bladder 100 evaluó avelumab como tratamiento de mantención en pacientes con respuesta o enfermedad estable luego de quimioterapia basada en platino, mostrando una mejora sustancial en la supervivencia global en comparación con el mejor cuidado de soporte, beneficio que se observó de manera consistente en todos los subgrupos, incluyendo aquellos con expresión positiva de PD-L1 (252).
Se recomienda determinar el estado de mutación del FGFR antes de decidir sobre el tratamiento de segunda línea. Los pacientes con mutaciones de FGFR3 son candidatos para el tratamiento con inhibidores del FGFR (253).
El tratamiento con Enfortumab vedotin es estándar en caso de progresión tras quimioterapia con platino e inmunoterapia (144). La secuencia óptima de nuevos agentes y las posibles combinaciones son objeto de numerosos ensayos en curso. En general, se recomienda tratar a los pacientes dentro de ensayos clínicos en curso siempre que sea posible.
Terapia trimodal de conservación vesical.
La terapia trimodal es una alternativa con intención curativa a la cistectomía radical en pacientes con enfermedad músculo invasora clínicamente localizada, en la que se combina una RTUV, quimioterapia radiosensibilizante y radioterapia. La razón para combinar la RTUV con radioterapia es lograr el máximo control tumoral local en la vejiga y los ganglios linfáticos adyacentes. La adición de quimioterapia radiosensibilizante u otros radiosensibilizadores tiene como objetivo potenciar la radioterapia.
Esta estrategia se reserva para pacientes con tumores solitarios más pequeños, sin CIS extenso o multifocal, o solo hidronefrosis unilateral relacionada con el tumor y buena función de la vejiga antes del tratamiento (254). El tratamiento trimodal de conservación de vejiga también debe considerarse en todos los pacientes con una contraindicación para la cirugía, ya sea relativa o absoluta.
Entre las series de terapia trimodal, las tasas de sobrevida cáncer específica y sobrevida global a cinco años varían entre el 50–84% y el 36–74%, respectivamente, con tasas de cistectomía de rescate del 10–30%. (255-258).
REFERENCIAS
- Filho AM, Laversanne M, Ferlay J, Colombet M, Piñeros M, Znaor A, Parkin DM, Soerjomataram I, Bray F. The GLOBOCAN 2022 cancer estimates: Data sources, methods, and a snapshot of the cancer burden worldwide. Int J Cancer. 2025 Apr 1;156(7):1336-1346.. Disponible en: https://gco.iarc.fr/today
- Brandt MP, Gust KM, Mani J, Vallo S, Höfner T, Borgmann H, et al. Nationwide analysis on the impact of socioeconomic land use factors and incidence of urothelial carcinoma. Cancer Epidemiol. 2017;2018(52):63–69.
- Burger, M. et al. Epidemiology and risk factors of urothelial bladder cancer. Eur. Urol. 63, 234–41 (2013)
- Zhang Y, Rumgay H, Li M, Yu H, Pan H, Ni J. The global landscape of bladder cancer incidence and mortality in 2020 and projections to 2040. J Glob Health. 2023 Sep 15;13:04109.
- Stenzl A. Words of Wisdom. Re: Sex and racial differences in bladder cancer presentation and mortality in the US. Eur Urol 2010 April;57(4):729.)
- Lee CT, Dunn RL, Williams C, Underwood W. Racial disparity in bladder cancer: trends in tumor presentation at diagnosis. J Urol. 2006;176:927–933.
- Siegel R, Naishadham D, Jemal A. Cancer statistics, 2013. CA Cancer J Clin. 2013;63:11–30. doi: 10.3322/caac.21166.
- Prout GR, Wesley MN, McCarron PG, Chen VW, Greenberg RS, Mayberry RM, et al. Survival experience of black patients and white patients with bladder carcinoma. Cancer. 2004;100:621–630.
- Underwood W, Dunn RL, Williams C, Lee CT. Gender and geographic influence on the racial disparity in bladder cancer mortality in the US. J Am Coll Surg. 2006;202:284–290.
- Bray F et al (2018) Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin 68(6):394–424.
- Bray F et al (2015) Cancer incidence in fIve continents: inclusion criteria, highlights from volume X and the global status of cancer registration. Int J Cancer 137(9):2060–2071).
- Cassell A et al (2019) Non-muscle invasive bladder cancer: a review of the current trend in Africa. World J Oncol 10(3):123–131).
- Siegel RL, Miller KD, Jemal A. Cancer statistics, 2019. CA Cancer J Clin. 2019; 69: 7-34.
- Primer informe de registros poblaciones de cáncer de Chile, quinquenio 2003-2007. Unidad de vigilancia de enfermedades no transmisibles y estudios del Departamento de Epidemiologia de la División de Planificación Sanitaria de la Subsecretaria de Salud Pública, Ministerio de Salud, 2012. Disponible en http://epi.minsal.cl
- Fuente GLOBOCAN: https://gco.iarc.fr/today/data/factsheets/populations/152-chile-fact-sheets.pdf)
- Marshall G, Ferreccio C, Yuan Y, Bates MN, et al. Fifty-year study of lung and bladder cancer mortality in Chile related to arsenic in drinking water. J Natl Cancer Inst 2007;99(12):920-928
- Cumberbatch MG et al (2016) The role of tobacco smoke in bladder and kidney carcinogenesis: a comparison of exposures and meta-analysis of incidence and mortality risks. Eur Urol 70(3):458–466).
- Brennan, P., et al. Cigarette smoking and bladder cancer in men: a pooled analysis of 11 case- control studies. Int J Cancer, 2000. 86: 289.
- Freedman ND, Silverman DT, Hollenbeck AR, Schatzkin A, Abnet CC. Association between smoking and risk of bladder cancer among men and women. JAMA. 2011 Aug 17;306(7):737-45
- IARC Working Group on the Evaluation of Carcinogenic Risks to Humans. Tobacco smoke and involuntary smoking. IARC Monogr Eval Carcinog Risks Hum 2004;83:1-1438.
- Golka K, Wiese A, Assennato G, Bolt HM. Occupational exposure and urological cancer. World J Urol 2004;21(6):382-91.
- Reulen RC, Kellen E, Buntinx F, Brinkman M, Zeegers MP. A meta-analysis on the association between bladder cancer and occupation. Scand J Urol Nephrol Suppl. 2008 Sep;(218):64-78.
- Travis LB, Curtis RE, Glimelius B, Holowaty EJ, et al. Bladder and kidney cancer following cyclophosphamide therapy for non-Hodgkin´s lymphoma. J Natl Cancer Inst 1995;87(7):524-30.
- Nieder AM, Porter MP, Soloway MS. Radiation therapy for prostate cancer increases subsequent risk of bladder and rectal cancer: a population based cohort study. J Urol 2008;180(5):2005-9; discussion 2009-10.
- Kaldor JM, Day NE, Kittelmann B, Pettersson F, Langmark F, Pedersen D, Prior P, Neal F, Karjalainen S, Bell J et al. Bladder tumours following chemotherapy and radiotherapy for ovarian cancer: a case-control study. Int J Cancer 1995;63(1):1-6.
- Prout GR Jr, Griffin PP, Shipley WU. Bladder carcinoma as a systemic disease. Cancer 1979; 43(6):2532-9
- Fernández MI, Valdebenito P, Delgado I, Segebre J, Chaparro E, Fuentealba D, Castillo M, Vial C, Barroso JP, Ziegler A, Bustamante A. Impact of arsenic exposure on clinicopathological characteristics of bladder cancer: A comparative study between patients from an arsenic-exposed region and nonexposed reference sites. Urol Oncol. 2019 Oct 17.
- Bejany DE, Lockhart JL, Rhamy RK. Malignant vesical tumors following spinal cord injury. J Urol 1987;138:1930-35.
- Delnay KM, Stonehill WH, Goldman H, Jukkola AF, Dmochowski RR. Bladder histological changes associated with chronic indwelling urinary catheter. J Urol 1999;161(4):1106.
- Groah SL, Weitzenkamp DA, Lammertse DP, Whiteneck GG, Lezotte DC, Hamman RF. Excess risk of bladder cancer in spinal cord injury: evidence for an association between indwelling catheter used and bladder cancer. Arch Phys Med Rehabil 2002;83(3):346.
- Fedewa SA et al (2009) Incidence analyses of bladder cancer in the Nile delta region of Egypt. Cancer Epidemiol 33(3–4):176–181)
- Phelan A, Lopez-Beltran A, Montironi R, Zhang S, Raspollini MR, Cheng M, et al. Inherited forms of bladder cancer: A review of Lynch syndrome and other inherited conditions. Future Oncol. 2018;14(3): 277-90.
- Xu WJ, Wen LP, Jiang XX, Ye LY, Meng FH, Guan S, Qian YJ, Wei JF. Association between N-Acetyltransferase 2 Polymorphism and Bladder Cancer Risk: a Meta-Analysis in a Single Ethnic Group. Clin Lab. 2017 Feb 1;63(2):287-293.
- Zhou T, Li HY, Xie WJ, Zhong Z, Zhong H, Lin ZJ. Association of Glutathione S-transferase gene polymorphism with bladder Cancer susceptibility.BMC Cancer. 2018 Nov 12;18(1):1088.
- McConkey DJ, Lee S, Choi W, Tran M, Majewski T, Lee S, Siefker-Radtke A, Dinney C, Czerniak B.Molecular genetics of bladder cancer: Emerging mechanisms of tumor initiation and progression.UrolOncol. 2010 Jul-Aug;28(4):429-40. //. 36. Czerniak B. Molecular pathology and biomarkers of bladder cancer. Cancer Biomark. 2010;9(1- 6):159-76.
- Sauter G, et al. Tumours of the urinary system: non-invasive urothelial neoplasias. In: WHO classification of classification of tumours of the urinary system and male genital organs., Sauter G, Amin M, et al., Eds. 2004, IARCC Press: Lyon. http://publications.iarc.fr/Book-And-Report-Series/Who-Iarc-Classification-Of-Tumours/WhoClassification-Of-Tumours-Of-The-Urinary-System-And-Male-Genital-Organs-2016 35
- Moch H, Humphrey PA, Ulbright TM, et al., eds. WHO classifica- tion of tumours of the urinary system and male genital organs. Lyon (France): IARC Press 2016. (WHO classification of tumours series, 4th ed.; vol. 8). https://publications.iarc.fr/540.
- WHO Classification of Tumours Editorial Board. Urinary and male genital tumours. Lyon (France): IARC Press 2022 (WHO classification of tumours series, 5th ed.; vol. 8)
- Van Rhijn BW, Burger M, Lotan Y, et al. Recurrence and progression of disease in non-muscle-invasive bladder cancer: from epidemiology to treatment strategy. European urology 2009;56:430-42.
- Sylvester, R.J., et al. High-grade Ta urothelial carcinoma and carcinoma in situ of the bladder. Urology, 2005. 66: 90.
- Lamm, D., et al. Updated concepts and treatment of carcinoma in situ. Urol Oncol, 1998. 4: 130.
- Montironi R, Lopez-Beltran A, Scarpelli M, Mazzucchelli R, Cheng L. Morphological classification and definition of benign, preneoplastic and non-invasive neoplastic lesions of the urinary bladder. Histopathology 2008;53:621-33.
- Amin MB, Reuter VE, Epstein JI, Grignon DJ, Hansel DE, Lin O, McKenney JK, Montironi R, Paner GP, Soloway M and Members of the Pathology of Bladder Cancer Work Group. Pathology Consensus Guideline by the Pathology of Bladder Cancer Work Group, en: Bladder Tumors. Second edition, Paris, Editions 21, ICUD-EAU 2012, p. 63-168.
- Mostafa MH, Sheweita SA, O’Connor PJ. Relationship between schistosomiasis and bladder cancer. Clinical microbiology reviews 1999;12:97-111.
- Jacobo E, Loening S, Schmidt JD, Culp DA. Primary adenocarcinoma of the bladder: a retrospective study of 20 patients. J Urol 1977;117:54-6.
- Nocks BN, Heney NM, Daly JJ. Primary adenocarcinoma of urinary bladder. Urology 1983;21:26-9.
- Goyanna R, Emmett JL, Mc DJ. Exstrophy of the bladder complicated by adenocarcinoma. J Urol 1951;65:391-400.
- Sheldon CA, Clayman RV, Gonzalez R, Williams RD, Fraley EE. Malignant urachal lesions. J Urol 1984;131:1-8.
- Ashley RA, Inman BA, Sebo TJ, et al. Urachal carcinoma: clinicopathologic features and long-term outcomes of an aggressive malignancy. Cancer 2006;107:712-20.
- Amin MB, Ro JY, el-Sharkawy T, et al. Micropapillary variant of transitional cell carcinoma of the urinary bladder. Histologic pattern resembling ovarian papillary serous carcinoma. The American journal of surgical pathology 1994;18:1224-32.
- Guo CC, Tamboli P, Czerniak B. Micropapillary variant of urothelial carcinoma in the upper urinary tract: a clinicopathologic study of 11 cases. Arch Pathol Lab Med 2009;133:62-6.
- Amin MB, Ro JY, Elsharkawy T, et al. Micropapillary variant of transitionalcell carcinoma of the urinary-bladder—histologic pattern resembling ovarian papillary serous carcinoma. Am J Surg Pathol. 1994;18(12):1224–1232.
- Beltran AL, Cheng L, Montironi R, et al. Clinicopathological characteristics and outcome of nested carcinoma of the urinary bladder. Virchows Arch. 2014; 465(2):199–205.
- Linder BJ, Frank I, Cheville JC, et al. Outcomes following radical cystectomy for nested variant of urothelial carcinoma: a matched cohort analysis. J Urol. 2013;189(5):1670–1675.
- Amin MB. Histological variants of urothelial carcinoma: diagnostic, therapeutic and prognostic implications. Mod Pathol 2009;22 Suppl 2:S96-S118.
- Gontero, P., et al., EAU Guidelines on Non Muscle-invasive Bladder Cancer. EAU Guidelines 2025
- Comperat, E., et al. Micropapillary urothelial carcinoma of the urinary bladder: a clinicopathological analysis of 72 cases. Pathology, 2010. 42: 650.
- Willis, D.L., et al. Clinical outcomes of cT1 micropapillary bladder cancer. J Urol, 2015. 193: 1129.
- Epstein JI, Amin, M.B., Reuter, V.E. Histologic variants of urothelial carcinoma. Philadelphia, PA: Lippincott Williams and Wilkins; 2010.
- Davis R, Jones JS, Barocas DA et al: Diagnosis, evaluation and follow-up of asymptomatic microhematuria (AMH) in adults: AUA guideline. J Urol 2012; 188: 2473.
- O’Connor OJ, Fitzgerald E, Maher MM. Imaging of haematuria. AJR Am J Roentgenol 2010; 195:263–7.
- Golin AL, Howard RS. Asymptomatic microscopic hematuria. J Urol. 1980 Sep;124(3):389-91.
- Grossfield GD, Wolf JS, Litwin MS, et al. Asymptomatic microscopic haematuria in adults: summary of the AUA Best Practice Policy Recommendations. Am Fam Physician 2001; 63:1145–53.
- Yeoh M, Macroscopic haematuria. A urological approach. Pain. Volume 42, No.3, March 2013, Pages 123-126.
- Alan J., Wein L., Kavoussi A., Novick A., et al.: “Campbell-Walsh Urology Tenth Edition”. 2011:10th revised edition, cap 81. ISBN-10: 1416069119 , ISBN-13 : 978-1416069119.
- AUA/SUO Joint Guideline, Diagnosis and Treatment of Non-Muscle Invasive Bladder Cancer, 2016.
- Gaston KE and Pruthi RS: Value of urinary cytology in the diagnosis and management of urinary tract malignancies. Urology 2004; 63: 1009.
- Koss LG, Deitch D, Ramanathan R and Sherman AB: Diagnostic value of cytology of voided urine. Acta Cytol 1985; 29: 810.
- Wojcik, E.M., Kurtycz, D.F.I., Rosenthal, D.L., The Paris System for Reporting Urinary Cytology, ed. E.M. Wojcik, Kurtycz, DFI, Rosenthal, D.L., Eds. Vol. 2nd Edn. . 2022.
- Chau Hung Lee et al. Role of Imaging in the Local Staging of Urothelial Carcinoma of the Bladder. American Journal of Roentgenology 2017, 208:6, 1193-1205.
- J. Bellmunt et al. Bladder cancer: ESMO Practice Guidelines for diagnosis, treatment and follow up. Annal of Oncology 2014, 25:3, iii40-iii48.
- Masahiro Jinzaki et al. Comparison of CT urography and Excretory Urography in the Detection and Localization of Urothelial Carcinoma of the Upper Urinary Tract. American Journal of Roentgenology 2011, 196:5, 1102-1109.
- Christian B van der Pol et al. ACR Appropriateness Criteria Pretreatment Staging of Muscle-Invasive Bladder Cancer. American College of Radiology 2018, 15:55, 150-159.
- Konstantinos Stamatiou et al. The accuracy of Ultrasonography in the diagnosis of superficial bladder tumors in patients presenting with hematuria. Ann Saudi Med 2009, 29:2, 134-137.
- Sadhna Verma et al. Urinary Bladder Cancer: Role of MR Imaging. Radiographics 2012, 32: 371-387.
- Valeria Panebianco et al. Multiparametric Magnetic Resonance Imaging of Bladder Cancer: Development of VI-RADS (Vesical Imaging-Reporting And Data System). Eur Urol. 2018. 74:3, 294-306.
- Hanjun Wang et al. Multiparametric MRI for Bladder Cancer: Validation of VI-RADS for the Detection of Detrusor Muscle Invasion. Radiology 2019. 00: 1-8.
- Chen G, Wang B, Li H, Ma X, Shi T, Zhang X. Applying narrow-band imaging in complement with white-light imaging cystoscopy in the detection of urothelial carcinoma of the bladder. Urol Oncol. 2013 May;31(4):475-9
- Bladder Cancer, National Comprehensive Cancer Network (NCCN) Guidelines, July 10, 2019.
- Tabayoyong, W., & Kamat, A. M. (2018). Current Use and Promise of Urinary Markers for Urothelial Cancer. Current Urology Reports, 19(12).
- Gofrit ON, et al. The predictive value of multi-targeted fluorescent in-situ hybridization in patients with history of bladder cancer. Urol Oncol. 2008;26(3):246–9.
- Van Kessel KE, et al. Validation of a DNA methylation mutation urine assay to select patients with hematuria for cystoscopy. J Urol. 2017;197(3 Pt 1):590–5.
- Comperat, E., et al. What’s new in WHO fifth edition – urinary tract. Histopathology, 2022. 81: 439
- Soloway M., Khoury S.: “2nd International Consultation on Bladder Cacer-Vienna”. Second edition 2012. ISBN : 978-9953-493-20-6).
- Trinchieri A., Mangiarotti B., Lizzano R.: “Use of levofloxacin in the antibiotic prophylaxis for diagnostic procedures in urology”. Arch Ital Urol Androl 2002; 74:33-9.
- MacDermott J., Ewing R., Somerville J., Gray B.: “Cephradine prophylaxis in transurethral procedures for carcinoma of the bladder”. Br J Urol 1988; 62:136-9.
- Koch M., Smith J.: “Natural history and surgical management of super- ficial bladder cancer (stages Ta/T1/Tis)”. In: Vogelzang N., Miles B., editors. Comprehensive textbook of genitourinary oncology. Baltimore: Wil- liams & Wilkins; 1996. p. 405–15.
- Manoharan M., Soloway M.: “Optimal management of the T1G3 bladder cáncer”. Urol Clin North Am. 2005 May;32(2):133-45.
- Richterstetter M., Wullich B., Amann K., et al.: “The value of extended transurethral resection of bladder tumour (TURBT) in the treatment of bladder cáncer”. BJU Int 2012 Jul;110(2 Pt 2):E76-9.
- Sylvester R., Van der Meijden A., Oosterlinck W., et al.: “Predicting recurrence and progression in individual patients with stage Ta, T1 bladder cancer using EORTC risk tables: a combined analysis of 2596 patients from seven EORTC trials”. Eur Urol 2006 Mar;49(3):466-5.
- Mariappan P., Zachou A., Grigor K.: “Detrusor muscle in the first, apparently complete transurethral resection of bladder tumour specimen is a surrogate marker of resection quality, predicts risk of early recurrence, and is dependent on operator experience”. Eur Urol 2010 May;57(5):843-9).
- Xishuang S., Deyong Y., Xiangyu C., Tao J., et al.: “Comparing the safety and efficiency of conventional monopolar, plasmakinetic, and holmium laser transurethral resection of primary non-muscle invasive bladder cáncer”. J Endourol. 2010 Jan;24(1):69-73.
- Del Rosso A., Pace G., Masciovecchio S., Saldutto P., et al.: “Plasmakinetic bipolar versus monopolar transurethral resection of non-muscle invasive bladder cancer: a single center randomized controlled trial”. Int J Urol. 2013 Apr;20(4):399-403. doi: 10.1111/j.1442-2042.2012.03174.x. Epub 2012 Sep 25.
- Sugihara T., Yasunaga H., Horiguchi H., Matsui H., et al.: “Comparison of perioperative outcomes including severe bladder injury between monopolar and bipolar transurethral resection of bladder tumors: a population based comparison”. J Urol. 2014 Nov;192(5):1355-9.
- Kausch I., Sommerauer M., Montorsi F., et al: “Photodynamic diagnosis in non-muscle-invasive bladder cancer: a systematic review and cumulative analysis of prospective studies”. Eur Urol 2010 Apr;57(4):595-606.
- Mowatt G., N’Dow J., Vale L., et al.: “Aberdeen Technology Assessment Review (TAR) Group. Photodynamic diagnosis of bladder cancer compared with white light cystoscopy: Systematic review and meta-analysis”. Int J Technol Assess Health Care 2011 Jan;27(1):3-10.
- Chou, R., et al. Comparative Effectiveness of Fluorescent Versus White Light Cystoscopy for Initial Diagnosis or Surveillance of Bladder Cancer on Clinical Outcomes: Systematic Review and Meta-Analysis. J Urol, 2017. 197: 548.
- Herr H., Donat S.: “A comparison of white-light cystoscopy and narrow-band imaging cystoscopy to detect bladder tumour recurrences”. BJU Int 2008; 102: 1111–4.
- Cauberg E., Kloen S., Visser M., et al.: “Narrow band imaging cystoscopy improves the detection of non-muscle invasive bladder cáncer”. Urology 2010; 76: 658–63.
- Zheng C., Lv Y., Zhong Q., Wang R., et al.: “Narrow band imaging diagnosis of bladder cancer: a systematic review and meta-analyis”. BJU Int 2012; 110: 680–7
- Naselli A., Introini C., Bertolotto F., Spina B., Puppo P.: “Narrow band imaging for detection residual/recurrent cancerous tissue during second transurethral resection of newly diagnosed non-muscle-invasive high-grade bladder cáncer”. BJU Int 2010; 105: 208–11.
- Naselli A., Introini C., Timossi L., et al.: “A randomized prospective trial to assess the impact of transurethral resection in narrow band imaging modality on non-muscle invasive bladder cancer recurrence”. Eur Urol 2012; 61: 908–13.
- Naito, S., et al. The Clinical Research Office of the Endourological Society (CROES) Multicentre Randomised Trial of Narrow Band Imaging-Assisted Transurethral Resection of Bladder Tumour (TURBT) Versus Conventional White Light Imaging-Assisted TURBT in Primary Non-Muscle-invasive Bladder Cancer Patients: Trial Protocol and 1-year Results. Eur Urol, 2016. 70: 506.
- Bach T., Muschter R., Herrmann R. et al.: “Technical solutions to improve the management of non-muscle-invasive transitional cell carcinoma: summary of a European Association of Urology Section for Uro-Technology (ESUT) and Section for Uro-Oncology (ESOU) expert meeting and current and future perspectives”. BJU Int. 2015 Jan;115(1):14-23.
- Ukai R., Kawashita E., Ikeda H.: “A new technique for transurethral resection of superficial bladder tumor in 1 piece”. J Urol 2000; 163: 878–9.
- Saito S.: “Transurethral en bloc resection of bladder tumors”. J Urol 2001; 166: 2148–50.
- Wolters M., Kramer M., Becker J., et al.: “Tm:YAG laser en bloc mucosectomy for accurate staging of primary bladder cancer: early experience”. World J Urol 2011; 29: 429–32.
- Nagele U., Kugler M., Nicklas A., et al.: “Waterjet hydrodissection: first experiences and short-term outcomes of a novel approach to bladder tumor resection”. World J Urol 2011; 29: 423–7.
- Li, Z., et al. Systematic review and meta-analysis of randomized controlled trials of perioperative outcomes and prognosis of transurethral en-bloc resection vs. conventional transurethral resection for non-muscle-invasive bladder cancer. Int J Surg, 2022. 104: 106777.
- Gallioli, A., et al. En Bloc Versus Conventional Transurethral Resection of Bladder Tumors: A Single-center Prospective Randomized Noninferiority Trial. Eur Urol Oncol, 2022. 5: 440.
- Yanagisawa, T., et al. En Bloc Resection for Bladder Tumors: An Updated Systematic Review and Meta-Analysis of Its Differential Effect on Safety, Recurrence and Histopathology. J Urol, 2022. 207: 754.
- D’Andrea, D., et al. En Bloc Versus Conventional Resection of Primary Bladder Tumor (eBLOC): A Prospective, Multicenter, Open-label, Phase 3 Randomized Controlled Trial. Eur Urol Oncol, 2023. 6: 508.
- Yuen-Chun Teoh, J., et al. Transurethral En Bloc Resection Versus Standard Resection of Bladder Tumour: A Randomised, Multicentre, Phase 3 Trial. Eur Urol, 2024. 86: 103.
- Brausi M., Collette L., Kurth K., et al.: “EORTC Genito-Urinary Tract Cancer Collaborative Group. Variability in the recurrence rate at first follow-up cystoscopy after TUR in stage Ta T1 transitional cell carcinoma of the bladder: a combined analysis of seven EORTC studies”. Eur Urol 2002 May;41(5): 523-3.
- Miladi M., Peyromaure M., Zerbib M., et al.: “The value of a second transurethral resection in evaluating patients with bladder tumours”. Eur Urol 2003 Mar;43(3):241-5.
- Brauers A., Buettner R., Jakse G.: “Second resection and prognosis of primary high risk superficial bladder cancer: is cystectomy often too early?” J Urol 2001 Mar;165(3):808-10.
- Schips L., Augustin H., Zigeuner R., et al.: “Is repeated transurethral resection justified in patients with newly diagnosed superficial bladder cancer?”Urology 2002 Feb;59(2):220-3.
- Grimm M., Steinhoff C., Simon X., et al.: “Effect of routine repeat transurethral resection for superficial bladder cancer: a long-term observational study”. J Urol 2003 Aug;170(2 Pt 1):433-7.
- Divrik R., Yildirim Ü., Zorlu F., et al.: “The effect of repeat transurethral resection on recurrence and progression rates in patients with T1 tumours of the bladder who received intravesical mitomycin: a prospective, randomized clinical trial”. J Urol 2006 May;175(5):1641-4.
- Jahnson S., Wiklund F., Duchek M., et al.: “Results of second-look resection after primary resection of T1 tumour of the urinary bladder”. Scand J Urol Nephrol 2005;39(3):206-10.
- Lazica D., Roth S., Brandt A., et al.: “Second transurethral resection after Ta high-grade bladder tumor: a 4.5-year period at a single university center”. Urol Int. 2014;92(2):131-5. doi: 10.1159/000353089. Epub 2013 Aug 23.
- Van der Meijden A., Oosterlinck W., Brausi M., Kurth K., et al.: “Significance of bladder biopsies in Ta,T1 bladder tumors: a report from the EORTC Genito-Urinary Tract Cancer Cooperative Group. EORTC- GU Group Superficial Bladder Committee”. Eur Urol 1999;35:267-71.
- Taguchi I., Gohji K., Hara I., et al.: “Clinical evaluation of random biopsy of urinary bladder in patients with superficial bladder cáncer”. Int J Urol 1998;5:30-4.
- May F., Treiber U., Hartung R., Schwaibold H.: “Significance of random bladder biopsies in superficial bladder cáncer”. Eur Urol 2003;44:47-50.
- Palou J., Sylvester R., Faba O., et al.: “Female gender and carcinoma in situ in the prostatic urethra are prognostic factors for recurrence, progression, and disease-specific mortality in T1G3 bladder cancer patients treated with bacillus Calmette-Guérin”. Eur Urol 2012 Jul;62(1):118-25.
- Matzkin H., Soloway M., Hardeman S.: “Transitional cell carcinoma of the prostate”. J Urol 1991 Nov;146(5):1207-12.
- Mungan M., Canda A., Tuzel E., et al.: “Risk factors for mucosal prostatic urethral involvement in superficial transitional cell carcinoma of the bladder”. Eur Urol 2005 Nov;48(5):760-3.
- Libro del Residente de Urología, Sociedad Española de Urología, 2007
- Messing, E.M., et al. Effect of Intravesical Instillation of Gemcitabine vs Saline Immediately Following Resection of Suspected Low-Grade Non-Muscle-Invasive Bladder Cancer on Tumor Recurrence: SWOG S0337 Randomized Clinical Trial. JAMA, 2018. 319: 1880.
- Sylvester RJ, Oosterlinck W, Holmang S, et al. Systematic review and individual patient data meta-analysis of randomized trials comparing a single immediate instillation of chemotherapy after transurethral resection with transurethral resection alone in patients with stage pTa-pT1 urothelial carcinoma of the bladder: which patients benefit from the instillation? Eur Urol 2016;69:231–44.
- Malmstrom PU, Sylvester RJ, Crawford DE, et al. An individual patient data meta-analysis of the long-term outcome of randomised studies comparing intravesical mitomycin C versus bacillus Calmette-Guerin for non-muscle-invasive bladder cancer. Eur Urol 2009;56:247–56.
- Boehm, B.E., et al. Efficacy of bacillus Calmette-Guerin Strains for Treatment of Nonmuscle Invasive Bladder Cancer: A Systematic Review and Network Meta-Analysis. J Urol, 2017. 198: 503.
- Martinez-Pineiro, L., et al. Maintenance Therapy with 3-monthly Bacillus Calmette-Guerin for 3 Years is Not Superior to Standard Induction Therapy in High-risk Non-muscle-invasive Urothelial Bladder Carcinoma: Final Results of Randomised CUETO Study 98013. Eur Urol, 2015. 68: 256.
- Oddens, J., et al. Final results of an EORTC-GU cancers group randomized study of maintenance bacillus Calmette-Guerin in intermediate- and high-risk Ta, T1 papillary carcinoma of the urinary bladder: one-third dose versus full dose and 1 year versus 3 years of maintenance. Eur Urol, 2013. 63: 462.
- Choi, S.Y., et al. Low-dose versus standard-dose bacille Calmette-Guerin for non-muscle-invasive bladder cancer: Systematic review and meta-analysis of randomized controlled trials. Investig Clin Urol, 2022. 63: 140
- Ministerio de Salud de Chile (2024). Guía de práctica clínica Cáncer Vesical en Personas de 15 años y más. https://diprece.minsal.cl/le-informamos/auge/acceso-guias-clinicas/guias-clinicas-desarrolladas-utilizando-manual-metodologico/cancer-vesical-en-personas-de-15-anos-y-mas/recomendaciones/
- Lerner, S.P., et al. Failure to achieve a complete response to induction BCG therapy is associated with increased risk of disease worsening and death in patients with high risk non-muscle invasive bladder cancer. Urol Oncol, 2009. 27: 155.
- Steinberg, R.L., et al. Multi-Institution Evaluation of Sequential Gemcitabine and Docetaxel as Rescue Therapy for Nonmuscle Invasive Bladder Cancer. J Urol, 2020. 203: 902.
- Balar, A.V., et al. Pembrolizumab monotherapy for the treatment of high-risk non-muscle-invasive bladder cancer unresponsive to BCG (KEYNOTE-057): an open-label, single-arm, multicentre, phase 2 study. Lancet Oncol, 2021. 22: 919
- Boorjian, S.A., et al. Intravesical nadofaragene firadenovec gene therapy for BCG-unresponsive non-muscle-invasive bladder cancer: a single-arm, open-label, repeat-dose clinical trial. Lancet Oncol, 2021. 22: 107
- Catto, J.W.F., et al. Erdafitinib in BCG-treated high-risk non-muscle-invasive bladder cancer. Ann Oncol, 2024. 35: 98
- Hautmann R., Abol- Enein H., Hafez K., Haro I., et al.: “World Health Organization (WHO) Consensus Conference in Bladder Cancer. Urinary diversión”. Urology 2007 Jan;69(1 Suppl):17-49.
- Van der Heijden“Guidelines on Muscle-invasive and Metastatic Bladder Cancer. European Association of Urology 2025”. Limited update March 2025.
- Thurairaja R., Burkhard F., Studer U.: “The orthotopic neobladder”. BJU Int. 2008 Nov;102(9 Pt B):1307-13. doi: 10.1111/j.1464-410X.2008.07975.x.
- Stenzl A., Nagele U., Kuczyk M., Sievert K.: “Cystectomy – Technical Considerations in Male and Female Patients”. EAU Update Series, 2005. 3: p. 138-46.
- Abdelhady, M., Abusamra A., Pautler S., Chin J., et al.: “Clinically significant prostate cancer found incidentally in radical cystoprostatectomy specimens”. BJU Int, 2007. 99(2): p. 326-9.
- Pettus, J., Al-Ahmadie H., Barocas D., Koppie T, et al.: “Risk assessment of prostatic pathology in patients undergoing radical cystoprostatectomy”. Eur Urol, 2008. 53(2): p. 370-5.
- Weizer A., Shah R., Lee C., Gilbert S.: “Evaluation of the prostate peripheral zone/capsule in patients undergoing radical cystoprostatectomy: defining risk with prostate capsule sparing cystectomy”. Urol Oncol, 2007. 25(6): p. 460-4.
- Ong C., Schmitt M., Thalmann G.: “Studer, Individualized seminal vesicle sparing cystoprostatectomy combined with ileal orthotopic bladder substitution achieves good functional results”. J Urol, 2010. 183(4): p. 1337-41.
- Bhatta D., Kessler T., Mills R., Burkhard F., et al.: “Nerve-sparing radical cystectomy and orthotopic bladder replacement in female patients”. Eur Urol. 2007 Oct;52(4):1006-14. Epub 2007 Mar 5.
- Dhar N., Klein E., Reuther A., Thalmann G.: “Outcome after radical cystectomy with limited or extended pelvic lymph node dissection”. J Urol. 2008 Mar;179(3):873-8.
- Isaka S., Okano T., Sato N., Shimazaki J.: “Pelvic lymph node dissection for invasive bladder cáncer”. Nihon Hinyokika GakkaiZasshi 1989;80:402–6.
- Miyakawa M., Oishi K., Okada Y., Takeuchi H.: “Results of the multidisciplinary treatment of invasive bladder cáncer”. Hinyokika Kiyo 1986;32:1931–9.
- Yuasa M., Yamamoto A., Kawanishi Y., Higa I., et al.: “Clinical evaluation of total cystectomy for bladder carcinoma: a ten-year experience”. Hinyokika Kiyo 1988;34:975–81.
- Zlotta A.: “Limited, extended, superextended, megaextended pelvic lymph node dissection at the time of radical cystectomy: what should we perform?” Eur Urol 2012 Feb;61(2):243-4.
- Bruins H., Veskimae E., Hernandez V., Imamura M., et al.: “The impact of the extent of lymphadenectomy on oncologic outcomes in patients undergoing radical cystectomy for bladder cáncer. A systematic review. Eur Urol. 2014 Dec;66(6):1065-77. doi:10.1016/j.eururo.2014.05.031. Epub 2014 Jul 26.
- Fiona C., Burkhard M., Beat R., Zehnder P. et al.: “Lymphadenectomy for Bladder Cancer: Indications and Controversies”. Urol Clin N Am 38 (2011) 397–405.
- Zehnder P., Studer U., Skinner E., et al.: “Super extended versus extended pelvic lymph node dissection in patients undergoing radical cystectomy for bladder cancer: a comparative study”. J Urol 2011;186:1261–8.
- Gschwend, J.E., et al. Extended Versus Limited Lymph Node Dissection in Bladder Cancer Patients Undergoing Radical Cystectomy: Survival Results from a Prospective, Randomized Trial. Eur Urol, 2018.
- Taguchi, S., Nakagawa, T., & Fukuhara, H. (2019). Re: Jürgen E. Gschwend, Matthias M. Heck, Jan Lehmann, et al. Extended Versus Limited Lymph Node Dissection in Bladder Cancer Patients Undergoing Radical Cystectomy: Survival Results from a Prospective, Randomized Trial. Eur Urol 2019;75:604–11.
- https://www.swog.org/clinical-trials/s1011
- Ayres B., Gillatt D., McPhail S., et al.: “A delay in radical cystectomy of >3 months is not associated with a worse clinical outcome”. BJU Int 2008 Sep;102(8):1045.
- Gore J., Lai J., Setodji C., et al.: “Mortality increases when radical cystectomy is delayed more than 12 weeks: results from a Surveillance, Epidemiology, and End Results-Medicare analysis”. Cancer 2009 Mar;115(5):988-96.
- Challacombe B., Bochner B., Dasgupta P., et al.: “The role of laparoscopic and robotic cystectomy in the management of muscle-invasive bladder cancer with special emphasis on cancer control and complications”. Euro Urol 2011;60(4):767-75.
- Aboumarzouk O., Hughes O., Narahari K., et al.: “Safety and feasibility of Laparoscopic Radical Cystectomy for the treatment of bladder cáncer”. J Endourol 2013 Sep;27(9):1083-95.
- Rai, B.P., et al. Robotic versus open radical cystectomy for bladder cancer in adults. Cochrane Database Syst Rev, 2019. 4:
- Khetrapal, P., et al. Robot-assisted Radical Cystectomy Versus Open Radical Cystectomy: A Systematic Review and Meta-analysis of Perioperative, Oncological, and Quality of Life Outcomes Using Randomized Controlled Trials. Eur Urol, 2023. 84: 393.
- Khan, M.S., et al. A Single-centre Early Phase Randomised Controlled Three-arm Trial of Open, Robotic, and Laparoscopic Radical Cystectomy (CORAL). Eur Urol, 2016. 69: 613.
- Mastroianni, R., et al. Open Radical Cystectomy versus Robot-Assisted Radical Cystectomy with Intracorporeal Urinary Diversion: Early Outcomes of a Single-Center Randomized Controlled Trial. J Urol, 2022. 207: 982
- Maibom, S.L., et al. Open vs robot-assisted radical cystectomy (BORARC): a double-blinded, randomised feasibility study. BJU Int, 2022. 130: 102.
- Catto, J.W.F., et al. Effect of Robot-Assisted Radical Cystectomy With Intracorporeal Urinary Diversion vs Open Radical Cystectomy on 90-Day Morbidity and Mortality Among Patients With Bladder Cancer: A Randomized Clinical Trial. JAMA, 2022. 327: 2092.
- Bruins HM, Veskimae E, Hernandez V, et al. The Importance of Hospital and Surgeon Volume as Major Determinants of Morbidity and Mortality After Radical Cystectomy for Bladder Cancer: A Systematic Review and Recommendations by the European Association of Urology Muscle-invasive and Metastatic Bladder Cancer Guideline Panel. Eur Urol Oncol. December 2019.
- Madersbacher S., Hochreiter W., Burkhard F., et al.: “Radical cystectomy for bladder cancer today-a homogeneous series without neoadjuvant therapy”. J Clin Oncol 2003 Feb;21(4):690-6.
- Pansadoro V., Emiliozzi P., De Paula F., et al.: “Long-term follow-up of G3T1 transitional cell carcinoma of the bladder treated with intravesical bacille Calmette-Guérin: 18-year experience”. Urology 2002 Feb;59(2):227-31.
- Pillai P., McEleavy I., Gaughan M., et al.: “A double-blind randomized controlled clinical trial to assess the effect of Doppler optimized intraoperative fluid management on outcome following radical cystectomy”. J Urol 2011;186:2201–6.
- Wühtrich P., Studer U., Thalmann G., Burkhard F.: “Intraoperative continuous norepinephrine infusion combined with restrictive deferred hydration significantly reduces the need for blood transfusion in patients undergoing open radical cystectomy: results of a prospective randomised trial”. Eur Urol. 2014 Aug;66(2):352-60. doi: 10.1016/j.eururo.2013.08.046. Epub 2013 Aug 28.
- Hilton W., Lotan Y., Parekh D., Basler J, et al.: “Alvimopan for prevention of postoperative paralytic ileus in radical cystectomy patients: a cost-effectiveness analysis”. BJU Int. 2013;111:1054-1060.
- Lee C., Chang S., Kamat A., Amiel G., et al.: “ Alvimopan accelerates gastrointestinal recovery after radical cystectomy: a multicenter randomized placebo-controlled trial”. Eur Urol. 2014 Aug;66(2):265-72. doi: 10.1016/j.eururo.2014.02.036. Epub 2014 Feb 26.
- Buchler M., Seiler C., Monson J, et al.: “Clinical trial: alvimopan for the management of post-operative ileus after abdominal surgery: results of an international randomized, double-blind, multicentre, placebo-controlled clinical study”. Aliment Pharmacol Ther. 2008;28:312-325.
- Choi H., Kang S., Yoon D., Kang S., et al.: “Chewing gum has a stimulatory effect on bowel motility in patients after open or robotic radical cystectomy for bladder cancer: a prospective randomized comparative study”. Urology. 2011 Apr;77(4):884-90. doi: 10.1016/j.urology.2010.06.042. Epub 2010 Oct 15.
- Kouba E., Wallen E., Pruthi R.: “Gum chewing stimulates bowel motility in patients undergoing radical cystectomy with urinary diversión”. Urology. 2007 Dec;70(6):1053-6 .
- Pozo, C., Shariat, S. F., D’Andrea, D., Fajkovic, H., & Abufaraj, M. (2019). Enhanced Recovery after Radical Cystectomy. Current Opinion in Urology, 29(3), 227–238
- Hautmann R., De Petriconi R., Volkmer B.: “Lessons learned from 1,000 neobladders: the 90-day complication rate”. J Urol 2010 Sep;184(3):990-4.
- Stein J., Skinner D.: “Radical cystectomy for invasive bladder cancer: long-term results of a standard procedure”. World J Urol 2006 Aug;24(3):296-304.
- Hautmann R., De Petriconi R., Pfeiffer C., et al.: “Radical cystectomy for urothelial carcinoma of the bladder without neoadjuvant or adjuvant therapy: long-term results in 1100 patients”. Eur Urol 2012 May;61(5):1039-47.
- Porter M., Gore J., Wright J.: “Hospital volume and 90-day mortality risk after radical cystectomy: a populationbased cohort study”. World J Urol 2011 Feb;29(1):73-7.
- Nuhn P., May M., Sun M., et al.: “External validation of postoperative nomograms for prediction of allcause mortality, cancer-specific mortality, and recurrence in patients with urothelial carcinoma of the bladder”. Eur Urol 2012 Jan; 61(1):58-64.
- Stein J., Lieskovsky G,. Cote R., et al. : “Radical cystectomy in the treatment of invasive bladder cancer: long-term results in 1,054 patients”. J Clin Oncol 2001 Feb;19(3):666-75.
- Gerharz E., Turner W., Kälble T., et al.: “Metabolic and functional consequences of urinary reconstruction with bowel”. BJU Int 2003 Jan;91(2):143-9
- Tanrikut C., McDougal W.: “Acid-base and electrolyte disorders after urinary diversión». World J Urol 2004 Sep; 22(3):168-71. 295.
- Farnham S., Cookson M.: “Surgical complications of urinary diversión”. World J Urol 2004 Sep;22(3):157-67. 296.
- Hautmann R., Volkmer B., Schumacher M, et al.: “Long-term results of standard procedures in urology: the ileal neobladder”. World J Urol 2006 Aug;24(3):305-14).
- Jentzmik F., Schrader A., De Petriconi R., et al.: “The ileal neobladder in female patients with bladder cancer: longterm clinical, functional, and oncological outcome”. World J Urol 2012 Dec;30(6):733-9.
- Ahmadi H., Skinner E., Simma-Chiang V., et al.: “Urinary functional outcome following radical cystoprostatectomy and ileal neobladder reconstruction in male patients”. J Urol 2013 May;189(5):1782-8.
- Wuethrich, P. Y., Vidal, A., & Burkhard, F. C. (2016). There is a place for radical cystectomy and urinary diversion, including orthotopic bladder substitution, in patients aged 75 and older: Results of a retrospective observational analysis from a high-volume center. Urologic Oncology: Seminars and Original Investigations, 34(2), 58.e19–58.e27. doi:10.1016/j.urolonc.2015.08.011
- Saika T., Arata R., Tsushima T. et al.: “Health-related quality of life after radical cystectomy for bladder cancer in elderly patients with an ileal conduit, ureterocutaneostomy, or orthotopic urinary reservoir: a comparative questionnaire survey”. Acta Med Oka 2007; 61:199-203.
- Yamanaka K., Miyake H., Hara I., et al.: “Significance of radical cystectomy for bladder cancer in patients over 80 years old”. Int Urol Nephro. 2007; 39:209-14.
- Deliveliotis C., Papatsoris A., Chrisofos M., et al.: “Urinary diversion in high-risk elderly patients: modified cutaneous ureterostomy or ileal conduit?” Urology 2005 Aug;66(2):299-304.
- Kanofsky J., Godoy G., Taneja S.: “Complications of Urologic Surgery”. In Taneja SS ed, 4 edn, Philadelphia Saunders Elsevier 2010; 533-46.
- Yong S., Dublin N., Pickard R., et al.: “Urinary diversion and bladder reconstruction/ replacement using intestinal segments for intractable incontinence or following cystectomy”. Cochrane Database SystRev. 2009:CDOO3306.
- Mattei A., Birkhaeuser F., Baermann C., Warncke S., et al.: “To stent or not to stent perioperatively the ureteroileal anastomosis of ileal orthotopic bladder substitutes and ileal conduits? Results of a prospective randomized trial”. J Urol. 2008 Feb;179(2):582-6. Epub 2007 Dec 21.
- Shimko M., Tollefson M., Umbreit E., et al: “Long- term Complications of Conduit Urinary Diversion”. JUrol 2011;185:562-567.
- Madersbacher S., Schmidt J., Eberle J., et al: “Long-term outcome of ileal conduit diversion”. JUrol 2003;169:985- 990.
- Somani B., Nabi G., Wong S., et al.: “How close are we to knowing whether orthotopic bladder replacement surgery is the new gold standard? – evidence from a systematic review update”. Urology 2009; 74:1331-9.
- Jin X., Roethlisberger S., Burkhard F., Birkhaeuser F., et al.: “Long-term renal function after urinary diversion by ileal conduit or orthotopic ileal bladder substitution”. Eur Urol. 2012 Mar;61(3):491-7. doi: 10.1016/j.eururo.2011.09.004. Epub 2011 Sep 15.
- Kock N., Nilson A., Nilsson L., et al.: “Urinary diversion via a continent ileal reservoir: clinical results in 12 patients”. JUrol ; 128:469-475.
- Wiesner C., Bonfig R., Stein R., et al.: “Continent cutaneous urinary diversion: long-term follow-up of more than 800 patients with ileocecal reservoirs”. World J Urol 2006 Aug;24(3):315-8.
- Okada Y., Shichiri Y., Terai A., et al.: “Management of late complications of continent urinary diversion using the Kock pouch and the Indiana pouch procedures”. Int J Urol 1996; 3:334-339.
- Spirnak J., Caldamone A.: Ureterosimoidostomy. Urol Clin NorthAm 1986; 13:285-294.
- Coffey R.: “Physiologic implantation of the severed ureter or common bile duct into the intestine”. JAMA 1911; 56:397.
- Hendren W.: “Reconstruction of previously diverted urinary tracts in children”. JPediatrSurg 1973; 8:135-150.
- Duckett J., Gazak J.: “Complications of ureterosigmoidostomy”. UrolClinNorthAm 1983; 10:473- 481.
- Azimuddin K., Khubchandanil T., Stasik J., et al.: “Neoplasia after reterosigmoidostomy”. Dis Colon Rectum 1999 Dec;42(12):1632-8.
- Hautmann R., Abol-Enein H., Lee C., Mansson W., et al.: “Urinary diversion: how experts divert”. Urology. 2015 Jan;85(1):233-8. doi: 10.1016/j.urology.2014.06.075. Epub 2014 Nov 8.
- Gore J., Litwin M.: “Quality of care in bladder cancer: trends in urinary diversion following radical cystectomy”. World J Urol. 2009; 27:45-50.
- Kim S., Shah N., Weight C.: “Population-based trends in urinary diversion among patients undergoing radical cystectomy for bladder cáncer”. BJU Int. 2013;112:478-484.
- Saigal C., Gore J., Polich S.: “Trends in reconstruction after radical cystectomy in the Medicare population”. J Urol. 2005;173(Suppl): 133; Abstract 487.
- Burkhard F., Kessler T., Mills R., Studer U.: “Continent urinary diversión”. Crit Rev Oncol Hematol 2006; 57: 255–64.
- Burkhard F., Kessler T., Springer J., et al.: “Early and late urodynamic assessment of ileal orthotopic bladder substitutes combined with an afferent tubular segment”. JUrol 2006; 175: 2155-2160; discussion 2160-2151.
- Kessler T., Burkhard F., Perimenis P., et al.: “Attempted nerve sparing surgery and age have a significant effect on urinary continence and erectile function after radical cystoprostatectomy and ileal orthotopic bladder substitution”. JUrol 2004; 172: 1323-1327.
- Studer U., Burkhard F., Schumacher M., et al.: “Twenty years experience with an ileal orthotopic low pressure bladder substitute – lessons to be learned”. JUrol 2006; 176:161-166).
- Waidelich R., Rink F., et al.: “A study of reflux in patients with an ileal orthotopic bladder“. BrJUrol 1998; 81:241-246.
- Skinner E., Fairey A., Groshen S., Daneshmand S., et al.: “Randomized Trial of Studer Pouch versus T-Pouch Orthotopic Ileal Neobladder in Bladder Cancer Patients”. J Urol. 2015 Mar 27. pii: S0022-5347(15)03565-X. doi: 10.1016/j.juro.2015.03.101.)
- Grossman, H.B., et al. Neoadjuvant chemotherapy plus cystectomy compared with cystectomy alone for locally advanced bladder cancer. N Engl J Med, 2003. 349: 859.
- International Collaboration of, T., et al. International phase III trial assessing neoadjuvant cisplatin, methotrexate, and vinblastine chemotherapy for muscle-invasive bladder cancer: long-term results of the BA06 30894 trial. J Clin Oncol, 2011. 29: 2171
- Sherif, A., et al. Neoadjuvant cisplatin-methotrexate chemotherapy for invasive bladder cancer — Nordic cystectomy trial 2. Scand J Urol Nephrol, 2002. 36: 419.
- Sengelov, L., et al. Neoadjuvant chemotherapy with cisplatin and methotrexate in patients with muscle-invasive bladder tumours. Acta Oncol, 2002. 41: 447.
- Shipley, W.U., et al. Phase III trial of neoadjuvant chemotherapy in patients with invasive bladder cancer treated with selective bladder preservation by combined radiation therapy and chemotherapy: initial results of Radiation Therapy Oncology Group 89-03. J Clin Oncol, 1998. 16: 3576.
- Winquist, E., et al. Neoadjuvant chemotherapy for transitional cell carcinoma of the bladder: a systematic review and meta-analysis. J Urol, 2004. 171: 561
- Yin, M., et al. Neoadjuvant Chemotherapy for Muscle-Invasive Bladder Cancer: A Systematic Review and Two-Step Meta-Analysis. Oncologist, 2016. 21: 708.
- Galsky, M.D., et al. Comparative effectiveness of gemcitabine plus cisplatin versus methotrexate, vinblastine, doxorubicin, plus cisplatin as neoadjuvant therapy for muscle-invasive bladder cancer. Cancer, 2015. 121: 2586
- Choueiri, T.K., et al. Neoadjuvant dose-dense methotrexate, vinblastine, doxorubicin, and cisplatin with pegfilgrastim support in muscle-invasive urothelial cancer: pathologic, radiologic, and biomarker correlates. J Clin Oncol, 2014. 32: 1889.
- Leow, J.J., et al. Adjuvant chemotherapy for invasive bladder cancer: a 2013 updated systematic review and meta-analysis of randomized trials. Eur Urol, 2014. 66: 42.
- Sternberg, C.N., et al. Immediate versus deferred chemotherapy after radical cystectomy in patients with pT3-pT4 or N+ M0 urothelial carcinoma of the bladder (EORTC 30994): an intergroup, open-label, randomised phase 3 trial. Lancet Oncol, 2015. 16: 76.).
- Galsky, M.D., et al. Effectiveness of Adjuvant Chemotherapy for Locally Advanced Bladder Cancer. J Clin Oncol, 2016. 34: 825
- Berg, S., et al. Impact of adjuvant chemotherapy in patients with adverse features and variant histology at radical cystectomy for muscle-invasive carcinoma of the bladder: Does histologic subtype matter? Cancer, 2019. 125: 1449.
- Powles, T., et al. Enfortumab Vedotin and Pembrolizumab in Untreated Advanced Urothelial Cancer. N Engl J Med, 2024. 390: 875)
- van der Heijden, M.S., et al. Nivolumab plus Gemcitabine-Cisplatin in Advanced Urothelial Carcinoma. N Engl J Med, 2023. 389: 1778.
- Bellmunt, J., et al. New therapeutic challenges in advanced bladder cancer. Semin Oncol, 2012. 39: 598.
- von der Maase, H., et al. Long-term survival results of a randomized trial comparing gemcitabine plus cisplatin, with methotrexate, vinblastine, doxorubicin, plus cisplatin in patients with bladder cancer. J Clin Oncol, 2005. 23: 4602
- von der Maase, H., et al. Gemcitabine and cisplatin versus methotrexate, vinblastine, doxorubicin, and cisplatin in advanced or metastatic bladder cancer: results of a large, randomized, multinational, multicenter, phase III study. J Clin Oncol, 2000. 18: 3068.
- Galsky, M.D., et al. Comparative effectiveness of cisplatin-based and carboplatin-based chemotherapy for treatment of advanced urothelial carcinoma. Ann Oncol, 2012. 23: 406.)
- Powles, T., et al. Avelumab Maintenance Therapy for Advanced or Metastatic Urothelial Carcinoma. N Engl J Med, 2020. 383: 1218.
- Galsky, M.D., et al. Treatment of patients with metastatic urothelial cancer “unfit” for Cisplatin-based chemotherapy. J Clin Oncol, 2011. 29: 2432.
- Balar, A.V., et al. First-line pembrolizumab in cisplatin-ineligible patients with locally advanced and unresectable or metastatic urothelial cancer (KEYNOTE-052): a multicentre, single-arm, phase 2 study. Lancet Oncol, 2017. 18: 1483.)
- Balar, A.V., et al. Atezolizumab as first-line treatment in cisplatin-ineligible patients with locally advanced and metastatic urothelial carcinoma: a single-arm, multicentre, phase 2 trial. Lancet, 2017. 389: 67).
- Loriot, Y., et al. Erdafitinib in Locally Advanced or Metastatic Urothelial Carcinoma. N Engl J Med, 2019. 381: 338.)
- Ploussard, G., et al. Critical analysis of bladder sparing with trimodal therapy in muscle-invasive bladder cancer: a systematic review. Eur Urol, 2014. 66: 120
- Zlotta, A.R., et al. Radical cystectomy versus trimodality therapy for muscle-invasive bladder cancer: a multi-institutional propensity score matched and weighted analysis. Lancet Oncol, 2023. 24: 669;
- Kulkarni, G.S., et al. Propensity Score Analysis of Radical Cystectomy Versus Bladder-Sparing Trimodal Therapy in the Setting of a Multidisciplinary Bladder Cancer Clinic. J Clin Oncol, 2017. 35: 2299
- Ploussard, G., et al. Critical analysis of bladder sparing with trimodal therapy in muscle-invasive bladder cancer: a systematic review. Eur Urol, 2014. 66.
- Giacalone, N.J., et al. Long-term Outcomes After Bladder-preserving Tri-modality Therapy for Patients with Muscle-invasive Bladder Cancer: An Updated Analysis of the Massachusetts General Hospital Experience. Eur Urol, 2017. 71: 952
- Finn, O. J. Cancer immunology. N. Engl. J. Med. 358, 2704–2715 (2008).
- Hoption Cann, S. A., van Netten, J. P. & van Netten, C. Dr William Coley and tumour regression: a place in history or in the future. Postgraduate medical journal 79, 672–680 (2003).
- Old, L. J., CLARKE, D. A. & BENACERRAF, B. Effect of Bacillus Calmette-Guerin infection on transplanted tumours in the mouse. Nature 184(Suppl 5), 291–292 (1959).
- Zbar, B. & Rapp, H. J. Immunotherapy of guinea pig cancer with BCG. Cancer 34, suppl:1532–40 (1974).
- Morales, A., Eidinger, D. & Bruce, A. W. Intracavitary Bacillus Calmette-Guerin in the treatment of superficial bladder tumors. JURO 116, 180–183 (1976).
- Lamm, D. L. et al. Bacillus Calmette-Guerin immunotherapy of superficial bladder cancer. JURO 124, 38–40 (1980).
- Shelley MD, Kynaston H, Court J, Wilt TJ, Coles B, Burgon K, Mason MD. A systematic review of intravesical bacillus Calmette-Guérin plus transurethral resection vs transurethral resection alone in Ta and T1 bladder cancer. BJU Int. 2001 Aug;88(3):209-16
- Han RF, Pan JG. Can intravesical bacillus Calmette-Guérin reduce recurrence in patients with superficial bladder cancer? A meta-analysis of randomized trials. Urology. 2006 Jun;67(6):1216-23
- Shelley MD, Wilt TJ, Court J, Coles B, Kynaston H, Mason MD. Intravesical bacillus Calmette-Guérin is superior to mitomycin C in reducing tumour recurrence in high-risk superficial bladder cancer: a meta-analysis of randomized trials. BJU Int. 2004 Mar;93(4):485-90
- Böhle A, Jocham D, Bock PR. Intravesical bacillus Calmette-Guerin versus mitomycin C for superficial bladder cancer: a formal meta-analysis of comparative studies on recurrence and toxicity. J Urol. 2003 Jan;169(1):90-5.
- Böhle A, Bock PR. Intravesical bacille Calmette-Guérin versus mitomycin C in superficial bladder cancer: formal meta-analysis of comparative studies on tumor progression. Urology. 2004 Apr;63(4):682-6; discussion 686-7
- Sylvester RJ, van der MEIJDEN AP, Lamm DL. Intravesical bacillus Calmette-Guerin reduces the risk of progression in patients with superficial bladder cancer: a meta-analysis of the published results of randomized clinical trials. J Urol. 2002 Nov;168(5):1964-70
- Redelman-Sidi, G., Iyer, G., Solit, D. B., research, M. G. C.2013. Oncogenic activation of Pak1-dependent pathway of macropinocytosis determines BCG entry into bladder cancer cells. AACR. doi:10.1158/0008-5472.CAN-12-1882
- Pettenati, C. & Ingersoll, M. A. Mechanisms of BCG immunotherapy and its outlook for bladder cancer. Nat Rev Urol (2018). doi:10.1038/s41585-018-0055-4
- Mitropoulos, D. N. Novel insights into the mechanism of action of intravesical immunomodulators. In Vivo 19, 611–621 (2005).
- Ikeda, N., Toida, I., Iwasaki, A., Kawai, K. & Akaza, H. Surface antigen expression on bladder tumor cells induced by bacillus Calmette-Guérin (BCG): A role of BCG internalization into tumor cells. Int. J. Urol. 9, 29–35 (2002).
- Lattime, E. C., Gomella, L. G. & McCue, P. A. Murine bladder carcinoma cells present antigen to BCG-specific CD4+ T-cells. Cancer Res. 52, 4286–4290 (1992).
- Bisiaux, A. et al. Molecular analyte profiling of the early events and tissue conditioning following intravesical bacillus calmette-guerin therapy in patients with superficial bladder cancer. J. Urol. 181, 1571–1580 (2009).
- Zuiverloon TC, Nieuweboer AJ, Vékony H, Kirkels WJ, Bangma CH, Zwarthoff EC. Markers predicting response to bacillus Calmette-Guérin immunotherapy in high-risk bladder cancer patients: a systematic review. Eur Urol. 2012 Jan;61(1):128-45
- Calmette A. L’infection bacillaire et la tuberculose chez l’homme et chez les animaux: processus d’infection, et de defense, etude biologi que et experimentale. 1922
- Messing EM. The BCG Shortage. Bladder Cancer. 2017 Jul 27;3(3):227-228
- AUA. BCG Shortage Information. Revisado el 14 de junio del 2025 en https://www.auanet.org/about-us/bcg-shortage-info. 2020
- AUA. BCG Shortage Information. Revisado el 14 de junio del 2025 en https://www.auanet.org/about-us/bcg-shortage-info. 2020
- EAU. Statement Concerning the shortage of BCG Vaccine from the EAU Guidelines Panel on Non-muscle invasive bladder cancer. Revisado el 14 de junio del 2025 en https://d56bochluxqnz.cloudfront.net/documents/guideline-publications/non-muscle-invasive-bladder-cancer/NMIBC-Guidelines-Panel-Statement-Concerning-Shortage-of-BCG-Vaccine.pdf
- Ikic D, Maricic Z, Oresic V, et al: Application of human leukocyte interferon in patients with urinary bladder papillomatosis, breast cancer and melanoma. Lancet 1:1022-1024, 1981
- Torti FM, Shortliffe LD, Williams RD, et al. Alpha-interferon in superficial bladder cancer: a Northern California Oncology Group Study. J Clin Oncol 1988;6:476–83
- Scorticatti CH, LaPena NC, Bellora OG, et al: Systemic IFN alpha treatment of multiple papilloma grade I or II patients pilot study. J Interferon Res 2:339-343, 1982
- Lamm D, Brausi M, O’Donnell MA, Witjes JA. Interferon alfa in the treatment paradigm for non-muscle-invasive bladder cancer. Urol Oncol. 2014 Jan;32(1):35.e21-30
- Shepherd AR, Shepherd E, Brook NR. Intravesical Bacillus Calmette-Guérin with interferon-alpha versus intravesical Bacillus Calmette-Guérin for treating non-muscle-invasive bladder cancer. Cochrane Database Syst Rev. 2017 Mar 8;3(3):CD012112.
- Chamie K, Chang SS, Kramolowsky E, Gonzalgo ML, Agarwal PK, Bassett JC, Bjurlin M, Cher ML, Clark W, Cowan BE, David R, Goldfischer E, Guru K, Jalkut MW, Kaffenberger SD, Kaminetsky J, Katz AE, Koo AS, Sexton WJ, Tikhonenkov SN, Trabulsi EJ, Trainer AF, Spilman P, Huang M, Bhar P, Taha SA, Sender L, Reddy S, Soon-Shiong P. IL-15 Superagonist NAI in BCG-Unresponsive Non-Muscle-Invasive Bladder Cancer. NEJM Evid. 2023 Jan;2(1):EVIDoa2200167. doi: 10.1056/EVIDoa2200167. Epub 2022 Nov 10.
- Collins, A. V. et al. The interaction properties of costimulatory molecules revisited. Immunity 17, 201–210 (2002).
- Linsley, P. S. et al. CTLA-4 is a second receptor for the B cell activation antigen B7. J. Exp. Med. 174, 561–569 (1991)
- Tivol, E. A. et al. Loss of CTLA-4 leads to massive lymphoproliferation and fatal multiorgan tissue destruction, revealing a critical negative regulatory role of CTLA-4. Immunity 3, 541–547 (1995).
- Waterhouse, P. et al. Lymphoproliferative disorders with early lethality in mice deficient in Ctla-4. Science 270, 985–988 (1995).
- Keler, T. et al. Activity and safety of CTLA-4 blockade combined with vaccines in cynomolgus macaques. J Immunol 171, 6251–6259 (2003)
- Hodi FS, O’Day SJ, McDermott DF, Weber RW, Sosman JA, Haanen JB, Gonzalez R, Robert C, Schadendorf D, Hassel JC, Akerley W, van den Eertwegh AJ, Lutzky J, Lorigan P, Vaubel JM, Linette GP, Hogg D, Ottensmeier CH, Lebbé C, Peschel C, Quirt I, Clark JI, Wolchok JD, Weber JS, Tian J, Yellin MJ, Nichol GM, Hoos A, Urba WJ. Improved survival with ipilimumab in patients with metastatic melanoma. N Engl J Med. 2010 Aug 19;363(8):711-23.
- Robert C, Thomas L, Bondarenko I, O’Day S, Weber J, Garbe C, Lebbe C, Baurain JF, Testori A, Grob JJ, Davidson N, Richards J, Maio M, Hauschild A, Miller WH Jr, Gascon P, Lotem M, Harmankaya K, Ibrahim R, Francis S, Chen TT, Humphrey R, Hoos A, Wolchok JD. Ipilimumab plus dacarbazine for previously untreated metastatic melanoma. N Engl J Med. 2011 Jun 30;364(26):2517-26.
- Ishida Y, Agata Y, Shibahara K, Honjo T. Induced expression of PD-1, a novel member of the immunoglobulin gene superfamily, upon programmed cell death. EMBO J. 1992 Nov;11(11):3887-95
- Nishimura H, Nose M, Hiai H, Minato N, Honjo T. Development of lupus-like autoimmune diseases by disruption of the PD-1 gene encoding an ITIM motif-carrying immunoreceptor. Immunity. 1999 Aug;11(2):141-51
- Keir ME, Butte MJ, Freeman GJ, Sharpe AH. PD-1 and its ligands in tolerance and immunity. Annu Rev Immunol. 2008;26:677-704
- Liang SC, Latchman YE, Buhlmann JE, Tomczak MF, Horwitz BH, Freeman GJ, Sharpe AH. Regulation of PD-1, PD-L1, and PD-L2 expression during normal and autoimmune responses. Eur J Immunol. 2003 Oct;33(10):2706-16
- Latchman, Y. et al. PD-L2 is a second ligand for PD-1 and inhibits T cell activation. Nature Immunology 2, 261–268 (2001).
- Azuma, T. et al. B7-H1 is a ubiquitous antiapoptotic receptor on cancer cells. Blood 111, 3635–3643 (2008).
- Hirano, F. et al. Blockade of B7-H1 and PD-1 by monoclonal antibodies potentiates cancer therapeutic immunity. Cancer Res. 65, 1089–1096 (2005).
- Chang, C.-H. et al. Metabolic Competition in the Tumor Microenvironment Is a Driver of Cancer Progression. Cell 162, 1229–1241 (2015).
- Zinselmeyer, B. H. et al. PD-1 promotes immune exhaustion by inducing antiviral T cell motility paralysis. J. Exp. Med. 210, 757–774 (2013).
- Okazaki, T., Chikuma, S., Iwai, Y., Fagarasan, S. & Honjo, T. A rheostat for immune responses: the unique properties of PD-1 and their advantages for clinical application. Nature Immunology 14, 1212–1218 (2013).
- Topalian, S. L. et al. Safety, activity, and immune correlates of anti-PD-1 antibody in cancer. N. Engl. J. Med. 366, 2443–2454 (2012).
- Necchi, A., et al. Pembrolizumab as Neoadjuvant Therapy Before Radical Cystectomy in Patients With Muscle-Invasive Urothelial Bladder Carcinoma (PURE-01): An Open-Label, Single-Arm, Phase II Study. J Clin Oncol, 2018. 36: 3353
- Basile, G., et al. Neoadjuvant Pembrolizumab and Radical Cystectomy in Patients with MuscleInvasive Urothelial Bladder Cancer: 3-Year Median Follow-Up Update of PURE-01 Trial. Clin Cancer Res, 2022. 28: 5107
- Valentina Tateo et al. Five-year median follow-up update of PURE-01: A phase 2 study of neoadjuvant pembrolizumab followed by radical cystectomy in patients with muscle-invasive bladder cancer (MIBC). J Clin Oncol, 2025 43:16_suppl, 4595-4595
- Mariathasan, S., et al. TGFbeta attenuates tumour response to PD-L1 blockade by contributing to exclusion of T cells. Nature, 2018. 554: 544
- Szabados, B., et al. Final Results of Neoadjuvant Atezolizumab in Cisplatin-ineligible Patients with Muscle-invasive Urothelial Cancer of the Bladder. Eur Urol, 2022. 82: 212
- van Dijk, N., et al. Preoperative ipilimumab plus nivolumab in locoregionally advanced urothelial cancer: the NABUCCO trial. Nat Med, 2020. 26: 1839
- Powles, T., et al. Perioperative Durvalumab with Neoadjuvant Chemotherapy in Operable Bladder Cancer. N Engl J Med, 2024
- NCCN Clinical Practice Guidelines in Oncology (NCCN Guidelines®) Bladder Cancer. Version 3.2025. Revisado el 14 de junio del 2025 en https://www.nccn.org/professionals/physician_gls/pdf/bladder.pdf. National Comprehensive Cancer Network.
- Grivas P, Kopyltsov E, Su PJ, Parnis FX, Park SH, Yamamoto Y, Fong PC, Tournigand C, Climent Duran MA, Bamias A, Caserta C, Chang J, Cislo P, di Pietro A, Wang J, Powles T. Patient-reported Outcomes from JAVELIN Bladder 100: Avelumab First-line Maintenance Plus Best Supportive Care Versus Best Supportive Care Alone for Advanced Urothelial Carcinoma. Eur Urol. 2023 Apr;83(4):320-328
- Powles, T., et al. Avelumab First-Line Maintenance for Advanced Urothelial Carcinoma: Results From the JAVELIN Bladder 100 Trial After >/=2 Years of Follow-Up. J Clin Oncol, 2023. 41: 3486
- Bellmunt, J. et al. Pembrolizumab as Second-Line Therapy for Advanced Urothelial Carcinoma. N. Engl. J. Med. 376, 1015–1026 (2017).
- Powles T et al. Atezolizumab versus chemotherapy in patients with platinum-treated locally advanced or metastatic urothelial carcinoma (IMvigor211): a multicentre, open-label, phase 3 randomised controlled trial. The Lancet 391, 748–757 (2018).
- Sharma P, Retz M, Siefker-Radtke A, Baron A, Necchi A, Bedke J, Plimack ER, Vaena D, Grimm MO, Bracarda S, Arranz JÁ, Pal S, Ohyama C, Saci A, Qu X, Lambert A, Krishnan S, Azrilevich A, Galsky MD. Nivolumab in metastatic urothelial carcinoma after platinum therapy (CheckMate 275): a multicentre, single-arm, phase 2 trial. Lancet Oncol. 2017 Mar;18(3):312-322.
- Sharma P, Callahan MK, Bono P, Kim J, Spiliopoulou P, Calvo E, Pillai RN, Ott PA, de Braud F, Morse M, Le DT, Jaeger D, Chan E, Harbison C, Lin CS, Tschaika M, Azrilevich A, Rosenberg JE. Nivolumab monotherapy in recurrent metastatic urothelial carcinoma (CheckMate 032): a multicentre, open-label, two-stage, multi-arm, phase 1/2 trial. Lancet Oncol. 2016 Nov;17(11):1590-1598.
- Sharma, P. et al. Nivolumab monotherapy in recurrent metastatic urothelial carcinoma (CheckMate 032): a multicentre, open-label, two-stage, multi-arm, phase 1/2 trial. The Lancet Oncology 17, 1590–1598 (2016).

