-
EPIDEMIOLOGÍA
En Chile, el cáncer de próstata (CaP) es el cáncer más frecuente en hombres, con una incidencia estimada el 2022 de 62,3 por 100.000 hombres, lo que representa el 16% del total de nuevos casos de cáncer. En cuanto a mortalidad, se estimaron 15,1 muertes por 100.000 hombres, equivalentes al 8,6% de los fallecimientos por cáncer. Esta cifra lo posiciona como la cuarta causa de muerte por cáncer en el país, después del cáncer de pulmón, estómago y colon (1).
La mortalidad por CaP ha mostrado una disminución significativa en las últimas dos décadas, siguiendo una tendencia similar a la observada en países desarrollados. A partir de 1998 se evidenció un descenso sostenido en la tasa ajustada de mortalidad, con reducciones estadísticamente significativas en todos los grupos etarios, especialmente en los de mayor edad (2).
Según las últimas estimaciones, la incidencia de CaP en Chile es comparable a la observada en países con índice de desarrollo humano muy alto (57,3 por 100.000). Sin embargo, la mortalidad es significativamente mayor (15,2 vs. 9,1 por 100.000), situándose entre las más altas tanto de América Latina como de los países miembros de la Organización para la Cooperación y el Desarrollo Económicos (OCDE) (1). La causa de este diferencia en la mortalidad no ha sido estudiada pero probablemente sea multifactorial; incluyendo un estilo de vida poco saludable (dieta, obesidad, sedentarismo), el estigma cultural que dificulta la consulta y el diagnóstico temprano, la inmigración de individuos de raza negra y las barreras en el acceso a servicios de salud (3,4).
En Chile, al igual que en el resto del mundo, no existe una política de tamizaje poblacional para el CaP. A pesar de avances significativos en los métodos diagnósticos y el tratamiento basados en la estratificación por riesgo, los programas de detección masiva aún no han demostrado ser costo-efectivos. El alto costo de algunas pruebas, sumado al problema del sobrediagnóstico, continúan siendo un problema. Aunque algunos hombres pueden resultar perjudicados por el tamizaje, quienes se benefician pueden obtener ventajas significativamente mayores. Actualmente, existe una expectativa creciente de que un programa de detección bien diseñado podría generar un beneficio neto a nivel poblacional, con posibilidades de mejora continua a lo largo del tiempo (5).
-
- Etiología y factores de Riesgo
- Edad:
- Etiología y factores de Riesgo
Es el factor de riesgo más importante. Sabemos por estudios de autopsias que la prevalencia incidental varía de 5% en <30 años a 59% en >79 años (6). Sin embargo, su diagnóstico es menos frecuente. Los datos del SEER del NIH de EEUU del año 2022 muestran que es extremadamente infrecuente en hombres <40 años con tasas cercanas a cero. Entre los 40-64 años la tasa sube a 126 por 100.000 hombres, llegando a lo más alto entre los 65-74 años con 744 por 100.000 hombres, para luego bajar en >75 años a 614 por 100.000 hombres (7).
En la mayoría de los hombres, la enfermedad no llegará a manifestarse clínicamente y permanecerá sin diagnóstico a lo largo de la vida. Es precisamente el sobrediagnóstico de hombres pertenecientes a esta amplia “reserva” de casos asintomáticos lo que limita la utilidad del screening poblacional.
-
-
- Raza:
-
En Estados Unidos, los hombres negros tienen 1,7 veces más probabilidades de ser diagnosticados con CaP que los hombres blancos, y 2,1 veces más probabilidades de morir a causa de esta enfermedad (8). Si bien las causas de estas diferencias no son claras, la evidencia sugiere que se relaciona más con la ascendencia genética que con la raza en sí. En particular, se ha planteado un mayor riesgo entre hombres con ascendencia del noroeste del África subsahariana, posiblemente asociado a una mayor prevalencia de ciertos factores genéticos (9).
A pesar del mayor riesgo de desarrollar la enfermedad, numerosos estudios han demostrado que, cuando hombres negros y blancos son diagnosticados con CaP de grado y estadio similares, y reciben tratamientos equivalentes dentro de sistemas de salud con acceso equitativo, sus resultados clínicos son equivalentes (10,11)
-
-
- Historia familiar:
-
El riesgo de CaP se ve influido por varios factores familiares, como el número de familiares afectados, el grado de parentesco (12), la edad del familiar al momento del diagnóstico y de la muerte, la presencia de enfermedad de alto grado y antecedentes de otros cánceres, como de mama u ovario. Hijos y hermanos de hombres con CaP presentan un riesgo aproximadamente 2,5 veces mayor de ser diagnosticados con la enfermedad (13). Además, tener antecedentes familiares de CaP se asocia a un mayor riesgo de enfermedad letal, siendo más significativo si se trata de cáncer de alto grado o metastásico, en comparación con formas de bajo grado y no metastásicas (14). Por otra parte, algunos estudios sugieren que el antecedente familiar puede reducir la mortalidad al aumentar el screening y diagnóstico precoz (15).
-
-
- Predisposición genética:
-
El CaP presenta una alta heredabilidad genética, estimada en un 58% (16). Las mutaciones en los genes HOXB13 y BRCA2 son las más asociadas a predisposición hereditaria, aunque son poco frecuentes en la población general (0,3%) (17). Mutaciones en genes de reparación del ADN, como BRCA1, ATM, CHEK2 y genes del síndrome de Lynch (MLH1, MSH6), se asocian con mayor riesgo de CaP, especialmente en formas metastásicas (18).
Una parte importante de la heredabilidad del CaP se explica por polimorfismos genéticos comunes de un solo nucleótido (SNPs). Estudios genómicos en poblaciones multiétnicas han validado 269 SNPs asociados al riesgo de CaP (19). Aunque cada SNP individual tiene un efecto pequeño, su combinación en puntajes de riesgo poligénico (PRS) tiene un impacto significativo en el riesgo de desarrollar la enfermedad (20).
Un PRS elevado se asocia con un mayor riesgo de CaP incidente, independientemente del grado. Sin embargo, el PRS no permite distinguir entre enfermedad indolente y agresiva, por lo que no es útil como marcador pronóstico, y su uso no es recomendado en las guías clínicas (21,22).
-
-
- Dieta
-
Las dietas vegetarianas y basadas en plantas se han asociado con un menor riesgo de CaP (23), mientras que la evidencia sobre la dieta mediterránea es débil y contradictoria (24). Las dietas proinflamatorias e hiperinsulinémicas se relacionan con un mayor riesgo de CaP, especialmente en formas agresivas (25,26). En cuanto a macronutrientes, el consumo elevado de proteínas lácteas y grasas trans se asocia con mayor riesgo, mientras que no se han observado asociaciones claras con proteínas animales o vegetales, ni con el índice o la carga glucémica (27).
El consumo de carne procesada muestra una asociación positiva con el riesgo de CaP, aunque generalmente débil (28). La leche y los productos lácteos fermentados también se vinculan con un mayor riesgo y mortalidad por CaP (29). En contraste, el consumo de soja, legumbres y alimentos ricos en fitoestrógenos podría ofrecer un efecto protector, con diferencias según la población (27).
-
-
- Ejercicio:
-
La actividad física se asocia con una menor mortalidad específica por CaP y una mayor sobrevida libre de enfermedad (30,31). Esta relación se ha observado tanto con ejercicio vigoroso como con caminatas rápidas, principalmente en actividades recreativas. Aunque la evidencia sobre la actividad física ocupacional es más limitada, algunos estudios sugieren un posible efecto protector a largo plazo (32).
-
-
- Otras enfermedades:
-
Se ha explorado la asociación de diversas enfermedades con el riesgo de CaP. El síndrome metabólico y la obesidad no se asocian claramente con el riesgo general de CaP, pero sí con un mayor riesgo de enfermedad agresiva (27,33). La infertilidad y subfertilidad se relacionan con un mayor riesgo de CaP, aunque los estudios presentan alta heterogeneidad (34,35). La prostatitis podría asociarse a un mayor riesgo de CaP, aunque este efecto desaparece en estudios que controlan mejor el sesgo de detección (36). La infección por virus del papiloma humano (VPH) también se asocia a mayor riesgo en múltiples estudios (27). El síndrome de Sjögren se relaciona con un aumento del riesgo de CaP (37). La colitis ulcerosa, más que la enfermedad de Crohn, se asocia con un riesgo aumentado de CaP (38). La relación entre diabetes tipo 2 y CaP es incierta, con estudios contradictorios (39).
No se ha demostrado que altos niveles séricos de andrógenos se relacionen con mayor riesgo de CaP. La obesidad y niveles elevados de IGF-1 aumentarían levemente el riesgo.
-
-
- Tabaquismo:
-
Los datos provenientes de estudios observacionales sugieren que existe una asociación inversa entre el consumo de cigarrillos y la incidencia del CaP; es decir, los fumadores presentan una menor frecuencia de diagnóstico de esta enfermedad. Sin embargo, los fumadores tienen un mayor riesgo de morir a causa del CaP. Es importante considerar que esta menor incidencia podría explicarse por una baja tasa de participación en programas de tamizaje entre los fumadores, así como por sesgos de clasificación o selección en los estudios analizados (40).
-
-
- Factores ocupacionales:
-
La evidencia sobre el riesgo de CaP por exposición ocupacional es mixta. La relación con el asbesto es poco concluyente, con estudios que muestran desde ausencia de asociación hasta una relación débil. No se observó riesgo asociado a ciertos químicos tóxicos, permetrina ni estrés laboral (27). En cambio, sí se reportaron asociaciones positivas con la exposición al cobalto, al cromo hexavalente, y con ocupaciones como trabajadores agrícolas y del petróleo, probablemente por contacto con pesticidas y sustancias químicas (41,42). Por otro lado, trabajos físicamente exigentes podrían reducir el riesgo (43).
-
-
- Testosterona
-
Los hombres con hipogonadismo que reciben terapia de reemplazo con testosterona no presentan un mayor riesgo de desarrollar CaP (44). Además, aunque la evidencia es limitada, los pacientes con CaP manejado de forma expectante o tratados con intención curativa no presentan peores resultados al recibir testosterona, a pesar del riesgo teórico de progresión al corregir el hipogonadismo (45).
-
-
- Otros
-
Se ha descrito que una mayor frecuencia eyaculatoria reduce el riesgo de CaP (46,47). El estar casado o tener una pareja también son un factor protector (48).
-
- Quimio prevención
Diversas estrategias farmacológicas han sido evaluadas para la prevención del CaP con resultados mixtos:
- Inhibidores de la 5-alfa reductasa (como finasteride y dutasteride): Existe evidencia robusta de que reducen el riesgo general de CaP en aproximadamente un 30%. Sin embargo, se asocian con un mayor riesgo de detección de tumores de alto grado (49,50). Más aún, no se ha observado beneficio en la prevención de cánceres letales en poblaciones con acceso a screening regular (51).
- Antiinflamatorios (aspirina y AINEs): El uso regular de aspirina (52) y otros antiinflamatorios no esteroideos se asocia con una leve reducción del riesgo de desarrollar CaP (53).
- Estatinas: Su efecto sigue siendo controversial. Algunos estudios muestran una disminución del riesgo de cáncer agresivo y una posible reducción en la mortalidad, especialmente con mayor dosis y duración del uso, mientras que otros no muestran efecto relevante sobre la incidencia general (27).
- Vitaminas y suplementos: La vitamina D no ha demostrado reducir la incidencia global de CaP, pero si podría reducir la mortalidad. El selenio podría tener un efecto protector, especialmente frente a enfermedad avanzada, aunque no se ha confirmado en ensayos aleatorizados (27).
- Otros fármacos (inhibidores de fosfodiesterasa-5, espironolactona, agonistas del receptor GLP-1, antagonistas de vitamina K): Algunos estudios preliminares sugieren un posible efecto, pero la evidencia es escasa y de baja calidad.
- HISTOLOGÍA
Más del 90 % de los CaP corresponden a adenocarcinoma acinar convencional. Según la clasificación de la OMS, existen subtipos del adenocarcinoma acinar, como el pseudo hiperplásico, microquístico, foamy-cell, mucinoso, signet-ring, pleomórfico giganto celular y sarcomatoide, que presentan pronósticos variables. Otros tipos histológicos no acinares incluyen el adenocarcinoma ductal, urotelial, carcinoma escamoso o adenoescamoso, carcinoma de células basales y tumores neuroendocrinos (54).
La mayoría de los CaP, cerca del 70-75 %, se originan en la zona periférica (ZP), siendo la zona de transición (ZT) el origen de aproximadamente el 20-25 % de los tumores, y los de la zona central (ZC) poco frecuentes (5 %). Desde el punto de vista clínico y molecular, los tumores de la ZP tienden a ser más agresivos, con mayor frecuencia de patrón cribiforme, fusión TMPRSS2–ERG y pérdida de PTEN. En contraste, los cánceres de la ZT suelen ser menos agresivos, con menor grado de Gleason, menor volumen extracapsular y menor tasa de metástasis, lo que se traduce en mejor pronóstico tras prostatectomía radical. Sin embargo, la detección de cáncer en ZT puede ser más difícil por su localización anterior y por simular hiperplasia nodular. Los tumores de la ZC, raros y poco estudiados, presentan características biológicas distintas, incluyendo un fenotipo basal-luminal mixto y mayor asociación con raza negra. Los perfiles moleculares y transcriptómicos varían según la zona, lo cual influye en la evolución clínica y respuesta al tratamiento (55).
El sistema de Gleason, propuesto en la década de 1960 por Donald Gleason, clasifica el CaP según la arquitectura y el grado de diferenciación glandular observado en la biopsia, asignando una puntuación entre 1 y 5 a los dos patrones predominantes: el más común y el de mayor grado. La suma de ambos constituye el puntaje de Gleason que varía entre 2 y 10, y se correlaciona con el pronóstico del tumor (56). No obstante, tras décadas de uso, se observó una tendencia a subestimar la agresividad tumoral y ciertos problemas de comunicación. Por ello, en 2005 y 2014, la “International Society of Urological Pathology” (ISUP) reformuló el sistema: se eliminaron los patrones 1 y 2 en biopsias, se redefinieron los criterios de los patrones 3 y 4, y se introdujo un nuevo sistema de “Grupos de Grado”, con cinco categorías (del 1 al 5), que reemplazan la escala original en reportes clínicos por ser más intuitiva y correlacionarse mejor con el pronóstico (57,58).
Algunas técnicas de inmunohistoquímica pueden ser útiles para el diagnóstico del CaP. Los marcadores clásicos como APE y PAP (antígeno prostático ácido) se expresan en tejido prostático, aunque su intensidad puede disminuir en tumores poco diferenciados. El NKX3.1 es un marcador nuclear altamente específico para tejido prostático, especialmente útil para confirmar el origen en casos de metástasis. La racemasa (AMACR/P504S) se sobre expresa en el adenocarcinoma y es útil para identificar focos pequeños o dudosos. Los marcadores de células basales como p63 y CK5/6 son positivos en glándulas benignas y se pierden en el cáncer, ayudando a demostrar la ausencia de la capa basal característica de la malignidad (59).
a) Adenocarcinoma ductal
El adenocarcinoma ductal de próstata es una variante relativamente rara pero clínica y biológicamente agresiva, a menudo considerada la segunda más común tras el acinar. Se origina de los ductos prostáticos y se caracteriza por células columnares altas organizadas en estructuras cribiformes, papilares o sólidas. Su comportamiento suele ser más agresivo, con una mayor tendencia a metástasis y peor pronóstico en comparación con el adenocarcinoma convencional (60).
b) Carcinoma de células transicionales
El carcinoma urotelial prostático puede originarse de la uretra prostática o extenderse por contigüidad desde la vejiga. Si bien es infrecuentes, su incidencia probablemente esta subestimada. Está asociado con infiltración estromal y peor pronóstico, especialmente en los casos detectados en cistectomías radicales. En casos no invasivos (superficiales), opciones como la resección transuretral seguida de BCG han mostrado resultados satisfactorios (61,62).
c) Carcinoma de células pequeñas (neuroendocrino)
El carcinoma de células pequeñas prostático en su forma pura es una neoplasia neuroendocrina infrecuente y altamente agresiva, morfológicamente similar al carcinoma de células pequeñas pulmonar. La mayoría de los pacientes se benefician de esquemas de quimioterapia similares a los utilizados en carcinomas pulmonares, aunque el pronóstico general es desfavorable. La diferenciación neuroendocrina de adenocarcinomas es más común, en particular en los carcinomas de alto grado y su contribución pronostica es controvertida (63).
d) Carcinoma mucinoso
El carcinoma mucinoso prostático es muy poco común (<0,3 % de los casos) y se define cuando al menos el 25 % del tumor muestra ‘lagos’ de mucina extracelular. Aunque inicialmente se consideraba de mal pronóstico, estudios contemporáneos indican que, tras prostatectomía radical, estos tumores no son más agresivos que el adenocarcinoma convencional, e incluso podrían tener un comportamiento igual o menos agresivo (64).
-
MARCADORES TUMORALES
Cómo muchos cánceres, el CaP es una enfermedad que se desarrolla y manifiesta con una serie de cambios genéticos, epigenéticos y proteómicos. Estos cambios pueden identificarse en distintas etapas de la enfermedad con fines diagnósticos, pronósticos y de tratamiento. Su uso puede incluso mejorarse al asociarse al uso de normogramas.
- Diagnóstico: utilizados para identificar pacientes que son potenciales portadores de cáncer (APE y parámetros derivados, PHI, 4K Score, Stockholm 3, PCA3, ExoDX, SelectMDX, Confirm MDX, MiPS).
- Pronóstico: para conocer que pacientes son candidatos a seguimiento activo, o quienes se podrían beneficiar de terapias adyuvantes (Decipher, Prolaris, Oncotype DX).
- Elección de tratamiento: selección de pacientes que puedan beneficiarse de tratamientos específicos (PARP, resistencia a enzalutamida o abiraterona).
- Diagnóstico
- Antígeno Prostático Específico (APE)
- Diagnóstico
El APE es una enzima secretada por las células epiteliales prostáticas cuya principal función en el semen es lisar las seminogelinas, permitiendo la licuefacción del semen. Una pequeñísima cantidad de APE pasa a la circulación sanguínea, donde circula tanto unido a proteínas como libre.
Aunque es específico del órgano, no lo es de ninguna enfermedad, pudiendo elevarse fisiológicamente luego de la eyaculación, en afecciones benignas como la hiperplasia, inflamatorias como infecciones, posterior a instrumentalización de la vía urinaria, trauma y cáncer. Su valor en el plasma no es estático, y puede variar ± 15% en un individuo sin causa aparente (65).
No existe un valor perfecto que permita identificar a sanos y enfermos. El APE es un parámetro continuo, en el que niveles elevados se asocian a una mayor probabilidad de CaP. La elección de un nivel de corte implica evaluar el equilibrio entre sensibilidad y especificidad: un umbral más bajo aumenta la sensibilidad del examen, pero reduce su especificidad, lo que conlleva un mayor número de falsos positivos y, en consecuencia, más biopsias innecesarias.
Cuando el APE apareció por primera vez a finales de la década del 80, el primer test comercial recomendada un valor de corte de 4 ng/ml, obteniéndose una sensibilidad de 20% y una especificidad de 93% (66). Basado en los resultados del estudio europeo de screening de CaP (ERSP), hoy el valor más utilizado es 3 ng/ml, con una la sensibilidad de 32% y especificidad de 85%, lo que se traduce en que un 17% de hombres requieren evaluaciones para mayor estudio (67).
Las recomendaciones de las guías clínicas son variables:
- La guía de la Sociedad Europea de Urología (EAU), recomienda estudiar con resonancia magnética a todos los pacientes con un APE >3 ng/ml.
- La “National Institute for Health and Care Excellence” (NICE) del Reino Unido recomienda usar APE ajustado por edad.
- Las guías para la detección precoz de CaP de la “National Comprehensive Cancer Network” (NCCN) de EE. UU. consideran puntos de corte de 1 y 3 ng/ml en su árbol de toma de decisiones. Sin embargo, recomienda realizar estudios a pacientes con un APE mayor a la mediana para su grupo de edad
- La “American Urological Association” (AUA) de EEUU no hace una recomendación precisa, pero dice que existe consenso en que el umbral a partir del cual un nivel de APE debe considerarse elevado debe aumentar con la edad, y que el umbral original de 4 ng/mL es demasiado alto para personas de entre 40 y 50 años, y demasiado bajo para personas de entre 70 y 80 años, quienes presentan un alto riesgo de sobrediagnóstico y subdiagnóstico respectivamente.
La evidencia sobre la precisión diagnóstica de los umbrales de APE ajustados por edad es incierta, con gran parte de los estudios que los avalan basadas en poblaciones previamente derivadas a atención secundaria y no en población general. Si bien no hay evidencia de que el uso del APE ajustado por dad sea mejor que el usar valores fijos, su uso parece razonable para evitar el sobrediagnóstico y sobretratamiento.
Siempre es recomendable repetir el APE y no tomar una decisión con un resultado aislado. En cerca de un 20% de los hombres puede disminuir de entre 4 y10 ng/ml a <3 ng/ml luego de 8 semanas (68). En el estudio ProtecT el riesgo de CaP clínicamente significativo fue 70% más bajo en aquellos pacientes en que el APE bajó al menos 20% a las 7 semanas (69,70). En el estudio Stockholm3, repetir el APE permitió reducir en un 17% el número de biopsias, dejando de encontrar solo un 5% de cánceres significativos (71).
El resultado del examen puede variar hasta un 7% entre distintos ensayos para su detección (72), por lo que se recomienda repetirlo en el mismo laboratorio, utilizando el mismo método y bajo condiciones estandarizadas (22).
También hay que considerar que la producción de APE depende de los andrógenos, y los inhibidores de la 5α-reductasa (como finasteride y dutasteride), utilizados para el tratamiento de la hiperplasia prostática benigna, reducen los niveles de APE en aproximadamente un 50% (73). En estos casos, el valor de APE debe corregirse para su interpretación. Tanto el APE total como la fracción libre disminuyen con el uso de estas drogas, por lo que el porcentaje libre de APE no se altera y puede utilizarse normalmente (74).
En la práctica clínica el valor de APE debe interpretarse considerando otros factores como edad, raza, tamaño prostático, resultados previos del mismo examen y de otros estudios, entre otros. La limitación del examen no radica en la exactitud de la prueba, sino en la tendencia a clasificar a los pacientes como «normales» o «anormales», pese a que esa división no se sostiene científicamente.
-
-
- Densidad de APE (d-APE)
-
La d-APE es la relación entre el nivel sérico de APE con el volumen prostático. Su utilidad se basa en que el CaP genera aproximadamente diez veces más APE por unidad de volumen que el tejido benigno. Esta relación permite discriminar mejor entre causas benignas y malignas de elevación del APE. Una d-APE superior a 0,1–0,15 ng/mL/cc se asocia con mayor riesgo de cáncer clínicamente significativo (75), mientras que valores < 0,09 se relacionan con una probabilidad muy baja (4%) de presentar cáncer relevante (76). Si bien el riesgo de CaP es continuo según el valor de la d-APE, el punto de corte más usado en la literatura es 0,15 ng/mL/cc.
Evidencia prospectiva sugiere que ajustar el valor de corte según el nivel de APE total puede mejorar significativamente la sensibilidad diagnóstica. Un estudio alemán encontró que, para alcanzar una sensibilidad del 95%, los valores de corte óptimos de d-APE serían 0,05, 0,1 y 0,19 para niveles de APE de 2–4, 4–10 y 10–20 ng/mL, respectivamente (77).
Existen varias formas de estimar el volumen de la próstata. Su estimación mediante tacto rectal tiende a subestimar el volumen prostático (78). La medición por ecografía transrectal tiende a subestimarlo un 8%, mientras que la vía transabdominal lo sobrestima en 10% (79,80). La forma más precisa de estimar el su volumen es mediante resonancia magnética (81).
-
-
- APE libre
-
El APE circula en dos formas: conjugado (unido a proteínas) y libre. El porcentaje de APE libre respecto del total es un parámetro utilizado como indicador complementario en la sospecha de CaP. Valores bajos de este porcentaje, especialmente inferiores al 10%, se asocian con mayor probabilidad de cáncer, mientras que porcentajes superiores al 25% suelen relacionarse con histología benigna (82). Sin embargo, algunos estudios sugieren que no aporta valor adicional en la discriminación de cáncer clínicamente significativo cuando se dispone del valor de d-APE (83).
-
-
- Velocidad de APE
-
Como es esperable que el nivel de APE vaya aumentando con la edad, se ha propuesto que la velocidad de este aumento podría ayudar a interpretar el APE en el diagnóstico precoz del cáncer prostático. La primera recomendación de que una velocidad del APE ≥ 0,75 ng/mL al año podía asociarse a un mayor riesgo de cáncer prostático es bastante antigua y se calculó solo con 18 casos de CaP (84). Una revisión sistemática reciente concluyó que existe poca evidencia que apoye el uso de la velocidad del APE en la toma de decisiones clínicas (85)
-
-
- Prostate health index (PHI): (sangre) combina APE total, libre y [-2] proAPE
- 4K: (sangre) Combina APE total, libre, intacto y hK2 con edad y antecedentes clínicos, logrando reducir biopsias innecesarias hasta en 60% (86)
-
Tanto PHI como 4K, han superado al APE libre/total en estudios prospectivos multicéntricos en hombres con APE entre 2–10 ng/mL (87). También se han comparado entre ellos con resultados equivalentes (88).
-
-
- isoAPE: (sangre) Analiza cambios estructurales del APE y ha mostrado un AUC de 0,784 para distinguir cáncer de alto y bajo grado (89).
- Stockholm 3: (sangre) Combina marcadores clínicos, genéticos y séricos (APE total, f/t APE, hK2, MCP-1 y MSMB), logrando reducir la detección de cánceres clínicamente insignificantes y el número de resonancias innecesarias (90)
- Proclarix: (sangre) Estima el riesgo de cáncer clínicamente significativo combinando trombospondina-1, catepsina D, APE total y libre, y edad del paciente, siendo útil ante imágenes dudosas (PI-RADS 3) (91).
- PCA3: (orina) es un ARN largo no codificante, que se analiza tras masaje prostático. Su principal rol es complementario en decisiones de re-biopsia (nombre comercial: Progensa) (92).
- TMPRSS2-ERG: (orina) Está fusión está presente en más del 50% de los cánceres prostáticos y su detección urinaria se asocia con formas agresivas (nombre comercial: My Prostate Score – MiPS) (93).
- ExoDx: (orina) analiza ARN exosomal de tres genes que están elevados en el CaP de alto grado ERG, PCA3 y SPDEF.
- SelectMDx: (orina) Se basa en la detección de ARN mensajero (mRNA) en orina. Evalúa los niveles de HOXC6 y DLX1, para estimar el riesgo de presencia de cáncer en la biopsia, así como la probabilidad de que este sea de alto riesgo.
- ConfirmMDx: (tejido prostático) Detecta metilación de los genes APC, RASSF1 y GSTP1. Puede ser útil cuando persiste la sospecha diagnóstica tras biopsias negativas, con valor predictivo negativo que alcanza el 96% (94).
- Prostate Core Mitotic Test (PCMT): (tejido prostático) Identifica depleción en el DNA mitocondrial asociado con cáncer prostático no diagnosticado, permitiendo detectar células malignas en el tejido de aspecto normal alrededor de un área de cáncer (95).
- PTEN: (tejido prostático) Identifica deleciones parciales o completas del gen supresor de tumores. En pacientes con lesiones intraepiteliales de alto grado (PIN de alto grado) permitiría distinguir lesiones no agresivas de aquellas asociadas a alto riesgo de cáncer y que requieren por lo tanto una nueva biopsia (96).
- Pronóstico
- Decipher: (tejido prostático) Analiza la expresión de 22 genes implicados en la progresión del CaP, y permite predecir el riesgo de metástasis y mortalidad específica por cáncer tras una prostatectomía radical o en enfermedad localizada. Se ha demostrado que proporciona información pronóstica independiente de las variables clínicas tradicionales, como el puntaje de Gleason, el APE o el estadio patológico, y es útil para guiar decisiones sobre terapia adyuvante y vigilancia active (97).
- Prolaris: (tejido prostático) Mide la expresión de 31 genes relacionados con el ciclo celular (genes reguladores de la proliferación) junto a 15 genes de control, y permite calcular un score de proliferación tumoral (Cell Cycle Progression, CCP). Este score se ha validado como un predictor independiente del riesgo de progresión, recurrencia bioquímica, metástasis y mortalidad específica por CaP, tanto en enfermedad localizada tratada con prostatectomía como en pacientes en vigilancia activa. Prolaris mejora la estratificación del riesgo más allá de los factores clínicos convencionales (APE, Gleason, estadio), y puede guiar decisiones terapéuticas sobre la necesidad de tratamiento activo versus manejo conservador (98).
- Oncotype DX: (tejido prostático) Analiza la expresión de 17 genes (12 relacionados con vías biológicas clave y 5 de referencia). Las vías incluidas abarcan la proliferación celular, organización del estroma, andrógeno-receptor y diferenciación celular. El examen entrega una puntuación entre 0 y 100 que predice la probabilidad de enfermedad con patrón de Gleason alto, compromiso extracapsular y progresión clínica, ayudando a tomar decisiones sobre vigilancia activa o tratamiento definitive (99).
- ProMark: (tejido prostático) Test proteómico que evalúa la expresión de ocho proteínas asociadas con la agresividad del CaP, mediante inmunofluorescencia cuantitativa en tejido de biopsia. A diferencia de los test genómicos basados en RNA, ProMark mide directamente proteínas involucradas en funciones como proliferación celular, adhesión, y resistencia a la apoptosis. Proporciona una puntuación continua entre 0 y 1 que predice la probabilidad de que el tumor tenga comportamiento agresivo (Gleason ≥7 o extensión extracapsular), ayudando a diferenciar entre candidatos a vigilancia activa y aquellos que podrían beneficiarse de tratamiento curative (100).
- Elección de tratamiento
- AR-V7 (Androgen Receptor Splice Variant 7): (sangre) Detecta la presencia de una variante del receptor androgénico que carece del dominio de unión a ligando, lo que le permite activarse de forma constitutiva e independiente de andrógenos. Esta variante se ha asociado con resistencia primaria a terapias hormonales de segunda generación, como enzalutamida y abiraterona, en pacientes con CaP metastásico resistente a la castración (mCRPC) (101).
- Genes HRR (homologous recombination repair): La pesquisa de alteraciones de estos genes permite identificar pacientes con mCRPC podrían beneficiarse del tratamiento con inhibidores de PARP. El análisis se realiza en líneas germinales o somáticas, buscando mutaciones de BRCA1, BRCA2, ATM, CHEK2, PALB2, RAD51 y CDK12, entre otros (102).
- Genes MMR (mismatch repair genes): Las alteraciones de genes MMR (MLH1, MSH2, MSH6, PMS2) o la presencia de inestabilidad de microsatélites (MSI-H) permiten identificar un subgrupo poco frecuente (<5%) de pacientes con CaP que podrían beneficiarse de inmunoterapia con pembrolizumab (103).
- PTEN: La pérdida o mutación del gen PTEN, un supresor tumoral que regula negativamente la vía PI3K/AKT/mTOR, ocurre en hasta el 40–50% de los cánceres de próstata metastásicos y se asocia con mal pronóstico. Esta alteración activa vías de supervivencia celular e involucra resistencia a terapias hormonales. Ensayos clínicos han demostrado que pacientes con pérdida de PTEN pueden beneficiarse de inhibidores de AKT, como capivasertib, especialmente en combinación con docetaxel (104).
-
-
SCREENING EN CÁNCER DE PRÓSTATA
La introducción del APE en la práctica clínica durante fines de los años 80 y comienzos de los 90 revolucionó la detección del CaP. Este biomarcador permitió identificar tumores en etapas asintomáticas, lo que se tradujo en un aumento significativo de la incidencia de CaP en las décadas siguientes. Su aplicación masiva en hombres asintomáticos llevó inicialmente a una reducción en el diagnóstico de enfermedad avanzada, generando optimismo respecto a su utilidad en la reducción de mortalidad (105,106)
Sin embargo, el uso indiscriminado del APE evidenció rápidamente sus limitaciones: su baja especificidad y su incapacidad para discriminar entre cánceres clínicamente significativos y aquellos indolentes derivaron en un aumento del sobrediagnóstico y sobretratamiento, exponiendo a muchos hombres a los riesgos de cirugías y radioterapias innecesarias (107).
Esta preocupación motivó la realización de dos ensayos clínicos aleatorizados de gran envergadura: “Prostate, Lung, Colorectal, and Ovarian (PLCO) Cancer Screening Trial” en EE. UU. y el “European Randomized Study of Screening for Prostate Cancer (ERSPC)” en Europa. El PLCO no mostró una reducción significativa en la mortalidad por CaP con screening sistemático (108), aunque sus resultados fueron cuestionados por el alto nivel de “contaminación” en el brazo control. En cambio, el ERSPC, con menor contaminación, sí demostró una reducción significativa en la mortalidad por CaP, inicialmente modesta (20% a 9 años), pero que se hizo más pronunciada con el tiempo (109).
Frente a esta evidencia contradictoria, el “U.S. Preventive Services Task Force” (USPSTF) en 2012 recomendó enérgicamente contra el screening rutinario con APE para CaP (grado D), argumentando que los daños superaban los beneficios (110). Esta decisión tuvo un impacto directo en la práctica clínica, disminuyendo las tasas de pesquisa y diagnóstico en Estados Unidos.
No obstante, la evolución de los datos del ERSPC ha modificado la percepción del screening: con un seguimiento más prolongado, el estudio ha evidenciado que la magnitud de la reducción de mortalidad aumenta con el tiempo, alcanzando una reducción de hasta 51% en mortalidad específica por CaP en algunos centros europeos a 21 años de seguimiento. Con los datos actuales, el número de hombres necesarios de tamizar para evitar una muerte se ha reducido a 570, lo que está por debajo de la misma métrica para screening en cáncer de mama (111)
Paralelamente, el sobretratamiento ha disminuido gracias al reconocimiento del CaP clínicamente insignificante como una entidad con bajo riesgo de progresión y al desarrollo del seguimiento activo como estrategia segura y eficaz para estos casos (112). Esto ha permitido reservar terapias invasivas para pacientes con enfermedad significativa, reduciendo efectos adversos y mejorando la calidad de vida.
Asimismo, el sobrediagnóstico se ha mitigado con la incorporación de la resonancia magnética multiparamétrica (RNMmp) al algoritmo diagnóstico. Esta herramienta mejora la especificidad de la pesquisa al permitir una mejor selección de pacientes que requieren biopsia, disminuyendo el número de diagnósticos de cánceres insignificantes (113,114)
En 2018, la USPSTF actualizó su recomendación, cambiando su postura de rechazo total al screening a una posición neutral, sugiriendo que la decisión debe ser individualizada para hombres entre 55 y 69 años, luego de discutir riesgos y beneficios (115).
A más de tres décadas del inicio del uso del APE como herramienta de detección precoz, el debate sobre el screening del CaP ha evolucionado sustancialmente. Si bien las primeras estrategias estuvieron marcadas por altas tasas de sobrediagnóstico y sobretratamiento, los avances tecnológicos han permitido mejorar la precisión diagnóstica, reduciendo intervenciones innecesarias sin comprometer la detección de cánceres clínicamente significativos. Esta transformación ha reavivado el interés por programas organizados de pesquisa, no solo por su potencial para disminuir la mortalidad por CaP, sino también como un mecanismo para reducir desigualdades en salud al ofrecer acceso equitativo a diagnóstico precoz. A pesar de los desafíos persistentes, como el sobrediagnóstico residual, las decisiones compartidas imperfectas y la necesidad de mayor adherencia poblacional, hoy disponemos de evidencia y herramientas que permiten pensar en una implementación responsable y beneficiosa del screening poblacional. Tal como ha ocurrido con la mamografía en mujeres, el momento de ofrecer esta posibilidad a los hombres parece haber llegado. Como toda política de salud pública, el éxito dependerá no solo de la evidencia, sino también de cómo se comunica, se organiza y se adapta en el tiempo.
-
RESONANCIA NUCLEAR MAGNÉTICA
La resonancia magnética multiparamétrica (RNMmp) se ha transformado en una herramienta clave para la evaluación del CaP. A través de la combinación de secuencias anatómicas y funcionales, esta técnica permite detectar lesiones sospechosas, guiar biopsias dirigidas y mejorar la estadificación local. En los últimos años, estudios clínicos aleatorizados, metaanálisis y recomendaciones internacionales han consolidado su valor diagnóstico.
-
- Fundamentos técnicos
La RNMmp combina imágenes de distintas secuencias:
- T2: fundamental para definir la anatomía zonal de la próstata y caracterizar la morfología de las lesiones, especialmente en la zona periférica.
- Difusión (DWI/ADC): mide el movimiento de agua en el tejido. Las lesiones malignas restringen la difusión, mostrando hipointensidad en el mapa ADC y alta señal en imágenes DWI de b altos.
- Perfusión dinámica con gadolinio (DCE): evalúa la captación precoz de contraste como signo indirecto de angiogénesis tumoral. Su utilidad es mayor cuando T2 y DWI son equívocas.
Con el objetivo de facilitar el acceso a la resonancia, se ha desarrollado una técnica biparamétrica (RNMbp) en la que se omite la secuencia DCE con contraste, limitándose a T2 y DWI. Su protocolo permite exploraciones más cortas (15–20 min frente a 30–45 min de la RNMmp), sin inyección intravenosa, lo que reduce costos y riesgos relacionados al gadolinio. La secuencia DCE se utiliza en el PI-RADS para caracterizar tumores equívocos de la zona de transición, lo que podría verse afectado con la bp. Si bien faltan estudios, el rendimiento diagnóstico parece ser similar entre RNMmp y RNMbp (116)
La evaluación de la RNMmp debe realizarse mediante el sistema PI-RADS (Prostate Imaging Reporting and Data System). Este fue desarrollado por el “American College of Radiology” (ACR) en conjunto con la “European Society of Urogenital Radiology” (ESUR) para estandarizar la adquisición, interpretación y reporte de estudios de RNMmp de la próstata. Su objetivo principal es mejorar la detección y caracterización del CaP clínicamente significativo facilitando la toma de decisiones clínicas y la comunicación entre radiólogos y urólogos.
Su segunda revisión ha demostrado una sensibilidad promedio de 78% y especificidad de 79% para cáncer clínicamente significativo, con valores predictivos negativos (VPN) tan altos como 96% según estudios con validación histopatológica (117).
El sistema PI-RADS ofrece múltiples beneficios clínicos y operativos en la evaluación del CaP mediante resonancia magnética. En primer lugar, proporciona una estandarización en la adquisición, interpretación y reporte de las imágenes, lo que facilita una comunicación clara y uniforme entre radiólogos y urólogos. Su aplicación mejora significativamente la detección de cánceres clínicamente significativos al guiar la atención hacia las lesiones con mayor sospecha, y a la vez reduce el sobrediagnóstico de tumores indolentes.
-
- RNMmp para el diagnóstico
El uso de RNMmp en pacientes sin biopsias previas ha sido respaldado por múltiples ensayos como PROMIS y PRECISION (113,114). El estudio PROMIS mostró que una estrategia basada en RNMmp seguida de biopsia dirigida permite detectar 93% de los cánceres clínicamente significativos y reducir las biopsias innecesarias en un 28%.
La prevalencia de CaP ISUP ≥2 en PIRADS 1-2 es 6%, PIRADS 3 de 16% y PIRADS 4-5 de 62% (118). El valor predictivo negativo en PIRADS 1 o 2 es de 90.8%, bajando a 86.8% si se incluyen los PIRADS 3. Sin embargo, puede existir variación importante el el rendimiento del examen entre distintos centros por lo que resulta de gran relevancia conocer los resultados de cada centro para poder tomar decisiones adecuadas (119).
Estudios de meta-análisis que agrupan pacientes con y sin biopsias previas muestran que aplicar un umbral de PI-RADS ≥3 evita el 30% de las biopsias, dejándose de pesquisar un 11% de cánceres ISUP ≥2. Si se eleva el umbral a PI-RADS ≥4, se evitan el 59% de todas las biopsias, pero con la desventaja de perder el 28% de los cánceres ISUP GG ≥2 (120).
Las guías EAU y NCCN recomiendan realizar RNM antes de la primera biopsia en hombres con sospecha de CaP localizado y usar calculadoras de riesgo si no está disponible. Estás recomendaciones tienen un nivel 1 de evidencia (22,121). La AUA sugiere que los clínicos pueden utilizar la RNM, sin embargo, a su juicio, la evidencia es de menor calidad (122).
-
- RNMmp para la estadificación
La RNMmp también se ha posicionado como herramienta útil en la estadificación local del CaP. Permite evaluar la extensión extracapsular, la invasión del fascículo neurovascular y del ápex, con implicancias directas en la decisión quirúrgica (123). Su uso puede mejorar la preservación de bandeletas neurovasculares y reducir los márgenes quirúrgicos positivos.
* La biopsia de próstata se trata en otro capítulo de este manual
-
ESTRATIFICACIÓN DE RIESGO PARA ENFERMEDAD CLINICAMENTE LOCALIZADA
- Sistema TNM
La estadificación TNM representa esquemáticamente la extensión anatómica del tumor
TX: tumor primario no puede ser evaluado.
T0: no hay evidencia de tumor primario.
T1: tumor clínicamente no aparente, no palpable ni visible mediante imágenes.
T1a: descubrimiento histológico incidental del tumor en 5% o menos del tejido resecado.
T1b: descubrimiento histológico incidental del tumor en más del 5% del tejido resecado.
T1c: tumor identificado por biopsia de aguja (por ejemplo, a causa de APE elevado).
T2: tumor confinado dentro de la próstata*.
T2a: el tumor afecta la mitad de un lóbulo o menos.
T2b: el tumor compromete más de la mitad de un lóbulo pero no ambos.
T2c: el tumor afecta ambos lóbulos.
T3: el tumor se extiende a través de la cápsula prostática.
T3a: extensión extracapsular (unilateral o bilateral).
T3b: el tumor invade la(s) vesícula(s) seminal(es).
T4: el tumor está fijo o invade estructuras adyacentes distintas a las vesículas seminales: el cuello de la vejiga, el esfínter externo, el recto, los músculos elevadores y/o la pared de la pelvis.
* Nota: el tumor se encuentra en uno o ambos lóbulos mediante biopsia con aguja, pero que no es palpable o confiablemente visible por imágenes es clasificado como T1c.
Nota: invasión al ápice prostático o a la cápsula prostática (pero no más allá) no está clasificada como T3, pero sí como T2.
NX: ganglios linfáticos regionales no pueden evaluarse.
N0: no existe metástasis ganglionar linfática regional.
N1: metástasis en ganglio linfático regional o ganglios.
MX: metástasis distante no puede ser evaluada.
MO: no hay metástasis distante.
M1: metástasis distante.
M1a: ganglio(s) linfático(s) no regional(es).
M1b: hueso(s).
M1c: otro(s) sitio(s).
Según la clasificación TNM de la “Union for International Cancer Control” (UICC) 8th edition (2017), el estadio clínico T puede determinarse por examen físico o por imágenes. Sin embargo, la clasificación del “American Joint Committee on Cancer” (AJCC) 8th edition (2017), explícitamente dice que sólo se realiza mediante examen físico.
La “European Association of Nuclear Medicine” (EANM), ha propuesto el uso de la nomenclatura miTNM (molecular imaging), para describir cuando la clasificación se realiza utilizando PET-PSMA (124,125). Esta recomendación ha sido acogida por la última versión del TNM de la UICC.
-
- Sistemas de clasificación de riesgo: guías clínicas
Las distintas guías clínicas proponen sistemas de clasificación para intentar predecir el riesgo de recurrencia bioquímica luego del tratamiento de tumores localizados o localmente avanzados. La clasificación por grupos de riesgo de la EAU se basa principalmente en el sistema de D’Amico, combinando información clínica sobre la extensión tumoral, el APE y el grado histológico de la biopsia sistemática (22). Siguiendo a las guías NCCN, el grupo de riesgo intermedio se ha dividido entre favorable y desfavorable, basado en la presencia de ISUP 3 (121). También se ha introducido el modelo “Cambridge Prognostic Groups” (CPG), que utiliza cinco niveles según ISUP, APE y estadio clínico (cT), con un mejor desempeño para predecir mortalidad específica por CaP que los grupos de riesgo EAU tradicionales (126).
Es importante señalar estas clasificaciones por grupos de riesgo no son perfectas y tienen un valor más limitado cuando las extrapolamos a nivel individual, donde el uso de normogramas puede ser más preciso.
Tabla 1. Comparación de sistemas de clasificación de riesgo
| Grupo de riesgo | EAU 2025 (22) | NCCN 2025 (121) | AUA 2022 (127) | CPG (Cambridge Prognostic Group) (126) |
| Muy bajo | Debe cumplir todo: • cT1c • ISUP 1 • APE <10 • <3 cores positivos, ≤50 % de cáncer por core • Densidad de APE <0.15 |
|||
| Bajo | ISUP 1 y APE <10 y cT1–2ª | Debe cumplir todo pero no califica como muy bajo: • cT1–cT2a • ISUP 1 • APE <10 |
ISUP 1, APE <10,
T1–T2a |
CPG 1:
ISUP 1 y APE <10 y T1–T2 |
| Intermedio favorable | ISUP 2 y APE <10 y cT1–2b
o ISUP 1 y APE 10–20 y cT1–2b o ISUP 1 y APE <10 y cT2b |
Debe cumplir todo lo siguiente: • No alto riesgo • No muy alto riesgo • Factores de riesgo intermedio (FRI): ▸ cT2b–cT2c ▸ ISUP 2 o 3 ▸ APE 10–20Riesgo intermedio favorable: debe cumplir todo lo siguiente: • 1 FRI • ISUP 1 o 2 • <50 % de cores positivos |
ISUP 1 con
APE 10–20 o T2b–c y <50 % de cores positivos o ISUP 2 con APE <10 y T1–2a y <50 % de cores positivos |
CPG 2:
ISUP 2 o APE 10–20 ng/ml y T1–T2 |
| Intermedio desfavorable | ISUP 2 y APE 10–20 ng/ml y cT1–2b
o ISUP 3 y cT1–2b |
Riesgo intermedio desfavorable: cumple uno o más de los siguientes: • 2 o 3 FRI • ISUP 3 • ≥50 % de cores positivos |
ISUP 1 con
APE 10-20 y estadio T2b–c o ISUP 2 con APE 10–20 y/o ≥50 % cores positivos o ISUP 3 con APE <20 |
CPG 3:
ISUP 2 y APE 10–20 y T1–T2 o ISUP 3 y T1–T2 |
| Alto | ISUP 4 o 5
o APE >20 ng/ml o cT2c |
Una o más características de alto riesgo, pero no califica como muy alto: • cT3–cT4 • ISUP 4 o 5 • APE >20 |
ISUP 4–5 o APE ≥20 o T3 | CPG 4:
ISUP 4 o APE >20 o T3 |
| Muy alto | Tiene al menos dos de los siguientes: • cT3–cT4 • ISUP 4 o 5 • APE >40 |
CPG 5:
Cualquier combinación de ISUP 4, APE >20 o T3 o ISUP 5 o T4 |
-
- Normogramas
Los nomogramas permiten predecir la extensión del cáncer al diagnóstico, el compromiso ganglionar linfático y los resultados a largo plazo posterior al tratamiento. Mientras más información clínica relevante se incluya, más preciso será el resultado. Como los nomogramas utilizan información de un paciente individual predicen de manera más precisa el riesgo para ese paciente en comparación con los grupos de riesgo.
La tablas de Partin fueron las primeras en ser utilizadas en clínica. Introducidas en 1993 han sufrido varias actualizaciones, la última publicada en el 2013 (128). Utilizan el valor del APE, score de Gleason de la biopsia y estadio clínico para predecir el estadio patológico del cáncer antes del tratamiento. La modalidad postoperatoria también conocida como tablas de Han, incluye variables de la anatomía patológica de la pieza operatoria y son utilizadas para predecir la recurrencia bioquímica posterior al tratamiento radical (129). Se ha desarrollado también varios otros nomogramas en centros dedicados al tratamiento del cáncer prostático. Los nomogramas de Kattan del “Memorial Sloan Kettering Cancer Center” también incluyen modelos pre y post cirugía radical y se han agregado, además, herramientas predictivas para radioterapia de salvataje, riesgo de morir de CaP en el periodo de recurrencia bioquímica y otros para calcular el riesgo de progresión utilizando el tiempo de doblaje del APE (130). Todas estas herramientas pueden integrarse en el manejo de un paciente determinado en distintas etapas de la enfermedad.
En el “Prostate Cancer Prevention Trial” (PCPT), se creó también una calculadora de riesgos en línea. Considerando edad, APE, origen étnico, antecedentes familiares, hallazgos del tacto rectal y resultados de la biopsia; permite predecir las probabilidades de CaP de bajo o alto grado (131).
Otro de los sistemas más utilizados es la evaluación del riesgo de CaP desarrollado en la Universidad de California, San Francisco (UCSF-CAPRA). Originalmente descrito en 2006, se basa en factores clínicos que incluyen el valor del APE, score de Gleason, estadio T, edad del paciente y porcentaje de cilindros positivos de cáncer en la biopsia (132).
De uso más habitual son los nomogramas que permiten predecir el compromiso de ganglios linfáticos antes de tratamiento. Estos nomogramas permiten predecir el riesgo de compromiso linfático y decidir si es conveniente considerar la linfadenectomía pelviana. El más utilizado en este contexto y que ha sido validado externamente es el de Briganti. En su actualización del 2023 incluye el APE, estadio clínico, RNM, el ISUP y detalles de la biopsia (133).
-
PRINCIPIOS DE TRATAMIENTO DEL CANCER PROSTATICO LOCALIZADO Y LOCALMENTE AVANZADO
El tratamiento del CaP localizado y localmente avanzado sigue siendo controvertido a pesar de los avances en las herramientas diagnósticas y terapéuticas de las últimas décadas. La introducción de la RNMmp, las biopsias dirigidas y la mayor comprensión de la biología tumoral han contribuido a una mejor caracterización del riesgo, pero no han resuelto las incertidumbres clínicas sobre qué pacientes se beneficiarán realmente del tratamiento activo.
La raíz de esta controversia reside en que no todos los pacientes con CaP requieren tratamiento, ya sea porque presentan una enfermedad indolente o clínicamente no significativa, o porque su expectativa de vida está limitada por su edad, comorbilidades u otras causas de mortalidad que compiten y no relacionadas con el cáncer (134). El CaP tiene una historia natural habitualmente lenta, y muchos hombres morirán por otras causas antes de que la neoplasia genere síntomas o amenace su vida. En consecuencia, los potenciales beneficios de un tratamiento radical deben siempre sopesarse frente a sus efectos adversos sobre la calidad de vida (22).
Para abordar este problema, se ha introducido el concepto de CaP clínicamente significativo, cuyo objetivo es identificar los tumores con potencial real de progresión o de generar morbilidad o muerte (22). Desde un punto de vista patológico, los tumores ISUP 1 (patrón Gleason 3 puro), confirmados en prostatectomía radical, han demostrado tasas extremadamente bajas de recurrencia bioquímica (3,5%) y extensión extracapsular (0,3%) (135), y nulo riesgo de metástasis ganglionares o a distancia (136), por lo que se consideran generalmente insignificantes. Sin embargo, cuando se diagnostican por biopsia, existe riesgo de submuestreo y subestimación del grado, especialmente en casos de alto volumen tumoral o APE elevado (137).
Desde un punto de vista biológico, las características del cáncer difieren profundamente entre los dos patrones más comunes de enfermedad, Gleason 3 y 4. En la mayoría de los casos, las anormalidades moleculares asociados con el cáncer están ausentes en el patrón de Gleason 3, particularmente en el caso de genes que regulan vías oncogénicas claves. Por ejemplo, genes involucrados en la proliferación se expresan en forma normal en el patrón de Gleason 3 y anormalmente en 4. Genes involucrados en la invasión celular y metástasis, y los genes que regulan la transición del ciclo celular no se sobre expresan en Gleason 3, pero están presentes en Gleason 4. Lo mismo sucede con genes asociados a la resistencia a la apoptosis, angiogénesis y regulación del metabolismo celular (138)
Por otra parte, también hay evidencia de que una proporción de tumores ISUP 2 podría ser clínicamente insignificante y estar siendo tratados en exceso (139).
En conjunto, estos datos han impulsado el desarrollo de estrategias como la vigilancia activa, que busca monitorizar selectivamente a los pacientes con tumores de bajo riesgo y ofrecer tratamiento sólo en caso de progresión biológica.
El estudio ProtecT ilustra de manera ejemplar los principios anteriormente descritos. Este ensayo clínico aleatorizado reclutó entre 1999 y 2009 a 82.429 hombres entre 50 y 69 años en el Reino Unido, de los cuales 2664 fueron diagnosticados con cáncer prostático localizado mediante tamizaje con APE. Un total de 1643 pacientes aceptaron ser randomizados a vigilancia activa, prostatectomía radical o radioterapia externa. A una mediana de seguimiento de 15 años, se observó que la mortalidad específica por cáncer fue baja y similar entre los tres grupos, mientras que aproximadamente la mitad de los pacientes bajo vigilancia activa requirieron tratamiento definitivo en algún momento del seguimiento. La mayoría de los hombres incluidos presentaban enfermedad de bajo riesgo (77%). Este estudio no sólo reafirma que muchos pacientes pueden beneficiarse de un enfoque conservador, sino que también demuestra que las opciones terapéuticas disponibles (cirugía y radioterapia) ofrecen resultados oncológicos equivalentes en el largo plazo, siempre que se indique en los pacientes apropiados (140).
-
PROSTATECTOMÍA RADICAL
- Fundamentos
La prostatectomía radical es un tratamiento quirúrgico con intención curativa indicado en pacientes con CaP localizado o localmente avanzado. Consiste en la extirpación completa de la glándula prostática junto con las vesículas seminales y, en algunos casos, incluye una linfadenectomía pélvica. Su objetivo principal es la erradicación oncológica del tumor, buscando minimizar el riesgo de recurrencia y progresión de la enfermedad.
El estudio SPCG-4 comparó la prostatectomía radical con la conducta expectante (“watchful waiting”) en pacientes con cáncer prostático localizado 87. El seguimiento extendido confirmó que el grupo sometido a prostatectomía radical presentó una reducción significativa de la mortalidad general, mortalidad cáncer específica, riesgo de metástasis o el uso de deprivación androgénica. Estos beneficios se mantuvieron en el curso del tiempo y fueron más pronunciados en los pacientes menores de 65 años y con tumores de riesgo intermedio. Por otro lado, en los pacientes mayores de 65 años sometidos a cirugía radical disminuyó significativamente el riesgo de metástasis y la necesidad de tratamiento paliativo lo que apoyaría que los pacientes de mayor edad, pero con una larga expectativa de vida también se beneficiarían del tratamiento quirúrgico (141) (142).
El estudio PIVOT también incluyó pacientes con cáncer prostático localizado randomizados a observación o prostatectomía radical. A los pacientes asignados a observación se ofreció tratamiento paliativo en la eventualidad de progresión sintomática de la enfermedad o metastásica. El seguimiento de estudio que también se actualizó recientemente es menos prolongado que el estudio SPCG-4, con una mediana de 18.6 años. A los 23 años de seguimiento del estudio, la prostatectomía radical se asoció a una reducción relativa del riesgo del 45 % y una reducción absoluta de 12%. Se necesitó tratar a 8,4 hombres con cirugía para evitar una muerte por cualquier causa. En promedio, la prostatectomía radical aportó 2,9 años adicionales de vida. Entre los hombres operados, la extensión extracapsular multiplicó por cinco el riesgo de muerte por cáncer, y un puntaje de Gleason mayor a 7 lo multiplicó por diez respecto de un Gleason ≤6. En conclusión, los hombres con CaP localizado detectado clínicamente y con alta expectativa de vida obtuvieron un beneficio claro en supervivencia con la prostatectomía radical, especialmente si presentaban factores de alto riesgo patológico. (143)
El estudio ProtecT incluyó pacientes con CaP localizad que fueron aleatorizados a vigilancia activa, prostatectomía radical o radioterapia. En su última actualización con seguimiento medio de 15 años, mostró que la mortalidad específica por cáncer fue baja y sin diferencias significativas: 3,1 % en vigilancia, 2,2 % en cirugía y 2,9 % en radioterapia (p = 0,53). La mortalidad global también fue similar entre los grupos. La incidencia de metástasis se duplicó en el grupo de vigilancia (9,4 %) frente a cirugía (4,7 %) o radioterapia (5,0 %). Además, más pacientes bajo vigilancia pasaron a terapia de privación androgénica a largo plazo (12,7 %) que en los grupos de tratamiento activo (7‑8 %). Tras 15 años, la supervivencia específica y global es muy alta y equivalente entre estrategias (vigilancia, cirugía o radioterapia). Por tanto, la elección de tratamiento debe basarse en una valoración de riesgos y beneficios, considerando principalmente los efectos secundarios y la calidad de vida (140).
SPCG-4, PIVOT y ProtecT difieren principalmente en la forma en que se reclutaron los pacientes. Los pacientes reclutados en el SPCG-4 fueron, en su mayoría, diagnosticados clínicamente y no mediante tamizaje, mientras que los hombres en los ensayos PIVOT y ProtecT fueron identificados a través de pruebas de APE. Los hombres del estudio PIVOT eran, en general, mayores. En el caso del ensayo ProtecT, los hombres fueron reclutados directamente desde el estudio de screening CAP, por lo que reflejan los resultados de programas de tamizaje poblacional. Como consecuencia, los pacientes del ensayo ProtecT tienen el mayor sesgo “lead time” (el tiempo entre la detección por screening y la presentación clínica); mientras que los pacientes del PIVOT el sesgo es más moderado; y los del SPCG-4 es prácticamente nulo (144).
Ninguno de estos estudios ha demostrado un beneficio en supervivencia de la cirugía para los hombres con ISUP 1. La gran mayoría de estos pacientes tiene poco o nada que ganar con la intervención, pero sí corren el riesgo de comprometer su calidad de vida (144).
Desafortunadamente, estos estudios no reclutaron un número significativo de hombres con enfermedad ISUP 2 o mayor, quienes tienen mayor probabilidad de morir por CaP. Los resultados a 20 años de los estudios SPCG‑4 y PIVOT no muestran una ventaja en supervivencia para este grupo, pero esto podría deberse a un error estadístico tipo II (falta de poder estadístico por tamaño de muestra pequeño) (144).
-
- Técnica quirúrgica
La prostatectomía radical se puede efectuar por vía retropúbica o transperineal, siendo la vía retropúbica la más popular. El abordaje puede realizarse por vía laparoscópica o asistida por robot. La prostatectomía robótica (RARP, por sus siglas en inglés) ofrece ventajas al compararla con la técnica laparoscópica estándar, incluyendo instrumentos articulados, control del temblor y visualización tridimensional. Todas estas mejorías permiten acortar significativamente la curva de aprendizaje, una de las limitantes mayores de la prostatectomía laparoscópica.
La prostatectomía robótica ha mostrado ventajas clínicas importantes sobre la prostatectomía radical abierta, especialmente en términos de recuperación perioperatoria y resultados funcionales tempranos. La evidencia más sólida proviene de estudios comparativos y metaanálisis que han demostrado que RARP se asocia con una reducción significativa de la pérdida sanguínea intraoperatoria, menor tasa de transfusiones, menor dolor postoperatorio, menor duración de la estancia hospitalaria y una recuperación funcional más rápida en términos de continencia urinaria (145)
-
- Linfadenectomía pelviana
La linfadenectomía pélvica extendida (ePLND) ha sido recomendada históricamente durante la prostatectomía radical con fines de estadificación, ya que permite detectar más metástasis ganglionares que una disección limitada (lPLND). Aunque la ePLND aporta información pronóstica útil para decidir terapias adyuvantes, no se ha demostrado un beneficio terapéutico claro en términos de supervivencia ni reducción de recurrencia bioquímica, según varios ensayos aleatorizados (146–148). El número de hombres que necesitan ser tratados con una PLND para lograr un APE indetectable en el postoperatorio, con un seguimiento mediano de 4 años, es de 395 (149). Además, se asocia a mayor morbilidad: riesgo elevado de linfedema (13.7 % a 3 meses), complicaciones hasta en un 20 % de los pacientes, tromboembolismo y mayor tiempo quirúrgico (150).
El PET-PSMA ha emergido como una herramienta no invasiva con alta especificidad (~95 %) para detectar metástasis ganglionares (miN1), incluso fuera de los campos clásicos de disección (151). Estudios recientes indican que los pacientes con hallazgos positivos en PET-PSMA tienen mayor carga tumoral ganglionar, lo cual se relaciona con peor supervivencia libre de progresión bioquímica (152). No obstante, esta técnica tiene limitaciones para detectar enfermedad de bajo volumen (debajo de 5 mm), y su disponibilidad puede ser restringida.
Frente a esta evidencia, desde el 2024 las guías de la EAU cambiaron su postura: ya no recomiendan fuertemente la ePLND como estándar para estadificación preoperatoria, especialmente cuando el PET-PSMA es negativo y el riesgo de invasión ganglionar es bajo (22). Se sugiere individualizar la indicación mediante nomogramas clínicos e imagenología avanzada, y discutir con los pacientes los riesgos y beneficios antes de realizar una ePLND. En el caso de decidirse por realizar una linfadenectomía, siempre debe ser extendida.
-
- Complicaciones
Como cualquier intervención médica, la prostatectomía radical no está exenta de complicaciones. Entre las más comunes se cuentan incontinencia urinaria, disfunción eréctil, estenosis de la anastomosis uretrovesical, sangrado, linfoceles, infecciones, así como otras menos frecuentes pero relevantes, como lesiones rectales, hernias, trombosis venosa profunda, complicaciones anestésicas y mortalidad quirúrgica.
La incontinencia urinaria es una de las complicaciones funcionales más relevantes tras la prostatectomía radical, con una tasa que varía según la técnica quirúrgica, la edad del paciente y la experiencia del cirujano. En general, se estima que entre un 10% y un 30% de los pacientes presentan algún grado de incontinencia tras la cirugía (22,153). La incontinencia severa, que requiere el uso de múltiples pañales o incluso un esfínter urinario artificial, ocurre en menos del 5% de los casos (154). La mayoría de los pacientes recupera la continencia dentro del primer año postoperatorio, alcanzando tasas de continencia total (sin uso de protectores) del 70–90%, con una recuperación generalmente más rápida en la técnica robótica (153,155).
Las lesiones rectales son poco frecuentes (<1%) pero de alto impacto, con mayor incidencia en cirugía abierta (154). Las hernias incisionales o en el sitio de los trocares son infrecuentes y se presentan en 1%. Las hernias inguinales son más frecuentes, apareciendo en cerca del 7% de los pacientes, sin diferencias entre cirugía abierta o robótica (156). La trombosis venosa profunda (TVP), aunque rara 1%), es una complicación grave, cuyo riesgo se incrementa en pacientes de edad avanzada, con comorbilidades, al realizarse una linfadenectomía o cirugía abierta (157). La mortalidad perioperatoria es muy baja (<0.5%), pero aumenta con la edad avanzada y comorbilidades cardiovasculares o respiratorias (22).
Como se ha discutido previamente, el abordaje robótico ha mostrado ventajas consistentes en pérdida de sangre, recuperación funcional y menor estancia hospitalaria. También presenta tasas ligeramente menores de estenosis anastomótica y lesiones rectales, gracias a la mejor visualización anatómica y menor trauma tisular (154,156)
-
- Recurrencia bioquímica
Luego de la cirugía se espera que los niveles de APE desciendan a valores indetectables dentro de las 6 a 8 semanas posteriores a la cirugía. La persistencia de APE, definida como un valor detectable o elevado en ese periodo temprano postoperatorio, puede reflejar la presencia de enfermedad residual local, metástasis ganglionares no tratadas o enfermedad micrometastásica a distancia. Su hallazgo se asocia con un mayor riesgo de recaída clínica y compromiso de la sobrevida libre de progresión (158). Ocasionalmente, la persistencia de niveles bajos de APE también puede asociarse a tejido residual benigno en el lecho prostático o en el cuello vesical (159).
La recurrencia bioquímica tras prostatectomía radical se define clásicamente como la reaparición de APE detectable ≥0,2 ng/mL en dos mediciones consecutivas, luego de haber alcanzado un nadir indetectable tras la cirugía. Esta recurrencia precede, en muchos casos, a la aparición de progresión clínica o metastásica, por lo que constituye una herramienta fundamental para la vigilancia postoperatoria. Su aparición puede deberse a recidiva local en el lecho prostático, compromiso ganglionar o diseminación a distancia. El momento del ascenso del APE, el tiempo hasta la recurrencia, la velocidad de duplicación del APE (APEDT) y la patología definitiva son factores pronósticos clave para guiar las decisiones terapéuticas, que incluyen vigilancia estrecha, radioterapia de rescate o tratamiento sistémico según el contexto clínico.
Sin embargo, esta definición de recurrencia bioquímica tiene múltiples limitaciones. No incluye los métodos super sensibles de determinación del APE y no es específica en establecer el periodo y extensión de la recurrencia metastásica. El método más ampliamente aceptado para predecir la recurrencia metastásica considera los factores clínicos iniciales (nivel de APE, velocidad de APE, categoría T y puntaje de Gleason de biopsia), hallazgos patológicos después de la cirugía y cinética de APE posterior a la falla (160).
-
VIGILANCIA ACTIVA
- Fundamentos
La vigilancia activa (VA) se ha consolidado como una estrategia clave en el manejo del CaP localizado de bajo riesgo. Consiste en un monitoreo estructurado del curso de la enfermedad con el objetivo de indicar un tratamiento curativo en caso de evidenciarse progresión. A diferencia de la observación o espera vigilante (“watchlful waiting”), la VA está orientada a pacientes más jóvenes con cáncer de comportamiento indolente, con el fin de diferir el tratamiento y sus posibles efectos adversos, sin comprometer el control oncológico. Su incorporación como opción terapéutica válida ha sido posible gracias al mayor conocimiento de la historia natural de la enfermedad, así como a la disponibilidad de mejores herramientas diagnósticas. Esta estrategia permite evitar el sobretratamiento, reservando intervenciones como la prostatectomía radical o la radioterapia para aquellos pacientes que verdaderamente se beneficiarán. Distintos estudios prospectivos y observacionales han demostrado que, en pacientes bien seleccionados, la VA permite mantener tasas de mortalidad por CaP muy bajas, preservando al mismo tiempo la calidad de vida.
La adopción de la VA ha crecido de forma sostenida en las últimas dos décadas, especialmente en países con sistemas de salud desarrollados. En Europa, las tasas de uso de VA en CaP de muy bajo riesgo han superado el 90 %, y en los casos de bajo riesgo oscilan entre el 70 % y el 80 % (161). En Suecia el uso de VA en pacientes con cáncer de muy bajo riesgo aumentó del 57 % al 91 % entre 2008 y 2020 (162). En Estados Unidos, los datos del período 2010–2018 revelan que la adopción pasó del 16 % al 60 % en riesgo bajo, y del 8 % al 22 % en casos de riesgo intermedio favorable (163).
La educación continua de los urólogos y la adecuada formación de los nuevos profesionales resulta fundamental para poder aumentar la adopción de esta estrategia. Un estudio mostró que el principal factor asociado al uso de VA es la recomendación directa del urólogo, la cual multiplicó por seis la probabilidad de optar por esta estrategia en comparación con otros enfoques (164).
- Criterios de inclusión
La elegibilidad para VA ha sido objeto de discusión en la literatura y varía entre los distintos estudios y guías internacionales. A pesar de estas diferencias, existe consenso en torno a ciertos criterios fundamentales para la inclusión: APE <10 ng/ml, estadio clínico T1c-T2a, ISUP 1, densidad de APE ≤0,15 ng/ml/cm³, y compromiso limitado en la biopsia. Estos parámetros derivan de las definiciones clásicas de CaP de bajo riesgo según D’Amico y de muy bajo riesgo según Epstein, que han servido como base para múltiples cohortes y protocolos internacionales (165,166).
El objetivo principal de estos criterios es excluir la presencia de elementos histopatológicos de mayor agresividad (patrón de Gleason 4). Si bien es conocido que puede existir heterogeneidad tumoral y focos ocultos de patrón 4, la progresión real de un tumor puro Gleason 3 a 4 o 5 es infrecuente. Modelos de progresión estiman que este riesgo no supera el 1–2 % anual, y se presenta sobre todo en pacientes con ISUP 1 de alto volumen (167). Una vez descartado un componente de mayor grado, es improbable que el paciente requiera tratamiento en el corto o mediano plazo.
Si bien la mayoría de los protocolos de VA se enfocan en pacientes con ISUP 1 y características de muy bajo riesgo, algunos grupos han ampliado estos criterios para incluir casos muy seleccionados con ISUP 2 de bajo volumen. El grupo de Toronto, por ejemplo, ha incorporado pacientes con riesgo intermedio favorable (168). En contraste, el protocolo de Johns Hopkins aplica criterios más restrictivos, limitando la inclusión a ISUP 1 con criterios de Epstein. Sin embargo, bajo estos criterios estrictos, solo el 20 % de los pacientes diagnosticados con CaP localizado calificaron para VA, en comparación con el 50 % en el grupo de Toronto. En una publicación más reciente, el brazo de VA del estudio GÖTEBORG-1 mostró que a 19 años de seguimiento un 30% de los pacientes con CaP de riesgo intermedio estaba libre de tratamiento, mientras que la sobrevida cáncer específica a 24 años era de 85% (169).
En la práctica clínica, es probable que la estrategia óptima se sitúe entre estos dos enfoques. La mayoría de los pacientes con ISUP 1 bien caracterizado son buenos candidatos para VA, y podría considerarse la inclusión de pacientes cuidadosamente seleccionados con ISUP 2 y bajo volumen tumoral. Asimismo, herramientas complementarias como la resonancia multiparamétrica (RNMmp) y biomarcadores genéticos están siendo incorporadas progresivamente para mejorar la precisión de la selección inicial.
- Resultados a largo plazo
La cohorte de Johns Hopkins es una de las más antiguas y rigurosamente estructuradas en la evaluación de VA. Desde 1995, ha incluido a más de 1.800 hombres con enfermedad de muy bajo riesgo, definidos por los criterios de Epstein. En el seguimiento a largo plazo, con una mediana de 5 años y algunos pacientes seguidos hasta 20 años, los resultados han sido extraordinarios. A los 15 años, la supervivencia específica por CaP fue del 99,9 %, con solo 0,1 % de mortalidad relacionada con la enfermedad y una tasa de metástasis inferior al 0,5 % (solo ocho pacientes). Un 32 % de los pacientes presentó progresión histológica (a ISUP ≥2) y el 48 % optó por tratamiento curativo durante el seguimiento, la mayoría de ellos por progresión en biopsias de vigilancia o incremento sostenido del APE (112).
La de Sunnybrook, publicada por Klotz, reportó con una mediana de seguimiento de 6,4 años (rango 0,2–19,8 años), que solo el 1,5 % había fallecido por CaP y el 1,3 % había desarrollado metástasis. Las tasas actuariales de supervivencia específica a los 10 y 15 años fueron del 98,1 % y 94,3 %, respectivamente. Además, aproximadamente el 55 % de los pacientes mantenían vigilancia activa sin tratamiento a los 15 años, reflejando una estrategia segura y duradera (168).
La cohorte Canary PASS, que incluye a 2155 hombres evaluados durante una mediana de seguimiento de 7,2 años, mostró que a los 10 años, solo el 1,4 % había progresado a metástasis y el 0,1 % había fallecido por CaP. Además, casi la mitad (49%) permanecía sin tratamiento, y menos del 2 % presentó enfermedad metastásica (170).
En el estudio GÖTEBORG-1, tras una mediana de seguimiento de 18 años, el 62 % de los hombres suspendieron el seguimiento y recibieron tratamiento, mientras que 81 casos presentaron progresión o fracaso del protocolo. La supervivencia específica por CaP fue excelente: a los 25 años alcanzó un 94 % para toda la cohorte, con resultados superiores en los subgrupos de menor riesgo (99 % en riesgo muy bajo, 92 % en bajo y 85 % en riesgo intermedio).
En resumen, las cohortes clásicas y contemporáneas con seguimiento prolongado (10–18 años) muestran resultados consistentes: mortalidad específica muy baja (≤ 1,5 %), tasas de metástasis inferiores al 2 %, y una gran proporción de pacientes (40–55 %) permanecen sin tratamiento tras diez años. Estos datos refuerzan que la VA es una estrategia segura, efectiva y sostenible para hombres con CaP de bajo riesgo.
- Calidad de vida
Una de las ventajas más destacadas de la VA es su impacto positivo en la calidad de vida. Estudios como el ProtecT y PRIAS han documentado que los pacientes bajo VA presentan mejores resultados en función urinaria y sexual que aquellos tratados activamente. Aunque algunos hombres experimentan ansiedad relacionada con la presencia de cáncer no tratado, en la mayoría de los casos esta ansiedad disminuye con el tiempo y no interfiere significativamente con la calidad de vida. Herramientas de apoyo psicológico, educación al paciente y toma de decisiones compartida son claves para sostener este beneficio.
- Protocolos de seguimiento
Las guías internacionales más recientes (NCCN, EAU, AUA) han armonizado parcialmente sus recomendaciones respecto a la frecuencia y tipo de controles que deben realizarse durante la vigilancia activa. Aunque existen diferencias según el entorno clínico y los recursos disponibles, las siguientes estrategias representan el estándar actual:
- APE cada 3–6 meses.
- Examen digital rectal anual (pudiendo obviarse si se cuenta con RNM)
- RNMmp: al inicio y según evolución.
- Biopsias: confirmatoria al año, luego cada 2–3 años o individualizada según riesgo.
La RNMmp ha demostrado ser fundamental tanto para la selección inicial como para la vigilancia de pacientes. Mejora la detección de tumores clínicamente significativos y reduce biopsias innecesarias. Los biomarcadores genómicos como Decipher, Oncotype DX, Prolarisy pruebas como PHI, PCA3 o SelectMDx aportan valor pronóstico adicional. Aunque su uso rutinario aún es limitado por costos y acceso.
La decisión de abandonar la VA y optar por tratamiento activo suele basarse en progresión histológica (a ISUP 2 o superior), aumento sostenido del APE, hallazgos nuevos en imagen (como PI-RADS 4–5 en RNMmp), o preferencia del paciente. La progresión también puede definirse por volumen tumoral en biopsias o cambios en la densidad de APE. Diversos estudios han mostrado que una vigilancia bien estructurada permite detectar progresión en etapas aún curables, manteniendo tasas bajas de metástasis y mortalidad.
Aunque ampliamente respaldada, la implementación de VA enfrenta barreras como la falta de estandarización, variabilidad entre centros, ansiedad del paciente y desigual acceso a tecnologías de imagen y biomarcadores. Programas como PRIAS, GAP3 y G-MAJOR buscan generar evidencia robusta y guías de seguimiento personalizadas. El futuro de la VA apunta hacia un enfoque individualizado, basado en riesgo, calidad de vida y preferencias compartidas.
| Guía | Criterios de inclusión (riesgo bajo) | Criterios extendidos (intermedio favorable) | Protocolo de seguimiento |
| EAU 2025 | ISUP 1, APE <20 ng/ml, estadio ≤cT2, densidad APE <0.15, esperanza de vida >10 años | ISUP 2 con bajo % de patrón 4, sin cribiforme/intraductal, RNMmp y biopsia negativa de alto grado | APE cada 6 meses, DRE opcional anual, RNMmp según sospecha, biopsia cada 2–3 años o antes si hay cambios |
| NCCN 2025 | ISUP 1, APE <10 ng/ml, estadio T1-T2a, ≤2 cilindros positivos, <50% compromiso por cilindro, densidad APE <0.15 | ISUP 2 con <50% de patrón 4, sin otras características adversas; solo en casos seleccionados | APE cada 6 meses, DRE anual, biopsia al año y luego cada 2–3 años, RNMmp si hay sospecha clínica |
| AUA 2022 | ISUP 1, APE <10 ng/ml, estadio T1c-T2a, expectativa de vida >10 años | ISUP 2 con bajo volumen y sin hallazgos adversos; evaluación individualizada | APE cada 3–6 meses, DRE anual, biopsias cada 1–2 años o si hay cambios clínicos, RNMmp sugerida para guiar biopsias |
RADIOTERAPIA EN CÁNCER DE PRÓSTATA
Radioterapia Primaria Externa (EBRT)
La radioterapia externa moderna con técnicas altamente conformacionales guiadas por imágenes es recomendada para todos los grupos de riesgo de cáncer de próstata localizado o con compromiso ganglionar pélvico. Los esquemas de escalamiento de dosis utilizando distintos esquemas hipofraccionados han mostrado consistentemente mejor control de la enfermedad que esquemas con dosis menores utilizados previamente.
En relación con los volúmenes de tratamiento los pacientes con cáncer de próstata de bajo riesgo solo requieren tratamiento de la próstata sin incluir áreas nodales pélvicas. Aquellos pacientes con riesgo intermedio favorable pueden recibir radioterapia a la próstata y base de vesículas seminales, sin tratamiento de áreas nodales, mientras que aquellos con riesgo intermedio desfavorable pueden considerarse para tratamiento de las áreas nodales pélvicas en casos específicos. Finalmente, aquellos pacientes con cáncer de próstata de alto riesgo debieran considerarse el tratamiento de las áreas nodales pélvicas en forma profiláctica basándonos en un estudio randomizado reciente (171).
En cuanto al uso concomitante de bloqueo hormonal con radioterapia externa, este no está indicado en pacientes con cáncer de próstata de bajo riesgo, se recomienda su uso en pacientes de riesgo intermedio por 6 meses y en casos de cáncer de próstata de alto riesgo por 24 meses.
En los últimos años el gran desarrollo tecnológico con un salto en la calidad de las imágenes de los equipo de tratamiento y la disponibilidad de equipos de alta precisión a nivel mundial junto con las publicaciones de varios estudios randomizados especialmente en Europa ha demostrado en forma consistente que la gran mayoría de los pacientes con cáncer de próstata se puede tratar con esquemas de radioterapia hipofraccionada frecuentemente en 20 fracciones en 4 semanas como también con hipofraccionada extrema en solo 5 fracciones en 1 o 2 semanas con resultados similares a los de esquemas más prolongados pero con un gran ahorro en carga de tratamiento para el paciente y equipo de salud.
Braquiterapia primaria
La braquiterapia de baja dosis (LDR) como monoterapia está indicada para pacientes con cánceres de bajo riesgo y de bajo volumen tumoral. Los cánceres de riesgo intermedio pueden ser tratados mediante la combinación de LDR con EBRT (40-50 Gy) y 4 a 6 meses de hormonoterapia (NCCN). Los pacientes con una próstata muy grande o pequeña, con síntomas obstructivos o con una resección transuretral de la próstata previa son más difíciles de someter a implantes y pueden sufrir un mayor riesgo de efectos secundarios.
Más recientemente la Braquiterapia de alta tasa HDR exclusiva ha demostrado resultados equivalentes a los descritos con braquiterapia de baja tasa pero con menor toxicidad (Morton et al, 2021). Esta técnica es especialmente útil para la sobreimpresión posterior a radioterapia externa para pacientes recidivados, donde ha mostrado resultados oncológicos superiores a la radioterapia externa exclusiva.
Linfadenectomía de rescate en cáncer de próstata recidivado
La linfadenectomía de rescate surgió como una alternativa la década pasada, con la aparición de imágenes dirigidas al cáncer de próstata como el PET CT PSMA. Sin embargo, la evidencia disponible no es de calidad, aun debiendo ser considerada en contexto experimental. Hay algunos trabajos comparándola con la radioterapia a pelvis siendo los resultados favorables a la segunda. En una revisión sistemática de la literatura, Yang et al (172) revisó la efectividad de la LND de rescate contra RT a pelvis, en pacientes con recidiva bioquímica, con PET CT (+) en ganglios pelvianos. Se revisaron 2576 pacientes, (995 para LND y 1481 para RT). Demostró un mejor control bioquímico con RT (LND 53,8% vs RT 74,8%) y mortalidad cáncer específica (LND 6,5% vs RT 1,3%). También es de notar las toxicidades. La cirugía se complicó con linfoceles e íleo, mientras que la RT presentó hasta un 37% de toxicidad genitourinaria grado III. Es de notar una alta heterogeneidad en los estudios involucrados, la gran mayoría retrospectivos, con imágenes diferentes, esquemas de radioterapia diferentes, uso de hormonoterapia diferentes y seguimientos cortos. Las guías NCCN y EAU consideran que deben realizarse en pacientes seleccionados, idealmente con baja carga nodal y APE bajo al momento del tratamiento primario, e idealmente en contexto experimental.
PET-CT en Cáncer de Próstata:
La tomografía por emisión de positrones (PET) combinada con una tomografía axial computada (CT) es una técnica de medicina nuclear y radiológica no invasiva, que permite identificar focos hipercaptantes de un radiofármaco que se une a un ligando específico para el cual se diseñó. En cáncer de próstata, el fármaco que más utilidad presenta es el PSMA (Antígeno de membrana próstata específico), por su mayor sensibilidad y especificidad que otros más antiguos (p.e. Colina, Fluciclovina). Los últimos años, ha aumentado el cuerpo de evidencia de forma importante en su utilización e indicaciones.
La especificidad y sensibilidad que se reportaron en el metaanálisis de Jeet et al (2021), confirmados con anatomía patológica, son las siguientes (173):
Enfermedad localizada: Sensibilidad 71%, Especificidad 92%
Metástasis linfonodal: Sensibilidad 57%, Especificidad 96%
Recidiva bioquímica: Sensibilidad 84%, Especificidad 97%
En el contexto de diagnóstico inicial del cáncer de próstata y el PSMA, se debe tener en cuenta que sólo un 3,3% de los pacientes con cánceres de próstata clínicamente significativos son negativos para la captación de PSMA en el tejido prostático, en el estudio secundario del proPSMA (174). En el estudio PRIMARY(175), se vio el efecto aditivo de la RM y PET CT PSMA en el estudio de los primarios prostáticos previo a la biopsia prostática (no como etapificación). Sus hallazgos: 1) Agregando ambas técnicas, se sube el valor predictivo negativo (VPN) de un 72% (RM sola) a 91%. 2) Se observó que un 100% de los pacientes con lesiones PIRADS 4 y 5 en la RM y con captación con SUVmax >9, fueron diagnosticados con cánceres clínicamente significativos. 3) Se vio que a mayor SUVmax en la lesión biopsiada, mayor grado ISUP
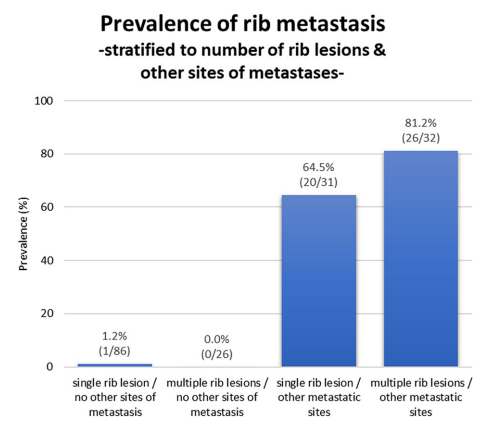 Un problema recurrente en la discusión de los casos clínicos son las lesiones costales que captan PSMA, es si estas son falsos positivos. De acuerdo al trabajo de Woo et al (176), si las lesiones son sólo costales, es muy poco probable que están sean positivas. En cambio, si hay lesiones en otros sitios (ganglios, otros huesos, etc) la lesión será probablemente positiva (ver figura). Otros predictores estadísticamente significativos en este estudio fueron: 1) Score PRIMARY, 2) APE>10ng/ml, 3) SUVmax >2.5 y 4) Presencia de esclerosis en el TAC.
Un problema recurrente en la discusión de los casos clínicos son las lesiones costales que captan PSMA, es si estas son falsos positivos. De acuerdo al trabajo de Woo et al (176), si las lesiones son sólo costales, es muy poco probable que están sean positivas. En cambio, si hay lesiones en otros sitios (ganglios, otros huesos, etc) la lesión será probablemente positiva (ver figura). Otros predictores estadísticamente significativos en este estudio fueron: 1) Score PRIMARY, 2) APE>10ng/ml, 3) SUVmax >2.5 y 4) Presencia de esclerosis en el TAC.
a) Indicaciones del PET-CT PSMA.
Si sumamos las indicaciones por guía clínica, según NCCN y EAU, las indicaciones de tomar el examen serían las siguientes.
- Recidiva bioquímica: Luego de prostatectomía radical, con APE entre 0,2 y 0,5 ng/ml, la sensibilidad del PET-CT PSMA para diagnosticar el foco de recidiva es de un 50-60%. Esta sube a un 85% con APE entre 0,5 y 2,0 ng/ml, y a un 100% con APE >2 ng/ml. A menor tiempo de doblaje de APE, mayor tasa de positividad tiene esta técnica. Además, sirve para la planificación de terapias de rescate locorregional en este contexto. También está aceptado su uso en recidiva bioquímica post radioterapia.
- Etapificación inicial en grupos “muy alto”, “alto” e “intermedio desfavorable”. Aquellos pacientes de estos grupos que sean elegibles a tratamiento curativo deberían ser etapificados con esta técnica, pues son los grupos que hay evidencia de que cambia la conducta en el estudio ProPSMA (177).
- Reetapificación por progresión de enfermedad metastásica, tanto en contexto hormonosensible como en cáncer resistente a castración.
- Diagnóstico y control en terapia con radioligandos PSMA. Sirve para evaluar captación tumoral para determinar elegibilidad y predecir respuesta a 177Lutecio-PSMA. Además, hay algunos trabajos que demuestran que sería útil para monitorizar e incluso predecir la respuesta al 223Radio en cáncer metastásico resistente a castración (mCRPC).
- Hallazgos equívocos en imágenes convencionales. Pacientes con Cintigrama óseo o TAC discordantes o ambiguos (p.e. Lesiones óseas al cintigrama, sin correlato tomográfico).
- Cáncer de próstata resistente a castración no metastásico (nmCRPC) en imágenes convencionales (alta sospecha de lesiones no visibles).
RECIDIVA BIOQUÍMICA (RBQ)
Recidiva bioquímica en cáncer de próstata operado.
Con el fin de tomar decisiones terapéuticas efectivas, la EAU clasifica la recidiva bioquímica post prostatectomía en bajo o alto riesgo. Es de notar que basta un criterio de alto riesgo para quedar en esa categoría.
| Bajo riesgo | Alto riesgo |
| PSADT > 1 año
Y ISUP 1 a 3 |
PSADT < 1 año
O ISUP 4-5 |
Definición: Luego de múltiples intentos de definición durante los 2000, el panel de guías clínicas de la AUA el año 2007 definió la recidiva bioquímica post prostatectomía radical en el umbral 0,2 ng/ml. Esto fue adoptado por las guías clínicas europeas en 2014. Las causas de alza de APE después de la cirugía, aparte de la recidiva de cáncer, incluyen la presencia de tejido prostático benigno en el lecho prostático. En este último caso, el alza va a ser muy lenta y sostenida, con un muy bajo riesgo de progresión (178). De acuerdo con series históricas, la recidiva bioquímica a 10 años se estima entre un 25% y un 41%. Esto empeora si se calcula para cánceres de próstata de alto riesgo operados, llegando hasta un 60% a 5 años (179). Factores de riesgo: En el análisis de los factores que mayor influyen en la progresión clínica son el APE pretratamiento, estadío clínico, score de Gleason y estadío patológico (129,180). En la pieza operatoria, los predictores más importantes son el score de Gleason, los márgenes quirúrgicos, invasión de vesículas seminales, presencia de metástasis linfonodales y extensión extraprostática. En el caso específico de los márgenes quirúrgicos, Budaus calculó que el margen quirúrgico positivo aumenta la probabilidad de recidiva entre un 12% a un 18% por sí solo. Además, observó que tiene menor probabilidad de recidiva bioquímica un Cáncer pT3 con márgenes negativos que un pT2 con márgenes positivos (181).
Manejo de la recidiva bioquímica post prostatectomía radical: Como en todo cáncer de próstata, para el tratamiento de esta, primero se debe calcular expectativa de vida. El predictor más sólido de mortalidad por recurrencia del cáncer es el tiempo de doblaje de antígeno (PSADT) menor a 10 meses, el cual ha probado ser un marcador de mal pronóstico. Otros menos sólidos son: a) recidiva precoz, b) Enfermedad ISUP 4-5, c) APE >2 ng/ml al inicio de la radioterapia de rescate, d) Compromiso de vesículas seminales pT3b, y e) Margen quirúrgico negativo en la pieza (182,183).
Estudio de la recidiva post prostatectomía. Luego de superado el umbral de 0,2 ng/ml, se recomienda reetapificación, idealmente con PET CT PSMA, en aquellos pacientes con más de 5 años de expectativa de vida. En este contexto, Sella et al encontraron importante utilidad a la RM con coil endorectal, con una sensibilidad de un 95% y una especificidad de un 100% para lesiones del lecho prostático (184). Todos los datos actuales parecen sugerir que los pacientes que irán a terapia de rescate se benefician del uso conjunto del PET CT y la RM para decidir su susceptibilidad a terapias locales.
Radioterapia Posterior a Prostatectomía
La evidencia respalda el ofrecimiento de RT de salvataje precoz para la mayoría de los hombres con APE detectable y en progresión posterior a prostatectomía, algunos pacientes con particulares características patológicas adversas y sin evidencia de enfermedad diseminada podrían ser considerados para RT adyuvante por sobre una estrategia de seguimiento y rescate precoz.
Estas indicaciones para la RT adyuvante incluyen enfermedad pT3, márgenes quirúrgicos positivos, puntaje de Gleason 8 a 10 o compromiso de vesículas seminales especialmente en pacientes jóvenes y sin comorbilidades relevantes (185,186). La RT adyuvante suele administrarse dentro del primer año de la cirugía y una vez que cualquier efecto quirúrgico secundario haya mejorado o se haya estabilizado.
Entre las indicaciones de RT de rescate se incluyen: un APE que se vuelve detectable y que aumenta en dos mediciones subsiguientes. Los esquemas actuales de rescate precoz no requieren alcanzar APE mayor a 0,2 ng/ml para indicar RT de rescate por lo que se sugiere derivación precoz a Radio-oncología para discutir mejor momento para programar el tratamiento y optimizar funcionalidad en caso necesario, ya que como se apreció en el estudio realizado por Sthephenson, iniciar la RT de salvataje, se asocia a una menor (187). A modo de referencia en los últimos estudios APE sobre 0,1 ng/ml en ascenso es valor suficiente para rescate precoz.
Las dosis clásicamente recomendadas para RT adyuvante o de salvataje posterior a prostatectomía fueron de 64-72 Gy (188).Sin embargo, de manera análoga al tratamiento de próstata primario, numerosos estudios recientes han demostrado que los resultados son equivalentes con esquemas de hipofraccionamiento moderado utilizando tecnología actual. Entre estos esquemas 51 Gy en 17 fracciones es efectivo y con baja toxicidad como hemos publicado recientemente (189).
Recientemente 2 estudios randomizados publicados han demostrado beneficios en sobrevida al agregar bloqueo hormonal a la radioterapia de rescate. Los análisis de subgrupo muestran que este beneficio se concentra en aquellos con valores de antígeno mayor por lo que es importante discutir con el paciente los beneficios y efectos adversos de agregar este tratamiento (190,191).
Recidiva bioquímica después de radioterapia primaria.
Con el fin de tomar decisiones terapéuticas efectivas, la EAU clasifica la recidiva bioquímica post radioterapia primaria en bajo o alto riesgo.
| Bajo riesgo | Alto riesgo |
| Intervalo a RBQ <18 meses
Y ISUP 1 a 3 |
Intervalo a RBQ <18 meses
O ISUP 4-5 |
Uno de los problemas luego de la radioterapia es que hay tejido remanente que es capaz de producir APE, dificultando su interpretación. Por esto, la ASTRO y RTOG hicieron un consenso el 2005, lo que hoy llamamos “criterios de Phoenix”. Este es el alza de 2 ng/ml sobre el nadir alcanzado luego de la RT primaria (192). Este criterio ha probado ser efectivo para definir presencia de tumor viable que precede a la progresión metastásica y la muerte por cáncer de próstata.
En pacientes no seleccionados – previo a la era de los bloqueos de segunda línea – el tiempo medio hasta el desarrollo de metástasis es de ocho años, y desde metástasis hasta la muerte, cinco años adicionales. En pacientes con RBQ de bajo riesgo según EAU, aquellos no aptos para tratamiento o con esperanza de vida <10 años, o que rechazan tratamiento, la observación puede ser una buena alternativa.
Las recomendaciones en guías clínicas, una vez tomada la decisión de tratar, es biopsiar la próstata, pues la presencia de cáncer comanda la decisión del tratamiento. Se ha visto que, en este contexto, la RM y el PET CT PSMA pueden tener un rol importante. Si estas imágenes concuerdan, hay una alta probabilidad de que la biopsia confirme el hallazgo (193).
Otro problema que puede surgir durante el seguimiento de la radioterapia primaria, es el “rebote de APE”. Este es el alza de APE, habitualmente de 0,1 a 0,5 ng/ml sobre el APE pre rebote, para luego descender a su basal, cuya causa se cree ser prostatitis focales luego de la terapia (194). Se vio que los pacientes que sufren rebote tienen menor tasa de recidiva bioquímica post radioterapia (195).
La decisión de tratar o no, al igual que en la RBQ post prostatectomía, depende de la expectativa de vida del paciente. Si el paciente a tratar tiene expectativa de vida (idealmente mayor a 10 años), se recomienda reetapificación con PET CT PSMA y además etapificar localmente con RM para luego tomar biopsias dirigidas para confirmar la presencia de cáncer viable. La terapia local está indicada cuando hay confirmación histológica y la etapificación muestra enfermedad no metastásica.
Prostatectomía radical de rescate. Las series iniciales de esta modalidad informaban alta morbilidad asociada al procedimiento. Series históricas informaba 50% de complicaciones mayores (lesiones rectales hasta 15%, estrechez de cuello vesical hasta 28%). Además, incontinencia de 40 a 60%, con 100% de disfunción eréctil severa. En series modernas, con cirugía robótica y abierta, el metanálisis de Marra (196) informa complicaciones de un 19% con 65% de continencia 0/1 pads al día. Este mismo estudio informó SV libre de recurrencia sólo un 57%. Las guías EAU preconizan que los candidatos deben cumplir: 1) Bajas comorbilidades con expectativa de vida >10 años, 2) APE <10 ng/ml, 3) Biopsia ISUP 3 o menor, 4) Reetapificación N0M0 y 5) Enfermedad inicial T1 o T2. Aquellos pacientes que tienen estos criterios, tienen las mejores probabilidades de SV libre de recurrencia a 5 años, de un 55% (197).
Braquiterapia de rescate. En paciente seleccionados, aptos para recibir esta modalidad, tanto en alta (HDR-BT) o baja tasa (LDR-BT) las sobrevidas libres de recurrencia a 5 años se reportan entre 45 a 63%. Un estudio pequeño de 119 pacientes, comparando ambas técnicas, reportó SV libre de recurrencia de 71%, con toxicidad genitourinaria grado 3 o más, de un 23% (198).
Radioterapia estereotáxica (SBRT). La data reciente reporta bajas morbilidades, con bajas tasas de toxicidad grado ≥3. El metaanálisis de Meng et al combinó 36 estudios, reportando SV libre de recurrencia a 5 años de un 40,6%, con toxicidad GU ≥3 de un 5,8%. Otro hallazgo interesante de este estudio, es que la TDA no agrega mayor beneficio oncológico en SBRT para el cáncer radiorecurrente (199).
Crioterapia de rescate. En pacientes seleccionados, la crioterapia puede ser una buena opción de manejo del cáncer radiorecurrente. En el metaanálisis de Zhu et al de 36 estudios con 1593 pacientes, se reporta una SV libre de recurrencia a 5 años de un 47,3%. Entre los hallazgos relevantes, se sugiere que en pacientes con reinicio tardío (intervalo RT a Crioterapia >70 meses), APE <5 ng/ml y Crioterapia de glándula completa con ADT peri‑salvataje, el éxito oncológico mejora significativamente. Toxicidad ≥3: 8,9%, con fístulas en un 1,1% de los pacientes tratados (200).
HIFU de rescate post RT. Esta modalidad se ha estudiado como tratamiento del cáncer radiorecurrente. En la revisión sistemática de Yang et al se reporta una SV libre de recurrencia de un 52,7%, pero con alta tasa de morbilidad genitourinaria, de un 22,7% (incluyendo fístulas rectouretrales) (201).
Cáncer de próstata localmente avanzado
La definición de “cáncer de próstata localmente avanzado” se presta para confusión por su ambigüedad. Para simplificar, resumido en la literatura, suma los estadío III (T3-4N0M0) y IVa (T1-4N1M0). Las guías EAU informan de una falta de evidencia en el manejo en este estadío, teniendo la opción de radioterapia el mayor nivel de evidencia en estos estadíos de enfermedad.
La historia natural de los cánceres localmente avanzados fue estudiado por Johansson et al (202). Este investigador realizó seguimiento de los cánceres clínicamente localizados, T1 a T4. Los pacientes con tumores localmente avanzados, T3-T4, tuvieron una sobrevida cáncer específica corregida a 15 años de un 57%. Lu-Yao et al (203), demuestra que los pacientes que padecen cánceres de alto riesgo, incluyendo localmente avanzados, tienen altas probabilidades de progresión y mortalidad cáncer-específica si se dejan a su evolución sin tratamiento. Debemos siempre recordar, que toda esta data proviene de series antiguas, con seguimientos incluso de la era pre-APE, más aún pre RM de próstata y PET CT PSMA. Se verá a años más adelante el efecto de migración de estadío con estas últimas técnicas.
En cuanto al manejo de los cánceres localmente avanzados, separaremos los pacientes que padecen T3-T4 de aquellos que tiene ganglios positivos (N+).
Pacientes T3-T4N0M0: Tanto las guías EAU como NCCN, recomiendan RT + HT por 2 a 3 años para pacientes en este estadío. Se recomienda además considerar un boost con braquiterapia si la función urinaria lo permite. Las guías NCCN además recomiendan agregar abiraterona por 2 años si el paciente tiene 2 o más factores de riesgo (Tumores T3-T4, Gleason ≥8 y APE >40 ng/ml), esto en base al brazo G del STAMPEDE. La Prostatectomía radical ha disminuido los últimos años en este grupo de pacientes, porque se ha reconocido que está sola es insuficiente para tratar un cáncer locamente avanzado, sin embargo, actualmente está en curso el estudio SCPG-15 en países escandinavos, que comparará los resultados en pacientes con cáncer T3N0M0, tratados con prostatectomía con o sin RT posterior, vs RT+HT. En este contexto de pacientes, Van den Ouden et al (204) demostró una RBQ mayor al 60% a 5 años en tumores T3 operados. Una serie antigua de la clínica Mayo demostró que tumores supuestamente T3 operados, a la biopsia había un sobre etapificación de un 27% (205). Probablemente esta cifra, con las herramientas actuales (RM y el PET-CT PSMA), sería mucho menor hoy.
Pacientes N+: Las guías EAU y NCCN, concuerdan el que el tratamiento standard del cáncer N+ es la RT a próstata y pelvis + HT combinada (TDA+Abiraterona) en aquellos pacientes de riesgo por criterios STAMPEDE (Tumores T3-T4, Gleason ≥8 y APE >40 ng/ml). Las guías EAU agregan como opción la prostatectomía radical + linfadenectomía extendida en pacientes con tumor resecable y expectativa de vida >10 años, o como parte de un tratamiento multimodal. En pacientes sintomáticos con pobre expectativa de vida o en performance status no óptimo, también se puede ofrecer TDA como monoterapia. En pacientes N1M0 asintomáticos con expectativa de vida baja (<5 años) también una opción válida es la observación.
Terapias sistémicas para el cáncer de próstata
Desde Huggins y Hodges, es conocida la importancia de la deprivación androgénica (terapias hormonales) en el manejo del cáncer de próstata avanzado. Esta sigue siendo la piedra angular en el tratamiento del cáncer de próstata metastásico, sin embargo, este trae múltiples efectos colaterales (ver capítulo de terapias sistémicas para cánceres urológicos).
La clasificación de las terapias sistémicas que proponen las guías EAU es la siguiente:
-
- Terapias hormonales
- Orquiectomía bilateral
- Agonistas LHRH
- Antagonistas LHRH
- Antiandrógenos
- Esteroidales (Ciproterona)
- No esteroidales
- Primera y segunda generación (Flutamida, Bicalutamida)
- Tercera generación (Apalutamida, Enzalutamida, Darolutamida)
- Inhibidores de la vía de receptores de andrógenos (ARPI)
- Terapias hormonales
- Inhibidores de síntesis de andrógenos (Abiraterona)
- Bloqueadores de receptores de andrógenos de tercera generación (Apalutamida, Enzalutamida, Darolutamida, entre otros)
- Terapias citotóxicas
- Taxanos
- Tratamientos no-hormonales no-citotóxicos
- Inhibidores PARP (Polimerasa poli-(ADP-ribosa))
- Inhibidores de checkpoint inmunes
- Radiofármacos
- Terapias citotóxicas
La terapia de deprivación androgénica se define como cualquier tratamiento que reduce la capacidad de los andrógenos de activar el receptor de andrógenos. Dentro de las formas de TDA está la castración que puede ser quirúrgica (orquiectomía bilateral, tanto total como sub albugínea) o médica (supresión de LH con agonistas LHRH o antagonistas GnRH) siendo ambas igualmente efectivas.
El nivel de castración se mide con niveles de testosterona total plasmáticos. En nivel deseable antiguamente se aceptaba como <50 ng/dL, sin embargo, se ha visto que un mejor predictor para medir sensibilidad a castración es de <20 ng/dL. Por otro lado, el nivel <50 ng/dL sigue siendo el nivel de castración para estudios clínicos y agencias gubernamentales.
La TDA se puede administrar de forma continua o intermitente. Hussein et al (206) demostró que la hormonoterapia continua es superior a la intermitente en pacientes con CaP metastásico. Sin embargo, en el subgrupo de pacientes con enfermedad metastásica extensa la hormonoterapia intermitente no fue inferior a la terapia continua. En estos estudios el protocolo para terapia intermitente consiste que una vez que el APE se encuentra bajo 4 y no hay progresión clínica luego de 6-9 meses de tratamiento, se suspende la TDA. En caso de que el APE se eleve sobre 15-20 o se evidencia progresión clínica, se reinicia TDA.
Inicialmente, el uso de agonistas LHRH (Goserelina, triptorelina, leuprolide) pueden producir un alza en los niveles de testosterona. En pacientes con metástasis de alta carga o en ubicación de riesgo (huesos que soportan peso o una gran masa prostática) esto puede producir eventos esqueléticos o urinarios con consecuencias importantes para el paciente, por lo que las guías NCCN recomiendan el uso de antiandrógenos asociados, como bicalutamida o flutamida, por 7 o más días al inicio de la terapia.
Cáncer de próstata metastásico
El cáncer de próstata metastásico, por su historia natural, inicialmente es hormonosensible para luego finalmente evolucionar a la refractariedad a la castración. Operativamente separaremos ambos por sus manejos completamente distintos.
CaP hormonosensible (CPHS)
Las metástasis en CaP pueden estar al diagnóstico (sincrónico) o puede desarrollarse durante la evolución de la enfermedad (metacrónico). De acuerdo con el estudio CHAARTED (207) la carga de enfermedad metastásica es muy importante. Con imágenes convencionales, se clasificó en “Baja carga” aquellos pacientes con 3 o menos lesiones metastásicas con ausencia de metástasis viscerales. “Alta carga” son aquellos que tienen ≥4 lesiones metastásicas óseas, con una fuera del esqueleto axial o con lesiones viscerales. Es importante recalcar que toda la evidencia que se expondrá a continuación es en base a imágenes convencionales. El resultado del manejo con nuevas imágenes – como el PET CT PSMA – es desconocido al momento con evidencia prospectiva.
De acuerdo a la última evidencia, ya no es aceptable tratar un CPHSm con TDA sola, excepto en casos de contraindicación o falta de cobertura de la droga.
A continuación, se expondrán las distintas terapias disponibles y los estudios que la validaron. Siglas a usar: SVG=Sobrevida global, SVLR=Sobrevida libre de recurrencia. SVLPb=Sobrevida libre de progresión bioquímica, SVLPr=Sobrevida libre de progresión radiológica. La tendencia actual es clasificar las terapias en dobletes (TDA + otra droga) o tripletes (TDA + 2 drogas).
Doble terapia CPHSm
- CHAARTED (207): 790 pacientes, CPHSm gran parte de alta carga, expuestos a TDA+Docetaxel vs TDA sola. Favorece la rama tratamiento sólo en alta carga, con beneficio en SV global (HR=0,61), SVLPb y SVLPr.
- GETUG-AFU (208): 15.385 pacientes, CPHSm, expuestos a TDA+Docetaxel vs TDA sola. SVG sin diferencias entre los grupos. Beneficio sólo en SVLPb (HR=0,73 p=0,014) y SVLPr (HR=0,75 p=0,03)
- LATITUDE (209): 1199 pacientes, CPHSm con Gleason ≥8, ≥3 lesiones óseas o lesiones viscerales, expuestos a TDA+Abiraterona+prednisona vs TDA + placebo. Beneficios en SVG (HR=0,62 p<0,01) y SVLPr (HR=0,47 p<0,001).
- STAMPEDE (brazo C) (210): 52% de los pacientes CPHSm, 15% N+ y 28% N0M0. 1184 pacientes a TDA, 592 pacientes a TDA+Docetaxel. Beneficio en SVG HR=0,78 p=0,006. Separando pacientes metastásicos, beneficio en SVG: HR=0,76 p=0,05.
- STAMPEDE (brazo G) (211): 1917 pacientes: 52%mHSPC, 20% N+ y 28% N0M0. Expuestos a TDA + Abiraterona(+prednisona) vs TDA sola. Favorece rama de tratamiento con HR=0,62 (p<0,001). SV global a 3 años 83% vs 76%. SV libre de progresión HR=0,29.
- ARCHES (212). 2019: 1150 pacientes con CPHSm, 62% de alta carga, expuestos a TDA+Enzalutamida vs TDA+placebo. Se permitió el uso de hasta 6 ciclos de docetaxel previo que tuvo un uso de 18% en cada rama. Objetivo primario: SVLPr por criterios RECIST 1.1 y PCWG2. Se favoreció rama de tratamiento en SVLPr HR=0,39 p<0,001. ARCHES 2022: Es una actualización para análisis de SVG. Favorece TDA+Enza con un HR=0,66. SVG a 48 meses: 70,6% (TDA+Enza) vs 57,0% (TDA+placebo).
- ENZAMET (213,214): 1125 pacientes con CPHSm, 50% de alta carga y 40% metacrónicos, expuestos a TDA+Enzalutamida vs TDA+Antiandrógenos. Se permitió el uso de docetaxel concurrente, máximo 6 ciclos. SVG HR 0,67. A 5 años: SVG 67% vs 57%. Beneficios en baja y alta carga metastásica. Uso de docetaxel en ambas ramas con un 43% cada una.
- TITAN (215): 1052 pacientes con CPHSm, 61% de alta carga. TDA+Apalutamida vs TDA+placebo. Docetaxel previo en 11% y 10,4% respectivamente. Beneficio a rama de TDA+Apalutamida en SVG (HR 0,67) y en rPFS (HR 0,48).
Triple terapia en CPHSm
- PEACE-1 (216): 1173 pacientes con CPHSm (63% alta carga), 4 ramas de tratamiento: 1) ADT ± docetaxel (estándar), 2) ADT ± docetaxel + radioterapia, 3) ADT ± docetaxel + abiraterona y 4) ADT ± docetaxel + abiraterona + radioterapia. Mejora significativamente la SVLPr y la SVG, especialmente en pacientes con enfermedad de alta carga. Fue el primer estudio que validó la triple terapia, sobre todo en enfermedad de alta carga. No se alcanzó mediana de sobrevida. Si hubo beneficio en SVLPr HR=0,5, p=0,017.
- ARASENS (217): 1306 pacientes portadores de CPHSm, randomizados a ADT+Docetaxel+Darolutamida vs TDA+Docetaxel+Placebo. Beneficios en SVG con un HR=0,68 p<0,001. Aparte se vio beneficio en tiempo a resistencia a castración, progresión del dolor, eventos esqueléticos e inicio de otra terapia sistémica.
Agregado a estos trabajos, estos últimos años se realizaron algunos metanálisis que confirman los hallazgos de los trabajos individuales.
- Hoeh et al (218): este concluye que en CPHSm de alta carga, el triplete de TDA+Docetaxel+Darolutamida aporta el mayor beneficio (p score 0,92) seguido por TDA+Docetaxel+Abiraterona (p score 0,85).
- Matsukawa et al (219): probó en otro metanálisis en red que la terapia triple mejora la supervivencia global en pacientes CPHSm, en comparación con la terapia doble basada en docetaxel, independientemente del volumen de la enfermedad. Sin embargo, según el ranking de tratamientos, la terapia triple debería considerarse preferentemente para pacientes con CPHSm de alta carga, mientras que aquellos con enfermedad de baja carga probablemente podrían ser tratados adecuadamente con TDA+ARPI
- Zhou et al (220): también realizó un metanálisis en red, pero con pacientes mayores de 70 años. En este, sugiere que aún en esta población, la terapia triple con Darolutamida+Docetaxel+TDA tiene el mayor beneficio teórico (p score 0,90)
La conclusión de todos estos trabajos es que se debe diferenciar a los pacientes hormonosensibles en baja o alta carga, pues tienen diferentes beneficios con distintos esquemas. Podríamos resumir de la siguiente manera:
- Cáncer de próstata hormonosensible de alta carga metastásica: Tripletes
- TDA + Docetaxel + ARPI:
- Abiraterona (PEACE-1) (categoría 1)
- Darolutamida (ARASENS) (categoría 1)
- Apalutamida y Enzalutamida (categoría 2B)
- En pacientes no aptos para QT, se puede indicar TDA + ARPI
- TDA + Docetaxel + ARPI:
- Cáncer de próstata hormonosensible de baja carga metastásica
- TDA + ARPI
- Abiraterona (LATITUDE, STAMPEDE-G)
- Enzalutamida (ARCHES, ENZAMET)
- Apalutamida (TITAN)
- TDA + ARPI
Cáncer de próstata resistente a castración (CPRC)
La resistencia a castración se define como la presencia de progresión de enfermedad (imágenes, clínica o bioquímica) con niveles de testosterona total en plasma en rango de castración (<50 ng/dL o idealmente <20 ng/dL). Se considera aún como la última fase de la enfermedad, precediendo la falla a los tratamientos sistémicos y la mortalidad por cáncer de próstata. Es importante recordar que a pesar de que algunos clones ya no responden a la castración, otros sí lo hacen, por lo que se debe mantener la TDA de todos modos, aún recibiendo otras terapias para el CaP. Todos los pacientes recién diagnosticados con un CPRC deben ser reetapificados, con imágenes convencionales (TAC + Cintigrama) que todos los estudios pivotales usaron estas para toma de decisiones. Se reconoce, eso sí, tanto en las guías NCCN como EAU, que el PET CT PSMA es más sensible y que puede transformar pacientes M0 en M1, aunque se desconoce aún el efecto que esto puede causar en el manejo de pacientes en evidencia prospectiva. Otra consideración muy importante en la población resistente a castración, es medir el tiempo de doblaje de APE (tdAPE). Este ha sido reconocido como uno de los mejores predictores del pronóstico de los pacientes CPRC (221).
Cáncer de próstata resistente a castración no metastásico (CPRCnm)
Todas las guías clínicas coinciden que el tratamiento del CPRCnm debe considerar doble bloqueo hormonal, es decir, TDA + ARPI (Apalutamida, Darolutamida o Enzalutamida), en pacientes con tdAPE < 10 meses. En pacientes con tdAPE > 10 meses, expectativa de vida limitada, o asintomáticos, la TDA sola, o incluso la observación, son opciones razonables. Otros factores de menor poder predictor son el nivel de APE basal y la velocidad de APE. El consenso RADAR – PCa Radiographic Assessments for Detection of Advanced Recurrence (222) – sugiere la evaluación con TAC y Cintigrama cuando el APE alcanza los 2 ng/ml, y de estar negativo, repetir el estudio cuando el APE llega a 5 ng/ml, y así repetir con cada doblaje de APE, con testeo de APE cada 3 meses, manteniedo terapia mientras el paciente esté asintomático. Hay 3 trabajos prospectivos pivotales en el contexto del CPRCnm:
- PROSPER (223): 1401 pacientes con CPRCnm y tdAPE <10 meses, expuestos a TDA+Enzalutamida vs TDA+placebo. Favorece rama de tratamiento con un HR para metástasis o muerte de 0,29 con un p<0,0001.
- SPARTAN (224): 1207 pacientes con CPRCnm y tdAPE <10 meses, tratados con TDA+Apalutamida vs TDA+placebo. Favorece rama de tratamiento con un HR para metástasis o muerte de 0,28, p<0,0001
- ARAMIS (225): 1509 pacientes con CPRCnm y tdAPE <10 meses, tratados con TDA+Darolutamida vs TDA+placebo. Favorece a Darolutamida con un HR para metástasis o muerte de 0,41 p<0,001.
En conclusión, a estos tres estudios pivotales, podemos aseverar que se debiese tratar con TDA+ARPI a pacientes portadores de CPRCnm de alto riesgo de acuerdo a evidencia de alto nivel.
Cáncer de próstata refractario a castración metastásico (CPRCm)
Tanto las guías europeas, como NCCN y AUA recomiendan mantener la TDA durante el manejo del cáncer refractario a castración, a pesar del modesto beneficio que puede recibir el paciente con este tratamiento, pues se mantiene suprimidos los clones aún sensibles a castración.
Las terapias de primera línea para el tratamiento del CPRCm tipo adenocarcinoma (idealmente confirmado por biopsia), depende del contexto en el que fue diagnosticado (pasó de CPRCnm a CPRCm, o pasó de CPHSm a CPRCm) y por lo tanto, de las exposiciones previas a Quimioterapia y/o ARPIs. A continuación, de acuerdo con guías NCCN, se muestran las primeras alternativas terapéuticas a cada contexto diagnóstico:
- Virgen a QT o ARPI: Abiraterona (COU-AA-302), Docetaxel (SWOG 99-16 y TAX-327), Enzalutamida (PREVAIL y TERRAIN)
- QT previa, virgen a ARPI: Abiraterona (COUA-AA-301), Cabazitaxel (TROPIC y CARD), Enzalutamida (AFFIRM)
- ARPI previo, virgen a QT: Docetaxel. Si hay BRCA+: Inhibidor PARP (Olaparib o Rucaparib)
- Exposición a ARPI y QT previa: Cabazitaxel o rechallenge de Docetaxel
Hay otras drogas, también probadas en CPRCm, cuyo orden en secuencia se desconoce, por ejemplo:
- Sipuleucel-T (IMPACT(226)), para pacientes CPRCm, primera línea.
- Olaparib (PROfound (102)), pacientes CPRCm post ARPI, con BRCA1/2 o ATM.
- Rucaparib (TRITON3 (227)), para pacientes CPRCm con BRCA mutado.
- Talazoparib+Enzalutamida (TALAPRO-2 (228)), para pacientes con HRR mutado sin QT o ARPI previo)
- Niraparib+Abiraterona (MAGNITUDE (229)), para pacientes BRCA1/2 mutado.
- Olaparib+abiraterona (PROpel (229)), para pacientes BRCA1/2 mutado.
- Pembrolizumab (KEYNOTE (230)) , MSI-H/dMMR mutados.
Así, el panorama de tratamiento del CPRCm está cambiando año a año producto de las múltiples drogas en ensayos clínicos en curso actualmente. A continuación, las drogas más utilizadas en este tipo de cáncer hoy.
- Abiraterona. Esta droga fue testeada el trial COU-AA-302 (231). 1088 pacientes, vírgenes a quimioterapia, sin metástasis viscerales, sintomáticos leve o asintomáticos, expuestos a Abiraterona+prednisona+TDA convencional vs Placebo+prednisona+TDA. Outcomes: SVG y SVLPr. En el análisis final, publicado por Ryan et al (2015), con seguimiento de 49 meses, la mediana de SVG entre ambos grupos tuvo diferencias significativas (34,7 vs 30,3 meses, HR=0,81, p=0,0033). Otro subanálisis también tuvo diferencias positivas en pacientes mayores a 75 años. En el contexto post Quimioterapia, se probó en el COU-AA-301 (232): 1195 pacientes post-docetaxel. Beneficio en SVG: 14,8 vs 10,9 meses (HR=0,65; p<0,0001). PSA50: 29% vs 6%.
- Enzalutamida. El estudio PREVAIL, fase III, comparó enzalutamida vs placebo. 1717 pacientes, vírgenes a QT, expuestos a TDA+Enzalutamida vs TDA+placebo. Se observaron diferencias significativas en SVG (HR=0,706 p<0,001) y SVLPr (HR=0,186, p<0,0001). PSA50 (baja de mayor del 50% del APE) se observó en un 78% de los pacientes. HTA y fatiga fueron los efectos colaterales más importantes en la rama tratamiento. Al igual que la abiraterona, también se observó beneficio y buena tolerancia en pacientes >75 años. Por otro lado, en pacientes con metástasis hepáticas no se observó beneficio de esta droga (212,233). Otro trabajo fase III fue el TERRAIN (234), que comparó enzalutamida vs bicalutamida (50 mg al día). Se observó beneficio importante en SVLP (15,7 vs 5,8 meses HR=0,44, p<0,0001).
- Docetaxel. Esta droga en el contexto CPRCm se soporta en dos estudios pivotales: El primero fue el SWOG 99-16 (235): 770 pacientes. Comparó Docetaxel+Estramustina+Dexametasona vs Mitoxantrona+Prednisona en mCRPC. Se observó beneficio en SVG: 17,5 vs 15,6 meses (HR=0,80; p=0,02).- TAX-327 (236): 1006 pacientes con CPRCm. Comparó Docetaxel(cada 3 semanas)+prednisona vs Docetaxel semanal+prednisona vs Mitoxantrona+Prednisona. Beneficio en SVG 18,9 meses (docetaxel cada 3 semanas) vs 16,5 (mitoxantrona) con un HR 0,76, p=0,009. Estableció a Docetaxel cada 3 semanas + prednisona como estándar de 1ra línea en CPRCm.
- Cabazitaxel. Esta se probó en segunda línea post Docetaxel en el estudio TROPIC (237). 755 pacientes post-docetaxel: cabazitaxel vs mitoxantrona. Beneficio en SVG: 15,1 vs 12,7 meses (HR=0,70; p<0,0001). Efectos: Neutropenia febril 8%; diarrea grado ≥3: 6%. Llevó a la aprobación de cabazitaxel como 2ª línea post-docetaxel. Luego, en contexto post Docetaxel y post ARPI, el estudio CARD probó en tercera línea. Ramas: Cabazitaxel vs segundo ARPI. Comprobó superioridad de Cabazitaxel con beneficio en SVG: 13,6 vs 11,0 meses (HR=0,64; p=0,008).
Aparte de todas estas drogas, en ciertos casos específicos, se recibe beneficio de otras terapias.
- Mutación BRCA (+): Los pacientes portadores de mutación BRCA, se benefician de recibir inhibidores PARP (Olaparib, Rucaparib, Talazoparib).
- Radiofármacos: En el contexto de trazadores diagnósticos-terapéuticos (“Theranostics”), los últimos años se ha innovado en este contexto. El Lutecio 177 (Lutetium-177 vipivotide tetraxetan, utiliza la afinidad del PSMA para unir el lutecio a la célula tumoral, dañando su ADN de forma definitiva. El estudio VISION (238), un estudio fase III, aleatorizó 831 pacientes con CPRCm previamente tratados con ARPI y Quimioterapia, con lesiones positivas al PET CT PSMA, a Lutecio-177-PSMA+ tratamiento standard vs Tratamiento standard solo. Demostró beneficio en SVG 15,4 vs 11,3 meses (HR 0,62 p<0,001) y SVLPr (HR 0,40 p<0,001).
- El Radio-223 se probó en el estudio ALSYMPCA (239). 921 pacientes, con metástasis óseas sintomáticas, sin enfermedad visceral ni adenopatías >3cm. Ramas de tratamiento: Radio-223 + tratamiento standard vs Placebo + tratamiento standard. Beneficio en SVG (HR 0,70) y eventos esqueléticos (HR=0,66). El estudio ERA-223 (240) observó al contrario, aumento de los eventos esqueléticos, debiendo ser detenido. Recientemente se publicó además los resultados preliminares del PEACE-3 (241), en terapia de primera línea para el CPRCm, que combina Radio-223 con enzalutamida y denosumab/ácido zoledrónico vs Enzalutamida sola, demostraron beneficio significativo en SVLPr (HR 0,69 P=0,0009), aunque con más fracturas en el grupo de combinación con radio-223. Al parecer hay beneficio en SVG, pero falta seguimiento para probarlo. Hay actualmente en curso, varios radiofármacos que se están probando en fase I o II: Actinio-225, Plomo-212, Astato211, Terbio-161, entre otros.
Genética en cáncer de próstata y nuevas drogas en CPRC
Las guías NCCN 2025 refuerzan la importancia del estudio genético en el manejo del cáncer de próstata, no solo para la estratificación del riesgo, sino también para orientar decisiones terapéuticas y brindar asesoría genética familiar. Se recomienda realizar estudio germinal multi génico en todos los pacientes con enfermedad metastásica (CPHSm y CPRCm), regional (N+), o localizada de alto o muy alto riesgo. Además, debe considerarse en pacientes con antecedentes familiares sugestivos de síndromes de predisposición hereditaria (como cáncer de próstata, mama, ovario, páncreas o colon), en tumores de aparición temprana (<60 años), y en casos con histología agresiva o infrecuente (ductal, intraductal, neuroendocrino).
El análisis germinal (hereditario) se realiza a partir de sangre o saliva y detecta mutaciones presentes en todas las células del cuerpo. Estas mutaciones son heredables, por lo que su identificación tiene implicancias clínicas tanto para el paciente como para sus familiares. Las guías NCCN recomiendan paneles que incluyan al menos los genes BRCA1, BRCA2, ATM, CHEK2, PALB2, HOXB13, MLH1, MSH2, MSH6 y PMS2, dado que las mutaciones en estos genes —especialmente los relacionados a reparación por recombinación homóloga (HRR)— se asocian con fenotipos tumorales más agresivos y con sensibilidad a inhibidores PARP o a quimioterapia con platinos. Todo testeo germinal debe estar indicado de asesoría genética antes y después de estos exámenes.
Además, se recomienda realizar análisis somático del tumor en todos los pacientes con enfermedad metastásica (debe obtenerse durante progresión bioquímica o radiológica, ya que su sensibilidad disminuye significativamente con APE indetectable). Este análisis busca mutaciones adquiridas no heredadas, presentes exclusivamente en el tumor, y puede realizarse sobre tejido tumoral (preferentemente de una metástasis) o bien a través de biopsia líquida (ctDNA) en sangre cuando no se dispone de tejido viable. Este estudio permite detectar alteraciones en genes de HRR, así como evaluar la presencia de inestabilidad microsatelital (MSI), deficiencia en reparación de desajustes del ADN (dMMR) y alta carga mutacional tumoral (TMB), todos estos con importancia en las terapias: por ejemplo, uso de olaparib, rucaparib o niraparib en casos con mutaciones en BRCA1/2 o PALB2, y pembrolizumab en tumores MSI-H o con TMB ≥10 mutaciones/Mb (carga mutacional tumoral, medida en mutaciones por megabase).
Salud ósea y efectos colaterales de la TDA
Este es un aspecto fundamental en el manejo del cáncer de próstata metastásico, especialmente en pacientes sometidos a TDA. Esta terapia, si bien efectiva en el control de la enfermedad, se asocia a una pérdida acelerada de masa ósea y a un incremento en el riesgo de fracturas. Por ello, las guías NCCN recomiendan evaluar a los pacientes mediante densitometría ósea (al diagnóstico, y después una vez cada 1 o 2 años) y herramientas como el score FRAX para estimar el riesgo de fractura. En todos los pacientes bajo TDA debe indicarse suplementación con calcio (1000–1200 mg/día) y vitamina D3 (hasta lograr niveles >30 ng/mL), junto con ejercicio con carga y modificaciones de estilo de vida (cesación tabáquica y control del alcohol). Cuando el riesgo de fractura es elevado, se aconseja iniciar tratamiento con agentes antirresortivos como denosumab o ácido zoledrónico. Estas terapias han demostrado reducir la pérdida ósea y prevenir fracturas clínicas en este grupo de pacientes. En caso de osteoporosis establecida, también pueden utilizarse bifosfonatos orales como alendronato semanal. Es fundamental realizar una evaluación dental previa al inicio del tratamiento, ya que existe riesgo de osteonecrosis mandibular, especialmente con terapias prolongadas o en presencia de intervenciones dentales.
En el contexto de CPRCm con metástasis óseas, el objetivo se amplía a prevenir eventos óseos graves (SRE), como fracturas en hueso patológico, compresión medular o necesidad de cirugía. En estos casos, se indica denosumab o ácido Zoledrónico en alta dosis, combinados con calcio y vitamina D (242,243). Además, en pacientes con metástasis óseas sintomáticas sin afectación visceral, el radiofármaco Radio-223 representa una opción válida, aunque su combinación con abiraterona requiere precaución por el riesgo aumentado de fracturas si no se incorpora terapia antirresortiva concomitante (240).
BIBLIOGRAFIA
1. Bray F, Laversanne M, Sung H, Ferlay J, Siegel RL, Soerjomataram I, et al. Global cancer statistics 2022: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA: A Cancer Journal for Clinicians. 2024;74(3): 229–263.
2. López JF, Fernández MI, Coz F. Mortalidad por cáncer de próstata en Chile: tendencias del período 1955-2019. Revista médica de Chile. 2022;150(10): 1370–1379.
3. Andahur E, Mercado A, Sánchez C. Cambia el color y el riesgo Nuevo escenario para el cáncer de próstata en Chile. Revista médica de Chile. 2019;147(9): 1159–1166.
4. Parra-Soto S, Petermann-Rocha F, Martínez-Sanguinetti MA, Leiva-Ordeñez AM, Troncoso-Pantoja C, Ulloa N, et al. Cáncer en Chile y en el mundo: una mirada actual y su futuro escenario epidemiológico. Revista médica de Chile. 2020;148(10): 1489–1495.
5. Hugosson J. Population-based Screening for Prostate Cancer: Is it Time? European Urology. 2025;87(3): 340–341.
6. Bell KJL, Del Mar C, Wright G, Dickinson J, Glasziou P. Prevalence of incidental prostate cancer: A systematic review of autopsy studies. International Journal of Cancer. 2015;137(7): 1749–1757.
7. Surveillance Research Program NCI. SEER*Explorer: An interactive website for SEER cancer statistics.
8. Siegel RL, Miller KD, Fuchs HE, Jemal A. Cancer statistics, 2022. CA: A Cancer Journal for Clinicians. 2022;72(1): 7–33.
9. Mahal BA, Alshalalfa M, Kensler KH, Chowdhury-Paulino I, Kantoff P, Mucci LA, et al. Racial Differences in Genomic Profiling of Prostate Cancer. New England Journal of Medicine. 2020;383(11): 1083–1085.
10. Dess RT, Hartman HE, Mahal BA, Soni PD, Jackson WC, Cooperberg MR, et al. Association of Black Race With Prostate Cancer–Specific and Other-Cause Mortality. JAMA Oncology. 2019;5(7): 975.
11. Sridhar G, Masho SW, Adera T, Ramakrishnan V, Roberts JD. Do African American Men Have Lower Survival From Prostate Cancer Compared With White Men? A Meta-analysis. American Journal of Men’s Health. 2010;4(3): 189–206.
12. Clements MB, Vertosick EA, Guerrios-Rivera L, De Hoedt AM, Hernandez J, Liss MA, et al. Defining the Impact of Family History on Detection of High-grade Prostate Cancer in a Large Multi-institutional Cohort. European Urology. 2022;82(2): 163–169.
13. Johns LE, Houlston RS. A systematic review and meta‐analysis of familial prostate cancer risk. BJU International. 2003;91(9): 789–794.
14. Bratt O, Drevin L, Akre O, Garmo H, Stattin P. Family History and Probability of Prostate Cancer, Differentiated by Risk Category: A Nationwide Population-Based Study. Journal of the National Cancer Institute. 2016;108(10): djw110.
15. Brook MN, Ní Raghallaigh H, Govindasami K, Dadaev T, Rageevakumar R, Keating D, et al. Family History of Prostate Cancer and Survival Outcomes in the UK Genetic Prostate Cancer Study. European Urology. 2023;83(3): 257–266.
16. Mucci LA, Hjelmborg JB, Harris JR, Czene K, Havelick DJ, Scheike T, et al. Familial Risk and Heritability of Cancer Among Twins in Nordic Countries. JAMA. 2016;315(1): 68.
17. Nicolosi P, Ledet E, Yang S, Michalski S, Freschi B, O’Leary E, et al. Prevalence of Germline Variants in Prostate Cancer and Implications for Current Genetic Testing Guidelines. JAMA Oncology. 2019;5(4): 523.
18. Dominguez-Valentin M, Sampson JR, Seppälä TT, ten Broeke SW, Plazzer JP, Nakken S, et al. Cancer risks by gene, age, and gender in 6350 carriers of pathogenic mismatch repair variants: findings from the Prospective Lynch Syndrome Database. Genetics in Medicine. 2020;22(1): 15–25.
19. Ehdaie B, Eastham JA, Zumsteg ZS, Zelefsky MJ, Nepple KG, Stephenson AJ, et al. Platinum Priority – Prostate Cancer Mortality After Prostate Cancer Treatment with Radical Prostatectomy , External-Beam Radiation Therapy , or Brachytherapy in Men Without Comorbidity. 2013;64: 372–378.
20. Siltari A, Lönnerbro R, Pang K, Shiranov K, Asiimwe A, Evans-Axelsson S, et al. How Well do Polygenic Risk Scores Identify Men at High Risk for Prostate Cancer? Systematic Review and Meta-Analysis. Clinical Genitourinary Cancer. 2023;21(2): 316.e1-316.e11.
21. Klein RJ, Vertosick E, Sjoberg D, Ulmert D, Rönn AC, Häggström C, et al. Prostate cancer polygenic risk score and prediction of lethal prostate cancer. npj Precision Oncology. 2022;6(1): 25.
22. EAU-ESUR-ESTRO-SIOG Guidelines on Prostate Cancer.
23. Parra-Soto S, Ahumada D, Petermann-Rocha F, Boonpoor J, Gallegos JL, Anderson J, et al. Association of meat, vegetarian, pescatarian and fish-poultry diets with risk of 19 cancer sites and all cancer: findings from the UK Biobank prospective cohort study and meta-analysis. BMC Medicine. 2022;20(1): 79.
24. Cheng S, Zheng Q, Ding G, Li G. Mediterranean dietary pattern and the risk of prostate cancer. Medicine. 2019;98(27): e16341.
25. Fu BC, Tabung FK, Pernar CH, Wang W, Gonzalez-Feliciano AG, Chowdhury-Paulino IM, et al. Insulinemic and Inflammatory Dietary Patterns and Risk of Prostate Cancer. European Urology. 2021;79(3): 405–412.
26. Langlais CS, Graff RE, Van Blarigan EL, Kenfield SA, Neuhaus J, Tabung FK, et al. Postdiagnostic Inflammatory, Hyperinsulinemic, and Insulin-Resistant Diets and Lifestyles and the Risk of Prostate Cancer Progression and Mortality. Cancer Epidemiology, Biomarkers & Prevention. 2022;31(9): 1760–1768.
27. Bergengren O, Pekala KR, Matsoukas K, Fainberg J, Mungovan SF, Bratt O, et al. 2022 Update on Prostate Cancer Epidemiology and Risk Factors-A Systematic Review. European urology. 2023;84(2): 191–206.
28. Nouri-Majd S, Salari-Moghaddam A, Aminianfar A, Larijani B, Esmaillzadeh A. Association Between Red and Processed Meat Consumption and Risk of Prostate Cancer: A Systematic Review and Meta-Analysis. Frontiers in Nutrition. 2022;9.
29. Zhang X, Chen X, Xu Y, Yang J, Du L, Li K, et al. Milk consumption and multiple health outcomes: umbrella review of systematic reviews and meta-analyses in humans. Nutrition & Metabolism. 2021;18(1): 7.
30. Benke IN, Leitzmann MF, Behrens G, Schmid D. Physical activity in relation to risk of prostate cancer: a systematic review and meta-analysis. Annals of Oncology. 2018;29(5): 1154–1179.
31. Cuthbertson CC, Nichols HB, Tan X, Kucharska-Newton A, Heiss G, Joshu CE, et al. Associations of Leisure-Time Physical Activity and Television Viewing with Life Expectancy Cancer-Free at Age 50: The ARIC Study. Cancer Epidemiology, Biomarkers & Prevention. 2020;29(12): 2617–2625.
32. MCTIERNAN A, FRIEDENREICH CM, KATZMARZYK PT, POWELL KE, MACKO R, BUCHNER D, et al. Physical Activity in Cancer Prevention and Survival: A Systematic Review. Medicine & Science in Sports & Exercise. 2019;51(6): 1252–1261.
33. Fang X, Wei J, He X, Lian J, Han D, An P, et al. Quantitative association between body mass index and the risk of cancer: a global Meta‐analysis of prospective cohort studies. International Journal of Cancer. 2018;143(7): 1595–1603.
34. Del Giudice F, Kasman AM, De Berardinis E, Busetto GM, Belladelli F, Eisenberg ML. Association between male infertility and male-specific malignancies: systematic review and meta-analysis of population-based retrospective cohort studies. Fertility and Sterility. 2020;114(5): 984–996.
35. Behboudi-Gandevani S, Bidhendi-Yarandi R, Panahi MH, Vaismoradi M. A Systematic Review and Meta-Analysis of Male Infertility and the Subsequent Risk of Cancer. Frontiers in Oncology. 2021;11.
36. Langston ME, Horn M, Khan S, Pakpahan R, Doering M, Dennis LK, et al. A Systematic Review and Meta-analysis of Associations between Clinical Prostatitis and Prostate Cancer: New Estimates Accounting for Detection Bias. Cancer Epidemiology, Biomarkers & Prevention. 2019;28(10): 1594–1603.
37. Zhong H, Liu S, Wang Y, Xu D, Li M, Zhao Y, et al. Primary Sjögren’s syndrome is associated with increased risk of malignancies besides lymphoma: A systematic review and meta-analysis. Autoimmunity Reviews. 2022;21(5): 103084.
38. Ge Y, Shi Q, Yao W, Cheng Y, Ma G. The association between inflammatory bowel disease and prostate cancer risk: a meta-analysis. Prostate Cancer and Prostatic Diseases. 2020;23(1): 53–58.
39. Ling S, Brown K, Miksza JK, Howells LM, Morrison A, Issa E, et al. Risk of cancer incidence and mortality associated with diabetes: A systematic review with trend analysis of 203 cohorts. Nutrition, Metabolism and Cardiovascular Diseases. 2021;31(1): 14–22.
40. Al-Fayez S, El-Metwally A. Cigarette smoking and prostate cancer: A systematic review and meta-analysis of prospective cohort studies. Tobacco Induced Diseases. 2023;21(February): 1–12.
41. Togawa K, Leon ME, Lebailly P, Beane Freeman LE, Nordby KC, Baldi I, et al. Cancer incidence in agricultural workers: Findings from an international consortium of agricultural cohort studies (AGRICOH). Environment International. 2021;157: 106825.
42. Onyije FM, Hosseini B, Togawa K, Schüz J, Olsson A. Cancer Incidence and Mortality among Petroleum Industry Workers and Residents Living in Oil Producing Communities: A Systematic Review and Meta-Analysis. International Journal of Environmental Research and Public Health. 2021;18(8): 4343.
43. Krstev S, Knutsson A. Occupational Risk Factors for Prostate Cancer: A Meta-analysis. Journal of Cancer Prevention. 2019;24(2): 91–111.
44. Haider A, Zitzmann M, Doros G, Isbarn H, Hammerer P, Yassin A. Incidence of Prostate Cancer in Hypogonadal Men Receiving Testosterone Therapy: Observations from 5-Year Median Followup of 3 Registries. Journal of Urology. 2015;193(1): 80–86.
45. Golla V, Kaplan AL. Testosterone Therapy on Active Surveillance and Following Definitive Treatment for Prostate Cancer. Current Urology Reports. 2017;18(7): 49.
46. Jian Z, Ye D, Chen Y, Li H, Wang K. Sexual Activity and Risk of Prostate Cancer: A Dose–Response Meta-Analysis. The Journal of Sexual Medicine. 2018;15(9): 1300–1309.
47. Crocetto F, Arcaniolo D, Napolitano L, Barone B, La Rocca R, Capece M, et al. Impact of Sexual Activity on the Risk of Male Genital Tumors: A Systematic Review of the Literature. International Journal of Environmental Research and Public Health. 2021;18(16): 8500.
48. Salmon C, Song L, Muir K, Pashayan N, Dunning AM, Batra J, et al. Marital status and prostate cancer incidence: a pooled analysis of 12 case–control studies from the PRACTICAL consortium. European Journal of Epidemiology. 2021;36(9): 913–925.
49. Wang L, Lei Y, Gao Y, Cui D, Tang Q, Li R, et al. Association of finasteride with prostate cancer. Medicine. 2020;99(15): e19486.
50. Andriole GL, Bostwick DG, Brawley OW, Gomella LG, Marberger M, Montorsi F, et al. Effect of Dutasteride on the Risk of Prostate Cancer. New England Journal of Medicine. 2010;362(13): 1192–1202.
51. Björnebo L, Nordström T, Discacciati A, Palsdottir T, Aly M, Grönberg H, et al. Association of 5α-Reductase Inhibitors With Prostate Cancer Mortality. JAMA Oncology. 2022;8(7): 1019.
52. Qiao Y, Yang T, Gan Y, Li W, Wang C, Gong Y, et al. Associations between aspirin use and the risk of cancers: a meta-analysis of observational studies. BMC Cancer. 2018;18(1): 288.
53. Shang Z, Wang X, Yan H, Cui B, Wang Q, Wu J, et al. Intake of Non-steroidal Anti-inflammatory Drugs and the Risk of Prostate Cancer: A Meta-Analysis. Frontiers in Oncology. 2018;8.
54. WHO Classification of Tumours Editorial Board, [ed.]. Urinary and Male Genital Tumours.. 5th Editio. Lyon, France: International Agency for Research on Cancer; 2022.
55. Ali A, Du Feu A, Oliveira P, Choudhury A, Bristow RG, Baena E. Prostate zones and cancer: lost in transition? Nature Reviews Urology. 2022;19(2): 101–115.
56. Gleason DF, Mellinger GT. Prediction of Prognosis for Prostatic Adenocarcinoma by Combined Histological Grading and Clinical Staging. Journal of Urology. 1974;111(1): 58–64.
57. Epstein JI, Allsbrook WC, Amin MB, Egevad LL. The 2005 International Society of Urological Pathology (ISUP) Consensus Conference on Gleason Grading of Prostatic Carcinoma. American Journal of Surgical Pathology. 2005;29(9): 1228–1242.
58. Epstein JI, Egevad L, Amin MB, Delahunt B, Srigley JR, Humphrey PA. The 2014 International Society of Urological Pathology (ISUP) Consensus Conference on Gleason Grading of Prostatic Carcinoma. American Journal of Surgical Pathology. 2016;40(2): 244–252.
59. Epstein JI, Egevad L, Humphrey PA, Montironi R. Best Practices Recommendations in the Application of Immunohistochemistry in the Prostate. American Journal of Surgical Pathology. 2014;38(8): e6–e19.
60. Ranasinha N, Omer A, Philippou Y, Harriss E, Davies L, Chow K, et al. Ductal adenocarcinoma of the prostate: A systematic review and meta‐analysis of incidence, presentation, prognosis, and management. BJUI Compass. 2021;2(1): 13–23.
61. Ayyathurai R, Gomez P, Luongo T, Soloway MS, Manoharan M. Prostatic involvement by urothelial carcinoma of the bladder: clinicopathological features and outcome after radical cystectomy. BJU International. 2007;100(5): 1021–1025.
62. Gofrit ON, Pode D, Pizov G, Zorn KC, Katz R, Shapiro A. Prostatic urothelial carcinoma: is transurethral prostatectomy necessary before bacillus Calmette‐Guérin immunotherapy? BJU International. 2009;103(7): 905–908.
63. Slovin SF. Neuroendocrine differentiation in prostate cancer: A sheep in wolf’s clothing? Nature Clinical Practice Urology. 2006;3(3): 138–144.
64. Samaratunga H, Delahunt B, Srigley JR, Yaxley J, Johannsen S, Coughlin G, et al. Mucinous adenocarcinoma of prostate and prostatic adenocarcinoma with mucinous components: a clinicopathological analysis of 143 cases. Histopathology. 2017;71(4): 641–647.
65. Yan Y. Intraindividual variation of prostate specific antigen measurement and implications for early detection of prostate carcinoma. Cancer. 2001;92(4): 776–780.
66. Merriel SWD, Pocock L, Gilbert E, Creavin S, Walter FM, Spencer A, et al. Systematic review and meta-analysis of the diagnostic accuracy of prostate-specific antigen (PSA) for the detection of prostate cancer in symptomatic patients. BMC Medicine. 2022;20(1): 54.
67. Schröder FH, Hugosson J, Roobol MJ, Tammela TLJ, Ciatto S, Nelen V, et al. Prostate-Cancer Mortality at 11 Years of Follow-up. New England Journal of Medicine. 2012;366(11): 981–990.
68. Roehrborn CG, Pickens GJ, Carmody T. Variability of repeated serum prostate-specific antigen (psa) measurements within less than 90 days in a well-defined patient population. Urology. 1996;47(1): 59–66.
69. Davik P, Elschot M, Frost Bathen T, Bertilsson H. Repeat Prostate-specific Antigen Testing Improves Risk-based Selection of Men for Prostate Biopsy After Magnetic Resonance Imaging. European Urology Open Science. 2024;65: 21–28.
70. Rosario DJ, Lane JA, Metcalfe C, Catto JW, Dedman D, Donovan JL, et al. Contribution of a Single Repeat PSA Test to Prostate Cancer Risk Assessment: Experience from the ProtecT Study. European Urology. 2008;53(4): 777–784.
71. Nordström T, Adolfsson J, Grönberg H, Eklund M. Repeat Prostate-Specific Antigen Tests Before Prostate Biopsy Decisions. Journal of the National Cancer Institute. 2016;108(12): djw165.
72. Gill N, Zouwail S, Joshi H. Prostate-Specific Antigen: a Review of Assay Techniques, Variability and Their Clinical Implications. BioNanoScience. 2018;8(2): 707–712.
73. Habib FK, Ross M, Tate R, Chisholm GD. Differential effect of finasteride on the tissue androgen concentrations in benign prostatic hyperplasia. Clinical Endocrinology. 1997;46(2): 137–144.
74. Keetch DW, Andriole GL, Ratliff TL, Catalona WJ. Comparison of percent free prostate-specific antigen levels in men with benign prostatic hyperplasia treated with finasteride, terazosin, or watchful waiting. Urology. 1997;50(6): 901–905.
75. Maggi M, Panebianco V, Mosca A, Salciccia S, Gentilucci A, Di Pierro G, et al. Prostate Imaging Reporting and Data System 3 Category Cases at Multiparametric Magnetic Resonance for Prostate Cancer: A Systematic Review and Meta-analysis. European Urology Focus. 2020;6(3): 463–478.
76. Yusim I, Krenawi M, Mazor E, Novack V, Mabjeesh NJ. The use of prostate specific antigen density to predict clinically significant prostate cancer. Scientific Reports. 2020;10(1): 20015.
77. Stephan C, Stroebel G, Heinau M, Lenz A, Roemer A, Lein M, et al. The ratio of prostate-specific antigen (PSA) to prostate volume (PSA density) as a parameter to improve the detection of prostate carcinoma in PSA values in the range of < 4 ng/mL. Cancer. 2005;104(5): 993–1003.
78. Roehrborn CG, Girman CJ, Rhodes T, Hanson KA, Collins GN, Sech SM, et al. Correlation between prostate size estimated by digital rectal examination and measured by transrectal ultrasound. Urology. 1997;49(4): 548–557.
79. Choe S, Patel HD, Lanzotti N, Okabe Y, Rac G, Shea SM, et al. MRI vs Transrectal Ultrasound to Estimate Prostate Volume and PSAD: Impact on Prostate Cancer Detection. Urology. 2023;171: 172–178.
80. de Vos II, Drost FJH, Bokhorst LP, Alberts AR, van Gelder M, Herman EM, et al. Prostate cancer risk assessment by the primary care physician and urologist: transabdominal- versus transrectal ultrasound prostate volume-based use of the Rotterdam Prostate Cancer Risk Calculator. Translational Andrology and Urology. 2023;12(2): 241–248.
81. Hamzaoui D, Montagne S, Granger B, Allera A, Ezziane M, Luzurier A, et al. Prostate volume prediction on MRI: tools, accuracy and variability. European Radiology. 2022;32(7): 4931–4941.
82. Catalona WJ, Partin AW, Slawin KM, Naughton CK, Brawer MK, Flanigan RC, et al. Percentage of free PSA in black versus white men for detection and staging of prostate cancer: a prospective multicenter clinical trial. Urology. 2000;55(3): 372–376.
83. Ström P, Nordström T, Aly M, Egevad L, Grönberg H, Eklund M. The Stockholm-3 Model for Prostate Cancer Detection: Algorithm Update, Biomarker Contribution, and Reflex Test Potential. European Urology. 2018;74(2): 204–210.
84. Carter HB. Longitudinal Evaluation of Prostate-Specific Antigen Levels in Men With and Without Prostate Disease. JAMA: The Journal of the American Medical Association. 1992;267(16): 2215.
85. Vickers AJ, Savage C, O’Brien MF, Lilja H. Systematic Review of Pretreatment Prostate-Specific Antigen Velocity and Doubling Time As Predictors for Prostate Cancer. Journal of Clinical Oncology. 2009;27(3): 398–403.
86. Wagaskar VG, Sobotka S, Ratnani P, Young J, Lantz A, Parekh S, et al. A <scp>4K</scp> score/ <scp>MRI</scp> ‐based nomogram for predicting prostate cancer, clinically significant prostate cancer, and unfavorable prostate cancer. Cancer Reports. 2021;4(4).
87. Bryant RJ, Sjoberg DD, Vickers AJ, Robinson MC, Kumar R, Marsden L, et al. Predicting High-Grade Cancer at Ten-Core Prostate Biopsy Using Four Kallikrein Markers Measured in Blood in the ProtecT Study. JNCI: Journal of the National Cancer Institute. 2015;107(7).
88. Nordström T, Vickers A, Assel M, Lilja H, Grönberg H, Eklund M. Comparison Between the Four-kallikrein Panel and Prostate Health Index for Predicting Prostate Cancer. European Urology. 2015;68(1): 139–146.
89. Stovsky M, Klein EA, Chait A, Manickam K, Stephenson AJ, Wagner M, et al. Clinical Validation of IsoPSATM, a Single Parameter, Structure Based Assay for Improved Detection of High Grade Prostate Cancer. Journal of Urology. 2019;201(6): 1115–1120.
90. Grönberg H, Eklund M, Picker W, Aly M, Jäderling F, Adolfsson J, et al. Prostate Cancer Diagnostics Using a Combination of the Stockholm3 Blood Test and Multiparametric Magnetic Resonance Imaging. European Urology. 2018;74(6): 722–728.
91. Morote J, Campistol M, Triquell M, Celma A, Regis L, de Torres I, et al. Improving the Early Detection of Clinically Significant Prostate Cancer in Men in the Challenging Prostate Imaging-Reporting and Data System 3 Category. European Urology Open Science. 2022;37: 38–44.
92. Ploussard G, de la Taille A. The role of prostate cancer antigen 3 (PCA3) in prostate cancer detection. Expert Review of Anticancer Therapy. 2018;18(10): 1013–1020.
93. Tosoian JJ, Zhang Y, Xiao L, Xie C, Samora NL, Niknafs YS, et al. Development and Validation of an 18-Gene Urine Test for High-Grade Prostate Cancer. JAMA Oncology. 2024;10(6): 726.
94. Van Neste L, Partin AW, Stewart GD, Epstein JI, Harrison DJ, Van Criekinge W. Risk score predicts high‐grade prostate cancer in DNA‐methylation positive, histopathologically negative biopsies. The Prostate. 2016;76(12): 1078–1087.
95. Legisi L, DeSa E, Qureshi MN. Use of the Prostate Core Mitomic Test in repeated biopsy decision-making: Real-world assessment of clinical utility in a multicenter patient population. American Health and Drug Benefits. 2016;9(9): 497–501.
96. Reid AHM, Attard G, Ambroisine L, Fisher G, Kovacs G, Brewer D, et al. Molecular characterisation of ERG, ETV1 and PTEN gene loci identifies patients at low and high risk of death from prostate cancer. British Journal of Cancer. 2010;102(4): 678–684.
97. Spratt DE, Yousefi K, Deheshi S, Ross AE, Den RB, Schaeffer EM, et al. Individual Patient-Level Meta-Analysis of the Performance of the Decipher Genomic Classifier in High-Risk Men After Prostatectomy to Predict Development of Metastatic Disease. Journal of Clinical Oncology. 2017;35(18): 1991–1998.
98. Shore N, Concepcion R, Saltzstein D, Lucia MS, van Breda A, Welbourn W, et al. Clinical utility of a biopsy-based cell cycle gene expression assay in localized prostate cancer. Current Medical Research and Opinion. 2014;30(4): 547–553.
99. Cullen J, Rosner IL, Brand TC, Zhang N, Tsiatis AC, Moncur J, et al. A Biopsy-based 17-gene Genomic Prostate Score Predicts Recurrence After Radical Prostatectomy and Adverse Surgical Pathology in a Racially Diverse Population of Men with Clinically Low- and Intermediate-risk Prostate Cancer. European Urology. 2015;68(1): 123–131.
100. Blume-Jensen P, Berman DM, Rimm DL, Shipitsin M, Putzi M, Nifong TP, et al. Development and Clinical Validation of an In Situ Biopsy-Based Multimarker Assay for Risk Stratification in Prostate Cancer. Clinical Cancer Research. 2015;21(11): 2591–2600.
101. Antonarakis ES, Lu C, Wang H, Luber B, Nakazawa M, Roeser JC, et al. AR-V7 and Resistance to Enzalutamide and Abiraterone in Prostate Cancer. New England Journal of Medicine. 2014;371(11): 1028–1038.
102. de Bono J, Mateo J, Fizazi K, Saad F, Shore N, Sandhu S, et al. Olaparib for Metastatic Castration-Resistant Prostate Cancer. New England Journal of Medicine. 2020;382(22): 2091–2102.
103. Rescigno P, Fenor de la Maza MD, Tovey H, Villacampa G, Cafferty F, Burnett S, et al. PERSEUS1: An Open-label, Investigator-initiated, Single arm, Phase 2 Trial Testing the Efficacy of Pembrolizumab in Patients with Metastatic Castration-resistant Prostate Cancer with Mismatch Repair Deficiency and Other Immune-sensitive Molecular Subtypes. European Urology Oncology. 2025;
104. Rescigno P, Porta N, Finneran L, Riisnaes R, Figueiredo I, Carreira S, et al. Capivasertib in combination with enzalutamide for metastatic castration resistant prostate cancer after docetaxel and abiraterone: Results from the randomized phase II RE-AKT trial. European Journal of Cancer. 2024;205: 114103.
105. Kim EH, Andriole GL. Prostate-specific antigen-based screening: controversy and guidelines. BMC medicine. 2015;13: 61.
106. Welch HG, Albertsen PC. Reconsidering Prostate Cancer Mortality – The Future of PSA Screening. The New England journal of medicine. 2020;382(16): 1557–1563.
107. Welch HG, Albertsen PC. Prostate cancer diagnosis and treatment after the introduction of prostate-specific antigen screening: 1986-2005. Journal of the National Cancer Institute. 2009;101(19): 1325–1329.
108. Andriole GL, Crawford ED, Grubb RL, Buys SS, Chia D, Church TR, et al. Mortality results from a randomized prostate-cancer screening trial. The New England journal of medicine. 2009;360(13): 1310–1319.
109. Schröder FH, Hugosson J, Roobol MJ, Tammela TLJ, Ciatto S, Nelen V, et al. Screening and prostate-cancer mortality in a randomized European study. The New England journal of medicine. 2009;360(13): 1320–1328.
110. Moyer VA, U.S. Preventive Services Task Force. Screening for prostate cancer: U.S. Preventive Services Task Force recommendation statement. Annals of internal medicine. 2012;157(2): 120–134.
111. Hugosson J, Roobol MJ, Månsson M, Tammela TLJ, Zappa M, Nelen V, et al. A 16-yr Follow-up of the European Randomized study of Screening for Prostate Cancer. European urology. 2019;76(1): 43–51.
112. Tosoian JJ, Mamawala M, Epstein JI, Landis P, Macura KJ, Simopoulos DN, et al. Active Surveillance of Grade Group 1 Prostate Cancer: Long-term Outcomes from a Large Prospective Cohort. European urology. 2020;77(6): 675–682.
113. Kasivisvanathan V, Rannikko AS, Borghi M, Panebianco V, Mynderse LA, Vaarala MH, et al. MRI-Targeted or Standard Biopsy for Prostate-Cancer Diagnosis. New England Journal of Medicine. 2018;
114. Ahmed HU, El-Shater Bosaily A, Brown LC, Gabe R, Kaplan R, Parmar MK, et al. Diagnostic accuracy of multi-parametric MRI and TRUS biopsy in prostate cancer (PROMIS): a paired validating confirmatory study. Lancet (London, England). 2017;389(10071): 815–822.
115. Grossman DC, Curry SJ, Owens DK, Bibbins-Domingo K, Caughey AB, Davidson KW, et al. Screening for Prostate Cancer. JAMA. 2018;319(18): 1901.
116. Salinas-Miranda E, Birosh A, McInnes MDF, Breau RH, Lam E, McGrath TA, et al. NPV of Biparametric and Multiparametric Prostate MRI: A Comparative Systematic Review and Meta-Analysis. AJR. American journal of roentgenology. 2025;224(5): e2432328.
117. de Rooij M, Hamoen EHJ, Witjes JA, Barentsz JO, Rovers MM. Accuracy of Magnetic Resonance Imaging for Local Staging of Prostate Cancer: A Diagnostic Meta-analysis. European urology. 2016;70(2): 233–245.
118. Schoots IG, Padhani AR. Risk-adapted biopsy decision based on prostate magnetic resonance imaging and prostate-specific antigen density for enhanced biopsy avoidance in first prostate cancer diagnostic evaluation. BJU international. 2021;127(2): 175–178.
119. Sathianathen N, Omer A, Harriss E, Davies L 3, Kasivisvanathan V, Punwani S, et al. Negative predictive value of multi-parametric MRI in detection of clinically significant prostate cancer in the PI-RADS era: a systematic review and meta-analysis. European Urology. 2020;in press.
120. Drost F jan H, Osses D, Nieboer D, Bangma CH, Steyerberg EW, Roobol MJ, et al. Prostate Magnetic Resonance Imaging , with or Without Magnetic Resonance Imaging-targeted Biopsy , and Systematic Biopsy for Detecting Prostate Cancer : A Cochrane Systematic Review and. European Urology. 2019;
121. Spratt D. NCCN Prostate Cancer Guidelines, Version 2.2025. Journal of the National Comprehensive Cancer Network. 2025;
122. Wei JT, Barocas D, Carlsson S, Coakley F, Eggener S, Etzioni R, et al. Early Detection of Prostate Cancer: AUA/SUO Guideline Part I: Prostate Cancer Screening. The Journal of urology. 2023;210(1): 46–53.
123. Marenco J, Orczyk C, Collins T, Moore C, Emberton M. Role of MRI in planning radical prostatectomy: what is the added value? World journal of urology. 2019;37(7): 1289–1292.
124. Ceci F, Oprea-Lager DE, Emmett L, Adam JA, Bomanji J, Czernin J, et al. E-PSMA: the EANM standardized reporting guidelines v1.0 for PSMA-PET. European Journal of Nuclear Medicine and Molecular Imaging. 2021;48(5): 1626–1638.
125. Eiber M, Herrmann K, Calais J, Hadaschik B, Giesel FL, Hartenbach M, et al. Prostate Cancer Molecular Imaging Standardized Evaluation (PROMISE): Proposed miTNM Classification for the Interpretation of PSMA-Ligand PET/CT. Journal of Nuclear Medicine. 2018;59(3): 469–478.
126. Parry MG, Cowling TE, Sujenthiran A, Nossiter J, Berry B, Cathcart P, et al. Risk stratification for prostate cancer management: value of the Cambridge Prognostic Group classification for assessing treatment allocation. BMC Medicine. 2020;18(1): 114.
127. Eastham JA, Boorjian SA, Kirkby E. Clinically Localized Prostate Cancer: AUA/ASTRO Guideline. Journal of Urology. 2022;208(3): 505–507.
128. Eifler JB, Feng Z, Lin BM, Partin MT, Humphreys EB, Han M, et al. An updated prostate cancer staging nomogram (Partin tables) based on cases from 2006 to 2011. BJU International. 2013;111(1): 22–29.
129. Han M, Partin AW, Zahurak M, Piantadosi S, Epstein JI, Walsh PC. Biochemical (prostate specific antigen) recurrence probability following radical prostatectomy for clinically localized prostate cancer. The Journal of urology. 2003;169(2): 517–523.
130. Kattan MW, Hess KR, Amin MB, Lu Y, Moons KGM, Gershenwald JE, et al. American Joint Committee on Cancer acceptance criteria for inclusion of risk models for individualized prognosis in the practice of precision medicine. CA: a cancer journal for clinicians. 2016;66(5): 370–374.
131. Thompson IM, Leach RJ, Ankerst DP. Focusing PSA testing on detection of high-risk prostate cancers by incorporating patient preferences into decision making. JAMA. 2014;312(10): 995–996.
132. Cooperberg MR, Broering JM, Carroll PR. Risk assessment for prostate cancer metastasis and mortality at the time of diagnosis. Journal of the National Cancer Institute. 2009;101(12): 878–887.
133. Gandaglia G, Barletta F, Scuderi S, Scilipoti P, Rajwa P, Huebner NA, et al. External Validation of Nomograms for the Identification of Pelvic Nodal Dissection Candidates Among Prostate Cancer Patients with Negative Preoperative Prostate-specific Membrane Antigen Positron Emission Tomography. European urology oncology. 2025;
134. Guo Y, Dong X, Mao S, Yang F, Wang R, Ma W, et al. Causes of Death after Prostate Cancer Diagnosis: A Population-Based Study. Oxidative medicine and cellular longevity. 2022;2022: 8145173.
135. Anderson BB, Oberlin DT, Razmaria AA, Choy B, Zagaja GP, Shalhav AL, et al. Extraprostatic Extension Is Extremely Rare for Contemporary Gleason Score 6 Prostate Cancer. European urology. 2017;72(3): 455–460.
136. Ross HM, Kryvenko ON, Cowan JE, Simko JP, Wheeler TM, Epstein JI. Do adenocarcinomas of the prostate with Gleason score (GS) ≤6 have the potential to metastasize to lymph nodes? The American journal of surgical pathology. 2012;36(9): 1346–1352.
137. Tilki D, Chen MH, Huland H, Graefen M, D’Amico A V. Mortality Risk for Patients with Biopsy Gleason Grade Group 1 Prostate Cancer. European urology oncology. 2024;7(6): 1520–1526.
138. Eggener SE, Badani K, Barocas DA, Barrisford GW, Cheng JS, Chin AI, et al. Gleason 6 Prostate Cancer: Translating Biology into Population Health. The Journal of urology. 2015;194(3): 626–634.
139. Overland MR, Washington SL, Carroll PR, Cooperberg MR, Herlemann A. Active surveillance for intermediate-risk prostate cancer: yes, but for whom? Current opinion in urology. 2019;29(6): 605–611.
140. Hamdy FC, Donovan JL, Lane JA, Metcalfe C, Davis M, Turner EL, et al. Fifteen-Year Outcomes after Monitoring, Surgery, or Radiotherapy for Prostate Cancer. New England Journal of Medicine. 2023;388(17): 1547–1558.
141. Bill-Axelson A, Holmberg L, Garmo H, Rider JR, Taari K, Busch C, et al. Radical Prostatectomy or Watchful Waiting in Early Prostate Cancer. New England Journal of Medicine. 2014;370(10): 932–942.
142. Bill-Axelson A, Holmberg L, Garmo H, Taari K, Busch C, Nordling S, et al. Radical Prostatectomy or Watchful Waiting in Prostate Cancer — 29-Year Follow-up. New England Journal of Medicine. 2018;379(24): 2319–2329.
143. Wilt TJ, Vo TN, Langsetmo L, Dahm P, Wheeler T, Aronson WJ, et al. Corrigendum to “Radical Prostatectomy or Observation for Clinically Localized Prostate Cancer: Extended Follow-up of the Prostate Cancer Intervention Versus Observation Trial (PIVOT)” [Eur Urol 77 (2020) 713–24]. European Urology. 2022;81(2): e52.
144. Albertsen PC. William Halsted and Prostate Cancer Progression. European Urology. 2020;77(6): 725–726.
145. Novara G, Ficarra V, Mocellin S, Ahlering TE, Carroll PR, Graefen M, et al. Systematic Review and Meta-analysis of Studies Reporting Oncologic Outcome After Robot-assisted Radical Prostatectomy. European Urology. 2012;62(3): 382–404.
146. Lestingi JFP, Guglielmetti GB, Trinh QD, Coelho RF, Pontes J, Bastos DA, et al. Extended Versus Limited Pelvic Lymph Node Dissection During Radical Prostatectomy for Intermediate- and High-risk Prostate Cancer: Early Oncological Outcomes from a Randomized Phase 3 Trial. European urology. 2021;79(5): 595–604.
147. Touijer KA, Sjoberg DD, Benfante N, Laudone VP, Ehdaie B, Eastham JA, et al. Limited versus Extended Pelvic Lymph Node Dissection for Prostate Cancer: A Randomized Clinical Trial. European urology oncology. 2021;4(4): 532–539.
148. Touijer KA, Vertosick EA, Sjoberg DD, Liso N, Nalavenkata S, Melao B, et al. Pelvic Lymph Node Dissection in Prostate Cancer: Update from a Randomized Clinical Trial of Limited Versus Extended Dissection. European urology. 2025;87(2): 253–260.
149. Yaxley JW, Dagher J, Delahunt B, Egevad L, Srigley J, Samaratunga H. Reconsidering the role of pelvic lymph node dissection with radical prostatectomy for prostate cancer in an era of improving radiological staging techniques. World journal of urology. 2018;36(1): 15–20.
150. Roberts MJ, Cornford P, Tilki D. Oncological Benefits of Extended Pelvic Lymph Node Dissection: More Fog or Clarity to the Debate? European urology. 2025;87(2): 261–263.
151. Hope TA, Eiber M, Armstrong WR, Juarez R, Murthy V, Lawhn-Heath C, et al. Diagnostic Accuracy of 68Ga-PSMA-11 PET for Pelvic Nodal Metastasis Detection Prior to Radical Prostatectomy and Pelvic Lymph Node Dissection: A Multicenter Prospective Phase 3 Imaging Trial. JAMA oncology. 2021;7(11): 1635–1642.
152. Meijer D, Ettema RH, van Leeuwen PJ, van der Kwast TH, van der Poel HG, Donswijk ML, et al. The prognostic value of lymph node staging with prostate-specific membrane antigen (PSMA) positron emission tomography/computed tomography (PET/CT) and extended pelvic lymph node dissection in node-positive patients with prostate cancer. BJU international. 2023;131(3): 330–338.
153. Ficarra V, Novara G, Rosen RC, Artibani W, Carroll PR, Costello A, et al. Systematic review and meta-analysis of studies reporting urinary continence recovery after robot-assisted radical prostatectomy. European urology. 2012;62(3): 405–417.
154. Haglind E, Carlsson S, Stranne J, Wallerstedt A, Wilderäng U, Thorsteinsdottir T, et al. Urinary Incontinence and Erectile Dysfunction After Robotic Versus Open Radical Prostatectomy: A Prospective, Controlled, Nonrandomised Trial. European urology. 2015;68(2): 216–225.
155. Yaxley JW, Coughlin GD, Chambers SK, Occhipinti S, Samaratunga H, Zajdlewicz L, et al. Robot-assisted laparoscopic prostatectomy versus open radical retropubic prostatectomy: early outcomes from a randomised controlled phase 3 study. The Lancet. 2016;388(10049): 1057–1066.
156. Nilsson H, Stranne J, Hugosson J, Wessman C, Steineck G, Bjartell A, et al. Risk of hernia formation after radical prostatectomy: a comparison between open and robot-assisted laparoscopic radical prostatectomy within the prospectively controlled LAPPRO trial. Hernia : the journal of hernias and abdominal wall surgery. 2022;26(1): 157–164.
157. Wani M, Al-Mitwalli A, Mukherjee S, Nabi G, Somani BK, Abbaraju J, et al. Venous Thromboembolism (VTE) in Post-Prostatectomy Patients: Systematic Review and Meta-Analysis. Journal of clinical medicine. 2023;12(12).
158. Heidenreich A, Pfister D. PSA persistence after radical prostatectomy needs more than standard therapeutic options to improve outcomes. BJU International. 2019;124(5): 716–718.
159. Kernek KM, Koch MO, Daggy JK, Juliar BE, Cheng L. The presence of benign prostatic glandular tissue at surgical margins does not predict PSA recurrence. Journal of Clinical Pathology. 2005;58(7): 725–728.
160. Pound CR, Partin AW, Eisenberger MA, Chan DW, Pearson JD, Walsh PC. Natural history of progression after PSA elevation following radical prostatectomy. JAMA. 1999;281(17): 1591–1597.
161. Moore CM, King LE, Withington J, Amin MB, Andrews M, Briers E, et al. Best Current Practice and Research Priorities in Active Surveillance for Prostate Cancer—A Report of a Movember International Consensus Meeting. European Urology Oncology. 2023;6(2): 160–182.
162. Maljkovic J, Bill-Axelson A, Hållberg H, Berglund A, Stattin P, Bratt O. Time trends for the use of active surveillance and deferred treatment for localised prostate cancer in Sweden: a nationwide study. Scandinavian Journal of Urology. 2024;59: 200–206.
163. Al Hussein Al Awamlh B, Barocas DA, Zhu A, Tosoian JJ, Ponsky L, Negoita S, et al. Use of Active Surveillance vs Definitive Treatment Among Men With Low- and Favorable Intermediate-Risk Prostate Cancer in the US Between 2010 and 2018. JAMA internal medicine. 2023;183(6): 608–611.
164. Xu J, Bock CH, Janisse J, Woo J, Cher ML, Ginsburg K, et al. Determinants of active surveillance uptake in a diverse population‐based cohort of men with low‐risk prostate cancer: The Treatment Options in Prostate Cancer Study (TOPCS). Cancer. 2024;130(10): 1797–1806.
165. D’Amico A V, Whittington R, Malkowicz SB, Schultz D, Blank K, Broderick GA, et al. Biochemical outcome after radical prostatectomy, external beam radiation therapy, or interstitial radiation therapy for clinically localized prostate cancer. JAMA. 1998;280(11): 969–974.
166. Epstein JI, Walsh PC, Carmichael M, Brendler CB. Pathologic and clinical findings to predict tumor extent of nonpalpable (stage T1c) prostate cancer. JAMA. 1994;271(5): 368–374.
167. Inoue LYT, Trock BJ, Partin AW, Carter HB, Etzioni R. Modeling grade progression in an active surveillance study. Statistics in medicine. 2014;33(6): 930–939.
168. Klotz L, Vesprini D, Sethukavalan P, Jethava V, Zhang L, Jain S, et al. Long-term follow-up of a large active surveillance cohort of patients with prostate cancer. Journal of clinical oncology : official journal of the American Society of Clinical Oncology. 2015;33(3): 272–277.
169. Palmstedt E, Månsson M, Hugosson J, Arnsrud Godtman R. Active Surveillance for Screen-detected Low- and Intermediate-risk Prostate Cancer: Extended Follow-up up to 25 Years in the GÖTEBORG-1 Trial. European Urology. 2025;
170. Newcomb LF, Schenk JM, Zheng Y, Liu M, Zhu K, Brooks JD, et al. Long-Term Outcomes in Patients Using Protocol-Directed Active Surveillance for Prostate Cancer. JAMA. 2024;331(24): 2084–2093.
171. Murthy V, Maitre P, Kannan S, Panigrahi G, Krishnatry R, Bakshi G, et al. Prostate-Only Versus Whole-Pelvic Radiation Therapy in High-Risk and Very High-Risk Prostate Cancer (POP-RT): Outcomes From Phase III Randomized Controlled Trial. Journal of Clinical Oncology. 2021;39(11): 1234–1242.
172. Yang YJ, Lee YS, Tae JH, Choi J, Kim JH, Yang EJ, et al. Salvage lymphadenectomy or radiation therapy in prostate cancer patients with biochemical recurrence and PET positive lymph nodes after radical prostatectomy: A systematic review and pooled analysis. European Journal of Surgical Oncology. 2024;50(12): 108704.
173. Jeet V, Parkinson B, Song R, Sharma R, Hoyle M. Histopathologically Validated Diagnostic Accuracy of PSMA-PET/CT in the Primary and Secondary Staging of Prostate Cancer and the Impact of PSMA-PET/CT on Clinical Management: A Systematic Review and Meta-analysis. Seminars in nuclear medicine. 2023;53(5): 706–718.
174. Chen DC, Buteau JP, Emmett L, Alipour R, de Galiza Barbosa F, Roberts MJ, et al. Prevalence and Medium-Term Outcomes of Patients with Biopsy-Proven Intermediate- to High-Risk Prostate Adenocarcinoma with Low Intraprostatic Uptake on [ 68 Ga]Ga-PSMA-11 PET/CT in the proPSMA Study. Journal of Nuclear Medicine. 2025;66(5): 713–718.
175. Emmett L, Buteau J, Papa N, Moon D, Thompson J, Roberts MJ, et al. The Additive Diagnostic Value of Prostate-specific Membrane Antigen Positron Emission Tomography Computed Tomography to Multiparametric Magnetic Resonance Imaging Triage in the Diagnosis of Prostate Cancer (PRIMARY): A Prospective Multicentre Study. European Urology. 2021;80(6): 682–689.
176. Woo S, Becker AS, Leithner D, Charbel C, Mayerhoefer ME, Friedman KP, et al. PSMA-avid rib lesions in prostate cancer patients: differentiating false positives from metastatic disease. European radiology. 2025;
177. Hofman MS, Lawrentschuk N, Francis RJ, Tang C, Vela I, Thomas P, et al. Prostate-specific membrane antigen PET-CT in patients with high-risk prostate cancer before curative-intent surgery or radiotherapy (proPSMA): a prospective, randomised, multicentre study. Lancet (London, England). 2020;395(10231): 1208–1216.
178. Koulikov D, Mohler MC, Mehedint DC, Attwood K, Wilding GE, Mohler JL. Low Detectable Prostate Specific Antigen after Radical Prostatectomy—Treat or Watch? Journal of Urology. 2014;192(5): 1390–1396.
179. Beauval JB, Roumiguié M, Filleron T, Benoit T, de la Taille A, Malavaud B, et al. Biochemical recurrence-free survival and pathological outcomes after radical prostatectomy for high-risk prostate cancer. BMC Urology. 2016;16(1): 26.
180. ROEHL KA, HAN M, RAMOS CG, ANTENOR JA V., CATALONA WJ. CANCER PROGRESSION AND SURVIVAL RATES FOLLOWING ANATOMICAL RADICAL RETROPUBIC PROSTATECTOMY IN 3,478 CONSECUTIVE PATIENTS: LONG-TERM RESULTS. Journal of Urology. 2004;172(3): 910–914.
181. Budäus L, Isbarn H, Eichelberg C, Lughezzani G, Sun M, Perrotte P, et al. Biochemical Recurrence After Radical Prostatectomy: Multiplicative Interaction Between Surgical Margin Status and Pathological Stage. Journal of Urology. 2010;184(4): 1341–1346.
182. Weiner AB, Kakani P, Armstrong AJ, Bossi A, Cornford P, Feng F, et al. Risk Stratification of Patients with Recurrence After Primary Treatment for Prostate Cancer: A Systematic Review. European Urology. 2024;86(3): 200–210.
183. Oikawa M, Tanaka T, Narita T, Noro D, Iwamura H, Tobisawa Y, et al. Impact of the Proportion of Biopsy Positive Core in Predicting Biochemical Recurrence in Patients with Pathological Pt2 and Negative Resection Margin Status after Radical Prostatectomy. Pathology & Oncology Research. 2020;26(4): 2115–2121.
184. Sella T, Schwartz LH, Swindle PW, Onyebuchi CN, Scardino PT, Scher HI, et al. Suspected Local Recurrence after Radical Prostatectomy: Endorectal Coil MR Imaging. Radiology. 2004;231(2): 379–385.
185. Swanson GP, Thompson IM, Tangen C, Paradelo J, Canby-Hagino E, Crawford ED, et al. Update of SWOG 8794: Adjuvant Radiotherapy for pT3 Prostate Cancer Improves Metastasis Free Survival. International Journal of Radiation Oncology*Biology*Physics. 2008;72(1): S31.
186. Thompson IM, Tangen CM, Paradelo J, Lucia MS, Miller G, Troyer D, et al. Adjuvant Radiotherapy for Pathological T3N0M0 Prostate Cancer Significantly Reduces Risk of Metastases and Improves Survival: Long-Term Followup of a Randomized Clinical Trial. Journal of Urology. 2009;181(3): 956–962.
187. Stephenson AJ, Scardino PT, Kattan MW, Pisansky TM, Slawin KM, Klein EA, et al. Predicting the Outcome of Salvage Radiation Therapy for Recurrent Prostate Cancer After Radical Prostatectomy. Journal of Clinical Oncology. 2007;25(15): 2035–2041.
188. Van der Kwast TH, Collette L, Bolla M. Adjuvant Radiotherapy After Surgery for Pathologically Advanced Prostate Cancer. Journal of Clinical Oncology. 2007;25(35): 5671–5672.
189. Canales JP, Barnafi E, Salazar C, Reyes P, Merino T, Calderón D, et al. Moderate hypofractionated radiotherapy to the prostate bed with or without pelvic lymph nodes: a prospective trial. Reports of Practical Oncology and Radiotherapy. 2024;
190. Carrie C, Hasbini A, de Laroche G, Richaud P, Guerif S, Latorzeff I, et al. Salvage radiotherapy with or without short-term hormone therapy for rising prostate-specific antigen concentration after radical prostatectomy (GETUG-AFU 16): a randomised, multicentre, open-label phase 3 trial. The Lancet. Oncology. 2016;17(6): 747–756.
191. Pollack A, Karrison TG, Balogh AG, Gomella LG, Low DA, Bruner DW, et al. The addition of androgen deprivation therapy and pelvic lymph node treatment to prostate bed salvage radiotherapy (NRG Oncology/RTOG 0534 SPPORT): an international, multicentre, randomised phase 3 trial. Lancet (London, England). 2022;399(10338): 1886–1901.
192. Roach M, Hanks G, Thames H, Schellhammer P, Shipley WU, Sokol GH, et al. Defining biochemical failure following radiotherapy with or without hormonal therapy in men with clinically localized prostate cancer: Recommendations of the RTOG-ASTRO Phoenix Consensus Conference. International Journal of Radiation Oncology*Biology*Physics. 2006;65(4): 965–974.
193. Rasing M, van Son M, Moerland M, de Keizer B, Wessels F, Jonges T, et al. Value of Targeted Biopsies and Combined PSMA PET/CT and mp-MRI Imaging in Locally Recurrent Prostate Cancer after Primary Radiotherapy. Cancers. 2022;14(3): 781.
194. Das P, Chen MH, Valentine K, Lopes L, Cormack RA, Renshaw AA, et al. Using the magnitude of PSA bounce after MRI-guided prostate brachytherapy to distinguish recurrence, benign precipitating factors, and idiopathic bounce. International journal of radiation oncology, biology, physics. 2002;54(3): 698–702.
195. ROSSER CJ, KUBAN DA, LEVY LB, CHICHAKLI R, POLLACK A, LEE AK, et al. Prostate Specific Antigen Bounce Phenomenon After External Beam Radiation for Clinically Localized Prostate Cancer. Journal of Urology. 2002;168(5): 2001–2005.
196. Marra G, Calleris G, Conte F, Benfant N, Rajwa P, Ahmed M, et al. Recurrent Gleason Score 6 Prostate Cancer After Radiotherapy or Ablation: Should We Observe Them All? Results from a Large Multicenter Salvage Radical Prostatectomy Consortium. European Urology Focus. 2024;10(3): 461–468.
197. Calleris G, Marra G, Benfant N, Rajwa P, Ahmed M, Abreu A, et al. Salvage Radical Prostatectomy for Recurrent Prostate Cancer Following First-line Nonsurgical Treatment: Validation of the European Association of Urology Criteria in a Large, Multicenter, Contemporary Cohort. European urology focus. 2023;9(4): 645–649.
198. Henríquez López I, González-San Segundo C, Vegas JO, Gutierrez C, Hervas A, Cabeza Rodriguez MÁ, et al. Salvage brachytherapy for locally-recurrent prostate cancer after radiation therapy: A comparison of efficacy and toxicity outcomes with high-dose rate and low-dose rate brachytherapy. Radiotherapy and oncology : journal of the European Society for Therapeutic Radiology and Oncology. 2019;141: 156–163.
199. Meng Y, Liu J, Shen B, Xu H, Wu D, Ying Y. Evaluation of the safety and efficacy of stereotactic body radiotherapy for radio-recurrent prostate cancer: a systematic review and meta-analysis. Prostate cancer and prostatic diseases. 2024;
200. Zhu S, Liu J, Shen B, Xu H, Zhong W, Jin S. Oncological effects and complications of salvage cryotherapy for radio-recurrent prostate cancer: a systematic review and meta-analysis. Frontiers in oncology. 2025;15(1): 1534739.
201. Yang J, Xiong X, Liao X, Zheng W, Xu H, Yang L, et al. Nonsurgical salvage options for locally recurrent prostate cancer after primary definitive radiotherapy: A systematic review and meta-analysis. International Journal of Surgery. 2024;
202. Johansson JE. Fifteen-year survival in prostate cancer. A prospective, population-based study in Sweden. JAMA: The Journal of the American Medical Association. 1997;277(6): 467–471.
203. Lu-Yao GL, Albertsen PC, Moore DF, Lin Y, DiPaola RS, Yao SL. Fifteen-year Outcomes Following Conservative Management Among Men Aged 65 Years or Older with Localized Prostate Cancer. European urology. 2015;68(5): 805–811.
204. van den Ouden D, Hop WC, Schröder FH. Progression in and survival of patients with locally advanced prostate cancer (T3) treated with radical prostatectomy as monotherapy. The Journal of urology. 1998;160(4): 1392–1397.
205. Ward JF, Slezak JM, Blute ML, Bergstralh EJ, Zincke H. Radical prostatectomy for clinically advanced (cT3) prostate cancer since the advent of prostate‐specific antigen testing: 15‐year outcome. BJU International. 2005;95(6): 751–756.
206. Hussain M, Tangen CM, Berry DL, Higano CS, Crawford ED, Liu G, et al. Intermittent versus Continuous Androgen Deprivation in Prostate Cancer. New England Journal of Medicine. 2013;368(14): 1314–1325.
207. Sweeney CJ, Chen YH, Carducci M, Liu G, Jarrard DF, Eisenberger M, et al. Chemohormonal Therapy in Metastatic Hormone-Sensitive Prostate Cancer. New England Journal of Medicine. 2015;373(8): 737–746.
208. Gravis G, Fizazi K, Joly F, et al. Androgen-deprivation therapy alone or with docetaxel in non-castrate metastatic prostate cancer (GETUG-AFU 15). The Lancet Oncology. 2013;14(2): 149–158.
209. Fizazi K, Tran N, Fein L, et al. Abiraterone plus prednisone in metastatic, castration-sensitive prostate cancer (LATITUDE). New England Journal of Medicine. 2017;377(4): 352–360.
210. James ND, Sydes MR, Clarke NW, et al. Addition of docetaxel, zoledronic acid, or both to first line long term hormone therapy in prostate cancer (STAMPEDE). The Lancet. 2016;387(10024): 1163–1177.
211. James ND, de Bono JS, Spears MR, et al. Abiraterone acetate plus prednisolone in prostate cancer not previously treated with hormone therapy (STAMPEDE arm G). New England Journal of Medicine. 2017;377(4): 338–351.
212. Armstrong AJ, et al. Enzalutamide plus androgen-deprivation therapy versus ADT plus placebo in metastatic hormone-sensitive prostate cancer (ARCHES). The Lancet Oncology. 2019;20(12): 1730–1740.
213. Davis ID, Martin AJ, Stockler MR, et al. Enzalutamide with standard first line therapy in metastatic prostate cancer. New England Journal of Medicine. 2019;381(2): 121–131.
214. Sweeney CJ, Davis ID, Stockler MR, et al. Updated overall survival outcomes in ENZAMET: 5-year follow-up. The Lancet Oncology. 2023;
215. Chi KN, Agarwal N, Bjartell A, et al. Apalutamide for metastatic, castration sensitive prostate cancer. New England Journal of Medicine. 2019;380(24): 2345–2356.
216. Fizazi K, Rathenborg P, Suárez C, others. Abiraterone plus prednisone added to androgen-deprivation therapy and docetaxel in de novo metastatic castration-sensitive prostate cancer (PEACE 1). The Lancet. 2022;399(10336): 1695–1707.
217. Smith MR, Hussain M, Saad F, et al. Darolutamide plus androgen-deprivation therapy and docetaxel in metastatic hormone-sensitive prostate cancer (ARASENS). New England Journal of Medicine. 2022;386(12): 1132–1142.
218. Hoeh B, Garcia CC, Wenzel M, et al. Triplet or doublet therapy in metastatic hormone sensitive prostate cancer: updated network meta analysis stratified by disease volume. European Urology Focus. 2023;9(5): 838–842.
219. Matsukawa A, Rajwa P, Kawada T, et al. Impact of disease volume on survival efficacy of triplet therapy for metastatic hormone sensitive prostate cancer: a systematic review, meta analysis, and network meta analysis. International Journal of Clinical Oncology. 2024;29: 399–409.
220. Zhou S, Chen X, Li Y, et al. Triplet versus doublet therapy in older patients with metastatic hormone sensitive prostate cancer: a network meta analysis. Journal of Clinical Oncology. 2025;43(16_suppl).
221. Brooks JD, Sun L, Byrd J, et al. Prostate-specific antigen doubling time thresholds for metastasis, all-cause mortality, and prostate cancer-specific mortality in men with non-metastatic castration-resistant prostate cancer. BJU International. 2017;120(4): 512–518.
222. Crawford ED, Albala DM, et al. A Clinician’s Guide to Targeted Precision Imaging in Patients With Prostate Cancer (RADAR VI). JU Open Plus. 2023;1(1): e00003.
223. Hussain M, Fizazi K, Saad F, et al. Enzalutamide in men with nonmetastatic, castration-resistant prostate cancer. New England Journal of Medicine. 2018;378(26): 2465–2474.
224. Smith MR, Saad F, Chowdhury S, others. Apalutamide and metastasis-free survival in prostate cancer. New England Journal of Medicine. 2018;378(15): 1408–1418.
225. Fizazi K, Shore N, McCoy A, et al. Darolutamide in nonmetastatic, castration-resistant prostate cancer. New England Journal of Medicine. 2019;380(13): 1235–1246.
226. Kantoff PW, Higano CS, Shore ND, et al. Sipuleucel T immunotherapy for castration resistant prostate cancer. New England Journal of Medicine. 2010;363(5): 411–422.
227. Fizazi K, Piulats JM, Reaume MN, Ostler P, McDermott R, Gingerich JR, et al. Rucaparib or Physician’s Choice in Metastatic Prostate Cancer. New England Journal of Medicine. 2023;388(8): 719–732.
228. Agarwal N, Azad AA, Carles J, Fay AP, Matsubara N, Heinrich D, et al. Talazoparib plus enzalutamide in men with first-line metastatic castration-resistant prostate cancer (TALAPRO-2): a randomised, placebo-controlled, phase 3 trial. Lancet (London, England). 2023;402(10398): 291–303.
229. Clarke NW, Ajithkumar T, Cowan R, et al. Niraparib plus abiraterone in metastatic castration-resistant prostate cancer (MAGNITUDE). Lancet Oncology. 2023;24(9): 1189–1201.
230. Tsai AK, Kagalwalla S, Langer J, Le-Kumar T, Le-Kumar V, Antonarakis ES. Pembrolizumab for metastatic castration-resistant prostate cancer: trials and tribulations. Expert opinion on biological therapy. 2024;24(1–2): 51–62.
231. Ryan CJ, Smith MR, Fizazi K, Saad F, Mulders PFA, Sternberg CN, et al. Abiraterone acetate plus prednisone versus placebo plus prednisone in chemotherapy-naive men with metastatic castration-resistant prostate cancer (COU-AA-302): final overall survival analysis of a randomised, double-blind, placebo-controlled phase 3 study. The Lancet. Oncology. 2015;16(2): 152–160.
232. Fizazi K, Scher HI, Molina A, Logothetis CJ, Chi KN, Jones RJ, et al. Abiraterone acetate for treatment of metastatic castration-resistant prostate cancer: final overall survival analysis of the COU-AA-301 randomised, double-blind, placebo-controlled phase 3 study. The Lancet. Oncology. 2012;13(10): 983–992.
233. Beer TM, Armstrong AJ, Rathkopf D, et al. Enzalutamide in metastatic prostate cancer before chemotherapy. New England Journal of Medicine. 2014;371(5): 424–433.
234. Shore ND, Chowdhury S, Villers A, Klotz L, Siemens DR, Phung D, et al. Efficacy and safety of enzalutamide versus bicalutamide for patients with metastatic prostate cancer (TERRAIN): a randomised, double-blind, phase 2 study. The Lancet. Oncology. 2016;17(2): 153–163.
235. Petrylak DP, Tangen CM, Hussain MH, et al. Docetaxel and estramustine compared with mitoxantrone and prednisone for advanced refractory prostate cancer. JAMA. 2004;291(13): 1493–1500.
236. Tannock IF, de Wit R, Berry WR, et al. Docetaxel plus prednisone or mitoxantrone plus prednisone for advanced prostate cancer. New England Journal of Medicine. 2004;351(15): 1502–1512.
237. de Bono JS, Oudard S, Ozguroglu M, et al. Prednisone plus cabazitaxel or mitoxantrone for metastatic castration-resistant prostate cancer after docetaxel treatment. New England Journal of Medicine. 2010;364(21): 1995–2005.
238. Sartor O, de Bono J, Chi KN, Fizazi K, Herrmann K, Rahbar K, et al. Lutetium-177-PSMA-617 for Metastatic Castration-Resistant Prostate Cancer. The New England journal of medicine. 2021;385(12): 1091–1103.
239. Parker C, Nilsson S, Heinrich D, others. Alpha emitter radium-223 and survival in metastatic prostate cancer. New England Journal of Medicine. 2013;369(3): 213–223.
240. Smith M, Parker C, Saad F, et al. Addition of radium 223 to abiraterone acetate and prednisone or prednisolone in patients with castration resistant prostate cancer and bone metastases (ERA 223). The Lancet Oncology. 2019;20(3): 408–419.
241. Tombal B, Bahl A, Sartor O, et al. Combination radio 223 with enzalutamide and bone protective agents in metastatic castration resistant prostate cancer: results of a phase 3 trial (PEACE 3). European Urology. 2025;
242. Fizazi K, Carducci M, Smith MR, others. Denosumab versus zoledronic acid for treatment of bone metastases in men with castration-resistant prostate cancer. The Lancet. 2011;377(9768): 813–822.
243. Smith MR, Coleman RE, Klotz L, et al. Denosumab for the prevention of skeletal-related events in men with castration-resistant prostate cancer: comparison of skeletal-related events and symptomatic skeletal events. Annals of Oncology. 2015;26(2): 368–374.

