Introducción
La biopsia de próstata es uno de los procedimientos diagnósticos más comunes en urología, especialmente ante la sospecha de cáncer prostático. Con el paso del tiempo, se han desarrollado distintas técnicas para su realización, destacando principalmente la vía transrectal guiada por ecografía, pero también incorporando enfoques más recientes como la biopsia transperineal y la biopsia dirigida por resonancia magnética.
Históricamente, la biopsia prostática era realizada digitalmente, hasta que en 1967 Watanabe y sus colegas describieron por primera vez la ecografía transrectal como herramienta diagnóstica, lo que permitió un abordaje más preciso y seguro del procedimiento(1). A partir de la introducción del protocolo sistemático de seis muestras por Hodge y colaboradores, y su posterior ampliación a 12 núcleos, se mejoró notablemente la tasa de detección de cáncer prostático(2).
Hoy en día, se estima que se realizan más de 1,3 millones de biopsias de próstata al año solo en Estados Unidos(3). Esta alta frecuencia ha impulsado el desarrollo de diferentes estrategias que buscan optimizar la indicación, técnica, calidad del muestreo y reducción de complicaciones, considerando tanto el abordaje transrectal como el transperineal y las técnicas guiadas por imagen.
Indicaciones para biopsia de próstata
En general, se estima que una biopsia de próstata inicial lleva una tasa de detección de cáncer de próstata del 30%. La detección temprana del cáncer de próstata mejoró notablemente gracias a los programas de cribado por medio del PSA. Estas iniciativas aumentaron la tasa de enfermedad órgano-confinada y potencialmente curable(4), pero también las mejoras llevaron como consecuencia no deseada al sobrediagnóstico y el sobretratamiento en muchos hombres con cáncer clínicamente insignificante.
La indicación para una biopsia de próstata se establece según el riesgo de cada paciente de presentar cáncer de próstata clínicamente significativo, en función de diferentes herramientas tales como el PSA, el tacto rectal o imágenes. Clásicamente se ha utilizado el PSA elevado o tacto rectal alterado, pero en la actualidad disponemos de técnicas de imágenes tales como la resonancia magnética para evaluar la indicación de una biopsia prostática. Con la adición de estas herramientas se han desarrollado diferentes recomendaciones para predecir el riesgo de cáncer de próstata. La edad, comorbilidades y consecuencias terapéuticas también deben considerarse y discutirse con el paciente antes de indicar la biopsia(5).
Clásicamente se ha recomendado la realización de una biopsia de próstata una vez que el nivel de PSA aumenta sobre 4,0 ng/ml. Datos posteriores de estudios de prevención del cáncer de próstata demostraron que no hay un umbral de PSA seguro que pueda descartar el cáncer de próstata en cualquier rango de edad(6).
Como se describe previamente, existe una variedad de nomogramas en línea disponibles que pueden ayudar en la toma de decisiones. La dificultad en su uso radica en la validación y la adaptación a la población objetivo. Aquellas que combinan datos clínicos como el tacto rectal, nivel de PSA, volumen de próstata, etcétera, pueden ser útiles para alcanzar una menor tasa de sobrediagnóstico y sobretratamiento(4).
Al considerar la edad como punto de inicio del tamizaje, existen diferentes umbrales según diferentes organizaciones como la AUA, que recomienda el inicio entre los 40 a 45 años en hombres con factores de riesgo como ascendencia de raza negra, mutaciones de la línea germinal o historia familiar, de lo contrario, el inicio del cribado se recomendaría en personas entre 45 y 50 años. Entre los 50 a 69 años recomiendan exámenes regulares de detección de cáncer de próstata cada 2 a 4 años. Sin embargo, los médicos pueden personalizar el intervalo de re screening según preferencias del paciente, esperanza de vida y salud general, luego de discutirlo con él(7).
Estrategias de estratificación de riesgo basadas en el PSA se han recomendado para mejorar el rendimiento de este examen en la detección del cáncer de próstata. Estas incluyen la relación de PSA libre/total, Velocidad de PSA y la Densidad del PSA. Sin embargo, estas no son uniformemente confiables(8). La *Nacional Comprehensive Cancer Network* (NCCN) aboga por el uso de algunas de estas estrategias de PSA para la decisión de realizar biopsia prostática.
Se debe recomendar la biopsia de próstata en las siguientes situaciones: **Tacto rectal patológico**, independientemente del nivel de PSA; **PSA mayor o igual a 4 ng/mL**, según el riesgo/beneficio del paciente; **nivel de PSA 2,5 ng/mL o menor con velocidad de PSA 0,35 ng/mL o mayor por año**; **Nivel de PSA 4,0 ng/mL o mayor, especialmente si la relación PSA libre/total es 10% o menos**. Según lo recomendado por la NCCN, la presencia de los nódulos en el examen rectal digital, por lo general, debería conducir a la realización de biopsia prostática, independientemente de los niveles de PSA. Okotie y Catalona en un estudio demostraron que el 14% de los cánceres se diagnosticaron solo con el examen rectal digital(9). Sin embargo, las pautas de la *American Cancer Society* ahora sugieren que se puede realizar el examen de detección del cáncer de próstata con o sin examen rectal(10).
Debemos considerar que no se debe detener el screening únicamente por una biopsia negativa; no se debe considerar únicamente el umbral de PSA para continuar con el tamizaje. Las Guías de la AUA recomiendan mantener el intervalo de seguimiento sin cambios, respecto a la indicación comentada previamente. Asimismo, sugieren la realización de una resonancia magnética en caso de no contar con una biopsia previa inicial(4).
Ecografía transrectal de la próstata: Técnica
La evaluación completa de la próstata incluye exploración tanto en el plano sagital como en el transversal para obtener el cálculo del volumen. La zona central y la zona periférica se inspeccionan para detectar lesiones hipoecoicas y anormalidades del contorno, las vesículas seminales y los vasos deferentes deben ser completamente visualizados.
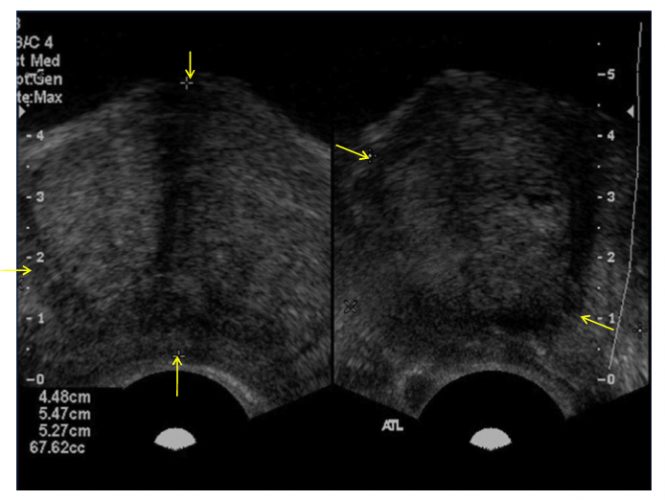
Los pacientes generalmente se ubican en posición decúbito lateral izquierdo para examinar tanto los planos transversales como longitudinales.
Para obtener imágenes transversales, se avanza con el transductor del ecógrafo hacia cefálico a través del recto, obteniendo imágenes del cuello vesical, vesículas seminales y de la base de la próstata. Retirando el transductor caudalmente hacia las imágenes del esfínter anal, se observará el ápice prostático y uretra proximal. Con algunos transductores biplano, las imágenes transversales se logran inclinando el mango de la sonda a derecha o izquierda usando el esfínter anal como punto de apoyo. Al inclinar el transductor hacia el escroto se visualizarán imágenes cefálicas y la inclinación hacia el sacro logra reproducir imágenes caudales. La rotación del transductor en el sentido de las agujas del reloj genera imágenes del lado izquierdo de la próstata y en sentido antihorario reproduce imágenes del lado derecho.
Alternativamente, se pueden obtener imágenes del plano sagital inclinando la sonda hacia arriba o hacia abajo, usando el esfínter anal como punto de apoyo. Con el paciente en posición de decúbito lateral izquierdo, inclinando el mango del transductor sonda hacia abajo (hacia el piso) se aprecian imágenes del lado derecho de la próstata e inclinado el transductor hacia arriba (hacia el techo) se apreciarán imágenes del lado izquierdo.
Imagenología del cáncer de próstata en la ecografía transrectal
En los primeros estudios las lesiones hipoecoicas se consideraban patognomónicas para el cáncer de próstata. Todas las lesiones hipoecoicas dentro de la zona periférica debían incluirse en el material de biopsia. Sin embargo, con el tiempo se demostró que el 39% de todos los cánceres son isoecoicos y hasta un 1% de los tumores pueden ser hiperecoicos en la ecografía transrectal convencional de escala de grises(11).
Un estudio de casi 4000 hombres reveló que el cáncer de próstata se detectó en un 25,5% con una lesión hipoecoica y en 25.4% sin tal lesión, con una distinción por muestra de 9.3% para hipoecoicos y 10.4% para áreas isoecoicas para cáncer(12).
Por el contrario, otro estudio señaló que las muestras de biopsia tomadas de una lesión de próstata tienen casi el doble de probabilidades de mostrar cáncer que cuando no hay lesión visible(13). Llegaron a la conclusión de que la búsqueda y la focalización de las lesiones hipoecoicas en la ecografía transrectal de la próstata sigue siendo importante para diagnóstico de cáncer, pero pueden corresponder a otros procesos patológicos como prostatitis(14), infarto prostático(15) y hasta linfoma. Es necesario realizar una biopsia en lesiones hipoecoicas, pero estas lesiones no son patognomónicas para el cáncer como alguna vez se pensó.
Resonancia magnética y su utilidad en la indicación de la biopsia
El uso de la resonancia magnética ha mostrado alta sensibilidad alto y valor predictivo negativo para identificar de forma segura qué pacientes deben someterse a una biopsia para diagnosticar cáncer de próstata clínicamente significativo(16).
El rendimiento diagnóstico y número de biopsias potencialmente evitadas, depende del umbral del PIRADS utilizado para definir una resonancia magnética positiva. Un metaanálisis mostró que utilizando PIRADS > a 3, presenta una sensibilidad y especificidad para enfermedades significativas del 96 y 43 % respectivamente, para biopsia positiva ISUP mayor o igual a 2. Utilizando PIRADS > a 4, presentó sensibilidad/especificidad de 88/64%.
El uso combinado de la densidad de antígeno prostático y resonancia magnética puede ayudar a afinar el diagnóstico de cánceres clínicamente significativos y ayudar a evitar de forma segura biopsias redundantes que conducen a cánceres clínicamente insignificantes (4).
Una revisión sistemática y metaanálisis reciente comparan la detección de cáncer de próstata, incorporando la resonancia magnética con biopsia dirigida, en contraste con la detección basada en el PSA y biopsia sistemática, mostrando resultados que indican que la integración de la resonancia magnética se asocia con una reducción de biopsias innecesarias y un menor diagnóstico de cáncer de próstata clínicamente no significativo (17).
Debemos considerar que la realización de la resonancia magnética como método de screening no tiene mayor diferencia en el diagnóstico de cánceres clínicamente significativos, pero presenta menor tasa de detección de cáncer de próstata no clínicamente significativo. La limitante de estos resultados considera centros altamente experimentados lo que dificultaría la generalización de los mismos(5). Es por esto que, aunque la biopsia transrectal y la transperineal todavía se consideran el estándar, los datos emergentes confirman el papel de la biopsia guiada por resonancia magnética, particularmente en pacientes con una biopsia negativa previa. Sin embargo, los costos de la resonancia magnética y la reproducción moderada entre lectores del examen siguen siendo preocupaciones significativas que requieren más estudios para definir el papel correcto de la resonancia magnética en la vía de diagnóstico del cáncer de próstata(18).
Teniendo esto en consideración, en caso de tener una resonancia magnética con una lesión sospechosa de cáncer de próstata clínicamente significativo, las guías de la AUA recomiendan la biopsia dirigida asociada a sistemática. Si la resonancia es negativa para lesiones sospechosas, pero existe riesgo de cáncer de próstata, se debe realizar de todas maneras una biopsia sistemática(7).
Preparación del paciente para biopsia de próstata
La preparación adecuada del paciente para una biopsia de próstata es esencial para reducir riesgos de complicaciones, mejorar el confort y garantizar la calidad de la muestra. Se recomienda una evaluación previa del estado de salud del paciente, incluyendo historia clínica, evaluación de comorbilidades y revisión del uso de anticoagulantes o antiagregantes plaquetarios. En general, estos fármacos deben ser suspendidos entre 5 a 7 días antes del procedimiento, según el riesgo trombótico individual y previa evaluación médica(19).
Además, se aconseja realizar un enema rectal el día anterior o la mañana del procedimiento para reducir la carga bacteriana rectal, lo que puede disminuir la tasa de infecciones post-biopsia(20).
Se debe informar a los pacientes sobre los riesgos y beneficios del procedimiento y obtener consentimiento informado previo a la realización del procedimiento
Profilaxis antibiótica en la biopsia de próstata
La profilaxis antibiótica es una práctica estándar en las biopsias prostáticas transrectales. La guía de la *Asociación Europea de Urología* (EAU) recomienda el uso de antibióticos profilácticos para reducir el riesgo de infección urinaria, prostatitis o sepsis(21). Las fluoroquinolonas, como el ciprofloxacino, han sido los antibióticos de elección. Sin embargo, debido al aumento de la resistencia bacteriana, se ha propuesto individualizar la profilaxis mediante el uso de cultivos rectales previos o la elección de antibióticos alternativos como aminoglucósidos o cefalosporinas de tercera generación(22).
La profilaxis dirigida (individualizada) con antibióticos o esquemas combinados de antibióticos, han resultado eficaces para reducir el riesgo de sepsis tras las biopsias de próstata. El uso previo de antibióticos y la diabetes se asocian con un mayor riesgo de sepsis(23).
Analgesia y anestesia en la biopsia de próstata
La biopsia prostática puede ser dolorosa, especialmente durante la inserción del transductor transrectal y la toma de muestras. El bloqueo periprostático con lidocaína al 1% bajo guía ecográfica ha demostrado ser eficaz para reducir el dolor durante el procedimiento(24). Este bloqueo consiste en infiltrar anestesia local bilateralmente en la región entre la base de la próstata y las vesículas seminales.
Otras opciones incluyen el uso de geles anestésicos rectales, analgésicos orales, sedación leve, profunda o incluso anestesia general en casos seleccionados, como pacientes con ansiedad severa o necesidad de múltiples tomas(25).
Posicionamiento del paciente en la biopsia de próstata
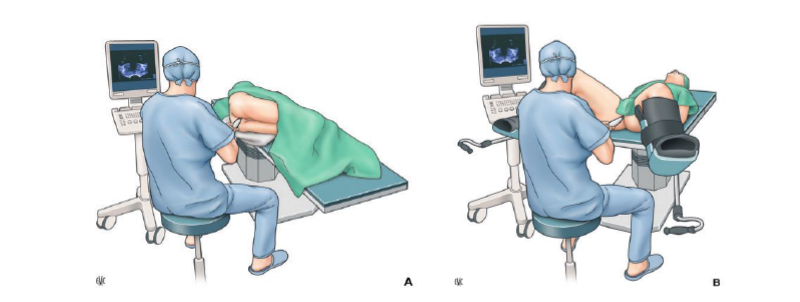
El posicionamiento correcto del paciente es crucial para la comodidad de este y para facilitar el acceso adecuado a la glándula prostática. La posición más utilizada en la biopsia transrectal es la de decúbito lateral izquierdo con caderas y rodillas flexionadas, también conocida como posición de Sims modificada(27). Esta posición permite una introducción adecuada del transductor transrectal y reduce el riesgo de lesiones rectales.
En el caso de la biopsia transperineal, el paciente se coloca en decúbito dorsal con las piernas en estribos o en posición de litotomía, lo que proporciona un mejor acceso al periné(27).
**Técnica de muestreo en la biopsia de próstata**
Se debe realizar un examen rectal digital inicial para evaluar cualquier alteración como nódulos prostáticos o procesos patológicos anales. Se determina el volumen de la próstata y se obtienen imágenes de la próstata en los planos transversal y sagital. Se debe señalar la ubicación y características de cualquier lesión (hipoecoicas, hiperecoicas, calcificaciones, anormalidades del contorno, estructuras quísticas, etcétera). La muestra de biopsia por lo general se coloca en formalina al 10%.
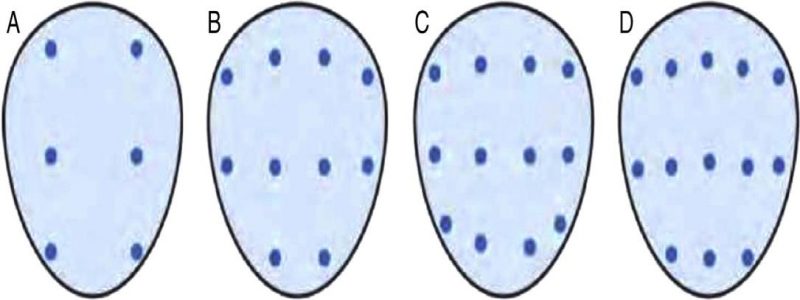
La técnica de muestreo ha evolucionado desde esquemas aleatorios sistemáticos hasta enfoques dirigidos por imagen. El método más común sigue siendo la biopsia sistemática de 12 cores bajo guía ecográfica transrectal, que incluye muestras de las zonas periféricas laterales y mediales de ambos lóbulos prostáticos(28).
Recientemente, el uso de resonancia magnética multiparamétrica (RMmp) ha permitido realizar biopsias dirigidas a lesiones sospechosas mediante fusión de imagen o biopsia cognitiva, lo que mejora la detección de cáncer clínicamente significativo y reduce el sobrediagnóstico(29). Las guías actuales recomiendan combinar biopsias sistemáticas con biopsias dirigidas en pacientes con lesiones sospechosas en RMmp(30).
Biopsia por fusión
Con la aparición y uso de la resonancia magnética en la práctica clínica, se han desarrollado nuevas técnicas que utilizan softwares para incorporar las imágenes de la resonancia y combinarla con la ecografía, la biopsia fusión. Esta nos permitiría una biopsia completamente dirigida a la lesión en evaluación. Es en este contexto que han aparecido diferentes revisiones sistemáticas y metanálisis que muestran mejor resultado para la biopsia fusión en caso de contar con resonancia magnética previo a la biopsia, entendiendo como mejor resultado la mayor detección de los cánceres significativos, y menor diagnóstico de los cánceres no significativos(31). Sumado a esto, se tiende a una mayor detección en casos de biopsia previa negativa(32).
Es importante señalar que los resultados mayormente presentados en la literatura comparan la biopsia fusión con la biopsia estándar. En una revisión sistemática donde se compara la biopsia fusión con la biopsia cognitiva, que también se apoya en el uso de la resonancia, se evidenció que existe una tendencia a tasas mejoradas en la detección del cáncer de próstata con biopsia fusión, no alcanzando en esta revisión resultados estadísticamente significativos, por lo que es importante estar evaluando futuras publicaciones que ayuden a dilucidar si esta modalidad, fusión, es superior a la biopsia cognitiva(33).
Existen estudios que han comparado en forma separada la biopsia solo transperineal estándar versus la biopsia fusión transperineal en donde las biopsias fusión sólo parece ser más efectivo en lesiones seleccionadas (anteriores y apicales) versus la biopsia transperineal en población general (34).
Biopsia de próstata transperineal
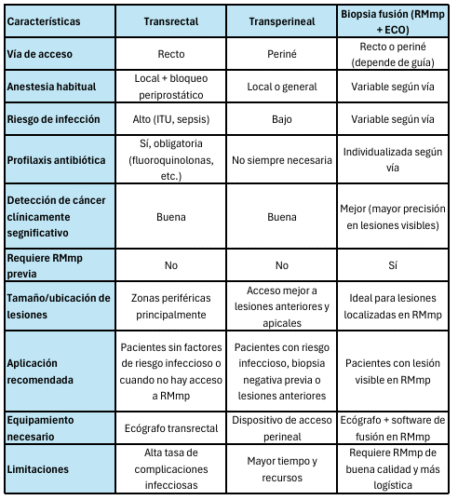
La biopsia de próstata por vía transperineal se ha consolidado como una técnica segura, eficaz y bien tolerada frente a la vía transrectal. La *American Urological Association* (AUA) y la *Society of Urologic Oncology* (SUO) consideran que ambas vías (transperineal y transrectal) son aceptables, pero destacan que la vía transperineal presenta menor riesgo de infección, especialmente de sepsis, y puede ser preferible en pacientes con alto riesgo de complicaciones infecciosas o con lesiones anteriores o apicales de difícil acceso por vía transrectal(35).
La literatura reciente muestra que la biopsia transperineal bajo anestesia local, utilizando dispositivos de acceso específicos (como PrecisionPoint™) o guías reutilizables, permite realizar el procedimiento en un entorno ambulatorio, con tasas de detección de cáncer clínicamente significativo equivalentes a la vía transrectal, pero con una reducción significativa de infecciones y sin necesidad rutinaria de profilaxis antibiótica (36-40). El dolor y la tolerancia del paciente son adecuados, siendo la infiltración anestésica el momento más molesto, pero la mayoría de los pacientes consideran el procedimiento aceptable bajo anestesia local (38-41).
La biopsia transperineal es especialmente ventajosa para la detección de tumores en zonas anteriores y apicales, y se integra fácilmente con técnicas de fusión MRI/ultrasonido, lo que optimiza la precisión diagnóstica (37,42-44). Las complicaciones más frecuentes son la retención urinaria (1-2%), mientras que la sepsis es rara (38,40).
**Los grupos que más se benefician de este abordaje son:**
– **Pacientes con alto riesgo de complicaciones infecciosas:** Incluye aquellos con antecedentes de infecciones post-biopsia, inmunosupresión, o factores de riesgo para sepsis. La vía transperineal reduce significativamente el riesgo de infecciones graves y hospitalizaciones en comparación con la vía transrectal, incluso sin profilaxis antibiótica.
– **Pacientes con lesiones prostáticas anteriores o apicales:** La vía transperineal permite un acceso más directo y preciso a estas regiones, mejorando la tasa de detección de cáncer clínicamente significativo en estas localizaciones.
– **Pacientes con antecedentes de biopsias transrectales negativas y persistencia de sospecha clínica:** La transperineal es preferida para repetir la biopsia, especialmente si se sospechan lesiones en zonas de difícil acceso transrectal.
– **Pacientes en vigilancia activa:** Para seguimiento histológico, la vía transperineal minimiza el riesgo acumulativo de infecciones.
– **Pacientes en los que se busca reducir el uso de antibióticos:** Dada la menor tasa de infecciones, la transperineal puede realizarse sin profilaxis antibiótica rutinaria, contribuyendo a la reducción de la resistencia bacteriana.
La evidencia reciente también respalda su uso en pacientes biopsia-naive, mostrando tasas de detección equivalentes o superiores y menor riesgo de infección(42).
**Entre las contraindicaciones absolutas, la literatura destaca** la presencia de infecciones activas en la región perineal (como abscesos, celulitis o heridas abiertas), ya que el paso de la aguja a través de tejido infectado puede diseminar la infección y aumentar el riesgo de complicaciones graves. La imposibilidad de colocar al paciente en posición de litotomía, alergia grave a anestésicos locales no sustituibles, o alteraciones graves de la coagulación no corregibles. Asimismo, trastornos graves de la coagulación no corregibles representan una contraindicación absoluta, dado el riesgo de hemorragia significativa, especialmente en pacientes con trombocitopenia severa o coagulopatías no reversibles (38,43,45).
La *American Urological Association* y la *Society of Urologic Oncology* no recomiendan profilaxis antibiótica rutinaria para la biopsia prostática transperineal en la mayoría de los pacientes, incluso en aquellos con alto riesgo de complicaciones infecciosas, lesiones anteriores o apicales, antecedentes de biopsias transrectales negativas, vigilancia activa o cuando se busca minimizar el uso de antibióticos. La justificación es que la vía transperineal presenta un riesgo significativamente menor de infección en comparación con la vía transrectal, por lo que la profilaxis antibiótica no es necesaria de forma sistemática en este contexto.
**La preparación óptima incluye** antisepsia rigurosa de la piel perineal con soluciones como clorhexidina o povidona yodada, y la corrección de coagulopatías antes del procedimiento. No se han identificado estrategias no antibióticas adicionales (como enemas, preparación rectal o cambios en el número de cilindros) que reduzcan el riesgo infeccioso en la vía transperineal, a diferencia de la vía transrectal donde la preparación rectal con povidona yodada sí es beneficiosa (46,47).
**La estratificación individualizada del riesgo y la evaluación previa a la biopsia son fundamentales** en pacientes con comorbilidades cardiovasculares o renales significativas que se someten a biopsia prostática transperineal. Es esencial valorar el estado de anticoagulación, la fragilidad, la función renal y la carga global de comorbilidad antes del procedimiento, ya que estos factores influyen en el riesgo de complicaciones y en la planificación del seguimiento postprocedimiento(35,48).
**Aunque la vía transperineal reduce el riesgo de infección, los pacientes inmunocomprometidos o con comorbilidades relevantes pueden requerir profilaxis antibiótica individualizada**. En estos casos, se sugiere considerar una dosis única de antibiótico (por ejemplo, una quinolona oral o cefalosporina), ajustando la elección según el antibiograma local y el perfil del paciente, especialmente si existe insuficiencia renal avanzada que requiera ajuste de dosis. Ante cualquier sospecha de infección, debe iniciarse tratamiento empírico precoz, siguiendo las recomendaciones de la *American Urological Association* y considerando la epidemiología local de resistencia bacteriana (48-51).
**El riesgo de hematuria y retención urinaria es mayor** en pacientes con insuficiencia renal, disfunción vesical o bajo tratamiento anticoagulante. Se recomienda monitorizar la diuresis y la aparición de hematuria, así como individualizar la suspensión o ajuste de anticoagulantes antes y después del procedimiento, en coordinación con cardiología o nefrología según el riesgo trombótico y hemorrágico. La retención urinaria debe tratarse precozmente, y en casos de hemorragia significativa, valorar la intervención urológica(34,48,49).
**El seguimiento post procedimiento debe incluir** una revisión precoz (idealmente en los primeros 7 a 14 días) y la entrega de instrucciones claras sobre signos de alarma: fiebre, disuria, hematuria persistente, dolor torácico, disnea o signos de sobrecarga de volumen. En pacientes con insuficiencia cardíaca o renal, es crucial vigilar la aparición de descompensación, y se recomienda la coordinación multidisciplinaria con cardiología y nefrología para el ajuste de medicación y el manejo de posibles complicaciones(35)(49)(50).
En resumen, la vía perineal bajo anestesia local representa el estándar emergente para la biopsia prostática, con ventajas claras en seguridad y equivalencia en eficacia diagnóstica, respaldada por la *American Urological Association* y la *Society of Urologic Oncology*(35).
Complicaciones de la biopsia de próstata
Aunque generalmente se considera un procedimiento seguro, la biopsia de la próstata puede estar asociada con complicaciones, que generalmente se manejan tranquilizando al paciente. La incidencia de las complicaciones graves que requieren hospitalización es relativamente baja (<1%).
En el estudio ProtecT que observó pacientes 35 días posterior a biopsia, la prevalencia de complicaciones menores fue de: 92,6% para hematospermia; 65,8% para hematuria; 43,6% para el dolor; 36,8% para hematoquecia; y 17,5% para fiebre. El 19,6% de los hombres consideró que cualquier biopsia adicional o repetida sería un problema moderado o grave(52).
En un estudio canadiense de más de 41.000 hombres con resultados de biopsia negativos, la tasa de ingreso hospitalario de 30 días después de la biopsia de próstata aumentó de 1,0% en 1996 a 4,1% en 2010(53). La mayoría de los ingresos hospitalarios (72%) estaban relacionados con infecciones bacterianas.
Las series grandes de detección como el PLCO y el ERSPC muestran que la biopsia de próstata no está asociada con un exceso de mortalidad y la tasa general de complicaciones infecciosas es inferior al 1% (54).
Infecciones post biopsia
La mayoría de las complicaciones infecciosas después de la biopsia guiada por ecografía transrectal se limitan a infecciones urinarias sintomáticas y enfermedad febril de bajo grado, que puede ser fácilmente tratada con antibióticos orales o intravenosos; sin embargo, las hospitalizaciones por complicaciones infecciosas varían de 0,6% a 4,1%, con la incidencia reportada de ITU de 2% y 6% (55)(56).
Aunque las hospitalizaciones por la sepsis aumentan después de la biopsia de próstata, los datos sugieren que la mortalidad en este grupo no fue excesiva en comparación con otras infecciones sistémicas similares(54).
Los microrganismos que se reportan como resultado de sepsis son predominantemente *Escherichia coli,* con altas tasas de resistencia a las fluoroquinolonas, trimetoprim-sulfametoxazol y ampicilina. Sin embargo, todos los aislamientos de esta serie eran susceptibles a las cefalosporinas de segunda y tercera generación, amikacina y carbapenémicos (p. ej., Imipenem, Meropenem)(54).
Los factores de riesgo para la infección relacionada con la biopsia de próstata incluyen: raza no blanca, mayor número de comorbilidades, diabetes mellitus, mayor volumen prostático, viajes al extranjero y uso de antibióticos recientes. Otro factor de riesgo fue el número de biopsias previas.
Familiarizarse con los patrones de resistencia local a los antibióticos puede ayudar en el tratamiento rápido de síntomas infección después de una biopsia de próstata.
La biopsia de próstata ha estado en el centro de la controversia en los últimos años debido a las altas complicaciones de infección asociadas con la vía transrectal y la retirada de la autorización para fluoroquinolonas y fosfomicina como profilaxis. El Grupo de Directrices de Infecciones Urológicas de la Asociación Europea de Urología (EAU) publicó recientemente un metaanálisis en dos partes basado en ensayos controlados aleatorios (ECA) y actualiza anualmente los datos de las directrices de la EAU. Los metaanálisis muestran que la biopsia transperineal de próstata está asociada significativamente con menos complicaciones infecciosas que la biopsia transrectal y, por lo tanto, debe preferirse. Si todavía se utiliza la biopsia transrectal, entonces se debe usar la limpieza intrarectal con povidona-yodo y profilaxis antibiótica. Las estrategias de profilaxis antibióticas incluyen profilaxis dirigida después de pruebas de sensibilidad de la flora rectal, profilaxis aumentada con varios antibióticos y monoprofilaxis empírica(57).
La literatura señala que la biopsia transrectal ha mostrado mayor tasa de complicaciones infecciosas que la biopsia transperineal de próstata(58,59).
Sangrado
Incluso con parámetros de coagulación normales, cualquier tipo de sangrado es la complicación más común observada después de una biopsia de próstata.
El sangrado rectal es típicamente menor y se debe generalmente a una lesión de una vena rectal, que habitualmente se resuelve antes de 48 hrs, también fácilmente controlado con presión directa por el transductor de ultrasonido o sonda o digitalmente; la pérdida de sangre rápida y persistente por recto pueden requerir una intervención más agresiva para el control(52). Medidas adicionales incluyen el taponamiento rectal con condón inflado, anoscopía/colonoscopía con inyección de epinefrina o uso de agentes escleroterapéuticos, angiografía con embolización, exploración transrectal y sutura(7).
La hematospermia, comúnmente observada después de una biopsia, es por lo general autolimitada, pero puede causar ansiedad significativa si no se discute en el momento de la biopsia(60). En un estudio, la duración media de la hemospermia fue de 4 (± 1,4) semanas. Ningún factor predijo la duración de la hemospermia(61). Lo más importante es explicar y tranquilizar al paciente.
Retención aguda de orina
Ocurre hasta en un 6% de los pacientes debido a edema glandular y existe mayor incidencia en el deterioro de los síntomas del tracto urinario inferior hasta en un 25%. Es más frecuente en la biopsia transperineal, en biopsias por saturación y próstatas de gran volumen. En la mayoría de los casos no necesitan un tratamiento invasivo más que la instalación de un catéter uretrovesical. El uso de alfabloqueadores profilácticos podrían ser útiles para reducir los síntomas en próstatas de gran volumen o ante la presencia de síntomas severos previos(52).
Otras complicaciones
La ansiedad y las molestias excesivas del transductor endorrectal pueden producir una respuesta vasovagal moderada o severa en 1,4% a 5,3% de pacientes (60,62) y pueden requerir la terminación del procedimiento. Colocar al paciente en la posición de Trendelenburg y uso de hidratación intravenosa generalmente logran resolver estos síntomas.
Los efectos de la biopsia de próstata en la disfunción eréctil han sido caracterizados de manera incompleta. Estudios iniciales sugirieron que la disfunción eréctil después de la biopsia se debió a un daño a los paquetes neurovasculares. Desde entonces, los estudios han sido conflictivos, con un estudio más reciente que sugiere que la disfunción eréctil es más pronunciada en hombres que tuvieron un diagnóstico de cáncer de próstata que en aquellos que estaban libres de cáncer(63).
Contraindicaciones para la biopsia de próstata
Las principales contraindicaciones para realizar una biopsia de próstata son la infección activa de la vía urinaria o de la próstata, el uso de anticoagulantes, y la presencia de ciertas condiciones anatómicas como fístulas rectales, estenosis anal o ausencia de recto. Se debe considerar, además, la historia clínica del paciente, poniendo especial atención en coagulopatías o algún tipo de alergias a medicamentos.
Bibliografía
-
1.-Watanabe H, Kato H, Kato T, Morita M, Tanaka M. Diagnostic aplication of the ultrasoundotomography for the prostate. Nippon Hinyokika Gakkai Zasshi. 1968;59 (4):273-279.
2.- Hodge KK, McNeal JE, Terris MK, et al. Random systematic versus directed ultrasound guided transrectal core biopsies of the prostate. J Urol 1989;142:71–5.
3.- Aubry W, Lieberthal R, Willis A, Bagley G, Willis SM 3rd, Layton A. Budget impact model: epigenetic assay can help avoid unnecessary repeated prostate biopsies and reduce healthcare spending. Am Health Drug Benefits. 2013 Jan;6(1):15-24.
4.- Catalona WJ, Smith DS, Ratliff TL, et al. Detection of organ-confined prostate cancer is increased through prostate-specific antigen-based screening. JAMA 1993;270:948–54.
5.- P. Cornford (Chair) DT (Vice chair), RCN van den B, D. Eberli GDM, G.J.L.H. van Leenders JO, M. Roberts OR, Patient Advocate: E. Briers, Guidelines Associates: P. Chiu AF, et al. EAU – EANM – ESTRO – ESUR – ISUP – SIOG Guidelines on Prostate Cancer [Internet]. [cited 2025 May 31]. Available from: https://d56bochluxqnz.cloudfront.net/documents/full-guideline/EAU-EANM-ESTRO-ESUR-ISUP-SIOG-Guidelines-on-Prostate-Cancer-2025_2025-03-24-120144_rinw.pdf
6.- Thompson IM, Ankerst DP, Chi C, Lucia MS, Goodman PJ, Crowley JJ, et al. Operating Characteristics of Prostate-Specific Antigen in Men With an Initial PSA Level of 3.0 ng/mL or Lower. JAMA [Internet]. 2005 Jul 6 [cited 2025 May 31];294(1):66–70. Available from: https://jamanetwork.com/journals/jama/fullarticle/201171
7.- Wei JT, Barocas D, Carlssons S, et al. AUA/SUO guideline part I: prostate cancer screening. J Urol. 2023;210(1):45-53. AUA/SUO guideline part II: considerations for a prostate biopsy. J Urol. 2023;210(1):54-63. [cited 2025 May 31]. Early Detection of Prostate Cancer: AUA/SUO Guideline (2023) – American Urological Association. Available from: https://www.auanet.org/guidelines-and-quality/guidelines/early-detection-of-prostate-cancer-guidelines
8.- Heidenreich A, Bastian PJ, Bellmunt J, Bolla M, Joniau S, Van Der Kwast T, et al. EAU guidelines on prostate cancer. Part 1: Screening, diagnosis, and local treatment with curative intent – Update 2013. Eur Urol [Internet]. 2014 [cited 2025 May 31];65(1):124–37. Available from: https://pubmed.ncbi.nlm.nih.gov/24207135/
9.- Okotie OT, Roehl KA, Han M, Loeb S, Gashti SN, Catalona WJ. Characteristics of Prostate Cancer Detected by Digital Rectal Examination Only. Urology [Internet]. 2007 Dec [cited 2025 May 31];70(6):1117–20. Available from: https://pubmed.ncbi.nlm.nih.gov/18158030/
10.- Smith RA, Andrews KS, Brooks D, Fedewa SA, Manassaram‐Baptiste D, Saslow D, et al. Cancer screening in the United States, 2017: A review of current American Cancer Society guidelines and current issues in cancer screening. CA Cancer J Clin [Internet]. 2017 Mar [cited 2025 May 31];67(2):100–21. Available from: https://pubmed.ncbi.nlm.nih.gov/28170086/
11.- Shinohara K, Wheeler TM, Scardino PT. The appearance of prostate cancer on transrectal ultrasonography: correlation of imaging and pathological examinations. J Urol. 1989 Jul;142(1):76-82. PMID: 2659828
12.- Onur R, Littrup PJ, Pontes JE, Bianco FJ Jr. Contemporary impact of transrectal ultrasound lesions for prostate cancer detection. J Urol. 2004 Aug;172(2):512-4. PMID: 15247717
13.- Toi A, Neill MG, Lockwood GA, Sweet JM, Tammsalu LA, Fleshner NE. The continuing importance of transrectal ultrasound identification of prostatic lesions. J Urol. 2007 Feb;177(2):516-20. PMID: 17222623
14.- Terris MK, Macy M, Freiha FS. Transrectal ultrasound appearance of prostatic granulomas secondary to bacillus Calmette-Guerin instillation. J Urol. 1997 Jul;158(1):126-7. PMID: 9186337
15.- Purohit RS, Shinohara K, Meng MV, Carroll PR. Imaging clinically localized prostate cancer. Urol Clin North Am. 2003 May;30(2):279-93.
16.- Rozas G de Q, Saad LS, e Melo HJ de F, Gabrielle HAA, Szejnfeld J. Impact of PI-RADS v2 on indication of prostate biopsy. International braz j urol [Internet]. 2019 Jun 27 [cited 2025 May 31];45(3):486–94. Available from: https://www.scielo.br/j/ibju/a/Td6JwD4mGpJZYkDGY5xWMyp/?lang=en
17.-Fazekas T, Shim SR, Basile G, Baboudjian M, Kói T, Przydacz M, et al. Magnetic Resonance Imaging in Prostate Cancer Screening: A Systematic Review and Meta-Analysis. JAMA Oncol [Internet]. 2024 Jun 1 [cited 2025 May 31];10(6):745–54. Available from: https://jamanetwork.com/journals/jamaoncology/fullarticle/2817308
18.- Cicione A, De Nunzio C, Manno S, Damiano R, Posti A, Lima E, et al. An update on prostate biopsy in the era of magnetic resonance imaging. Minerva Urologica e Nefrologica [Internet]. 2018 Jun 1 [cited 2025 May 31];70(3):264–74. Available from: https://www.minervamedica.it/en/journals/minerva-urology-nephrology/article.php?cod=R19Y2018N03A0264
19.- Rosario DJ, Lane JA, Metcalfe C, et al. Short term outcomes of prostate biopsy in men tested for cancer by prostate specific antigen: prospective evaluation within ProtecT study. BMJ. 2012;344:d7894.
20.- Carey JM, Korman HJ. The role of rectal preparation in transrectal ultrasound guided prostate biopsy: a meta-analysis. J Urol. 2001;166(1):82–5.
21.- Bonkat G, Barabasch A, Bruins HM, et al. EAU Guidelines on Urological Infections 2024. Arnhem, The Netherlands: European Association of Urology; 2024.
22.- Zani EL, Clark OA, Rodrigues Netto N Jr. Antibiotic prophylaxis for transrectal prostate biopsy. Cochrane Database Syst Rev. 2011;(5):CD006576.
23.- Jincun Shi, Yujie Pan, Tong Su. Analysis of Influencing Factors of Sepsis after Prostate Biopsy: A Meta-Analysis. Arch. Esp. Urol. 2023; 76(10): 810–822 https://doi.org/10.56434/j.arch.esp.urol.20237610.98
24.- Nash PA, Bruce JE, Indudhara R, et al. Transrectal ultrasound guided prostatic nerve blockade eases systematic needle biopsy of the prostate. J Urol. 1996;155(2):607–9.
25.- Autorino R, De Sio M, Di Lorenzo G, et al. How to decrease pain during transrectal ultrasound guided prostate biopsy: a look at the evidence. Eur Urol. 2012;61(3):629–40.
26.- Kakehi Y, Takei M, Naito S. Biopsy of the prostate. Int J Urol. 2008;15(5):326–32.
27.- Takenaka A, Hara R, Ishimura T, et al. A prospective randomized comparison of diagnostic efficacy between transperineal and transrectal 12-core prostate biopsy. Prostate Cancer Prostatic Dis. 2008;11(2):134–8.
28.- Hodge KK, McNeal JE, Terris MK, et al. Random systematic versus directed ultrasound guided transrectal core biopsies of the prostate. J Urol. 1989;142(1):71–4.
29.- Kasivisvanathan V, Rannikko AS, Borghi M, et al. MRI-Targeted or Standard Biopsy for Prostate-Cancer Diagnosis. N Engl J Med. 2018;378(19):1767–77.
30.- National Comprehensive Cancer Network (NCCN). Prostate Cancer Early Detection (Version 2.2024). NCCN Clinical Practice Guidelines in Oncology.
31.- Deng YS, He YH, Ying WW, Liu HL, Li PZ, Ma CY, et al. Value of three biopsy methods in prostate cancer detection: A meta-analysis and systematic review. Eur Rev Med Pharmacol Sci. 2021;25(5):2221–34.
32.- Tang Y, Liu Z, Tang L, Zhang R, Lu Y, Liang J, et al. Significance of MRI/Transrectal Ultrasound Fusion Three-Dimensional Model-Guided, Targeted Biopsy Based on Transrectal Ultrasound-Guided Systematic Biopsy in Prostate Cancer Detection: A Systematic Review and Meta-Analysis. Urol Int [Internet]. 2018 Jan 19 [cited 2025 May 31];100(1):57–65. Available from: https://dx.doi.org/10.1159/000484144
33.- Watts KL, Frechette L, Muller B, Ilinksy D, Kovac E, Sankin A, et al. Systematic review and meta-analysis comparing cognitive vs. image-guided fusion prostate biopsy for the detection of prostate cancer. Urologic Oncology: Seminars and Original Investigations [Internet]. 2020 Sep 1 [cited 2025 May 31];38(9):734.e19-734.e25. Available from: https://www.sciencedirect.com/science/article/abs/pii/S1078143920301265?via%3Dihub
34.- Uleri A, Baboudjian M, Tedde A, Gallioli A, Long-Depaquit T, Palou J, et al. Is There an Impact of Transperineal Versus Transrectal Magnetic Resonance Imaging–targeted Biopsy in Clinically Significant Prostate Cancer Detection Rate? A Systematic Review and Meta-analysis. Eur Urol Oncol [Internet]. 2023 Dec 1 [cited 2025 May 31];6(6):621–8. Available from: https://www.sciencedirect.com/science/article/abs/pii/S2588931123001645?via%3Dihub
35.- Early Detection of Prostate Cancer: AUA/SUO Guideline Part II: Considerations for a Prostate Biopsy. Wei JT, Barocas D, Carlsson S, et al. The Journal of Urology. 2023;210(1):54-63. doi:10.1097/JU.0000000000003492.
36.- Transperineal Biopsy Devices in People With Suspected Prostate Cancer – A Systematic Review and Economic Evaluation. Souto-Ribeiro I, Woods L, Maund E, et al. Health Technology Assessment (Winchester, England). 2024;28(60):1-213. doi:10.3310/ZKTW8214.
37.- Multiparametric Magnetic Resonance Imaging for the Detection of Clinically Significant Prostate Cancer: What Urologists Need to Know. Part 4: Transperineal Magnetic Resonance-Ultrasound Fusion Guided Biopsy Using Local Anesthesia. Immerzeel J, Israël B, Bomers J, et al. European Urology. 2022;81(1):110-117. doi:10.1016/j.eururo.2021.10.032.
38.- Transperineal Prostate Biopsies Using Local Anesthesia: Experience With 1,287 Patients. Prostate Cancer Detection Rate, Complications and Patient Tolerability. Stefanova V, Buckley R, Flax S, et al. The Journal of Urology. 2019;201(6):1121-1126. doi:10.1097/JU.0000000000000156.
39.- Patient Tolerability With Office Transperineal Biopsy Using a Reusable Needle Guide. Wertheimer S, Budzyn J, Perkins S, et al. Urology. 2021;154:339-341. doi:10.1016/j.urology.2021.05.018.
40.- Local Anaesthetic Transperineal (LATP) Prostate Biopsy Using a Probe-Mounted Transperineal Access System: A Multicentre Prospective Outcome Analysis. Lopez JF, Campbell A, Omer A, et al. BJU International. 2021;128(3):311-318. doi:10.1111/bju.15337.
41.- Local Anaesthetic Transperineal Biopsy Versus Transrectal Prostate Biopsy in Prostate Cancer Detection (TRANSLATE): A Multicentre, Randomised, Controlled Trial. Bryant RJ, Marian IR, Williams R, et al. The Lancet. Oncology. 2025;26(5):583-595. doi:10.1016/S1470-2045(25)00100-7.
42.- Vector Prostate Biopsy: A Novel Magnetic Resonance Imaging/Ultrasound Image Fusion Transperineal Biopsy Technique Using Electromagnetic Needle Tracking Under Local Anaesthesia. Fletcher P, De Santis M, Ippoliti S, et al. European Urology. 2023;83(3):249-256. doi:10.1016/j.eururo.2022.12.007.
43.- Fusion MRI/Ultrasound-Guided Transperineal Biopsy: A Game Changer in Prostate Cancer Diagnosis. Giannakodimos I, Kaltsas A, Moulavasilis N, et al. Journal of Clinical Medicine. 2025;14(2):453. doi:10.3390/jcm14020453.
44.- Biopsy Strategies in the Era of mpMRI: A Comprehensive Review. Windisch O, Valerio M, Yee CH, et al. Prostate Cancer and Prostatic Diseases. 2025;28(2):288-297. doi:10.1038/s41391-024-00884-2.
45.- Complications Following Transrectal and Transperineal Prostate Biopsy: Results of the ProBE-PC Randomized Clinical Trial. Mian BM, Feustel PJ, Aziz A, et al. The Journal of Urology. 2024;211(2):205-213. doi:10.1097/JU.0000000000003788.
46.- Nonantibiotic Strategies for the Prevention of Infectious Complications Following Prostate Biopsy: A Systematic Review and Meta-Analysis. Pradere B, Veeratterapillay R, Dimitropoulos K, et al. The Journal of Urology. 2021;205(3):653-663. doi:10.1097/JU.0000000000001399.
47.- Preventing Infections After Prostate Biopsy: Prophylactic Antibiotics, Prebiopsy Rectal Culture, and Biopsy Approach. Hubner N, Dall’Era M. The Urologic Clinics of North America. 2024;51(4):439-444. doi:10.1016/j.ucl.2024.06.001.
48.- Complications After Systematic, Random, and Image-Guided Prostate Biopsy. Borghesi M, Ahmed H, Nam R, et al. European Urology. 2017;71(3):353-365. doi:10.1016/j.eururo.2016.08.004.
49.- A Retrospective Comparison of Transrectal and Transperineal Prostate Biopsies: Experience of a Single Surgeon. Young R, Norris B, Reeves F, Peters JS. Journal of Endourology. 2019;33(6):498-502. doi:10.1089/end.2019.0170.
50.- Cancer Detection and Complications of Transperineal Prostate Biopsy With Antibiotics When Indicated. Boevé LMS, Bloemendal FT, de Bie KCC, et al. BJU International. 2023;132(4):397-403. doi:10.1111/bju.16041.
51.- Prevention and Management of Infectious Complications in Prostate Biopsy: A Review. Shigemura K, Fujisawa M. International Journal of Urology : Official Journal of the Japanese Urological Association. 2021;28(7):714-719. doi:10.1111/iju.14572.
52.- Das CJ, Razik A, Sharma S, Verma S. Prostate biopsy: when and how to perform. Clin Radiol [Internet]. 2019 Nov 1 [cited 2025 May 31];74(11):853–64. Available from: https://www.clinicalradiologyonline.net/action/showFullText?pii=S0009926019301606
53.- Nam RK, Saskin R, Lee Y, Liu Y, Law C, Klotz LH, et al. Increasing hospital admission rates for urological complications after transrectal ultrasound guided prostate biopsy. Journal of Urology [Internet]. 2013 [cited 2025 May 31];189(1 SUPPL). Available from: https://pubmed.ncbi.nlm.nih.gov/23234616/
54.- Pinsky PF, Parnes HL, Andriole G. Mortality and complications after prostate biopsy in the Prostate, Lung, Colorectal and Ovarian Cancer Screening (PLCO) trial. BJU Int [Internet]. 2014 [cited 2025 May 31];113(2):254–9. Available from: https://pubmed.ncbi.nlm.nih.gov/24053621/
55.- Bjurlin MA, Wysock JS, Taneja SS. Optimization of Prostate Biopsy: Review of Technique and Complications. Urol Clin North Am [Internet]. 2014 [cited 2025 May 31];41(2):299. Available from: https://pmc.ncbi.nlm.nih.gov/articles/PMC4151475/
56.- McNeal JE, Redwine EA, Freiha FS, Stamey TA. Zonal distribution of prostatic adenocarcinoma. Correlation with histologic pattern and direction of spread. American Journal of Surgical Pathology [Internet]. 1988 [cited 2025 May 31];12(12):897–906. Available from: https://pubmed.ncbi.nlm.nih.gov/3202246/
57.- Pilatz A, Alidjanov J, Bonkat G, Wagenlehner F. Prostate biopsy—infection prophylaxis and patient preparation. Urologie [Internet]. 2023 May 1 [cited 2025 May 31];62(5):459–63. Available from: https://link.springer.com/article/10.1007/s00120-023-02065-w
58.- Derin O, Fonseca L, Sanchez-Salas R, Roberts MJ. Infectious complications of prostate biopsy: winning battles but not war. World J Urol [Internet]. 2020 Nov 1 [cited 2025 May 31];38(11):2743–53. Available from: https://link.springer.com/article/10.1007/s00345-020-03112-3
59.- Xiang J, Yan H, Li J, Wang X, Chen H, Zheng X. Transperineal versus transrectal prostate biopsy in the diagnosis of prostate cancer: A systematic review and meta-analysis. World J Surg Oncol [Internet]. 2019 Feb 13 [cited 2025 May 31];17(1):1–11. Available from: https://wjso.biomedcentral.com/articles/10.1186/s12957-019-1573-0
60.- B Djavan, M Waldert, A Zlotta, P Dobronski, C Seitz, M Remzi, et al. J Urol. 2001 [cited 2025 May 31]. p. 856–60 Safety and morbidity of first and repeat transrectal ultrasound guided prostate needle biopsies: results of a prospective European prostate cancer detection study – PubMed. Available from: https://pubmed.ncbi.nlm.nih.gov/11490233/
61.- Abdelkhalek M, Abdelshafy M, Elhelaly H, Kamal M. Hemosepermia after transrectal ultrasound-guided prostatic biopsy: A prospective study. Urol Ann [Internet]. 2013 Jan [cited 2025 May 31];5(1):30–3. Available from: https://pubmed.ncbi.nlm.nih.gov/23662007/
62.- Rodríguez L V., Terris MK. Risks and complications of transrectal ultrasound guided prostate needle biopsy: a prospective study and review of the literature. J Urol [Internet]. 1998 Dec [cited 2025 May 31];160(6 Pt 1):2115–20. Available from: https://pubmed.ncbi.nlm.nih.gov/9817335/
63.- Helfand BT, Glaser AP, Rimar K, Zargaroff S, Hedges J, McGuire BB, et al. Prostate cancer diagnosis is associated with an increased risk of erectile dysfunction after prostate biopsy. BJU Int [Internet]. 2013 [cited 2025 May 31];111(1):38–43. Available from: https://pubmed.ncbi.nlm.nih.gov/22639942/

