Introducción
Imagenología en urología: Evolución histórica y aplicaciones clínicas contemporáneas
El desarrollo de la urología moderna ha estado intrínsecamente ligado al progreso de las técnicas de adquisición de imágenes, tanto endoscópicas como radiológicas. La imagenología constituye una herramienta indispensable en la evaluación del aparato genitourinario, con implicancias fundamentales en los ámbitos diagnóstico, terapéutico y de seguimiento.
Desde el descubrimiento de los rayos X por Wilhelm Conrad Röntgen en 1895, la radiología ha experimentado un crecimiento sostenido. En 1896, J. McIntyre ya documentaba la visualización de litiasis urinaria mediante radiografías simples, lo que marcó un hito inicial en la integración de la imagen en el manejo de patologías urológicas(1).
Durante las primeras décadas del siglo XX, la incorporación de medios de contraste —inicialmente gaseosos y posteriormente iodados— permitió una caracterización más precisa del tracto urinario. En 1929, Moses Swick describió la opacificación del sistema pielocalicial mediante la administración intravenosa de compuestos iodados, lo que dio origen a la urografía intravenosa como técnica para el estudio anatómico y funcional de la vía urinaria excretora(2).
El desarrollo de la ecografía (ultrasonografía) supuso un avance disruptivo en el abordaje clínico del paciente urológico. Esta técnica no invasiva, en tiempo real, carente de radiación ionizante y segura en embarazadas y pacientes con insuficiencia renal, se consolidó rápidamente como método de primera línea para la evaluación morfológica de los riñones, vejiga y órganos genitales internos.
La introducción de la Tomografía Computada (TC) representó un salto cualitativo en la evaluación estructural del sistema genitourinario. Su alta resolución espacial y capacidad multiplanar permite una caracterización precisa de la anatomía y la patología urológica. La posibilidad de cuantificar la densidad tisular mediante unidades Hounsfield ha demostrado ser de particular utilidad en la diferenciación de la composición de litiasis urinarias, la caracterización de masas renales y el análisis del realce tumoral tras la administración de contraste intravenoso.
En las últimas décadas, la Resonancia Magnética (RM) ha adquirido un rol protagónico en el estudio urológico. Esta técnica, exenta de radiación ionizante, es ideal para su uso en pacientes pediátricos, gestantes y con disfunción renal. Ofrece una resolución superior en contraste de tejidos blandos y permite el uso de agentes de contraste basados en gadolinio, con bajo riesgo de nefrotoxicidad. Su aplicación es particularmente relevante en el estudio de patología prostática, vesical, del suelo pélvico y del tracto urinario superior.
En paralelo, el desarrollo de la Tomografía por Emisión de Positrones combinada con Tomografía Computada (PET/CT) ha expandido las posibilidades diagnósticas en el contexto oncológico. Esta modalidad híbrida integra información anatómica y metabólica, siendo altamente eficaz en la etapificación, reestadificación y evaluación de respuesta terapéutica en neoplasias urológicas. Su uso se ha visto potenciado por la introducción de radiofármacos específicos como el PSMA en cáncer de próstata.
Las técnicas de medicina nuclear han estado tradicionalmente presentes en la práctica urológica. Los estudios renales isotópicos permiten la evaluación de la función renal diferencial, la detección de reflujo vesicoureteral —incluso en ausencia de hallazgos ecográficos o radiológicos convencionales— y la pesquisa de metástasis óseas mediante cintigrama óseo.
Muchas de estas técnicas de imagen han trascendido su utilidad diagnóstica, adquiriendo un rol terapéutico relevante. El desarrollo de la litotricia extracorpórea por ondas de choque (LEC) ha permitido el tratamiento no invasivo de la litiasis renal. Asimismo, el acceso percutáneo guiado por imagen ha transformado el abordaje de la nefrolitotomía y de ciertas lesiones tumorales, con abordajes mínimamente invasivos y terapias dirigidas(3).
En este escenario de complejidad creciente, la colaboración estrecha entre el urólogo y el radiólogo resulta esencial para la toma de decisiones clínicas informadas y la selección de estrategias diagnósticas y terapéuticas individualizadas.
Urolitiasis
La litiasis urinaria es una patología frecuente, en particular en la medicina de urgencia, con prevalencia e incidencia reportadas que han ido en aumento(4). En Chile no se cuenta con datos demográficos confiables. En los Estados Unidos de Norteamérica las personas tienen una probabilidad de 10-15% de presentar un episodio sintomático de litiasis urinaria durante su vida adulta, con un porcentaje de recurrencia de 42%(4). Existen factores geográficos, climáticos, étnicos, alimentarios y genéticos que influyen en la producción y recurrencia de cálculos renales.
Imagenología
El rol de las imágenes es fundamental para el diagnóstico preciso y determinar el tratamiento correspondiente. Permite informar ubicación, tamaño, relación con otros órganos y sospechar complicaciones. Además permite determinar la fragilidad del cálculo y actualmente, determinar la composición(5).
El 90% de los cálculos de la vía urinaria son radioopacos, siendo la gran mayoría compuestos por oxalato de calcio (80%). Cálculos de acido úrico y de cistina (5-10% y 1-3% respectivamente), pueden ser radiolúcidos a la radiología tradicional y pueden tener distinto enfrentamiento terapéutico(6).
Radiografía renal y vesical simple y pielografía de eliminación
La radiografía renal y vesical simple históricamente fue el examen inicial para la sospecha de cálculos urinarios, sin embargo presenta una sensibilidad baja menor al 60% para la detección de cálculos. Su principal utilidad actual es la planificación de LEC guiada por fluoroscopía y para la monitorización de fragmentos después de LEC, PNL o ureteroscopía(7).
La pielografía o urografía de eliminación, usa medio de contraste yodado endovenoso excretado por la vía urinaria. Permite mejor evaluación de la anatomía renal y de la vía urinaria, y puede mostrar la presencia de litiasis obstructiva(6). Sin embargo, falla en la detección de cálculos en 31-48% de los casos. En la actualidad el uso de tomosínteisis digital, que corresponde a una serie de radiografías de baja dosis tomadas durante un barrido único del tubo de rayos X en un rango limitado, permite mejorar la detección de cálculos pequeños con radiología convencional(5) y mejorar la calidad diagnóstica de la pielografía de eliminación, manteniendo un bajo nivel de dosis de radiación al paciente.
Ecografía
La ecografía es el método de estudio inicial de elección en pacientes pediátricos y embarazadas, ya que no usa radiación ionizante. Tiene una alta sensibilidad en el diagnóstico de nefrolitiasis, sin embargo, baja su rendimiento en la visualización de cálculos ureterales distales(8). Los cálculos son ecogénicos y presentan sombra acústica posterior, independiente de su composición, y se pueden detectar cálculos menores a 1 mm usando este método(6). Existen reportes de que el rendimiento diagnóstico de la ecografía en usuarios expertos es comparable a la tomografía computada (TC).
Las mejoras en el rendimiento de la ecografía, usando equipos modernos y protocolos estrictos de preparación del paciente, han hecho plantear la posibilidad de protocolos de estudio combinando ultrasonografía y radiología convencional en el estudio inicial, bajando levemente la sensibilidad en comparación con TC, pero tomando en consideración la creciente preocupación por la dosis de radiación acumulada de los pacientes(6).
Tomografía Computada Multidetector
La tomografía computada multidetector de abdomen y pelvis no contrastada (PieloTAC), se ha convertido en el estándar en el estudio de imágenes en contexto de sospecha de cólico renal. Actualmente los protocolos de baja dosis han logrado disminuir el riesgo de la radiación, bajando la dosis efectiva a cifras menores a 5 mSv. Los resultados según metaanálisis demuestran un excelente rendimiento diagnóstico con sensibilidad y especificad de 97% y 95% respectivamente(9). La adquisición de alta resolución se reconstruye en cortes finos de entre 1-3mm, además permite obtener un voxel isotrópico y realizar reconstrucciones volumétricas coronales de alta resolución que mejoran aun más el rendimiento del estudio.
Los lugares más frecuentes donde se puede obstaculizar el avance de los cálculos son la unión pieloureteral, el cruce con los vasos iliacos y la unión ureterovesical, siendo hitos anatómicos a revisar dirigidamente.
Dentro de la información que se debiese reportar en el informe radiológico se encuentran: El número de cálculos; el tamaño mayor en el plano axial en milímetros (medido en ventana ósea), fundamental para establecer probabilidad de expulsión espontánea. La ubicación anatómica en el riñón (superior, medio, inferior), que incide en los resultados de las técnicas de tratamiento y la ubicación anatómica en el uréter (proximal, medio, distal), que se asocia a menor o mayor probabilidad de expulsión. La presencia de signos de obstrucción, infección o de complicaciones como urinomas son de importancia ya que le otorgan urgencia o agresividad al manejo(10).
El uso de medio de contraste yodado solo es de utilidad en la sospecha de complicaciones, en la búsqueda de diagnósticos diferenciales, o especialmente en fase de eliminación cuando existe duda razonable para diferenciar litiasis ureteral distal de flebolito pelviano.
Tomografía Computada de doble energía
La composición del cálculo es información fundamental para la definición de tratamientos, principalmente diferenciando cálculos de ácido úrico versus no ácido úrico (predominantemente de oxalato o fosfato de calcio) debido a que los primeros pueden ser manifestación de un desorden metabólico(5) y son susceptibles a tratamiento médico de alcalinización de orina. Los cálculos de cistina y oxalato de calcio tienen una composición firme que puede limitar el éxito de la LEC(11).
La tomografía computada de doble energía (DECT) adquiere dos sets de datos de baja y alta energía durante una sola adquisición, lo que le confiere una capacidad inherente para diferenciar materiales que tengan similar densidad pero que varían en la absorción de fotones a diferentes niveles energéticos(11). Las dos tecnologías más usadas son la técnica de rápido cambio de voltaje y la técnica de doble fuente de rayos x. Se ha reportado excelente certeza en determinar la composición química de los cálculos renales, determinando su número Z efectivo, con alto grado de concordancia con técnicas in vivo, siendo más confiable que la medición de densidad tomográfica en unidades de Hounsfield (UH), que se realiza con la tomografía computada convencional de energía única. Aún más, se han reportado resultados confiables diferenciando cálculos de acido úrico, cistina, estruvita y oxalato de calcio (Fig 1).
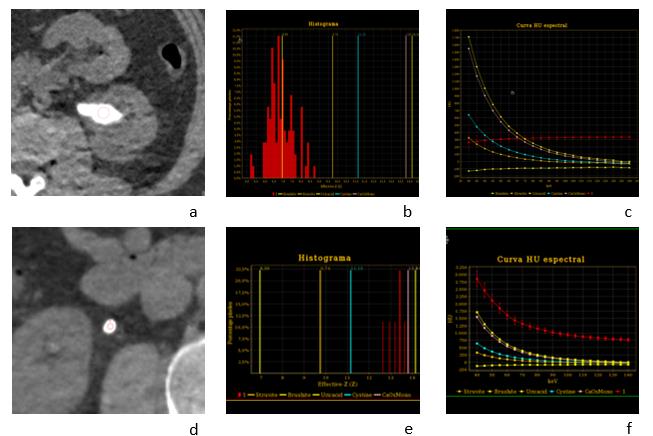
Una limitación es el tamaño del cálculo, ya que el rendimiento baja en cálculos menores de 3 mm, en los cuales no es posible realizar una región de interés (ROI) adecuada. Sin embargo, el análisis de estos cálculos no sería de mucha importancia debido a su alta probabilidad de eliminación espontánea.
La litiasis urinaria es un problema de salud creciente, que puede provocar sintomatología con gran disconfort para los pacientes. El advenimiento de nuevas tecnologías en estudios de imágenes ha aumentado considerablemente la certeza diagnóstica en la detección y caracterización de esta patología, disminuyendo los riesgos para los pacientes y permitiendo un tratamiento mejor planificado y más efectivo.
Tumores renales: Diagnóstico y caracterización radiológica
El cáncer renal ha mostrado un aumento progresivo en su incidencia a nivel mundial durante las últimas décadas. De acuerdo con estimaciones del estudio **Global Burden of Disease (GBD) 2019**, la tasa de incidencia ajustada por edad (ASR) a nivel global se incrementó de **3,5 casos por 100.000 habitantes en 1990** a **4,6 por 100.000 en 2019**, lo que representa un aumento del 29,1 % en ese período. En paralelo, la **tasa global de mortalidad** por cáncer renal se elevó de **1,9 a 2,1 por 100.000 habitantes**, con un incremento relativo del 11,6 % (12).
Según el informe **GLOBOCAN 2018**, se estimaron aproximadamente **403.000 nuevos casos** de cáncer renal y **175.000 muertes** a nivel mundial, con una incidencia estandarizada por edad de **4,5 por 100.000 habitantes** y una mortalidad de **1,8 por 100.000**(13). Este tipo de neoplasia representa cerca del **2,2 % de todos los cánceres diagnosticados globalmente**, y es más frecuente en países de ingresos altos, especialmente en América del Norte y Europa Occidental.
El cáncer renal presenta un claro predominio en el sexo masculino, con una **relación hombre:mujer aproximada de 1,7:1**, atribuida a diferencias en exposición a factores de riesgo como el tabaquismo, hipertensión arterial y obesidad(14).
Aproximadamente el 20% de las lesiones renales sólidas menores de 4 cm son benignas. La mayoría de las lesiones detectadas de forma incidental presentan un crecimiento lento o incluso imperceptible en el tiempo(15). El 90% de los tumores renales malignos corresponden a carcinomas de células renales (CCR), mientras que el 10% restante incluye tumores mesenquimales, nefroblásticos, metanéfricos, neuroendocrinos, linfoproliferativos y metastásicos(16). El carcinoma urotelial del tracto urinario superior es poco frecuente, representando entre el 5% y el 10% de los carcinomas uroteliales.
Las principales herramientas diagnósticas incluyen la ecografía, la tomografía computada (TC) y la resonancia magnética (RM), cuyos avances recientes permiten una evaluación más precisa en la detección, caracterización y estadificación de los tumores renales.
Tumores benignos
Angiomiolipoma (AML)
Los angiomiolipomas (AML) son los tumores benignos renales más frecuentes, representando hasta el 43% de las lesiones benignas en algunas series, seguidos por los oncocitomas, que pueden alcanzar hasta el 35% de los casos. Los AML son los tumores renales con contenido graso más común; sin embargo, aproximadamente el 5% de ellos son pobres en grasa, lo que dificulta su diferenciación con el CCR en estudios de imagen(16).
El riesgo de rotura y hemorragia aumenta en lesiones mayores de 4 cm o que presentan pseudoaneurismas intralesionales prominentes, lo que puede justificar su tratamiento mediante embolización o cirugía. En ecografía, los AML suelen ser hiperecogénicos, aunque esta característica también puede observarse en CCR pequeños. La detección de grasa macroscópica en TC y RM constituye el hallazgo imagenológico más específico, con excelente rendimiento diagnóstico en AML clásicos.
Oncocitoma
Los oncocitomas son tumores epiteliales benignos que pueden simular tanto en imágenes como en histología al CCR cromófobo (CCRchr). Son el tumor renal sin grasa más frecuente, representando aproximadamente el 7% de las neoplasias corticales renales. La presencia de una cicatriz central y hemorragia intratumoral se ha identificado en el 33% y 20% de los pacientes, respectivamente(15).
Tumores malignos
Carcinoma de Células Renales (CCR)
Existen múltiples subtipos histológicos de CCR, siendo los tres más frecuentes: el carcinoma de células claras (CCRcc), que representa el 75% de los casos; el carcinoma papilar (CCRp), con una frecuencia del 7–15%; y el carcinoma cromófobo (CCRchr), que constituye aproximadamente el 5%. La sobrevida está determinada por la etapificación, el grado histológico, la presencia de elementos sarcomatoides y la necrosis tumoral(14). Cada subtipo presenta características imagenológicas y pronósticos distintos, lo que resalta la importancia de su diferenciación(17).
Carcinoma Urotelial
Este tipo de tumor se origina en el urotelio de los cálices y la pelvis renal, y puede representar hasta el 15% de los tumores renales. Se ha descrito la presencia de tumores sincrónicos en la vía urinaria en un 24% de los casos. En estadios iniciales, la diferenciación con CCR es relativamente sencilla cuando se manifiesta como engrosamiento parietal del tracto urinario o como un defecto de llenado en el sistema colector. No obstante, la presencia de una masa infiltrativa en el seno renal puede dificultar la distinción con otras lesiones agresivas.
Linfoma Renal
La afectación renal por linfoma es más comúnmente secundaria a linfoma no Hodgkin. Puede presentarse como una masa solitaria que simula un CCR, múltiples masas, enfermedad retroperitoneal-perirrenal o infiltración difusa del parénquima renal. El patrón más frecuente es el de múltiples masas (60%), mientras que una lesión solitaria se observa en el 10–20% de los casos. Las lesiones suelen ser homogéneas en TC y RM, con realce hipovascular tras la administración de contraste endovenoso, lo que permite diferenciarlas del CCRcc. La presencia de adenopatías abdominales se reporta en el 50% de los casos(14).
Escenarios clínicos-imagenológicos
Diferenciación entre patología benigna y maligna
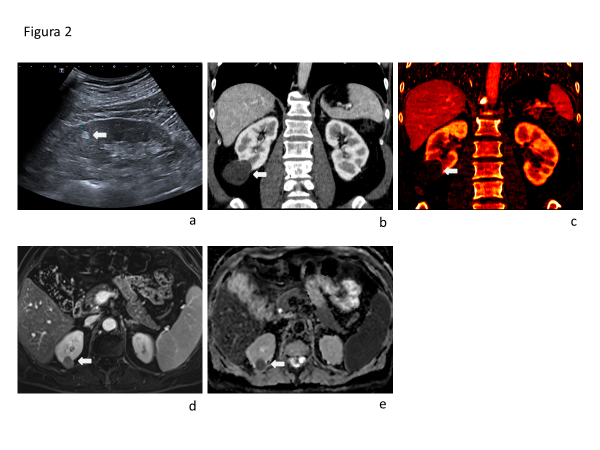
La ecografía presenta una capacidad limitada para diferenciar lesiones benignas de malignas. La apariencia hiperecogénica clásica del AML no es específica, ya que también puede observarse en CCR pequeños (Fig. 2a).
La detección de grasa macroscópica en una lesión renal es altamente sugestiva de AML. En TC, esta grasa se manifiesta como áreas con densidad inferior a -10 unidades Hounsfield (UH). En RM, la grasa macroscópica intratumoral presenta una intensidad de señal similar a la grasa subcutánea e intraabdominal en todas las secuencias, con saturación de señal en secuencias con supresión grasa y artefacto de “tinta china” en la interfaz agua-grasa en secuencias T1 en fase opuesta. Algunos AML pobres en grasa no muestran grasa macroscópica en imágenes. Estos pueden ser hipointensos en T2, al igual que los CCRp. Un patrón de realce hipervascular intenso favorece el diagnóstico de AML.
Por otro lado, la presencia de necrosis y hemorragia intratumoral es más sugestiva de CCR que de lesiones benignas(18).
La diferenciación entre lesiones quísticas y sólidas tiene buen rendimiento en ecografía, TC y RM. La presencia de vascularización en Doppler color o poder, o la impregnación con contraste endovenoso, son hallazgos patognomónicos de lesiones sólidas. Sin embargo, esta diferenciación puede ser difícil en presencia de pseudorealce en TC o en lesiones hipovasculares. La TC multidetector de doble energía (DECT) permite, mediante separación de materiales, generar mapas de yodo que identifican con precisión las estructuras que captan contraste (Fig. 2b y 2c). La RM con técnica de sustracción de fases también permite identificar lesiones con realce (Fig. 2d).
La cuantificación de la restricción a la movilidad de protones en secuencias de difusión (DWI) puede ser útil para diferenciar lesiones benignas de malignas. Se han reportado valores de coeficiente de difusión aparente (ADC) significativamente menores en CCR en comparación con lesiones benignas (Fig. 2e), siendo particularmente significativa la diferencia con oncocitomas, que presentan valores de ADC más altos. Sin embargo, los AML pueden presentar valores bajos de ADC, incluso inferiores a los del CCR.
Diferenciación de subtipos de carcinoma de células renales
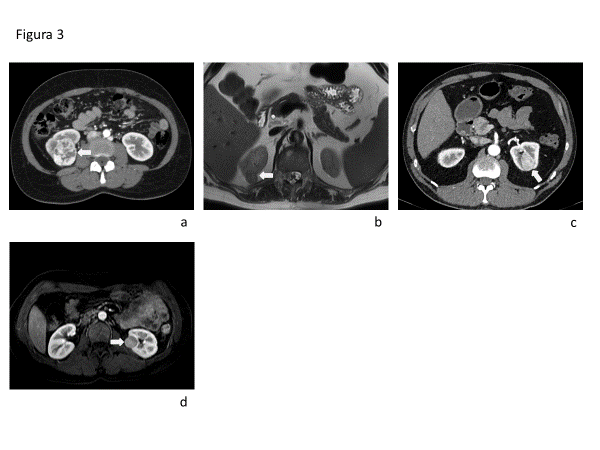
El CCRcc se caracteriza por un realce intenso en fase corticomedular en TC y RM, con lavado en fase nefrográfica en comparación con el parénquima renal. Los tumores de mayor tamaño suelen ser heterogéneos debido a necrosis, hemorragia o componentes quísticos (Fig. 3a). El CCRp, en contraste, es más homogéneo e hipovascular. El patrón de realce dinámico permite diferenciar estas entidades con alta sensibilidad y especificidad(19).
En resonancia magnética, el CCRcc suele presentar alta señal en secuencias ponderadas en T2, mientras que el CCRp se caracteriza por hipointensidad en T2 (Fig. 3b). Aproximadamente el 60% de los CCRcc contienen grasa microscópica, lo que se manifiesta como caída de señal en secuencias T1 gradiente en fase opuesta. Por su parte, los CCRp pueden contener hemosiderina, evidenciándose como caída de señal en T1 gradiente en fase.
La tomografía computada de doble energía (DECT) permite cuantificar la concentración de yodo intratumoral, lo que ha demostrado utilidad en la diferenciación entre CCRcc y CCRp. Utilizando un punto de corte de 0,9 mg/ml, se ha reportado un área bajo la curva (AUC) de 0,92 (IC 95%: 0,91–0,93), con mayor concentración de yodo en CCRcc y menor en CCRp[18]. Cuando los CCRchr no presentan una cicatriz central estrellada ni un patrón de realce invertido en secuencias dinámicas, suelen ser indistinguibles imagenológicamente de los CCRcc y de los oncocitomas (Fig. 3c y 3d).
Determinación del grado histológico
El grado tumoral de Fuhrman constituye un índice pronóstico fundamental en el CCR. Se ha demostrado que la cuantificación de la concentración de yodo intratumoral mediante DECT se correlaciona significativamente con el grado nuclear de Fuhrman, tanto en CCRcc como en CCRp. A mayor concentración de yodo, mayor es el grado tumoral(18).
Asimismo, la restricción en secuencias de difusión (DWI), evaluada mediante el valor ADC, también se correlaciona con el grado histológico: valores más bajos de ADC se asocian con grados tumorales más altos(17).
Sistemas de Clasificación y Evaluación
R.E.N.A.L Score
Las opciones terapéuticas para lesiones renales pequeñas incluyen nefrectomía parcial, nefrectomía radical, ablación o vigilancia activa, siendo todas opciones válidas según el contexto clínico. El sistema R.E.N.A.L. es una herramienta estructurada y cuantificable que permite describir características imagenológicas relevantes para predecir la complejidad quirúrgica.
Evalúa cinco parámetros: R (Radio: tamaño máximo), E (Exofítico/endofítico), N (Proximidad al seno renal), A (Orientación anterior-posterior) y L (Localización respecto a las líneas polares). Se asigna un puntaje de 1 a 3 a todos los descriptores, excepto el parámetro A. La suma total clasifica las lesiones en tres grupos: baja complejidad (4–6 puntos), complejidad moderada (7–9 puntos) y alta complejidad (10–12 puntos)(20).
Clear Cell Likelihood Score (ccLS)
El **Clear Cell Likelihood Score** (ccLS) es un sistema estructurado de evaluación e informe diseñado para mejorar la especificidad diagnóstica en la caracterización de masas renales, especialmente en la diferenciación del CCR de células claras (CCRcc) frente a otros subtipos o lesiones benignas. Utiliza hallazgos de resonancia magnética multiparamétrica (mpMRI) y estratifica las masas en una escala de Likert de 5 puntos, desde “muy poco probable” (1) hasta “muy probable” (5) de corresponder a CCRcc(21).
El ccLS se basa en la evaluación de secuencias específicas de RM y parámetros auxiliares, como la presencia de grasa macroscópica, la intensidad de señal en T2, la restricción en DWI y los patrones de realce dinámico (DCE-MRI)(22). Los radiólogos asignan puntuaciones según la presencia, ausencia y grado de estas características, lo que permite una estimación reproducible y estandarizada de la probabilidad de CCRcc. Una puntuación alta puede respaldar decisiones quirúrgicas, mientras que una puntuación baja puede favorecer la vigilancia activa o la biopsia dirigida, reduciendo intervenciones innecesarias.
Inteligencia Artificial en la caracterización de lesiones renales
Más allá de los sistemas de puntuación tradicionales como el ccLS, la **inteligencia artificial (IA)** ha emergido como una herramienta prometedora para la caracterización automatizada de masas renales en imágenes avanzadas. Algoritmos de aprendizaje profundo (*deep learning*) tienen la capacidad de identificar patrones complejos en tomografías computadas multifásicas con contraste, superando las limitaciones de la inspección visual humana y los métodos radiómicos convencionales. Estudios recientes, como el de Dai y Xiong et al. (2022), han demostrado que modelos de *deep learning* pueden alcanzar alta precisión diagnóstica en lesiones pequeñas, con áreas bajo la curva (AUC) superiores a 0,80 en la diferenciación de subtipos histológicos específicos, resultados comparables a los obtenidos por radiólogos subespecialistas en urorradiología(23).
La integración de IA en la evaluación de lesiones renales no solo mejora la precisión diagnóstica, sino que también permite estandarizar la interpretación de imágenes y reducir la variabilidad interobservador. Al proporcionar un análisis objetivo y cuantitativo, estos sistemas pueden facilitar la detección temprana de lesiones malignas, lo cual es crucial para la planificación terapéutica y la mejora de los resultados clínicos. No obstante, es fundamental que estos modelos sean validados rigurosamente en cohortes diversas y en entornos clínicos reales antes de su implementación generalizada en la práctica urológica(22).
Cáncer de próstata
Según la Agencia Internacional para la Investigación sobre el Cáncer (IARC) de la Organización Mundial de la Salud, el cáncer de próstata representa la segunda neoplasia maligna más frecuente en varones a nivel mundial y una de las principales causas de mortalidad oncológica masculina. En el año 2020, se estimaron 1.414.259 nuevos casos, lo que equivale al 14,1 % de todos los cánceres diagnosticados en hombres, con una tasa de incidencia ajustada por edad de 30,7 por 100.000. En ese mismo periodo, se registraron 375.304 muertes por cáncer de próstata, representando el 3,8 % de todas las defunciones por cáncer en hombres, con una tasa de mortalidad global ajustada de 7,7 por 100.000. La carga de enfermedad es altamente heterogénea a nivel geográfico, observándose mayores tasas de incidencia en regiones como América del Norte, Europa Occidental y Oceanía, y una menor incidencia en Asia y África, aunque estas últimas presentan frecuentemente diagnósticos más tardíos y mayor mortalidad proporcional(24).
El diagnóstico del CP difiere de otros cánceres en órganos sólidos, en que el estudio de imágenes se utiliza para identificar pacientes y lesiones que requieren ser biopsiadas. Está basado en biopsia transrectal bajo ultrasonido (TRUS), con muestreo sistemático de la glándula prostática, sin la identificación de una lesión sospechosa. Pacientes elegidos para esta estrategia incluyen aquellos con antígeno prostático específico (APE) elevado y/o tacto rectal alterado en pacientes sin biopsia previa, pacientes de alto riesgo de presentar un cáncer significativo con biopsia previa negativa y hombres con CP de bajo riesgo en vigilancia activa, que requieren repetir la biopsia sistemática para monitorización de la enfermedad(25).
Sin embargo, múltiples causas de elevación del APE no relacionadas a cáncer, errores intrínsecos en el muestreo y la semirandomización de la biopsia (TRUS), y la amplia diversidad genómica como también de pronóstico del CP, conducen a múltiples impactos clínicos y riesgos elevados para los hombres. Entre ellos destacan una importante proporción de pacientes sometidos a TRUS biopsia que no tienen cáncer detectado; biopsias poco fructíferas incurren en un aumento de la morbilidad sin entregar una seguridad completa de ausencia de enfermedad clínicamente significativa. El sobrediagnóstico de cánceres clínicamente no significativos contribuye a ansiedad innecesaria de los pacientes, llevando a sobretratamientos y problemas inherentes, con mínimos beneficios sólo para un limitado grupo de pacientes. El subdiagnóstico y subtratamiento de cánceres clínicamente significativos también ocurre debido a problemas en el muestreo en las TRUS biopsia y también en errores en la estratificación, contribuyendo a diagnósticos y tratamientos fallidos, especialmente en pacientes elegidos para vigilancia activa(25,26).
Muchas herramientas están siendo desarrolladas para llegar a diagnósticos más certeros del CP. El paradigma clínico emergente es la utilización de avances imagenológicos y moleculares para el diagnóstico y por ende seleccionar de mejor manera pacientes que requieren biopsia. El desarrollo de la idea de la combinación de métricas de APE (APE, densidad de APE (DAPE), velocidad APE), *prostate health index (PHI)*, score 4K y tests de metilación urinaria del gen de CP, pueden actuar como estimadores de riesgo multivariados para identificar pacientes que pueden presentar un CP clínicamente significativo. Sin embargo, los métodos de selección de pacientes por medio de calculadoras de riesgo no pueden localizar en la glándula prostática CP clínicamente significativos, pudiendo ser perdidos en la TRUS biopsia sistemática. El diagnóstico de la biopsia, por lo tanto, puede ser incrementado con la utilización de imágenes, especialmente la Resonancia Magnética Multiparamétrica (RMmp) en la selección de pacientes y dirigiendo la biopsia a una localización sospechosa, reduciéndose el número de pacientes sometidos a este procedimiento y por consecuencia, sobretratamientos de pacientes con cánceres insignificantes. Es por esto que en el centro de todo este desarrollo en los últimos años, se encuentra el rol emergente de la RMmp y de la biopsia dirigida por RM para el diagnóstico del CP y la selección del tratamiento(25,26).
Múltiples estudios y experiencia clínica avalan la combinación de RMmp y biopsia dirigida por RM para la detección y localización de CP clínicamente significativos. Esta estrategia incrementa el diagnóstico de cánceres extensos Gleason score (GS) 3+3 y de intermedio/alto grado (GS≥3+4), utilizando menor número de muestras en la biopsia. Esta estrategia además disminuye la detección de CP insignificantes(26).
Existen numerosos desafíos en la implementación de la RMmp y de la biopsia dirigida en la práctica clínica, incluyéndose la heterogeneidad en la calidad de las imágenes entre los diferentes centros y por lo tanto variación en el rendimiento en la detección de CP. La calidad de la RMmp de próstata depende en las capacidades que tenga el equipamiento de RM (marca del equipo, campo magnético (1.5T, 3T), gradientes, bobina adecuada, software, hardware, parámetros en las secuencias, factores del paciente (medicación, movimientos, gas rectal, implantes metálicos), hemorragia glandular relacionada a biopsia previa y el factor más importante la interpretación radiológica de las imágenes (curva de aprendizaje, subjetividad de la observación, variabilidad interobservador y estilo del reporte). Debido a estos desafíos ha sido necesario el desarrollo de estándares de calidad, imágenes y reporte para la RMmp de próstata y estándares de acreditación en el futuro(27).
El año 2012 fue desarrollado el* Prostate Imaging-Reporting and Data System* **(PI-RADS)**, por un comité conjunto de la American College of Radiology (ACR), European Society of Urogenital Radiology (ESUR) y la AdMeTech Foundation(3,5,). Los objetivos del PI-RADS son estandarizar la terminología y contenidos en los reportes de la RMmp, el desarrollo de categorías que resuman niveles de sospecha de CP clínicamente significativo (PI-RADS 1- 5), asistencia en la selección de pacientes para biopsia dirigida y manejo, establecer parámetros técnico aceptables para la realización de la RMmp y reducir la variabilidad en la interpretación(28).
La RMmp permite, de manera no invasiva, caracterizar anatómica y funcionalmente la glándula prostática, al usar secuencias morfológicas potenciadas en T2 y complementarla con secuencias funcionales de difusión y perfusión. Sin embargo, es importante destacar que una gran variedad de patología benigna y maligna pueden superponer sus características en la RMmp. Por lo tanto, un score PI-RADS 2, no excluye completamente la posibilidad de un CP clínicamente significativo, pero indica que es poco probable. Del mismo modo un score PI-RADS 5 no es prueba de un CP clínicamente significativo, pero indica que es muy posible(28,29).
Estudios de correlación histológica entre la prostatectomía-Rmmp han demostrado una mayor visibilidad de lesiones de alto grado y tamaño sin un patrón cribiforme. Una lesión Gleason 3+3 con un patrón de crecimiento sólido necesita un volumen ≥0.5 ml (aprox. 9-10 mm de diámetro) para ser detectada a diferencia de una lesión índice con un GS ≥ 3+4 que necesita un volumen ≥0.2 ml (aprox. 7-8 mm) especialmente en equipamiento moderno con magnetos de 3T(28).
PI-RADS v2 (2015) y su posterior actualización PI-RADS v2.1 (2019) no apunta a detectar todos los tumores prostáticos, ya que presenta baja sensibilidad para la detección de enfermedad de bajo volumen (<0.5 ml) y CP de bajo riesgo (GS 3+3) (29). Esto permite que la estrategia de RMmp-biopsia dirigida diminuya los sobrediagnósticos y sobretratamientos, como también reduce el número de pacientes sometidos a biopsia que se encuentran en vigilancia activa. Lesiones de alto grado y volumen se detectan con mayor facilidad y presentan categorías de PI-RADS más alto (PI-RADS score 4 y 5). (Figura 4)
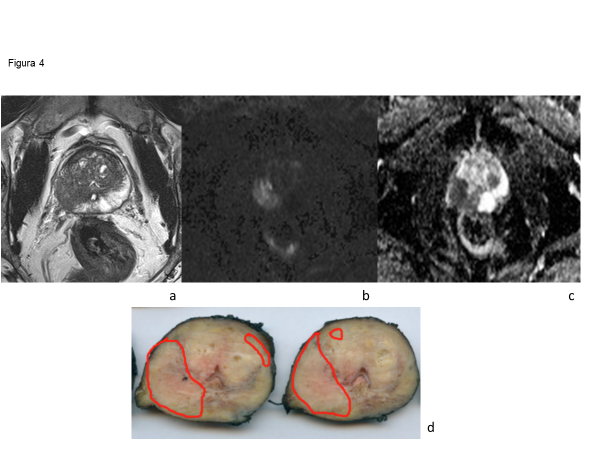
La validación diagnóstica de PI‑RADS versión 2.1 ha sido confirmada en recientes revisiones sistemáticas y metaanálisis. En un análisis que incluyó 1.248 pacientes y 1.406 lesiones, se obtuvo una sensibilidad combinada del 87% (IC 95%: 82–91%) y una especificidad del 74% (IC 95%: 63–82%) para la detección de cáncer de próstata clínicamente significativo (csPCa).
Este rendimiento es congruente con estudios individuales, donde un punto de corte de PI‑RADS ≥ 4 mostró una sensibilidad de 86,2 % (IC 95%: 77,4–91,9%) y una especificidad de 84,7% (IC 95%: 79,6–88,8%).
En cuanto a la prevalencia de csPCa por puntuación, meta-análisis a nivel de lesión indican tasas del 2% (IC 95%: 0–8%) para PI‑RADS 1, 4% (1–9%) para PI‑RADS 2, 20% (13–27%) para PI‑RADS 3, 52% (43–61%) para PI‑RADS 4, y 89% (76–97%) para PI‑RADS 5. A nivel paciente, las tasas son: PI‑RADS 1=3%, PI‑RADS 2=9%, PI‑RADS 3=20%, PI‑RADS 4=70%, PI‑RADS 5≈97%.
Estudios centrados en lesiones PI‑RADS 3 muestran una tasa de csPCa alrededor del 11%, lo que confirma el carácter intermedio de esta categoría y la necesidad de considerar factores adicionales (edad, PSAD, antecedente de biopsias) antes de indicar biopsia(30-33).
Scores en RM de próstata
En la última década la resonancia magnética multiparamétrica (RMmp) ha transformado el diagnóstico del cáncer de próstata, con el sistema PI-RADS como estándar para detección inicial. Sin embargo, nuevos desafíos clínicos han impulsado el desarrollo de sistemas complementarios orientados a contextos específicos. El sistema PI-RADS ha mejorado significativamente la detección del cáncer prostático clínicamente significativo (csPCa), pero presenta limitaciones fuera del contexto diagnóstico inicial. Para abordarlas, se han creado nuevas escalas que responden a necesidades específicas como la calidad de imagen, vigilancia activa o evaluación de recurrencia (PI-QUAL, PRECISE, PI-RR y PI-FAB). Estos nuevos sistemas buscan estandarizar la práctica radiológica y optimizar la toma de decisiones clínicas(34).
**PI-QUAL v2: Calidad de imagen**
El objetivo de este score es evaluar la calidad diagnóstica de los estudios de RMmp.
Se evalúa en una escala de 1 a 3, donde 1 indica calidad no diagnóstica, por lo que el estudio debe ser repetido, 2 calidad aceptable y 3 calidad óptima.
La importancia de utilizar este score es que la mala calidad de imagen se asocia con mayor número de resultados indeterminados y biopsias innecesarias.
**Limitaciones:** Evaluación subjetiva, variabilidad interobservador y escasa aplicabilidad sin contraste intravenoso(35).
**PRECISE v2: Vigilancia activa**
El objetivo de este score es monitorizar la progresión del cáncer prostático en pacientes en vigilancia activa mediante RM seriada.
La evaluación se realiza con una escala de 1–2 (regresión), 3 (estabilidad visible y no visible), 4–5 (progresión).
**Ventajas:** Alta capacidad para excluir progresión; útil para evitar biopsias repetidas.
**Limitaciones:** Falta de estandarización en mediciones, escasa evidencia prospectiva, subjetividad en definir progresión, y variabilidad entre programas de vigilancia activa(36).
**PI-RR: Recurrencia post prostatectomía radical y post radioterapia**
El objetivo es evaluar recurrencia local tras prostatectomía radical o radioterapia.
Se realiza una evaluación con una escala de 1 a 5, basada en hallazgos en T2, DWI y DCE, donde scores 4 y 5 indican mayor probabilidad de recurrencia.
**Fortalezas:** Alta reproducibilidad y precisión diagnóstica.
**Limitaciones:** Exclusión de metástasis a distancia, escasa evidencia prospectiva, dependencia del contraste IV, y necesidad de RM basal para comparación.
**Rol futuro:** Integración con PSMA PET/CT en algoritmos adaptados al riesgo de recurrencia(37).
**PI-FAB: Recurrencia tras terapia focal**
El objetivo de este score es evaluar recurrencia tras tratamientos focales como HIFU o crioterapia.
**Escala:** 1 (seguimiento y continuar con monitorización), 2 (correlación con PSA, seguimiento con RM y eventual biopsia), 3 (biopsia recomendada).
**Datos iniciales:** Alta sensibilidad pero baja especificidad.
**Limitaciones:** Falta de validación robusta, dependencia excesiva del contraste, integración incompleta con otros sistemas como PI-RADS para zonas no tratadas.
**Aplicabilidad clínica:** Requiere más estudios para adopción generalizada.
Estos sistemas complementarios al PI-RADS representan un avance significativo hacia la estandarización de la RM prostática en escenarios clínicos específicos. PI-QUAL y PRECISE ya muestran impacto clínico; PI-RR y PI-FAB emergen como herramientas prometedoras. La validación multicéntrica prospectiva y la integración de inteligencia artificial serán clave para su adopción definitiva.
Cáncer de vejiga
El cáncer de vejiga (CV) es la segunda neoplasia maligna más frecuente del tracto urinario, el cuarto cáncer en hombres y el décimo en mujeres con una relación entre géneros de 4:1. Tiene un peak de incidencia entre 60 y 70 años por lo que se ha considerado clásicamente una enfermedad de personas mayores, sin embargo, la incidencia en pacientes más jóvenes ha ido en aumento y se ha transformado en una de las enfermedades más costosas en su manejo. La gran mayoría de los CV son carcinomas de células uroteliales, clasificándose en cánceres de bajo y alto grado, en músculo invasores (MI) y no músculo invasores (NMI). Los cánceres NMI en general son de bajo grado y por lo general de historia natural indolente(38,39).
El tratamiento del CV tiene como objetivo reducir la recurrencia local y la progresión del estadío de la enfermedad, manteniendo la calidad de vida de los pacientes, bajo una vigilancia estricta para detectar la aparición de invasión muscular. Lesiones de alto grado representan aproximadamente un tercio de los cánceres NMI, sin embargo, pueden progresar a MI y enfermedad metastásica en alrededor de un 20-25% de los pacientes. El éxito del tratamiento depende en el estadío del tumor primario y de la presencia de adenopatías regionales. Se puede llegar a tasas de curabilidad de un 75-80% de los pacientes en enfermedad órgano confinada, de un 60% en estadío T3 con linfonodos negativos y de un 30% con linfonodos positivos(40,41).
El CV en general se diagnostica después de un episodio de hematuria o de síntomas urinarios mixtos, realizándose algún estudio de imágenes (ecografía, tomografía computada, resonancia magnética), confirmándose posteriormente con una cistoscopía flexible. Se realiza una resección transuretral (RTU) del tumor vesical, siendo el tratamiento definitivo de la mayoría de los cánceres NMI y sirve como diagnóstico para la mayoría de los cánceres MI. Una adecuada RTU debe incluir la muscular propia, sin embargo, ocurre subetapificación por pérdida de la infiltración muscular en aproximadamente un 25% de los cánceres invasivos.
La RTU es un método operador dependiente por lo que diferentes tasas de tumor residual se encuentran dependiendo de la experiencia en el procedimiento, lo que refleja resecciones incompletas de tumores vesicales. La re-resección por lo tanto se utiliza en neoplasias de alto grado NMI, previo a quimio-radioterapia por preservación vesical o bien cuando hay diferencias de los hallazgos patológicos y clínicos(41-43).
El rol de las imágenes es fundamentalmente para realizar el diagnóstico de una lesión vesical y también de lesiones sincrónicas en el tracto urinario superior, determinar la presencia de adenopatías regionales y metástasis a distancia(44).
La tomografía computada de abdomen y pelvis con protocolo de urografía (UroTC) es el método de imagen más usado en el estudio de hematuria y en pacientes con diagnóstico de cáncer de vejiga. Las lesiones se pueden presentar como engrosamiento parietal en forma de placa, polipoidea (papilar) o engrosamiento difuso infiltrativo, con reportes de sensibilidad de un 93% y especificidad de un 99. Una de las limitaciones de la TC es la escasa capacidad de diferenciar los diferentes planos de la pared vesical, lo que se traduce en menor certeza en la estadificación local entre 40% y 88%. El rendimiento es menor para estadíos Ta-T2 (77%), y mayor para estadíos T3-T4 (95%). Otra limitación es la incapacidad de diferenciar tumor de edema y fibrosis post tratamiento. La certeza en la detección de extensión extravesical varía entre 40-92%, con baja capacidad de discriminar infiltración neoplásica perivesical de bajo volumen y de diferenciar edema post-tratamiento de infiltración tumoral. La detección de adenopatías metastásicas tiene sensibilidad reportada variable, la cual disminuye de manera importante para micrometastasis. La tomografía computada también da información relevante en cuanto a presencia de metástasis a distancia.
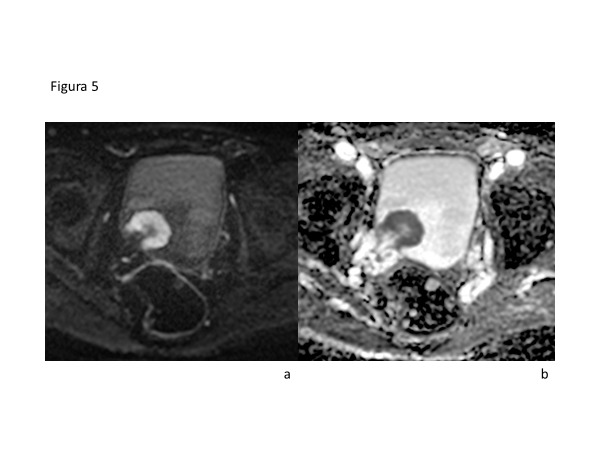
La RMmp de vejiga permite una adecuada estadificación local, ya que es capaz de diferenciar tumores invasores (que invaden músculo detrusor, por lo tanto estadío T2 o superior) de no invasores (T1 o inferior) e identificar la extensión a la grasa perivesical (T3) macroscópica y a órganos adyacentes (T4). Se ha reportado una exactitud de la RM con difusión y contraste intravenoso de hasta un 92% para diferenciar tumores T1 y T2 o mayores(44,45).
Los estudios se pueden realizar tanto en equipos de 1.5T o 3T, con bobina de pelvis de superficie (phased-array) y presencia de vejiga llena. El protocolo óptimo consta de secuencias morfológicas de alta resolución, con una gran capacidad de diferenciar la muscular de una lesión neoplásica como también de la grasa perivesical (secuencias T1 y T2) y secuencias funcionales de difusión y contraste intravenoso con gadolinio, que permiten evaluar el compromiso invasivo de la muscular.
El año 2018 fue desarrollado y publicado el **Vesical Imaging-Reporting and Data System (VI-RADS)**, que busca estandarizar la adquisición y reporte de la resonancia multiparamétrica (RMmp) de vejiga, definiendo el riesgo de invasión muscular, siendo aplicable a pacientes no tratados y a pacientes con resección transuretral diagnóstica. El sistema de puntuación aplicado va desde VI-RADS score 1 – 5, lo que se traduce en “altamente improbable invasión muscular” a “alta probabilidad de invasión muscular y extravesical”, respectivamente. Usando este método se ha reportado un área bajo la curva ROC para invasión muscular de 0,94, con una sensibilidad de 87% y especificidad de 96% para VI-RADS≥3 (invasión equivoca o con alta probabilidad)(45).
La utilización de la RMmp ofrece una oportunidad para reducir errores en la estadificación debido a una mejor visualización antatómica de la pared vesical además de ser un método con ausencia de radiación, lo que permite investigar en forma individual a pacientes en riesgo de CV, como también realizar estudio de imágenes previo, durante y en el seguimiento de respuesta a tratamiento (Figura 5).
Finalmente, el PET-CT con FDG tiene su principal uso en la detección de compromiso linfonodal con sensibilidad de 69% y especificidad de 95%, y de metástasis fuera de la pelvis con sensibilidad y especificad de hasta 70% y 94% respectivamente en pacientes con invasión muscular.
De acuerdo a la información de la literatura y nuevos estudios clínicos, se requiere de estudios imagenológicos para la evaluación del compromiso de la pared muscular vesical y diseminación pelviana ya que la estadificación clínica es insuficiente para diferenciar tumores superficiales versus invasores. La etapificación preoperatoria puede ser el factor más importante para el manejo apropiado de estos pacientes.
Medicina nuclear
Las técnicas de imágenes en medicina nuclear se basan en la administración de un trazador radioactivo que, dado su comportamiento en el organismo, permite evaluar una función o una ruta metabólica determinada. Para su uso en urología, tradicionalmente se dispone de varios radiofármacos, dependiendo del órgano o estructura que se desee evaluar. A continuación se describen los exámenes utilizados más frecuentemente.
PET/CT-PSMA
El PET/CT es una técnica híbrida que incluye la evaluación anatómica del cuerpo completo mediante una tomografía computada (CT) y otra funcional mediante la tomografía por emisión de positrones (PET) en un solo estudio. Para la adquisición del PET se requiere la administración de un radiofármaco, en el caso del estudio del cáncer de próstata, un ligando del antígeno específico de membrana prostático (PSMA) marcado con un radioisótopo, los dos disponibles en la actualidad son Ga68 y F18.
El antígeno específico de membrana prostático corresponde a una proteína transmembrana, a pesar de su nombre, no exclusiva de las células prostáticas, con baja expresión en la superficie de las células prostáticas normales y con sobreexpresión en las cancerígenas. Este radiofármaco, Ga68 o F18- PSMA, se acumula en el interior de las células prostáticas neoplásicas lo cual permite su detección tanto en el tumor primario como en las lesiones metastásicas.
Las potenciales utilidades del PET/CT-PSMA son la evaluación de la recurrencia bioquímica, etapificación de tumores de moderado y alto riesgo, y en la evaluación de respuesta a tratamiento.
Recurrencia bioquímica
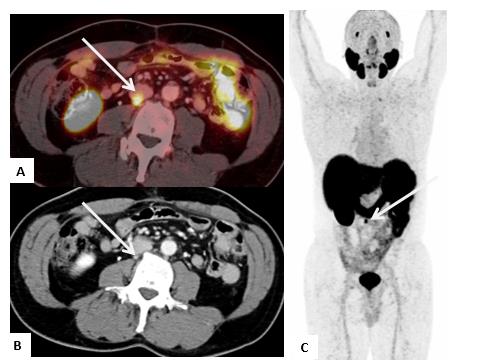
Las imágenes convencionales tienen una capacidad limitada para detectar recurrencia de enfermedad con niveles bajos de antígeno prostático específico (APE). Existe suficiente evidencia que demuestra la alta sensibilidad del PET/CT-PSMA en la evaluación de recidiva bioquímica, incluso con niveles bajos de APE. La tasa de detección de recurrencia se incrementa a medida que asciende el valor del APE, con tasas de 33% con APE < 0,2 ng/ml y 95% con APE > 2 ng/ml(46).
En un estudio de van Leeuwen PJ et al.(23) , el PET/CT-PSMA demostró alto impacto en el manejo de los pacientes con prostatectomía radical y niveles de APE entre 0,05 y 0,99 ng/ml cambiando el manejo en 29% de ellos (Figura 6).
Estadificación
Las guías internacionales no recomiendan el uso del PET/CT-PSMA en la etapificación del cáncer de próstata, sin embargo, existen estudios que han demostrado mayor sensibilidad en la detección de adenopatías metastásicas en comparación a la tomografía computada (TC) en pacientes de riesgo intermedio y alto, con sensibilidad de 66% versus 44% y especificidad de 99% versus 85% respectivamente(48). La menor sensibilidad es debido principalmente a adenopatías secundarias menores de 5 mm.
En relación con la detección de metástasis óseas, un metaanálisis(49) que comparó distintas modalidades de imágenes, entre ellos PET/CT-PSMA y cintigrafía ósea, demostró mayor sensibilidad del PET en la detección, por lesión y por paciente, 88% versus 68% y 97% versus 86% respectivamente, en comparación a la cintigrafía.
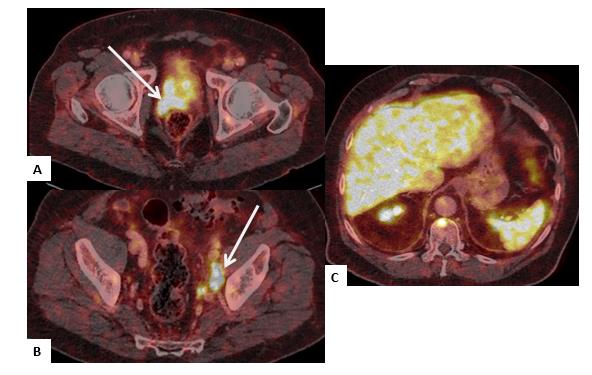
El PET/CT-PSMA también es sensible en la detección de metástasis viscerales, las cuales son menos frecuentes (Figura 7).
Reestadificación
En la evaluación de la respuesta a tratamiento se recomienda el uso de imágenes convencionales como la TC, cintigrafía ósea o resonancia magnética combinado con los niveles de APE, sin embargo, la cintigrafía ósea detecta actividad osteoblástica y no directamente enfermedad tumoral, por lo tanto, puede confundir lesiones reparativas de verdadera persistencia de enfermedad, no así el PET/CT-PSMA. El PET tiene la ventaja de evaluar la respuesta local, nodal y ósea simultáneamente, sin embargo, no existen estudios suficientes que avalen su uso en la evaluación de respuesta a tratamiento. Una de sus limitaciones potenciales es la ausencia de captación en tumores pobremente diferenciados, como aquellos con diferenciación neuroendocrina, los cuales presentan mayor captación con el trazador fluorodesoxiglucosa (FDG) que con él ligando para PSMA.
Cintigrama óseo
El cintigrama óseo permite la obtención de un mapa de la actividad osteoblástica de todo el esqueleto. Esto se logra mediante la administración endovenosa de un compuesto difosfonado marcado con Tecnecio-99m. Las moléculas que más utilizadas son el metilén-difosfonato (MDP) y el hidroxi-metilén-difosfonato (HMDP), siendo el primero el que por lejos predomina. Luego de la administración del radiofármaco por una vía periférica se espera entre 2 y 4 horas para obtener las imágenes una vez que el trazador se haya fijado en el esqueleto. Estos compuestos se absorben sobre la superficie de los cristales de hidroxiapatita, los cuales se encuentran más expuestos en el hueso de neoformación y más abundante en aquellos sitios en que existe importante recambio óseo, lo que producirá una mayor concentración del trazador radioactivo.
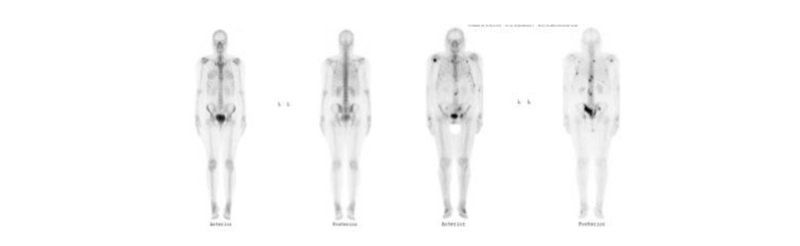
La técnica presenta una alta sensibilidad para la detección de lesiones osteoblásticas, pero una baja especificidad, dado que cualquier patología que genere un mayor recambio óseo provocará una hipercaptación del difosfonato. La alta sensibilidad ha hecho que el cintigrama óseo de cuerpo entero constituya un examen ideal para la detección de metástasis óseas osteoblásticas, como las que ocurren en la mayoría de las lesiones derivadas de un cáncer de próstata.
La probabilidad de compromiso óseo es de menos del 1% en los cánceres con APE<10 ng/ml y ausencia de síntomas de dolor esquelético, y por otro lado es de alrededor de 50% si el APE es >40 ng/ml. Por lo tanto para etapificación inicial se debería solicitar un cintigrama óseo en todo cáncer de próstata con APE>20 ng/ml. El grado de Gleason también se correlaciona con la probabilidad de metástasis en el cintigrama óseo (Gleason menor de 7 v/s Gleason mayor o igual 8) (50,51). En el seguimiento se utiliza el cintigrama óseo para evaluar la presencia de metástasis óseas en caso de elevación de los valores de APE o si aparece dolor óseo sin otra causa que lo explique(52).
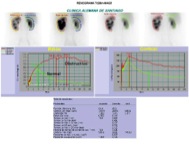
Cintigrama renal dinámico
Este examen consiste en la administración endovenosa de un radiofármaco que se excreta por la orina, permitiendo hacer un análisis en el tiempo de su paso por los riñones, uréteres y vejiga. De este modo se obtienen curvas de tiempo v/s actividad y cuantificación de algunos parámetros que permiten evaluar la permeabilidad de la vía urinaria, la eventual presencia de filtraciones (fístulas) y distinguir entre los mecanismos del compromiso de la función renal de un riñón trasplantado (necrosis tubular aguda v/s rechazo)(53).
El radiofármaco de elección es el MAG-3 (mercapto acetil glicina) que se secreta activamente por las células del túbulo contorneado proximal, lo que permite su uso incluso en pacientes con compromiso moderado de la función renal, o en niños con inmadurez renal fisiológica como ocurre en los recién nacidos o prematuros. Como alternativa se puede utilizar DTPA, cuya única ventaja es su menor costo, pero se obtienen resultados que pueden ser menos categóricos cuando la función renal no es totalmente normal. El examen consiste en la administración del trazador por vía endovenosa y adquisición secuencial de imágenes de la región lumbar durante 30 minutos, con controles post miccionales en caso de apreciarse retención del radiofármaco en el sistema excretor. La indicación principal es en pacientes con dilatación de la vía urinaria, congénita o adquirida, en quienes se desee evaluar la presencia de obstrucción funcionalmente significativa en algún nivel (unión pielo-ureteral, urétero-vesical u otro), la evaluación de fístulas urinarias y la monitorización de la evolución de un riñón trasplantado.
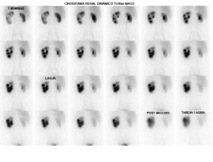
Cintigrama renal estático con DMSA
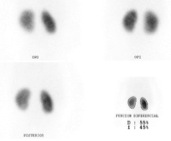
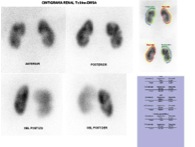
El cintigrama renal estático con ácido dimercaptosuccínico marcado con Tecnecio-99m (DMSA-99mTc) es una herramienta diagnóstica esencial para la evaluación morfológica y funcional cortical renal. Este radiofármaco se fija selectivamente y de manera estable en las células del túbulo contorneado proximal de la corteza renal, permitiendo evaluar la integridad y función parenquimatosa de cada riñón en forma independiente.
El DMSA presenta una sensibilidad superior al 95% para la detección de lesiones corticales renales, especialmente en el contexto de pielonefritis aguda, y para su seguimiento longitudinal (54,55). Aproximadamente el 50% de las lesiones visibles en la fase aguda revierten a los seis meses, y cerca del 60% al año. Solo aquellos pacientes que presentan defectos corticales persistentes en el cintigrama en fase aguda desarrollan cicatrices renales, situación asociada a pielonefritis crónica, que requiere un control más riguroso y, en ocasiones, el uso de antibióticos profilácticos.
Asimismo, el estudio con DMSA permite la detección de riñones ectópicos o displásicos, así como también la cuantificación funcional renal diferencial, información clave para la evaluación prequirúrgica en casos de nefrectomía indicados por tumor renal, pielonefritis crónica u otras patologías unilaterales.
Bibliografía
- Merencian F., Escuder A., Manzanero M., Martínez P., ET AL. Significance of simple radiography of the abdomen in nephritic colic. Actas Urol. Esp. 2000; Feb;24(2):138-43.
- Chan V., Buckley O., Persaud T., Torreggiani W. Urolithiasis: how accurate are plain radiographs? Can Assoc Radiol J. 2008; Jun;59(3):131-4.
- Coleman J., Nascimento R., Solomon S. Advances in imaging for urologic procedures. Nat. Clin. Pract. Urol. 2007; Sep;4(9):498-504.
- A. Hesse et al. Study on the prevalence and incidence or urolithiasis in Germany comparing the years 1979 vs 200. Eur Urol, 2003; 44(6), 709-13.
- J. Dale et al. Imaging Advances in Urolithiasis. Journal of Endourology, 2017; 31, 623-629.
- P. Cheng et al. What the Radiologist Needs to Know about Urolithiasis: Part 1- Pathogenesis, Types Assessment, and Varian Anatomy. AJR, 2012; 198, 540-547.
- A. Kambadakone et al. New and Evolving Concepts in the Imaging and Management of Urolithiasis: Urologist´s Perspective. Radiographics, 2010; 30, 603-623.
- C. Sandhu et al. Urinary Tract Stones-Part I: Role of Radiological Imaging in Diagnosis and Treatment Planning. Clinical Radiology. 2003; 58, 415-421.
- T. Niemann. Diagnostic Performance of Low-Dose CT for the Detection of Urolithiasis: A Meta-Analysis. AJR. 2008; 191. 396-401.
- P. Cheng et al. What the Radiologist Needs to Know about Urolithiasis: Part 2- CT Findings, Reporting, and Treatment. AJR, 2012; 198, 540-547.
- G. Hidas et al. Determination of Renal Stone Composition with Dual-Energy CT: In Vivo Analysis and Comparison with X-ray Diffraction. Radiology. 2010; 257(2). 394-401.
- GBD 2019 Kidney Cancer Collaborators. Global, regional, and national burden of kidney cancer, 1990–2019: a systematic analysis for the Global Burden of Disease Study 2019. Int J Qual Health Care. 2023;36(1):mzad113. doi:10.1093/intqhc/mzad113.
- Bray F, Ferlay J, Soerjomataram I, Siegel RL, Torre LA, Jemal A. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide. CA Cancer J Clin. 2018;68(6):394–424. doi:10.3322/caac.21492.
- Padala SA, Barsouk A, Thandra KC, Saginala K, Mohammed A, Vakiti A, et al. Epidemiology of renal cell carcinoma. World J Oncol. 2021;12(3):62–89. doi:10.14740/wjon1371.
- F. Kay et al. Imaging of Solid Renal Masses. Radiol Clin N Am. 2017; 55(2). 243-258.
- H. Moch et al. The 2016 WHO Classification of Tumours of the Urinary System and Male Genital Organs- Part A: Renal, Penile, and Testicular Tumours. Eur Urol. 2016; 70(1). 93-105.
- T. van Oostenburugge et al. Diagnostic Imaging for Solid Renal Tumors: A Pictorial Review. Kidney Cancer. 2018; 2(2). 79-93.
- A. Mileto et al. Iodine Quantification to Distinguish Clear Cell Carcinoma at Dual-Energy Multidetector CT: A Multireader Diagnostic Performance. Radiology. 2014; 273(3). 813-820.
- MRM. Sun et al. Renal Cell Carcinoma: Dynamic Contrast-Enhanced MR Imaging for Differentiation of Tumor Subtypes-Correlation with Pathologic Findings. Radiology. 2009; 250(3). 793-802.
- D. Canter et al. Utility of the R.E.N.A.L Nephrometry Scoring System in Objectifying Treatment Decision-making of the Enhancing Renal Mass. Urology. 2011; 78(5). 1089-1094.
- Shetty A., Fraum T., Ballard D., Hoegger M., et al. Renal Mass Imaging with MRI Clear Cell Likelihood Score: A User´s Guide. Radiographics 2023; 43(7): e220209.
- Bellin M., Valente C., Bekdache O., Maxwell F., et al. Update on Renal Cell Carcinoma Diagnosis with Novel Imaging Approaches. Cancers 2024, 16, 1926.
- Dai Ch., Xiong Y., Zhu P., Yao L., et al. Deep Learning Assessment of Small Renal Masses at Contrast-enhanced Multiphase CT. Radiology 2024; 311(2): e232178.
- Sung H, Ferlay J, Siegel RL, Laversanne M, Soerjomataram I, Jemal A, Bray F. Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin. 2021;71(3):209–49. doi:10.3322/caac.21660.
- Giganti, F., Rosenkrantz, A. B., Villeirs, G., Panebianco, V., Stabile, A., Emberton, M., & Moore, C. M. (2019). The Evolution of MRI of the Prostate: The Past, the Present, and the Future. AJR. American Journal of Roentgenology, 1–13.
- Padhani, A. R., Weinreb, J., Rosenkrantz, A. B., Villeirs, G., Turkbey, B., & Barentsz, J. (2019). Prostate Imaging-Reporting and Data System Steering Committee: PI-RADS v2 Status Update and Future Directions. European Urology, 75(3), 385–396.
- Barentsz, J. O., Weinreb, J. C., Verma, S., Thoeny, H. C., Tempany, C. M., Shtern, F., et al. (2015). Synopsis of the PI-RADS v2 Guidelines for Multiparametric Prostate Magnetic Resonance Imaging and Recommendations for Use. European Urology, 69(1), 1–9.
- Barkovich EJ, Shavlokhova Y, Westphalen AC. A systematic review of the existing prostate imaging reporting and data system version 2 (PI-RADS v2) literature and performance in prostate cancer detection. AJR Am J Roentgenol. 2019;212(4):847–54. doi:10.2214/AJR.18.20217.
- Turkbey, B., Rosenkrantz, A. B., Haider, M. A., Padhani, A. R., Villeirs, G., Macura, K. J., et al. (2019). Prostate Imaging Reporting and Data System Version 2.1: 2019 Update of Prostate Imaging Reporting and Data System Version 2. European Urology.
- Zhang L, Tang M, Chen S, Lei Y, Xu M, Zhang X. Diagnostic performance of PI-RADS v2.1 for prostate cancer detection: a systematic review and meta-analysis. AJR Am J Roentgenol. 2021;216(5):1165–1173. doi:10.2214/AJR.20.24833.
- Wu R, Luo Y, Qian W, Pan Y, Peng X, Yang Y, et al. Diagnostic performance of multiparametric MRI with PI-RADS v2.1 in the PSA gray zone (4–10 ng/mL): a prospective multicenter study. Sci Rep. 2024;14:4479. doi:10.1038/s41598-024-57337-y.
- Alabousi M, Ghai S, Kassam Z, Lim C, Hansen R, Klotz L, et al. PI-RADS v2 and v2.1: a systematic review and meta-analysis on clinically significant prostate cancer detection by category. Prostate Cancer Prostatic Dis. 2021;24:372–381. doi:10.1038/s41391-021-00417-1.
- Sivananthan D, Dovey Z, Punwani S, Barwick T. Review of clinically significant cancer in lesions labeled PI-RADS 3 on MRI using PI-RADS v2.1. Appl Radiol. 2023.
- Basso Dias A, Chang SD, Fennessy FM, Ghafoor S, Ghai S, Panebianco V, Purysko AS, Giganti F. New Prostate MRI Scoring Systems (PI-QUAL, PRECISE, PI-RR, and PI-FAB): AJR Expert Panel Narrative Review. AJR Am J Roentgenol. 2024 Apr 3. Accepted manuscript. doi:10.2214/AJR.24.30956.
- de Rooij M, Allen C, Twilt JJ, Thijssen LCP, Asbach P, Barrett T, et al. PI-QUAL version 2: an update of a standardised scoring system for the assessment of image quality of prostate MRI. Eur Radiol. 2024. doi:10.1007/s00330-024-10795-4
- Englman C, Maffei D, Allen C, Kirkham A, Albertsen P, Kasivisvanathan V, et al. PRECISE Version 2: Updated Recommendations for Reporting Prostate Magnetic Resonance Imaging in Patients on Active Surveillance for Prostate Cancer. Eur Urol. 2024. doi: 10.1016/j.eururo.2024.03.014
- Panebianco V, Villeirs G, Weinreb JC, Turkbey BI, Margolis DJ, Richenberg J, et al. Prostate Magnetic Resonance Imaging for Local Recurrence Reporting (PI-RR): International Consensus-based Guidelines on Multiparametric Magnetic Resonance Imaging for Prostate Cancer Recurrence after Radiation Therapy and Radical Prostatectomy. Eur Urol Oncol. 2021;4(6):868–76. doi:10.1016/j.euo.2021.01.003.
- Svatek RS, Hollenbeck BK, Holmang S, et al. The economics of bladder cancer: costs and considerations of caring for this disease. Eur Urol 2014;66:253–62.
- Antoni S, Ferlay J, Soerjomataram I, Znaor A, Jemal A, Bray F. Bladder cancer incidence and mortality: a global overview and recent trends. Eur Urol 2017;71:96–108.
- Soukup V, Capoun O, Cohen D, et al. Prognostic performance and reproducibility of the 1973 and 2004/2016 World Health Organization grading classification systems in non-muscle-invasive bladder cancer: a European Association of Urology Non-muscle Invasive Bladder Cancer Guidelines Panel systematic review. Eur Urol 2017;72:801–13.
- Linton KD, Rosario DJ, Thomas F, et al. Disease specific mortality in patients with low risk bladder cancer and the impact of cystoscopic surveillance. J Urol 2013;189:828–33.
- Babjuk M, Bohle A, Burger M, et al. EAU guidelines on non-muscle invasive urothelial carcinoma of the bladder: update 2016. Eur Urol 2017;71:447–61.
- Fonteyne V, Ost P, Bellmunt J, et al. Curative treatment for muscle invasive bladder cancer in elderly patients: a systematic review. Eur Urol 2018;73:40–50.
- Verma, S., Rajesh, A., Prasad, S. R., Gaitonde, K., Lall, C. G., Mouraviev, V., et al. (2012). Urinary bladder cancer: role of MR imaging. RadioGraphics, 32(2), 371–387.
- Panebianco, V., Narumi, Y., Altun, E., Bochner, B. H., Efstathiou, J. A., Hafeez, S., et al. (2018). Multiparametric Magnetic Resonance Imaging for Bladder Cancer: Development of VI-RADS (Vesical Imaging-Reporting And Data System). European Urology, 74(3), 294–306.
- Perera M, Papa N, Roberts M, Williams M, Udovicich C, Vela I, et al. Gallium-68 Prostate-specific Membrane Antigen Positron Emission Tomography in Advanced Prostate Cancer—Updated Diagnostic Utility, Sensitivity, Specificity, and Distribution of Prostate-specific Membrane Antigen-avid Lesions: A Systematic Review and Meta-analysis. European Urology. 2019 Feb.
- van Leeuwen PJ, Stricker P, Hruby G, Kneebone A, Ting F, Thompson B, et al. 68 Ga-PSMA has a high detection rate of prostate cancer recurrence outside the prostatic fossa in patients being considered for salvage radiation treatment. BJU Int. 2016 May;117(5):732–9.
- Maurer T, Gschwend JE, Rauscher I, Souvatzoglou M, Haller B, Weirich G, et al. Diagnostic Efficacy of 68 Gallium-PSMA Positron Emission Tomography Compared to Conventional Imaging for Lymph Node Staging of 130 Consecutive Patients with Intermediate to High Risk Prostate Cancer. Journal of Urology. 2016 May;195(5):1436–43.
- Zhou J, Gou Z, Wu R, Yuan Y, Yu G, Zhao Y. Comparison of PSMA-PET/CT, choline-PET/CT, NaF-PET/CT, MRI, and bone scintigraphy in the diagnosis of bone metastases in patients with prostate cancer: a systematic review and meta-analysis. Skeletal Radiol. 2019 May 24.
- Oyen W., Witjes J., Corstens F. Nuclear medicine techniques for the diagnosis and therapy of prostate carcinoma. Eur Urol. 2001 Sep; 40(3):294-9
- Jaukovic L., Adjinovic B., Cerovic S., Joksimovic M., et al. Is bone scintigraphy necessary in initial staging of prostate cancer patients? Hell J Nucl Med. 2011 May-Aug;14(2):126-30
- Jana S., Blaufox M. Nuclear medicine studies of the prostate, testes, and bladder. Semin Nucl Med. 2006 Jan;36(1):51-72
- Sfakianaki E., Sfakianakis G., Georgiou M., Hsiao B. Renal scintigraphy in the acute care setting. Semin Nucl Med. 2013 Mar;43(2):114-28. doi: 10.1053/j.semnuclmed.2013.01.001
- Rushton H., Majd M. Dimercaptosuccinic acid renal scintigraphy for the evaluation of pyelonephritis and scarring: a review of experimental and clinical studies. J Urol 1992 Nov;148(5 Pt 2):1726-32
- Donoso R., Lobo S., Arnello V., Arteaga M., et al. Renal scars after one year of follow up in children with a first episode of acute pyelonephritis. Rev Méd Chile 2006; 134: 305-311.

