El cáncer de pene es una neoplasia epitelial poco frecuente en nuestro medio. La mayoría de los cánceres invasores de pene corresponden al carcinoma de células escamosas (95%) originada en el epitelio de la porción interna del glande y/o del prepucio (1). A pesar de su baja frecuencia generalmente implica consecuencias físicas y psicológicas importantes a quienes lo padecen. Su evolución natural y anatomía patológica es similar a la de otros cánceres epiteliales como el cáncer de bucofaringe, el de cuello uterino, vagina, vulva y ano.
Un conocimiento más acabado de la progresión de la enfermedad, el diagnóstico cada vez más precoz y el conocimiento acumulado de grupos de investigación han mejorado las tasas de curación de este cáncer desde 50% en los años 90 a 2000 a un 80% en los últimos años en centros oncológicos de excelencia.
EPIDEMIOLOGÍA
La incidencia de cáncer de pene varía en forma significativa entre países, siendo los países subdesarrollados los que ostentan las tasas más altas. La incidencia mundial se detalla en tabla 1 por zona geográfica. En Estados Unidos, Canadá y los países europeos el cáncer de pene representa el 0,4 – 0,6 % de todas las neoplasias en el hombre, mientras que en países como Uganda e India corresponde al 10 – 20 % de todos los tumores. La prevalencia mundial el año 2020 fue de 0.94/100.000 habitantes; la más baja se encuentra en Israel con una tasa ajustada por edad de 0,1/100.000 habitantes debido a las prácticas de circuncisión neonatal de rutina por motivos religiosos (2). No existe incidencia reportada en nuestro país, salvo por reportes aislados como el del año 2004 en Atacama con incidencia de 2.52/100.000 o Valdivia con una incidencia ajustada por edad de 0.7 por 100.000 habitantes (3). En la tasa global estimada de nuevos casos, el 25% se atribuye a la infección por virus papiloma humano (VPH), sin embargo, aproximadamente un 30-50% de los tumores escamosos invasores de pene se asocian a este virus, principalmente al VPH 16 (4). Debido a la baja prevalencia de la enfermedad en los países industrializados donde se desarrollan habitualmente las guías clínicas, suele haber baja calidad de evidencia al momento de determinar las distintas conductas. Uno de los hitos que ha permitido mejorar el pronóstico de la enfermedad en los últimos años es la centralización de la patología en centros de alto volumen (5).
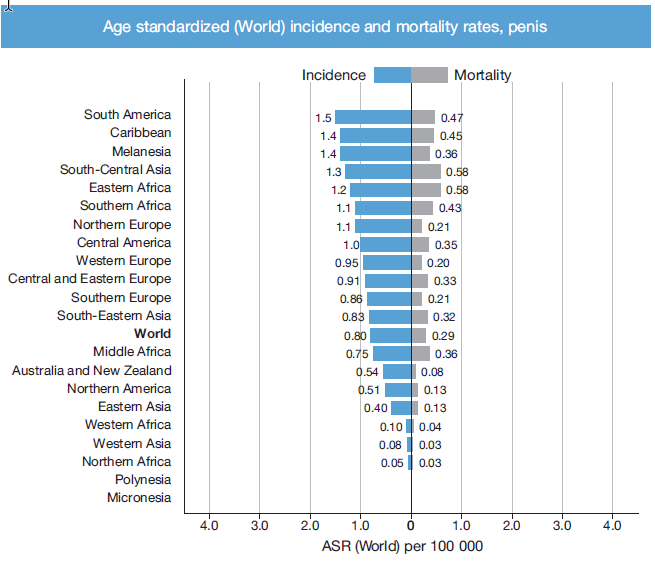
Tabla 1. Incidencia de cáncer de pene y mortalidad en el mundo estandarizado por edad (por 100.000 hab. (2)
FACTORES DE RIESGO
La incidencia de cáncer de pene varía en relación a factores protectores, como las políticas de circuncisión rutinaria, los hábitos de higiene y posiblemente la vacunación; factores de riesgo, como la presencia de lesiones premalignas, exposición a tabaco, número de parejas sexuales e infección por VPH, estas últimas íntimamente relacionadas.
Fimosis: El factor de riesgo más importante es la presencia de fimosis. Una historia de fimosis está presente en el 20% al 60% de los pacientes con cáncer de pene. Además,está fuertemente asociada con carcinoma invasor de pene (OR 16) no así con carcinoma in situ (OR 1,7) (6). Hombres no circuncidados y aquellos circuncidados en la adultez tienen mayor riesgo de presentar tumores en el glande que aquellos circuncidados en la niñez (7).
Infección por VPH: La infección por VPH es un factor importante en la patogenia del cáncer de pene, siendo los serotipos más frecuentemente asociados el 16 (60.23%), 18 (13.35%), 6 y 11 (combinados 8.13%) (8). La prevalencia general de infección por VPH oscila entre 30 y 50%. El 100% de los carcinomas de células escamosas del cérvix uterino están relacionados con infección por HPV, mientras que un 30% a un 50% de los tumores epidermoides invasores del pene presentan esta relación (6). La mayor prevalencia de HPV está relacionada con el tipo histológico basaloide (76%) y verrucoso (24.5%), y es inusual en los tipos clásico y papilar (9).
Tabaquismo: El tabaquismo es un factor de riesgo para el cáncer de pene (OR 1.44). El riesgo aumenta entre aquellos que fuman más de 10 cigarrillos diarios (OR 2.14), en los que han fumado por más de 5 años (OR 1.43), y aquellos con índice paquetes- años mayor a 30 (OR 1.86) (10). Por otro lado, el tabaquismo se asocia a mayor riesgo de tumores invasores, siendo mayor en aquellos con tabaquismo activo (OR 4.5) que aquellos con tabaquismo previo (OR 1.8) (7)
Lesiones de pene y balanitis crónicas: Múltiples autores han publicado incremento en el riesgo de carcinoma in situ (OR 23) y cáncer de pene invasor (OR 4,6) en pacientes con antecedentes de laceraciones en pene. La historia de balanitis crónica es común en pacientes con cáncer invasor con un OR de 9,46 (11).
Verrugas genitales: La presencia de verrugas genitales al menos dos años antes de la lesión peneana, incrementa el riesgo para carcinoma in situ y cáncer de pene invasor en OR 1,7 y 3,7 respectivamente. Un 25,7% de los hombres con cáncer de pene tenían historia de verrugas genitales comparado con el 4,8% de los controles (OR 7,6) (7).
FACTOR PROTECTOR
Vacuna Nonavalente: La vacuna nonavalente cubre los tipos 6, 11, 16, 18, 31, 33, 45, 52 y 58. Está demostrado que la vacunación con esquema 0, 2 y 6 meses en hombres ofrece protección a largo plazo contra las cepas que causan el 90% de los cánceres relacionados con el VPH, el 80% de las lesiones precancerosas y el 90% de las verrugas anogenitales. (12, 13)
Debido a que la vacunación para VPH aún no está masificada mundialmente hay poca evidencia que permita afirmar con certeza que la vacuna contra el VPH puede prevenir el cáncer de pene, sin embargo, la vacunación es recomendada (14)
Lesiones premalignas.
Eritroplasia de Queyrat: Se presenta como una placa lisa, brillante y eritematosa en la zona del glande y surco balanoprepucial, su presentación clínica es variable; desde indolora hasta muy dolorosa en presencia de erosiones. La transformación a cáncer de pene se ha reportado en el 33% de los casos (15).
Enfermedad de Bowen: Histológicamente indistinguible de la eritroplasia de Queyrat, afecta a la piel no mucosa del pene, se presenta como una placa eritemato-escamosa plana o ligeramente solevantada, puede presentar ulceraciones, hiperqueratosis e hiperpigmentación. Está reportada su transformación a cáncer de pene en un 5% de los pacientes (16).
Papulosis bowenoide: Se presenta en jóvenes sexualmente activos y está asociada a la infección por papiloma virus 16. Las lesiones son pápulas pruriginosas, que pueden formar placas, se encuentran con preferencia en el pubis y son raras en el prepucio. La transformación de estas lesiones en cáncer de pene es menor al 1% (16).
Condiloma acuminado gigante: Es la confluencia de condilomas acuminados que pueden afectar cualquier parte de la zona ano-genital. Tienen una fuerte asociación con infección por VPH 6 y 11 (17).
Liquen escleroso: Es una condición inflamatoria crónica de la piel de origen desconocido. Se presenta como placas blanquecinas el prepucio y glande. Existe una fuerte asociación entre liquen escleroso y cáncer de pene, siendo de 2% a 8% dependiendo de las series (18).
HISTORIA NATURAL
Los sitios más comunes de presentación del cáncer de pene son el glande (48%), el prepucio (21%) y glande junto a prepucio simultáneamente (9%). Por lo general la consulta al especialista es tardía, con un 25% al 50% de los pacientes con lesiones peneanas de un año de evolución al momento del diagnóstico.
La fascia de Buck actúa como una barrera natural a la extensión local del tumor. Cuando la fascia de Buck es traspasada, el tumor penetra a los cuerpos cavernosos y produce permeación al sistema linfático. El drenaje linfático del pene es a los linfonodos inguinales superficiales y profundos, pasando luego a los linfonodos pélvicos. La infiltración de los linfonodos inguinales superficiales puede producir ulceración e infección de la piel, y la infiltración de los linfonodos profundos puede comprometer los vasos femorales y producir hemorragias exanguinantes. Los pacientes con cáncer de pene no tratado mueren en promedio a los 2 años del diagnóstico, usualmente por complicaciones derivadas de un crecimiento locorregional no controlado o por metástasis a distancia. Metástasis a distancia sin compromiso locorregional son raras (19).
PATOLOGÍA
Anatomía del pene para la etapificación patológica.
Para un manejo e interpretación adecuada de las piezas quirúrgicas es importante comprender la anatomía del pene. Los tumores se pueden originar en el glande (la mayoría), en el surco coronal (raramente son solo de esta zona) o la piel del prepucio (más frecuentemente la piel interior del prepucio). Es importante la determinación del sitio del tumor porque el glande y la piel prepucial albergan diferentes capas anatómicas lo que da una etapa patológica específica para cada una como se expone más adelante en el detalle de la etapificación TNM. En sitios con epitelio transicional (como también en el cérvix y el canal anal), es más frecuente que se desarrollen carcinomas mal diferenciados relacionados con HPV. En el pene aparecen en el glande y meato uretral (tumores centrales) mientras que carcinomas queratinizantes de bajo grado son más prevalentes en la piel prepucial (tumores periféricos).
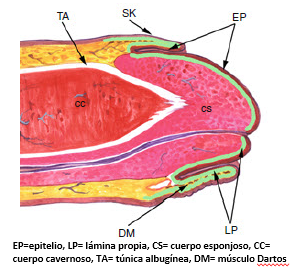
Fig. 1. Anatomía peneana, Cubillas, 2009 (20)
El sistema de clasificación TNM está basado en la extensión de la invasión tumoral en los niveles anatómicos. Existe una correlación entre el pronóstico y la profundidad del tumor o su grosor. Por tanto, es importante para el patólogo tener clara la anatomía tal como se aprecia en la Figura 1 (20). El nivel de la piel prepucial incluye zonas del epitelio escamoso, lámina propia, músculo dartos y la piel exterior. En el glande existe epitelio escamoso, lámina propia, cuerpo esponjoso y cuerpo cavernoso. El cuerpo cavernoso está subdividido por la túnica albugínea que se considera parte de él. Para la adecuada evaluación de los márgenes de resección estos sitios anatómicos deberían ser bien identificados (21).
ETAPIFICACIÓN PATOLÓGICA
La nueva etapa patológica TNM de 2017 se detalla en la tabla 2. En su octava edición, el cáncer de pene presenta un cambio en la categoría Ta incluyendo en ésta el carcinoma verrucoso y escamoso localizado no invasor. Además, en la categoría T1 se agrega la diferenciación por estructura según segmento peniano comprometido, así como los diferentes niveles de invasión y su grado histológico (Tabla 2) (22). Una segunda modificación a destacar es la separación en diferentes categorías de la invasión del cuerpo esponjoso (T2) del compromiso de cuerpo cavernoso (T3).

| Tabla 2. Etapificación TNM 2017, AJCC (22)
|
||
ANATOMÍA PATOLÓGICA
Respecto de la etapificación patológica (etapificación quirúrgica) para cáncer de pene de la AJCC de enero 2017, se presenta la agrupación por etapas. Es la más reciente. Sirve sobre todo para el carcinoma escamoso que lejos es el más frecuente.
| Etapa AJCC | Agrupación por
Etapa |
Descripción de la etapa |
| 0 (0is ó 0a) | Tis ó Ta
N0M0 |
Se conoce como carcinoma in situ ó CIS. El tumor está sólo en la capa más superficial de la piel y no tiene crecimiento en profundidad.
El cáncer no se ha diseminado a los ganglios linfáticos vecinos (N0) o con metástasis a distancia (M0) |
| I | T1aN0M0 | El tumor ha crecido a tejido justo bajo la capa superficial de la piel
No ha crecido próximo a vasos sanguíneos vasos linfáticos o nervios y no es de alto grado /grado 3) (T1a) El cáncer no se ha diseminado a los ganglios linfáticos vecinos (N0) o con metástasis a distancia (M0) |
| T1bN0M0 | El tumor ha crecido en el tejido justo bajo la capa superior de la piel
Ha crecido hacia los vasos sanguíneos cercanos, vasos linfáticos o nervios, y/o es de alto grado (grado 3) (T1b) El cáncer no se ha diseminado a los ganglios linfáticos vecinos (N0) o con metástasis a distancia (M0) |
|
| IIA | Ó | |
| T2NoMo | El cáncer ha crecido en el cuerpo esponjoso con o sin invasión uretral
El cáncer no se ha diseminado a los ganglios linfáticos vecinos (N0) o con metástasis a distancia (M0) |
|
| IIB | T3N0M0 | El cáncer invade el cuerpo cavernoso con o sin invasión uretral
El cáncer no se ha diseminado a los ganglios linfáticos vecinos (N0) o con metástasis a distancia (M0) |
| IIIA | T1-T3N1M0 | El tumor ha crecido en profundidad y puede comprometer el cuerpo esponjoso o el cuerpo cavernoso (T1 – T3)
El cáncer se ha diseminado a 1 o 2 ganglios inguinales en el mismo lado del cuerpo (N1). No existen metástasis a distancia (M0) |
| IIIB | T1-T3 N2 M0 | El tumor ha crecido en profundidad y puede comprometer el cuerpo esponjoso o el cuerpo cavernoso (T1 – T3)
El cáncer se ha diseminado a 3 o más ganglios inguinales en el mismo lado del cuerpo o a ganglios inguinales de ambos lados |
| IV | T4 cualquier N
M0 |
El tumor ha crecido próximo a estructuras tales como escroto, próstata o hueso púbico (T4)
El cáncer puede o no haberse diseminado a ganglios linfáticos vecinos (cualquier N). No se ha diseminado a distancia (M0) |
| Ó | ||
| Cualquier TN3M0 | El tumor puede o no haber crecido a las capas profundas del pene o de las estructuras vecinas (cualquier T)
El cáncer se ha diseminado a los ganglios de la pelvis o ha crecido fuera de los ganglios y hacia el tejido próximo (N3). No se ha diseminado a distancia (M0) |
|
| Ó | ||
| Cualquier T, cualquier N M1 | El tumor puede o no haber crecido a las capas profundas del pene o de las estructuras vecinas (cualquier T)
El cáncer puede o no haberse diseminado a ganglios linfáticos vecinos (cualquier N) El cáncer se ha diseminado a partes distantes del cuerpo (M1) |
|
Tabla 3. Etapificación TNM 2017, AJCC (22)
Aproximadamente el 95% de los casos corresponden a carcinoma epidermoide (CE) originado en la mucosa del prepucio, glande o surco coronal (aprox. 90%) pero rara vez en el cuerpo del pene (aprox. 10%) (23). Menos frecuentes son el melanoma y el carcinoma basocelular. Existen también lesiones con un riesgo elevado de aparición de carcinoma epitelial de pene, considerando que hasta un tercio puede transformarse en carcinoma invasor: se trata de la neoplasia intraepitelial de pene (carcinoma in situ) que incluye la eritroplaquia de Queyrat, la enfermedad de Bowen y papulosis bowenoide, entidades descritas previamente.
Dentro del carcinoma epidermoide existen diferentes variedades de presentación:

Fig. 2. Variedades de presentación de carcinoma epidermoide.
Por otra parte, el CE tiene diferentes patrones de crecimiento: (Fig 3.)
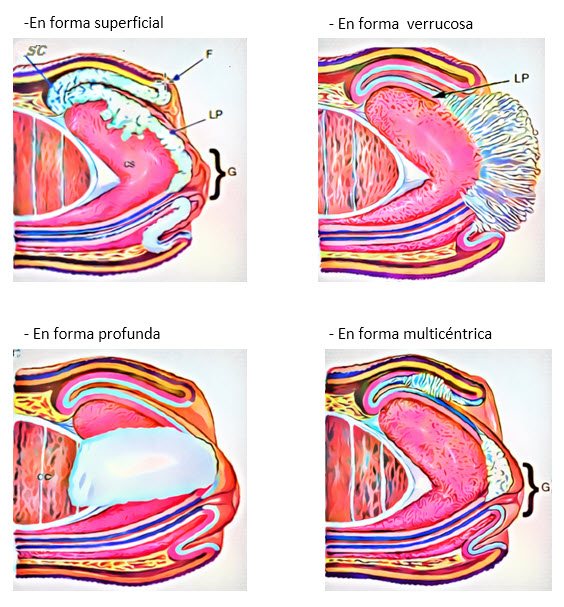
Fig. 3. Patrones de crecimiento de tumores peneanos Cubillas A: Am J Surg Path 2001, 25(20):1091-94
Los tumores con crecimiento superficial muestran una baja incidencia de metástasis inguinales. Los tumores verrucosos tienen excelente pronóstico pese a que a veces presentan gran tamaño e invasión en profundidad; esto principalmente debido a su histología de bajo grado. Los tumores con crecimiento en profundidad tienen el peor pronóstico con alta tasa de metástasis. En presencia de lesiones multicéntricas se consideran como focos independientes de carcinoma no continuos afectando uno o más de los compartimentos anatómicos, son generalmente superficiales y de bajo grado (23).
Grado histológico
El American Joint Committee on Cancer (AJCC) recomienda la graduación histológica de los carcinomas epidermoides de pene de acuerdo a la clasificación establecida por la OMS y la Sociedad Internacional de Patología Urológica (24); Las lesiones bien diferenciadas corresponden a grado 1, moderadamente diferenciadas a grado 2 y poco diferenciadas a grado 3. La presencia de células anaplásicas en cualquier proporción otorga la categoría de grado 3. El nivel de diferenciación es un factor pronóstico de invasión local y de presencia de metástasis a distancia (25).
La profundidad de la invasión y el grosor del tumor son factores pronósticos patológicos relevantes en el resultado. Tumores que invaden menos de 5 mm tiene bajo riesgo de metástasis. Tumores que invaden más de 10 mm muestran una alta incidencia de metástasis ganglionares (80%). En estos casos se debe considerar la invasión perineural y el grado histológico.
Los diferentes subtipos histológicos presentan diferentes riesgos de presentar metástasis ganglionares, los tumores verrugosos un 18,2%, el carcinoma epitelial clásico un 56,7% y el carcinoma sarcomatoide un 89% (26).
Recientemente se han descrito factores pronósticos moleculares. El Ki-67 es un marcador de proliferación celular que se ha descrito que puede orientar respecto a la sobrevida cáncer específica (CSS). En un metaanálisis reciente se describe HR de 1.96 (95% CI 1.15-3.32) para CS (27).
En la última guía de la EAU/ASCO de 2023, respecto de la anatomía patológica se realizan las siguientes recomendaciones: (28)
| Recomendaciones | Fortaleza de la recomendación |
| La evaluación patológica de las muestras de cáncer de pene deben incluir la etapa pTNM y medición del grado tumoral | Fuerte |
| La evaluación patológica de las muestras de cáncer de pene deben incluir una medición de p16 por inmunohistoquímica | Fuerte |
| La evaluación patológica de los especímenes de cáncer de pene debiera seguir el formato de reporte del International Collaboration on Cancer Reporting (ICCR) | Fuerte |
Tabla 4. EAU/ASCO Collaborative Guidelines on Penile Cancer 2023
EXAMEN FÍSICO
La palpación del pene es fundamental para evaluar el tumor primario (glande, prepucio, cuerpo del pene), definir sus límites en relación a otras estructuras (uretra, cuerpo esponjoso y cuerpo cavernoso), su tamaño, número de lesiones y su morfología (plana, papilar, nodular, ulcerada). Esta evaluación puede estar distorsionada por infección local y edema periférico que puede sobreestimar el grado de infiltración. Se ha estimado que hasta en un 26% de los pacientes puede tener una etapificación clínica inexacta del tumor primario (con una sub-etapificación de 10% y una sobre-etapificación de 16%).
La presencia de invasión tumoral del cuerpo cavernoso y la extensión de metástasis inguinales son factores de mal pronóstico. El pronóstico de tumores del glande con invasión sólo de la uretra distal es mejor que los tumores que invaden los cuerpos cavernosos (29).
En la primera consulta se debe determinar si hay ganglios inguinales palpables. Estos están presentes en el 24-64% de los pacientes y en aproximadamente la mitad de ellos se encuentran ganglios metastásicos, siendo el compromiso unilateral en el 75% y bilateral en el 25%. En el resto la adenopatía es secundaria a inflamación. El examen físico inguinal en ambos lados debe ser particularmente cuidadoso en los cuadrantes superiores de los ganglios inguinales superficiales. La palpación se debe enfocar en los cuadrantes sobre la ingle, recordando que el grupo ganglionar medial superior yace lateral al cordón espermático ipsilateral. Se debe anotar su número, si son uni o bilaterales, tamaño, si están móviles o fijos y su relación con estructuras vecinas; se debe describir si hay edema del escroto, del pene o de las piernas. Debemos destacar que el examen físico no puede predecir la presencia de metástasis ganglionares en ausencia de ganglios palpables.
DIAGNÓSTICO Y ETAPIFICACIÓN
Utilizando el sistema TNM, del tumor inicial y los ganglios regionales se debe establecer la etapa de la enfermedad con el fin de definir el tratamiento adecuado.
La etapificación clínica, se inicia con el examen físico que sigue siendo un buen método para determinar extensión tumoral. Esto se complementa con una TC o RNM de abdomen y pelvis y se debe considerar un PET/CT-FDG desde la base del cráneo a la sección media de la pierna en pacientes con sospecha de enfermedad ganglionar inguinal (22).
Lesión primaria
Respecto de la etapificación del tumor primario el ultrasonido es una posibilidad por su amplia disponibilidad y bajo costo. Debido a la alta resolución espacial el ultrasonido puede delinear la extensión local del tumor y establecer la potencial invasión en el cuerpo cavernoso y/o uretra (30), sin embargo, la mayor utilización del ultrasonido es en la evaluación de adenopatías inguinales. Sirve para el diagnóstico y como guía para la biopsia percutánea (31).
En aquellos pacientes candidatos a cirugía conservadora se puede establecer el compromiso de cuerpo esponjoso, cavernoso o uretra mediante uso de RNM con erección inducida farmacológicamente (prostaglandina). La sensibilidad y especificidad de la RNM para predecir invasión de túnica albugínea es de 82% y 62.5% respectivamente y para invasión uretral es de 73% y 82% (32).
Estudios recientes han establecido que el uso de ultrasonido doppler peneano tiene resultados similares a la RNM en detección de invasión de cuerpos cavernosos a un costo menor. Se debe considerar que los estudios emplearon resonador 1.5 T. Por otra parte, el ultrasonido es muy operador dependiente (30)
Etapificación imagenológica
La TC de tórax, abdomen y pelvis (TAC-TAP) es la modalidad utilizada con más frecuencia porque provee imágenes de alto contraste de los tejidos blandos con gran resolución espacial para la detección de metástasis. Es más económica que la RNM o el PET/CT. Para la NCCN el estudio inicial debe contemplar cortes transversales de imagen. TC o RNM con contraste de abdomen y pelvis, TC o Rx de tórax con contraste y TC o RNM con contraste de pelvis para evaluación ganglionar (22).
Dada la prevalencia de metástasis ganglionares existe un interés considerable en el uso del PET/CT. El radiotrazador más usado es el 18 fluorodeoxiglucosa (FDG), este radiotrazador es excretado por la orina, un hecho importante dado que una alta concentración del trazador en la vejiga y contaminación externa de orina radioactiva en el pene y la piel local puede imitar o aún ocultar una lesión maligna. Ganglios inguinales inflamados pueden imitar malignidad. Las guías NCCN de 2024 no considera el PET/CT en el estudio inicial, pero si en la etapificación (22). También es la técnica de elección en pacientes con insuficiencia renal o alergias que contraindican la administración de contraste EV (33).
EL PET-CT para la evaluación de la lesión primaria aún se encuentra en estudio sin existir indicación para esto; algunos estudios han determinado que el valor máximo de absorción estandarizada (SUVmax) del tumor primario es mayor en tumores avanzados y se correlaciona con patología adversa como invasión linfovascular, mayor infiltración y grado histológico. Estos resultados son aún experimentales y además los valores de SUVmax dependen de variables como el protocolo de escaneo y tipo de escáner utilizado por lo que los valores exactos pueden diferir entre diferentes instituciones en que se realizan estos estudios (34)
Biopsia de pene
Es necesaria una biopsia cuando hay dudas acerca de la naturaleza de la lesión o cuando el tratamiento de los ganglios linfáticos se basa en la información histológica preoperatoria (estrategia adaptada al riesgo). En estos casos se debe realizar una biopsia excisional. Esta provee el máximo de información respecto del tipo histológico, grado citológico, patrón de crecimiento, grosor del tumor y la presencia de compromiso linfático, vascular e invasión perineural (35).
Ganglios linfáticos Regionales
El compromiso linfonodal y la extensión de este ha sido identificado como el factor pronóstico individual de sobrevida más importante en el carcinoma invasor de pene (36). Como previamente fue detallado es fundamental realizar un examen físico inguinal cuidadoso con el fin de identificar linfonodos clínicamente palpables.
Pacientes cN0 tiene un riesgo de 13% a 25% de presentar micrometástasis; por otro lado, pacientes con cN+ tienen un 20-40% de riesgo de no presentar metástasis lo cual se debe a aumento de volumen linfonodal inflamatorio (37). La etapificación clínica dependerá de la presencia o ausencia de linfonodos palpables.
Linfonodos palpables (cN+)
En este escenario clínico se debe describir la localización, consistencia, tamaño, si es único o son múltiples y si existe adherencia a estructuras vecinas o son móviles. En el caso de existir ganglios palpables no es necesaria la imagenología dirigida a estos debido a que no altera el abordaje terapeútico.
La presencia de linfonodos palpables implica la evaluación histológica de estos. Prácticas previas que implican el tratamiento antibiótico y evaluación de respuesta clínica antes de la evaluación histológica no son recomendadas excepto en presencia de infección clínica.
Estudios recientes con PET-CT 18-FDG han mostrado alta sensibilidad (88-100%) y especificidad (98-100%) para confirmar metástasis en presencia de ganglios palpables. La precisión diagnóstica del PET-CT varía según la probabilidad pre-test de linfonodos metastásicos. En ingle normal la sensibilidad es de solo un 57%. Con linfonodos aumentados de tamaño la sensibilidad aumenta a 96%. Para la determinación de linfonodos pélvicos y metástasis a distancia el PET-CT también es más preciso en caso de ingle positiva. Cabe destacar que estos resultados se basan solo en un número limitado de estudios (38). Lo que sí está establecido como norma actual es que si existen ganglios palpables es mandatorio el estudio con TC de pelvis para determinar compromiso linfonodal profundo.
Linfonodos No palpables (cN0)
Si no hay ganglios palpables ninguna modalidad de imagen actual puede identificar invasión microscópica de forma confiable, sin embargo, puede ser útil en la evaluación inguinal de pacientes obesos o afecciones inguinales que dificultan la evaluación inguinal confiable. Para esto la TC no tiene utilidad pero para una aproximación diagnóstica puede emplearse RNM multiparamétrica; estudios recientes evidencian sensibilidad de 89% y especificidad de 81% en ausencia de linfonodos palpables (39).
Para la etapificación ganglionar cuando no hay ganglios palpables hay varios estudios con PET/CT . Scher reporta una sensibilidad para ganglios inguinales superficiales de 89% por lesión y de 80% por paciente (40). En un metanálisis de 7 estudios la sensibilidad agrupada por ingle para el PET/CT FDG en pacientes cN0 fue solo 57% (41). Por tanto, es necesaria la etapificación quirúrgica para identificar metástasis inguinales pequeñas y no se recomienda el PET/CT FDG para la etapificación de ganglios inguinales en pacientes cN0 (42).
La evidencia actual en casos de pacientes cN0 orienta al uso de etapificación invasiva según en nivel de riesgo debido que hasta un 25% de pacientes cN0 puede presentar micrometástasis. La estratificación de riesgo para determinar la necesidad de evaluación histológica linfonodal depende principalmente del grado histológico, estadio tumoral y la presencia de invasión linfovascular y perineural (43).
En un esfuerzo por estratificar a los pacientes según riesgo se han desarrollado nomogramas, uniendo parámetros anatomopatológicos. Ficarra y Kattan en 2009 desarrollaron un nomograma para predecir compromiso ganglionar utilizando 8 variables clínicas y patológicas con un índice de concordancia de 0.876 (44). Zhu también presentó un nomograma que incorpora como elemento la medición del p53 con un índice de concordancia de 0,79 (45). Recientemente en 2024 Luo presentó el desarrollo y validación de un nomograma para sobrevida en cáncer de pene en un estudio integral basados en los datos del SEER y de China (Fig. 4). Según los autores mostró mejor consistencia y mejor valor clínico comparado con los modelos predictivos basados en la etapificación TNM. (46). Zhang W. et als en 2021 presentó un nomograma clínico para predecir metástasis ganglionares basado en los datos del SEER de 1016 pacientes. Aunque el modelo predictivo tiene ciertas limitaciones el nomograma reveló la relación entre las características clinicopatológicas y el riesgo de metástasis ganglionares (47). Wu et als en 2021 presenta un nomograma para predecir extensión en metástasis ganglionares inguinales en cáncer de pene. Aparte de los factores clinicopatológicos incorpora la razón plaquetas-linfocitos (PLR), el antígeno de carcinoma de células escamosas peneano (SCC Ag), la invasión linfovascular (LVI) y la etapa pT (48). Xu W et als reporta un nomograma para predecir sobrevida global y cáncer específica en pacientes con cáncer de pene (49). Necchi propone un nomograma basado en la predicción de sobrevida global después de disección ganglionar regional y el rol de la quimioterapia perioperatoria: un estudio retrospectivo multicéntrico. (50)
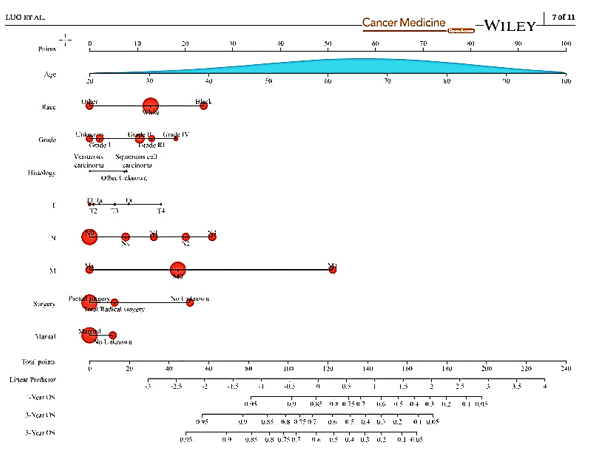
Fig. 4. Nomograma Sobrevida global en cáncer de pene a 1-3 y 5 años (Luo et al.) 2024
Es consenso de la Sociedad Europea de Urología y de la NCCN (National Comprehensive Cancer Network) al año 2025 que en casos de tumores pTa/pTis y pT1G1 existe bajo riesgo de metástasis. En aquellos pT1G2 existe un riesgo intermedio y en las lesiones de alto grado y estadios T2 en adelante se consideran lesiones de alto riesgo. Recomiendan etapificación con estudio histológico en casos de riesgo intermedio y alto ya que existe una probabilidad entre 40 a 80% de compromiso microscópico metastásico. Según la estratificación de riesgo puede emplearse la vigilancia, etapificación invasiva linfonodal o linfadenectomía radical, alternativas que serán abordadas en detalle más adelante en este capítulo.
Metástasis a distancia
Si hay ganglios inguinales positivos se debe buscar metástasis a distancia dado que no existe diseminación linfática directa hacia la pelvis. Para encontrar metástasis pélvicas y a distancia el mejor examen parece ser el PET/TC-FDG y su uso se encuentra actualmente recomendado internacionalmente. También puede emplearse la TC o RNM de abdomen y pelvis para precisar las características de las adenopatías y determinar si existe compromiso linfonodal pélvico, retroperitoneal o metástasis a distancia.
Respecto del cáncer de pene con metástasis a distancia, la mayor serie de Zhang et al. comparó PET/CT FDG a la TC convencional en 42 pacientes con lesiones sospechosas a la TC o RNM. Usando la histopatología o el seguimiento de imágenes como referencia la sensibilidad y especificidad del PET/CT FDG fue de 85% y 86% respectivamente. En este estudio se criticó sesgo de selección (51).
TRATAMIENTO
Introducción
El tratamiento del tumor primario depende de la etapificación clínica. A continuación, se describe el tratamiento del tumor primario y posteriormente las alternativas existentes para el adecuado control de los sitios de metástasis inguinales y pelvianas.
El principal objetivo de la cirugía del tumor primario es la resección con márgenes adecuados preservando la posibilidad de micción en posición de pies y la función sexual.
Los tratamientos quirúrgicos tardíos o incompletos afectan severamente la sobrevida del paciente al igual que en la mayoría de los carcinomas epidermoides de otras localizaciones. La linfadenectomía inguinopélvica es un componente importante de la terapéutica del cáncer de pene invasor y la evidencia muestra que la disección primaria tiene mejores resultados que la disección ganglionar en presencia de masa.
Tratamiento del tumor Primario
La elección del tratamiento depende de las características del tumor primario, tamaño, número, localización y profundidad. Lesiones in situ pequeñas del pene pueden ser tratadas con escisión local, láser CO2, o Nd:YAG (neodymium: yttrium-aluminium-garnet), quimioterapia tópica (5-fluorouracilo, Imiquimod al 5%) y radioterapia externa o braquiterapia. Actualmente no existen ensayos clínicos que comparen estas diferentes alternativas.
Enfermedad superficial Ta/Cis
Tratamientos tópicos
Actualmente existe disponible imiquimod al 5% y 5-fluoracilo en lesiones Ta y Cis. No existen a la fecha estudios que comparen ambas terapias pero en revisiones sistemáticas recientes describen tasa de respuesta de 40-100% para imiquimod y 48-78% para 5-FU con recurrencias de 10-20% (52). Existen efectos adversos tópicos frecuentemente como dolor, eritema e inflamación lo cual conlleva hasta un 12 % de descontinuación de terapia, en caso de fracaso o abandono de tratamiento el consenso actual es no reintentar con una terapia tópica (EUA y NCCN).
Técnicas ablativas
Las técnicas láser ablativas como láser Neodymium: Yttrium-Aluminium-Garnet (Nd:YAG), láser de dióxido de carbono y terapia fotodinámica son técnicas validadas. Aunque tradicionalmente descritos como alternativas tienen la desventaja de tener una mayor tasa de recurrencia que imiquimod o 5-FU alcanzando 7-48% y una respuesta total de 52-100% (52).
Reconstrucción de glande con injerto libre o “Glans Resurfacing”.
Esta técnica reservada para lesiones Ta/Cis extensas o recidivantes superficiales consiste en la remoción del epitelio del glande en su totalidad para posteriormente reconstruir con injerto cutáneo o de mucosa bucal. Esta técnica tiene el beneficio oncológico de obtener biopsia que permite una etapificación local adecuada. Se ha descrito resección total o parcial de mucosa. Destacamos que en las series descritas se encuentra hasta 20% de enfermedad invasora en la biopsia y hasta un 28% de retratamiento (53). En el siguiente artículo se detalla la técnica y se incluye un video de ésta (54) Link.
Enfermedad invasora T1-T4
El manejo de lesiones invasoras depende fundamentalmente de su tamaño, ubicación, grado histológico y preferencia del paciente, sin embargo, en la medida que sea posible se optará por cirugía conservadora con preservación peneana. La resección de lesiones de glande y prepucio deben ser complementadas con circuncisión. Estas lesiones pueden ser manejadas con las terapias tópicas o ablativas previamente descritas en casos de lesiones pequeñas concomitantes. En lesiones de mayor tamaño es preferible la escisión local, penectomía parcial o total con reconstrucción. Adicionalmente como alternativa a la cirugía existe la radioterapia que se describe al final de la sección.
Técnicas con preservación de Pene (T1-T2)
La circuncisión es un tratamiento efectivo para los tumores ubicados en el prepucio. Lesiones ubicadas en el surco balanoprepucial o en el glande pueden ser tratadas con glandectomía parcial o total, lo que requiere conocer con la mayor exactitud posible la extensión local y profundidad de la lesión, para lo cual el examen físico resulta ser útil y habitualmente suficiente. Como se mencionó en secciones anteriores se puede complementar la evaluación con ecografía peneana o RNM. Algunas publicaciones han descrito glans resurfacing en lesiones T1 pero dada las altas tasas de márgenes y retratamiento no parece aconsejable realizar.
La glandectomía ofrece resultados oncológicos y cosméticos superiores a la penectomía parcial. Los márgenes deben estudiarse en el intraoperatorio para dejar un lecho y borde sin tumor. La recidiva local puede ser vista en un 6.9% a 8% de los casos y se puede tratar con penectomía parcial. Estas técnicas se recomiendan en tumores T2 limitados al glande. Se debe destacar que algunos reportes incluyen 9-12% de recurrencia inguinal y 2% metástasis a distancia (55,56). En caso de lesiones pT3, lesiones de alto grado o con invasión linfovascular se debe complementar con penectomía parcial sin esperar a la recidiva ya que, junto a la recurrencia local, son predictores de peor sobrevida cáncer específica (57).
La resección parcial del glande se puede realizar cuando la lesión no alcanza los cuerpos cavernosos o compromete menos de la mitad del glande; la reconstrucción se realiza con injertos de piel parcial o avance de piel peneana o de la mucosa uretral movilizada y espatulada por su cara ventral de modo que pueda cubrir el defecto. Del punto de vista funcional estas cirugías se pueden acompañar de erecciones y capacidad de penetrar debido a que se logra una longitud mayor que la de una penectomía parcial formal. Los carcinomas verrucosos debido a su escaso nivel de infiltración son candidatos ideales para este tipo de cirugías.
La penectomía parcial ofrece un excelente control de enfermedad logrando un 92% de sobrevida libre de recurrencia a 5 años en pT1 y un 96% en pT2 (58).
La técnica quirúrgica incluye el aislamiento de la lesión, habitualmente sobreinfectada, y la demarcación en piel sana de un margen de 1 cm. Con un control vascular proximal tipo torniquete se procede a la sección de la piel, dartos, fascia de Buck y cuerpos cavernosos. Los cuerpos cavernosos se suturan con material sintético reabsorbible y se completa la hemostasia con el pene sin isquemia. El muñón peneano se cubre con avance de la piel remanente o a través del injerto de piel parcial sobre los cuerpos cavernosos amputados a modo de neoglande. La uretra se espátula por ventral para formar un neomeato.
La creación de un remanente funcional luego de la penectomía parcial con la técnica de “parachute” o paracaídas es una opción de reconstrucción que puede ser implementada en la mayoría de los casos. Consiste en la espatulación ventral de la uretra y la sutura con vicryl 4-0 de la piel desde el vértice de la “V” desde ventral hacia dorsal (59).
Penectomía total: para lesiones extensas que impiden asegurar un margen de seguridad adecuado la recomendación es la penectomía total con meato perineal. También se puede realizar en el contexto de lesiones distales grandes asociadas a metástasis locorregionales con la intención de aseo y manejo local paliativo. En la cirugía se realiza una incisión circular en la base del pene con extensión al rafe medio del escroto, los cuerpos cavernosos son seccionados a nivel de la crura y la uretra bulbar es liberada para alcanzar el periné o se realiza una uretrostomía perineal con apertura ventral de la uretra bulbar. Es la modalidad de tratamiento menos utilizada reportándose solo su indicación en un 14% de los casos en USA, con un 12.6% de metástasis inguinales y 11% de necesidad de quimioterapia adyuvante. La tasa de márgenes positivos es de 6%, similar a lo reportado en penectomía parcial (60).
En pacientes jóvenes con sobrevida libre de recurrencia local y a distancia que deseen una rehabilitación de su imagen corporal, se puede realizar la reconstrucción del pene con colgajo libre pediculado de antebrazo. La técnica más utilizada es el colgajo de antebrazo radial pediculado (RFF) que utiliza la arteria radial, la vena cefálica y basílica como drenaje vascular. La arteria es anastomosada a la arteria epigástrica y las venas a la safena ipsilateral. La neo-uretra se anastomosa de forma término terminal a la uretra nativa protegida con catéter uretral y cistostomía. La sensación táctil se observa casi en el 90% de los pacientes y se logra por la neurorrafia entre el nervio cutáneo antebraquial lateral y nervio dorsal del pene (61).
Tratamiento de los ganglios linfáticos regionales
El drenaje linfático inguinal fue descrito previamente por Dassler y clásicamente se ha descrito que la mayoría de las zonas comprometidas corresponden a los cuadrantes superiores sin embargo evidencia reciente de una serie de 414 con linfadenectomía inguinal bilateral evidencian que el compromiso inguinal también puede incluir los cuadrantes inferiores medial y lateral (62).
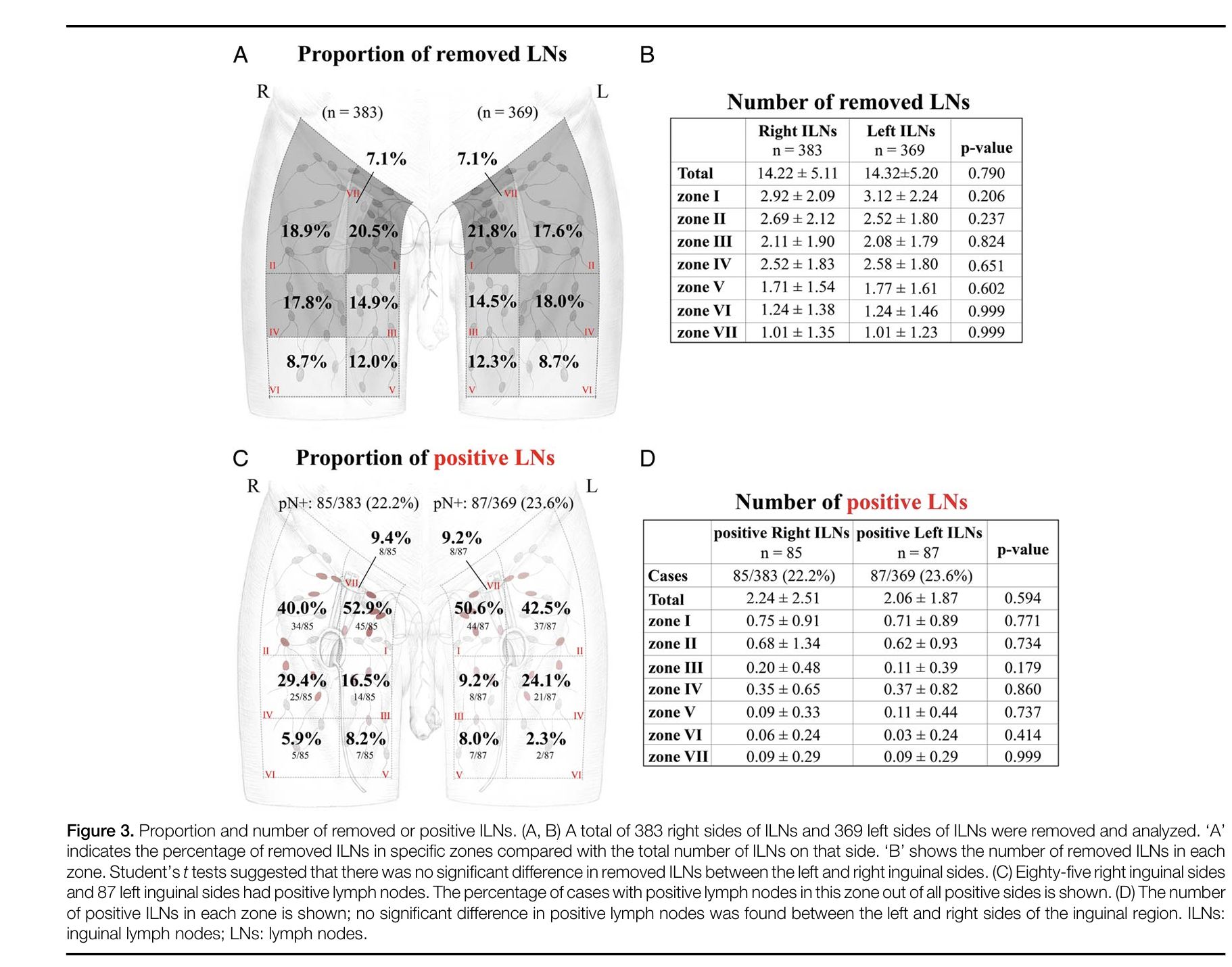
Fig. 5. Proporción de linfonodos positivos en linfadenectomía inguinal por cáncer de pene, adaptado de Tan X. et al, 2024.
La linfadenectomía inguinal es el tratamiento complementario para los pacientes con metástasis inguinales y tiene un rol etapificador y terapéutico en pacientes con alto riesgo de metástasis inguinales. La presencia de compromiso inguinal y su extensión es el factor pronóstico más determinante en cáncer de pene disminuyendo la sobrevida de 90% a 5 años a 50% en presencia de enfermedad linfonodal.
Esta cirugía requiere de un tratamiento cuidadoso de la piel, de una disección ganglionar meticulosa y comprensión del drenaje linfático peneano. En la técnica abierta clásica se reporta que entre el 30-70% de los pacientes presentan drenaje linfático prolongado, linfedema en las piernas y el escroto, pudiendo producirse necrosis de la piel e infección de la herida operatoria. A continuación se detalla el manejo de los pacientes según la situación de ausencia o presencia de compromiso linfonodal clínico.
Pacientes con ganglios inguinales no palpables: Linfadenectomía inguinal profiláctica.
A pesar de que todos los exámenes imagenológicos de etapificación pueden ser informados como normales, hasta el 25% puede tener metástasis microscópicas. Se deben considerar los diversos factores de riesgo para estratificar a estos pacientes con ganglios negativos y decidir una linfadenectomía (63). En la edición anterior de este manual se describe que el riesgo de metástasis ganglionar depende fundamentalmente del estadio tumoral, grado de diferenciación y presencia de invasión linfovascular (ILV) a lo cual se agrega el 2022 la presencia de invasión perineural (IPN) (64).
La clasificación propuesta por la EUA 2025 divide los pacientes con cN0 en tres grupos de riesgo:
Alto riesgo: T1G3, T1 con ILV o IPN, lesiones T2–T4 de cualquier grado
Intermedio: pT1a G2
Bajo riesgo: Cis – TaG1
A partir de esta clasificación podemos determinar el manejo óptimo:
Vigilancia: Esta alternativa está reservada para pacientes de bajo riesgo quienes consienten tras informar del riesgo de recidiva y disminución de sobrevida en casos de recidiva inguinal; se debe considerar la sobrevida en aquellos pacientes sometidos a linfadenectomía inguinal precoz es de 77% vs 38% en aquellos sometidos a linfadenectomía de rescate o realizada en 3 o más meses posterior a la cirugía del tumor primario (65).
Etapificación linfonodal invasiva: Esta alternativa es de elección para los tumores de riesgo intermedio o alto. La punción con aguja fina guiada por US es una alternativa solo en pacientes de bajo riesgo sin linfonodos presentes ya que en pacientes de riesgo intermedio o alto no excluye la etapificación invasiva que actualmente puede realizarse con biopsia dinámica de ganglio centinela o linfadenectomía inguinal modificada.
– Biopsia dinámica de ganglio centinela (BDGC): Consiste en la inyección de Tc99 nanocoloidal el día antes de la intervención y posteriormente se utiliza una sonda de detección de rayos gamma de forma intraoperatoria. Tiene una sensibilidad del 79%, 97% de VPN y 100% de VPP (66). Esta técnica tiene el rol principalmente en lesiones de riesgo intermedio en las que puede excluir la linfadenectomía inguinal modificada. Más de un ganglio centinela puede estar presente y se deben considerar las variaciones individuales. En los centros que realizan BDGC, en caso de ganglio centinela positivo se realiza linfadenectomía inguinal.
– Linfadenectomía inguinal modificada abierta: Técnica quirúrgica propuesta por Catalona (67) con una menor incisión cutánea que implica la remoción de los linfonodos superficiales mediales centrales y superiores lo que preserva el área lateral a la arteria femoral y vena safena, eliminando la necesidad de transposición de sartorio; con esto se reducen las complicaciones respecto a la linfadenectomía radical abierta. Con la implementación de técnicas mínimamente invasivas como la linfadenectomía inguinal video-endoscópica se han disminuido significativamente las complicaciones perioperatorias relacionadas con la herida sin comprometer los resultados oncológicos (68).
- Linfadenectomía inguinal video-endoscópica (VEIL) o robo-asistida (RAVEIL) modificada con preservación de fascia lata: En casos de linfonodos ausentes en pacientes de riesgo intermedio y alto lo que permite resecar los linfonodos superficiales a esta fascia disminuyendo la morbilidad sin comprometer los resultados oncológicos de los pacientes.
Pacientes con ganglios inguinales palpables
En este escenario clínico la probabilidad de compromiso metastásico es elevada; conductas previas descritas que implican uso de antibióticos para evaluar respuesta clínica no son aceptadas. En casos en que existe duda diagnóstica existe como alternativa la utilización de citología mediante aspiración con aguja fina guiada por ultrasonido la cual tiene una sensibilidad reportada de 93% y especificidad de 91% (69).
En casos en que existe compromiso inguinal la linfadenectomía inguinal radical es la indicación estándar, pero conlleva una morbilidad elevada con hasta un 50% de complicaciones, principalmente linfedema, necrosis de colgajo cutáneo, infección y linfocele o linforrea (70). Existen actualmente reportes de técnica robótica y laparoscópica que describen una menor tasa de complicaciones sin comprometer los resultados oncológicos a largo plazo, sin embargo, no existen ensayos clínicos prospectivos comparando ambas vías de abordaje que permitan recomendar con nivel I de evidencia la implementación de técnicas mínimamente invasivas proviniendo la evidencia actual de series retrospectivas (71).
Los pacientes con confirmación histológica tumoral pN2/pN3 se benefician de quimioterapia adyuvante lo que es mandatorio ya que incrementa la sobrevida libre de enfermedad en 40% a 50%, con una sobrevida global promedio entre 17 y 24 meses (72)
Pacientes con ganglios fijos o recidivantes
No se recomienda la cirugía porque hay importante tasa de complicaciones, es poco probable que se pueda curar y la sobrevida es breve. En centros de alta complejidad se ha probado quimioterapia inicial seguida de cirugía en caso de respuesta tumoral. En ocasiones se presentan los pacientes con masas de gran tamaño y ulceradas lo que otorga pronóstico ominoso. La indicación en estos casos es realizar quimioterapia neoadyuvante con cirugía de consolidación en los pacientes que responden a terapia y complementar con quimioterapia adyuvante; esto ha permitido hasta un 25% de enfermedad estable y 50% de sobrevida a 5 años (73).
Técnica quirúrgica de la linfadenectomía Inguinal
El drenaje linfático de la región inguino-femoral, de acuerdo a Daseler et al. (74) comprende 5 zonas descritas en la Fig. 6: una zona central (V), superior medial (I) e inferior medial (IV), zona lateral superior (II) y lateral inferior (III).
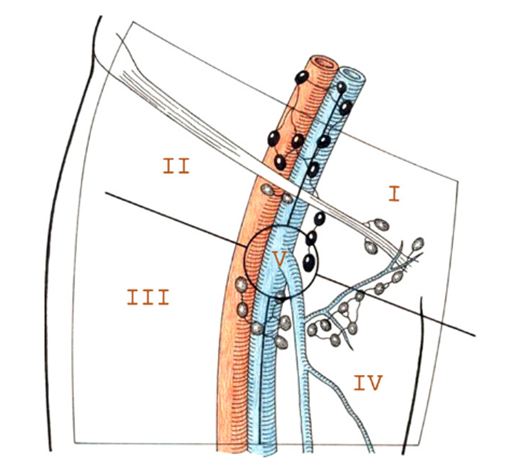
Fig. 6. Drenaje linfático según Daseler et al (74)
Actualmente existen diferentes técnicas abiertas y mínimamente invasivas que permiten la resección del tejido linfonodal entre las que encontramos la linfadenectomía abierta radical, técnica abierta modificada, videoendoscópica radical y modificada con preservación de fascia lata.
Linfadenectomía radical abierta
Los límites de la linfadenectomía a superior es el ligamento inguinal, a lateral el músculo Sartorio y a medial el músculo abductor largo. En la descripción clásica se emplea una incisión cutánea longitudinal o una incisión en forma de S, que se extiende 2-3 cm por encima y medialmente hasta la espina ilíaca anterosuperior, hasta la cara medial del muslo, en el vértice del triángulo femoral formado por la convergencia de los músculos sartorio y aductor. Los colgajos de piel se crean medialmente hasta el tubérculo púbico, el margen anterior de los músculos gracilis y abductor, y lateralmente hasta la espina ilíaca anterosuperior y el músculo sartorio. La disección continúa profundamente, a través de la incisión de la fascia lata hasta Los músculos subyacentes y los vasos femorales. La vena safena generalmente se secciona en el vértice del triángulo femoral y a la altura de la unión safenofemoral. (74).
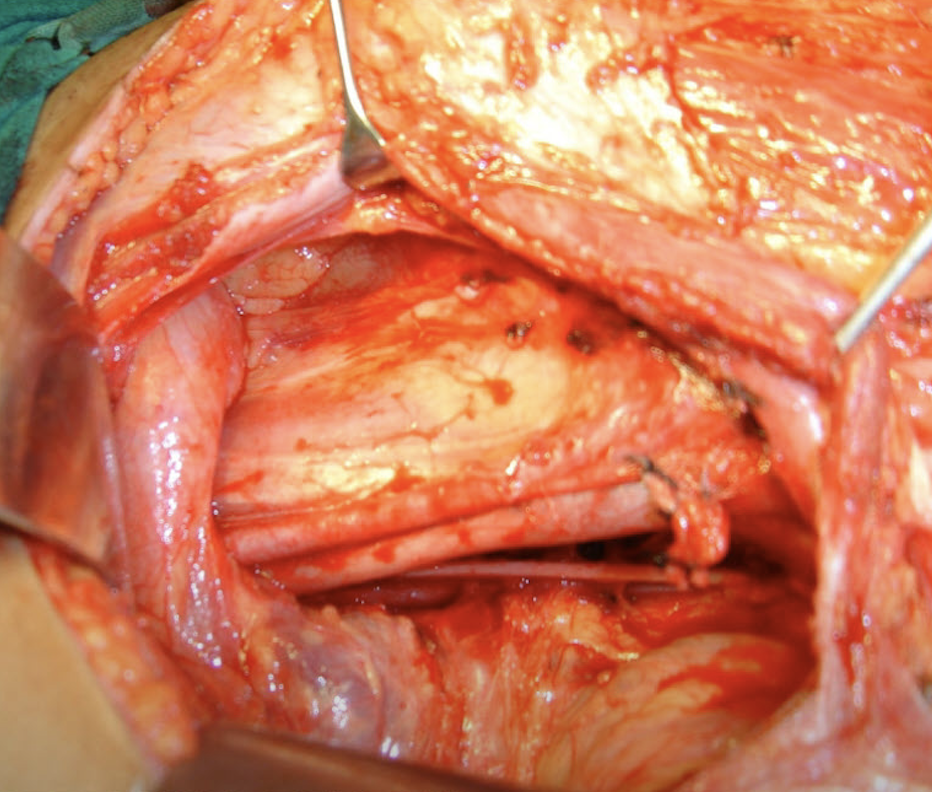
Fig. 7. Linfadenectomía inguinal abierta (75)
De esta manera los ganglios linfáticos superficiales de las 5 zonas anatómicas de Daseler y los ganglios inguinales profundos son disecados.
Linfadenectomía abierta modificada
Catalona (67) propuso una linfadenectomía modificada con una incisión más corta, y disección limitada, excluyendo del área lateral a la arteria femoral y caudal a la fossa ovalis, preservando la vena safena y sin transposición del músculo sartorio. De acuerdo al conocimiento actual del drenaje linfático, parece conveniente que una linfadenectomía modificada debería disecar la zona central y las zonas superiores en la región inguinal. La morbilidad se reduce si se compara con la linfadenectomía radical. La necrosis de piel es de 2,5% comparada con 8,6%, linfedema de 3,4% comparado con 22,4%, trombosis venosa profunda de 0 comparado con 12%. La tasa de complicaciones precoces fue de 6,8% vs 41,1% y de complicaciones tardías de 3,4% vs 43,1%. Sin embargo, el reducir el campo de sección aumenta la posibilidad de falsos negativos.
Linfadenectomía video-endoscópica
Técnica descrita el año 2003 inicialmente en cadáver y luego implementada progresivamente debido a su menor tasa de complicaciones (76).
El paciente se coloca en decúbito supino con abducción de muslos, brazos en abducción y compresión de hemiabdomen inferior para evitar disección del tejido celular subcutáneo del CO2. Se debe disponer de dos monitores que permitan realizar la cirugía bilateral sin proceder a movilizar el equipo.
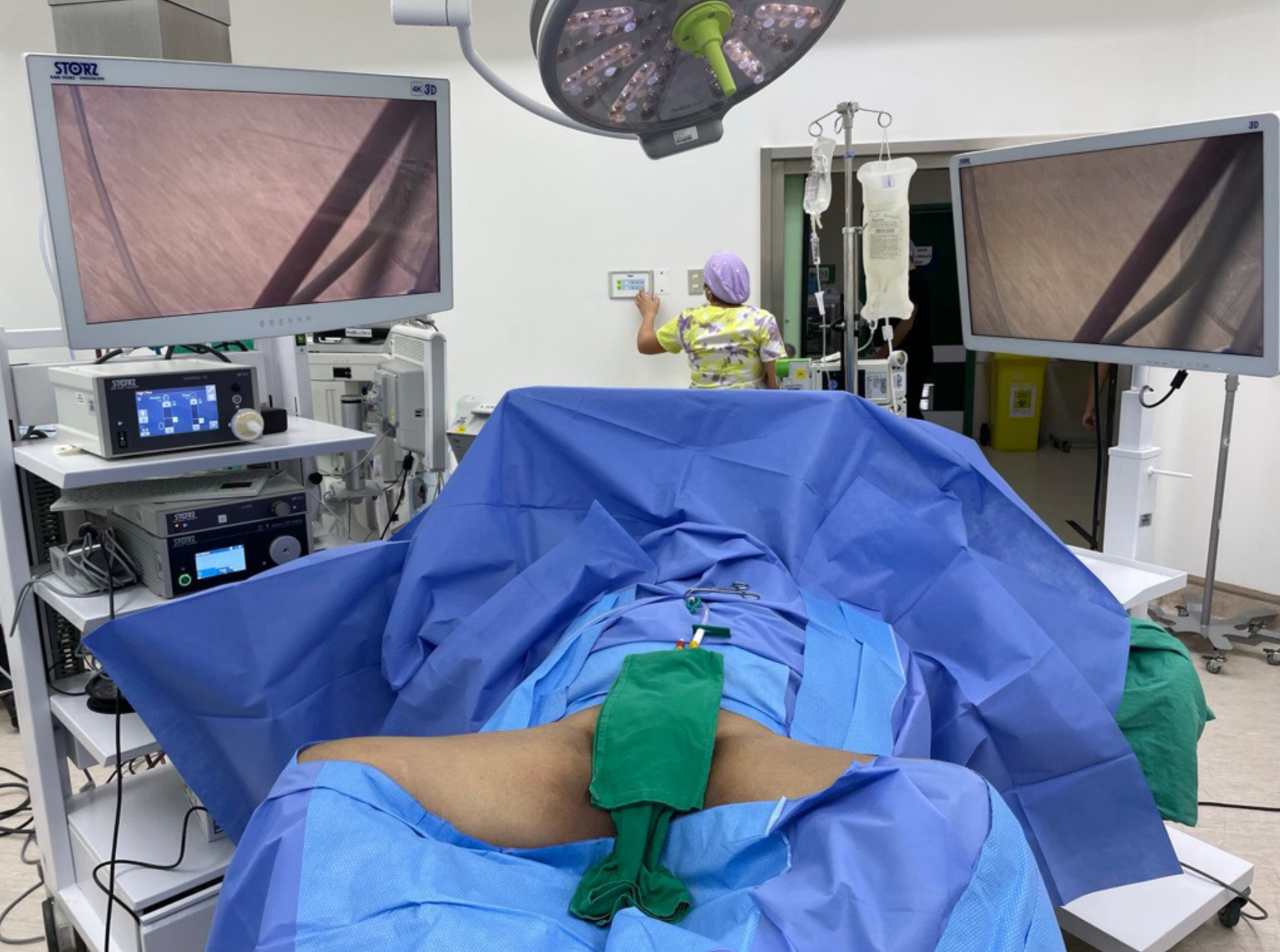
Fig 8. Posicionamiento del paciente y disposición de pabellón.
Tras demarcar los límites del triángulo femoral se realiza una incisión de 1,5 cm a 2 cm distalmente del vértice inferior del triángulo para insertar el primer trocar de 10 mm.
Se emplean tijeras para desarrollar un plano de disección profundo a la fascia de Scarpa hasta el punto de inserción de los trocares laterales de trabajo. Existe una variante en la cual se desarrolla un plano subcutáneo para desarrollar el plano de disección superficial inicialmente.
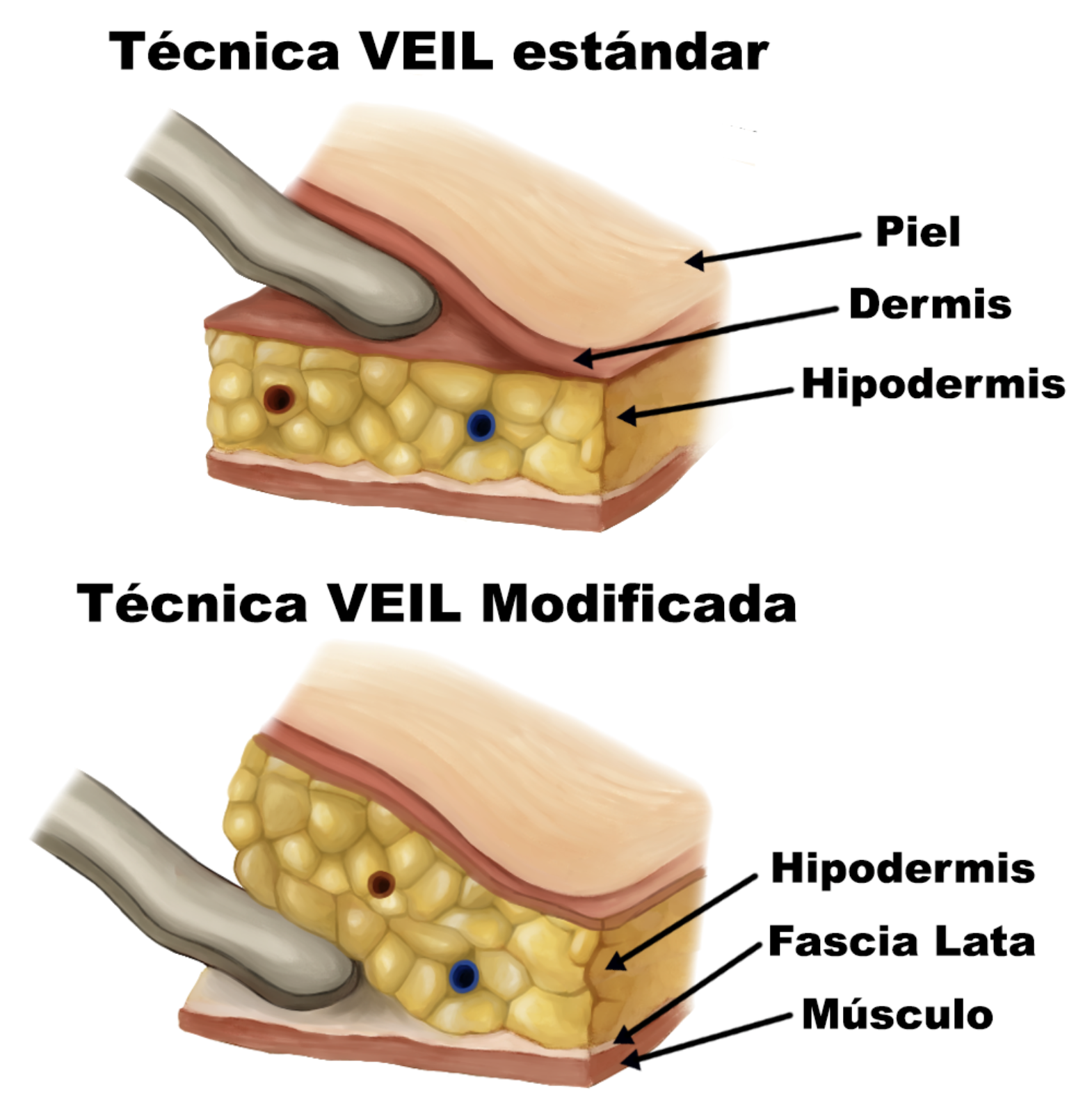
Fig 9. Alternativas de planos de disección inicial en VEIL.
La segunda incisión se realiza a 2 cm proximalmente y 6 cm medialmente. Se insertan dos trócares idealmente con balón en estas incisiones y se insufla CO2 en el espacio de trabajo a 5-15 mmHg. El último trocar se coloca a 2 cm proximalmente y 6 cm lateralmente del primer puerto.
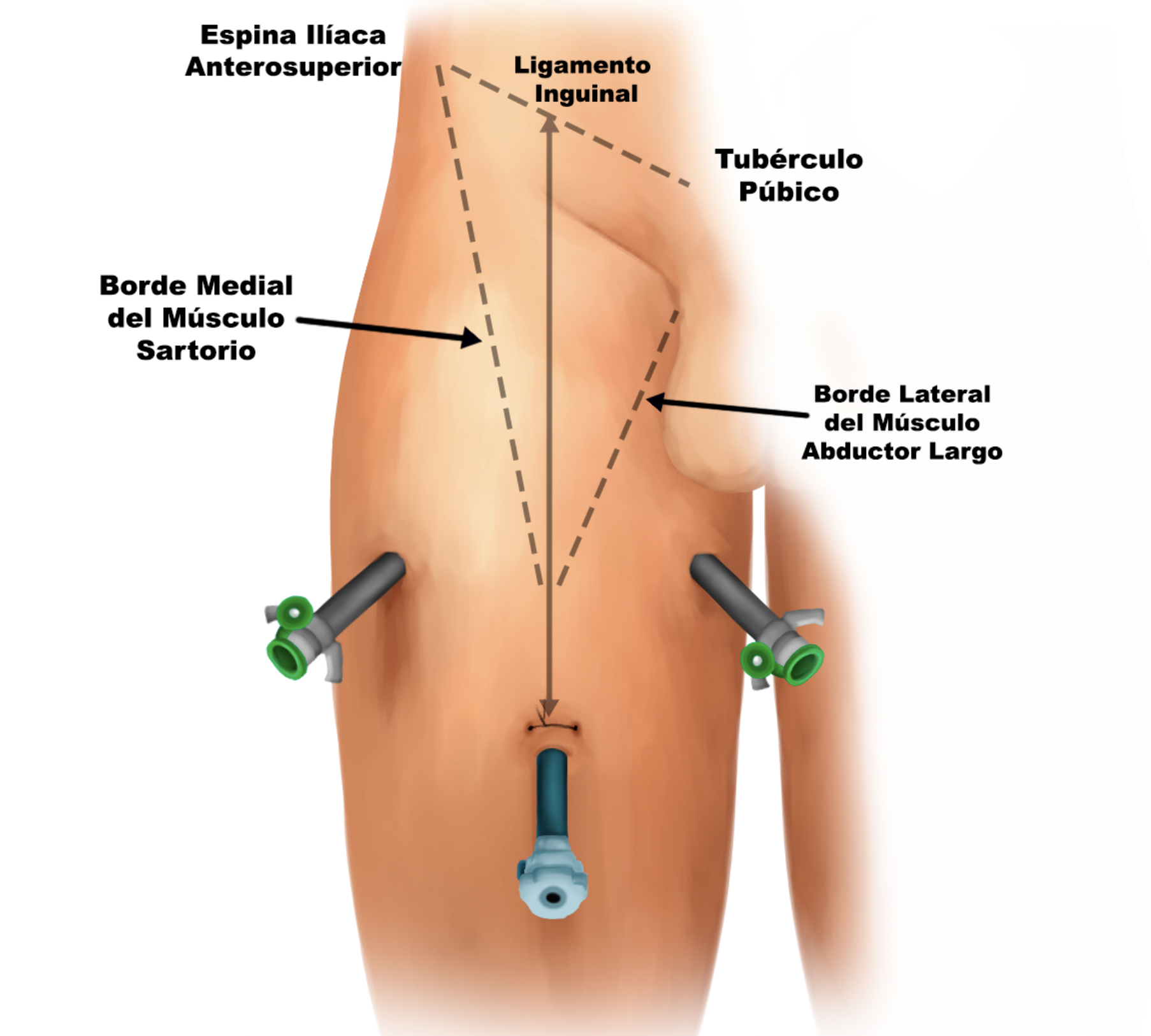
Fig 10. Disposición de trocares y relación anatómica con límites de disección.
Se realiza una linfadenectomía inguinal video-endoscópica radical con el mismo patrón de la cirugía abierta. Se visualizan claramente los puntos de referencia principales: el músculo aductor largo medialmente, el músculo sartorio lateralmente y el ligamento inguinal superiormente. La disección retrógrada con ligasure o energía similar se inicia distalmente cerca del vértice del triángulo femoral hacia la fosa oval, donde se identifica, se corta y secciona la vena safena, y hacia la arteria femoral lateralmente.
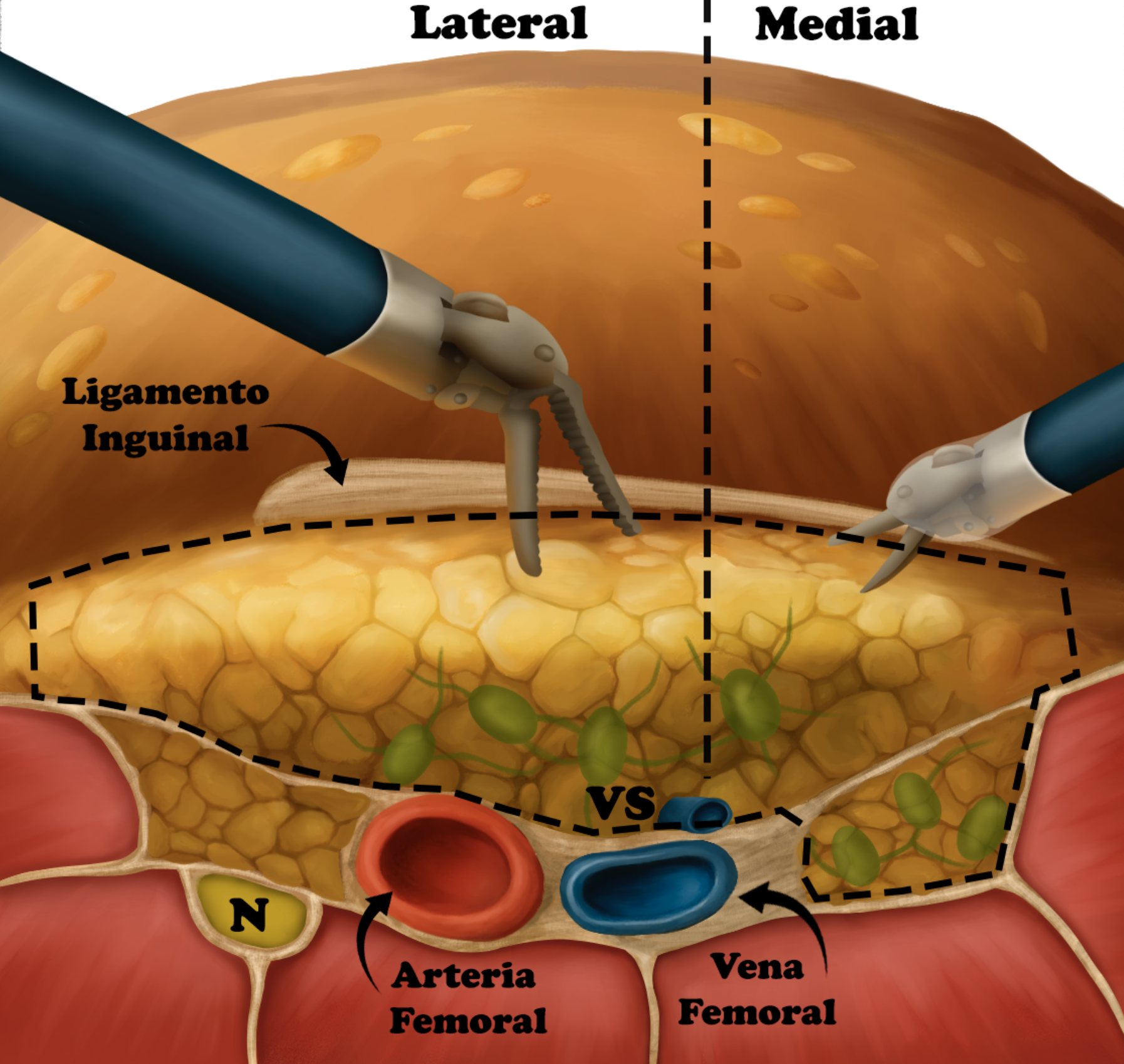
Fig 11. Corte transversal de la región inguinal a disecar.
Tras el procedimiento, se pueden identificar los vasos femorales esqueletizados y el canal femoral vacío, lo que demuestra que el tejido linfático en esta región es completamente resecado.
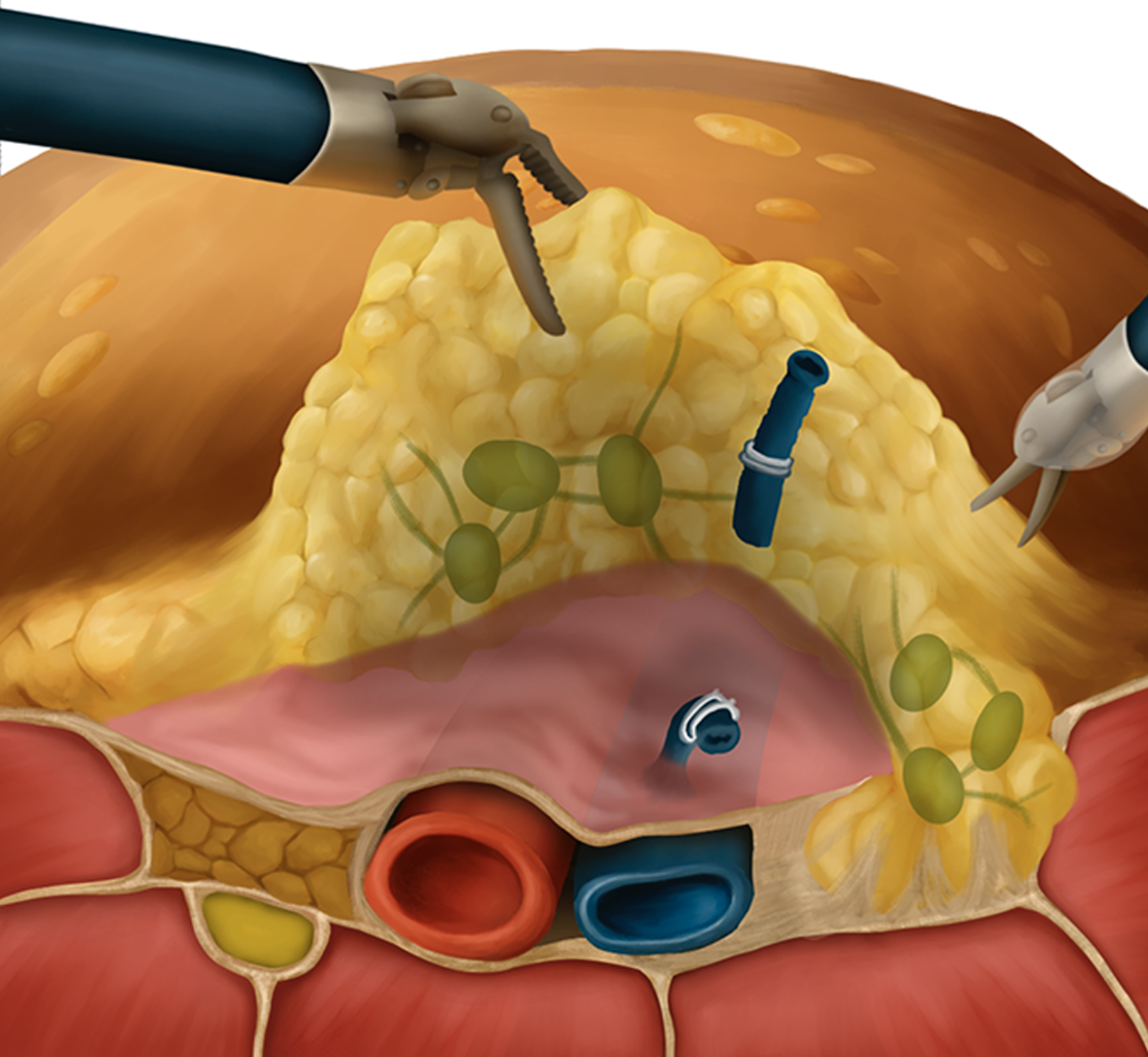
Fig 12. Corte transversal de la región inguinal con tejido celular subcutáneo y linfonodos a resecar.
La pieza quirúrgica se extrae a través de la primera incisión del puerto de 10 mm.
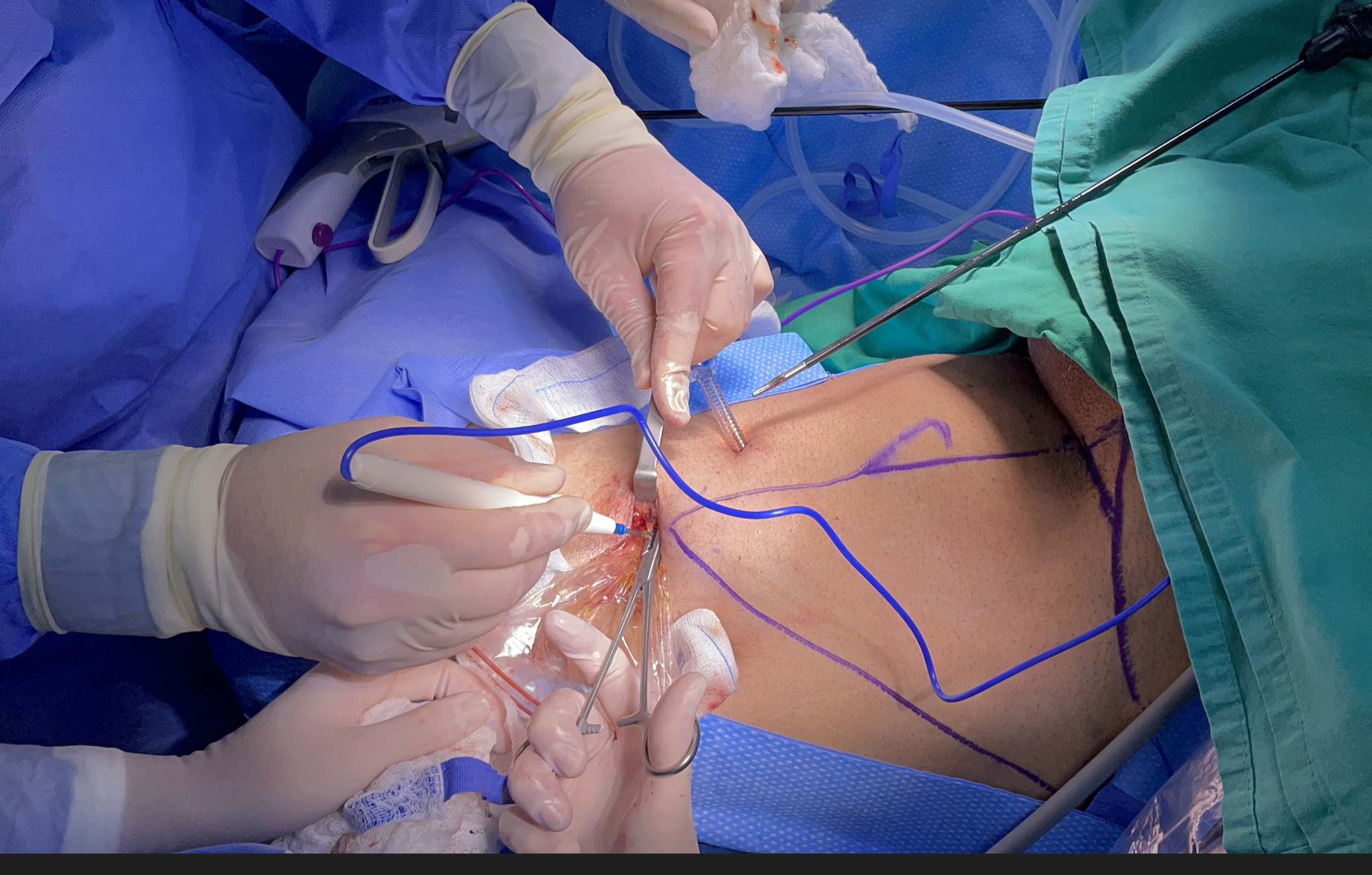
Fig 13. Extracción de pieza quirúrgica por puerto ampliado.
Se instala uno o dos drenajes de succión para prevenir la linfocele y se mantienen hasta que el drenaje alcanza 50 ml o menos en 24 h.
En nuestra experiencia iniciada el año 2020 hemos obtenido similares resultados a los descritos en la literatura, disminuyendo las complicaciones relacionadas a la herida operatoria como necrosis, infección pero con pacientes que han tenido linforrea persistente por drenaje hasta 6 semanas.
Rol de la linfadenectomía pelviana
En caso de que los ganglios inguinales no estén comprometidos, no se requiere linfadenectomía pelviana. Predictores de potencial compromiso de ganglios pelvianos son el número de ganglios inguinales comprometidos >2, el diámetro mayor a 30 mm, la presencia de enfermedad extracapsular, inmunorreactividad a p53 elevada (77). De tal manera, la linfadenectomía pelviana se puede realizar como procedimiento secundario posterior mediante técnica abierta, mínimamente invasiva laparoscópica o robótica. Se ha reportado una tasa de 23% de ganglios pélvicos positivos cuando existen más de 2 ganglios inguinales positivos y de 56% cuando hay más de 3 ganglios inguinales positivos. Adicionalmente se ha descrito que existe diseminación pélvica cruzada por lo que la recomendación actual es realizar la linfadenectomía bilateral independiente de la ingle comprometida. (78) Reportes actuales indican que la resección debe incluir la zona iliaca externa, obturatriz, iliaca interna y presacra con un mínimo de 9 linfonodos resecados para incrementar la sobrevida libre de recurrencia de forma significativa (79)
RECOMENDACIONES PARA EL TRATAMIENTO DE METÁSTASIS GANGLIONAR
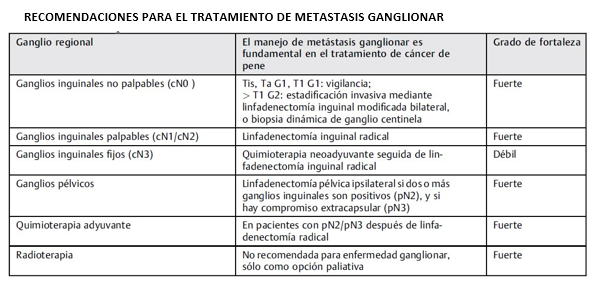 Tabla 5. Resumen de recomendaciones para el tratamiento de metástasis ganglionar (80)
Tabla 5. Resumen de recomendaciones para el tratamiento de metástasis ganglionar (80)
RADIOTERAPIA
La radioterapia permite la preservación del órgano en el manejo del cáncer de pene en etapa precoz T1 y T2 en casos seleccionados. El propósito es obtener resultados terapéuticos similares a la penectomía, manteniendo la función del órgano y reduciendo la morbilidad. Para las etapas más precoces la radioterapia se efectúa ya sea con braquiterapia o radioterapia externa más braquiterapia.
La elección entre radioterapia externa y braquiterapia depende de la localización y tamaño del tumor como también de la disponibilidad de equipos y de la experiencia necesaria. La radioterapia externa tiene la ventaja de tener mayor disponibilidad y producir una distribución de la dosis más homogénea con mayores márgenes alrededor del tumor. Antes de cualquier radioterapia se debería realizar una circuncisión para exponer adecuadamente la lesión.
En una de las revisiones sistemática más recientes del año 2022 que incluye 1222 pacientes se describe en primer lugar una importante heterogeneidad en los estudios una sobrevida libre de recurrencia a 5 años de 76% pero rangos amplios de 31-92% (81). En una revisión sistemática previa que intenta comparar cirugía y radioterapia publicada en el año 2015 que incluye 2178 pacientes, principalmente de series retrospectivas, se concluye que existe una discreta superioridad en sobrevida global al utilizar cirugía (76% vs 73%) pero que no alcanza significancia estadística, con un control local equivalente. Existe la posibilidad de cirugía de salvataje si hay recurrencia tumoral. Se destaca como complicaciones de radioterapia estenosis uretral, meatal, erección dolorosa, disuria persistente, necrosis del glande con necesidad de amputación hasta en 6.8% (82).
Respecto a la radioterapia inguinal actualmente no existe evidencia en un escenario de neoadyuvancia pero existe un ensayo clínico en curso que está evaluando el efecto de esta, el InPACT trial (83) con la intención de reclutar 200 pacientes con compromiso tumoral inguinal. Se compone de 3 opciones de randomización: Cirugía exclusivamente, quimiorradioterapia neoadyuvante seguida de cirugía, o quimioterapia neoadyuvante más cirugía; estos resultados aportaran nivel de evidencia tipo I para la toma de decisiones clínicas en este subgrupo de pacientes (83)
Respecto a la adyuvancia existen algunas series retrospectivas y de bajo número de pacientes que describen un beneficio en aquellos pacientes con enfermedad pN2-N3 pero actualmente se recomienda con un nivel de evidencia 2b aunque en aquellos pacientes con HPV + parece existir un beneficio mayor en sobrevida global (84, 85)
QUIMIOTERAPIA
Se han probado diferentes estrategias para el uso de quimioterapia en cáncer de pene. Actualmente puede ser utilizado en neoadyuvancia, adyuvancia y en enfermedad metastásica. Los esquemas que han evidenciado mejores resultados y menor toxicidad son basados en cisplatino, 5-Fluorouracilo en combinación con paclitaxel o docetaxel.
En el escenario de neoadyuvancia las tasas de respuestas en enfermedad localmente avanzada varía entre un 30% a 40% Faltan estudios randomizados y existe una preocupación sustancial respecto de la selección de los pacientes, que sean los más adecuados, para una terapia sistémica desde un principio. En un meta-análisis reciente principalmente retrospectivo. analizando 10 estudios (n=182 pacientes) la ORR agrupada fue 53% y la mortalidad en general fue 55% (86). La evidencia disponible favorece la combinación de cis-platino y taxanos (doblete o triplete) como el enfoque preferido.
Un ensayo fase II evaluó el tratamiento con 4 ciclos de terapia neoadyuvante con paclitaxel, cisplatino e ifosfamida (TIP) en pacientes con metástasis ganglionares clínicas N2 o N3 (87). Se reportó una tasa de respuesta objetiva (ORR) de 50% en 30 pacientes. La mediana del tiempo a la progresión (TTP) fue de 8,1 meses y la mediana de sobrevida global fue de 17.1 meses. Se observó un tiempo largo de sobrevida libre de enfermedad en el 67% de los pacientes respondedores y un 7% en los no respondedores.
Respecto de la quimioterapia adyuvante, una serie de 611 pacientes tomados de la Base de Datos Nacional del Cáncer, pacientes con ganglios inguinales positivos, después de ajustar para co- variables no hubo diferencia en la sobrevida para los que recibieron quimioterapia adyuvante (88). Un meta-análisis reciente con 7 estudios evaluando el uso de quimioterapia perioperatoria, en 4 de ellos se examinó la quimioterapia adyuvante. (n=771), No hubo diferencia en la sobrevida entre los que recibieron quimioterapia vs observación (HR 0,95) (89)
GUIAS PARA LA QUIMIOTERAPIA
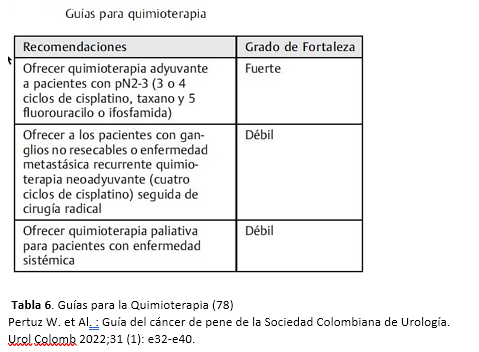
Tabla 6. Resumen de recomendaciones al uso de quimioterapia en cáncer de pene (80).
RESUMEN DE LA EVIDENCIA Y GUÍAS PARA QUIMIOTERAPIA NEOADYUVANTE Y ADYUVANTE

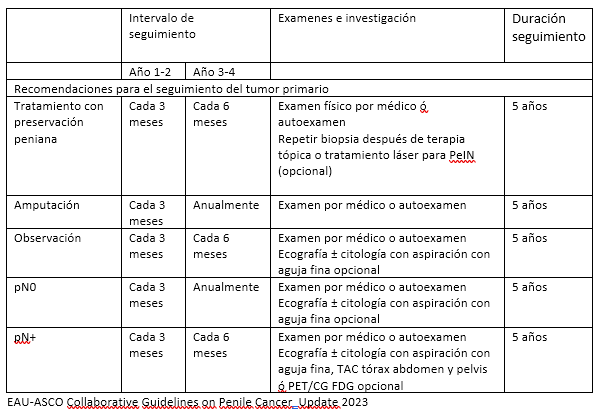
SEGUIMIENTO
ESQUEMA DE SEGUIMIENTO PARA CÁNCER DE PENE
BIBLIOGRAFÍA
1. Velazquez E, Chaux A, Cubilla A. Histologic classification of penile intraepithelial neoplasia. Semin Diagn Pathol. 2012;29:96-102.
2. International Agency for Research on Cancer. 26-Penis Fact Sheet 2020. Accessed May 2025. https://gco.iarc.fr/today/data/factsheets/cancers/26-Penis-fact-sheet.pdf
3. Navarro M, Montes J, Tagle R. Epidemiología de los cánceres urológicos en la Tercera Región de Atacama. Rev Chil Urol. 2004;69(3):230-236.
4. Thomas A, Necchi A, Muneer A, Tobias-Machado M, Tran ATH, Van Rompuy AS, Albersen M. Penile cancer. Nat Rev Dis Primers. 2021;7(1):11.
5. Vanthoor J, Thomas A, Tsaur I, Albersen M. Making surgery safer by centralization of care: impact of case load in penile cancer. World J Urol. 2019.
6. Tseng HF, Morgenstern H, Mack T, et al. Risk factors for penile cancer: results of a population-based case-control study in Los Angeles County (United States). Cancer Causes Control. 2001;12:267-277.
7. Daling J, Madeleine M, Johnson L, et al. Penile cancer: importance of circumcision, human papillomavirus and smoking in situ and invasive disease. Int J Cancer. 2005;116:606-616.
8. Miralles-Guri C, Bruni L, Cubilla AL, Castellsagué X, Bosch FX, de Sanjosé S. Human papillomavirus prevalence and type distribution in penile carcinoma. J Clin Pathol. 2009;62(10).
9. Rubin M, Kleter B, Zhou M, et al. Detection and typing of human papillomavirus DNA in penile carcinoma. Am J Pathol. 2001;159:1211-1218.
10. Harish K, Ravi R. The role of tobacco in penile carcinoma. Br J Urol. 1995;75:375-377.
11. Hellberg D, Valentin J, Eklund T, et al. Penile cancer: is there an epidemiological role for smoking and sexual behaviour? Br Med J (Clin Res Ed). 1987;295:1306-1308.
12. Goldstone SE, Giuliano AR, Palefsky JM, et al. Efficacy, immunogenicity, and safety of a quadrivalent HPV vaccine in men: results of an open-label, long-term extension of a randomised, placebo-controlled, phase 3 trial. Lancet Infect Dis. 2022;22:413-425.
13. Hartwig S, St Guily JL, Dominiak-Felden G, Alemany L, de Sanjosé S. Estimation of the overall burden of cancers, precancerous lesions, and genital warts attributable to 9-valent HPV vaccine types in women and men in Europe. Infect Agent Cancer. 2017;12:19.
14. Elst L, Albersen M. HPV vaccination: does it have a role in preventing penile cancer and other preneoplastic lesions? Semin Oncol Nurs. 2022;38(3):151284.
15. Micali G, Innocenzi D, Nasca MR, et al. Squamous cell carcinoma of the penis. J Am Acad Dermatol. 1996;35(3 Pt 1):432-451.
16. von Krogh G, Horenblas S. Diagnosis and clinical presentation of premalignant lesions of the penis. Scand J Urol Nephrol Suppl. 2000;205:201-214.
17. Cubilla AL, Velazquez EF, Reuter VE, et al. Warty (condylomatous) squamous cell carcinoma of the penis: a report of 11 cases and proposed classification of ‘verruciform’ penile tumors. Am J Surg Pathol. 2000;24(4):505-512.
18. Barbagli G, Palminteri E, Mirri F, et al. Penile carcinoma in patients with genital lichen sclerosus: a multicenter survey. J Urol. 2006;175(4):1359-1363.
19. Burgers JK, Badalament RA, Drago JR. Penile cancer: clinical presentation, diagnosis, and staging. Urol Clin North Am. 1992;19:247-256.
20. Cubilla AL. The role of pathologic prognostic factors in squamous cell carcinoma of the penis. World J Urol. 2009;27:169-177.
21. Moch H, Cubilla AL, Humphrey PA, Reuter VE, Ulbright TM. The 2016 WHO classification of tumours of the urinary system and male genital organs-part A: renal, penile, and testicular tumours. Eur Urol. 2016;70:93-105.
22. National Comprehensive Cancer Network. NCCN Clinical Practice Guidelines in Oncology: Penile Cancer. Version 1.2025. Published May 2025.
23. Cubilla AL, Barreto J, Caballero C, Ayala G, Riveros M. Pathologic features of epidermoid carcinoma of the penis: a prospective study of 66 cases. Am J Surg Pathol. 1993;17(8):753-763.
24. IARC. Urinary and Male Genital Tumours. WHO Classification of Tumours. 5th ed. Vol. 8. Lyon, France: IARC; 2022.
25. Velazquez EF, Ayala G, Liu H, et al. Histologic grade and perineural invasion are more important than tumor thickness as predictors of nodal metastasis in penile squamous cell carcinoma invading 5 to 10 mm. Am J Surg Pathol. 2008;32(7):974-979.
26. Cubilla AL, Piris A, Pfannl R, et al. Anatomic levels: important landmarks in penectomy specimens: a detailed anatomic and histologic study based on examination of 44 cases. Am J Surg Pathol. 2001;25:1091-1094.
27. Sand FL, Lindquist S, Aalborg GL, Kjaer SK. The prognostic value of p53 and Ki-67 expression status in penile cancer: a systematic review and meta-analysis. Pathology. 2025;57(3):276-284.
28. EAU/ASCO Collaborative Guidelines on Penile Cancer. Published 2023.
29. Chaux A, Caballero C, Soares F, et al. The prognostic index: a useful pathologic guide for prediction of nodal metastases and survival in penile squamous cell carcinoma. Am J Surg Pathol. 2009;33:1049-1057.
30. Bozzini G, Provenzano M, Romero J, et al. Role of penile Doppler US in the preoperative assessment of penile squamous cell carcinoma patients: results from a large prospective multicenter European study. Urology. 2016;90:131.
31. Fischerova D, Garganese G, Reina H, et al. Terms, definitions and measurements to describe sonographic features of lymph nodes: consensus opinion from the Vulvar International Tumor Analysis (VITA) group. Ultrasound Obstet Gynecol. 2021;57:861-879.
32. Hanchanale V, Yeo L, Subedi N, et al. The accuracy of magnetic resonance imaging (MRI) in predicting the invasion of the tunica albuginea and the urethra during the primary staging of penile cancer. BJU Int. 2016;117:439.
33. Galgano SJ, Norton JC, Porter KK, et al. Imaging for the initial staging and post-treatment surveillance of penile squamous cell carcinoma. Diagnostics (Basel). 2022;12:120.
34. Salazar A, Junior EP, Salles PGO, et al. 18F-FDG PET/CT as a prognostic factor in penile cancer. Eur J Nucl Med Mol Imaging. 2018;46(4):855-863.
35. Solsona E, Iborra I, Rubio J, et al. Prospective validation of the association of local tumor stage grade as a predictive factor for occult lymph node micrometastasis in patients with penile carcinoma and clinically negative inguinal lymph nodes. J Urol. 2001;165(5):1506-1509.
36. Ficarra V, Akduman B, Bouchot O, et al. Prognostic factors in penile cancer. Urol Int. 2010;76(Suppl 2):66-73.
37. Slaton JW, Morgenstern N, Levy DA, et al. Tumor stage, vascular invasion and the percentage of poorly differentiated cancer: independent prognosticators for inguinal lymph node metastasis in penile squamous cancer. J Urol. 2001;165(4):1138-1142.
38. Ottenhof SR, Vegt E. The role of PET/CT imaging in penile cancer. Transl Androl Urol. 2017;6(5):833-838. doi:10.21037/tau.2017.04.36
39. Barua SK, Kaman PK, Baruah SJ, et al. Role of diffusion-weighted magnetic resonance imaging (DWMRI) in assessment of primary penile tumor characteristics and its correlations with inguinal lymph node metastasis: a prospective study. World J Oncol. 2018;9:145-150.
40. Scher B, Seitz M, Reiser M, et al. 18F-FDG PET/CT for staging of penile cancer. J Nucl Med. 2005;46:1460-1465.
41. Sadeghi R, Gholami H, Zakavi SR, et al. Accuracy of 18F-FDG PET/CT for diagnosing inguinal lymph node involvement in penile squamous cell carcinoma: systematic review and meta-analysis of the literature. Clin Nucl Med. 2012;37:436-441.
42. Leijte JA, Graafland NM, Valdés Olmos RA, et al. Prospective evaluation of hybrid 18F-fluorodeoxyglucose positron emission tomography/computed tomography in staging clinically node-negative patients with penile carcinoma. BJU Int. 2009;104:640-644.
43. Alkatout I, Naumann C, Hedderich J, et al. Squamous cell carcinoma of the penis: predicting nodal metastases by histologic grade, pattern of invasion and clinical examination. Urol Oncol. 2011;29(6):774-781.
44. Ficarra V, Novara G, Boscolo-Berto R, et al. How accurate are present risk group assignment tools in penile cancer? World J Urol. 2009;27(2):155-160.
45. Zhu Y, Zhang HL, Yao XD, et al. Development and evaluation of a nomogram to predict inguinal lymph node metastasis in patients with penile cancer and clinically negative lymph nodes. J Urol. 2010;184(2):539-545.
46. Luo J, Hu J, Mulati Y, et al. Developing and validating a nomogram for penile cancer survival: a comprehensive study based on SEER and Chinese data. Cancer Med. 2024;13:e7111.
47. Zhang W, Gao P, Gao J, Wu X, Liu G, Zhang X. A clinical nomogram for predicting lymph node metastasis in penile cancer: a SEER-based study. Front Oncol. 2021;11:640036.
48. Wu C, Li Z, Guo S, Zhou F, Han H. Development and validation of a nomogram for the prediction of inguinal lymph node metastasis extranodal extension in penile cancer. Front Oncol. 2021;11:675565.
49. Xu W, Qi F, Liu Y, Zheng L, Kang Z. Nomograms to predict overall and cancer-specific survival in patients with penile cancer. Transl Cancer Res. 2020;9(4):2326-2339. doi:10.21037/tcr.2020.03.77
50. Necchi A, Lo Vullo S, Mariani L, et al. Nomogram-based prediction of overall survival after regional lymph node dissection and the role of perioperative chemotherapy in penile squamous cell carcinoma: a retrospective multicenter study. Urol Oncol. 2019;37(8):531.e7-531.e15.
51. Zhang S, Li W, Liang F. Clinical value of fluorine-18 2-fluoro-2-deoxy-D-glucose positron emission tomography/computed tomography in penile cancer. Oncotarget. 2016;7:48600-48606.
52. Issa A, et al. Treatment options and outcomes for men with penile intraepithelial neoplasia: a systematic review. Eur Urol Focus. 2022;8:829.
53. Shabbir M, Muneer A, Kalsi J, et al. Glans resurfacing for the treatment of carcinoma in situ of the penis: surgical technique and outcomes. Eur Urol. 2011;59(1):142-147. doi:10.1016/j.eururo.2010.09.039
54. Pappas A, Katafigiotis I, Waterloos M, Spinoit AF, Ploumidis A. Glans resurfacing with skin graft for penile cancer: a step-by-step video presentation of the technique and review of the literature. Biomed Res Int. 2019;2019:5219048.
55. Philippou P, Shabbir M, Malone P, et al. Conservative surgery for squamous cell carcinoma of the penis: resection margins and long-term oncological control. J Urol. 2012;188:803.
56. Austoni E, Guarneri A, Colombo F, et al. Reconstructive surgery for penile cancer with preservation of sexual function. Eur Urol Suppl. 2008;7:116.
57. Roussel E, Peeters E, Vanthoor J, et al. Predictors of local recurrence and its impact on survival after glansectomy for penile cancer: time to challenge the dogma? BJU Int. 2021;127(5):606-613.
58. Sakalis VI, et al. What is the most effective management of the primary tumor in men with invasive penile cancer: a systematic review of the available treatment options and their outcomes. Eur Urol Open Sci. 2022;40:58.
59. Korkes F, Neves-Neto OC, Wroclawski ML, et al. Parachute technique for partial penectomy. Int Braz J Urol. 2010;36:198-201.
60. Kamel MH, Tao J, Su J, et al. Survival outcomes of organ-sparing surgery, partial penectomy, and total penectomy in pathological T1/T2 penile cancer: report from the National Cancer DataBase. Urol Oncol. 2018;36(2):82.e7-82.e15.
61. Garaffa G, Raheem AA, Christopher NA, Ralph DJ. Total phallic reconstruction after penile amputation for carcinoma. BJU Int. 2009;104:852-856.
62. Tan X, Cai T, Wang Y, et al. Regional lymph node mapping in patients with penile cancer undergoing radical inguinal lymph node dissection: a retrospective cohort study. Int J Surg. 2024;110(5):2865-2873.
63. Winters BR, Mossanen M, Holt SK, et al. Predictors of nodal upstaging in clinical node-negative patients with penile carcinoma: a National Cancer Database analysis. Urology. 2016;96:29-34.
64. Fankhauser CD, Teoh JY, Chung K, et al. Lymphovascular and perineural invasion are risk factors for inguinal lymph node metastases in men with T1G2 penile cancer. J Cancer Res Clin Oncol. 2022;148:2231-2237.
65. Chipollini J, Tang DH, Gilbert SM, et al. Delay to inguinal lymph node dissection greater than 3 months predicts poorer recurrence-free survival for patients with penile cancer. J Urol. 2017;198(6):1346-1352.
66. Gebruers J, Elst L, Baldewijns M, et al. Accuracy of dynamic sentinel lymph node biopsy for inguinal lymph node staging in cN0 penile cancer. EJNMMI Res. 2023;13(1):62.
67. Catalona WJ. Modified inguinal lymphadenectomy for carcinoma of the penis with preservation of saphenous veins: technique and preliminary results. J Urol. 1988;140:306.
68. Thyavihally YB, Dev P, Waigankar SS, et al. Comparative study of perioperative and survival outcomes after video endoscopic inguinal lymphadenectomy (VEIL) and open inguinal lymph node dissection (O-ILND) in the management of inguinal lymph nodes in carcinoma of the penis. J Robot Surg. 2021;15(6):905-914.
69. Saisorn I, Lawrentschuk N, Leewansangtong S, Bolton DM. Fine-needle aspiration cytology predicts inguinal lymph node metastasis without antibiotic pretreatment in penile carcinoma. BJU Int. 2006;97:1225.
70. Koifman L, Hampl D, Koifman N, et al. Radical open inguinal lymphadenectomy for penile carcinoma: surgical technique, early complications and late outcomes. J Urol. 2013;190:2086.
71. Thyavihally YB, Dev P, Waigankar SS, et al. Comparative study of perioperative and survival outcomes after video endoscopic inguinal lymphadenectomy (VEIL) and open inguinal lymph node dissection (O-ILND) in the management of inguinal lymph nodes in carcinoma of the penis. J Robot Surg. 2021;15(6):905-914.
72. Sharma P, Djajadiningrat R, Zargar-Shoshtari K, et al. Adjuvant chemotherapy is associated with improved overall survival in pelvic node-positive penile cancer after lymph node dissection: a multi-institutional study. Urol Oncol. 2015;33:496.e17.
73. Heyns CF, Fleshner N, Sangar V, et al. Management of the lymph nodes in penile cancer. Urol Int. 2010;76(Suppl 2):43-57.
74. Daseler EH, Anson BJ, Reimann AF. Radical excision of the inguinal and iliac lymph glands: a study based upon 450 anatomical dissections and upon supportive clinical observations. Surg Gynecol Obstet. 1948;87(6):679-694.
75.Luzarraga Aznar A, Pérez-Benavente A, Cabrera S, Bebia V, Gil-Moreno A, Angeles MA. Inguinofemoral lymphadenectomy technique in 10 steps. Int J Gynecol Cancer. 2023;33(11):1823-1824. Published 2023 Nov 6.
76. Bishoff JA, Lackland AFB, Basler JW, et al. Endoscopy subcutaneous modified inguinal lymph node dissection (ESMIL) for squamous cell carcinoma of the penis. J Urol. 2003;169:78.
77. Liu JY, et al. The risk factors for the presence of pelvic lymph node metastasis in penile squamous cell carcinoma patients with inguinal lymph node dissection. World J Urol. 2013;31:1519.
78. Yao K, et al. Lymph node mapping in patients with penile cancer undergoing pelvic lymph node dissection. J Urol. 2021;205:145.
79. Chipollini J, Tang DH, Gilbert SM, et al. Identifying an optimal lymph node yield for penile squamous cell carcinoma: prognostic impact of surgical dissection. BJU Int. 2020;125:82.
80. Pertuz W, Cabrera M, Estrada A, et al. Guía del cáncer de pene de la Sociedad Colombiana de Urología. Urol Colomb. 2022;31(1):e32-e40.
81. Sakalis VI, Campi R, Barreto L, et al. What is the most effective management of the primary tumor in men with invasive penile cancer: a systematic review of the available treatment options and their outcomes. Eur Urol Open Sci. 2022;40:58-94.
82. Cordoba A, Casas F, Perea A, et al. Low-dose brachytherapy for early-stage penile cancer: a 20-year single-institution study (73 patients). Radiat Oncol. 2016;11:96.
83. Pettaway CA, Nicholson S, Spiess PE, et al. The international penile advanced cancer trial (InPACT): the first phase III trial for squamous carcinoma of the penis with regional lymph node metastases. J Clin Oncol. 2022;40(6_suppl):TPS7.
84. Ager M, Rehfuss M, Eswara JR, et al. Long-term multicentre experience of adjuvant radiotherapy for pN3 squamous cell carcinoma of the penis. BJU Int. 2021;128:451.
85. Jaipuria J, Waigankar S, Bakshi G, et al. Adjuvant radiation compares favorably to chemotherapy in patients with carcinoma penis and nodal positivity restricted to groin. Urol Oncol. 2020;38:641.e9.
86. Azizi M, Rehman S, Chipollini J, et al. Systematic review and meta-analysis: is there a benefit in using neoadjuvant systemic chemotherapy for locally advanced penile squamous cell carcinoma? J Urol. 2020;203:1147.
87. Pagliaro LC, Williams DL, Daliani DD, et al. Neoadjuvant paclitaxel, ifosfamide, and cisplatin chemotherapy for metastatic penile cancer: a phase II study. J Clin Oncol. 2010;28:3851. doi:10.1200/JCO.2010.28.3710
88. Raup V, Wang R, DiNatale R, et al. MP49-09 – Adjuvant chemotherapy in the treatment of lymph node positive squamous cell carcinoma of the penis: analysis of the National Cancer Data Base. J Urol. 2019;201:e709.
89. Paz Rojas JF, Castillo L, González B, et al. Effectiveness and safety of adjuvant chemotherapy compared to neoadjuvant chemotherapy in patients with penile cancer and positive lymph nodes regarding overall survival and disease-free survival: a systematic review and meta-analysis. Urol Oncol. 2022;40:200.e11.

