INTRODUCCIÓN Y CONTEXTO HISTÓRICO DEL TRASPLANTE EN CHILE
El trasplante renal constituye el tratamiento de elección para la enfermedad renal crónica (ERC) terminal, al ofrecer una mayor expectativa y calidad de vida a los receptores, además de ser la alternativa más costo-efectiva para el tratamiento de la falla renal terminal (1).
La historia del trasplante renal en humanos se remonta a la década de 1950 con los primeros intentos realizados en París y Boston. Estos trasplantes pioneros, que se realizaban sin inmunosupresión, incluyeron el primer trasplante de donante vivo, el cual presentó función inmediata, pero fue seguido de un rechazo agudo precoz. Un hito fundamental ocurrió en 1954 en Boston: el primer trasplante exitoso entre gemelos idénticos. Estas experiencias iniciales consolidaron aspectos técnicos fundamentales y plantearon los primeros desafíos inmunológicos, sentando las bases para el desarrollo de la inmunosupresión (2).
Durante la década de 1960 se lograron avances cruciales, como el desarrollo de agentes inmunosupresores (Azatioprina) y técnicas de preservación de injertos. Es en este periodo donde se establecieron esquemas combinados de inmunosupresión con esteroides, vigentes hasta hoy. Hacia fines de los años 60, el trasplante renal ya se había consolidado como tratamiento estándar para la ERC terminal en Estados Unidos (2).
En Chile, el trasplante renal inició su historia en la década de 1960 bajo el liderazgo del inmunólogo Dr. Fernando Morgado, jefe del Departamento de Medicina Experimental del Hospital José Joaquín Aguirre. Este proceso culminó en 1966 con el primer trasplante renal de donante fallecido, realizado por un equipo quirúrgico liderado por cirujanos vasculares. Dos años después (1968), el mismo centro realizó el primer trasplante de donante vivo del país. En el mes de julio de ese mismo año se inició el programa en hospitales públicos con tres trasplantes renales exitosos realizados en el Hospital del Salvador y luego en el Hospital San Juan de Dios (3). Estos equipos quirúrgicos, liderados por cirujanos vasculares del servicio de Cirugía del Dr. Juan Allamand, Drs. Walter Sunkel y Guillermo Piwoka y urólogos, el Dr. Fernando Hidalgo (Hospital del Salvador) y el Dr. Roberto Vargas (Hospital José Joaquín Aguirre), enfrentaron enormes desafíos éticos en la época.
Realizar trasplante de donante fallecido en esos años, constituía una gran hazaña, pues en aquella época se consideraba muerto a quien le dejaba de latir el corazón, lo que era una limitación importante en la obtención de órganos de cadáver. El límite entre la vida y la muerte era un punto de discusión ética importante, hasta ese entonces la muerte encefálica no estaba definida, ni normada, la necesidad de donantes fallecidos genera un debate multidisciplinario y trascendental, que revoluciona el pensamiento humano al revisar el concepto de muerte.
Los equipos de trasplante pasaban noches en vigilia esperando que pacientes críticos evolucionaran con paro cardiorespiratorio para poder realizar el procuramiento inmediatamente ocurrido el paro, incluso nefrólogos colaboraron con extracción ante la premura de constituir rápidamente el equipo quirúrgico. La ausencia de protocolos modernos de transporte y soluciones de preservación eficaces obligaba a realizar el trasplante de forma inmediata y sucesiva tras el procuramiento. Resultó fundamental la integración de especialidades médicas y el trabajo en equipo, se trabajó de manera cohesionada, superando barreras y creencias establecidas, para hacer posible los primeros trasplantes.
Avances significativos llegaron en la década de 1980 con el desarrollo de las Unidades de Tratamiento Intensivo, la aceptación del concepto de muerte encefálica y la creación de soluciones de preservación que permitieron el almacenamiento temporal y el transporte seguro de órganos (3).
La valentía, perseverancia y compromiso de estos equipos fueron fundamentales para el desarrollo y consolidación del trasplante renal en el país y en Latinoamérica, sentando las bases del programa que conocemos en la actualidad.
EPIDEMIOLOGÍA
Según la Encuesta Nacional de Salud (ENS) 2016-2017, la prevalencia de ERC en etapas 3 a 5 en la población general de Chile alcanza el 3%, reflejando un aumento con respecto a la ENS 2009-2010. Se estima que la prevalencia de ERC en etapas 4 y 5 es de 0.5% a nivel poblacional (4).
Diabetes mellitus se identifica como la principal causa de ERC terminal, siendo el factor etiológico en el 42% de los pacientes en diálisis, seguida por la hipertensión arterial (HTA) con 14%, y la glomerulonefritis crónica con 7.7% (5). Para estos pacientes, la hemodiálisis sigue siendo la terapia de reemplazo renal más utilizada (6).
Si bien la tasa de trasplante renal en Chile ha mostrado un incremento en los últimos años, en 2019 se registró una tasa de 17 trasplantes por millón de personas (pmp), cifra que aún está muy por debajo de países como España (50-67 pmp) y Reino Unido (35 pmp) (7).
Este déficit está directamente asociado a la baja tasa de donación de órganos. En el año 2023 Chile presentó una tasa de 8.9 donantes fallecidos pmp, muy por debajo de España (49 pmp), Estados Unidos (48 pmp) y otros países latinoamericanos como Uruguay (19.7 pmp), Argentina y Brasil (17 pmp) (8). Reducir esta brecha requiere duplicar el número de donantes mediante estrategias de concientización y fortalecimiento de la procuración de órganos.
Según estadísticas del Instituto de Salud Pública (ISP) en el Registro Nacional de Trasplante y listas de espera, hasta el 31 de diciembre de 2023, se habían realizado en Chile 10.223 trasplantes renales, 70% de éstos de donante fallecidos. Más del 60% de los trasplantes renales, se realizaron en receptores entre 18 y 55 años. En general la espera es mayor de un año para recibir una donación, con una espera promedio de 3 años (9).
De un total de 13.000 pacientes en hemodiálisis el año 2023, menos de un 10% de ellos se encontraba activo en lista de trasplante (5). En Chile el año 2024 se realizaron 430 trasplantes renales, de éstos el 75.8% de los trasplantes renales corresponden a trasplante con donante fallecido, según la última estadística del ISP de trasplante de órganos y listas de espera 2024 (10).
Frente a este panorama, es fundamental fortalecer estrategias de concientización sobre la donación de órganos, con el objetivo de reducir los tiempos de espera y mejorar el acceso al trasplante renal en Chile.
EVALUACIÓN DEL RECEPTOR
Aunque el trasplante renal ofrece mayores beneficios en el tratamiento de ERC terminal respecto de la diálisis, su acceso está restringido por criterios de elegibilidad estrictos. Estadísticas recientes muestran que, de los pacientes dializados, únicamente el 9% integra la lista de espera, mientras el 78% no son candidatos a trasplante y el 12% opta por no recibirlo (5).
Dentro de las contraindicaciones absolutas se consideran: cáncer no controlado, infecciones agudas/crónicas sin tratamiento o expectativa de vida inferior a 24 meses (7).
El proceso de evaluación, al igual que la terapia de sustitución renal, el trasplante propiamente tal y su manejo posterior, se encuentra garantizado en Chile. El estudio se inicia una vez que el paciente es evaluado por el nefrólogo con clearence <30 ml/min y se plantea la terapia de sustitución renal; si el paciente es candidato a trasplante renal, éste debe ser considerado y propuesto como opción y el paciente derivado a un Centro de Trasplante e ingresado a lista de espera (7).
En esta etapa de ingreso a lista de espera el paciente debe ser informado de todos los riesgos y beneficios del trasplante, dejando registro de la aceptación o rechazo del mismo. Este consentimiento debe renovarse todos los años en el centro de diálisis respectivo (7).
Para ser incluido en la lista de espera, el paciente debe presentar insuficiencia renal terminal, definida como un clearance de creatinina menor a 20 mL/min, ya sea en tratamiento con diálisis o en fase previa a su inicio. No obstante, el concepto de «Trasplante Renal Preemptivo» (Preemptive Kidney Transplant) busca, siempre que sea posible, realizar el trasplante antes de que el paciente requiera terapia de sustitución renal, con el fin de mejorar los resultados clínicos y la calidad de vida (11).
Dentro del estudio pre-trasplante, se incluye el Estudio Inmunológico y de Histocompatibilidad, estudio serológico, que incluye VIH y Hepatitis, además de posibles infecciones latentes. Debe considerarse la evaluación multidisciplinaria por especialistas (7).
En relación con el estudio urológico, es importante considerar:
- La evaluación urológica debe realizarse en pacientes hombres mayores de 50 años, pacientes con patología o cirugías urológicas, como trasplante renal previo.
- Examen físico, con principal atención en IMC ya que este un IMC > 30 se asocia a mayor riesgo de pérdida del injerto, retardo en la función del injerto, diabetes post-traplante y complicaciones de la herida. Deben registrarse cicatrices abdominales y realizar examen genital y pulsos de extremidades inferiores.
- La cistoscopía no es necesaria en todo paciente; se justifica en pacientes con riesgo de cáncer vesical (tabaquismo, dosis altas de cilofosfamida, exposición a arsénico) o en estudio de hematuria, infección urinaria recurrente, sospecha de estenosis uretral o antecedentes de cirugía urológica por vía uretral previa. Si bien puede ser de utilidad en la medición de capacidad vesical, se debe considerar que es un procedimiento invasivo y que la capacidad vesical no contraindica el trasplante renal, se puede inferir de historia clínica y evaluar en forma intraoperatoria.
- Uretrocistografía retrograda y miccional y Estudio Urodinámico, en casos seleccionados.
- Si se pesquisa alteraciones anatómicas obstructivas como crecimiento prostático benigno o estrechez uretral en pacientes oligoanúricos, se recomienda diferir su resolución quirúrgica en período postrasplante diferido.
- Los pacientes con enfermedad renal poliquística deben ser evaluados con tomografía computada de abdomen y pelvis, para decidir la necesidad de nefrectomía previo al trasplante; esta última está indicada en caso riñones de gran volumen que ocupen fosa iliaca, hematuria, infecciones recurrentes o sospecha de malignidad. En casos seleccionados también se puede plantear una terapia endovascular (12).
- En relación con el tamizaje de patologías oncológicas se siguen las recomendaciones de la población general, teniendo en consideración mayor riesgo de cáncer renal en pacientes con más de 3 años en diálisis, antecedentes familiares, nefropatía asociada a analgésico y la enfermedad quística adquirida (12).
- Los cánceres previos no constituyen una contraindicación para el trasplante y los plazos para aprobar el ingreso a lista de espera dependerán del tipo de cáncer y su agresividad. En el caso de cánceres urológicos tratados se recomienda no postergar el trasplante en pacientes con cáncer de próstata bajo riesgo, cáncer renal incidental pT1a sin factores de riesgo y cáncer de vejiga de bajo riesgo (13).
- Estudio vascular dirigido a la evaluación de vasos iliacos por riesgo de calcificación de arterias ilíacas debe realizarse en pacientes con hemodiálisis por tiempo prolongado o factores de riesgo para enfermedad ateroesclerótica. El estudio vascular- venoso en pacientes que han utilizados catéteres femorales para diálisis, se indica por riesgo de trombosis o estenosis venosas.
POTENCIAL DONANTE FALLECIDO POR MUERTE ENCEFÁLICA
Notificación y Estudio
El proceso de donación de órganos inicia con la identificación y notificación de un potencial donante, donde es obligación del médico de turno notificar al coordinador de procuramiento de esta situación. Se debe consignar muerte encefálica (ME), lo que corresponde a un diagnóstico clínico basado en la presencia o ausencia de respuesta frente a un estímulo neurológico, y se define como la pérdida total de las funciones del cerebro, incluyendo tronco cerebral. Esta evaluación la realiza el médico tratante en conjunto con neurólogo o neurocirujano (14).
Una serie de prerrequisitos deben existir antes de la evaluación de muerte encefálica (11):
- Historia de trauma encefalocraneano catastrófico, origen conocido e irreversible.
- Oxigenación y ventilación adecuadas.
- Temperatura corporal >32°C
- Descartar trastornos endocrino-metabólicos severos
- Ausencia de tóxicos o fármacos depresores del SNC.
Determinado este escenario y descartado otras causas que pudiesen simular un escenario de ME, deben ser identificados 3 aspectos para confirmar ME (11):
- Coma arreactivo
- Ausencia de reflejos de tronco encefálico (ausencia de reflejo fotomotor, reflejo corneal, reflejo oculocefálico, reflejo oculovestibular, reflejo nauseoso, reflejo tusígeno, respiración espontánea y respuesta al test de atropina)
- Apnea (PCO2 >60 mmHg)
Las contraindicaciones para la donación se especifican en la Tabla 1
| Contraindicaciones absolutas de donación | Contraindicaciones relativas de donación |
| VIH + | Edad |
| Neoplasias | Comorbilidades: DM2, HTA, Obesidad mórbida |
| Infecciones diseminadas no controladas | Portador de Hepatitis crónica |
Tabla 1. Contraindicaciones de donación (7)
Será un donante elegible con criterio estándar: Edad < 60 años o <55 años con antecedentes de HTA mal controlada o DM2. Función renal creatinina <1,5 mg/dL, eVFG >60ml/min y diuresis>1ml/kg/hr. Proteinuria IPC <500mg/g.
Los Donantes con Criterio Expandido (DCE), corresponden a donantes cuyos parámetros clínicos se alejan del ideal; la inclusión de estos donantes ha contribuido a aumentar la cantidad de órganos trasplantados. Son condiciones que se rechazan normalmente por asociarse a menor sobrevida del injerto luego del trasplante, pero otorgan de todas formas mayor sobrevida a estos pacientes.
Sus criterios son (11):
1) Edades extremas (<5 años y >60 años).
2) Mayor de 55 años con historia de hipertensión arterial, diabetes mellitus o accidente vascular
isquémico.
3) Anatomía anormal del órgano extraído.
4) Función Renal:
– Creatinina >1,5 mg/dl con:
– eVFG >40 ml/min
– Diuresis >1 ml/kg/h
5) Órganos con isquemia fría prolongada (Riñones >30 horas).
DONANTE EN ASISTOLIA O MUERTE CIRCULATORIA
Con el afán de expandir la disponibilidad de órganos, se ha incluido la opción de optar por potenciales donantes por muerte circulatoria. Se consideran donantes no ideales, por estar expuestos a isquemia caliente en momento del fallecimiento por paro cardiorespiratorio.
Se categorizan utilizando la clasificación de Maastricht (11):
-Donación en asistolía no controlada
- Tipos I: fallecido a la llegada. La muerte ocurre fuera de recinto hospitalario, sin maniobras de reanimación
- Tipo II: Muerte por paro cardiaco luego de reanimación infructuosa.
-Donación en asistolía controlada
- Tipo III: muerte circulatoria tras la retirada de medidas de soporte vital. Esta es la modalidad más frecuente en este tipo de donación.
Se procede al retiro de soporte vital y luego de 5 minutos de asistolia el paciente es declarado fallecido, pues se ha demostrado que las funciones cerebrales tras 5 min de asistolia no son recuperables, incluso con reanimación exitosa luego de transcurridos los 5 minutos.
- Tipo IV: cese de la función circulatoria y respiratoria después de la muerte encefálica.
En Chile no contamos con esta modalidad de donación, no existe regulación al respecto.
DONANTE VIVO
El trasplante renal con donante vivo presenta ventajas significativas frente al de donante fallecido, incluyendo:
- Menor tiempo de espera para el procedimiento.
- Mayor tasa de supervivencia del injerto a largo plazo.
- Reducción del tiempo de isquemia fría.
- Disminución de la incidencia de rechazo agudo.
- Mejor supervivencia global del receptor.
El Objetivo primario de la evaluación del donante vivo es minimizar riesgos perioperatorios y a largo plazo.
La evaluación incluye (15):
Estudio preoperatorio completo:
- Tamizaje de hipertensión arterial
- Evaluación metabólica (glicemia, perfil lipídico)
- Factores de riesgo cardiovascular: IMC, antecedentes familiares de diabetes mellitus, tabaquismo
Consentimiento informado:
- Comunicación explícita de riesgos, incluyendo mortalidad perioperatoria (0.003% a 90 días posterior a la donación)
Compatibilidad inmunológica:
- Tipificación ABO y HLA
- Descartar enfermedades transmisibles (VHB, VHC, VIH, CMV, EBV, Treponema pallidum)
Función renal:
- Estimación de la filtración glomerular
- Descarte de albuminuria y hematuria microscópica (requiere estudio urológico en caso de presentarse)
Evaluación anatómica (AngioTAC renal):
- Número, calibre y patrones de bifurcación arterial/venosa. De vital importancia para la planificación quirúrgica adecuada de la extracción y trasplante.
- Variantes anatómicas
Detección de litiasis:
- Las litiasis estarán presentes en 11% de los donantes y 3% tendrán historia previa de síntomas. Un cálculo en riñón solitario puede generar falla renal aguda, por lo que debe estudiarse su riesgo previo a la donación (historia clínica, TAC).
- Si se evidencia litiasis, se sugiere estudio metabólico con PTH intacta, y evaluación metabólica en orina de 24 horas.
- Los factores asociados a recurrencia son diagnóstico antes de los 40 años, recurrencias previas, historia familiar de cálculos. Son factores de bajo riesgo: litiasis única, asintomática, sin cálculos previos.
- El hallazgo de litiasis no contraindica la donación, debe valorarse el riesgo para el donante. Cálculos en riñón donado, pueden extraerse ex vivo en cirugía de banco.
DONANTE VIVO CRUZADO
Corresponde a una opción para receptores que cuentan con un donante apto, sin compatibilidad inmunológica óptima, que afecta al 30% de los casos. En estas circunstancias el donante puede enrolarse en un listado de pacientes en situación similar. Mediante un estudio acabado del caso y coordinación adecuada, se ha logrado realizar trasplantes con donante vivo cruzado, incluso procedentes de distintos centros de trasplante. Actualmente esta modalidad de donación en Chile ha permitido realizar trasplantes renales con éxito desde el año 2023.
PROCURAMIENTO RENAL
Para la obtención de injertos de la mejor calidad es fundamental realizar una técnica quirúrgica estandarizada que permita evitar daños de órganos, y que estos sean preservados de forma adecuada para optimizar los resultados del trasplante.
Este punto es importante de destacar, ya que no siempre se le da la importancia necesaria a la extracción renal y debería ser considerada en la formación de todo urólogo, sobre todo en nuestra realidad nacional, que dada sus características geográficas hece necesario contar con especialistas calificados en distintas zonas del país, para así evitar el desplazamiento de equipos quirúrgicos y además lograr realizar una cirugía oportuna, técnicamente óptima y evitar pérdida de injertos, que lamentablemente existen asociados a injuria quirúrgica y problemas en embalaje de órganos.
Procuramiento renal donante fallecido
En este grupo podemos encontrar donantes con muerte encefálica (DME) y donantes con muerte circulatoria. En nuestra realidad nacional contamos con DME, en su mayoría multiorgánicos, seguidos por los DME en los que se procuran exclusivamente los riñones.
Previo a la realización de la cirugía es conveniente revisar si contamos con imágenes que permitan identificar variantes anatómicas vasculares o de vía urinaria, y así disminuir riesgos de injuria quirúrgica.
Procuramiento renal donante fallecido, exclusivo renal
Este grupo corresponde a menos del 20% de total de donantes, al ser una cirugía infrecuente, y existiendo una menor exposición a cirugía abierta, su aprendizaje puede ser más complejo, pero constituye una cirugía estandarizada y reproducible.
Técnica Quirúrgica
Podemos dividir los tiempos quirúrgicos en 3 etapas:
- Exploración, disección y detección de anomalías o variantes anatómicas.
- Canulación y perfusión in situ.
- Extracción.
- Exploración y disección
El paciente es posicionado en posición decúbito supino, con las extremidades superiores en abducción forzada. Se realiza instalación de sonda nasogástrica y sonda vesical. Se realiza una incisión media desde el apéndice xifoides hasta la sínfisis del pubis; habitualmente se prolonga la incisión en cruz, por sobre el nivel del ombligo, y se fijan los vértices. Se seccionan los ligamentos redondo y falciforme y se realiza una exploración de toda la cavidad abdominal. Se accede al retroperitoneo, realizando una incisión del peritoneo parietal, mediante la maniobra de Cattell-Brasch, liberando el parietocólico derecho por la fascia de Toldt hasta ángulo hepático del colon y liberación a medial hasta ángulo de Treitz. Se realiza una maniobra de Kocher, rechazando duodeno y cabeza de páncreas a medial. El intestino delgado se cubre con compresas y se rechaza a cefálico, fuera del campo quirúrgico. Después de esta exposición se diseca la arteria aorta (AA) y vena cava (VC) inferior, sobre el nivel de bifurcación donde se realizará la canulación (Imagen 1). En este punto es importante identificar variantes anatómicas, como vasos renales accesorios, que hasta en un 3% pueden emerger incluso de la arteria iliaca, en cuyo caso es necesario modificar el sitio de canulación. Luego se procede a disecar, ligar y seccionar la arteria mesentérica inferior. Se libera riñón derecho e izquierdo, por plano de Gerota, requiriendo ventana de mesenterio a izquierda. En esta etapa no se debe manipular el hilio renal. Se diseca VC sobre el hilio renal y se deja controlada con sutura gruesa. Se diseca, liga y secciona la arteria mesentérica superior. Se diseca el hilio hepático, y se liga la vena porta. Se disecan y seccionan los pilares del diafragma, y se controla la AA infradiafragmática.
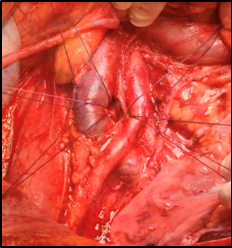
Fig. 1. Visión del retroperitoneo, con vena cava rechazada a la derecha y aorta y su bifurcación hacia la izquierda
Canulación y Perfusión
Heparinización sistémica (300U/kg). Ligadura de VC y AA sobre nivel de bifurcación iliaca, con una de las suturas previamente instaladas. Se realiza incisión transversa sobre cara anterior de la aorta 2 a 3 cm sobre nivel de bifurcación, y previa compresión contra la columna de su porción más proximal. Se instala Cánula de perfusión 24 Fr pinzada, y se fija con segunda sutura. Venotomía cava al mismo nivel, introduciendo cánula pinzada, y fijándola (Imagen 2). Ligadura de AA y VC Infradiafragmática. Se inicia perfusión, iniciando el Tiempo de Isquemia Fría. Se abre la cánula de VC para vaciamiento. Se coloca hielo alrededor de grasa pararrenal. Se completa perfusión con 4 litros de solución de preservación hasta lograr salida líquido claro.
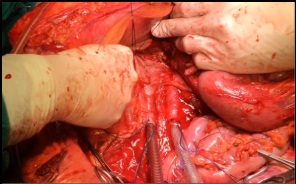
Fig. 2. Cánulas instaladas en grandes vasos y doble ligadura de vena cava sobre los vasos renales
- Extracción y embalaje: Esta se puede realizar en forma individual o en bloque.
- Individual: sección uréteres bajo cruce de iliacos, sección de vena gonadal. Sección de vena renal izquierda en su llegada a vena cava. Apertura aorta por línea media anterior visualización de ostiums renales, sección de aorta por línea media posterior, respetando parche aórtico. Liberación de riñón de estructuras vecinas por plano de psoas, respetando grasa perirrenal.
- En Bloque: Sección uréteres bajo cruce de iliacos, se recomienda marcar lateralidad con instrumental quirúrgico (Kelly recta/ curva). Sección de venas gonadales. Sección aorta y cava, caudal a nivel de cánulas. Disección a proximal, seccionando tejido retroaórtico y vasos lumbares. Disección y liberación de riñón de estructuras perirrenales, sección de VC y AA sobre nivel de hilio renal y extracción. Una vez extraídos se realiza sección de AA por línea media de su cara posterior (Figura 3) de caudal a proximal, se identifican ostiums renales. Sección de vena renal izquierda, en su llegada a VC, dejando parche de cava completo junto con riñón derecho (Figura 4).
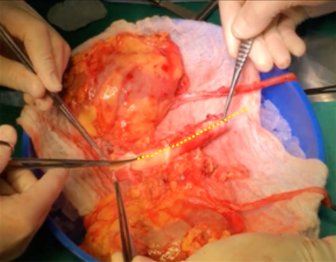
Fig. 3. Riñones en bloque. Sección de la aorta por línea media posterior en línea punteada amarilla
Imagen 3: Riñones en bloque. Sección de la Aorta por línea media posterior en línea punteada amarilla
Imagen 3: Riñones en bloque. Sección de la Aorta por línea media posterior en línea punteada amarilla
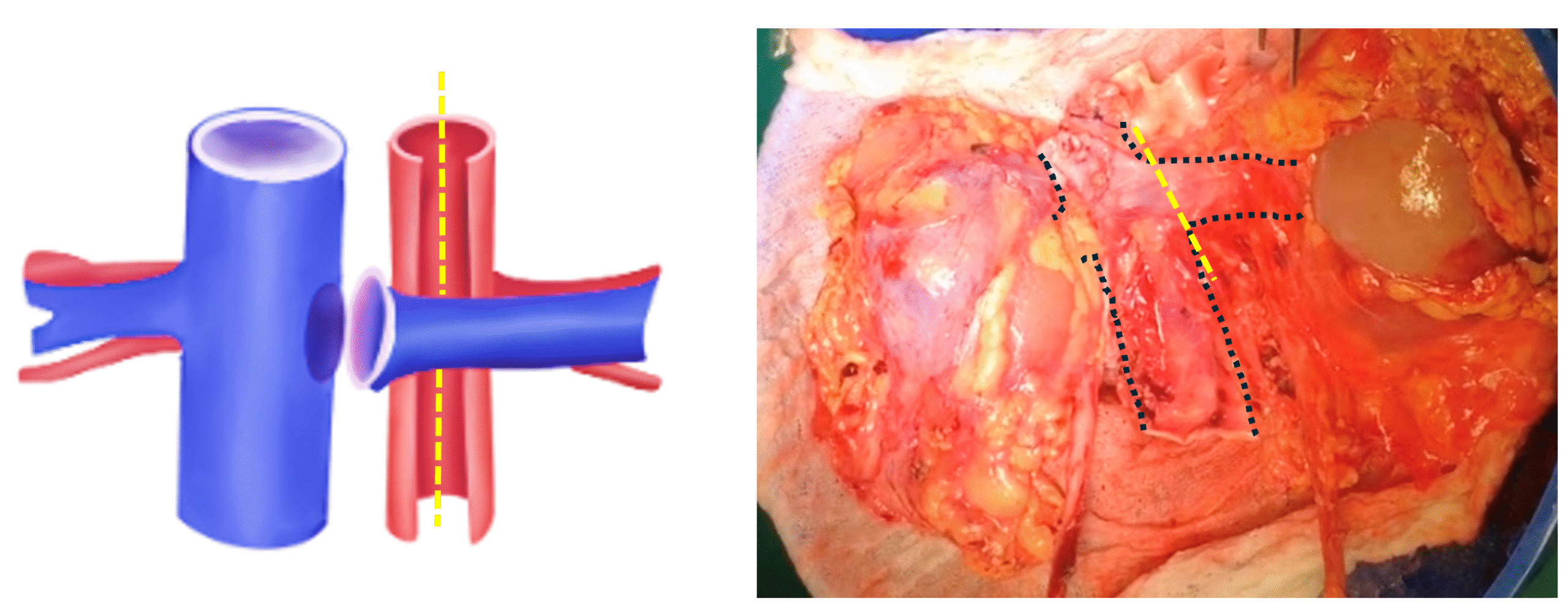
Fig. 4. Esquema: Sección de la vena renal izquierda a ras de VC y sección de la aorta por la mitad en forma longitudinal (línea punteada amarilla), dejando parche de aorta para ambos riñones. Foto de Riñones extraídos en bloque, línea punteada negra muestra vena cava y vena renal derecha.
En caso de dudas en la perfusión se puede realizar por bránula con solución de
Previo a cierre se debe realizar la extracción de tejido esplénico y linfonodos, y vasos iliacos que pueden ser útiles en reconstrucción vascular. El proceso de cierre de pared abdominal debe ser cuidadoso, respetando la dignidad del donante.
Embalaje: Introducción riñón en bolsa con 500 ml de solución de irrigación, el cual se introduce en segunda bolsa con suero frio (250cc) y luego ésta en recipiente estéril con tapa hermética, que va embalado con otra bolsa, e introducido en un cooler con hielo no estéril.
Procuramiento renal multiorgánico
Habitualmente el procuramiento se realiza en forma conjunta con equipos de extracción de órganos torácicos y hepáticos. El orden establecido de los equipos quirúrgicos es cardiaco, pulmonar, hepático, pancreático, renal, córneas, seguido por musculo esquelético. En esta situación no se detallará los pasos de los distintos equipos quirúrgicos, teniendo en consideración que el equipo cardiaco realizará la canulación de la aorta torácica y vena pulmonar, y el equipo hepático realiza la perfusión por la aorta abdominal y vena mesentérica inferior, realizando un control de la aorta supracelíaca. De igual modo, se realiza la canulación de la VC para permitir el drenaje venoso. El proceso de extracción renal puede llevarse a cabo como se describió previamente en forma individual o en bloque.
Procuramiento renal donante vivo vía laparoscópica
Como es sabido, en la mayoría de los casos se utiliza el riñón izquierdo ya que presenta una vena rena más larga que facilita la posterior anastomosis; habitualmente la cirugía se lleva a cabo en forma laparoscópica debido a las ventajas que permiten una mejor convalecencia y un mejor resultado estético. Dentro de la planificación quirúrgica es fundamental el angiotac preoperatorio y conocer los antecedentes quirúrgicos previos que puedan influir en la extracción del riñón.
Técnica quirúrgica
Se posiciona a donante en posición lateral con protección de puntos de apoyo. El neumoperitoneo se realiza de acuerdo con la preferencia y experiencia de cada cirujano. Se insufla hasta 12 – 15 mmHg. El posicionamiento de trocares varía en las distintas publicaciones. En nuestra experiencia, el hecho de que el cirujano que va a realizar la cirugía de banco sea el que introduzca la mano al término de la cirugía para la extracción, habitualmente por incisión de Pfannestiel o media infraumbilical, ha permitido una cirugía más cómoda, manteniendo muy poca variación con respecto a la disposición de los trócares utilizada en nefrectomías laparoscópicas por otra etiología: trócar paraumbilical de 11 mm, trócar 5 mm subcostal y uno de 11 mm en fosa iliaca izquierda. Se realiza exploración de cavidad abdominal y luego decolamiento colon izquierdo, liberación de ángulo esplenorenal y medialización de bazo. Luego, disección de plano posterior y psoas, identificación vena gonadal y uréter. Disección de hilio renal, disecando, clipando y seccionando vena lumbar, gonadal y suprarrenal. Apertura fascia Gerota y liberación de riñón, rechazando glándula suprarrenal; se libera polo inferiordel riñón y su cara posterior, completando liberación de hilio renal. Disección ureteral respetando tejido periureteral; se clipa y secciona a nivel de cruce de iliacos. Introducción de mano de la forma detallada previamente y heparinización sistémica; se clipan los vasos renales, habitualmente con Hem O lok, iniciando isquemia caliente. Extracción del riñón y traslado para cirugía de banco y perfusión. Se realiza cierre de pared y revisión de hemostasia y de sitio de cierre de pared abdominal.
PRESERVACIÓN DEL INJERTO Y TRASLADO
Tiempos de Isquemia
Existen tiempos de isquemia fría e isquemia caliente, ambos con impacto independiente en la funcionalidad del injerto.
La minimización del tiempo de extracción durante el procuramiento del donante fallecido, desde el clampeo aórtico hasta la colocación de los riñones en hielo (considerado tiempo de isquemia caliente), es crucial para disminuir tiempos de retardo de función del injerto, que es un factor reconocido como predictor de falla a largo plazo (16). La incidencia en retardo de la función del injerto con tiempo de extracción de 60 min es de 27%, y asciende a 60% con tiempo de extracción de 120 min (17).
La isquemia fría se define como el tiempo entre el inicio de la perfusión con líquido frío hasta el retiro de los riñones del hielo para su trasplante (16). La isquemia fría debiese reducirse a lo mínimo posible, ya que la isquemia fría prolongada también es un factor predictor independiente de retardo en función del injerto luego del trasplante (16).
Los riñones provenientes de donante fallecido estándar debiesen trasplantarse en un periodo máximo de 18-21 h; mientras que los de criterio expandido, no debiesen sobrepasar 12-15 horas. Aquellos procurados de donante fallecido por muerte cardiovascular deben trasplantarse antes de 12 horas (16). En Chile es difícil manejar tiempos reducidos de isquemia fría, considerando nuestra geografía y la centralización de los equipos de trasplante renal. El traslado de órganos y pacientes a centros de referencia, suelen prolongar tiempos de isquemia fría. Por lo que las recomendaciones del Ministerio de Salud en cuanto a isquemia fría son más permisivas (18).
En relación con el tiempo de anastomosis, (también tiempo de isquemia caliente), un tiempo de menos de 45 min es crucial para reducir el riesgo de pérdida del injerto. En receptores con tiempo de isquemia caliente de anastomosis de más de 55 min, la pérdida del injerto a 5 años ocurre en un 25% vs. 18% en tiempos de menos de 35 min (17). En riñones de donantes de criterio expandido y por muerte cardiovascular, existe una particular susceptibilidad al daño por isquemia caliente durante la anastomosis (19). Tiempos de isquemia de anastomosis prolongada no se relacionan con la sobrevida del receptor a 5 años (17).
Soluciones de perfusión y perfusión estática
La perfusión estática funciona removiendo la sangre de injerto y reemplazándola por una solución acelular en un ambiente hipotérmico, para almacenamiento y transporte. Se preservan en un contenedor con hielo a 4° aproximadamente (20).
Es conocido el rol de la preservación en frío. A temperaturas bajas, la demanda metabólica cae a 5%-8% del basal cuando se preserva a 4°, minimizando la demanda celular y generando una depleción del ATP y acumulación de metabolitos (11,21); cuando el riñón se reperfunde con sangre oxigenada ocurre injuria por reperfusión (16). Existen 2 mecanismos principales de daño del injerto: la isquemia, tanto fría como caliente, y la reperfusión. Los objetivos de las soluciones de perfusión incluyen: control del edema celular durante la isquemia fría, mantenimiento del gradiente electrolítico, buffer de acidosis, provisión de reserva energética temporal y minimización de la injuria oxidativa por reperfusión (16).
La primera solución desarrollada fue Euro-Collins (EC)en la década de 1960. En la Tabla 2., se ilustran las soluciones de perfusión y sus acrónimos.
| Nombre Genérico | Abreviación |
| Euro- Collins | EC |
| Citrato Hiperosmolar (Solución de Marshall) | HOC |
| Histidina- Triptophano y Cetoglutarato (Custodiol) | HTK |
| Universidad de Wisconsin | UW |
| Solución Belzer | MPS |
| Solución de Celsior | Celsior |
| Solución del instituto George Lopez-1 | IGL-1 |
Tabla 2. Soluciones de perfusión y preservación de órganos
Globalmente las soluciones de preservación más utilizadas son las de Universidad de Wisconsin (UW) e histidina-triptofano-cetoglutarato (HTK,por sus siglas en inglés, o Custodiol) (11). Esta solución está compuesta por una mezcla de histidina y manitol como impermeabilizantes; electrolitos, incluyendo calcio, sodio, magnesio, potasio y cloro; triptofano como estabilizador de desechos del estrés oxidativo, y cetoglutarato, como sustrato; no contiene buffers ya que la histidina actúa como tal y por el riesgo de precipitación de estos con el calcio. Por su parte la solución de UW se compone de un coloide, el hidroxietileno; lactobionato, rafinosa como impermeabilizantes; fosfato monopotásico, como buffer; electrolitos, igual que solución HTK con la excepción del calcio; alopurinol y glutatión, como estabilizadores de productos del estrés oxidativo y adenosina como sustrato. Ambas soluciones con osmolaridad de 320mOsm (11).
Ambas soluciones, UW y HTK, son igualmente efectivas y son el estándar en procuramiento multiorgánicos y sólo renal. La solución de UW y HTK son equivalentes en cuanto a sus resultados funcionales en trasplante renal. La solución de UW es particularmente beneficiosa para órganos de donantes óptimos y/o tiempos de isquemia fría prolongados; la ventaja de solución HTK es su bajo costo (11,21).
Estudios experimentales sugieren que HTK y UW tienen mayor capacidad para preservar el endotelio y mejor función de buffer durante la reperfusión, con menos daño histológico luego de la reperfusión, cuando se comparan con solución de Marshall de citrato hipertónico y Celsior, por lo que debe preferirse el uso de UW y HTK, especialmente en donantes cadavéricos y donantes criterio expandido (16,21). El uso de Euro-Collins ya no está recomendado (16).
Para donantes vivos, donde está planificada la cirugía de trasplante en forma inmediata, basta con perfusión con cristaloides (16).
Preservación dinámica
La perfusión dinámica consiste en el bombeo de solución acelular o basado en sangre, a través de los vasos del injerto (22). La perfusión dinámica de órganos existe incluso antes del almacenamiento estático en frío. Era la única forma de preservar órganos antes de la existencia de las soluciones de perfusión actuales, las que por su bajo costo, practicidad y efectividad se transformaron en el principal método de preservación y transporte. La perfusión dinámica reaparece con la finalidad de disminuir el deterioro de los órganos en isquemia fría estática, para poder ofrecer mejor preservación de órganos de alto riesgo (22).
Existen Estrategias de preservación dinámica, que incluyen además de la isquemia fría dinámica, la preservación normotérmicas y subnormotermicas; oxigenada y no oxigenada; pulsátil y continua (16). La máquina de perfusión continua hipotérmica es la más comúnmente usada, utilizando en la mayoría de los casos solución del Belzer. Puede emplearse desde el procuramiento hasta el implante, o utilizarla justo previo al trasplante luego de un periodo de preservación estática inicial (22).
Existen estudios que sugieren que la máquina de reperfusión hipotérmica reduce el retardo de función del injerto, comparado con la isquemia fría estática, con un mayor beneficio demostrado en donantes fallecidos por muerte cardiovascular. El número de veces que necesario utilizar la máquina de perfusión para prevenir un evento de retardo de función de injerto es de 7.26 y 13.60 en donante por muerte cardiovascular y por muerte cerebral, respectivamente (20).
La máquina de perfusión hipotérmica debiese utilizarse regulada por presión y no por flujo, ya que la hiperpresión puede ocasionar daño por presión (16). La perfusión pulsátil pareciera ser mejor para preservar riñones (20,22).
El déficit creciente de órganos hace necesario considerar órganos no ideales, incluyendo en Chile a donantes de Criterio Expandido y en otros países se incluyen además donantes por Muerte Cardiovascular. En ambos grupos pareciera existir un beneficio funcional cuando se utiliza máquina de perfusión oxigenada (22).
Traslado de riñones procurados en Chile
En nuestro país el traslado de órganos post-procuramiento está regido por la Ley 19.451, decreto 656 del MINSAL. El ISP y Coordina Chile (ex Corporación Nacional de Trasplantes), supervisan la logística (18).
Los riñones se transportan en contenedores isotérmicos a 4° con soluciones de preservación estática, riñones con menos de 30 h de isquemia fría no debiesen ser rechazados (23). El 78% de los traslados se realiza por vía aérea mientras que el traslado terrestre se reserva para distancias menores de 200 km. y en ambulancia especializada para transporte en cadena de frío (24).
Los principales desafíos en Chile incluyen la logística en nuestra geografía extrema y los errores en la cadena de frío, reportados en un 5% de los traslados. Innovaciones como la máquina de perfusión hipotérmica, que está en evaluación en nuestro país, promete optimizar la viabilidad de los injertos, más aún de donantes marginales (25).
CIRUGÍA DE BANCO Y TRASPLANTE RENAL
La cirugía de trasplante renal es una cirugía mayor, que involucra anastomosis vascular y de vía urinaria. Debe considerarse que los receptores renales frecuentemente tienen patologías crónicas, que les confieren mayor riesgo quirúrgico y anestésico. Muchos con riesgo incrementado de hemorragia, ya que son portadores de disfunción plaquetaria determinada por uremia y en ocasiones por uso de antiagregantes plaquetarios, y un grupo menor de pacientes son usuarios de tratamiento anticoagulantes (11).
Un grupo menos de pacientes, son beneficiarios de trasplante anticipado o Preemtive (inglés), en ellos existe el beneficio de no tener complicaciones relacionadas a la diálisis crónica, beneficio que es mayor aún en niños (11).
Cirugía de banco
Consiste en la preparación del riñón para trasplantarlo. Es un paso crucial para el éxito del trasplante y disminución de las complicaciones intra y postoperatorias (3). Una adecuada preparación, asegura una longitud adecuada de los vasos renales y evita hemorragias prevenibles al momento de la reperfusión. La cirugía de banco debiese iniciarse antes de la preparación anestésica y quirúrgica del receptor, dando tiempo a la detección de anomalías del injerto como lesiones tumorales que contraindican el trasplante o lesiones del procuramiento que puedan requerir reparación (11,16)
Se realiza sobre hielo estéril y solución de perfusión, se puede utilizar una compresa para evitar el contacto directo del riñón con el hielo.
En primer lugar se realiza una inspección visual del riñón y su anatomía. Evaluando la integridad del parénquima, la ausencia de lesiones renales sospechosas, la cantidad y calidad de vasos renales y la vía urinaria. (16)
Es necesario resecar la grasa perirrenal, preservando la capsula. Los vasos linfáticos del hilio renal deben ligarse.
Se evalúa la calidad de la arteria renal y su íntima. Si hay desprendimientos de la íntima, se fija con sutura no reabsorbible.
En el donante fallecido, se confecciona parche de aorta en los casos que se estime conveniente. El parche se desecha cuando existen placas de ateroma considerables en el ostium.
En caso de que exista más de una arteria renal principal, en donante fallecido preferir implante en un mismo parche, para realizar una sola anastomosis arterial. En donante vivo con 2 arterias principales, éstas pueden anastomosarse por separado o realizar una anastomosis entre arterias renales (Figura 5).
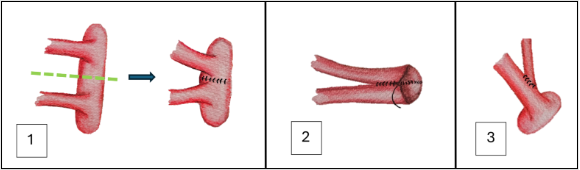
Fig. 5. 1- Anastomosis de 2 arterias en parche único (Carrel Patch). 2- Anastomosis arterial en pantalón. 3- Anastomosis arterial termino-lateral, útil cuando hay arterias de diferente calibre
Imagen 3: Riñones en bloque. Sección de la Aorta por línea media posterior en línea punteada amarilla
Imagen 3: Riñones en bloque. Sección de la Aorta por línea media posterior en línea punteada amarilla
Cuando existen arterias polares, si es superior y de delgado calibre, puede desecharse. Si hay polares inferiores, debe intentarse su preservación por estar relacionadas con irrigación de la vía urinaria.
Las arterias polares pueden anastomosarse a la arteria renal principal. Y eventualmente a la arteria epigástrica
La preparación de la vena renal consta de la ligadura meticulosa de sus colaterales, para evitar hemorragia al momento de la reperfusión y desgarros de mayor tamaño con el flujo.
La vena renal derecha es más corta por su cercanía a la vena cava, en caso de donante fallecido, se puede utilizar vena cava para elongar la vena renal cuando sea necesario (Figura 6).Si no se cuenta con parche de vena cava, puede utilizarse vena gonadal o safena para la elongación. Si hay 2 venas renales, la más pequeña puede ser ligada; si son dos venas de igual calibre, es mejor preservar ambas.
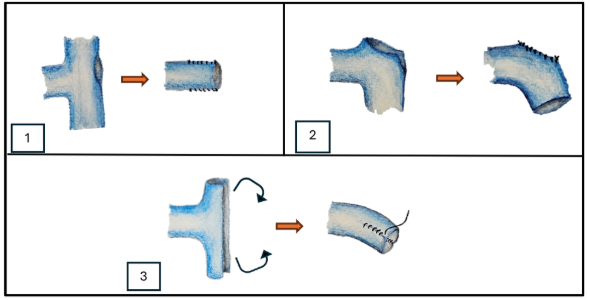
Fig. 6. Alternativas de elongación de vena derecha utilizando Vena Cava
En donante vivo los vasos renales suelen ser cortos y de menor calibre, la liberación intrasinusal de los vasos permite ganar longitud, teniendo precaución de no dañar ramas arteriales dentro del seno y colaterales venosas pequeñas.
Una vez finalizada la preparación de los vasos, puede realizarse la perfusión con 100-200 ml líquido de perfusión para barrer productos del metabolismo y la detección de defectos de los vasos (11).
En cuanto a la vía urinaria, se realiza una revisión de la calidad y número de uréteres, preservando la grasa periureteral, en especial aquella cercana al hilio en el “triángulo dorado”, con la finalidad de preservar la vascularización del uréter
Técnica quirúrgica del Trasplante renal
Acceso
Tradicionalmente el trasplante renal se efectúa a través de una incisión de Gibson o incisión curva de Rutherford Morison, que se realiza 2 cm cefálica del tubérculo del pubis, lateralizándose 2 cm sobre el ligamento inguinal, se curva hacia la espina iliaca anterosuperior, manteniendo distancia de 2 cm de la espina. Se realiza apertura de los músculos oblicuos y el transverso del abdomen en la línea de la incisión (Figura 7) (11).
La cirugía de trasplante se puede realizar también vía laparoscópica y robótica, pero el estándar sigue siendo la cirugía abierta (16).
Se puede utilizar accesos abiertos menos invasivos, puede utilizarse una incisión transversa de la piel, similar a un Phannestiel más alto y lateralizado al lado del trasplante, con la finalidad de seguir las líneas de tensión de la piel, favoreciendo cicatrización más estética (28,29).
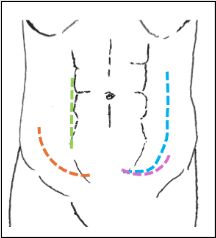
Fig. 7. Incisiones para trasplante renal: Línea Naranja, incisión de Gibson o de Rutherford Morison. Línea Verde, Incisión paramediana. Línea Celeste, Incisión en Palo de Hockey. Línea lila, incisión de piel modificada
Un acceso menos invasivo, denominado Acceso por Vaina Anterior de Recto Abdominal, consiste en una apertura longitudinal de la aponeurosis de la vaina anterior del recto, rechazando éstos a medial, evitando la sección de fibras musculares. Este acceso, se asocia a menos dolor postoperatorio, menos complicaciones a largo plazo como hernias, y menos deformidad de la pared abdominal por denervación (29)
La incisión paramediana en Palo de Hockey, con apertura de la línea de Spiegel, se ha asociado a mayores complicaciones que el acceso clásico de Gibson, por lo que se desaconseja su uso (32).
No existe evidencia sobre mejores resultados en relación a la selección del lado derecho versus el izquierdo (16).
Preparación del lecho quirúrgico
Una vez realizada la incisión y expuesto el peritoneo, se seccionan y ligan los vasos epigástricos y en la mujer, el ligamento redondo. Se realiza la apertura de la fascia tranversalis, se rechaza el peritoneo medial y cefálico. Se identifican los vasos iliacos externos, se seccionan y ligan linfáticos, exponiendo los vasos iliacos externos (Figura 8). Se prepara campo quirúrgico con separador autoestático de Book-Walter. (35)
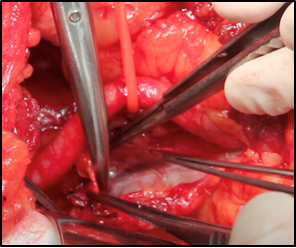
Fig. 8. Vasos Iliacos Externos, la Arteria se encuentra traccionada por elástico vascular; la vena señalada con la punta de tijera
Anastomosis vascular
Lograda la exposición de los vasos, se realiza clampeo de la vena iliaca, aislando segmento receptor. Se efectúa la anastomosis termino- lateral venosa. Si la vena renal es corta, la transposición de la vena iliaca con la arteria puede facilitar la sutura.
Luego se realiza la anastomosis termino-lateral de la arteria, a la arteria iliaca externa.
Se puede utilizar también la arteria iliaca interna para realizar anastomosis termino-terminal. Estudios aleatorizados no han demostrado superioridad de una técnica sobre otra, pero existen reportes de serie de casos, con mayores complicaciones por uso de arteria iliaca interna. Hay que considerar que la arteria iliaca interna es más frecuentemente afectada por enfermedad ateroesclerótica, lo que podría afectar funcionalidad a largo plazo (16).
La selección del sitio de las anastomosis es importante para evitar acodaduras con el posicionamiento renal, asegurando un flujo adecuado.
Una vez finalizada la anastomosis de ambos vasos, se procede al desclampeo logrando la reperfusión renal.
Para las anastomosis vasculares, comúnmente se utilizan suturas no reabsorbibles monofilamento de polipropileno 5-0 o 6-0.
Minimizar el tiempo de la anastomosis vascular, se correlaciona con menos retardo en la funcionalidad del injerto, y mejor funcionalidad a largo plazo (19).
Neoimplante ureteral
Por último, se realiza la implantación del uréter. Habitualmente se efectúa el neoimplante a vejiga con técnica extravesical de Lich-Gregoir, esta es la técnica que se ha asociado a menos complicaciones (filtración, estrechez, hematuria). Se utiliza sutura absorbible, monofilamento. El uréter debe dejarse lo más corto posible, preservando la grasa periureteral.
Como implante primario, la anastomosis a uréter nativo se asocia a más estrechez, obstrucción y formación de litiasis (11).
Se recomienda la colocación de catéter doble J para el neoimplante, ya que ha demostrado reducir las complicaciones urológicas mayores, en especial la filtración de orina (11,34). Existe un beneficio en la reducción de infecciones urinarias, cuando el doble J se retira antes de las 3 semanas postoperatorias (11,35).
Se puede considerar realizar el implante a la cara posterior de vejiga, para facilitar eventuales procedimientos endoscópicos futuros y porque se asocia a menos hidronefrosis luego de retiro de doble J cuando se compara con implante en la cara anterior (36).
Otras consideraciones
Cuando la calidad de un solo riñón del donante fallecido se presume insuficiente para lograr apropiada función a largo plazo, se realiza trasplante dual (11).
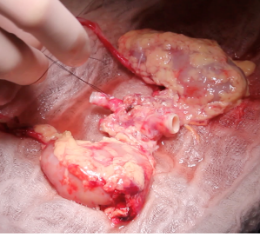
Cuando el donante fallecido es pediátrico y pesa menos de 15 kg, se realiza la extracción renal en bloque, procurando ambos riñones con cava y aorta. Dependiendo de las características del receptor, se puede considerar el trasplante de ambos riñones en bloque (Figura 9).
.
Fig. 9. Riñones en bloque, de donante de menos de 15 kg
COMPLICACIONES QUIRÚRGICAS DEL TRASPLANTE RENAL
Las complicaciones quirúrgicas relacionadas con el trasplante renal (TR) han recibido escasa atención en la literatura médica, a pesar de su impacto en la morbimortalidad del receptor y en la viabilidad del injerto. Por otro lado, en los últimos años hemos asistido a cambios relacionados con el tipo de riñones trasplantados, la comorbilidad de los receptores y el uso de nuevas combinaciones de fármacos inmunosupresores. Todos estos cambios tienen un impacto sobre la incidencia y la gravedad de estas complicaciones.
Uno de estos cambios es la utilización de donantes con criterio expandido, lo cual significa utilizar riñones de mayor edad, tradicionalmente no aceptados en los programas de trasplante renal (37). Esto a su vez asociado a una mayor edad de los receptores, lo cual en su conjunto aumenta la incidencia de complicaciones las cuales están relacionadas con la presencia de patologías crónicas (38).
Para estandarizar y clasificar las complicaciones quirúrgicas, la clasificación de Clavien-Dindo es ampliamente utilizada. Este sistema estratifica las complicaciones acordes al grado de invasividad de los tratamientos requeridos y está siendo cada vez más utilizada en trasplante renal (39).
Dagnaes-Hansen et al. Utilizaron esta clasificación para estratificar las complicaciones a corto y largo plazo en una extensa cohorte institucional, reportando que un 60% de los trasplantes experimentaban al menos una complicación durante el primer mes del trasplante. Ellos identificaron el trasplante previo, edad avanzada, bajo peso (IMC < 18.5), y sangrado intraoperatorio como factores de riesgo para complicaciones severas de grado Clavien-Dindo > 2, en particular, cada 100 ml de sangrado intraoperatorio fue asociado significativamente con un mayor riesgo (40).
La incidencia de complicaciones quirúrgicas después del trasplante renal oscila según las series entre el 1 y el 25%, dependiendo en gran medida de los tipos de complicaciones quirúrgicas recogidas en los estudios (41), sin embargo, la mayoría de estas series son de un solo centro, retrospectivas y con una definición variable de las complicaciones.
Estos hallazgos subrayan la importancia de una adecuada valoración de los riesgos preoperatorios, una meticulosa técnica quirúrgica, y una temprana detección y apropiado manejo de las complicaciones quirúrgicas usando criterios objetivos.
Clasificación de las complicaciones quirúrgicas
- Según etiología:
- Complicaciones urológicas: Fístula urinaria, obstrucción urinaria, estenosis ureteral, hidronefrosis, hematuria.
- Complicaciones vasculares: trombosis arterial o venosa del injerto, estenosis de la arteria renal, hemorragia.
- Complicaciones quirúrgicas generales: hematomas, seromas, infección del sitio quirúrgico, desarrollo de linfocele.
- Según tiempo de aparición:
- Complicaciones tempranas (primer mes post-trasplante): en este punto es importante analizar la Función Retrasada del Injerto (FRI), definida como la necesidad de diálisis, oligoanuria o retraso en el descenso de la creatinina plasmática en la primera semana postrasplante. Esta puede responder a múltiples causas de índole médico y quirúrgico y representa un desafío para el equipo de trasplante renal en conjunto, esto lo discutiremos más adelante en detalle.
- Complicaciones tardías (después del primer mes): infecciones oportunistas debido a la inmunosupresión, neoplasias (mayor riesgo debido a la inmunosupresión), hernias incisionales, linfocele y las complicaciones urinarias tardías.
En la Tabla 3 se enumeran causas de función retrasada del injerto
| Periodo | Causas |
| Postrasplante inmediato | Necrosis tubular aguda (NTA)* |
| 0-7 días (función renal retrasada) | Rechazo hiperagudo
Obstrucción tracto urinario Fuga urinaria (fístula) Trombosis vasculares Toxicidad por fármacos Hipovolemia Injerto no viable |
| Postrasplante temprano
1-12 semanas |
Rechazo agudo
Toxicidad por fármacos Infecciones: virus BK, CMV, etc. Obstrucción tracto urinario Disminución de la perfusión renal Recurrencia de la enfermedad de base |
* causa más frecuente.
Tabla 3. (causas de función retrasada del injerto FRI)
Disfunción precoz del injerto (Función retrasada del injerto FRI)
Es la complicación más frecuente tras el trasplante renal y tiene implicaciones pronósticas sobre la supervivencia del mismo. Su etiología y diagnóstico diferencial varían en función del momento de presentación.
La oligoanuria o anuria, especialmente en pacientes en los que se espera una diuresis inmediata (donante vivo, receptor y donante joven con isquemia fría corta, etc.), es una urgencia diagnóstica.
Si a pesar de comprobar adecuado estado de volemia del receptor y descartar problemas con la sonda vesical, y ante no respuesta a expansión de volumen y furosemida u optimización hemodinámica del receptor, estaremos en la obligación de realizar pruebas de imagen (eco Doppler más accesible y rápida con posibilidad de realizarla a pie de cama del paciente) para comprobar la vascularización del injerto o complicaciones de la vía urinaria.
La FRI constituye un tipo de insuficiencia renal aguda característico del trasplante renal. Si bien la principal causa es intrínseca, relacionada con la agresión renal por el daño asociado a la isquemia y posterior reperfusión asociada a factores inmunológicos, en algunos casos puede existir un componente prerrenal o postrenal (42).
La necrosis tubular aguda (NTA) es la causa más frecuente de FRI (5-50% donante fallecido, 4-10% con donante vivo) (43). Su incidencia aumenta en presencia de determinados factores de riesgo relacionados con características del donante, del receptor, la preservación del injerto y el manejo peri operatorio.
Para el tratamiento de la FRI es importante prevenir e identificar factores de riesgo, modificándolos en lo posible (adecuada hidratación y mantenimiento del donante, acortar los tiempos de isquemia). Tener en cuenta que el receptor puede precisar intraoperatoriamente volúmenes de resucitación de hasta el 5-10% del peso corporal para contrarrestar la vasodilatación ocasionada por la anestesia, previniendo así la FRI.
Es necesario minimizar la nefrotoxicidad y evitar el rechazo agudo, mediante regímenes inmunosupresores adaptados. Soporte con diálisis asegurando estado de hidratación. Realizar pruebas de imagen seriadas (ecodoppler, renograma isotópico), con el fin de descartar precozmente otras complicaciones.
Complicaciones Urológicas
Las complicaciones ureterales reducen significativamente la sobrevida del injerto. Los pacientes que desarrollan estenosis ureteral presentan una menor sobrevida del injerto y menor sobrevida general (44)
- Factores y consideraciones asociados a su prevención: Prestar atención a la preservación del tejido peri-ureteral en especial del llamado “Golden triangle”, un área critica definida por el polo inferior del injerto, el hilio renal y el ángulo formado por la vena cava a derecha y la llegada de la vena gonadal a izquierda.
- Respecto a la técnica de anastomosis una revisión realizada por Albert et al, concluyó, que la anastomosis extravesical con técnica de Lich-Gregoir presenta la menor tasa de complicaciones (45).
- Estenosis ureteral:
la incidencia de esta complicación varía en las series según el diseño del estudio, la población y la definición de estenosis, sin embrago, se describe una incidencia de 3,8% (2,8-18%), la mayoría ocurre entre los tres meses a un año de realizado el trasplante (46). El diagnóstico se realiza con imágenes (TAC, ecografía) siendo la parte distal la comprometida la mayoría de las veces.
Su etiología está relacionada a factores del donante, del receptor y de la técnica quirúrgica. En general se trata de factores que determinan un flujo arterial inadecuado del uréter, por ejemplo, edad avanzada y arterosclerosis del donante, excesiva manipulación del tejido peri-ureteral en la cirugía de banco.
Respecto a su tratamiento existen alternativas no invasivas (instalación de pig-tail, dilatación con balón) y la reparación quirúrgica.
La instalación de un catéter pig-tail ya sea por vía retrograda o anterograda debe considerarse una solución transitoria puesto que este se asocia a riesgo de infección y estenosis en si mismo, la dilatación con balón es un tratamiento seguro que sin embargo se asocia hasta en un 50% a riesgo de re-estenosis con la necesidad de nuevos tratamientos o incluso cirugía (47). La endoureterectomia con láser (Ho:YAG) se ha utilizado por vía percutánea en estenosis de hasta 10 mm cuando no es posible dilatar con balón anterogrado (48).
La reparación quirúrgica de la estenosis ureteral se realiza retirando el tejido estenótico y fibrótico y realizando un nuevo implante ureteral a vejiga o una uretero-uretero anastomosis utilizando uréter nativo.
Una serie reportó que los pacientes sometidos a tratamiento no invasivo de estenosis ureteral presentaban menor sobrevida del injerto vs los pacientes sin estenosis, por el contrario, los pacientes que inicialmente presentaban estenosis ureteral y realizaban reparación quirúrgica de esta no presentaban menor sobrevida del injerto que los pacientes sin esta complicación (8), esta evidencia podría apoyar la resolución quirúrgica inicial para los resultados a largo plazo del injerto.
- Filtración y/o fístula urinaria:
Se trata de la complicación quirúrgica precoz más frecuente se estima su incidencia 2,7% (1,1-2,7%), sin embargo, no existen series a gran escala estudiando el problema (44). El sitio más comúnmente afectado es la anastomosis seguido de la pelvis renal, habitualmente ocurre dentro de los tres primeros meses post-trasplante, siendo la necrosis y posterior dehiscencia de la anastomosis la principal causa.
Para reducir el riesgo de necrosis es fundamental preservar el tejido conectivo peri-ureteral para mantener un adecuado flujo sanguíneo del uréter distal. El diagnóstico habitualmente se realiza midiendo la creatinina del líquido del drenaje. Los factores de riesgo asociado son la edad avanzada del donante y receptor, la diabetes y el número de arterias del injerto (44).
El manejo de una fístula urinaria varía según su ubicación, causa y severidad, no existiendo evidencia científica sólida al respecto.
El manejo conservador se reserva para filtraciones urinarias precoces y de bajo volumen, para esto se utilizan la instalación de sonda vesical, catéter doble j y/o nefrostomía.
Si falla el manejo conservador o la filtración de orina es masiva, se requiere un manejo quirúrgico, este consiste en retirar el segmento necrótico del uréter y realizar un nuevo implante ureteral, si la longitud del uréter es demasiado corta y no permite un implante libre de tensión se puede recurrir a la anastomosis uretero-ureteral con uréter nativo, anastomosis a una vejiga psoica o el flap de Boari.
Complicaciones Vasculares
La incidencia de complicaciones vasculares se reporta hasta en un 10% en las diferentes series, estas complicaciones incluyen la estenosis arterial, la trombosis arterial y venosa, los aneurismas y la disección arterial. Entre la estenosis de la arteria renal y la trombosis representan el 50-80% de las complicaciones vasculares (49). La estenosis de la arteria renal es la complicación vascular más frecuente, con una incidencia aproximada del 3 %. Suele presentarse entre los 3 meses y 2 años posteriores al trasplante, siendo su manifestación clínica más común la hipertensión arterial refractaria.
Factores y consideraciones asociados a su prevención:
- Se ha discutido sobre la relación entre el uso de parche de aorta y el desarrollo de estenosis de la arteria renal. No es el parche en sí mismo la causa, se trataría de las placas ateroescleróticas asociadas a este, por lo tanto, este parche debe ser removido ante la presencia de placas.
- Especial cuidado debe tenerse en la manipulación de las arterias durante el procuramiento, por otro lado, los tiempos de isquemia fría y caliente prolongados también aumentan el riesgo de complicaciones vasculares.
- Por el lado del receptor la presencia de diabetes, HTA y dislipidemia puede contribuir al riesgo de complicaciones vasculares. El trasplante previo y la presencia de ateroesclerosis en la arteria del receptor aumentan los riesgos.
- El uso de ecografía doppler en el intra y post-operatorio inmediato es una herramienta de gran utilidad en el diagnóstico precoz de las complicaciones vasculares.
Tratamiento de las complicaciones vasculares
La estenosis de arteria renal producida dentro de los primeros diez días post-trasplante es rara y por lo general debe sospecharse algún factor técnico durante la cirugía, por cual la revisión quirúrgica debería considerarse por sobre un manejo endovascular (50). Para el manejo de estenosis de arteria renal de aparición tardía se realiza una angioplastia con la instalación de un stent en el mismo sitio.
Mientras algunas series muestran resultados buenos en seguimientos a largo plazo, otras por el contrario muestran deterioro de la función del injerto en seguimientos a largo plazo.
Para la trombosis de arteria y vena renal, la terapia trombolítica y la trombectomía percutánea son realizadas, en caso de no ser efectivas deberá realizarse una trombectomía quirúrgica.
Complicaciones Linfáticas ( Linfocele y Linforrea)
El linfocecle y la linforrea son complicaciones comunes del trasplante renal con una incidencia reportada entre un 0,6 al 35,2%, con aproximadamente un tercio de los casos requiriendo tratamiento invasivo (51). Existe una gran variabilidad entre las distintas series debido a las definiciones utilizadas en su diagnóstico.
El origen de la linfa puede ser de los vasos iliacos del receptor, del hilio del injerto o de ambos. Aunque la linforrea suele ser asintomática puede causar dolor, aumento de volumen, infección o deterioro de la función renal por compresión del injerto.
Para distinguir la linforrea de la filtración urinaria la medición de creatinina del líquido del drenaje suele ser útil. El tiempo medio al diagnóstico es de 29 días (19-51 días) post-trasplante.
Factores y consideraciones asociados a su prevención:
- Factores asociados al paciente son edad, obesidad, diabetes, cirugía abdominal previa, episodios de rechazo.
- Factores asociados a la cirugía son la presencia de múltiples arterias en el injerto (51), el inadecuado manejo de los linfáticos del receptor, esto último tiende a aumentar con el uso de la fosa iliaca izquierda para el trasplante.
- El uso del drenaje es controvertido, debido a que por un lado previene la formación de linfocele, pero por otro lado aumenta el riesgo de linforrea.
Tratamiento de las complicaciones linfáticas.
Mehrabi et al. recomienda una estrategia basada en grados para el diagnóstico y manejo de los linfoceles y la linforrea (52).
Grado A: linfoceles que no requieren tratamiento o pueden ser manejados sólo con aspiración.
Grado B: linfoceles que requieren intervención no-quirúrgicas; si la linforrea persiste podrían necesitar manejo farmacológico (octreotide) o escleroterapia (etanol, tetraciclina) de ser necesario. Linfoceles infectados que requieren manejo antibiótico son catalogados como B.
Grado C: linfoceles que requieren intervención quirúrgica, ya sea por vía abierta o laparoscópica. El procedimiento de realizar una ventana peritoneal por vía laparoscópica muestra una baja tasa de recurrencias.
En el último tiempo las técnicas mínimamente invasivas con aspiración y posterior escleroterapia son las preferidas por su baja tasa de complicaciones y corta estadía hospitalaria.
Conclusiones
Las complicaciones quirúrgicas representan un desafío para los equipos de trasplante renal, esto por las implicancias que tienen en la sobrevida del injerto y los resultados del paciente. Una detección precoz, una correcta estratificación y un adecuado manejo son fundamentales en mejorar los resultados a largo plazo y reducir la morbilidad. Por otro lado, es fundamental entender la naturaleza multifactorial de estas complicaciones integrando prácticas basadas en evidencia, de esta forma se mejorarán los resultados optimizando la calidad de vida de los pacientes.
EVALUACIÓN IMAGENOLÓGICA DEL TRASPLANTE RENAL Y SUS COMPLICACIONES
El control en el período postoperatorio inmediato tras un trasplante renal es fundamental para evaluar el injerto renal, la permeabilidad de las estructuras vasculares y para la detección temprana de complicaciones. La ecotomografía complementada con Doppler-color es la modalidad de elección debido a su accesibilidad, seguridad, carácter no invasivo y capacidad de evaluar en tiempo real la vascularización y estructura del riñón trasplantado, dada su ubicación superficial en las fosas ilíacas (53).
Control ecográfico postrasplante renal inmediato
Las distintas guías sugieren realizar un primer control ecográfico precoz dentro de las primeras 6 a 12 hrs. post trasplante (53), un segundo control a las 48 horas y un tercer control al tercer o cuarto día, con controles sucesivos dependiendo de las condiciones clínicas y evolución del paciente.
El control incluye evaluación morfológica del injerto renal, sistema excretor, de la periferia del injerto (colecciones) y especialmente de la perfusión y vascularización del injerto. El estudio Doppler-color permite valorar la perfusión, los índices de resistencias (IR) arteriales, flujo arterial y venoso renal (54).
Recomendación de la evaluación sistemática que debe incluir (54,55):
- Estudio morfológico en escala de grises: tamaño, morfología, volumen, ecogenicidad, diferenciación corticomedular, colecciones perirrenales (hematomas, urinomas o abscesos), sistema excretor (ectasia, dilataciones u obstrucciones), engrosamiento uroepitelial, masas, calcificaciones, cicatrices, etc.
- Evaluación de la vejiga: material hemático (coágulos), extremo distal de catéter doble J, balón de sonda Foley, jet ureteral del uréter del injerto, entre otros.
- Evaluación vascular: Doppler color o Power Doppler que tiene mayor sensibilidad para valorar vascularización global y Doppler espectral que podrían orientar a isquemia, estenosis, trombosis, rechazo o necrosis tubular aguda.
- Vascularización intrarrenal: se deben evaluar arterias interlobares y arcuatas medidas en ambos polos y línea interpolar para calcular IR. Curvas de morfología espectral de baja resistencia, con un tiempo de aceleración menor a 0,1 segundos e índices de resistencia entre 0.6 y 0.8. En las primeras 48 horas – 1 semana los IR se aceptan dentro del rango esperable hasta 0.8, factor que se corrige a las dos semanas
- Arteria y vena renal deben evaluarse en sus segmentos proximal (anastomosis), tercio medio y a nivel del hilio siempre con ángulo corregido y nunca > 60º. Las velocidades de peak (VPS) en la arteria renal normales son hasta 200 cm/s. VPS arterial por encima de 250-300 cm /s se considera elevada, aunque en las primeras fases puede existir edema perianastomosis y elevar dicha velocidad.
- Tiempo de aceleración menor a 0,1 segundos e IR entre 0.6 y 0.8.
- Vena y arteria ilíaca externa ipsilateral y relación VPS arteria renal / ilíaca externa (valores normales: entre 1.8 y 2).
Consideraciones al control ecotomográfico inmediato
- En los primeros controles puede observarse leve aumento de la ecogenicidad con mayor acentuación de la diferenciación corticomedular, especialmente en riñón de donante cadáver, y también relacionados a mayor tiempo de isquemia fría del injerto.
- El injerto renal suele hipertrofiarse entre 2-3 cm 1 a 2 meses post trasplante por el edema.
- Es frecuente encontrar dilatación discreta del sistema excretor que afecta a la pelvis renal, debido a la disposición quirúrgica vesicoureteral habitual que facilita la existencia de reflujo/denervación, siempre que no exista disfunción del injerto ni evidencia de causa obstructiva de la vía.
- Si la ectasia del sistema excretor persiste o progresa y se asocia a IR aumentados, deben investigarse causas obstructivas (endoluminales, estenosis en la anastomosis o isquemia ureteral) o compresión extrínseca por colecciones periinjerto.
- Puede observarse líquido libre y pequeñas colecciones en forma habitual en el postoperatorio precoz, que tienden a desaparecer. Si el volumen es excesivo o si persisten luego de 7 a 14 días se deben considerar complicaciones como hematomas, urinomas o abscesos, que además pueden aumentar IR por compresión extrínseca del parénquima
- La presencia de flujo venoso en la vena renal mediante Doppler-color es suficiente para descartar trombosis.
- Un flujo diastólico reverso en la arteria renal es altamente sugerente de trombosis venosa, torsión del injerto, rechazo agudo o NTA severa.
- Sospechar NTA: riñones algo ecogénicos, IR aumentado (en algunas áreas más que en otras), engrosamiento del urotelio, antecedentes de isquemia prolongada.
- Sospechar Rechazo agudo: aumento del tamaño y volumen renal >25%, riñón globuloso, ecogénico con IR aumentados en arterias arcuatas, engrosamiento del urotelio. Presentación usual entre las 48 hrs. post trasplante a 10 semanas
- Sospechar Rechazo crónico: riñón de tamaño normal o algo pequeño, con ecogenicidad conservada o aumentada, IR normal generalmente alto en menor porcentaje; usualmente > 10 semanas (54,55).
Complicaciones inmediatas
Las complicaciones pueden clasificarse en vasculares y no vasculares.
Complicaciones vasculares:
- Trombosis de la arteria o vena renal y estenosis de la arteria renal
La trombosis arteria renal, aunque poco frecuente, es la complicación más importante que suele observarse en las primeras 48 hrs. post trasplante y debe buscarse dirigidamente en un escenario de deterioro de función renal en todo paciente trasplantado reciente (<48 hrs.), no detectándose flujo.
- Rechazo hiperagudo: trombosis de arteria renal, diagnóstico es quirúrgico o post operatorio inmediato. El riñón se pierde, existiendo muy pocas oportunidades para realizar ultrasonido en pabellón
El método de elección para su detección es la ecotomografía Doppler-color, con una sensibilidad diagnóstica cercana al 90 %. Los signos directos incluyen disminución del calibre de la arteria renal con velocidades de pico sistólico (VPS) elevadas, superiores a 340 cm/s o VPS > 200 cm/s asociadas a signos indirectos. Entre estos últimos destacan las curvas espectrales intrarrenales tipo parvus tardus, índices de resistencia intraparenquimatosa < 0.5 y una relación VPS arteria renal / arteria ilíaca externa > 3. En caso de alta sospecha diagnóstica y hallazgos ecotomográficos no concluyentes, deben considerarse métodos de segunda línea como angio-TC o angio-RM.
Es importante considerar que en el postoperatorio inmediato puede observarse un aumento leve de las VPS por edema del injerto, por lo que estos hallazgos deben ser interpretados en conjunto con la evolución clínica y la función renal.
- Trombosis venosa: infrecuente, menos de 3%. Doppler demuestra flujo venoso ausente, con trombo dentro del lumen. Puede observarse flujo diastólico reverso en la arteria renal.
- Infarto Segmentario: área hipoecogénica del parénquima, con borde ecogénico bien delimitado (54)
- Otros: Fístula arteriovenosa, aneurisma de la arteria
Complicaciones no vasculares:
– Necrosis tubular aguda (NTA): Las alteraciones difusas del parénquima como la NTA, rechazo agudo y nefrotoxicidad pueden tener presentación idéntica en ecografía. Se muestra riñón aumentado de tamaño, con parénquima hiperecogénico, pirámides prominentes y borramiento del seno renal. En las formas leves, no hay efecto en el Doppler. Sin embargo, en las formas más severas puede existir una reducción en el flujo diastólico con alto índice de resistencia (sobre 0.8). En las formas más severas, el índice de resistencias puede estar sobre 1.0 y el flujo diastólico ausente o reverso.
– Hidronefrosis obstructiva y no obstructiva: pielectasia leve puede deberse a reflujo vesicouretral o dilatación por denervación de la vía urinaria del injerto (54).
– Colecciones perirrenales: el líquido perirrenal es frecuente de encontrar en control precoz del trasplante, puede estar presente en 50% inicialmente (54).
- Urinomas: colección simple que generalmente aparece en los 10 primeros días y que progresa en el tiempo. Requiere otros métodos de evaluación para su diagnóstico cuando se sospecha (punción y análisis del líquido, TC con contraste, cintigrama renal) (54).
- Hematomas: son comunes en postoperatorio precoz. Muy inicialmente pueden ser anecoicos. Luego en fase aguda son heterogenénos hiperocicoicos y van desarrollando áreas solido- quísticas por lísis de los coágulos con el tiempo (53). Hematomas voluminosos pueden comprimir el hilio o afectar funcionalidad del injerto (54).
– Síndrome compartimental del injerto: Raro y poco sospechado como causa de disfunción precoz del injerto, más frecuente en riñones voluminosos con cierre a tensión de la fascia (sólo en riñones implantados extraperitoneales). Se caracteriza por flujo cortical disminuido o ausente en el Doppler color y generalmente se manifiesta en las primeras 2 horas por trasplante (54).
Seguimiento
Se recomienda realizar un control ecográfico con Doppler-color al primer mes postquirúrgico. Los controles a mediano y largo plazo dependerán de la evolución clínica del paciente y de los exámenes que evalúen la función renal.
Otros Procedimientos
TC / RM
– Complemento cuando los hallazgos de la ecografía no sean concluyentes o necesiten confirmación /estudio.
– Infecciones, traumatismos
– Complicaciones abdominopélvicas de la cirugía (obstrucción intestinal por síndrome adherencial, confirmar urinomas o linfoceles en colecciones, etc).
– Neoplasias para estadiaje.
Angio-TC/RM
– Sospecha de estenosis arterial u otras patologías vasculares
– Hematomas que no puedan valorarse correctamente
– 1ª línea Angiotac por mejor resolución axial, estudio muy rápido de realizar (menos de 3 minutos) siempre y cuando clearence de creatinina > 30 ml/min
– 2º línea AngioRM con contraste considerar si existe antecedente de RAM severa al medio de contraste yodado que contraindica estudio. Si existe falla renal (clearence creatinina < 30 ml/min) considerar estudio AngioRM no contrastada en secuencias especiales (por ejemplo, arterial spin label)
Angiografía
– En aquellos pacientes que necesiten un tratamiento endovascular. Rol diagnóstico- terapéutico
Medicina nuclear
– Son especialmente útiles en período postoperatorio precoz. El cintigrama MAG3 y DTPA pueden entregar información cualitativa y cuantitativa de la perfusión cortical, de la extracción del parénquima y su excreción, más cuando se utilizan en forma seriada con fines comparativos. Existiendo otros métodos diagnósticos, actualmente son menos utilizados (53).
INMUNOLOGÍA DEL TRASPLANTE RENAL: FUNDAMENTOS, TÉCNICAS Y APLICACIÓN CLÍNICA
Introducción
El éxito de un programa de trasplante renal depende en gran medida del conocimiento profundo de la inmunología del trasplante. A medida que la medicina de trasplante ha evolucionado, también lo han hecho nuestra comprensión de los mecanismos inmunológicos involucrados y las herramientas diagnósticas y terapéuticas asociadas.
Actualmente, no es posible diseñar un abordaje clínico seguro ni optimizar la asignación de órganos sin dominar los conceptos de reconocimiento antigénico, presentación del antígeno, y las complejidades del complejo mayor de histocompatibilidad (HLA) (56).
El avance en técnicas de tipificación de alta resolución y la implementación de algoritmos como PIRCHE-II o el análisis de epítopos HLA, han permitido predecir riesgos de rechazo con una precisión sin precedentes (57,58).
Comprender estos principios no sólo reduce la incidencia de rechazo, sino que permite mejorar la sobrevida a largo plazo del injerto y del paciente, siendo la piedra angular de cualquier estrategia de inmunosupresión individualizada (59).
1. Reconocimiento antigénico y presentación del antígeno
Las células del sistema inmune del receptor pueden reconocer al injerto mediante tres vías distintas: directa, indirecta y semidirecta.
- Vía directa: las células presentadoras de antígenos (APC) del donante presentan HLA intactos a linfocitos T naive del receptor. Es la vía dominante en el rechazo agudo celular (56,60).
- Vía indirecta: las APC del receptor procesan péptidos del injerto y los presentan en moléculas HLA propias. Esta vía es clave en el desarrollo de rechazo crónico y DSA de novo (56,61).
- Vía semidirecta: las APC del receptor adquieren moléculas HLA intactas del donante y las presentan directamente, uniendo los mecanismos directos e indirectos (56).
La activación resultante de linfocitos T CD4⁺ y CD8⁺, junto con células NK, constituye el inicio de una respuesta inmunológica dirigida contra el injerto (56).
2. Complejo Mayor de Histocompatibilidad (HLA)
El HLA es un sistema polimórfico localizado en el cromosoma 6, esencial para la presentación de antígenos. Se divide en clases I (HLA-A, -B, -C) presentes en todas las células nucleadas, y clase II (HLA-DR, -DQ, -DP) restringidas a APC (56).
La incompatibilidad en HLA, especialmente en DR y DQ, se ha correlacionado con una mayor incidencia de rechazo celular y humoral, así como con una disminución de la sobrevida del injerto (62,63).
3. Tipificación HLA y epítopos
Las técnicas modernas permiten tipificación a nivel de alta resolución mediante NGS, identificando diferencias moleculares mínimas entre receptor y donante.
- PCR-SSP y SSO: métodos estándar de resolución media.
- Secuenciación de nueva generación (NGS): permite analizar diferencias a nivel de epletos.
- Algoritmos como PIRCHE-II predicen péptidos derivados del donante capaces de ser presentados por HLA del receptor, lo que se ha correlacionado con mayor riesgo de rechazo (58,63).
4. Pruebas de compatibilidad inmunológica
- Detección de DSA mediante Luminex (SAB): anticuerpos específicos frente al HLA del donante.
- Crossmatch:
- CDC: identifica anticuerpos citotóxicos, útil para evitar rechazo hiperagudo
- Flow-XM: más sensible, útil en pacientes sensibilizados
- Virtual crossmatch: predicción basada en tipificación y perfil de anticuerpos.
- PRA/cPRA: cuantifican la sensibilización previa del receptor, siendo cPRA >95% un marcador de alta sensibilización y dificultad para encontrar un donante compatible (63).
5. Implicancias clínicas
- DSA preformados se asocian con rechazo hiperagudo o ABMR precoz.
- DSA de novo son predictores de disfunción crónica del injerto y rechazo humoral crónico
- El uso de algoritmos de epítopos y PIRCHE-II permite optimizar la asignación de órganos y estratificar riesgos inmunológicos, incluso en pacientes hipersensibilizados (64,65).
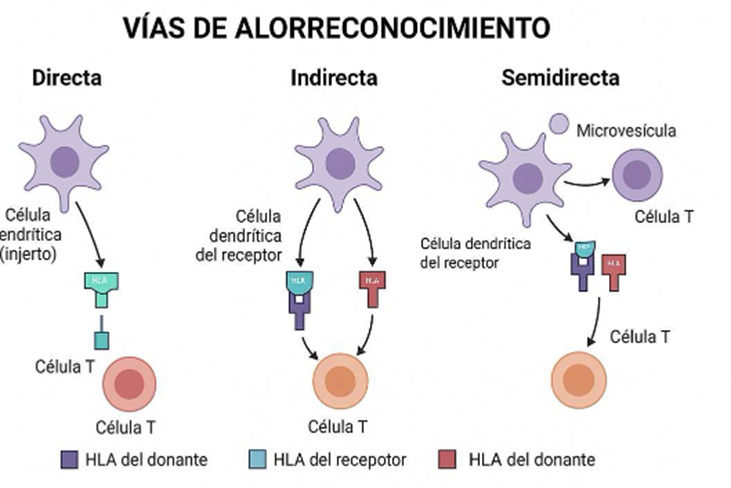
Fig. 10. Vías de alorreconocimiento (56).
Representación esquemática de las tres vías mediante las cuales las células inmunes del receptor reconocen al injerto: directa, indirecta y semidirecta. La vía directa domina en el rechazo agudo temprano, la indirecta en el rechazo crónico, y la semidirecta combina elementos de ambas rutas.
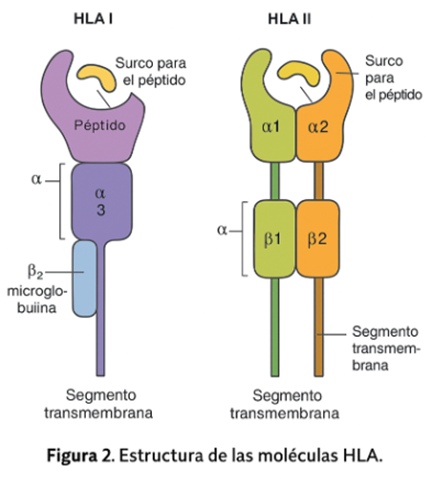
Fig. 11. Estructura de las moléculas HLA (56).
Comparación esquemática de las moléculas HLA clase I y clase II. Ambas presentan un surco para la unión de péptidos antigénicos, pero difieren en su composición subunitaria: clase I incluye una cadena α y β2-microglobulina; clase II se compone de dos cadenas (α y β) que forman el surco de unión. Estas diferencias son clave en la presentación antigénica a células T CD8⁺ y CD4⁺, respectivamente.
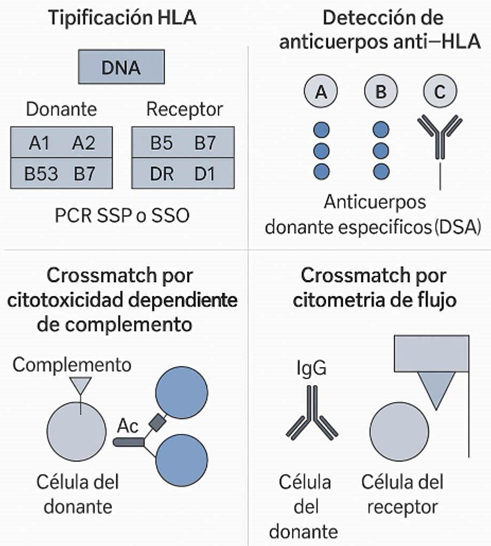
Fig. 12. Técnicas de compatibilidad inmunológica (63,66).
Infografía que muestra las principales pruebas inmunológicas utilizadas para evaluar la compatibilidad entre donante y receptor en trasplante renal. Se incluyen: tipificación HLA por PCR-SSP/SSO, detección de anticuerpos anti-HLA (DSA), prueba de citotoxicidad dependiente de complemento (CDC crossmatch) y crossmatch por citometría de flujo. Estas herramientas permiten estratificar el riesgo inmunológico y guiar estrategias de desensibilización o asignación de órganos.
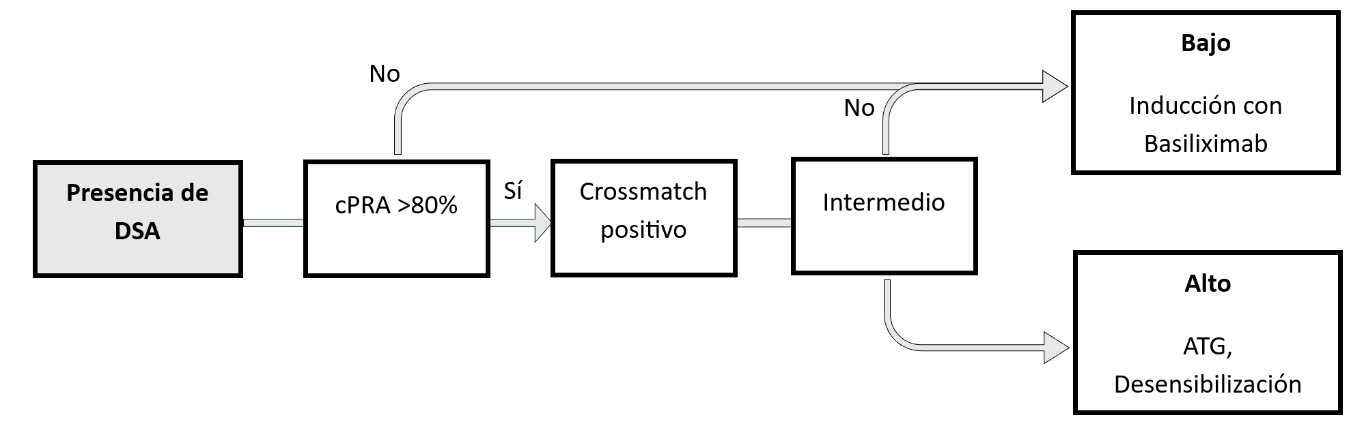 Fig. 13. Algoritmo de riesgo inmunológico (59,67).
Fig. 13. Algoritmo de riesgo inmunológico (59,67).
Algoritmo de estratificación del riesgo inmunológico en trasplante renal basado en la presencia de anticuerpos donante específicos (DSA), cPRA y pruebas de crossmatch. El riesgo se clasifica como bajo, intermedio o alto, lo que determina la necesidad de terapia de inducción con basiliximab o estrategias de desensibilización con ATG en pacientes sensibilizados.
TRATAMIENTO INMUNOSUPRESOR EN EL TRASPLANTE RENAL
Introducción
El tratamiento inmunosupresor es una piedra angular del éxito en el trasplante renal (56). Su propósito es prevenir el rechazo agudo y crónico del injerto al tiempo que se minimizan los efectos adversos, como infecciones y toxicidad (59,13). El desarrollo de fármacos inmunosupresores ha permitido un notable aumento en la sobrevida del injerto y del paciente, pero su uso requiere una profunda de los mecanismos inmunológicos involucrados, los sitios de acción de cada agente y la capacidad para adaptar los esquemas a cada perfil de riesgo y condición clínica del paciente (59,68).
1. Fundamentos y Mecanismo de Acción de los Inmunosupresores
Los inmunosupresores actúan interfiriendo con diferentes etapas de la respuesta inmune. Se agrupan según su mecanismo de acción y su sitio de acción sobre el sistema inmune:
- Inhibidores de la calcineurina (ICN): Tacrolimus y Ciclosporina. Inhiben la activación de linfocitos T al bloquear la transcripción de IL-2 mediante la inhibición de la calcineurina.
- Antiproliferativos: Micofenolato mofetilo (MMF) y Azatioprina. Inhiben la proliferación de linfocitos al interferir con la síntesis de purinas.
- Inhibidores mTOR: Sirolimus y Everolimus. Actúan en la fase de proliferación celular posterior a la señalización IL-2, bloqueando la síntesis proteica y proliferación.
- Corticoesteroides: Prednisona. Inhiben múltiples rutas inflamatorias y citocinas.
- Anticuerpos monoclonales: Basiliximab (anti-CD25), Rituximab (anti-CD20), Alemtuzumab (anti-CD52).
- Anticuerpos policlonales: ATG (globulina antitimocítica). Depleción masiva de linfocitos T y B (56,58).
2. Esquemas de Inducción y Mantenimiento
- Inducción: fase inicial postrasplante, orientada a prevenir el rechazo temprano. Utiliza fármacos depletores (ATG, Alemtuzumab) en pacientes de alto riesgo, o no depletores (Basiliximab) en riesgo bajo.
- Mantenimiento: combinación de 2 o 3 agentes a largo plazo. Esquema triple clásico: ICN + Antimetabolito + Corticoide. Puede modificarse según el perfil inmunológico o presencia de efectos adversos (59,67).
3. Adaptación del Tratamiento según el Riesgo Inmunológico
- Riesgo bajo (donante vivo HLA compatible, no sensibilizado): Basiliximab, reducción precoz de corticoides.
- Riesgo intermedio (incompatibilidad menor, DSA de bajo título): ATG + triple esquema.
- Riesgo alto (PRA > 80%, trasplante ABO incompatible, re-trasplante): ATG o Alemtuzumab + esquemas con exposición minimizada a ICN y seguimiento estrecho (59,67, 70).
4. Plasticidad del Tratamiento según Comorbilidades y Complicaciones
- Infecciones: reducción temporal de inmunosupresión. En infecciones virales como CMV o BK, suspender antimetabolito primero.
- Complicaciones oncológicas: suspensión de MMF, conversión a mTOR si es posible.
- Citopenias o toxicidad medular: evitar antimetabolitos o ATG.
- Enfermedad cardiovascular o diabetes: reducción de ICN; considerar conversión a mTOR o belatacept (59,71).
5. Consideraciones en Virus BK
El virus BK es una complicación grave en trasplante renal. Su manejo incluye:
- Monitoreo con PCR en plasma (cada 1-3 meses en el primer año).
- Reducción escalonada de inmunosupresión, comenzando con suspensión de MMF.
- Conversión a mTOR si existe replicación persistente.
- Biopsia renal si hay disfunción para confirmar BKVAN (nefropatía asociada a virus BK) (62,72, 73).
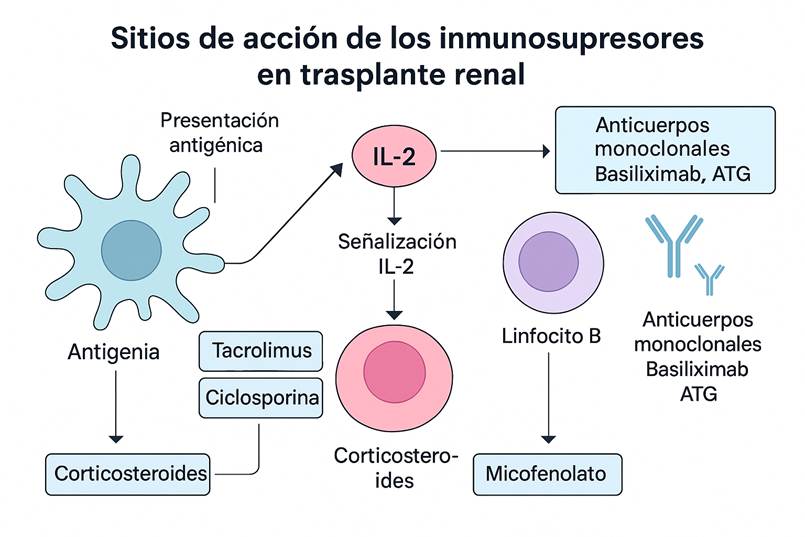
Fig. 14. Sitios de acción de los inmunosupresores (56,68).
Mapa inmunológico que muestra cómo los inmunosupresores actúan en distintas fases de la respuesta inmune adaptativa. Tacrolimus y Ciclosporina inhiben la transcripción de IL-2 en linfocitos T; Micofenolato interfiere con la proliferación de linfocitos; los anticuerpos monoclonales bloquean la activación celular por citocinas; y los corticosteroides suprimen múltiples vías inflamatorias.
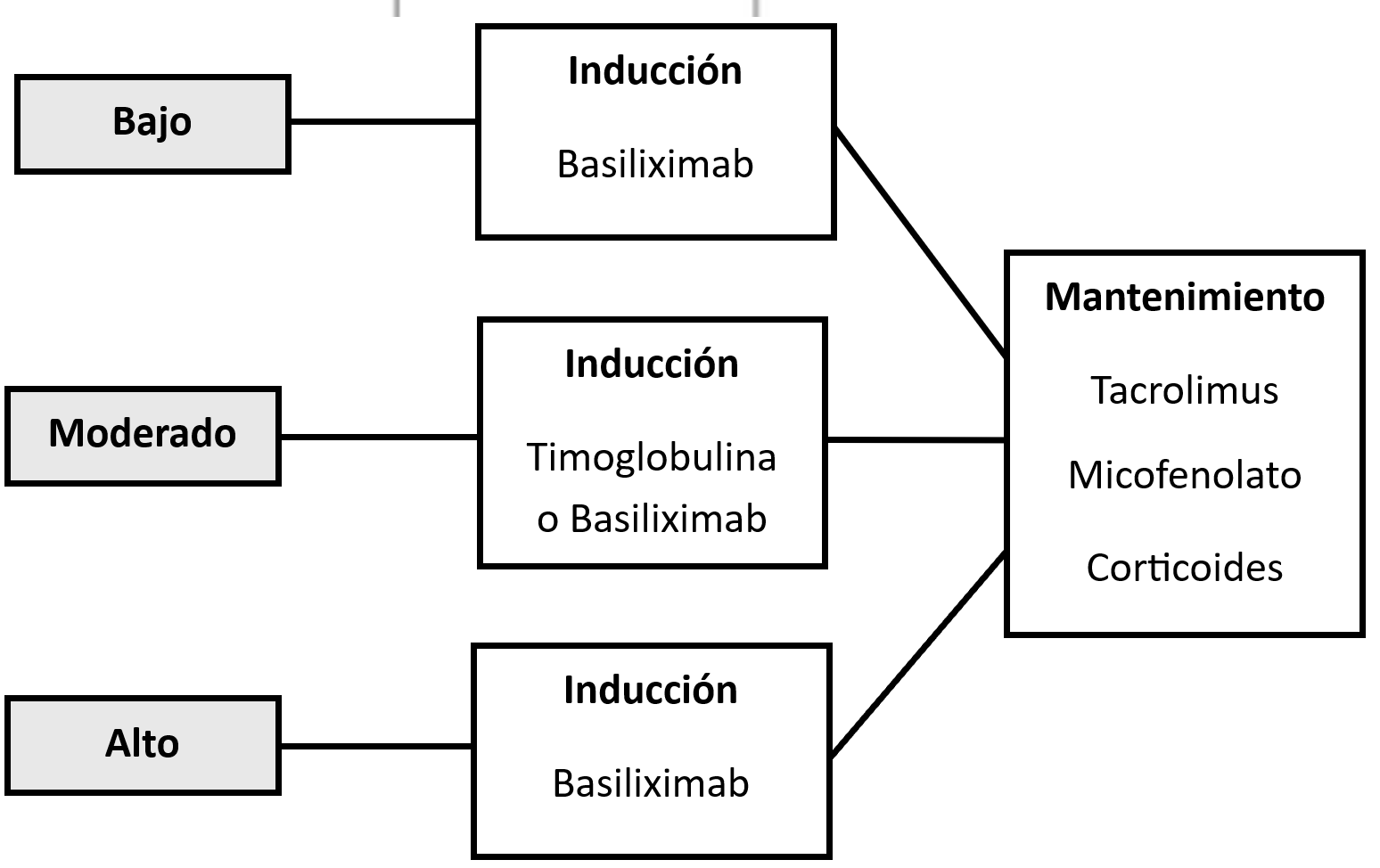
Fig. 15. Esquema terapéutico según riesgo inmunológico (59,67).
Flujograma terapéutico que establece el esquema de inducción y mantenimiento de inmunosupresión según el riesgo inmunológico del paciente. En riesgo bajo se utiliza basiliximab como inducción; en riesgo moderado, ATG o basiliximab; en riesgo alto, timoglobulina. El mantenimiento se basa en triple terapia con tacrolimus, micofenolato y corticoides.
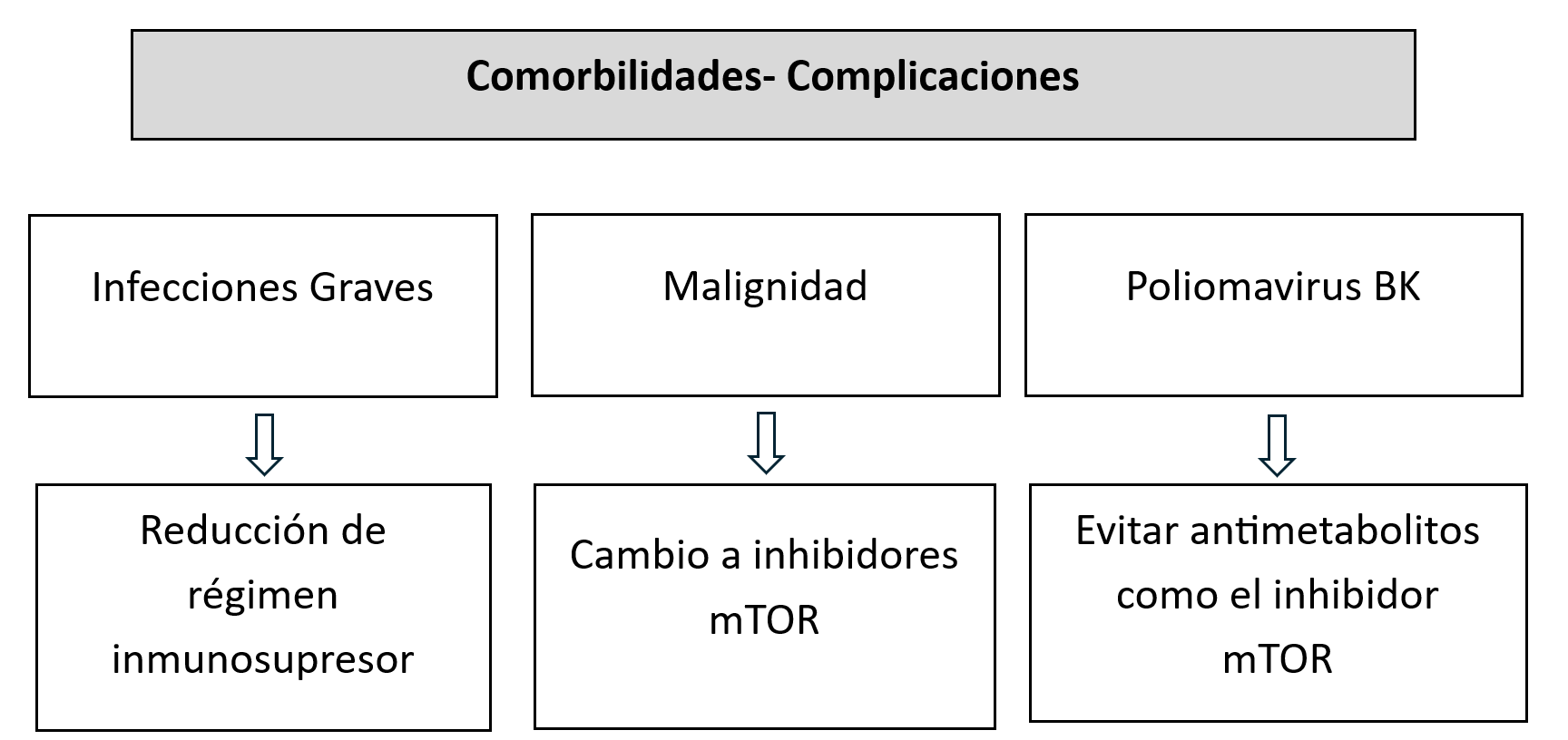
Fig. 16. Adaptación del tratamiento inmunosupresor ante complicaciones clínicas (59,70).
Diagrama de decisiones clínicas ante complicaciones frecuentes en trasplante renal. Ante infecciones graves se recomienda reducción escalonada de inmunosupresión; en caso de malignidad, se favorece el uso de inhibidores mTOR; en nefropatía por poliomavirus BK, se evita el uso de antimetabolitos y mTOR; en citopenias severas se reconsidera el uso de ATG o micofenolato.
RECHAZO EN EL TRASPLANTE RENAL: MECANISMOS, DIAGNÓSTICO Y MANEJO INTEGRAL
Introducción
El rechazo del injerto renal continúa siendo uno de los principales desafíos clínicos en trasplante renal. A pesar de los avances en inmunosupresión, la activación inmunológica contra el aloinjerto puede comprometer su función y supervivencia a corto y largo plazo. El conocimiento profundo de los mecanismos inmunopatológicos, las formas de presentación clínica y de laboratorio, así como el valor diagnóstico de la biopsia renal, permite establecer estrategias terapéuticas y preventivas más eficaces. Esta sección describe en detalle los aspectos fundamentales del rechazo agudo y crónico, su fisiopatología, clasificación, diagnóstico y manejo basado en la evidencia (62).
1. Mecanismos Inmunológicos del Rechazo
El rechazo renal es el resultado de una respuesta inmunitaria adaptativa frente a antígenos del injerto, principalmente antígenos HLA. El proceso puede implicar:
– Rechazo mediado por células T (TCMR): los linfocitos T CD4⁺ y CD8⁺ reconocen péptidos alogénicos presentados por células presentadoras de antígenos (APC) a través de la vía directa, indirecta o semidirecta anteriormente descrita (59).
– Rechazo mediado por anticuerpos (ABMR): implica anticuerpos donante-específicos (DSA) preformados o de novo, que se fijan a células endoteliales del injerto activando el complemento (C4d), células NK o mecanismos FcR-dependientes generando una respuesta rápida y agresiva (60,64).
– Rechazo mixto: combinación de mecanismos celulares y humorales, con presencia de infiltrados celulares y daño endotelial mediado por DSA (74).
2. Formas Clínicas y de Laboratorio
El rechazo puede presentarse como:
– Deterioro de la función renal: aumento de creatinina, oliguria.
– Proteinuria de novo o en aumento.
– Hipertensión arterial nueva o descontrolada.
– En laboratorio: disfunción del injerto sin causa urológica ni infecciosa, con evidencia histológica de rechazo.
La detección de DSA circulantes (por Luminex), evidencia de activación del complemento (C4d) y signos de inflamación microvascular son claves (64).
El diagnóstico de certeza se establece por Biopsia renal del injerto donde se evidencia el daño, ya sea mediado por anticuerpos, células o mixto, con los patrones de lesión descritos en la clasificación de Banff para categorizarlo (62).
3. Temporalidad del Rechazo (60).
– Hiperagudo (minutos a horas): mediado por anticuerpos preformados. Cada vez menos frecuente considerando los avances en las técnicas de detección de Anticuerpos pre-trasplante y la mayor sensibilidad de las pruebas de compatibilidad pre trasplante mediante crossmatch por citometría de flujo.
– Agudo (días a semanas): puede ser celular o humoral. Requiere tratamiento inmediato.
– Tardío (meses a años): suele implicar mecanismos humorales crónicos, con fibrosis progresiva y formación de anticuerpos anti HLA DSA de novo, que traduce una respuesta inmune activa.
– Crónico: daño estructural acumulativo (fibrosis, glomerulopatía) asociado a ABMR o TCMR de bajo grado pero que llevan a la pérdida del injerto progresivamente.
4. Clasificación: TCMR, ABMR y Rechazo Mixto (62,74).
– Rechazo celular (TCMR): afecta túbulos (tubulitis) y vasos (vasculitis). Clasificación Banff IA–III.
– Rechazo humoral (ABMR): caracterizado por daño endotelial, presencia de DSA y C4d positivo (en ABMR activo). Incluye formas agudas y crónicas.
– Rechazo mixto: superposición de hallazgos TCMR y ABMR; tiene peor pronóstico.
5. Importancia de la Biopsia Renal y Marcadores Histológicos
La biopsia es el estándar de oro para el diagnóstico. Se basa en criterios de Banff e incluye:
– Tubulitis, inflamación intersticial, glomerulitis, capilaritis peritubular.
– Positividad para C4d (por inmunofluorescencia o inmunohistoquímica).
– Presencia de DSA en suero.
– Hallazgos crónicos: atrofia tubular, fibrosis intersticial, glomeruloesclerosis, arteriopatía.
La biopsia permite establecer la gravedad, guiar el tratamiento y evaluar respuesta.
6. Tratamiento y Seguimiento (64).
– TCMR IA-IB: metilprednisolona en bolos.
– TCMR IIA-III: ATG.
– ABMR agudo: plasmaféresis + IVIG; rituximab; en casos refractarios se puede evaluar uso de algunos otros anticuerpos, pero con poca evidencia de respuesta hasta ahora.
– ABMR crónico: manejo complejo, centrado en control de DSA y optimización de la terapia inmunosupresora crónica por ahora. Poca evidencia de éxito en otros tipos de terapia.
El seguimiento requiere control de DSA, función renal y biopsias de seguimiento, vigilancia o por indicación.
7. Prevención del Rechazo (5).
- Optimización de la inmunosupresión según riesgo inmunológico.
- Programas de vigilancia de DSA postrasplante.
- Adherencia estricta al tratamiento inmunosupresor.
- Monitoreo temprano de infecciones y toxicidad.
8. Rechazo por Anticuerpos no-HLA
Además de los anticuerpos dirigidos contra antígenos HLA, se ha demostrado la existencia de anticuerpos no-HLA capaces de inducir daño en el injerto renal. Estos anticuerpos están dirigidos contra antígenos endoteliales, proteínas de membrana o receptores expresados en el aloinjerto (75,77).
Entre los más estudiados se encuentran (75,76,77):
– Anticuerpos contra el receptor de angiotensina tipo 1 (anti-AT1R): se han asociado a rechazo vascular severo, microangiopatía y pérdida temprana del injerto de no mediar tratamiento.
– Anticuerpos contra MICA (MHC class I chain-related A): también asociados a menor sobrevida del injerto.
– Anticuerpos contra proteínas endoteliales (vimentina, perlecan, agrina): contribuyen a activación endotelial, inflamación y rechazo crónico.
– Anticuerpos anti-LG3 y contra receptores de VEGF: implicados en microangiopatía crónica y pérdida progresiva del injerto.
Características clave:
– No son detectables por técnicas convencionales como Luminex anti-HLA.
– Pueden coexistir con DSA HLA o aparecer de forma aislada.
– En biopsias, se asocian con glomerulitis, capilaritis, y activación del endotelio sin positividad para C4d (75-77).
Diagnóstico:
– Ensayos ELISA o de inmunoensayo específicos (por ejemplo, anti-AT1R).
– Evaluación clínica: rechazo vascular sin DSA detectables, respuesta pobre a tratamiento convencional (77).
Tratamiento:
– Similar al rechazo humoral HLA: IVIG, plasmaféresis, rituximab, con adición de antagonistas específicos como bloqueadores de receptores AT1.
– En algunos casos, la inhibición del complemento terminal con inhibidores del complejo de ataque a membrana ha mostrado beneficios (75,77).
Importancia clínica:
El reconocimiento de anticuerpos no-HLA como causa de disfunción inmunológica del injerto permite reevaluar casos de rechazo humoral C4d-negativo o “inexplicado”, y abre nuevas estrategias diagnósticas y terapéuticas personalizadas.
AGRADECIMIENTOS
Con profunda gratitud, extendemos nuestro reconocimiento a nuestros profesores y maestros: Dr. Fernando Hidalgo Carmona, Dr. Javier Avilés Jasse y el Dr. David Carvajal Soria. Su disciplina, paciencia (a veces a prueba) y dedicación, fueron fundamentales en nuestra formación en trasplante renal. Sus enseñanzas y anécdotas están siempre presentes en cada trasplante.
Referencias
- Trasplante Renal, Guías Clínicas Sociedad Chilena del Trasplante, 2023
- Sergio Thambo B. Trasplante renal en Chile: historia del primer trasplante. Rev Hosp Clín Univ Chile 2007; 18; 295 – 8
- Hidalgo F. Historia del trasplante renal en el Hospital del Salvador. Conferencia Hernán Alessandri R. 2002
- Encuesta nacional de salud 2016-2017. Ministerio de Salud. Chile
- XXLIII Cuenta de hemodiálisis crónica en Chile, H Poblete, Sociedad Chilena de nefrología, 2023
- Resumen Ejecutivo. Guía de Práctica Clínica Trasplante Renal. Ministerio de Salud 2020
- Trasplante Renal, Guías Clínicas Sociedad Chilena del Trasplante, 2023
- Global Observatory on Donation and Transplantation. https://www.transplant-observatory.org/
- Registro nacional de trasplantes 2023. ISP. Ministerio de Salud
- Trasplante de órganos sólidos, corneas y listas de espera por mes 2024. Instituto de Salud pública, sección de histocompatibilidad, subdepartamento de enfermedades no transmisibles. Departamento biomédico nacional y de referencia
- Knechtle SJ, Marson LP, Morris PJ. Kidney Transplantation: Principles and Practice. 8th ed. Philadelphia: Elsevier; 2019.
- KDIGO. Clinical practice guideline on the evaluation and mangment of canidates for kidney transplantation. April 2020 . Vol 104
- Sprangers B, Nair V, Launay-Vacher V, Riella LV, Jhaveri KD. Risk factors associated with post–kidney transplant malignancies: an article from the Cancer-Kidney International Network. Clin Kidney J. 2018;11(3):315–29
- Pestana JOM, Moura LRR, Freitas TVS, Silva HT. Transplante renal: manual prático – uso diário ambulatorial e hospitalar. 2ª ed. São Paulo: Balieiro; 2022.
- Kidney Disease: Improving Global Outcomes (KDIGO) Living Kidney Donor Work Group. KDIGO Clinical Practice Guideline on the Evaluation and Care of Living Kidney Donors. Transplantation. 2017;101(8 Suppl 1):S1–S109.
- European Association of Urology. EAU Guidelines on Renal Transplantation. Arnhem, The Netherlands: EAU Guidelines Office; 2025
- Osband AJ, James NT, Segev DL. Extraction Time of Kidneys From Deceased Donors and Impact on Outcomes. Am J Transplant. 2016 Feb;16(2):700-3
- Ministerio de Salud. Decreto Supremo N° 656: Aprueba reglamento de la Ley N° 19.451 sobre trasplante y donación de órganos. Santiago: Diario Oficial; 1997 dic 17
- Heylen, L., et al. The Impact of Anastomosis Time During Kidney Transplantation on Graft Loss: A Eurotransplant Cohort Study. Am J Transplant, 2017. 17: 724.
- Tingle SJ, Figueiredo RS, Moir JA, Goodfellow M, Talbot D, Wilson CH. Machine perfusion preservation versus static cold storage for deceased donor kidney transplantation. Cochrane Database Syst Rev. 2019 Mar 15;3(3):CD011671
- Kay MD, Hosgood SA, Bagul A, Nicholson ML. Comparison of preservation solutions in an experimental model of organ cooling in kidney transplantation. Br J Surg. 2009 Oct;96(10):1215-21.
- Jochmans I, Akhtar MZ, Nasralla D, Kocabayoglu P, Boffa C, Kaisar M, Brat A, O’Callaghan J, Pengel LH, Knight S, Ploeg RJ. Past, Present, and Future of Dynamic Kidney and Liver Preservation and Resuscitation. Am J Transplant. 2016 Sep;16(9):2545-55
- Ministerio de Salud. Resolución Exenta N°487: Aprueba Guía Técnica para la asignación de riñones para trasplante renal con donante cadáver. Santiago: MINSAL; 2022 Julio
- Coordina Chile. Informe Annual de Procuramiento y trasplante 2023. Santiago: Minsal; 2023
- Ruiz M, Fernandez R, Soto N. Perfusión mecánica de donantes en parada cardiaca. Experiencia chilena. Rev Chilena de Cirugía. 2022;74(4):321-330
- Heylen L, Pirenne J, Samuel U, Tieken I, Naesens M, Sprangers B, Jochmans I. The Impact of Anastomosis Time During Kidney Transplantation on Graft Loss: A Eurotransplant Cohort Study. Am J Transplant. 2017 Mar;17(3):724-732
- Valeriani G, Cerbone V, Russo E, Sciano D, De Rosa P. Bench surgery in right kidney transplantation. Transplant Proc. 2010 May;42(4):1120-2
- Kishore TA, Shetty A, Tharun BK, John EV, Bhat S. Renal transplantation through a modified non-muscle-cutting Pfannenstiel incision. Int Urol Nephrol. 2014 May;46(5):901-4
- Phillips SH, Hill SK, Lipscomb LD, Africa JB. First experience: Open small incision rectus sheath approach renal transplant: A case series. Int J Surg. 2017 Mar;39:114-118.
- Wagenaar S, Nederhoed JH, Hoksbergen AWJ, Bonjer HJ, Wisselink W, van Ramshorst GH. Minimally Invasive, Laparoscopic, and Robotic-assisted Techniques Versus Open Techniques for Kidney Transplant Recipients: A Systematic Review. Eur Urol. 2017 Aug;72(2):205-217
- Barry JM. Renal transplant-recipient surgery. BJU Int. 2007 Mar;99(3):701-17
- Nanni G, Tondolo V, Citterio F, Romagnoli J, Borgetti M, Boldrini G, Castagneto M. Comparison of oblique versus hockey-stick surgical incision for kidney transplantation. Transplant Proc. 2005 Jul-Aug;37(6):2479-81
- Heylen, L., et al. The Impact of Anastomosis Time During Kidney Transplantation on Graft Loss: A Eurotransplant Cohort Study. Am J Transplant, 2017. 17: 724.
- Wilson, C.H., et al. Routine intraoperative ureteric stenting for kidney transplant recipients. Cochrane Database Syst Rev, 2013: CD004925.
- Visser, I.J., et al. Timing of Ureteric Stent Removal and Occurrence of Urological Complications after Kidney Transplantation: A Systematic Review and Meta-Analysis. J Clin Med, 2019. 8.
- Dadkhah F, Asgari MA, Tara A, Safarinejad MR. Modified ureteroneocystostomy in kidney transplantation to facilitate endoscopic management of subsequent urological complications. Int Urol Nephrol. 2010 Jun;42(2):285-93
- Pérez-Sáez MJ et al. Strategies for an Expanded Use of Kidneys From Elderly Donors. Transplantation 2017;101(4):727.
- Bentas W et al. Renal transplantation in the elderly: surgical complications and outcome with special emphasis on the Eurotransplant Senior program. Nephrol Dial Transplant 2008;23:2043.
- Clavien, P.A.; Barkun, J.; de Oliveira, M.L.; Vauthey, J.N.; Dindo, D.; Schulick, R.D.; de Santibanes, E.; Pekolj, J.; Slankamenac, K.;Bassi, C.; et al. The Clavien-Dindo classification of surgical complications: Five-year experience. Ann. Surg. 2009, 250, 187–196.
- Dagnaes-Hansen, J.; Kristensen, G.H.; Stroomberg, H.V.; Rohrsted, M.; Sorensen, S.S.; Roder, A. Surgical Complications Following Renal Transplantation in a Large Institutional Cohort. Transplant. Direct 2024, 10, e1626.
- Kamali K., Zargar M.A., Zargar H. Early common surgical complications in 1500 kidney transplantations. Transplant Proc. 2003; 35:2655-6.
- Moreso F and Hernandez D. Has the survival of the graft improved after renal transplantation in the era of modern immunosuppression?. Nefrología 2013; 33: 14-26
- Blume OR, Yost SE, Kaplan B. Antibody-Mediated Rejection: Pathogenesis, Prevention, Treatment, and Outcomes. J Transplant 2012;2012:201754.
- Arpali, E.; Al-Qaoud, T.; Martinez, E.; Redfield, R.R., III; Leverson, G.E.; Kaufman, D.B.; Odorico, J.S.; Sollinger, H.W. Impact of ureteral stricture and treatment choice on long-term graft survival in kidney transplantation. Am. J. Transplant. 2018, 18, 1977–1985.
- Alberts, V.P.; Idu, M.M.; Legemate, D.A.; Laguna Pes, M.P.; Minnee, R.C. Ureterovesical anastomotic techniques for kidney transplantation: A systematic review and meta-analysis. Transpl. Int. 2014, 27, 593–605.
- Arpali, E.; Al-Qaoud, T.; Martinez, E.; Redfield, R.R., III; Leverson, G.E.; Kaufman, D.B.; Odorico, J.S.; Sollinger, H.W. Impact of ureteral stricture and treatment choice on long-term graft survival in kidney transplantation. Am. J. Transplant. 2018, 18, 1977–1985.
- Ooms, L.S.S.; Moelker, A.; Roodnat, J.I.; Ijzermans, J.N.M.; Idu, M.M.; Terkivatan, T. Antegrade Balloon Dilatation as a Treatment Option for Posttransplant Ureteral Strictures: Case Series of 50 Patients. Exp. Clin. Transplant. 2018, 16, 150–155.
- Gdor, Y.; Gabr, A.H.; Faerber, G.J.;Wolf, J.S., Jr. Holmium:yttrium-aluminum-garnet laser endoureterotomy for the treatment of transplant kidney ureteral strictures. Transplantation 2008, 85, 1318–1321.
- Ammi, M.; Daligault, M.; Sayegh, J.; Abraham, P.; Papon, X.; Enon, B.; Picquet, J. Evaluation of the Vascular Surgical Complications of Renal Transplantation. Ann. Vasc. Surg. 2016, 33, 23–30.
- Patel, U.; Kumar, S.; Johnson, O.W.; Jeon, J.H.; Das, R. Long-term Graft and Patient Survival after Percutaneous Angioplasty or Arterial Stent Placement for Transplant Renal Artery Stenosis: A 21-year Matched Cohort Study. Radiology 2019, 290, 555–563.
- Ranghino, A.; Segoloni, G.P.; Lasaponara, F.; Biancone, L. Lymphatic disorders after renal transplantation: New insights for an old complication. Clin. Kidney J. 2015, 8, 615–622.
- Mehrabi, A.; Kulu, Y.; Sabagh, M.; Khajeh, E.; Mohammadi, S.; Ghamarnejad, O.; Golriz, M.; Morath, C.; Bechstein, W.O.; Berlakovich, G.A.; et al. Consensus on definition and severity grading of lymphatic complications after kidney transplantation.Br. J. Surg. 2020, 107, 801–811.
- Sugi MD, Joshi G, Maddu KK, Dahiya N, Menias CO. Imaging of renal transplant complications throughout the life of the allograft: comprehensive multimodality review. RadioGraphics. 2019 Sep-Oct;39(5):1327–1355.
- Sjekavica I, Novosel L, Rupčić M, Smiljanić R, Muršić M, Duspara V, Lušić M, Perkov D, Hrabak-Paar M, Zidanić M, Skender M. Radiological imaging in renal transplantation. Acta Clin Croat. 2018 Dec;57(4):694–712.
- Galgano SJ, Lockhart ME, Fananapazir G, Sanyal R. Optimizing renal transplant Doppler ultrasound. Abdom Radiol (NY). 2018 Oct;43(10):2564–2573.
- Abbas AK, Lichtman AH, Pillai S. Cellular and Molecular Immunology. 10th ed. Philadelphia: Elsevier; 2022.
- Kramer B, Klinger M, Hönger G, Hopfer H, Amico P, Steiger J, et al. The PIRCHE-II algorithm predicts indirect T-cell alloreactivity and graft loss in kidney transplantation. Front Immunol. 2022;13:973968.
- Zhang R, Zhou X, Meng Y, Liu C. Recent advances in HLA epitope matching and immunologic risk stratification. Front Genet. 2024;15:1442018.
- KDIGO Clinical Practice Guideline for the Care of Kidney Transplant Recipients. Kidney Int Suppl. 2020;10(4):e1–e107.
- Wiebe C, Gibson IW, Blydt-Hansen TD, Karpinski M, Ho J, Storsley LJ, et al. Evolution and clinical pathologic correlations of de novo donor-specific HLA antibody post kidney transplant. Am J Transplant. 2012;12(5):1157–67.
- Leventhal JR, Mathew JM. Mechanisms of immune tolerance in organ transplantation: past, present and future. Curr Opin Organ Transplant. 2018;23(1):6–14.
- Loupy A, Haas M, Roufosse C, Naesens M, Adam B, Afrouzian M, et al. The Banff 2019 Kidney Meeting Report (I): Updates on and Clarification of Criteria for T Cell– and Antibody‐Mediated Rejection. Am J Transplant. 2020;20(9):2318–31.
- British Transplantation Society. Guidelines for HLA Matching and Antibody Testing in Solid Organ Transplantation. 2023.
- Tait BD. Detection of HLA antibodies in organ transplant recipients—triumphs and challenges of the solid phase assays. Front Immunol. 2016;7:570.
- Abbas, Mubarak. The expanding role of antibodies in kidney transplantation. WJT. 2025;15(1):10–28.
- Organización Nacional de Trasplantes (ONT), España. Manual de Trasplante Renal. Madrid: ONT; 2022.
- British Transplantation Society. Clinical Practice Guidelines. Immunosuppression in renal transplantation. 2023.
- Halloran PF. Immunosuppressive drugs for kidney transplantation. N Engl J Med. 2004;351(26):2715–29.
- Pascual J, Royuela A, Crespo M, et al. The evolution of immunosuppression in kidney transplantation: a Spanish consensus document. Nefrología. 2021;41(5):487–504.
- Naesens M, Kuypers DR, Sarwal M. Calcineurin inhibitor nephrotoxicity. Clin J Am Soc Nephrol. 2009;4(2):481–508.
- Vincenti F, Charpentier B, Vanrenterghem Y, Rostaing L, Bresnahan B, Darji P, et al. A phase III study of belatacept-based immunosuppression. N Engl J Med. 2010;363(6):555–65.
- Hirsch HH, Randhawa P. BK virus in solid organ transplant recipients. Am J Transplant. 2013;13(Suppl 4):179–88.
- Bamoulid J, Staeck O, Crépin T, Caillard S, Angeletti A. BK virus-induced nephropathy in kidney transplant recipients: diagnosis, prevention and treatment. Transpl Int. 2021;34:182–95.
- Lefaucheur C, Loupy A, Hill GS, et al. Preexisting donor-specific HLA antibodies predict outcome. J Am Soc Nephrol. 2010;21(8):1398–406.
- Dragun D, Catar R, Philippe A. Non-HLA antibodies targeting the graft: emergence of non-HLA antibody-mediated rejection. Transpl Int. 2021;34:1005–1018.
- Lefaucheur C, Viglietti D, Bentlejewski C, et al. Non-HLA antibodies and kidney allograft rejection. Nat Rev Nephrol. 2019;15(9):575–586.
- Banasik M, Boratynska M, Koscielska-Kasprzak K, et al. Non-HLA antibodies: the hidden threat in transplantation. Transpl Immunol. 2022;70:101540.
Imágenes
- Fotos (Imágenes 1,2,3,4,8,9) tomadas de Cirugías de procuramiento y trasplante Renal: Dr. Gonzalo Rubio
- Ilustraciones (Imágenes 5,6,7) de elongación de arterias, venas e incisiones: Dra. Cristina Baeza
- Figuras se sección inmunología y Tratamiento inmunopresor: Abbas AK, Lichtman AH, Pillai S. Cellular and Molecular Immunology. 10th ed. Philadelphia: Elsevier; 2022.

