DOLOR PÉLVICO CRÓNICO EN LA MUJER
El dolor pélvico crónico (DPC) en mujeres se define actualmente como un dolor persistente, no cíclico, localizado en estructuras relacionadas con la pelvis, con una duración de al menos 6 meses y que afecta la calidad de vida o la funcionalidad(1).
La determinación precisa de la prevalencia del dolor pélvico crónico en mujeres es compleja, principalmente porque muchas afectadas no consultan al sistema de salud y porque existen variaciones en los criterios diagnósticos utilizados. No obstante, las estimaciones internacionales sitúan la prevalencia entre el 2,1% y el 24% de la población femenina, cifras comparables a las observadas en condiciones como el dolor lumbar, el asma o la migraña. El DPC no solo compromete de manera relevante la calidad de vida, sino que también genera un impacto económico significativo, reflejado en el aumento del ausentismo laboral y la disminución de la productividad(2)
En la actualidad, la mayoría de los estudios excluyen la dismenorrea primaria de la definición de DPC, con el fin de mejorar la comparabilidad epidemiológica(3).
Actualmente, el dolor pélvico crónico en mujeres se reconoce como una condición multifactorial en la que rara vez se identifica una única causa subyacente o un tratamiento completamente resolutivo. En más de la mitad de los casos, el DPC se asocia a la coexistencia de dos o más diagnósticos, siendo frecuentes la endometriosis, el síndrome de intestino irritable, la cistitis intersticial/síndrome de vejiga dolorosa y las adherencias pélvicas. Es importante destacar que la superposición clínica entre endometriosis y cistitis intersticial es especialmente común, lo que complica el abordaje terapéutico y requiere un enfoque multidisciplinario(4).
Actualmente, las principales guías internacionales para el diagnóstico y manejo del dolor pélvico crónico, desarrolladas por la Asociación Europea de Urología (EAU) y la Asociación Urológica Americana (AUA), recomiendan un enfoque integral y multidisciplinario. Estas guías abordan no solo los aspectos biológicos y fisiopatológicos, sino que también destacan la relevancia de los factores psicosociales y la importancia de la clasificación fenotípica para orientar el tratamiento individualizado(5). En ausencia de una etiología única identificable, el DPC se conceptualiza como un síndrome complejo, que puede reflejar mecanismos neuromusculares, viscerales y psicosociales superpuestos, similar a otros síndromes de dolor regional crónico y funcional, como el síndrome del intestino irritable o el síndrome de fatiga crónica(6).
La fisiopatología involucra procesos de sensibilización central, hiperestesia y posibles alteraciones en la función del suelo pélvico, además de la influencia significativa del contexto psicosocial. Estudios recientes muestran que hasta el 50% de las mujeres que consultan por DPC reportan antecedentes de trauma emocional, físico o sexual, y cerca de un tercio cumplen criterios de trastorno de estrés postraumático, lo que subraya la necesidad de una evaluación psicológica rutinaria en este grupo(7).
Evaluación
La Sociedad Internacional de Dolor Pélvico desarrolló un formulario de evaluación, que incluye herramientas para cuantificación y mapeo del dolor pélvico, cuestionarios de detección y una extensa revisión de los sistemas digestivo, reproductivo y urológico. La Tabla 1 enumera los hallazgos de la historia y examen físico asociado con diagnósticos específicos. Signos de alarma que pueden indicar enfermedad sistémica incluyen: sangrado poscoital, sangrado posmenopáusico, baja de peso, masa pélvica y hematuria(8).
Anamnesis La anamnesis de la paciente debe incluir preguntas sobre factores precipitantes y atenuantes; asociación entre dolor y menstruación, actividad sexual, micción y defecación; y respuesta a cualquier tratamiento previo (tabla 1). El mapeo del dolor puede ser útil; el paciente debe localizar el dolor en una representación visual del cuerpo. Esto permite identificar otras áreas donde el paciente experimenta dolor o puede revelar una distribución dermatomal, lo que sugiere una etiología no visceral. La revisión por sistemas debe enfatizar síntomas de enfermedades uroginecológicas, gastrointestinales, musculoesqueléticas y trastornos psiconeurológicos.
El clínico debe consultar la perspectiva subjetiva del paciente sobre posibles orígenes del dolor, y validar sus preocupaciones y ansiedad. Los efectos en calidad de vida y funcionalidad deben ser evaluados utilizando cuestionarios validados como la Escala de calidad de vida. Tener registro del dolor puede ser útil para comprender el patrón de dolor y su impacto en la vida del paciente. El registro puede incluir fechas de episodios de dolor, calificación numérica de cero a 10, ubicación del dolor y gravedad, factores asociados (por ejemplo, menstruaciones, estado de ánimo, función del intestino/vejiga, coito, actividad física), y el uso de medicamentos analgésicos(9).
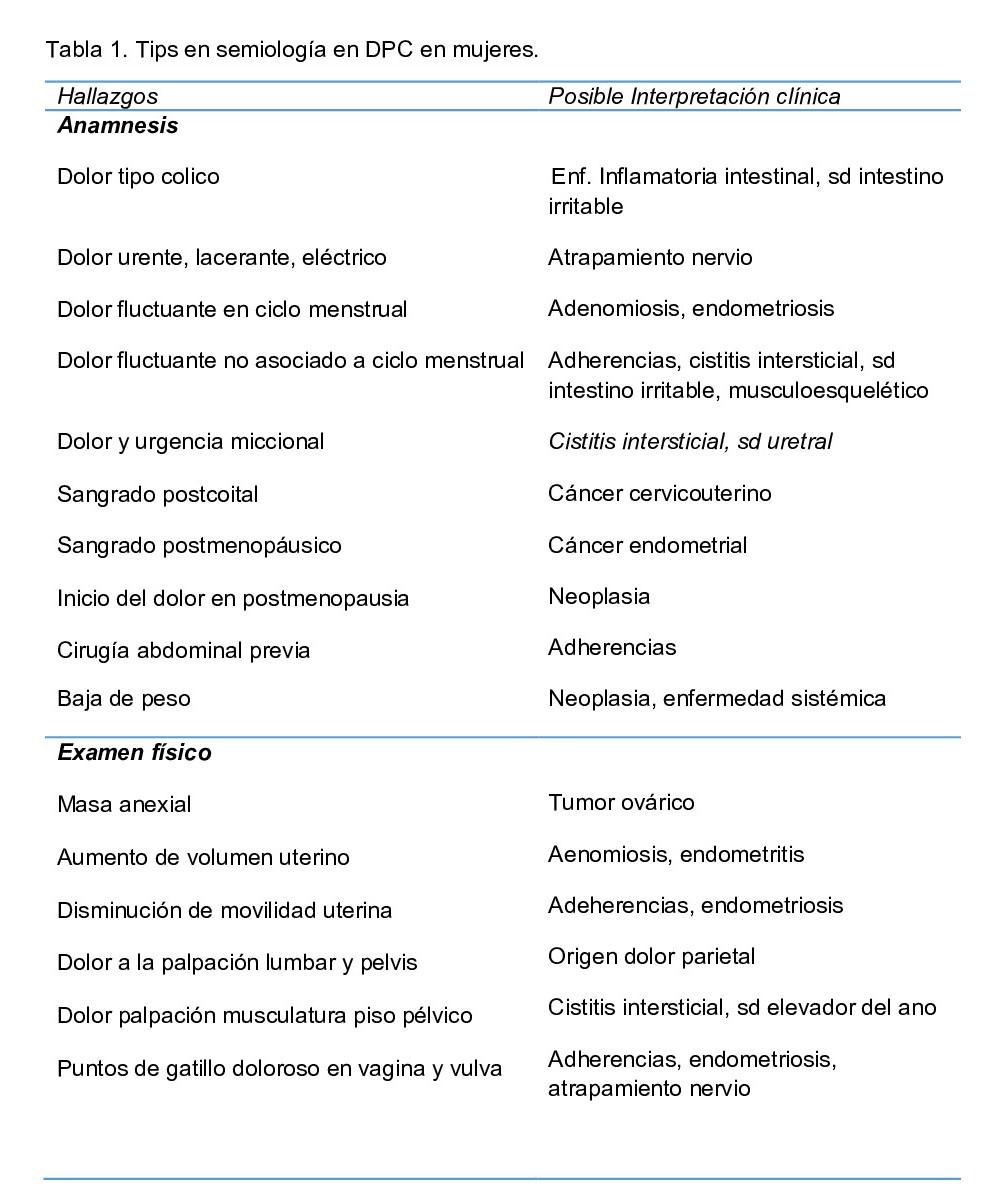
Tabla N°1. Hallazgos Clínicos asociados a anamnesis y examen físico
Examen físico
El examen físico en pacientes con dolor pélvico crónico tiene como principal objetivo identificar áreas específicas (dermatomas, tejidos, nervios, músculos y órganos) que reproduzcan los síntomas de dolor y permitan orientar la búsqueda de una causa subyacente. El examen debe realizarse de forma cuidadosa y respetuosa para minimizar la exacerbación del dolor y la ansiedad asociada, e idealmente debe estar adaptado al umbral de tolerancia de la paciente(10).
Se recomienda la evaluación sistemática del abdomen y la pelvis para detectar puntos gatillo miofasciales, cicatrices quirúrgicas, masas pélvicas, secreción vaginal, prolapso de órganos pélvicos o aumento del tamaño uterino. El examen de los genitales externos debe considerar la pesquisa de signos de infección, enfermedades dermatológicas inflamatorias, lesiones sugestivas de malignidad vulvar y posibles etiologías neurogénicas del dolor.
La palpación del suelo pélvico es fundamental, ya que puede revelar hipertonicidad muscular, contractura o puntos gatillo asociados a disfunción miofascial. Asimismo, la evaluación de la sensibilidad a la palpación en la zona lumbar, articulaciones sacroilíacas o sínfisis púbica puede orientar hacia un origen musculoesquelético del dolor. El uso de una torunda de algodón sobre la piel del abdomen es útil para detectar hiperestesia cutánea, un hallazgo asociado a sensibilización central en algunos casos de dolor pélvico crónico(11).
Pruebas diagnósticas
La historia clínica detallada y el examen físico dirigido constituyen los pilares fundamentales para el diagnóstico del dolor pélvico crónico. Los estudios complementarios -incluyendo exámenes de laboratorio, ecografía, tomografía computarizada, resonancia magnética y, en casos seleccionados, laparoscopía diagnóstica- deben emplearse de manera racional, guiados por la sospecha clínica y los hallazgos iniciales(12).
Las pruebas de laboratorio presentan un valor limitado en la evaluación de mujeres con dolor pélvico crónico, pero pueden ser útiles para descartar causas infecciosas o inflamatorias. Se recomienda solicitar hemograma, velocidad de sedimentación globular, examen de orina, pruebas para detección de diversas infecciones de trasnmisión sexual (Chlamydia, Ureaplasma, Mycoplasma, Neisseria) y test de embarazo, especialmente en la evaluación inicial, para identificar procesos infecciosos crónicos o descartar embarazo.
La ecografía transvaginal es el método de imagen de primera línea, ya que permite identificar masas pélvicas y adenomiosis, siendo particularmente eficaz para detectar lesiones de menos de 4 cm de diámetro, que suelen ser no palpables en el examen físico. Además, la ecografía resulta útil en la pesquisa de hidrosalpinx, marcador indirecto de enfermedad inflamatoria pélvica.
La resonancia magnética pélvica puede complementar la ecografía en casos de duda diagnóstica o para caracterizar mejor alteraciones anatómicas encontradas previamente. En situaciones de dolor severo o refractario, la laparoscopía diagnóstica puede ser indicada para confirmar o tratar patologías como la endometriosis o las adherencias pélvicas o abdominales, aunque en casi un 40% de los casos el hallazgo puede ser negativo. Durante este procedimiento, el mapeo del dolor con el paciente consciente y bajo anestesia local puede aportar información relevante, permitiendo identificar tejidos y estructuras responsables del dolor mediante la provocación dirigida y el diálogo con la paciente. Sin embargo, la expectativa de mejoría significativa tras intervenciones quirúrgicas sigue siendo limitada, ya que menos de la mitad de las pacientes experimentan una reducción clínicamente relevante del dolor tras estas intervenciones(13).
Tratamiento
El manejo del dolor pélvico crónico debe centrarse en optimizar la calidad de vida y la funcionalidad de la paciente, promoviendo activamente su participación en el autocuidado y la toma de decisiones terapéuticas. Aunque la evidencia sobre intervenciones específicas continúa siendo limitada, el tratamiento suele enfocarse en el alivio sintomático y la reducción del impacto negativo sobre la vida diaria. Siempre que sea posible, debe intentarse el manejo dirigido de las causas identificables, aunque incluso el tratamiento etiológico no garantiza la resolución completa del dolor en la mayoría de los casos. La fisiopatología multifactorial del dolor pélvico crónico implica la coexistencia de mecanismos físicos, psicológicos y sociales, por lo que el abordaje terapéutico recomendado es holístico e interdisciplinario, integrando componentes médicos, conductuales, psicológicos y sexuales. Las guías internacionales, como las de la Asociación Europea de Urología y el Colegio Americano de Obstetras y Ginecólogos, insisten en la importancia de la personalización del manejo, la educación del paciente y el trabajo coordinado de equipos multidisciplinarios(6).
Medicamentos
La Tabla 2 resume grupos de medicamentos usados en el tratamiento de dolor pélvico crónico inespecífico. Analgésicos como el paracetamol y los medicamentos antiinflamatorios no esteroidales son generalmente bien tolerados, aunque una revisión Cochrane concluyó que los Aines no son efectivos para tratar el dolor pélvico crónico asociado con endometriosis. Los anticonceptivos orales son efectivos para tratamiento de la dismenorrea asociada con endometriosis, con evidencia limitada en cuanto a su eficacia en dolor pélvico no menstrual. Una revisión concluyó que existe evidencia moderada para apoyar el tratamiento con progestágenos para el dolor pélvico crónico (p. ej., medroxiprogesterona de depósito, 150 mg por vía intramuscular cada 12 semanas). Si la paciente tiene endometriosis, los agonistas de la hormona liberadora de gonadotropina como la goserelina proporcionan mayor duración de efectos que la medroxiprogesterona de depósito. Los efectos adversos hipoestrogénicos pueden mitigarse con terapia hormonal. El dispositivo intrauterino liberador de levonorgestrel ha demostrado reducir la recurrencia de dismenorrea si se coloca después del tratamiento laparoscópico de la endometriosis(12).
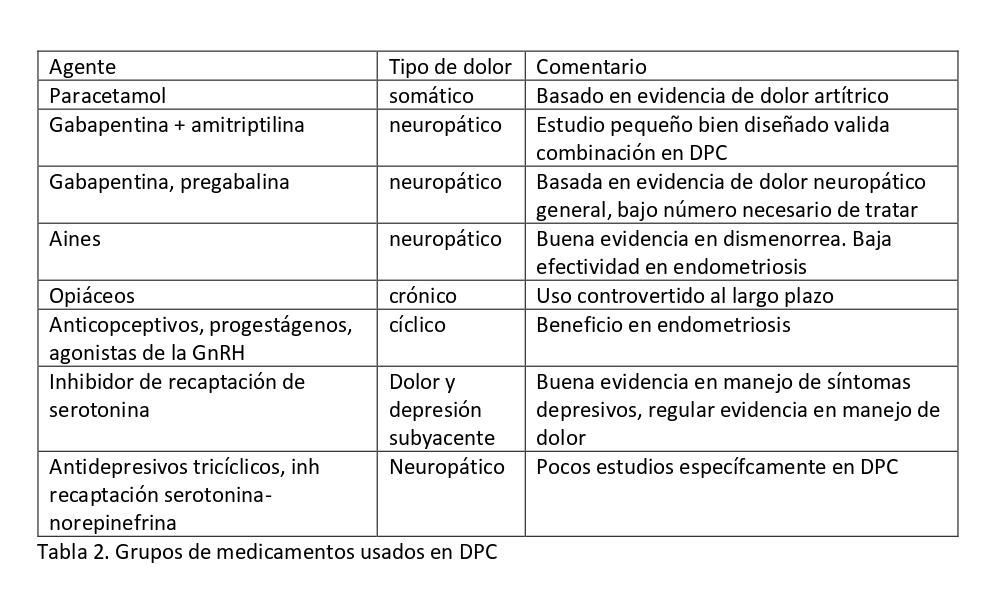
Tabla N°2. Tratamiento farmacológico
Si se sospecha dolor neuropático pueden ser útiles los antidepresivos tricíclicos, inhibidores de la recaptación de serotonina-noradrenalina o anticonvulsivos (por ejemplo, gabapentina, pregabalina). Aunque los datos sobre su efectividad en el tratamiento de dolor pélvico crónico son limitados, su uso se homologa a la evidencia de beneficio para tratar el dolor neuropático en general. Hay evidencia positiva para los inhibidores de la recaptación de serotonina-norepinefrina y Gabapentina.
Un estudio diseñado en dolor pélvico crónico en mujeres sugirió que la gabapentina usada sola o en combinación con amitriptilina es más efectiva que la amitriptilina sola. La evolución positiva con gabapentina o pregabalina puede ser un predictor de respuesta a la neuromodulación. Los datos son insuficientes para recomendar los inhibidores de recaptación selectiva de serotonina en dolor pélvico de carácter neuropático, pero son eficaces si hay depresión subyacente. Los opioides pueden considerarse a largo plazo en manejo del dolor no maligno cuando se han agotado otras opciones. Sin embargo, su uso en síndromes de dolor somático funcional es controvertido y se debe considerar derivación a unidad de tratamiento del dolor(13).
Cirugía
La indicación de intervención quirúrgica en dolor pélvico crónico debe estar fundamentada en la identificación clara de una causa tratable. La cirugía laparoscópica suele ser efectiva para el control del dolor asociado a endometriosis, pero no garantiza la resolución completa en todos los casos. La histerectomía se considera una alternativa de último recurso, dada su alta morbilidad y el beneficio limitado en la mejoría del dolor, reservándose para pacientes seleccionadas con patología uterina refractaria a otros tratamientos. Aunque aproximadamente la mitad de las mujeres con dolor uterino experimentan mejoras en la salud mental, física y funcionalidad social tras la histerectomía, hasta un 40% puede mantener dolor persistente y al menos un 5% puede experimentar intensificación del dolor postoperatorio. En casos donde se identifican nervios periféricos como generadores del dolor, la infiltración local de esteroides puede tener tanto un valor diagnóstico como terapéutico. Además, el compromiso del nervio sacro puede manejarse mediante bloqueos específicos o, en situaciones refractarias, mediante neuromodulación eléctrica con implante de dispositivos estimuladores, estrategia que debe ser considerada solo por equipos multidisciplinarios especializados(14).
Fisioterapia
La fisioterapia especializada del suelo pélvico representa una intervención prometedora en el manejo del dolor pélvico crónico, especialmente en pacientes con disfunción o dolor miofascial identificado. Aunque ensayos clínicos controlados han mostrado beneficios en la reducción del dolor y la mejoría funcional, las revisiones sistemáticas recientes señalan que la evidencia aún es limitada para recomendarla como estándar universal en todos los casos de DPC. El biofeedback se ha consolidado como una herramienta útil dentro de la fisioterapia, ya que permite a los pacientes tomar conciencia y controlar la actividad de los músculos del piso pélvico, logrando mayor eficacia en el alivio del dolor en comparación con técnicas como la electroestimulación o el masaje aislado. Se recomienda que la indicación y supervisión de estas terapias esté a cargo de equipos multidisciplinarios con experiencia en dolor pélvico crónico(15).
Intervención en salud mental
El abordaje de la salud mental constituye un pilar fundamental en la atención de mujeres con dolor pélvico crónico, independientemente de la etiología subyacente. El tratamiento de los trastornos emocionales y psicológicos asociados, como la ansiedad y la depresión, mejora significativamente los resultados clínicos y la calidad de vida de las pacientes(16).
Entre las intervenciones más prometedoras se encuentra la terapia somatocognitiva, que integra psicoterapia cognitivo-conductual y fisioterapia especializada. Esta modalidad se enfoca en promover la conciencia corporal integral, potenciar estrategias de afrontamiento y facilitar la liberación manual del dolor muscular. Diversos estudios han demostrado que, cuando se combina con el manejo ginecológico habitual, la terapia somato-cognitiva contribuye a reducir la angustia, mejorar la percepción del dolor y optimizar la función motora. La identificación y el tratamiento precoz de los síntomas depresivos son esenciales, ya que la depresión incrementa entre tres y cinco veces el riesgo de persistencia del dolor tras intervenciones quirúrgicas ginecológicas. El uso de cuestionarios validados, como el PHQ-9, facilita la detección sistemática de depresión en este grupo de pacientes. Además, se ha observado que intervenciones sencillas orientadas a la validación de los síntomas, como la realización de ecografías de tranquilidad, pueden tener un efecto positivo en la reducción de la percepción de dolor, en comparación con políticas de seguimiento pasivo(13).
Terapias complementarias y alternativas
Las terapias complementarias y alternativas han adquirido un interés creciente en el manejo del dolor pélvico crónico, especialmente en mujeres con síntomas persistentes a pesar de tratamientos convencionales. La acupuntura ha sido evaluada en varios ensayos clínicos y revisiones sistemáticas recientes, sugiriendo que puede ser útil para reducir la intensidad del dolor en determinadas pacientes, incluyendo aquellas con endometriosis y dismenorrea secundaria; sin embargo, la calidad de la evidencia es variable y aún se requieren estudios más robustos para confirmar su eficacia. Por otra parte, las intervenciones basadas en mindfulness y meditación han demostrado beneficios en la reducción del dolor y la mejora de la calidad de vida, particularmente cuando se combinan con otras estrategias psicológicas. El yoga terapéutico, a su vez, ha mostrado resultados positivos en estudios observacionales y ensayos clínicos de pequeña escala, contribuyendo tanto al alivio del dolor como a la regulación emocional y el manejo del estrés(17). Además, terapias psicológicas como la hipnosis y la terapia cognitivo-conductual adaptada a dolor crónico han evidenciado mejoras moderadas en la esfera emocional y funcionalidad diaria de las pacientes(18).
CISTITIS INTERSTICIAL
La Cistitis Intersticial (CI), actualmente conocida también como Síndrome de Vejiga Dolorosa (SVD), ha sido definida desde 2009 por la Sociedad Internacional de Continencia como “una sensación desagradable (dolor, presión o molestia) percibida como relacionada con la vejiga urinaria, asociada a síntomas del tracto urinario inferior durante más de seis semanas, en ausencia de infección u otra causa identificable”(19). Esta definición ha sido adoptada en las guías más recientes de la Asociación Americana de Urología y la Asociación Europea de Urología(20). La epidemiología del SVD/CI sigue siendo incierta debido a la heterogeneidad de los criterios diagnósticos y definiciones empleadas en los estudios. Sin embargo, las investigaciones poblacionales más grandes indican que la prevalencia es notablemente superior en mujeres (hasta cinco veces más que en hombres), y tiende a aumentar con la edad, especialmente en personas mayores de 40 años. En América Latina, y específicamente en Chile, la prevalencia exacta aún no ha sido documentada, pero los datos sugieren que el SVD/CI constituye una causa relevante de dolor crónico urológico en la población adulta(13).
Fisiopatología
La patogenia y la etiología de la cistitis intersticial permanecen aún definidas incompletamente. Sin embargo, existe consenso sobre el papel central de la disfunción epitelial. La superficie urotelial está revestida por una mucina impermeable de la superficie de la vejiga compuesta de glucosaminoglucanos sulfonados (GAG) y glucoproteínas. Los cambios en esta superficie pueden causar alteraciones de la permeabilidad que permiten que los iones de potasio atraviesen el urotelio, despolaricen los nervios sensoriales y motores y activen los mastocitos. Esta disfunción de la permeabilidad se manifiesta por una mayor absorción de urea. Esta es la base teórica del uso de fármacos de «recubrimiento epitelial», como el polisulfato de pentosano y la heparina intravesical o el ácido hialurónico(21).
Los GAG no son el único depósito de la impermeabilidad de la pared de la vejiga. Otros factores, como las moléculas de adhesión intercelular, la matriz extracelular y el citoesqueleto celular pueden ser importantes. Un número considerable de pacientes con CI relaciona la aparición de sus síntomas con episodios de cistitis bacteriana. Las bacterias pueden ser secuestradas dentro de las células uroteliales y causar alteraciones de la permeabilidad. El factor antiproliferativo urinario, recientemente descrito en CI, inhibe la proliferación celular y altera la reparación del urotelio dañado o desnudo con los cambios resultantes en la función de barrera del urotelio(22).
Neuro-interacciones uroteliales
Además de su función de barrera, el urotelio actúa como un «sensor mecánico» de la distensión de la vejiga y un «sensor químico» de la acidez, osmolalidad y composición de la orina. Los nervios aferentes de fibra C en la submucosa penetran en el urotelio y pueden mediar en estos funciones. Está surgiendo nueva información sobre el papel del urotelio como una extensión del sistema nervioso sensorial de la vejiga en relación con la neurotransmisión purinérgica a través de la vía adenosina 5 ‘trifosfato (ATP) y las vías vanilloide y purinérgica (P2X3).
La sustancia P, una taquiquinina liberada por los aferentes activados de la fibra C, está involucrada en la nocicepción en los sistemas nerviosos central y periférico y también funciona como un mediador inflamatorio. La liberación de la sustancia P produce una cascada inflamatoria con activación de mastocitos y regulación positiva de los nervios adyacentes (sensoriales, autónomos, motores). El aumento en el número de nervios que contienen sustancia P y el ARNm del receptor de sustancia P (neuroquinina-1) ocurren en la CI (9). El factor de crecimiento nervioso (NGF) también aumenta en esta patología, lo que confirma aún más el papel de la inflamación neurogénica en la CI.
Activación de mastocitos
Los mastocitos contienen mediadores vasoactivos e inflamatorios (Histamina, leucotrienos, prostaglandinas y triptasas) y desempeñan un papel central en la patogénesis de afecciones neuroinflamatorias, incluida la CI. La liberación de los gránulos en el intersticio se produce como parte de una reacción de hipersensibilidad mediada por inmunoglobulina E o en respuesta a la sustancia P, citocinas, toxinas bacterianas, alérgenos, toxinas y estrés. La mastocitosis ocurre en 30% a 65% de los pacientes con CI. Los niveles aumentados de histamina, metabolitos de histamina y triptasa ocurren en pacientes con CI. La respuesta terapéutica al tratamiento con antihistamínicos (Hidroxicina) e inhibidores de leucotrienos habla del papel de los mastocitos en la patogénesis de CI (18-19).
Autoinmunidad e infección
CI tiene muchas características de una enfermedad autoinmune: cronicidad, exacerbaciones y remisiones, respuesta clínica a esteroides / inmunosupresores, la alta prevalencia de anticuerpos antinucleares y asociación con otros síndromes autoinmunes. La evidencia actual sugiere que los fenómenos autoinmunes (anticuerpos de la vejiga) son fenómenos secundarios que ocurren como resultado del daño celular local de la vejiga. Los cultivos en pacientes con CI son rutinariamente negativos, y los estudios de reacción en cadena de la polimerasa (PCR) no han identificado consistentemente material genético bacteriano en CI (13). Sin embargo, un episodio de cistitis bacteriana puede causar disfunción de la vejiga que resulta en alteraciones en la permeabilidad de la vejiga, regulación positiva neurogénica (purinérgico, aferente, etc.) reclutamiento y activación de mastocitos(23-24).
Diagnóstico
- Historia clínica
La presentación característica de CI incluye la combinación de dolor, frecuencia, nicturia y urgencia. La aparición de los síntomas puede ser gradual o con un síntoma miccional único; sin embargo, el dolor pélvico es la principal característica clínica. Los síntomas de CI generalmente empeoran unos días antes de la menstruación, en contraste con la endometriosis, que se asocia a más intensidad de las molestias durante los días de la menstruación. Los pacientes pueden describir «brotes» o períodos de empeoramiento sintomático, que pueden ser provocados por el estrés, coito, menstruación o dieta. Los desencadenantes comunes incluyen café, alcohol, cítricos, tomates, bebidas gaseosas, y comidas picantes. La polaquiuria puede llevar a confusión con el diagnóstico de vejiga hiperactiva (VH). Una buena respuesta a los antimuscarínicos sugieren VH; sin embargo, los trastornos pueden coexistir. Es importante obtener una anmanesis completa, incluyendo cirugía pélvica pasada o radiación, medicamentos que pueden causar cistitis (Aines, ciclofosfamida y ketamina), fibromialgia, depresión, disfunción sexual, patologías autoinmunes, alergias y otras afecciones ginecológicas (vulvodinia, endometriosis, dispareunia) (25-28).
- Examen físico (OBLIGATORIO, todos los pacientes)
El examen físico debe incluir palpación de musculatura abdominal y pélvica, examen genital y neurológico básico (reflejo anal). Buscando puntos de gatillo doloroso, sectores de contractura muscular.
- Ultrasonido / imagen pélvica (OPCIONAL, pacientes seleccionados)
Ecografía abdominal y pélvica debe ser realizada de rutina en pacientes con micro o macrohematuria. La CI no se asocia a alteración imagenológica evidente, pero, por ser un diagnóstico de descarte, es importante tener imágenes pélvicas que permitan descartar otras patologías como por ejemplo, tumores vesicales, divertículos y otros. Además, la ecografía pélvica permite medir el volumen pre y postmiccional, lo que sirve como apoyo para evaluar la capacidad vesical y dirigir el estudio hacia otras patologías funcionales o anatómicas en caso de presentar residuo elevado.
- Cartilla miccional (RECOMENDADO a todos los pacientes)
Clásicamente se describe polaquiuria con volúmenes miccionales menores de 100 cc. La cartilla miccional también ayuda a determinar la gravedad de lasíntomas de almacenamiento y pueden usarse para refuerzo positivo relacionada con la intervención conductual y farmacológica. - Pruebas de laboratorio: análisis de orina, cultivo (RECOMENDADO a todos los pacientes)
Si se identifican signos de infección del tracto urinario, se requiere un cultivo y sensibilidad y posiblemente pruebas para detectar Chlamydia trachomatis, Mycoplasma, Ureaplasma. En caso de piuria estéril sospechar infección por Corynebacterium, Candida, Mycoplasma o tuberculosis. - Cuestionarios de síntomas (RECOMENDADO, todos los pacientes)
Ninguna de las encuestas tiene suficiente especificidad para servir como un único indicador de diagnóstico, sino que pueden usarse como herramientas para ayudar con el diagnóstico. Basado en la literatura actual, el uso del índice de síntomas de cistitis intersticial (ICSI), ICPI (o su versión actualizada, el BPIC-SS) y / o el puntaje PUF ayudan a calificar la severidad de los síntomas y al seguimiento de la respuesta terapéutica. - Cistoscopia (RECOMENDADA, todos los pacientes)
La evidencia muestra que las glomerulaciones no son sensibles ni específicas para CI. El propósito de la cistoscopia debe ser visto como una herramienta para descartar cáncer de vejiga / carcinoma in situ, para identificar úlceras de Hunner que reflejan una enfermedad grave o incluso una enfermedad diferente (información que puede afectar decisiones de tratamiento), para determinar el efecto sobre el dolor pélvico del llenado y vaciado de la vejiga, para evaluar objetivamente capacidad vesical «funcional». - Hidrodistensión (OPCIONAL, pacientes seleccionados)
La hidrodistensión (HD) bajo anestesia general permite estratificación de pacientes en aquellos con enfermedad más clásica asociado con úlceras y glomerulaciones de aquellos sin anomalías evidentes de la mucosa. La técnica de diagnóstico de HD generalmente implica el llenado por gravedad de la vejiga en 70‒100 cmH20 por un mínimo de dos minutos, realizado bajo anestesia general o regional.
Tratamiento
Los objetivos de la terapia deben ser realistas y mutuamente acordados entre el médico y el paciente. Se debe privilegiar la mejoría en la calidad de vida y el control sintomático poniendo atención a los efectos adversos de los distintos tratamientos (ver imagen N°1).
- Educación del paciente (RECOMENDADA en todos los pacientes) y Modificaciones dietéticas (RECOMENDADO en todos los pacientes)
Basado en el mejor nivel de evidencia disponible, el manejo inicial debería centrarse en estrategias conservadoras. Éstas incluyen: educación del paciente, cambios en la dieta y estilo de vida, y entrenamiento vesical para todos los pacientes. Se ha reportado mejoría sintomática significativa en cerca del 50% de los pacientes solo con consejos y apoyo. Modificaciones dietéticas, como una ingesta constante de agua para diluir la orina y reducir el estreñimiento. instruir a los pacientes para evitar alimentos irritantes por un período y luego reintroducir metódicamente uno a la vez, a fin de identificar posibles gatillantes.
- Entrenamiento vesical (RECOMENDADO en pacientes motivados)
El entrenamiento de la vejiga se puede iniciar con otras intervenciones de estilo de vida. El objetivo es reducir la frecuencia miccional, potencialmente aumentar la capacidad de la vejiga y reducir la necesidad de vaciar en respuesta a urgencia o dolor. Con la estrategia de supresión de la necesidad, los pacientes reciben instrucciones de retrasar la micción gradualmente aumentando el intervalo de cuando se siente la necesidad de cuando en realidad requiere vaciar la vejiga. Se han usado esquemas de distracción conductual y técnicas de relajación con reportes de resultados en pacientes muy motivados.
- Técnicas de manejo del estrés y apoyo psicológico (RECOMENDADO en pacientes identificados con estrés o disfunción psicológica)
Debido a su naturaleza crónica, el impacto psicológico de la CI en la calidad de vida del paciente debe ser específicamente abordado como parte integral del tratamiento. Un significativo porcentaje de pacientes CI relata historia de depresión, ansiedad, angustia y varios grados de discapacidad. La relación médico-paciente debe ser tener como eje el apoyo emocional y la contención. Deben recomendarse actividades que ayuden a disminuir el estrés como actividad física regular, yoga, etc.
- Técnicas de fisioterapia:
- Fisioterapia y masaje (RECOMENDADO para pacientes con disfunción de piso pélvico): Aquellos pacientes que tienen sensibilidad en el examen físico podría beneficiarse de varias terapias físicas técnicas, que incluyen: fisioterapia (± biofeedback); liberación miofascial de puntos sensibles o masaje intravaginal.
- Acupuntura (OPCIÓN en pacientes motivados): Sigue siendo una modalidad relativamente no invasiva eso podría usarse como un complemento de la medicina alopática.
- Inyecciones en el punto gatillo (OPCIÓN para pacientes con dolor en el punto gatillo): Inyecciones de puntos gatillo del suelo pélvico utilizando agujas 22 o 25 G con 1‒5 ml de anestésico local, con o sin glucocorticoides, también se ha descrito, pero solo evidencia anecdótica sugiere que puede ser eficaz en el tratamiento.
- Terapias médicas
Los dos únicos tratamientos aprobados oficialmente por Health Canadá y por la FDA para CI son pentosan polisulfato y dimetilsulfóxido intravesical (DMSO).
- Terapias orales: Tanto en las guías clínicas de AUA, EAU y de asociación canadiense, las distintas terapias farmacológicas no logran tener evidencia superior a nivel C salvo Amitriptilina, Cimetidina y Pentosan polisulfato.
- Terapia intravesical: Como terapia intravesical se indica: DMSO (dimetilsulfoxido) (evidencia C), heparina (evidencia C) o lidocaína (evidencia B).
- Tratamientos mínimamente invasivos: Dentro de las alternativas quirúrgicas está recomendada la cistoscopia con hidrodistensión bajo anestesia (evidencia C). Si se evidencian úlceras de Hunner, se debe realizar fulguración. En caso de refractariedad se puede ofrecer inyección de toxina botulinica intradetrusor, siendo fundamental la información sobre la potencialidad de requerimiento de autocateterismo en caso de hipoactividad del detrusor marcada. Otro tratamiento posible es la implantación de un dispositivo de neuroestimulación sacra.
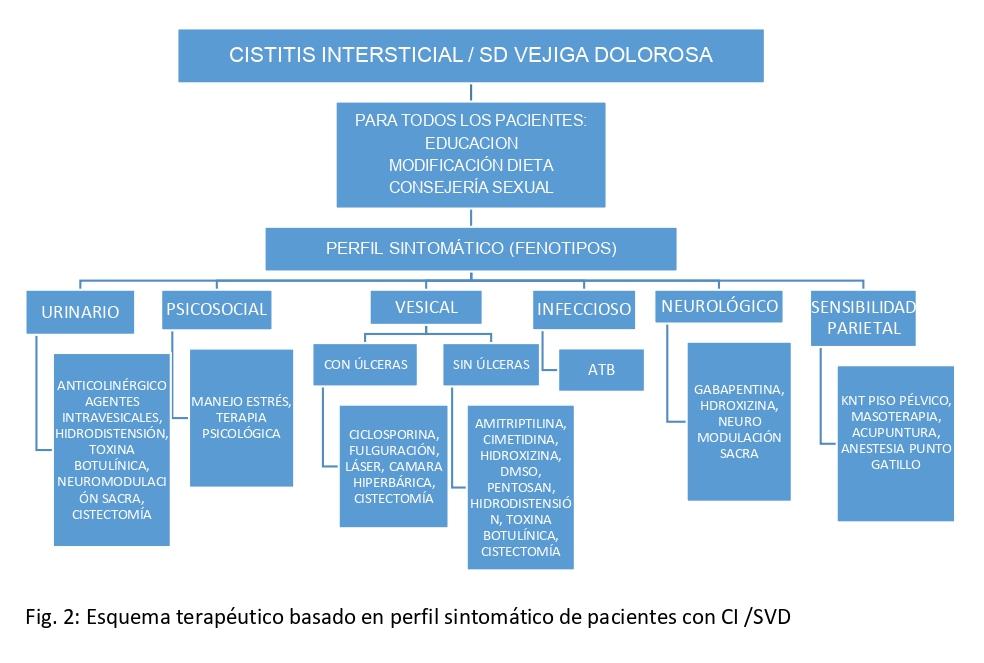
Fig. 1 Esquema terapeútico basado en perfil sintomático de pacientes con CI/SVD
PROSTATITIS
La prostatitis aguda se presenta típicamente como una infección severa del tracto urinario inferior, acompañada de síntomas irritativos y obstructivos, junto a manifestaciones sistémicas de respuesta inflamatoria. Esta entidad suele responder rápidamente al tratamiento antimicrobiano apropiado y, en la mayoría de los casos, es autolimitada. En contraste, la prostatitis crónica bacteriana se caracteriza por dolor pélvico de intensidad leve a moderada, asociado a episodios recurrentes de infecciones urinarias agudas. El tratamiento antimicrobiano prolongado logra la curación en aproximadamente un 60% a 80% de los casos. Sin embargo, la mayoría de los pacientes diagnosticados con “prostatitis crónica” presentan en realidad el síndrome de prostatitis crónica/dolor pélvico crónico (PC/DPC), el cual se caracteriza por dolor persistente en la región perineal, suprapúbica, testicular o peneana, acompañado de síntomas urinarios variables y disfunción sexual, particularmente dolor durante la eyaculación(29-33).
Definición y diagnóstico
La prostatitis describe una combinación de enfermedades infecciosas (prostatitis bacteriana aguda y crónica), PC/DPC o prostatitis asintomática. La clasificación NIH de los síndromes de prostatitis incluye(22-27):
- Categoría I: Prostatitis bacteriana aguda que se asocia con síntomas graves de prostatitis, infección sistémica e ITU bacteriana aguda.
- Categoría II: Prostatitis bacteriana crónica que es causada por una infección bacteriana crónica de la próstata con o sin síntomas de prostatitis y generalmente con infecciones urinarias recurrentes por la misma cepa bacteriana.
- Categoría III: Prostatitis crónica / síndrome de dolor pélvico crónico que se caracteriza por síntomas de dolor pélvico crónico y posiblemente síntomas de anulación en ausencia de ITU.
- Categoría IV: Prostatitis inflamatoria asintomática que se caracteriza por inflamación de la próstata en ausencia de síntomas del tracto genitourinario.
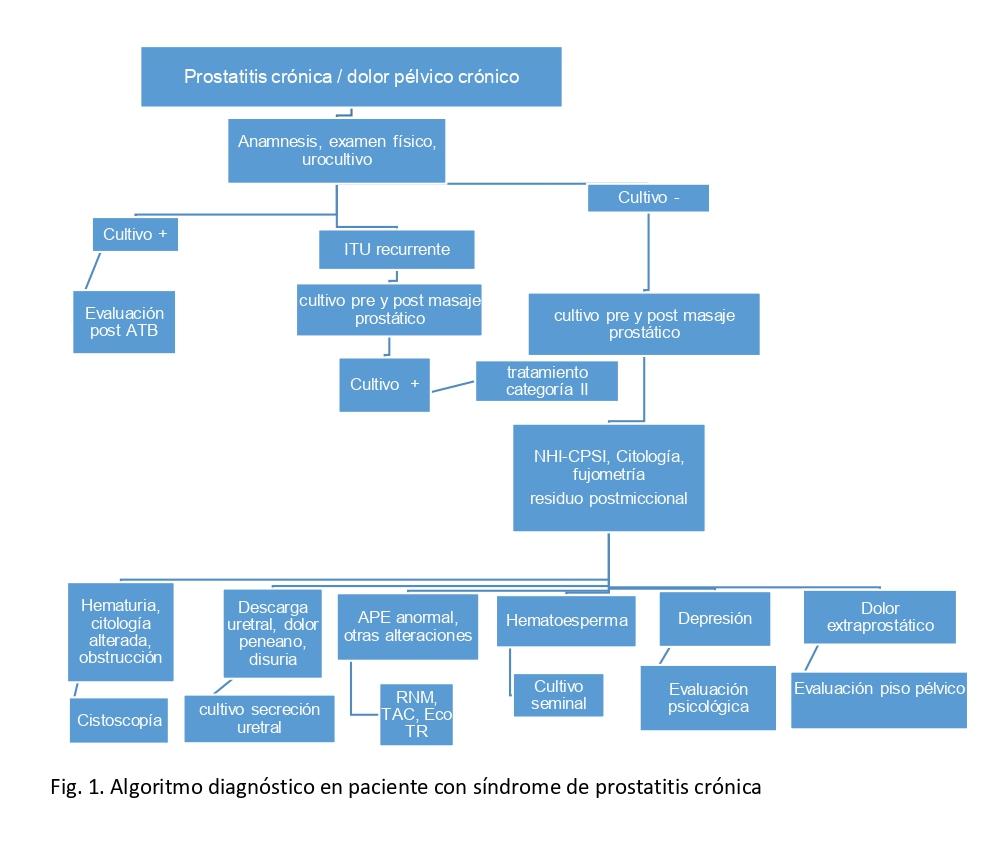
Fig. 2 Esquema algoritmo del diagnóstico en Prostatitis.
Prostatitis bacteriana aguda (NIH categoría I)
Examen físico (Obligatorio): abdomen, genitales externos, periné y la próstata debe ser examinada. No se recomienda realizar masaje prostático. Examen de orina y cultivo son obligatorios. En caso de evolución refractaria se sugiere el TAC de abdomen y pelvis con contraste para descartar absceso prostático. La realización de Antígeno prostático no es recomendado en las distintas guías clínicas básicamente por la confusión que podría generar su valor elevado.
Prostatitis bacteriana crónica (NIH categoría II)
El examen físico (obligatorio) debe incluir el examen del abdomen, los genitales externos, el periné, la próstata y el suelo pélvico. La prueba diagnóstica ideal es la pruebas de 4 vasos (micción inicial, micción “media” premasaje prostático, secreción uretral al momento del masaje prostático y micción post masaje), sin embargo debido a lo engorroso de su realización puede simplificarse a 2 muestras de orina (pre y post masaje prostático). No se recomienda el cultivo de semen ni ecotomografía.
Prostatitis crónica / síndrome de dolor pélvico crónico (NIH categoría IIIA, IIIB)
Cuestionario de puntuación de síntomas: el NIH-CPSI se ha convertido en el estándar internacional establecido para la evaluación de síntomas (no para diagnóstico) de prostatitis(34). El índice ha mostrado ser confiable al evaluar gravedad de los síntomas puede ser utilizado en seguimiento. El tacto rectal demuestra la reproducción del dolor al comprimir la próstata, además se deben evaluar eventuales puntos de gatillo doloroso en periné. También es recomendado los urocultivos pre y post masaje prostático.
Prostatitis asintomática (NIH categoría IV)
En este momento no hay evidencia de que la determinación de prostatitis asintomática tenga alguna relevancia clínica.
Tratamiento
- Prostatitis bacteriana aguda (NIH categoría I)
La determinación del tratamiento se debe ajustar a la condición clínica del paciente, antecedentes mórbidos, función renal, tolerancia oral, estado de hidratación , etc. Los esquemas más habituales incluyen: cefalosporina de tercera generación o una fluoroquinolona o aminoglucósidos parenterales hasta normalización de la urosepsis asociada. Pacientes que no presenten signos de gravedad y que tengan buena tolerancia oral pueden recibir desde el inicio fluoroquinolona oral por 2 a 4 semanas. Debe evaluarse en forma dirigida el vaciamiento vesical, el que puede apoyarse con uso de bloqueadores alfa adrenérgicos, y en caso de retención o síntomas muy intensos debe instalarse sonda Foley. En caso de evolución refractaria y evidencias de absceso prostático debe realizarse drenaje mediante resección transuretral(35,36).
- Prostatitis bacteriana crónica (NIH categoría II)
Por su farmacocinética única y favorable, las fluoroquinolonas son los agentes recomendados de elección para el tratamiento antimicrobiano de la prostatitis bacteriana crónica. La duración recomendada de 4 a 6 semanas de tratamiento antimicrobiano está basado en la experiencia y la opinión de expertos y es apoyado por muchos estudios clínicos. En caso de germen resistena a fluoroquinolonas puede usarse trimetoprima-sulfametoxazol (u otros antimicrobianos), pero la duración del tratamiento debe ser de 8 a 12 semanas.También se recomienda asociar alfa bloqueadores para manejo de síntomas obstructivos.
Para el tratamiento de pacientes refractarios con uropatógeno confirmado localizado en la próstata, los siguientes son opciones terapéuticas(36-40):
- Tratamiento antimicrobiano intermitente de episodios sintomáticos agudos (cistitis)
- Supresión antimicrobiana en dosis bajas
- Resección prostática si todas las demás opciones han fallado.
- Prostatitis crónica / síndrome de dolor pélvico crónico (NIH categoría III)
- Antimicrobianos: Tendría un rol en pacientes sin antecedentes de uso de antibióticos previos. El recurrir nuevamente a tratamiento antimicrobiano no es recomendado en pacientes con para hombres con PC/DPC de larga duración previamente tratado.
Alfabloqueadores: La terapia alfabloqueadora parece proporcionar beneficio en un algoritmo terapéutico multimodal para hombres con síntomas miccionales. Los alfabloqueantes deben continuar por más de 6 semanas (probablemente más de 12 semanas).
- Antiinflamatorios: La terapia antiinflamatoria es útil para algunos pacientes, pero no se recomienda como tratamiento primario. Puede usarse como manejo adicional.
Fitoterapia: Específicamente quercetina y el extracto de polen son recomendaciones opcionales para la primera línea.
- Otras terapias médicas: Los inhibidores de la 5-alfa-reductasa, pentosanpolisulfato y pregabalina pueden proporcionar beneficio en pacientes seleccionados (hombres mayores con STUI para 5-AR terapia; hombres con dolor asociado a vejiga síntomas miccionales irritantes para el pentosanpolisulfato y dolor de tipo neuropático para pregabalina).
- Fisioterapia: Aún falta más evidencia sistemática para realizar recomendaciones específicas.
- Psicoterapia: Se ha recomendado el apoyo psicológico basado en el nuevo modelo psicosocial de este síndrome. Derivación a psicólogo o psiquiatra es obligatorio en pacientes con síntomas depresivos.
- Cirugía: No constituye alternativa de tratamiento estandarizada ni recomendada con la evidencia actual
- Terapia Multimodal (UPOINT): Basado en el hecho de que las monoterapias proporcionan (en el mejor de los casos) una eficacia modesta, el enfoque multimodal que utiliza los fenotipos clínicos específicos para elegir terapias se considera una recomendación opcional.
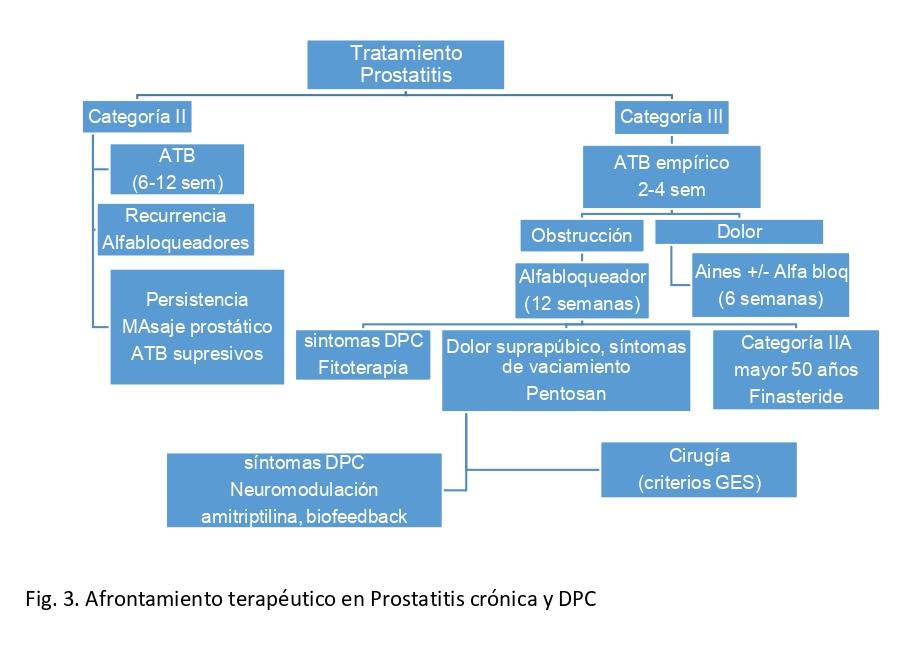
Fig 3 Esquema resume del tratamiento de Prostatitis
Bibliografía
- Ahangari A. Prevalence of chronic pelvic pain among women: an updated review. Pain Physician. 2014;17(2):E141–147.
- Reavey J, Vicente K. Chronic pelvic pain: an overview of causes and approaches to investigation and management. Obstet Gynaecol Reprod Med. 2021;31(5):211–215.
- EAU Guidelines. EAU Guidelines on Chronic Pelvic Pain. Presented at the EAU Annual Congress, Amsterdam 2022. Arnhem, The Netherlands: EAU Guidelines Office; 2022. ISBN 978‑94‑92671‑16‑5
- BMJ Best Practice. Chronic pelvic pain in women – symptoms, diagnosis and treatment. BMJ Best Practice. London: BMJ Publishing Group; 2024.
- Engeler DS, et al. EAU Guidelines on Chronic Pelvic Pain 2024. European Urology. 2024;85:183-210.
- Origoni M, Leone Roberti Maggiore U, Salvatore S, Candiani M. Neurobiological mechanisms of pelvic pain. Biomed Res Int. 2014;2014:903848. doi: 10.1155/2014/903848. Epub 2014 Jul 8. PMID: 25110704; PMCID: PMC4119661.
- Brooks T, Sharp R, Evans S, Baranoff J, Esterman A. Psychological Interventions for Women with Persistent Pelvic Pain: A Survey of Mental Health Clinicians. J Multidiscip Healthc. 2021 Jul 7;14:1725-1740. doi: 10.2147/JMDH.S313109. PMID: 34262286; PMCID: PMC8275108.
- International Pelvic Pain Society. Home. Burnsville, MN: IPPS; 2025. Disponíble en: https://www.pelvicpain.org/
- Engeler, D.S., et al. The 2013 EAU guidelines on chronic pelvic pain: is management of chronic pelvic pain a habit, a philosophy, or a science? 10 years of development. Eur Urol, 2013. 64: 431.
- Castro Carranza C. Dolor Pélvico Crónico en Ginecología: actualización en fisiopatología, causas, diagnóstico y tratamiento. Revista Electrónica de PortalesMedicos.com. 2023 Ago 29; Vol XVIII(16):907.
- Itza F., Zarza D., Serra L., Gómez-Sancha F., Salinas J., Allona-Almagro A.. Síndrome de dolor miofascial del suelo pélvico: una patología urológica muy frecuente. Actas Urol Esp [Internet]. 2010 Abr [citado 2025 Jun 18] ; 34( 4 ): 318-326.
- Allaire, C., et al., History-taking, physical examination and psychological assessment. In: Consensus guidelines for the management of chronic pelvic pain., Jarrell JF, Vilos GJ (editors). J Obstet Gynaecol Can. 2005. p. 869.
- González I, Valdevenito A, Aroca S. Capítulo 18 – Dolor pélvico crónico. En: Manual de Urología. 2ª ed. Sociedad Chilena de Urología; 2020.
- Fuentes Porras, Juan Sebastian, & Sepúlveda Agudelo, Janer. (2014). Abordaje integral del dolor pélvico crónico: revisión de la literatura. Revista chilena de obstetricia y ginecología, 79(4), 330-339.
- Wagner B, Steiner M, Huber DFX, Crevenna R. The effect of biofeedback interventions on pain, overall symptoms, quality of life and physiological parameters in patients with pelvic pain : A systematic review. Wien Klin Wochenschr. 2022 Jan;134(Suppl 1):11-48. doi: 10.1007/s00508-021-01827-w. Epub 2021 Mar 22. PMID: 33751183; PMCID: PMC8825385.
- Panisch LS, Tam LM. The Role of Trauma and Mental Health in the Treatment of Chronic Pelvic Pain: A Systematic Review of the Intervention Literature. Trauma Violence Abuse. 2020 Dec;21(5):1029-1043. doi: 10.1177/1524838018821950. Epub 2019 Jan 1. PMID: 30599814.
- Physio‑pedia. Yoga and mindfulness for pelvic health. Physiopedia; 2020 [citado 2025 Jun 18]. Disponible en: https://www.physio-pedia.com/Yoga_and_mindfulness_for_pelvic_health
- Skvarc D, Furness P, Homer M, et al. Hypnotherapy for chronic pelvic pain: a scoping systematic review. Complementary Therapies in Clinical Practice. 2023;53:101707.
- McLennan MT. Interstitial cystitis: epidemiology, pathophysiology, and clinical presentation. Obstet Gynecol Clin North Am. 2014 Sep;41(3):385-95. doi: 10.1016/j.ogc.2014.05.004. Epub 2014 Jul 9. PMID: 25155120.
- Clemens JQ, Erickson D, Varela NP, Lai HH. Diagnosis and treatment of interstitial cystitis/bladder pain syndrome. Journal of Urology. 2022;208(1):34–42.
- Pathophysiology of interstitial cystitis/bladder pain syndrome. Neurourology and Urodynamics. 2015;34(8):p139-144
- Lim Y, Leslie SW, O’Rourke S. Interstitial Cystitis/Bladder Pain Syndrome. [Updated 2024 Oct 7]. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2025 Jan-.
- Konkle KS, Berry SH, Elliott MN, et al. Comparison of an interstitial cystitis/bladder pain syndrome clinical cohort with symptomatic community women from the RAND Interstitial Cystitis Epidemiology study. J Urol 2012;187:508-12. http://dx.doi.org/10.1016/j.juro.2011.10.040
- Bassaly R, Downes K, Hart S. Dietary consumption triggers in interstitial cystitis/bladder pain syndrome patients. Female Pelvic Med Reconstr Surg 2011;17:36-9. http://dx.doi.org/10.1097/ SPV.0b013e3182044b5c
- Allaire, C., et al., History-taking, physical examination and psychological assessment. In: Consensus guidelines for the management of chronic pelvic pain., Jarrell JF, Vilos GJ (editors). J Obstet Gynaecol Can. 2005. p. 869.
- Burkman, R.T. Chronic pelvic pain of bladder origin: epidemiology, pathogenesis and quality of life. J Reprod Med, 2004. 49: 225. https://www.ncbi.nlm.nih.gov/pubmed/15088860
- Martin, C.E., et al. Catastrophizing: A predictor of persistent pain among women with endometriosis at 1 year. Human Reprod, 2011. 26: 3078. https://www.ncbi.nlm.nih.gov/pubmed/21900393
- Hanno P, Lin A, Nordling J, et al. Bladder Pain Syndrome Committee of the International Consultation on Incontinence. Neurourol Urodyn 2010;29:191-8. http://dx.doi.org/10.1002/nau.20847
- Anothaisintawee T, Attia J, Nickel JC, et al. The Management of Chronic Prostatitis/Chronic Pelvic Pain Syndrome: A systematic review and network meta-analysis. JAMA 2011;305:78-86.
- Nickel JC, Teichman JM, Gregoire M, et al. Prevalence, diagnosis, characterization, and treatment of prostatitis, interstitial cystitis and epididymitis in outpatient urologic practice: The Canadian PIE Study. Urology 2005;66:935-40.
- Nickel JC. Clinical evaluation of the man with chronic prostatitis/chronic pelvic pain syndrome. Urology 2003;60(Suppl 6A):20-3.
- Nickel JC, Narayan P, McKay J, et al. Treatment of chronic prostatitis/chronic pelvic pain syndrome with tamsulosin: A randomized double blind trial. J Urol 2004;171:1594-7.
- Nickel JC, Mullins C, Tripp DA. Development of an evidence-based cognitive behavioural treatment program for men with chronic prostatitis/chronic pelvic pain syndrome. World J Urol 2008;26:167-72.
- Litwin M, McNaughton‑Collins M, Fowler FJ Jr, et al. NIH Chronic Prostatitis Symptom Index (CPSI) en español. [Internet]. Disponible en: http://www.laprp.com/pdf/CPSI_en_espanol.pdf
- Pontari MA, Krieger JN, Litwin MS, et al. Pregabalin for the Treatment of Men With Chronic Prostatitis/ Chronic Pelvic Pain Syndrome: A Randomized Controlled Trial. Arch Intern Med 2010;170:1586-93.
- Nickel JC, Downey J, Ardern, D, et al. Failure of a monotherapy strategy for difficult chronic prostatitis/chronic pelvic pain syndrome. J Urol 2004;172:551-4.
- Shoskes D, Katz E. Multimodal therapy for chronic prostatitis/chronic pelvic pain syndrome. Curr Urol Rep 2005;6:296-9.
- Nickel JC: Prostatitis, CUA Guideline: Can Urol Assoc J 2011;5(5):306-15;. DOI:10.5489/cuaj.11211.
- Nickel JC, Shoskes D. Phenotypic Approach to the management of the Chronic Prostatitis/Chronic Pelvic Pain Syndrome. BJU Int 2010;106:1252-63.
- Shoskes DA, Nickel JC, Kattan M. Phenotypically Directed Multimodal Therapy for Chronic Prostatitis/Chronic Pelvic Pain Syndrome: A Prospective Study Using UPOINT. Urology 2010;75:1249-53.

