Introducción
La incontinencia urinaria (IU) se define como cualquier pérdida involuntaria de orina, constituyendo tanto un síntoma referido por la paciente como un signo clínico observable por el examinador¹. Se trata de un problema de salud frecuente en la mujer que impacta negativamente en la calidad de vida, afectando la autoestima, las relaciones sociales y el desempeño laboral. Además, genera un costo económico significativo en gastos de higiene, tratamientos y ausentismo laboral. La prevalencia de IU femenina varía ampliamente según la definición utilizada y la población evaluada. Estudios epidemiológicos reportan que aproximadamente una de cada tres mujeres presenta algún grado de incontinencia, con rangos entre un 10% y 40% en distintas series² ³. La incidencia anual de nuevos casos se ha estimado entre 2% y 11%. Estas cifras tienden a aumentar con la edad de la mujer, especialmente en presencia de factores de riesgo como la obesidad y el tabaquismo³.
Según la International Continence Society (ICS), los principales tipos clínicos de incontinencia urinaria son: incontinencia de esfuerzo, de urgencia y mixta. La incontinencia urinaria de esfuerzo (IUE) se define como la pérdida involuntaria de orina asociada a algún esfuerzo físico (por ejemplo, ejercicio, levantar peso) o a actos reflejos como la tos o el estornudo¹. En inglés se denomina stress urinary incontinence, habiéndose propuesto en la terminología reciente llamarla “incontinencia relacionada con la actividad” para evitar la confusión del término “estrés” con estrés psicológico¹. La incontinencia urinaria de urgencia (IUU), por su parte, es la pérdida involuntaria de orina acompañada por una urgencia miccional súbita e imperiosa¹. Cuando una paciente presenta ambos componentes, es decir, escape con esfuerzos y también asociado a urgencia, se habla de incontinencia urinaria mixta (IUM)¹.
Además de estos tres síndromes principales, la ICS reconoce otras variantes de incontinencia menos comunes. Entre ellas se cuentan la incontinencia urinaria continua o permanente, definida como una pérdida ininterrumpida de orina usualmente debida a fístulas u otras comunicaciones anómalas¹; la incontinencia insensible (de reciente incorporación), en la cual la paciente presenta escapes de orina sin percatarse de ello¹; la incontinencia coital, que ocurre durante el coito (ya sea durante la penetración o en el momento del orgasmo)¹; y la incontinencia urinaria asociada a discapacidad, que describe la pérdida involuntaria de orina en pacientes con limitaciones físicas o cognitivas que impiden llegar a tiempo al baño o manejar adecuadamente el acto miccional, a pesar de que el tracto urinario inferior pueda estar estructuralmente normal².
En la práctica clínica, cuando una paciente no encaja claramente en los subtipos clásicos (por ejemplo, refiere pérdidas no relacionadas a urgencia ni a esfuerzos evidentes), puede requerirse un estudio más exhaustivo para determinar la causa de su incontinencia. Históricamente se ha utilizado el término “incontinencia urinaria atípica” para estos casos de difícil caracterización, enfatizando la necesidad de investigación, usualmente urodinámica y/o imagenológica adicional para esclarecer su etiología.
La IU femenina constituye no sólo un desafío médico, sino también social e higiénico, dadas sus repercusiones en la salud psicológica y física de la mujer. La vergüenza, la ansiedad anticipatoria y la necesidad de planificar constantemente el acceso a baños son experiencias comunes en quienes la padecen. En mujeres adultas mayores, la incontinencia se asocia incluso a mayor riesgo de caídas y fracturas, debido a las prisas e inseguridad para llegar al baño a tiempo⁴. Todo lo anterior subraya la importancia de un diagnóstico y manejo oportuno de esta condición, la cual afortunadamente cuenta con múltiples alternativas terapéuticas efectivas.
Síndrome de Vejiga Hiperactiva (Incontinencia urinaria de urgencia – IUU)
El síndrome de vejiga hiperactiva (SVH) se define por la presencia de urgencia miccional, generalmente acompañada de aumento de la frecuencia miccional diurna y nocturna (polaquiuria y nocturia), con o sin incontinencia urinaria de urgencia⁵. Cuando la urgencia se acompaña de escapes involuntarios se habla de “vejiga hiperactiva húmeda”, y si no hay escapes es una “vejiga hiperactiva seca”. La urgencia miccional en sí se describe como un deseo de orinar repentino, intenso y difícil de posponer. Es fundamental recordar que el diagnóstico de SVH es clínico y de exclusión: antes de establecerlo se deben descartar causas frecuentes de síntomas irritativos del tracto urinario inferior, como infección urinaria, y algunas menos prevalentes, según antecedentes clínicos, como litiasis, tumores vesicales o patologías neurológicas centrales/periféricas que puedan ocasionar hiperactividad del detrusor. En toda paciente con síntomas de urgencia se debe pesquisar la presencia de hematuria o dolor vesical; de estar presentes, no corresponden a SVH idiopático y requieren un estudio específico (p. ej., cistoscopia, estudios por imagen).
El SVH afecta a un porcentaje importante de mujeres y su prevalencia tiende a incrementarse con la edad. Estudios poblacionales han reportado prevalencias de síntomas de vejiga hiperactiva en un rango muy amplio (9% a 43% en distintas series), dependiendo de los criterios utilizados. La verdadera prevalencia es difícil de precisar debido a diferencias en la definición entre estudios, pero se estima en alrededor de un 12–17% en la población femenina general, aumentando en grupos etarios mayores. Notablemente, aunque hombres y mujeres pueden sufrir SVH con frecuencia similar, la incontinencia de urgencia como tal, es decir con escape de orina asociado, es marcadamente más común en mujeres⁴. Las pacientes con SVH a menudo experimentan un deterioro importante de su calidad de vida: pueden restringir sus actividades por miedo a pérdidas, presentar trastornos del sueño por la nocturia, depresión y aislamiento social. En mujeres mayores, el SVH se ha asociado a mayor riesgo de caídas nocturnas y fracturas, particularmente cuando hay urgencia con incontinencia⁵.
Fisiopatología del SVH
La fisiopatología de la vejiga hiperactiva idiopática (no neurogénica) es compleja y multifactorial, permaneciendo aún no del todo dilucidada. Clásicamente se han propuesto teorías miogénicas y neurogénicas para explicar las contracciones involuntarias del detrusor. En el aspecto miogénico, destaca la hipótesis de Alison Brading (1997), quien postuló que debe existir una alteración en las propiedades del músculo detrusor que permita la propagación de una contracción involuntaria. Estudios posteriores mostraron que las micciones con presiones vesicales elevadas pueden inducir isquemia transitoria del detrusor; con el tiempo, esto dañaría neuronas intramurales y fibras musculares, aumentando la excitabilidad y el acoplamiento eléctrico entre miocitos. Como resultado, una contracción espontánea focal podría difundirse y generar una contracción involuntaria de toda la vejiga. Asimismo, se ha observado que la denervación parcial del detrusor produce hipersensibilidad a los neurotransmisores liberados, facilitando respuestas exageradas a estímulos mínimos⁶.
Por otro lado, la teoría neurogénica propone que alteraciones en los mecanismos nerviosos de control provocan la desinhibición de los reflejos miccionales primitivos. Lesiones a nivel del sistema nervioso central (por daño en los centros inhibitorios suprapontinos) o de la médula espinal (afectando las vías inhibitorias descendentes) pueden resultar en hiperactividad vesical por pérdida de control inhibitorio o por liberación de reflejos espinales arcaicos. No obstante, muchas pacientes con SVH idiopático no presentan lesiones neurológicas evidentes; se cree que podrían tener una sensibilización de las aferencias vesicales (fibras C) que desencadena contracciones reflejas anómalas⁷.
Un ámbito de investigación reciente es el rol del urotelio vesical y del urotrasmisor. Se ha descubierto que el epitelio vesical no es solo una barrera pasiva, sino que actúa liberando neurotransmisores (ATP, acetilcolina, óxido nítrico, entre otros) que pueden modular la actividad de las fibras nerviosas aferentes. Alteraciones en la función urotelial podrían contribuir a la hiperexcitabilidad del reflejo miccional. También se ha explorado la influencia de la microbiota urinaria en estos trastornos: estudios recientes muestran que las mujeres con vejiga hiperactiva tienden a tener un microbioma urinario menos diverso, con predominio de ciertas cepas (p. ej. Lactobacillus) en comparación con controles sanas⁸. Curiosamente, otros patrones microbiológicos (flora menos dominada por lactobacilos y más heterogénea) se han asociado con incontinencia de urgencia más severa. Estos hallazgos sugieren que desequilibrios sutiles en el ecosistema microbiano vesical podrían influir en la aparición o severidad de síntomas urinarios, si bien este campo aún está en desarrollo⁸.
Los factores hormonales y etarios también modulan la fisiopatología del SVH. En mujeres posmenopáusicas, la deficiencia de estrógenos conlleva cambios atróficos en la mucosa uretral y vesical que pueden exacerbar la urgencia y la incontinencia. De hecho, el síndrome genitourinario de la menopausia (atrofia urogenital) a menudo incluye síntomas irritativos urinarios, los cuales pueden mejorar con terapia estrogénica local. Contrariamente, en mujeres jóvenes los episodios de urgencia idiopática podrían relacionarse más con factores como ansiedad, hiperactividad vesical primaria o hábitos (p. ej., ingesta elevada de cafeína)⁵. En cualquier grupo etario, es fundamental reconocer que el SVH es una entidad heterogénea donde múltiples mecanismos (miogénicos, neurogénicos, uroteliales, hormonales) pueden coincidir, variando de una paciente a otra.
Diagnóstico del SVH
El diagnóstico inicial del síndrome de vejiga hiperactiva es eminentemente clínico. Una anamnesis dirigida debe indagar por los síntomas cardinales: urgencia miccional, frecuencia urinaria aumentada (diurna >8 micciones/día) y nocturia (más de 1 micción/noche), estableciendo si existen o no episodios de incontinencia asociados. La ausencia de urgencia significativa o la presencia de desencadenantes mecánicos claros orientarían más bien a otra etiología (p. ej., incontinencia de esfuerzo o poliuria). Es imprescindible descartar causas secundarias mediante un examen general y de laboratorio básico: un examen de orina con urocultivo debe realizarse para excluir infección urinaria, y según la presentación clínica se considerará glicemia (descartar diabetes insípida o mellitus mal controlada si hay poliuria), evaluación neurológica si hay signos asociados, etc. En pacientes con predominio de urgencia y frecuencia, sin factores de alarma, estos exámenes suelen ser negativos⁹ ¹⁰ ¹¹.
Una herramienta valiosa en la evaluación es el diario miccional o cartilla miccional, en el cual la paciente registra por 2–3 días la hora y volumen de cada micción, episodios de urgencia y pérdidas, y circunstancias asociadas. Este registro objetivo permite cuantificar la frecuencia miccional, la capacidad funcional de la vejiga, la diuresis y los patrones de escapes, siendo de gran utilidad tanto para el diagnóstico inicial como para evaluar la respuesta a tratamientos. Hoy en día existen versiones digitales de los diarios miccionales, mediante aplicaciones móviles sencillas donde la paciente ingresa estos datos y puede incluso programar alarmas o recordatorios. Por ejemplo, aplicaciones como BladderPal o URinControl permiten monitorear la ingesta de líquidos, las micciones y los escapes en tiempo real, generando reportes para el equipo de salud. Estas tecnologías, junto con cuestionarios validados de síntomas (como el ICIQ-OAB o el OAB-q), complementan la valoración clínica clásica.
El examen físico en el contexto de SVH suele ser poco específico, pero no debe omitirse. Debe incluir abdomen (distensión vesical, masas), evaluación perineal y neurológica básica, y examen genital para descartar prolapso significativo, atrofia mucosa o alteraciones neurológicas que sugieran patologías subyacentes. Típicamente, en la vejiga hiperactiva idiopática el examen físico es normal o muestra solo cambios atróficos vaginales en mujeres posmenopáusicas. En cambio, si existiera un prolapso pélvico importante, que protruye más allá del introito con maniobras de Valsalva, o un residuo postmiccional elevado, habría que replantear el diagnóstico (posible obstrucción o vejiga hipoactiva en lugar de SVH puro). La exploración física también debe incluir la evaluación del tono del piso pélvico. Un tono aumentado o la incapacidad de relajar la musculatura durante el examen pueden sugerir una disfunción del vaciado vesical, lo que debe hacer considerar diagnósticos diferenciales como obstrucción funcional o disinergia del esfínter, más que un síndrome de vejiga hiperactiva puro. En estos casos, puede ser útil complementar con estudios de residuo postmiccional, uroflujometría o incluso urodinamia cuando el diagnóstico no es claro⁹ ¹⁰.
Los exámenes complementarios específicos (uroflujometría y/o medición de residuo post miccional, estudio urodinámico, cistoscopía, estudios de imagen) no se requieren de rutina para confirmar SVH, reservándose para escenarios complejos o refractarios. Según las guías, se recomienda realizar estudios urodinámicos cuando el diagnóstico no esté claro, exista falla a tratamientos de primera o segunda línea, se sospeche una combinación de patologías (por ejemplo, incontinencia mixta con componente de disfunción del vaciado), o existan antecedentes quirúrgicos que dificulten la comprensión del cuadro clínico. Estudios no invasivos como la medición de residuo post miccional con o sin uroflujometría, se pueden utilizar como screening inicial para el descarte de una disfunción miccional, en especial cuando se aplicará un tratamiento que podría alterar la función miccional, como los antimuscarínicos y la toxina botulínica. Dentro del estudio urodinámico, la fase cistométrica puede objetivar contracciones involuntarias del detrusor confirmando el diagnóstico fisiopatológico de vejiga hiperactiva, así como los hitos sensitivos y la capacidad cistométrica. El estudio flujo/presión es importante si se sospecha, por clínica, uroflujometría o residuo post miccional elevado, obstrucción o disfunción miccional asociada (p. ej., un SVH acompañado de un vaciado incompleto). En general, en la mujer sin comorbilidades neurológicas, estos estudios pueden evidenciar una capacidad vesical reducida por la urgencia y a veces contracciones involuntarias, pero con vaciado completo y sin anomalías anatómicas.
Cabe enfatizar que ni la urodinamia ni la cistoscopia son necesarias en la mayoría de los casos de vejiga hiperactiva idiopática. El diagnóstico es esencialmente clínico, basado en la tríada de urgencia, frecuencia y nocturia, con o sin incontinencia asociada. Estos estudios se reservan para situaciones en que exista duda diagnóstica, fracaso a terapias iniciales, sospecha de condiciones concomitantes (p. ej., disfunción de vaciado, obstrucción, lesiones anatómicas) o antecedentes quirúrgicos complejos. Aunque la presencia de hiperactividad del detrusor en la fase cistométrica puede objetivar el cuadro, no es un requisito para establecer el diagnóstico de síndrome de vejiga hiperactiva. Esto es relevante en textos de formación médica, ya que la ausencia de contracciones involuntarias en el estudio urodinámico no descarta la entidad clínica⁹ ¹⁰.
Tratamiento del SVH
El manejo de la vejiga hiperactiva se ha abordado clásicamente mediante un enfoque escalonado, comenzando por las terapias menos invasivas y avanzando progresivamente a opciones más complejas. Sin embargo, las guías más recientes de la American Urological Association (AUA) 2024 han cuestionado esta estrategia rígida, proponiendo un modelo de tratamiento flexible y personalizado, que prioriza el proceso de decisión compartida con la paciente como elemento central desde la evaluación inicial (AUA/SUFU, 2024. Statement 9). Este enfoque reconoce que las preferencias, expectativas y calidad de vida de cada paciente pueden justificar el acceso directo a terapias mínimamente invasivas o avanzadas sin la necesidad de agotar previamente las opciones conservadoras o farmacológicas tradicionales⁹.
La AUA sostiene que las pacientes con vejiga hiperactiva pueden ser candidatas a opciones como neuromodulación sacra, estimulación del nervio tibial posterior o inyecciones de toxina botulínica como parte de la estrategia inicial, siempre que se realice bajo un proceso de decisión compartida adecuado, sin que sea obligatorio pasar por tratamientos secuenciales clásicos (AUA/SUFU, 2024. Statements 24 y 25). Este modelo contemporáneo promueve un abordaje individualizado, flexible y centrado en las prioridades de la paciente, reconociendo que el alivio sintomático efectivo puede alcanzarse siguiendo trayectorias terapéuticas diversas.
Medidas conservadoras: Incluyen la educación y modificación de hábitos y la terapia conductual. Se recomienda restringir o fraccionar la ingesta de líquidos (evitando grandes volúmenes de una sola vez), eliminar irritantes vesicales de la dieta (cafeína, alcohol, cítricos, bebidas carbonatadas, picantes) y establecer un programa de micciones regulares (por horario) para reducir episodios de urgencia. La reeducación vesical o entrenamiento para demorar gradualmente la micción ante la urgencia también puede mejorar la capacidad funcional de la vejiga. Asimismo, muchas pacientes con SVH se benefician de ejercicios de kinesioterapia del piso pélvico, que contribuyen a inhibir las contracciones involuntarias mediante la contracción activa voluntaria del esfínter uretral externo ante los deseos miccionales (maniobra de knack). Esta terapia kinésica suele incluir Neuromodulación tibial posterior, que será discutida más adelante. Las guías internacionales (ICS, AUA, EAU) sugieren que las intervenciones conductuales y de fortalecimiento del piso pélvico sean de primera línea en mujeres con incontinencia, dado que logran mejoría sintomática significativa en 50–80% de los casos. La principal limitante de estas terapias es la adherencia a largo plazo: muchas pacientes abandonan las técnicas conductuales o los ejercicios si no ven resultados inmediatos. Para abordar esto, se han desarrollado ayudas tecnológicas como dispositivos de biofeedback y apps de entrenamiento que motivan a seguir las rutinas de ejercicios⁹ ¹².
Estudios actuales muestran que los programas de entrenamiento vesical y de piso pélvico autoguiados mediante aplicaciones móviles pueden mejorar la adherencia y los resultados clínicos a corto plazo (Araujo et al., 2020; Dufour et al., 2019; Goode et al., 2020; Wadensten et al., 2021). Sin embargo, no existe un método eficaz sin una evaluación funcional inicial por una kinesióloga o fisioterapeuta, que emplee palpación vaginal, sensores intravaginales o ecografía para descartar que la paciente realice una maniobra de Valsalva en lugar de una contracción del piso pélvico. De hecho, un estudio mostró que el 78 % de las mujeres que inicialmente contrajeron incorrectamente mejoraron tras una instrucción breve. Además, el uso de biofeedback por ecografía demostró que casi la mitad de las mujeres activaron el elevador del ano al intentar el Valsalva, incluso tras entrenamiento⁹ ¹². Este patrón de reclutamiento incorrecto, conocido como inversión de la orden, es frecuente y cuando ocurre, podría reforzar dinámicas perineales inadecuadas.
Por lo tanto, aunque las aplicaciones móviles pueden ser herramientas útiles para mejorar la adherencia, su implementación debe realizarse siempre después de una valoración funcional presencial adecuada, que garantice que la paciente realiza correctamente las contracciones desde el inicio.
En opinión de los autores, estas herramientas podrían tener un rol muy importante en mejorar la adherencia a las terapias, pero en combinación con una evaluación funcional del piso pélvico que evalúe y descarte, entre otras, condiciones como inversión de la orden, en que la persona realiza una maniobra de Valsalva cuando recibe la instrucción de contraer el piso pélvico.
Terapia farmacológica: Si las medidas conservadoras resultan insuficientes se debe considerar el uso de fármacos antimuscarínicos o beta agonistas. En algunas pacientes ambas terapias, conservadora y farmacológica, se pueden iniciar de forma paralela. Los fármacos antimuscarínicos orales han sido por décadas el pilar del tratamiento farmacológico del SVH. Estos medicamentos (oxibutinina, tolterodina, solifenacina, trospio, imidafenacina entre otros) antagonizan uniéndose con diverso grado de selectividad a los receptores muscarínicos M2 y M3 en el músculo detrusor, reduciendo su contractilidad involuntaria. Tienen tasas de respuesta del orden de 60% en reducción de episodios de incontinencia¹³. Sin embargo, presentan frecuentes efectos adversos que limitan la adherencia: boca seca, constipación, visión borrosa, entre otros, debido al bloqueo de otros subtipos de receptores muscarínicos. Se recomienda preferir formulaciones de liberación prolongada y dosificación única diaria para mejorar la tolerancia y cumplimiento.
Por su parte, los agonistas adrenérgicos β3, cuyo representante principal es mirabegron, no se encuentran disponible en Chile a la fecha de la publicación de este manual. Estos relajan el músculo detrusor a través de la estimulación de los receptores beta3, aumentando la capacidad vesical sin causar los efectos anticolinérgicos clásicos. Mirabegrón ha mostrado eficacia comparable a antimuscarínicos con menor incidencia de eventos adversos. Un agente más reciente de esta clase es vibegrón, aprobado en 2020, que ofrece un perfil farmacológico similar. Estudios sugieren que vibegrón tiene eficacia sostenida en mujeres tanto menores como mayores de 65 años, con mínima influencia en parámetros cardiovasculares¹⁰ ¹⁴. Cabe mencionar que la combinación de un β3-agonista con un antimuscarínico es una estrategia posible en casos refractarios a monoterapia, obteniendo mejora adicional modesta a costa de una suma de efectos adversos (estrategia que debe individualizarse cuidadosamente).
Un problema común en la terapia farmacológica del SVH es la discontinuación del tratamiento a mediano plazo. Estudios muestran que un porcentaje significativo de mujeres abandona los antimuscarínicos antes de 1 año, ya sea por efectos secundarios o percepción de beneficio insuficiente. En estos casos, es importante reforzar las medidas conductuales concomitantes, re-evaluar dosis o moléculas (rotación de antimuscarínicos) y considerar tratamientos mínimamente invasivos.
Tratamientos mínimamente invasivos: Incluyen intervenciones para casos de SVH refractario al manejo conservador y farmacológico o a personas que no desean o no puedan mantener una terapia farmacológica. Destacan tres modalidades: la inyección intravesical de toxina botulínica A, la neuromodulación de raíces sacras y la neuromodulación del nervio tibial posterior.
- La toxina botulínica tipo A (onabotulinumtoxinA) administrada mediante múltiples inyecciones en el detrusor es altamente efectiva para suprimir las contracciones involuntarias. Fue inicialmente utilizada en vejigas neurogénicas y luego adoptada para SVH idiopático con excelentes resultados. Produce mejoría o continencia en un alto porcentaje de pacientes, con duraciones de efecto en promedio de 6 a 9 meses, tras lo cual suele requerirse reinyectar. La dosis típicamente utilizada es 100 U en 10 sitios de punción bajo cistoscopía. El efecto adverso principal es la retención urinaria transitoria (5–20% requieren sondaje postoperatorio), por lo que es fundamental seleccionar pacientes dispuestas y capaces de realizar cateterismo intermitente si fuese necesario. También pueden presentarse infecciones urinarias post procedimiento con mayor frecuencia, manejables con profilaxis antibiótica breve. En general, la toxina botulínica ha revolucionado el manejo del OAB al ofrecer una opción mínimamente invasiva (procedimiento ambulatorio) con alto grado de satisfacción, aunque a expensas de un tratamiento repetitivo¹⁶.
- La neuromodulación sacra consiste en la estimulación eléctrica crónica de las raíces sacras (usualmente S3) mediante la implantación quirúrgica de un electrodo y un generador subcutáneo (marcapaso vesical). Este método modula los reflejos miccionales a nivel de la médula y ha mostrado tasas de éxito alrededor de 60–70% en reducir significativamente la incontinencia de urgencia en pacientes seleccionadas. Debido a su costo elevado y la necesidad de uno o dos procedimientos, según el esquema utilizado, se recomienda principalmente para casos refractarios y/o severos. Habitualmente se realiza una fase de prueba (estimulación externa temporal) y, si hay respuesta positiva, se implanta el dispositivo definitivo. La neuromodulación sacra tiene riesgos asociados al procedimiento (infección, dolor pélvico, recambio de batería cada varios años) pero puede brindar alivio duradero en pacientes que de otro modo no tendrían solución¹⁵.
- La neuromodulación del nervio tibial posterior es otra técnica menos invasiva de neuromodulación, basada en estimular mediante impulsos eléctricos el nervio tibial (a nivel del tobillo), el cual comparte vía con aferencias del plexo sacro modulatorias de la micción. Se puede realizar de forma percutánea (aguja fina estimulando el nervio tibial posterior en sesiones semanales durante 3 meses) o mediante parches de estimulación transcutánea domiciliaria. Las guías internacionales la incluyen como tratamiento de tercera línea, sin embargo, en Chile, debido a su perfil de seguridad y resultados positivos alrededor de 50–60% de las pacientes experimentan mejoría significativa de síntomas con este método (Peters et al., 2010; Moossdorff-Steinhauser & Berghmans, 2013) se ha utilizado en el manejo inicial del SVH, tanto dentro de la kinesioterapia de piso pélvico como de forma domiciliaria. Una innovación reciente en este campo es el desarrollo de dispositivos implantables de estimulación tibial continua, como el eCoin®. Este aparato, del tamaño de una moneda, se implanta bajo la piel cerca del tobillo y emite impulsos predeterminados de forma autónoma; fue aprobado en 2022 por la FDA para tratar la incontinencia de urgencia refractarias¹¹. Los primeros estudios con este dispositivo muestran tasas de éxito prometedoras, ofreciendo una alternativa mínimamente invasiva que evita sesiones repetitivas en consulta. Sin embargo, su disponibilidad aún es limitada y se requieren más datos a largo plazo.
- Otro dispositivo emergente en este campo es el BlueWind Revi®, un neuroestimulador implantable de pequeño tamaño diseñado para la estimulación crónica del nervio tibial posterior. A diferencia del eCoin®, el Revi® es un implante totalmente pasivo que se activa de manera inalámbrica mediante un generador externo portátil que la paciente coloca en el tobillo durante sesiones programadas de estimulación. Los estudios iniciales han mostrado resultados alentadores en mujeres con vejiga hiperactiva refractaria, con mejorías significativas en la frecuencia miccional y los episodios de incontinencia, manteniendo un perfil de seguridad favorable. Este tipo de dispositivos amplía las opciones de neuromodulación mínimamente invasiva, ofreciendo alternativas menos costosas y de menor complejidad quirúrgica que la neuromodulación sacra, aunque aún se requieren datos a largo plazo para establecer su eficacia comparativa¹¹
Tratamientos Invasivos
En casos extremos donde otras terapias fracasan, existen intervenciones quirúrgicas mayores como la cistoplastía de aumento (ampliación de la vejiga con segmentos intestinales) o la derivación urinaria idealmente continente, pero estas se reservan a situaciones excepcionales dada su morbilidad. Afortunadamente, la gran mayoría de las mujeres con vejiga hiperactiva pueden ser manejadas efectivamente con alguna combinación de las opciones mencionadas, evitando llegar a cirugías tan radicales.
Si bien las guías actuales (AUA/SUFU 2024) promueven un modelo flexible y centrado en la decisión compartida, en la práctica clínica es importante considerar que muchos sistemas de salud y seguros médicos todavía requieren documentar intentos de terapias conservadoras o farmacológicas antes de autorizar intervenciones más costosas, como la neuromodulación sacra. Por lo tanto, aunque no sea estrictamente necesario “escalar” de manera rígida por razones médicas, en la práctica habitual raramente se indica una terapia invasiva avanzada sin haber probado previamente modificaciones conductuales (p. ej., restricción de líquidos, entrenamiento vesical) o tratamiento farmacológico⁹.
Incontinencia urinaria de esfuerzo (IUE)
La incontinencia urinaria de esfuerzo (IUE) corresponde a la pérdida involuntaria de orina asociada a aumentos de la presión intra abdominal, típicamente durante actividades físicas, esfuerzos, risa, estornudos o tos. Es la forma más prevalente de incontinencia en la mujer, representando alrededor del 50% de los casos de IU en estudios poblacionales, y está presente (ya sea de forma pura o mixta) en hasta un 86% de las mujeres incontinentes. La paridad es el principal factor de riesgo predisponente para IUE. Tanto el número de partos como la vía del parto influyen en el riesgo: las mujeres que han tenido partos vaginales presentan aproximadamente 1.7 veces más riesgo de IUE que las nulíparas, y aquellas con sólo partos por cesárea tienen un riesgo 1.5 veces mayor que nulíparas. El impacto de la lesión obstétrica es más marcado en la mujer joven (20–40 años); en cambio, en mayores de 65 años la diferencia por antecedente de parto tiende a atenuarse¹⁷ ¹⁸. Esto sugiere que, a edades avanzadas, otros factores relacionados con el envejecimiento (deterioro del tejido conectivo, alteraciones neuromusculares, hipoestrogenismo, etc.) pasan a ser predominantes en la génesis de la IUE, igualando el riesgo entre quienes tuvieron partos y quienes no.
Datos obstétricos más detallados indican que no solo el hecho de parir sino cómo se produce el parto influye en la continencia futura. Por ejemplo, un estudio en >13.000 noruegas encontraron que entre las mujeres menores de 50 años, haber tenido un parto asistido con fórceps aumentó significativamente el riesgo de IUE posterior en comparación a un parto vaginal no instrumentado (OR ~1,4), e incluso comparado a partos con vacuoextractor (OR ~1,8). En cambio, en mujeres mayores de 50, el tipo de parto ya no mostró asociación con la incontinencia, reforzando la idea de que en la postmenopausia confluyen múltiples causas de incontinencia más allá de la lesión obstétrica remota. Otros factores de riesgo conocidos para IUE incluyen el hipoestrogenismo (menopausia), la obesidad (cada 5 unidades de aumento en IMC se asocian a incremento importante del riesgo de IU) y antecedentes de cirugías pélvicas (histerectomía, cirugías anti-incontinencia previas, reparaciones de prolapso), las cuales pueden debilitar los soportes pélvicos o dañar el esfínter uretral¹².
Fisiopatología de la IUE
La continencia urinaria en reposo depende de la interacción anatómica y funcional entre la uretra y sus mecanismos de soporte. Durante los aumentos súbitos de presión abdominal, ocurren cambios que pueden sobrepasar los mecanismos de continencia y originar la fuga de orina característica de la IUE. A lo largo de la historia, se han propuesto varias teorías para explicar este fenómeno:
- Teoría de la transmisión de presiones (Enhörning, 1961): Establece que la posición adecuada del cuello vesical y uretra proximal dentro de la pelvis (por encima del diafragma urogenital) es crucial para transmitir eficientemente las presiones abdominales a la uretra durante eventos como la tos. Si la uretra proximal desciende excesivamente (por debilidad de sus soportes) y queda fuera de la pelvis, esas presiones no se transmiten en igual medida a la luz uretral, provocando un desequilibrio presión-vesical > presión-uretral y resultando en escape. Esta teoría fundamentó por décadas procedimientos como la colposuspensión de Burch, que busca reubicar y fijar el cuello vesical en una posición elevada retropúbica, restaurando así la transmisión de presión abdominal a la uretra.
- Teoría integral de la continencia (Petros & Ulmsten, 1990s): Propone que la zona medio uretral (y su complejo de soporte fascial, muscular y vaginal) es la estructura clave para la continencia durante los aumentos de presión. Según Petros, la uretra media actúa como un “punto de apoyo” crítico (denominado “zona de elasticidad crítica”); si ese soporte cede, la uretra pierde la capacidad de coaptarse ante un esfuerzo. Basados en esta idea, Petros y Ulmsten desarrollaron la técnica de la cinta libre de tensión suburetral a nivel medio uretral, utilizando materiales sintéticos de polipropileno, que demostraron ser altamente efectivos para “reemplazar” el soporte deficiente. Esta técnica revolucionó el tratamiento quirúrgico de la IUE a partir de 1996, desplazando a procedimientos previos.
- Deficiencia esfinteriana intrínseca (DEI): Más que una teoría, es un concepto fisiopatológico que explica algunos casos de IUE donde el mecanismo predominante no es la hipermovilidad uretral sino una falla intrínseca del cierre uretral. En la DEI, el esfínter uretral (intrínseco) no logra oponer resistencia ni siquiera a pequeños aumentos de presión, ya sea por daño neuromuscular severo, isquemia o cambios fibróticos. McGuire definió urodinámicamente la DEI como el escape de orina con presiones abdominales muy bajas en el estudio urodinámico (Valsalva leak point pressure). Clínicamente se sospecha DEI en pacientes con IUE que presentan: antecedentes de lesión severa (cirugía radical pélvica, radioterapia, trastornos neurológicos), pérdida de orina con esfuerzos mínimos o incluso en reposo, uretra poco móvil o “fija” al examen físico, y una prueba de soporte uretral positiva (ver más abajo) que no logra corregir la fuga. Estos casos suelen requerir intervenciones de mayor soporte e incluso de obstrucción (p. ej., sling suburetral tipo cabestrillo de fascia o incluso esfínter urinario artificial) dado que las cirugías estándar podrían ser insuficientes.
Vale la pena mencionar que las mujeres con IUE a menudo presentan una combinación de elementos: algo de hipermovilidad uretral junto con cierto grado de deficiencia esfinteriana subclínica. Por ello, la distinción no siempre es absoluta, pero tiene implicancias en la selección del tratamiento óptimo.
Diagnóstico de la IUE
La evaluación de una mujer con incontinencia de orina debe ser integral, iniciando por una anamnesis detallada y un examen físico minucioso. En la anamnesis es fundamental caracterizar el tipo de incontinencia. Los hallazgos clave sugestivos de IUE son: escapes de orina que ocurren sólo con esfuerzos físicos (ejercicio, tos, estornudo, risa, etc.), ausencia de sensación de urgencia previo al escape, patrón miccional generalmente normal (sin aumento marcado de frecuencia, ni nocturia significativa) y volumen de escape variable según la intensidad del esfuerzo. Se debe cuantificar la frecuencia de los episodios y estimar el impacto en la calidad de vida. Para graduar rápidamente la severidad de la IUE se puede usar escalas simples como el Score de Sandvik, de solo 2 preguntas, que clasifica la incontinencia en leve, moderada o severa según frecuencia y cantidad de orina perdida. Otra herramienta válida a considerar es el ICIQ-UI SF (International Consultation on Incontinence Questionnaire – Short Form), ampliamente utilizado a nivel internacional para objetivar la severidad y molestia que causa la incontinencia y validado en Chile. ¹² ²⁶. Como se señaló en SVH, conviene también registrar la información en un diario miccional de al menos 48 horas.
Entre los cuestionarios utilizados en investigación destaca el MESA (Medical, Epidemiologic, and Social Aspects of Aging questionnaire), ampliamente aplicado en estudios epidemiológicos y clínicos para diferenciar el componente de incontinencia de esfuerzo del de urgencia, e incluso estimar la contribución relativa de ambos en la incontinencia urinaria mixta. Aunque no cuenta con una versión validada formalmente en español, su estructura ha sido utilizada en algunos ensayos clínicos internacionales como herramienta de clasificación sintomática complementaria. En la práctica clínica en nuestro medio, el cuestionario más recomendado sigue siendo el ICIQ-UI SF, validado en español y en población chilena, por su simplicidad y robustez psicométrica²⁶.
Para distinguir entre IUE e IUU por la historia, resulta útil resumir sus diferencias clínicas principales, tal como se muestra en la Tabla 1.
| Característica | Incontinencia de esfuerzo (IUE) | Incontinencia de urgencia (IUU) |
| Momento de ocurrencia | Solo durante el día (actividad física) | Día y noche (no relacionado a actividad) |
| Sensación de urgencia previa | No | Sí (deseo miccional imperioso precede al escape) |
| Frecuencia miccional diurna | Normal | Aumentada (polaquiuria) |
| Frecuencia miccional nocturna | Normal (0–1 despertar) | Aumentada (nocturia frecuente) |
| Predictibilidad del escape | Alta (situaciones de aumento de presión) | Baja (episodios impredecibles) |
Tabla 1. Características diferenciales entre incontinencia urinaria de esfuerzo y de urgencia.
En la exploración física, se debe realizar un examen ginecológico-urológico con la vejiga con llenado cómodo (idealmente ~300 ml o deseo miccional moderado) para intentar reproducir los escapes. Se explora en posición de litotomía (o en posición de mariposa en camilla común) observando: integridad del piso pélvico (tono y fuerza muscular del elevador del ano mediante contracción voluntaria), presencia de prolapso de órganos pélvicos (especialmente defecto anterior que podría enmascarar una IUE oculta), estado de la mucosa vaginal (signos de atrofia o sindrome genitourinario de la manopausia) y eventual sensibilidad o masas pélvicas. Para evaluar objetivamente la movilidad uretral y la presencia de escape, se solicita a la paciente que realice maniobras de Valsalva y tos durante el examen. Un método sencillo es la observación directa de salida de orina por el meato al toser (prueba de estrés positiva) (Figura 1) y cuantificar en grados la movilidad de la uretra entre el estado de reposo y el de valsalva. Esta cuantificación clínica vino a reemplazar el test del cotonito (Q-tip test) que causaba un elevado nivel de discomfort. Si se objetiva la salida de orina con maniobras de Valsalva y tos, la prueba de esfuerzo se considera positiva.
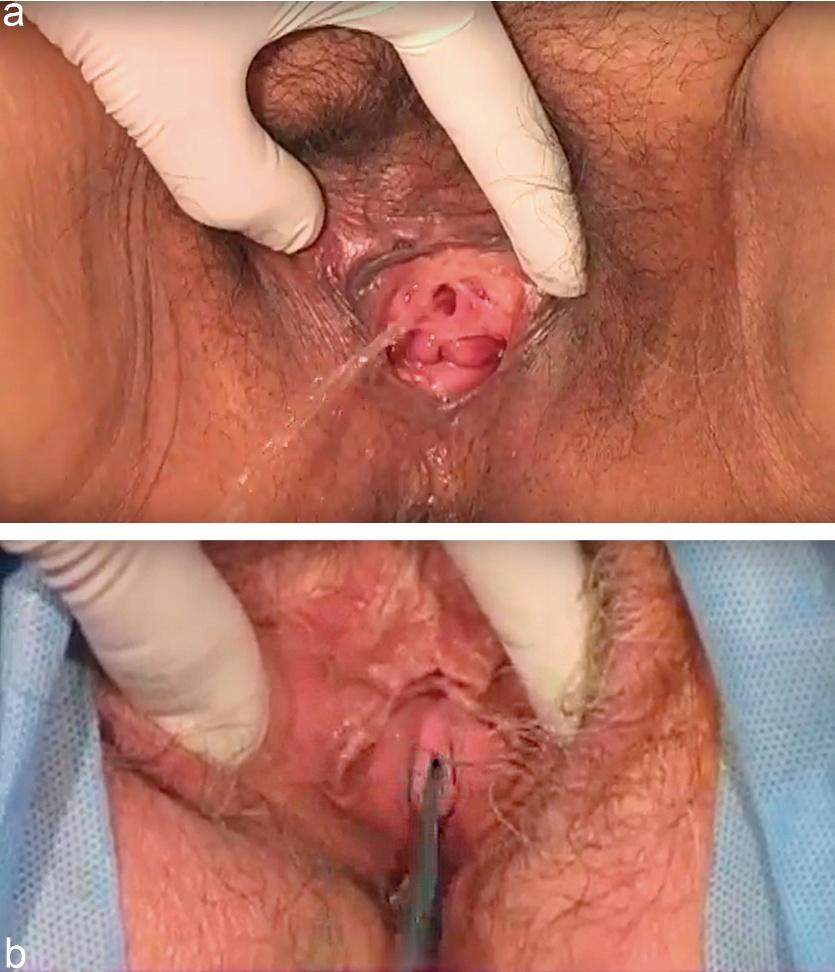
Fig. 1 Examen físico de mujeres con IUE. a) test de tos o esfuerzo con vejiga a capacidad 300ml b) Test de esfuerzo con azul de metileno.
Una recomendación práctica es aprovechar el examen físico para simular el efecto de un posible tratamiento quirúrgico (“ensayo” del procedimiento). Por ejemplo, si se está pensando en ofrecer una cinta suburetral, se puede realizar la prueba de Bonney modificada: sostener la uretra media con uno o dos dedos a través de la pared anterior vaginal mientras la paciente realiza Valsalva y tos. Si al proporcionar este soporte uretral manual el escape de orina se detiene, sugiere que la IUE se debe a hipermovilidad uretral pura y que probablemente una cinta suburetral que proporcione soporte en la uretra media, sería efectiva. Por el contrario, si pese al soporte digital sigue ocurriendo el escape, podría indicar un componente de deficiencia esfinteriana intrínseca (ya que ni aun sosteniendo la uretra se evita la fuga), lo cual podría orientar hacia la necesidad de procedimientos más compresivos u otros abordajes (ver tratamiento). Este sencillo test tiene un gran valor orientador y de consejo preoperatorio.
Un aspecto práctico importante es la evaluación de la paciente con prolapso de órganos pélvicos concomitante. El prolapso, especialmente de la pared anterior, puede “enmascarar” la incontinencia urinaria de esfuerzo al comprimir o angular la uretra. Por ello, durante el examen físico se recomienda reducir manualmente el prolapso (con espéculo, hisopo o incluso con la mano del examinador) antes de solicitar maniobras de tos o Valsalva. De esta forma es posible desenmascarar una incontinencia oculta, lo cual tiene implicancias diagnósticas y terapéuticas relevantes, ya que una cirugía de prolapso sin corrección de la incontinencia concomitante puede resultar en escapes postoperatorios que no se evidenciaron en la evaluación inicial¹².
En caso de que la paciente refiera incontinencia con esfuerzos pero no se logre objetivar la pérdida durante el examen (lo cual ocurre en un porcentaje apreciable, especialmente si la vejiga no se encuentra lo suficientemente llena o la paciente estaba inhibida), se pueden tomar medidas adicionales: repetir la maniobra con la vejiga más llena, examinar a la paciente de pie (posición erecta) ya que a veces en decúbito no se genera suficiente presión descendente, o bien utilizar pruebas complementarias.
Al mismo tiempo, en casos donde no es claro si la pérdida reportada corresponde efectivamente a orina o a secreciones vaginales, puede utilizarse el pad test con Pyridium. Este consiste en administrar fenazopiridina (100–200 mg VO) que tiñe la orina de color anaranjado intenso; posteriormente, la paciente utiliza una toalla sanitaria durante un periodo de observación (generalmente 1–2 horas con actividad física). Si la toalla se tiñe de naranja, se confirma que el líquido corresponde a orina. Esta prueba es especialmente útil en pacientes con secreción vaginal abundante, flujo postquirúrgico o en quienes persiste la duda diagnóstica tras la anamnesis y el examen físico¹².
Los exámenes de laboratorio básicos en IUE incluyen un urianálisis con urocultivo (para descartar infección concomitante) y, en pacientes con síntomas mixtos o vaciamiento sospechoso, una medición de residuo postmiccional (idealmente con ecografía o badder scan y si no están disponibles, con cateterismo). Esto es importante sobre todo antes de considerar un tratamiento quirúrgico, ya que una disfunción del vaciado no detectada se puede exacerbar tras la cirugía anti-incontinencia. Las pacientes con vaciado normal (sin residuo elevado) y diagnóstico claro de IUE no complicada, se denominan pacientes “índice” y en ellas no se requieren estudios complementarios de rutina. La urodinamia (estudio urodinámico multicanal) está indicada en circunstancias específicas, tales como: duda diagnóstica (por ejemplo, síntomas mixtos sin haber objetivado el componente de esfuerzos), fracaso de cirugías previas (IUE recurrente), presencia de factores neurológicos o prolapso de grado avanzado (que protruye por fuera del introito) concomitante que dificulte la interpretación clínica.
La prueba urodinámica puede diferenciar si existe realmente una hipermovilidad uretral con incontinencia de esfuerzo (demostrando fuga con incrementos de presión abdominal sin contracción del detrusor), cuantificar la presión de fuga (valiosa para sospechar DEI si es muy baja) y evaluar la función de vaciado. No obstante, debe recordarse que la urodinamia tiene sensibilidad limitada: hasta un 20–30% de las pacientes con clara IUE por historia y examen físico pueden no mostrar fuga durante el estudio (falso negativo). Por ello, la urodinamia complementa pero no reemplaza la evaluación clínica, pero debe considerarse en aquellos casos en que haya cualquier duda diagnóstica, sobretodo cuando la paciente manifiesta mínima sensación de urgencia previo al escape de orina, ya que hay casos en los que el esfuerzo o la valsalva, puede gatillar una contracción involuntaria del detrusor seguida de escape de orina, y que se pudiera confundir con una incontinencia urinaria de esfuerzo real.
En casos seleccionados, la urodinamia puede ser especialmente relevante. Esto incluye pacientes con síntomas sugestivos de disfunción del vaciamiento, presencia de residuo postmiccional elevado, o antecedentes de comorbilidades complejas como radioterapia pélvica o enfermedades neurológicas de alto riesgo (esclerosis múltiple, lesión medular, enfermedad de Parkinson). En estas situaciones, el estudio urodinámico permite diferenciar si existe obstrucción funcional, vejiga hipoactiva o disinergia esfinteriana, lo cual impacta directamente en la planificación terapéutica. Por lo tanto, aunque no se recomienda de rutina en IUE típica, la urodinamia sigue teniendo un rol en escenarios de mayor complejidad diagnóstica¹².
En casos seleccionados, otros estudios como la cistoscopia (si hay hematuria o se sospecha fístula, cuerpo extraño, etc) o estudios de imagen dinámicos (uretrocistografía miccional, ultrasonido perineal) pueden brindar información anatómica adicional, pero no se indican rutinariamente en la IUE típica.
Tratamiento de la IUE
Tratamientos no quirúrgicos
El manejo de la IUE debe ser individualizado. En general se recomienda iniciar por las medidas conservadoras, reservando la cirugía para casos en que estas fallen o la severidad lo amerite. Esto es especialmente relevante en mujeres jóvenes, embarazadas o en puerperio temprano, donde intervenciones mínimamente invasivas pueden lograr mejoras significativas.
- Disminución de peso: Una medida conservadora clave es la pérdida de peso en mujeres con sobrepeso u obesidad. La evidencia muestra que reducciones relativamente modestas del peso corporal (alrededor de un 5–10%) se asocian a una disminución significativa en la frecuencia de episodios de incontinencia, tanto de esfuerzo como de urgencia. En un ensayo clínico, mujeres con sobrepeso que lograron perder en promedio 8 kg redujeron en más de un 50% los episodios de incontinencia semanal en comparación con el grupo control. Por lo tanto, el asesoramiento en dieta, actividad física y reducción de peso debe considerarse parte integral del manejo inicial de la incontinencia urinaria en mujeres con exceso de peso¹².
- Terapia farmacológica: A diferencia del SVH, las opciones farmacológicas para IUE son limitadas. El objetivo es aumentar la resistencia uretral, ya sea mejorando la coaptación mucosa o incrementando el tono del esfínter (músculo liso y estriado). La duloxetina, un inhibidor de recaptura de serotonina-noradrenalina, ha mostrado en estudios aumentar ligeramente la presión de cierre uretral y reducir episodios de IUE moderada; sin embargo, sus beneficios son modestos y sus efectos secundarios (náuseas, fatiga, boca seca) limitan su aceptación, por lo que no está aprobada universalmente para este fin. Los estrógenos locales (cremas, óvulos vaginales) pueden fortalecer el epitelio uretral y mejorar el trofismo periuretral en mujeres posmenopáusicas, ayudando en casos leves o asociados a atrofia vaginal, aunque la evidencia de su impacto directo en IUE es variable. En general, ningún fármaco oral cuenta con alta efectividad en IUE y las guías no los recomiendan como monoterapia de rutina. Por tanto, el tratamiento farmacológico tiene un rol secundario, pudiendo considerarse como coadyuvante en ciertos casos (p. ej., estrógeno vaginal en posmenopáusicas con uretra atrófica, o duloxetina en IUE moderada cuando se pospone cirugía), siempre informando a la paciente de las expectativas realistas.
- Fisioterapia de piso pélvico: Corresponde a la primera línea terapéutica en IUE, especialmente para grados leves a moderados. Consiste en entrenamiento de los músculos elevadores del ano mediante ejercicios supervisados por kinesiólogos especializados en piso pélvico. Idealmente se realiza un programa de varias semanas que incluye ejercicios de contracción repetitiva, técnicas de retroalimentación (biofeedback) y ejercicios funcionales (contracción previa a esfuerzo, etc.). Se pueden emplear conos vaginales de peso graduado, que la paciente debe sostener durante periodos variables y progresivos, lo que ayuda a identificar y fortalecer la musculatura adecuada; el uso supervisado de bolas chinas tendría un efecto similar. La eficacia de la fisioterapia está bien documentada: logra mejoría subjetiva en 50–70% de las pacientes y objetivamente puede curar la IUE en hasta 1 de cada 3 mujeres con adherencia óptima. Además, estudios han demostrado que la ejercitación temprana postparto (desde la 3ᵃ semana) puede prevenir la incontinencia en mujeres con factores de riesgo. Lamentablemente, la adherencia es el punto crítico: muchas pacientes abandonan los ejercicios a los pocos meses si no cuentan con refuerzos. Para ello se han desarrollado dispositivos modernos como entrenadores pélvicos conectados (ej.: dispositivos vaginales con sensores Bluetooth que se conectan a una app y guían los ejercicios con biofeedback lúdico). Estos dispositivos y apps podrían mejorar la motivación y asegurar que los ejercicios se realicen correctamente, aumentando potencialmente el éxito del tratamiento conservador¹² ²⁰.
- Ejercicios hipopresivos (gimnasia abdominal hipopresiva): En años recientes han ganado popularidad como complemento para el fortalecimiento pélvico. Combinan técnicas de respiración y posturas que reducen la presión abdominal, contrayendo reflejamente el músculo transverso abdominal y el piso pélvico. Algunos estudios iniciales han mostrado resultados promisorios en mejorar síntomas de IUE, tanto en prevención (postparto) como tratamiento, y su práctica goza de adherencia por su componente grupal/disciplinario. Sin embargo, la evidencia aún es controvertida. Una revisión Cochrane de 2019 no encontró beneficio significativo del yoga/hipopresivos sobre la incontinencia. En la actualidad, pueden recomendarse como actividad complementaria saludable, pero no sustituyen la fisioterapia convencional pélvica.
- Pesarios: Los pesarios vaginales son dispositivos de silicona comúnmente usados para el tratamiento conservador del prolapso, pero también existen diseños específicos para IUE. Se trata de pesarios (generalmente anillos) que incorporan una protuberancia o soporte que queda bajo la uretra proximal, ayudando a comprimirla levemente y prevenir escapes durante esfuerzos. Se consideran una opción no invasiva para pacientes que desean posponer o evitar cirugía, como mujeres ancianas, con alto riesgo quirúrgico o incluso mujeres jóvenes embarazadas (en quienes la cirugía está contraindicada durante la gestación). El pesario debe ser ajustado en tamaño por un especialista y removido periódicamente para higiene. Las contraindicaciones incluyen infección vaginal activa, ulceraciones vaginales graves o pobre adherencia al seguimiento (pues si la paciente no acude a controles puede haber riesgo de ulceración por un pesario olvidado). Las tasas de éxito reportadas con pesarios en IUE varían ampliamente (mejoría en ~30–50% de usuarias, continencia completa en porcentajes menores), pero muchos estudios son observacionales. Aun así, representan una herramienta útil en escenarios seleccionados⁹.
- Los plugs uretrales son dispositivos temporales diseñados para ocluir la uretra y prevenir la fuga de orina en situaciones específicas, como durante la actividad física intensa o eventos sociales (Dwyer et al., 2014). Están fabricados con materiales flexibles y generalmente son de uso intermitente. Los plugs son autoaplicables por la paciente y deben retirarse para orinar, siendo bien tolerados en la mayoría de los casos.
Entre las ventajas se incluyen:
- Alternativa no invasiva.
- Uso intermitente según necesidad.
- No requiere cirugía ni medicación.
Las principales limitaciones son:
- Pueden generar sensación de cuerpo extraño o disconfort.
- Riesgo bajo de infección urinaria si no se usan adecuadamente.
- No son una solución definitiva.
Además de los plugs, existen dispositivos vaginales específicos para incontinencia de esfuerzo, como el Contiform® o el Uresta®, que proporcionan soporte bajo la uretra similar a un pesario y pueden ser colocados y retirados por la propia paciente (Farrell et al., 2007). Estos dispositivos han demostrado tasas de satisfacción superiores al 60% en mujeres con IUE leve a moderada que desean evitar tratamientos invasivos o postergar la cirugía (The Canadian Continence Foundation, 2024).
Una innovación reciente en este ámbito es el dispositivo intravaginal Yōni.Fit®, un soporte uretral reutilizable y autocolocable, fabricado en silicona médica y diseñado para ofrecer control eficaz de la incontinencia urinaria de esfuerzo durante actividades físicas o para uso prolongado (hasta 12 h). En un ensayo clínico multicéntrico, aleatorizado y ciego, logró una reducción significativa de los eventos de incontinencia y del peso de las toallas comparado con un dispositivo placebo, alcanzando una tasa de respuesta del 53 % frente al 23 % (p = 0,013), además de una reducción del 88,8 % en los episodios de incontinencia (p < 0,001), sin eventos adversos graves¹³. El dispositivo recibió la autorización 510(k) de la FDA en mayo de 2024, lo que lo posiciona como una opción no quirúrgica eficaz, fácil de usar y bien tolerada, especialmente atractiva para mujeres que desean evitar intervenciones invasivas.
- Nuevas terapias no invasivas (energía): Recientemente han surgido tratamientos basados en energía aplicada vía vaginal para la IUE leve a moderada. Uno de ellos es el láser vaginal no ablativo (fraccionado, Er:YAG o CO₂), aplicado en la mucosa de la pared anterior de la vagina. Este procedimiento ambulatorio induce remodelación de colágeno y engrosamiento de los tejidos de soporte uretral. Estudios iniciales y series de casos han mostrado mejoría subjetiva de la IUE en un número importante de pacientes tras 1–2 sesiones de láser. Sin embargo, las mejorías objetivas son modestas (alrededor de 30% de curación) y suelen disminuir con el tiempo, siendo necesarios retratamientos al cabo de 12–18 meses. Además, la evidencia más robusta es conflictiva: un ensayo clínico aleatorizado reciente (láser Er:YAG vs tratamiento simulado) no encontró diferencias significativas a 6 meses en la tasa de curación o mejoría de la IUE. Otra modalidad es la radiofrecuencia intravaginal, que calienta los tejidos periuretrales a ~40–45°C estimulando la contracción del colágeno y neocolagénesis. Estudios recientes sugieren que la radiofrecuencia monopolar puede reducir los escapes de IUE leve-moderada con un perfil de seguridad adecuado, además de reportar mejoría en la función sexual en algunas pacientes pos-tratamiento. Tanto el láser como la radiofrecuencia son procedimientos mínimamente invasivos (no requieren anestesia ni incisiones) y podrían considerarse en mujeres con IUE leve que no desean (o no califican para) cirugía. No obstante, aún se consideran terapias experimentales; las principales sociedades científicas han advertido que se necesita mayor evidencia de eficacia y seguridad a largo plazo antes de recomendarlas de rutina.
- El ultrasonido focalizado de alta intensidad (HIFU) es una tecnología que ha sido explorada principalmente para el tratamiento de miomas uterinos y cáncer de próstata, pero recientemente ha comenzado a investigarse como posible opción terapéutica para la incontinencia urinaria, debido a su capacidad para inducir calentamiento profundo y remodelación tisular sin dañar la superficie (Wu et al., 2020).
En teoría, la aplicación transvaginal de HIFU podría fortalecer el tejido periuretral mediante la contracción del colágeno y la regeneración progresiva (Zhang et al., 2022). Los estudios en esta área aún son preliminares y los ensayos clínicos en mujeres con incontinencia urinaria son escasos.
Actualmente, las principales guías internacionales no recomiendan el uso de HIFU para IUE de rutina, ya que la evidencia de eficacia y seguridad es insuficiente (International Urogynecological Association, 2022). No obstante, podría convertirse en una alternativa no invasiva prometedora en el futuro.
- Estimulación eléctrica y magnetoterapia: La electroestimulación funcional del piso pélvico, ya sea con electrodos vaginales o superficiales, busca fortalecer reflejamente el esfínter y musculatura pélvica mediante contracciones inducidas eléctricamente. Puede ser útil en pacientes que no logran contraer adecuadamente el piso pélvico por sí solas (por ejemplo, mujeres añosas con pobre control muscular). Asimismo, la estimulación magnética extracorpórea (p. ej., silla con campo magnético focal HIFEM) es una alternativa no invasiva aprobada para incontinencia, que induce contracciones pélvicas repetitivas al sentarse sobre el dispositivo durante sesiones de 20–30 minutos, varias veces por semana. Ambas modalidades han mostrado mejorías modestas en algunos ensayos, pero la evidencia es heterogénea. Pueden considerarse como complemento en casos seleccionados, enfatizando que no sustituyen el entrenamiento activo voluntario.
- Terapia regenerativa (células madre): Una línea de investigación novedosa en IUE es la utilización de células madre autólogas para regenerar el esfínter urinario. Se han realizado ensayos piloto inyectando células musculares estriadas cultivadas (mioblastos) y/o células mesenquimales en la pared uretral. Los resultados preliminares son alentadores: investigadores israelíes reportaron mejoría de la continencia en 65% de pacientes con IUE severa tras la inyección de células musculares autólogas, con aumento >50% en la presión de cierre uretral en el 70% de las mujeres tratadas. En un subgrupo de pacientes mayores de 60 años, un 60% recuperó continencia completa a los 6 meses de la terapia. Estos procedimientos se realizan bajo anestesia local, extrayendo primero un pequeño fragmento muscular de la paciente, expandiendo las células en cultivo durante algunas semanas, y luego inyectándolas alrededor de la uretra. La idea es que las células madre se diferencien y sustituyan al tejido muscular del esfínter dañado, reforzando su función. Aunque por ahora es una terapia experimental disponible sólo en el contexto de estudios clínicos, los avances en medicina regenerativa sugieren que a futuro podría convertirse en una alternativa para pacientes con IUE refractaria o deficiencia esfinteriana intrínseca que no responden a los tratamientos actuales.
En conjunto, las opciones no quirúrgicas pueden lograr un control satisfactorio de la IUE en un número importante de mujeres, especialmente aquellas con síntomas leves a moderados, jóvenes o con contraindicación temporal para cirugía. Sin embargo, cuando la incontinencia de esfuerzo es severa, afecta significativamente la calidad de vida, o no mejora con las medidas conservadoras adecuadas, suele plantearse el tratamiento quirúrgico, que ofrece las mayores tasas de curación definitiva.
Tratamientos quirúrgicos
A lo largo de la historia se han descrito múltiples técnicas quirúrgicas para corregir la IUE, reflejando en parte la evolución del entendimiento de su fisiopatología. Hoy en día, el estándar de oro es la utilización de cintas suburetrales sintéticas libres de tensión, pero es útil conocer brevemente las alternativas y sus indicaciones particulares. La selección de la técnica quirúrgica óptima para cada paciente dependerá de sus características (edad, comorbilidades, preferencias, expectativa de vida, actividad sexual), del tipo y severidad de la incontinencia (hipermovilidad vs DEI), de la disponibilidad de materiales, y de la experiencia del cirujano.
– Colposuspensión retropúbica de Burch: Fue durante décadas la cirugía más empleada y considerada gold standard hasta finales de los 90. Consiste en fijar de forma bilateral los tejidos parauretrales y la vagina anterior a los ligamentos de Cooper, elevando el cuello vesical y la uretra proximal hacia la pared abdominal (espacio retropúbico). Se realiza habitualmente por vía abierta o laparoscópica. La colposuspensión restaura la posición anatómica favoreciendo la transmisión de presión (basada en la teoría de Enhörning) y presenta altas tasas de curación inicial (>85%). No obstante, con el advenimiento de técnicas menos invasivas su uso ha disminuido mucho. Aún puede considerarse en pacientes que van a cirugía abdominal por otra causa (p. ej., colposuspensión durante histerectomía abierta) o en casos donde no se desee emplear material protésico.
– Sling pubovaginal autólogo: Implican colocar una banda de tejido (generalmente fascia del músculo recto abdominal o fascia lata de la propia paciente) debajo de la uretra o cuello vesical, anclada a estructuras retropúbicas, generando una especie de hamaca de soporte (Figura 2 y 3). Fueron populares antes de la era de las cintas sintéticas, especialmente para casos de DEI marcada. Actualmente se usan sobre todo cuando está contraindicado el uso de malla sintética (por ejemplo, pacientes con cirugías fallidas con malla o con complicaciones de estas como erosión, o en lugares donde las mallas estén restringidas legalmente o por preferencias de la paciente). Las tasas de éxito de los slings autólogos son similares a las de las cintas sintéticas en el corto plazo (cura subjetiva ~85%), y al ser material autólogo presentan mínimo riesgo de erosión vaginal o uretral. Sin embargo, conllevan una cirugía más invasiva (requiere incisión abdominal para obtención de fascia, con morbimortalidad asociada de la zona donante) y un posoperatorio algo más prolongado. Los efectos adversos incluyen disfunción miccional en 10–15% (retención/obstrucción que en un porcentaje puede requerir operación), aparición de urgencia de novo en 5–15%, y las complicaciones de la herida abdominal²⁷. En algunos centros, los slings de fascia siguen utilizándose en mujeres jóvenes muy activas o en casos de fallo de sling sintético previo, con buenos resultados.
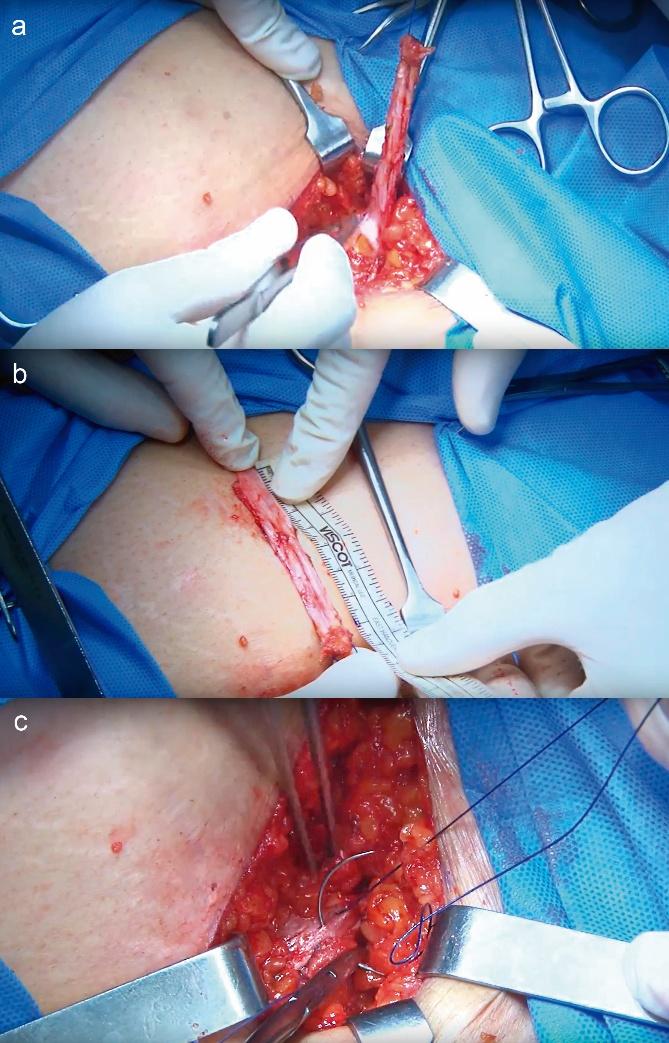
Fig. 2. Principales tiempos quirúrgicos de un Sling de Fascia de Músculos Rectos del abdomen. Tiempo suprapúbico a) Extracción de la cinta de fascia mediante una incisión suprapúbica. b) La cinta mide 2 cm de ancho por 8 cm de largo. c) cierre del defecto aponeurótico.
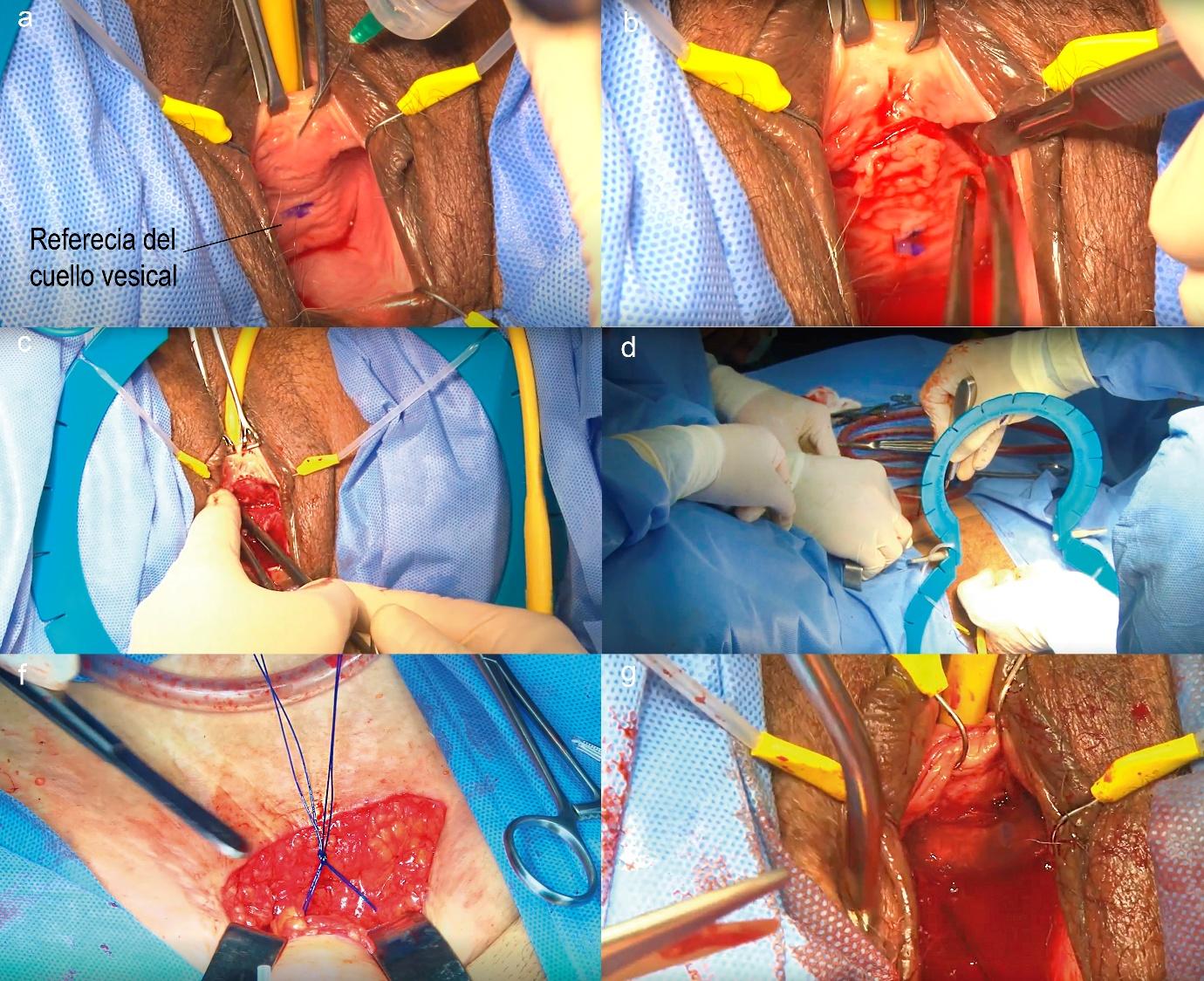
Fig. 3. Tiempo Vaginal a) Hidrodisección vaginal anterior, el punto azul marca la referencia del cuello vesical. b) Incisión vaginal en forma de U invertida. c) Perforación de la fascia Endopélvica del lado derecho de la paciente. d) Traspaso de las suturas irreabsorbibles que guían la cinta de fascia desde la vagina al espacio suprapúbico e) Se anudan ambas suturas irreabsorbibles, la izquierda y la derecha f) Posición final de la cinta, se fija a la fascia vesicovaginal con cuatro puntos de material reabsorbible (optativo).
– Cintas suburetrales sintéticas libres de tensión (TVT/TOT): Actualmente constituyen la cirugía de elección para IUE en la mayoría de los casos. Consisten en una estrecha tira de malla de polipropileno (malla tipo I macroporosa, material biocompatible) que se coloca debajo de la uretra media a manera de “hamaca”, sin tensión, fijada por el propio tejido una vez incorporada. Existen dos abordajes principales: el retropúbico (TVT: tension-free vaginal tape, técnica original de Ulmsten) en que la cinta se pasa desde una incisión vaginal, rodeando el hueso púbico hacia la pared abdominal (Figura 4); y el transobturador (TOT: trans-obturator tape, técnica de Delorme) en que la cinta se coloca a través de los forámenes obturadores, ya sea desde la vagina hacia afuera (Figura 5) (inside-out) o viceversa. Numerosos ensayos han demostrado que ambas vías ofrecen tasas de curación comparables (>80–90% a 1–5 años).
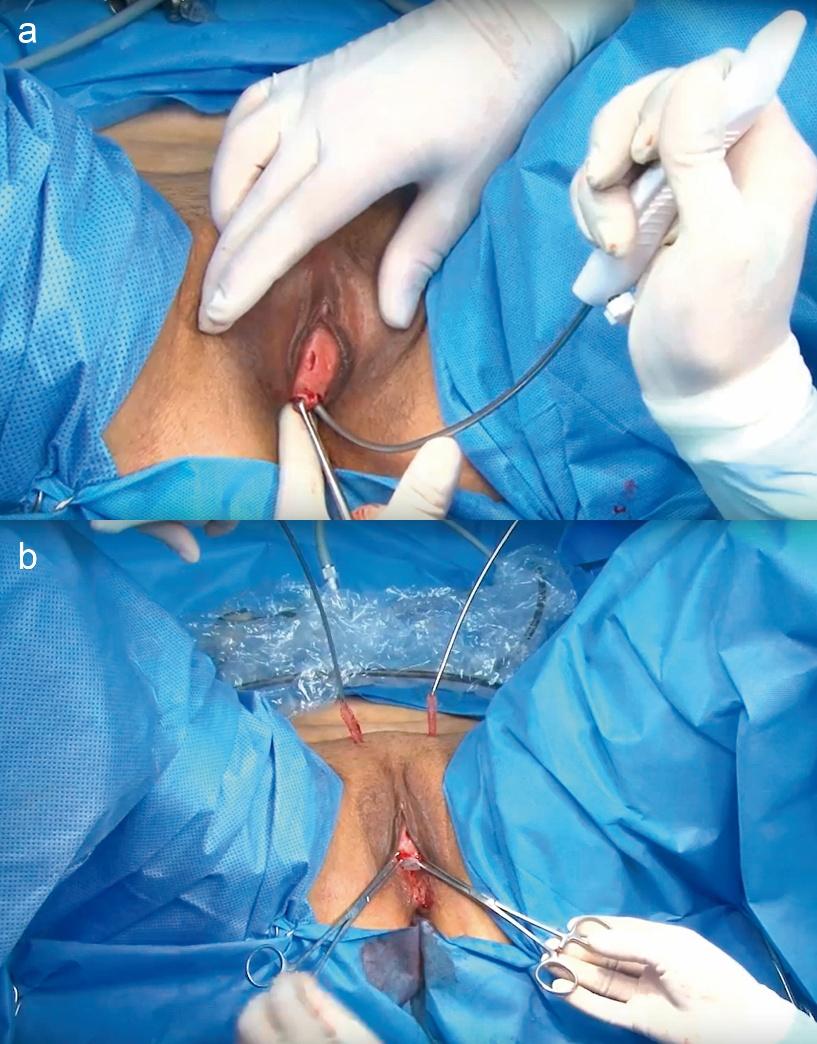
Fig. 4. Cirugía de cinta sub uretral retropúbica. a) Paso de la aguja desde la incisión vaginal hacia la zona suprapúbica al lado derecho de la paciente. b) Trayectoria final de la malla antes de ajustar la tensión y recortar los excedentes.
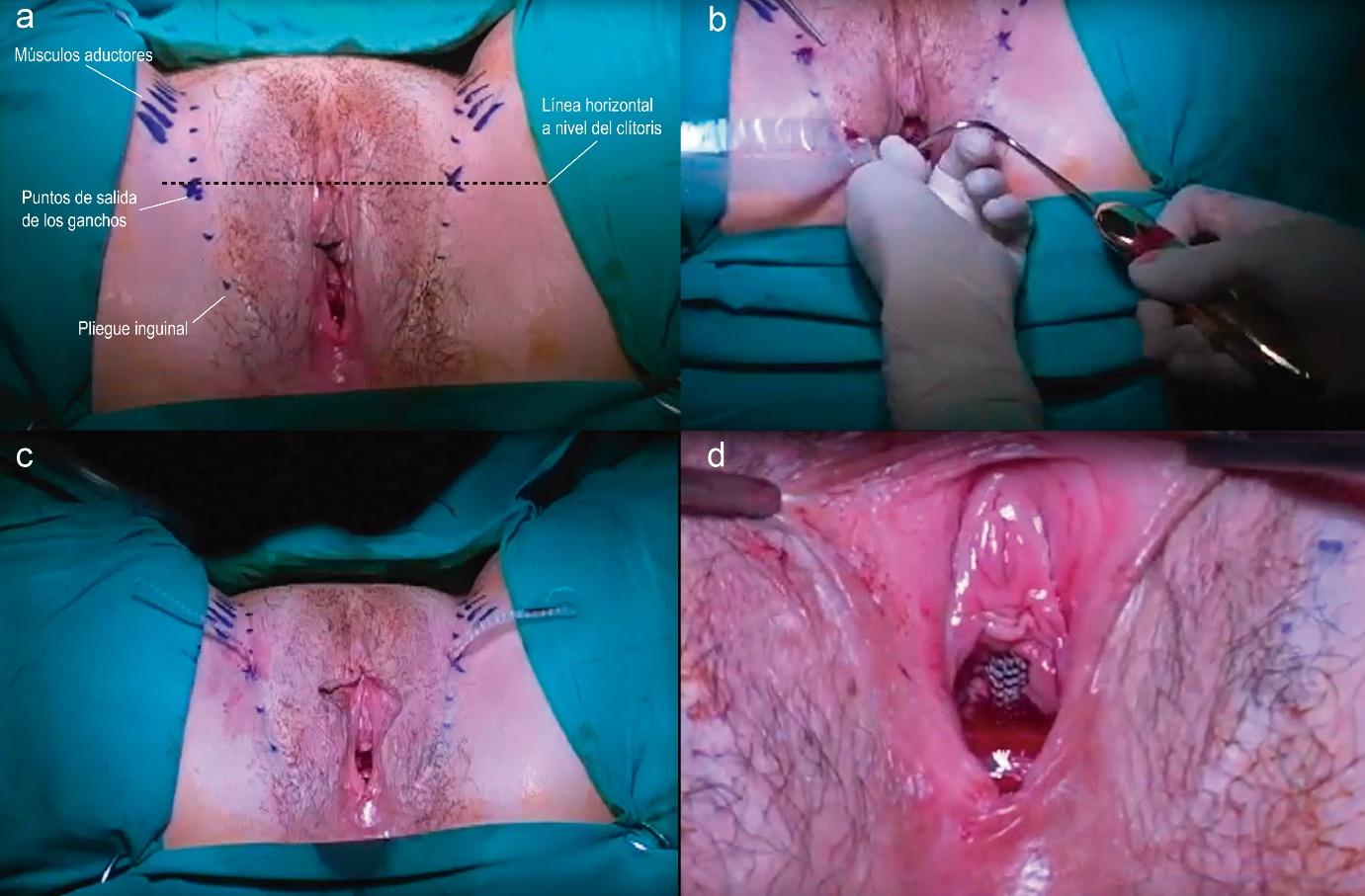
Fig. 5. Cirugía de cinta suburetral trans obturadora con técnica de vagina a piel o inside out. a) Referencias Anatómicas. b) Paso del gancho helicoidal desde la incisión vaginal hacia el agujero obturador izquierdo de la paciente. c) Malla atravesando ambos agujeros obturadores previo al recorte de excedentes. d) Posición final del segmento sub uretra media posterior al ajuste de tensión de la malla.
El TOT se asoció a menor riesgo de lesión vesical y de retención aguda, mientras que el TVT tiene un ligero mayor riesgo de aumento transitorio de urgencia posoperatoria pero tal vez menor tasa de reintervención por recurrencia a largo plazo. Un estudio de 2019 reportó que con TVT el 85% de las pacientes con incontinencia mixta mejoraron su componente de esfuerzo, con solo 5% de exacerbación de la urgencia. En la práctica, la elección suele basarse en la experiencia del cirujano y consideraciones anatómicas de la paciente (por ejemplo, en mujeres con cirugía retropúbica previa compleja se prefiere TOT para evitar adherencias; en mujeres jóvenes, deportistas o con incontinencia severa se prefiere TVT). Las complicaciones de las cintas suburetrales son poco frecuentes, pero incluyen: perforación vesical (en ~2–5% de TVT, manejada simplemente retirando y reinsertando en el momento), retención urinaria posoperatoria (∼5%, que puede requerir aflojar la cinta o sondaje corto hasta que ceda el edema), erosión de la malla en vagina o uretra (1–3% en manos experimentadas, más con factores de riesgo como atrofia o infección; puede requerir retirar parcial o totalmente la cinta), dolor inguinal crónico (especialmente en TOT, <2–4%), y muy raramente lesiones vasculares o de órganos mayores. En general, las mallas tipo 1 de polipropileno han mostrado excelente integración tisular con mínima reacción inflamatoria, siendo el estándar aceptado con menores complicaciones. No obstante, en años recientes ha habido controversias legales y mediáticas sobre el uso de “mallas” en cirugía pélvica (particularmente asociadas a reparaciones de prolapso), lo cual ha generado cierta preocupación en las pacientes. Es importante aclarar que las cintas suburetrales para incontinencia han demostrado un perfil de eficacia/seguridad muy alto cuando son colocadas por cirujanos entrenados, y siguen recomendadas por todas las guías internacionales como tratamiento de primera línea quirúrgico para IUE moderada a severa²¹ ²² ²³.
– Procedimientos compresivos ajustables: Incluyen técnicas como el esfínter urinario artificial femenino (implantación de un manguito hidráulico alrededor de la uretra que la ocluye hasta que la paciente voluntariamente lo desinfla para orinar) o slings ajustables durante el periodo posoperatorio. El esfínter urinario artificial (EUA) es más común en incontinencia masculina, pero en mujeres con IUE muy severa por DEI (especialmente tras fallos de múltiples cirugías previas o por daño esfinteriano irreparable) puede ofrecer tasas de continencia superiores al 70%. Sin embargo, su costo, la necesidad de manipulación manual del dispositivo y el riesgo de complicaciones (erosión uretral, infecciones del sistema, fallas mecánicas) limitan su uso a casos excepcionales en la mujer. Por su parte, algunos sistemas de sling ajustable (como slings con baritensor accesible para tensado en el postoperatorio) han sido desarrollados para manejar la eventual necesidad de calibrar la compresión.
– Inyección de agentes de abultamiento (o agentes de relleno periuretral): Consiste en la colocación vía endoscópica (cistoscopía) de material de relleno en la submucosa del cuello vesical/uretra proximal, con el fin de “engrosar” para promover la coaptación uretral. Se han usado sustancias como colágeno, partículas de carbón, ácido hialurónico/dextranómero, polímeros sintéticos, etc. La inyección periuretral es un procedimiento ambulatorio, de bajo riesgo y rápido, indicado sobre todo en mujeres que no son candidatas a cirugía mayor o que desean evitarla/diferirla. Su eficacia inmediata en mejorar o resolver la IUE se reporta en alrededor de 50–70% de las pacientes, pero las tasas de éxito a 1–5 años son más bajas debido a la reabsorción del material y necesidad de reinyectar periódicamente²⁴. Es, en esencia, un tratamiento de muy bajo riesgo que puede repetirse según necesidad. Las complicaciones son mínimas (disuria pasajera, infección urinaria, muy raramente obstrucción si el material se coloca en exceso).
En resumen, la cirugía de las cintas suburetrales ha desplazado a la mayoría de las técnicas previas por su combinación óptima de eficacia alta, mínima invasión y recuperación rápida²⁵. No obstante, el arsenal quirúrgico sigue incluyendo opciones que se adaptan a circunstancias especiales (uso de tejidos autólogos, dispositivos artificiales, etc.), permitiendo un abordaje personalizado de la paciente con IUE.
Consideraciones en la Incontinencia Urinaria Mixta (IUM)
El manejo de la IU mixta requiere abordar ambos componentes, a menudo de manera secuencial²⁶. Se recomienda identificar qué síntoma (urgencia vs esfuerzo) es el más molesto para la paciente y dirigir inicialmente el tratamiento hacia ese componente. En la mayoría de los casos, se inicia por medidas conservadoras generales (rehabilitación del piso pélvico, reeducación vesical y hábitos) dado que benefician a ambos aspectos y tienen baja morbilidad²⁷. Si predomina el componente de urgencia, puede iniciarse tratamiento farmacológico (antimuscarínicos/β3-agonistas y estrógeno local en postmenopáusicas) e incluso considerar neuromodulación o toxina botulínica si es refractario²⁸, antes de plantear cirugía anti-incontinencia de esfuerzos.
Si en cambio predomina claramente el componente de esfuerzo y la paciente tiene escapes significativos, puede indicarse cirugía (sling suburetral sin tensión) sabiendo que el componente de urgencia podría persistir y requerir manejo complementario²⁹. Estudios han evaluado los resultados de las cintas suburetrales en pacientes con IUM: en general, las tasas de curación del componente de esfuerzo son algo menores que en IUE pura (por ejemplo, 56% vs 85–97% en un metanálisis)³⁰, y existe un pequeño riesgo de empeorar la urgencia postoperatoria (alrededor de 5–15% de pacientes pueden referir más urgencia tras la cirugía) ³¹.
Sin embargo, la mayoría de las pacientes con IUM mejoran globalmente después de tratar el componente de esfuerzo, especialmente si se combina con terapia médica/fisioterapia para la urgencia en el postoperatorio³². En el ensayo ESTEEM, se comparó sling aislado versus sling combinado con terapia conductual, ambos grupos experimentaron reducciones comparables en episodios de urgencia e incontinencia de urgencia, lo que demuestra que la cirugía por sí sola puede impactar favorablemente en la sintomatología mixta²⁵. Otro estudio mostró que adicionar kinesioterapia en el período perioperatorio de una cinta suburetral redujo significativamente los síntomas de urgencia y frecuencia urinaria a 12 meses³³.
Por tanto, en IUM es crucial una adecuada consejería preoperatoria: explicar que la cirugía de sling tiene altas probabilidades de eliminar las pérdidas con esfuerzo, pero que los síntomas de urgencia podrían persistir y requerir tratamientos adicionales. Aun así, combinando modalidades terapéuticas, muchas pacientes con IUM logran un control satisfactorio de ambos síntomas.
Pronóstico y consideraciones finales
El pronóstico de la incontinencia urinaria en la mujer depende del tipo, la severidad inicial, la edad de la paciente y las comorbilidades, así como de las terapias instauradas. En términos generales, la IU no tratada tiende a persistir e incluso progresar con el tiempo, dado que los factores de riesgo (edad, partos, obesidad) suelen acumularse en la vida de la mujer³⁴. Sin embargo, con un manejo adecuado, el pronóstico es muy favorable en la mayoría de los casos, logrando mejorías sustanciales e incluso la continencia completa.
Para la IUE (esfuerzo), las tasas de curación objetiva con tratamiento son altas. Las medidas conservadoras pueden resolver los casos leves, y hasta un 50% de mujeres jóvenes con IUE posparto recuperan la continencia solo con ejercicios y el proceso natural de recuperación tisular en los meses siguientes al parto³⁵. Intervenciones como la pérdida de peso tienen un impacto demostrable: estudios en mujeres con sobrepeso han mostrado que reducciones de ~5–10% del peso corporal se traducen en ~50% menos episodios de incontinencia³⁶. En casos moderados a severos, la cirugía con cinta suburetral ofrece tasas de éxito inicial del orden de 85–95%³⁷. A largo plazo (5–10 años), aproximadamente 70–80% de las pacientes operadas mantienen una continencia satisfactoria³⁸, aunque puede haber un porcentaje que presente recurrencia de IUE con los años y requiera un nuevo tratamiento³⁹. Las recurrencias a largo plazo se atribuyen a procesos de envejecimiento, cambios hormonales o deterioro progresivo del soporte pélvico.
En la IUU (urgencia/SVH), el pronóstico es más variable porque se trata de un síndrome crónico. Pocas veces la vejiga hiperactiva idiopática “se cura” definitivamente; más bien, se maneja en el tiempo⁴⁰. Muchos pacientes requieren tratamiento farmacológico continuo o intermitente a lo largo de los años. La buena noticia es que con la combinación de medidas (dietéticas, comportamiento, fármacos, etc.) la mayoría logra reducir sustancialmente la frecuencia de urgencias y escapes, mejorando su calidad de vida⁴¹. Algunos estudios sugieren que hasta un 20–30% de pacientes pueden entrar en remisión parcial o completa de síntomas de OAB en el largo plazo⁴², especialmente si han modificado factores contribuyentes (p. ej., control de diabetes, manejo de estreñimiento crónico, tratamiento de atrofia vaginal). Sin embargo, en mujeres muy añosas o con trastornos neurodegenerativos, la incontinencia de urgencia puede ser de manejo más difícil y suele persistir en cierto grado.
Es importante continuar el seguimiento, ya que el ajuste periódico del tratamiento (cambios de medicamento, dosis, refuerzo de medidas físicas) puede mantener los síntomas controlados. Asimismo, la aparición de nuevos síntomas (como retención) debe hacer reevaluar el diagnóstico.
En la IU mixta, el pronóstico dependerá de lograr controlar ambos componentes. Como se mencionó, la expectativa de curación total es menor que en IUE pura; aun así, muchas pacientes quedan satisfechas si al menos uno de los componentes se resuelve y el otro disminuye a un nivel manejable⁴³. Con un manejo multimodal (kinesioterapia + cirugía + tratamiento farmacológico), se puede conseguir continencia completa o casi completa en un porcentaje alto de casos, aunque puede requerir más tiempo y ajuste encontrar la combinación óptima.
Por último, cabe destacar que la incontinencia urinaria no pone en riesgo la vida de manera directa, pero sí se asocia a consecuencias indirectas importantes en la salud de la mujer, especialmente en edades avanzadas (como caídas, fracturas, infecciones cutáneas por humedad, depresión e incluso institucionalización) ⁴⁴. Estudios en población geriátrica han identificado la incontinencia como un marcador de fragilidad y predictor independiente de deterioro funcional y mortalidad⁴⁵. Por ello, tratar la incontinencia mejora no solo un síntoma, sino la salud global de la paciente, al posibilitar conservar su independencia, autoestima y participación social.
En conclusión, la incontinencia urinaria en la mujer es una condición prevalente y multifactorial cuyo manejo exitoso requiere un enfoque integral, basado en la mejor evidencia disponible y adaptado a las características individuales⁴⁶. En la última década se han incorporado importantes innovaciones –desde nuevas definiciones y clasificaciones que nos permiten precisar el diagnóstico, hasta terapias farmacológicas, tecnológicas y quirúrgicas más efectivas y menos invasivas–. Estos avances permiten ofrecer a nuestras pacientes una medicina personalizada, logrando altos índices de curación o alivio con mínima morbilidad.
Referencias Bibliográficas:
- Haylen BT, et al. An International Urogynecological Association (IUGA)/International Continence Society (ICS) joint report on the terminology for female pelvic floor dysfunction. Int Urogynecol J. 2010;21(1):5-26ics.orgics.org.
- Abrams P, et al. Evaluation and treatment of urinary incontinence, pelvic organ prolapse, and fecal incontinence. Abrams P (ed.), 6th International Consultation on Incontinence, 2017ics.orgics.org.
- Fritel X, et al. Female urinary incontinence, from pregnancy to menopause: a review of epidemiological and pathophysiological findings. Acta Obstet Gynecol Scand. 2012;91(8):901-910pubmed.ncbi.nlm.nih.gov.
- Milsom I, et al. Epidemiology of urinary incontinence (UI) and other lower urinary tract symptoms (LUTS), pelvic organ prolapse (POP) and anal incontinence (AI). In: Abrams P, Cardozo L, Wagg A, Wein A (Eds.), Incontinence 6th Ed. Vol. 1, 2017pmc.ncbi.nlm.nih.gov.
- Gomelsky A, Dmochowski RR. Impact of Overactive Bladder on Female Sexual Health. Curr Bladder Dysfunct Rep. 2019;14(1):67-72.
- Brading AF. A myogenic basis for the overactive bladder. Urology. 1997;50(6A Suppl):57-67.
- de Groat WC, Yoshimura N. Mechanisms underlying the synergy between pelvic floor muscle training and the treatment of overactive bladder. Int Urogynecol J. 2015;26(9):1275-1280.
- Kuismanen K, et al. The role of urinary and gut microbiota in stress urinary incontinence and overactive bladder: a systematic review. Eur Urol Focus. 2022;8(3):873-882sciencedirect.com.
- Gormley EA, et al. Diagnosis and Treatment of Overactive Bladder (Non-Neurogenic) in Adults: AUA/SUFU Guideline. J Urol. 2012;188(6 Suppl):2455-2463 (Actualizada 2019).
- Chapple CR, et al. A pooled randomized placebo-controlled trial of darifenacin in overactive bladder: analysis in patients ≥ 65 years. Curr Med Res Opin. 2007;23(10):2347-2358.
- Rovner ES, et al. Treatments for refractory overactive bladder: 2019 update. Curr Opin Urol. 2019;29(4):405-412.
- Plata M, et al. Eficacia de la neuromodulación tibial posterior percutánea en vejiga hiperactiva idiopática refractaria. Actas Urol Esp. 2015;39(7):496-501.
- MacDiarmid SA, et al. Efficacy and safety of mirabegron, a β3-adrenoceptor agonist, in patients with overactive bladder: results from North American and European pooled analysis. Urology. 2016;88:104-111.
- Rortveit G, et al. Urinary incontinence after vaginal delivery or cesarean section. N Engl J Med. 2003;348(10):900-907.
- Enhörning G. Simultaneous recording of intraabdominal and intravesical pressure. Acta Chir Scand. 1961;Suppl 276:1-68.
- Petros P, Ulmsten U. An integral theory of female urinary incontinence. Acta Obstet Gynecol Scand. 1990;69 Suppl 153:7-31.
- Swift S, et al. Pelvic Organ Support Study (POSST): the distribution, clinical definition, and epidemiologic condition of pelvic organ support defects. Am J Obstet Gynecol. 2005;192(3):795-806.
- Bump RC, et al. The standardization of terminology of female pelvic organ prolapse and pelvic floor dysfunction. Am J Obstet Gynecol. 1996;175(1):10-17.
- McGuire EJ, et al. Stress incontinence and detrusor instability. Neurourol Urodyn. 1988;7(3):563-567.
- Dumoulin C, et al. 2018 International Continence Society white paper on pelvic floor muscle training for urinary incontinence. Neurourol Urodyn. 2019;38(2):A16-A54.
- Araño P, et al. Incontinencia urinaria de esfuerzo: actualización en tratamiento no invasivo y mínimamente invasivo. Rev Chil Obstet Ginecol. 2020;85(2):156-168.
- Delorme E. Transobturator urethral suspension: mini-invasive procedure in the treatment of stress urinary incontinence in women. Prog Urol. 2001;11(6):1306-1313.
- Ford AA, et al. Mid-urethral sling operations for stress urinary incontinence in women. Cochrane Database Syst Rev. 2017;7:CD006375.
- Jung H, et al. Efficacy and safety of urethral bulking agents in the treatment of female stress urinary incontinence: a systematic review and meta-analysis. Int Urogynecol J. 2022;33(2):297-310.
- Iglesia CB, et al. The use of vaginal mesh for the treatment of stress urinary incontinence and pelvic organ prolapse: a review of safety, efficacy, and complications. Obstet Gynecol Surv. 2010;65(10):719-731.
- Espuña Pons M, et al. ICIQ-SF: validación del International Consultation on Incontinence Questionnaire-Short Form en la población española. Med Clin (Barc). 2004;122(8):288-292 scielo.isciii.es.
- Hay‑Smith EJC, et al. Pelvic floor muscle training versus no treatment for urinary incontinence in women. Cochrane Database Syst Rev. 2018;10:CD012433.
- Cameron AP, Chung DE, Dielubanza EJ, et al. The AUA/SUFU guideline on the diagnosis and treatment of idiopathic overactive bladder. J Urol. 2024. Apr 23. doi:10.1097/JU.0000000000003985
- Trutnovsky G, et al. Effects of pregnancy and childbirth on urinary incontinence and pelvic organ prolapse in urogynecologic patients. Eur J Obstet Gynecol Reprod Biol. 2016;205:44-48pubmed.ncbi.nlm.nih.gov.
- Campbell P, et al. Mobile app self-management for urinary incontinence: a randomized controlled trial. JAMA Intern Med. 2020;180(11):1487-1494news-medical.netnews-medical.net.
- Sikora M. Current Treatment of Stress Urinary Incontinence by Bulking Agents and Laser Therapy—An Update. J Clin Med. 2023;12(5):1377mdpi.commdpi.com.
- Dwyer PL, Lee E, Rosamilia A. Urethral plugs for female stress urinary incontinence: a systematic review. Int Urogynecol J. 2014;25(8):1103-1110.
- Farrell SA, Baydock S, Amir B, et al. Urethral plugs for the treatment of stress urinary incontinence: a randomized controlled trial. Obstet Gynecol. 2007;109(4):1001-1007.
- The Canadian Continence Foundation. Uresta bladder support for stress urinary incontinence. 2024. Disponible en: www.canadiancontinence.ca
- Wu H, Wang Y, Zhang W, et al. High-intensity focused ultrasound (HIFU) in gynecology: A review. J Ultrasound Med. 2020;39(5):893-908.
- Zhang Y, et al. Efficacy of high-intensity focused ultrasound for treatment of female stress urinary incontinence: a pilot study. Front Med. 2022;9:827584.
- International Urogynecological Association (IUGA) position statement. Energy-based therapies for female pelvic floor disorders. 2022.
- American Urological Association (AUA) / Society of Urodynamics, Female Pelvic Medicine & Urogenital Reconstruction (SUFU). Guideline on the Diagnosis and Treatment of Idiopathic Overactive Bladder. 2024.
- Sung VW, Borello‑France D, Newman DK, Richter HE, Lukacz ES, Moalli P, Weidner AC, Smith AL, Dunivan G, Ridgeway B, Nguyen JN, Mazloomdoost D, Carper B, Gantz MG; Pelvic Floor Disorders Network. Effect of behavioral and pelvic floor muscle therapy combined with midurethral sling surgery vs surgery alone on incontinence symptoms among women with mixed urinary incontinence: the ESTEEM randomized clinical trial. JAMA. 2019 Sep 17;322(11):1066–1076. doi:10.1001/jama.2019.12467
- Peters KM, Carrico DJ, Perez‑Marrero RA, et al. Percutaneous tibial nerve stimulation for overactive bladder syndrome: a randomized trial (SUmiT). J Urol. 2010;183(4):1438‑43.
- Moossdorff‑Steinhauser HF, Berghmans B. Effects of percutaneous tibial nerve stimulation on adult patients with overactive bladder syndrome: a systematic review. Neurourol Urodyn. 2013;32(3):206‑14.
- Araujo BF, Varella LRL, Lopes MHBM. Mobile health application in pelvic floor muscle training for urinary incontinence: A systematic review. J Wound Ostomy Continence Nurs. 2020;47(3):250-256.
- Dufour S, Hiltz A, Forget MJ, Vandyken C, Hall LM. A physiotherapy practice survey of pelvic floor muscle training for urinary incontinence. Int Urogynecol J. 2019;30(9):1517-1525.
- Goode PS, Burgio KL, Richter HE, Markland AD. Pelvic floor muscle training in the treatment of urinary incontinence in women: A systematic review and meta-analysis. Am J Obstet Gynecol. 2020;222(6):556-565.
- Wadensten B, Friberg A, Lundgren T. Effectiveness of app-based pelvic floor muscle training for stress urinary incontinence: A randomized controlled trial. JMIR Mhealth Uhealth. 2021;9(3):e28751.
- Bump RC, Hurt WG, Fantl JA, Wyman JF. Assessment of Kegel pelvic muscle exercise performance after brief verbal instruction. Am J Obstet Gynecol. 1991;165(2):322-327.

