BALANITIS Y BALANOPOSTITIS
Se define la balanopostitis (BP) como una inflamación común que afecta el glande y el prepucio, caracterizada por eritema, edema, erosión, ulceración y secreción de esmegma, con síntomas que incluyen malestar, picazón y mal olor.
Cuando la inflamación afecta el prepucio hablamos de postitis. Estas frecuentemente van asociadas a inflamación del glande, a lo que se denomina balanopostitis; por la similitud de los cuadros muchos emplean indistintamente ambos términos. Dada que para la existencia de una postitis es necesario que exista prepucio, la balanopostitis no puede presentarse en pacientes circuncidados1.
Se estima que entre el 3-11% de los hombres presentarán una balanitis en algún momento de su vida. Estudios han demostrado que la presencia de circuncisión disminuye la incidencia de balanitis en un 68%, y los pacientes que han presentado balanitis tienen un aumento del riesgo de cáncer de pene de 3.8 veces2.
Muchas de estas balanitis son en la práctica simple intertrigo, es decir, la inflamación por sobrecrecimiento bacteriano o fúngico entre las dos capas de piel, la cual se resuelve con el uso de medidas generales de aseo y adecuado secado de la zona. Muchos pacientes se automedican con cremas antifúngicas obtenidas en la farmacia, con buenos resultados3.
Las causas de balanitis se pueden agrupar en infecciosas, inflamatorias y pre-neoplásicas (Tabla 1). En este artículo sólo se atenderán las de mayor frecuencia dado lo extenso del tema.
| Infecciosas |
|
| Dermatosis inflamatorias |
|
| Irritantes o Alérgicas |
|
Tabla 1. Causas de Balanitis
El ambiente húmedo y cálido bajo el prepucio es una condición ideal para el crecimiento de bacterias y hongos como Candida albicans, que habitualmente es parte de la flora de la zona; el cambio de pH determina el desbalance de la flora favoreciendo el crecimiento de hongos. La falta de higiene y la existencia del prepucio asociado a la acumulación de esmegma son las condiciones que determinan la principal causa de balanitis, que es la balanitis por C. albicans. No obstante, existen otros agentes infecciosos que también pueden causar balanitis, como se describe en la Tabla 1 y que deben ser sospechados según los antecedentes clínicos y las características al examen físico. Aunque los datos no muestran una relación causal directa entre balanitis y la existencia de prepucio, la circuncisión es un factor protector para la presencia de balanitis4.
Los factores de riesgo identificados para desarrollar una balanitis son:
- Presencia de prepucio
- Obesidad mórbida
- Pobre higiene
- Diabetes (especialmente si está descompensada), probablemente por presencia de glucosa en la piel proveniente de la orina.
- Pacientes institucionalizados
- Pacientes con recolector tipo condón
- Sensibilidad a irritantes químicos (jabones, lubricantes, etc.)
- Condiciones que determinen edema genital.
- Infecciones de transmisión sexual.
El consenso de expertos clasifica la BP en infecciosa y no infecciosa. La BP infecciosa se debe a patógenos como hongos y bacterias, mientras que la no infecciosa ocurre por causas desconocidas en ausencia de infecciones obvias, donde encontramos causas inflamatorias, alérgicas, por agentes irritantes y lesiones premalignas.
Correlación de la colonización microbiana y actividad sexual
En un estudio de cohorte de 478 hombres con BP y en individuos asintomáticos, la prevalencia de colonización por Candida fue del 26.2%, y la prevalencia de balanitis candidiásica fue del 18%. También se han reportado Malassezia, Staphylococcus aureus y Streptococcus del grupo B en pacientes con BP. Se han observado altas tasas de cocos grampositivos, hongos y Mycoplasma en casos de BP. Mycoplasma genitalium estuvo presente en el 37% de los pacientes con BP, mientras que Chlamydia trachomatis y Ureaplasma urealyticum no mostraron asociación3.
Aunque la BP no se considera una enfermedad de transmisión sexual (ITS) en sí misma, puede transmitirse a través del contacto sexual, siendo la infección por Candida la causa principal. Se recomienda evitar la actividad sexual durante la terapia antifúngica.
Generalmente las lesiones del pene suelen estar subdiagnosticadas por el estigma social que representa la consulta. El diagnóstico puede ser difícil por la tardanza en la consulta, la imposibilidad de retraer el prepucio, por sobreinfección o por irritación por el uso de jabones antisépticos que contengan sustancias irritantes5, generando mayor edema o úlceras, además de la gran variedad de diagnósticos diferenciales que plantea, dermatológicos, infecciosos y tumorales. El diagnóstico debe basarse en la anamnesis, antecedentes de fimosis, enfermedades crónicas como Diabetes Mellitus, tiempo de evolución, tratamientos ya recibidos, historia sexual y la exploración física; en algunas ocasiones, es necesario realizar pruebas complementarias, tanto microbiológicas como posible biopsia diagnóstica6.
La balanitis se puede presentar a cualquier edad del paciente, en los primeros años debido a la fimosis fisiológica y a la dificultad de la higiene, y en adultos debido a la actividad sexual y la existencia de enfermedades que aumentan el riesgo como diabetes y otras enfermedades inmunosupresoras.
Historia y examen físico
Aunque frecuentemente se omiten en la anamnesis, los antecedentes son muy importantes para establecer el diagnostico etiológico: los antecedentes sexuales del paciente, la existencia de otras enfermedades como artritis, diabetes, enfermedades dermatológicas, etc; la recurrencia del cuadro, los hábitos higiénicos del paciente, el consumo de medicamentos, etc., son elementos de importancia al intentar establecer un factor causal. Por lo general la sintomatología es inespecífica: prurito, ardor y dolor son los síntomas más frecuentes. Los hallazgos del examen físico establecen el diagnóstico, donde podemos ver eritema, edema del prepucio, pápulas, vesículas y úlceras, fimosis reactiva, adenopatías en caso de sobreinfección. La balanitis en si es un diagnóstico fácil, ya que el sólo el examen físico hace el diagnostico, pero la causa de esta es importante para un adecuado tratamiento. Se ha señalado de utilidad realizar penoscopia en caso de balanitis inflamatorias7.
El examen de la piel no genital es importante también para descartar otras afecciones que pueden afectar a mucosas y piel como en la balanitis psoriática. Por último, la toma de biopsia puede ser necesaria en balanitis persistente o refractarias al tratamiento
Ante la duda es conveniente tomar exámenes de laboratorio como cultivos en caso de presencia de secreciones o serológicos para descartar ITS
.
Tratamientos
Medidas generales
Ante la presencia de un paciente con balanitis es importante realizar medidas generales para el manejo de los síntomas y la promoción de un ambiente saludable para la resolución. Es crucial evitar el uso de jabones irritantes, ya que pueden exacerbar la inflamación. Se recomienda un aseo frecuente para eliminar secreciones y mantener la zona seca, lo que crea un ambiente hostil para los microorganismos. Asimismo, evitar la actividad sexual favorece la resolución del cuadro.
Además, es necesario un manejo específico según el factor causal. La Tabla 2 resume el manejo de las diferentes causas de balanitis. En este capítulo nos referiremos a las causas más frecuentes de ellas.
Balanitis infecciosas
Balanitis candidiásica: principal causa de balanitis infecciosa8, en un 30-35%9. Se manifiesta clínicamente por lesiones eritematosas, brillantes, con pápulas y pústulas satélites, en ocasiones, exudado blanquecino (smegma). El diagnóstico generalmente es clínico y no suele requerir más exámenes. Puede confirmarse con cultivo de la zona subprepucial o realizar preparaciones con hidróxido de potasio para estudios fungicos o coloración de Gram. Si es recidivante se debe descartar Diabetes Mellitus mediante examen de orina y glicemia y, en casos de mayor severidad, descartar otras causas de inmunosupresión10.
Aunque no es una enfermedad de trasmisión sexual, se puede realizar prueba diagnóstica o tratamiento empírico de la pareja sexual para evitar la reinfección, ya que esto disminuye el reservorio de cándidas en la pareja10. Principalmente en los pacientes diabéticos que presentan balanitis recurrente, además de un buen control metabólico de su enfermedad, se pueden usar cremas con antimicóticos en forma periódica o realizar una circuncisión, la que disminuye los riesgos de recidiva en el 68% de los casos. También está indicada la circuncisión en los pacientes con fimosis secundaria a balanitis recurrente.
Balanitis bacteriana: caracterizada por inflamación del prepucio junto a secreción de mal olor. En ocasiones se asocia a adenopatías inguinales. Generalmente se da como una sobreinfección de una balanitis micótica o en condiciones de solución de continuidad de la piel o mucosa genital. Se diagnostica por cultivo del exudado sub-prepucial por tinción de Gram. El tratamiento en general es según antibiograma. Una de las causas frecuentes es la Gardnerella vaginalis. Una respuesta rápida al tratamiento con metronidazol también puede confirmar la causa anaeróbica de la infección.
Balanitis Xerótica Obliterante (Liquen Escleroso)
Es la primera causa de balanitis inflamatorias. Descrita por primera vez en 1887, la Balanitis Xerótica Obliterante (BXO), se considera el nombre específico del liquen escleroso (LS) en hombres, puede aparecer a cualquier edad, aunque la edad media del diagnóstico se sitúa alrededor de los 40 años11. En los hombres, existe una débil asociación con la autoinmunidad a diferencia del liquen escleroso en el sexo femenino12,21.
La etiología y patogénesis del LS aún no se comprenden completamente. Se sugiere una predisposición genética y familiar. Factores como el trauma frecuente, el estado hormonal, el ambiente oclusivo y húmedo y la exposición crónica a la orina podrían influir13. Existe un papel controvertido de la Borrelia burgdorferi y el virus de Epstein Barr en su patogenia11. Se ha observado una asociación con el VPH-16 en el prepucio, pero su papel patogénico es dudoso14. No hay infecciones específicas que la desencadenen.
Clínicamente BXO se caracteriza por la aparición de lesiones blanquecinas o blanco azuladas, de aspecto «acartonado» en el glande y/o la superficie interna del prepucio. Esto puede llevar a una fimosis progresiva en prepucios previamente retráctiles o a adhesiones del prepucio al glande. Síntomas comunes incluyen prurito y dolor, a veces acompañados de disuria. Puede haber hipopigmentación de la porción distal del prepucio, eritema, telangiectasias, púrpura y cicatrización. En algunos casos, pueden presentarse erosiones, úlceras e incluso lesiones ampollosas.
La afectación del meato uretral externo puede ocurrir en aproximadamente el 17% de los pacientes, lo que se asocia con disuria y un flujo urinario deficiente20. La estenosis del meato puede aparecer años después de la manifestación inicial del LS, sin signos de enfermedad persistente o recurrente21.
El diagnóstico suele ser clínico, pero en ocasiones es necesaria la biopsia, aunque no siempre es concluyente, siendo fundamental la correlación clínico-patológica. Es importante destacar que el diagnóstico clínico puede subestimar la presencia de LS en niños.
El tratamiento se basa en el uso de corticoides tópicos potentes (como propionato de clobetasol 0.05% o furoato de mometasona 0.1%) aplicados hasta la remisión de las lesiones (2-16 semanas), con la posibilidad de mantenimiento semanal. La circuncisión con resección completa del prepucio sigue siendo el tratamiento definitivo. La prepucioplastia combinada con inyección intralesional de esteroides es una alternativa, aunque con mayor tasa de recaída que la circuncisión.
Las recurrencias son poco frecuentes después de una extirpación completa del prepucio, pero el prepucio residual en circuncisiones parciales mostró enfermedad recurrente en el 50% de los pacientes. La afectación del glande y el meato son factores pronósticos negativos para la estenosis del meato y las estenosis uretrales proximales. Las dilataciones periódicas de las estenosis son una opción quirúrgica, pero es poco probable que sean una solución permanente. Las estenosis de más de 2 cm, las estenosis uretrales recurrentes o las del pene pueden beneficiarse de la uretroplastía primaria.
Existe un riesgo potencial de transformación maligna a carcinoma de células escamosas (CCE) 20, lo cual indica seguimiento periódico del paciente. Se estima que entre el 4% y el 13.4% de los casos de MGLS (liquen escleroso genital masculino) pueden desarrollar CCE.
Balanitis por reacciones alérgicas o irritantes
Dermatitis de contacto alérgica: su etiología puede variar por sensibilización a múltiples factores: látex de preservativo, lubricantes de condones, desodorantes de higiene femenina, anestésicos locales, etc. manifestándose como reacción alérgica inmediata, mediada por IgE. La reacción de hipersensibilidad también puede ser retardada al látex o a productos químicos añadidos al látex durante la fabricación18. La manifestación clínica se caracteriza por eritema, edema y posible aparición de microvesículas y exudado. El diagnóstico se basa en la clínica y puede requerir valoración dermatológica para la realización de pruebas alérgicas mediante test cutáneo18.
Dermatitis de contacto irritante: se produce principalmente en el área de contacto con ciertos irritantes como jabones, detergentes, medicamentos tópicos, etc. Es el resultado de un daño físico o químico no inmunológico en la piel. Clínicamente las lesiones son eritematosas y pueden ser exudativas y con costra. Si la exposición al agente se mantiene, la piel puede sufrir una reacción de liquenificación, inflamación o hiperqueratosis.
Exantema fijo medicamentoso: Son lesiones que aparecen de forma característica en el mismo sitio coincidiendo con la administración de un fármaco. Clínicamente se presenta de forma habitual como un nódulo endurecido, eritematoso, hiperpigmentado, indurado con vesícula central, aunque puede manifestarse de otras formas como eritema no pigmentado, urticaria, etc. Ocasionalmente imita al liquen plano, eritema multiforme, etc. Las lesiones en los genitales masculinos aparecen de forma muy frecuente con cotrimoxazol19. Otros fármacos implicados en esta patología pueden ser: tetraciclina, metamizol, fenilbutazona, paracetamol, AAS, metronidazol, amoxicilina, eritromicina, etc.
El diagnóstico se basa en una correcta historia clínica y una revisión de la medicación asociada al paciente, en la reaparición de las lesiones al reintroducir el fármaco y en la biopsia.
Lesiones premalignas
Se han identificado diversos factores de riesgo para su desarrollo. Los más importantes son la presencia de fimosis (BP crónicas, infecciones de repetición, liquen escleroso y escleroatrófico o Diabetes Mellitus), mala higiene del pene y la infección por VPH. Otros factores de riesgo son BXO, la fototerapia tipo PUVA sin protección genital, tabaquismo, condilomas acuminados o inmunosupresión. El carcinoma de pene se desarrolla generalmente sobre lesiones preexistentes20.
- Bajo riesgo: Papulosis bowenoide (el riesgo es mayor si asocia inmunosupresión)
- Riesgo intermedio: BXO.
- Alto riesgo: enfermedad de Bowen (sobre piel queratinizada) y eritroplasia de Queyrat (piel no queratinizada).
Tratamiento específico
Terapia Tópica: los corticoides tópicos son la primera línea de tratamiento para la balanitis inflamatoria, incluyendo BXO. El propionato de clobetasol (PC) al 0.05% en ungüento es el estándar de oro, y se aplica una vez al día durante 1 a 3 meses en hombres. En un estudio retrospectivo sobre LS genital masculino, el PC tópico durante 3 meses, con una frecuencia de aplicación decreciente, tuvo éxito en casi el 60% de los casos, evitando la necesidad de circuncisión. En niños, el PC al 0.05% aplicado durante 3 meses también es el tratamiento más eficaz para inducir la remisión y manejar los síntomas. El uso de corticosteroides tópicos como el furoato de mometasona o la crema de betametasona puede prevenir la circuncisión hasta en un 35% de los casos en niños.
Los inhibidores de la calcineurina, como el tacrolimus al 0.1% o el pimecrolimus al 1% en crema, aplicados una o dos veces al día durante 1-2 meses, pueden considerarse una alternativa en caso de falla o intolerancia al propionato de clobetasol. En niños, el tacrolimus al 0.03% es seguro y efectivo13. Sin embargo, el propionato de clobetasol parece ser más efectivo y debe seguir siendo la terapia de primera línea.
Para la balanitis candidiásica, los agentes antifúngicos tópicos recomendados incluyen ketoconazol al 2%, butenafina clorhidrato al 1%, clotrimazol al 1% y bifonazol al 1% (dos veces al día por 1-2 semanas), y luliconazol al 1% (una vez al día por 1-2 semanas). También se puede usar pimecrolimus (dos veces al día por 14 días)16.
Para las infecciones bacterianas, los antibióticos tópicos recomendados incluyen eritromicina, mupirocina (dos veces al día) y ácido fusídico al 2% (tres veces al día) por 7-14 días17. El metronidazol al 0.75% tópico puede usarse para infecciones bacterianas anaeróbicas leves18.
Terapia Sistémica: en casos de balanitis micótica severa, se pueden usar antifúngicos orales como fluconazol (dosis única de 150 mg), itraconazol (200 mg una vez al día por 5 días) y terbinafina (250 mg una vez al día por 1-2 semanas). Para casos severos o refractarios a los antibióticos tópicos, se pueden requerir antibióticos orales como fosfomicina trometamina (3 g una vez al día por 3 días) o eritromicina (500 mg una vez al día por 1 semana)20. El metronidazol oral (400-500 mg dos veces al día por 1 semana) se sugiere para casos severos de infecciones anaeróbicas. La terapia combinada antibacteriana y antifúngica tópica se recomienda para la BP refractaria, especialmente en pacientes con condiciones subyacentes como Diabetes Mellitus.
La terapia sistémica para el LS suele indicarse esporádicamente, reservándose para casos de LS extragenitales extensos o resistentes al tratamiento tópico estándar. Se ha demostrado que los corticosteroides en dosis altas pulsadas combinados con metotrexato en dosis bajas mejoran la condición clínica en el LS extragenital generalizado refractario. Los retinoides sistémicos, como la acitretina y el etretinato, han sido efectivos en el LS extragenital y en casos severos de LS genital cuando otras terapias han fallado.
Tratamiento Quirúrgico: la circuncisión con resección completa del prepucio sigue siendo el tratamiento definitivo para BXO, con uretroplastía distal en caso de compromiso del meato uretral, como ya se ha señalado. En caso de balanitis recurrente debido a la mala respuesta a la terapia médica, se puede considerar la circuncisión como alternativa, ya que permite mantener la zona más limpia y seca, evitando la proliferación fúngica o bacteriana. La circuncisión también está indicada en aquellos pacientes con balanitis asociado a fimosis.
| Etiología | Tratamiento recomendado | Alternativa |
| Balanitis candidiásica |
|
|
| Balanitis por anaerobios |
tópico. |
|
| Balanitis por aerobios |
|
|
| Balanitis por herpes |
|
|
| BXO |
|
|
| Liquen plano |
|
|
| Balanitis de Zoon |
|
|
| Psoriasis |
|
|
| Balanitis circinada |
|
|
| Balanitis alérgica-irritante |
|
|
| Exantema fijo medicamentos |
|
|
| Eritroplasia de Queyrat Enfermedad de Bowen |
|
|
| Papulosis Bowenoide |
|
|
Tabla 2. Tratamiento según etiología
FIMOSIS Y PARAFIMOSIS
Evaluación
Al evaluar los pacientes es importante establecer el tiempo de evolución para determinar si es congénita o secundaria. Dentro de los antecedentes mórbidos es importante indagar sobre la presencia de Diabetes Mellitus y otras enfermedades dermatológicas que pueden afectar el prepucio. Los exámenes de laboratorio no son relevantes en esta patología ya que los antecedentes y el examen físico son suficientes para establecer el diagnóstico25. En el examen físico es importante evaluar las características de la piel del prepucio, presencia de cicatrices y zonas despigmentadas, que son sugerentes de fimosis secundaria a balanitis a repetición o a la presencia de BXO26.
Tratamiento
El tratamiento de la fimosis fisiológica no está indicado y se debe educar a los padres y explicarles la evolución natural de esta condición, actualmente por ello está contraindicado el realizar masaje peneano. En caso de presentar infecciones urinarias, se podría evaluar una circuncisión profiláctica precoz.
Dentro de las alternativas de tratamiento podemos encontrar tratamientos de tipo quirúrgico y no quirúrgicos.
Tratamientos alternativos a la cirugía: se ha descrito como alternativa la retracción manual bajo anestesia con liberación de adherencias con buenos resultados, llegando al 62% de resolución total de la patología, pero con riesgo de re-adherencias al glande, evolucionar a fimosis secundaria por lesión del prepucio y cicatrización de la zona, aparición de BXO y riesgo de parafimosis27,28.
El uso de corticoides tópicos para tratar la fimosis en niños tiene buenos resultados, con tasas de éxito entre el 67-95%. Se utilizan principalmente corticoides de alta potencia, aunque también el uso de estos de potencia media o baja tienen buenas tasas de éxito, llegando al 84%. Los esquemas de aplicación son muy variados, pero la mayoría está de acuerdo en aplicarlos durante por lo menos 4 a 6 semanas. Las complicaciones de este tipo de tratamientos son prácticamente inexistentes. Los efectos antiinflamatorios, inmunosupresores y el adelgazamiento de la piel que provocan los corticoides, explica la eficacia del tratamiento29,30.
Se ha reportado además el uso de cremas de estrógenos, con tasas de respuesta entre 76-100%. La aparición de ginecomastia como reacción adversa se ha señalado en varias publicaciones, por lo cual actualmente no se sugiere su uso31.
Opciones quirúrgicas
Incisión dorsal: esta técnica se reserva prácticamente como tratamiento de la parafimosis, para liberar el anillo estenótico y resolver la urgencia. Aunque también se ha usado en pacientes añosos y niños con buena tasa de resolución de la fimosis, pero malos resultados estéticos, por lo que se considera actualmente una opción sólo para pacientes adultos mayores con riesgo para recibir anestesia, ya que este procedimiento se realiza con anestesia local32,33.
Prepucioplastia: esta técnica se ha desarrollado para solucionar la fimosis principalmente en niños cuyos padres no quieren la resección del prepucio, condición habitual en Japón. La técnica consiste en incisiones longitudinales en el prepucio con suturas transversales, lo que libera la estenosis, manteniendo un buen aspecto estético. Dentro de las opciones están las incisiones laterales para no comprometer la zona del frenillo ni la zona dorsal, con el fin de mantener el aspecto estético; las incisiones múltiples en Y-V, la plastia en T-V 34 y la V con plastia en Z. Todas estas técnicas buscan resolver la fimosis con tasas de éxito de más del 90% preservando el prepucio, con una satisfacción cosmética del 80%35.
Circuncisión: es la resección quirúrgica del prepucio dejando expuesto el glande. En general se pueden considerar 3 tipos de circuncisión:
- Circuncisión ritual: que es la primera causa de circuncisión en el mundo; se da en la comunidad judía y musulmana. En la creencia judía, la circuncisión es un pacto entre Dios y Abraham como está escrito en la biblia (Génesis) y se realiza cuando el niño tiene 8 días de vida36. En la población musulmana se considera una tradición del profeta Mahoma y se realiza al introducir al niño en la comunidad islámica religiosa, antes de la adolescencia37.
- Circuncisión profiláctica: es cuando se realiza la circuncisión para prevenir las infecciones urinarias en los niños. Las adherencias balanoprepuciales se consideran las responsables de la colonización del prepucio por patógenos y la causal de las balanopostitis o ITUs. Se ha informado que la incidencia de ITUs en lactantes es menor en niños circuncidados38, aunque se puede esperar la maduración del prepucio y la resolución espontánea de la fimosis, la circuncisión está indicada en pacientes con infecciones recurrentes.
La circuncisión profiláctica también se puede realizar para reducir la incidencia de ITS. En diversos estudios se ha encontrado asociación entre la circuncisión y la disminución de ITS, esto principalmente en chancroide, sífilis, herpes genital y uretritis gonocócica, aunque sin clara asociación con las uretritis no gonocócicas y los condilomas39. Con respecto al VIH, tres ensayos controlados confirmaron que la tasa de infección de hombres con parejas seropositivas fue 55-76% menor en el grupo de pacientes circuncidados40. Esto tiene sentido biológico porque las células de Langerhans superficiales que expresan receptores de VIH-1 son más frecuentes en el prepucio que en el resto del pene; además la queratinización del glande luego de la circuncisión es un factor protector a los traumas menores del coito. Los estudios han demostrado que el número necesario a tratar (NNT) para evitar un contagio de VIH es de 5 a 15 cirugías41.
La circuncisión profiláctica para prevenir el cáncer de pene es otra condición que está ampliamente demostrada. El cáncer de pene se da en pacientes con bajos estándares de higiene, la presencia del prepucio y la acumulación de esmegma bajo el prepucio, que tiene efectos irritantes, son los factores determinantes del aumento del riesgo de cáncer de pene. La fimosis está presente en el 25 a 75% de los pacientes con cáncer de pene. La circuncisión es un factor protector bien establecido: en la población judía donde el cáncer de pene es casi inexistente42, la circuncisión neonatal disminuye el riesgo al menos en 10 veces, lo mismo se ha visto en la población musulmana que circuncidan a los niños antes de la pubertad. La circuncisión en adulto no ofrece protección contra el desarrollo del cáncer de pene, lo que sugiere la necesidad de un cierto periodo de exposición al efecto carcinogénico del esmegma. La incidencia de cáncer de pene es menor a 1 por 100.000 en países desarrollados, por lo cual, dada la rareza de esta enfermedad, la circuncisión no está justificada con el único propósito de proteger contra el cáncer de pene.
- Circuncisión terapéutica: está indicada cuando el paciente presenta una fimosis secundaria. Esta puede ser por balanitis recurrentes, como se da en pacientes diabéticos, cuando una fimosis congénita no se resuelve espontáneamente y en presencia de BXO. La técnica quirúrgica es similar sea cual sea la causa de la circuncisión y consiste en la resección del manguito de piel estenótica que no permite la retracción del prepucio; existen diferentes técnicas de resección sin variaciones en los resultados finales. Los pacientes con fimosis, además de los problemas infecciosos ya descritos, pueden presentar problemas en el coito por dispareunia y parafimosis.
Nuevos antecedentes en técnicas de circuncisión: Uso de Dispositivos
Un metaanálisis reciente de Hohlfeld et al.43 ha comparado los dispositivos de circuncisión con las técnicas quirúrgicas estándar en adolescentes y adultos (mayores de 10 años), incorporando evidencia de 18 ensayos controlados aleatorios con un total de 5246 participantes. Este estudio ofrece importantes perspectivas sobre la seguridad, el tiempo operatorio, el dolor postoperatorio y la satisfacción del paciente:
- Eventos adversos graves: no se reportaron eventos adversos graves en ninguno de los grupos (dispositivos vs. técnicas estándar), lo que sugiere que probablemente hay poca o ninguna diferencia en este aspecto. La certeza de la evidencia fue moderada44.
- Eventos adversos moderados: podría haber un ligero aumento en los eventos adversos moderados (que requieren intervención como suturas o antibióticos) cuando se utilizan dispositivos en comparación con las técnicas quirúrgicas estándar (RR 1.31, IC 95% 0.55 a 3.10; I2=68%; 10 ensayos, 3370 participantes; evidencia de baja certeza). Esto se traduce en aproximadamente 8 eventos adversos moderados más por cada 1000 participantes. Los análisis de subgrupos sugirieron que los dispositivos de ligadura podrían tener una tasa menor de eventos adversos moderados que los dispositivos de aplastamiento45.
- Eventos adversos leves: la evidencia es incierta sobre la diferencia en eventos adversos leves (que requieren poca o ninguna intervención, como sangrado menor) entre los grupos (RR 1.09, IC 95% 0.44 a 2.72; I2=91%; 10 ensayos, 3370 participantes; evidencia de muy baja certeza)46.
- Tiempo operatorio: el tiempo operatorio es probablemente alrededor de 17 minutos más corto cuando se utiliza un dispositivo en lugar de técnicas quirúrgicas estándar (MD -17.26 minutos, IC 95% -19.96 a -14.57; I2=99%; 14 ensayos, 4812 participantes; evidencia de certeza moderada). La técnica quirúrgica estándar generalmente toma alrededor de 24 minutos. Los dispositivos de aplastamiento mostraron una reducción mayor en el tiempo operatorio que los dispositivos de ligadura47.
- Dolor postoperatorio:
- Primeras 24 horas: puede haber menos dolor si se utilizan dispositivos de circuncisión en comparación con las técnicas quirúrgicas estándar (MD -1.30 cm, IC 95% -2.37 a -0.22; I2=99%; 9 ensayos, 3022 participantes; evidencia de baja certeza)48.
- Primeros 7 días: podría haber poca o ninguna diferencia en el dolor postoperatorio experimentado durante los primeros siete días en comparación con las técnicas quirúrgicas estándar (MD 0.11 cm, IC 95% -0.89 a 1.11; I2=94%; 4 ensayos, 1430 participantes; evidencia de baja certeza)49.
- Satisfacción del participante: los participantes pueden preferir ligeramente los dispositivos de circuncisión en comparación con las técnicas quirúrgicas estándar (RR 1.19, IC 95% 1.04 a 1.37; I2=97%; 15 ensayos, 4501 participantes; evidencia de baja certeza)50.
A pesar de la reducción del tiempo operatorio y la posible disminución del dolor inicial, se destaca la necesidad de ensayos de alta calidad para proporcionar mayor certeza sobre las tasas de efectos adversos y el dolor postoperatorio con el uso de dispositivos51.
Parafimosis
Es una urgencia urológica en la que el prepucio sufre una retracción más allá del surco coronal del glande, sin poder recuperar su posición natural. Esto provoca una alteración del retorno venoso determinando ingurgitación venosa dolorosa y edema del glande y del prepucio a distal del anillo estenótico. En caso de no solucionar el problema, puede presentar ulceraciones y necrosis de los tejidos encarcelados. Aunque se puede presentar en pacientes sin fimosis, esta generalmente se presenta en aquellos que tienen algún grado de fimosis.
Este problema se produce en pacientes no circuncidados y se puede presentar a cualquier edad: en lactantes con fimosis fisiológica, luego de aseo genital o en adultos donde la causa principal es iatrogénica, al omitir volver el prepucio a su posición natural luego de procedimientos urológicos, o luego de prácticas sexuales52.
A pesar de la frecuencia de fimosis fisiológica en el niño, la incidencia de parafimosis es baja llegando al 0,2%, muy por debajo de alteraciones como la balanitis con una incidencia de 5,9%53,54.
El cuadro es por lo general fácil de diagnosticar: El paciente consulta por dolor y edema a nivel peneano, con incapacidad de devolver el prepucio a su posición natural; puede presentar dificultad miccional y disuria. El examen físico por lo general no establece dudas del cuadro y debe evaluarse cuidadosamente la perfusión de la zona afectada. Aunque la evaluación física es por lo general evidente, debe tenerse presente que balanopostitis, estados edematosos, angioedema y picaduras de insectos con reacciones alérgicas, pueden ser diagnósticos diferenciales.
El objetivo del tratamiento es tratar los síntomas y lograr la reducción del prepucio. Por lo general el dolor es moderado y para poder manipular la zona y reducir el prepucio se aconseja el uso de analgésicos endovenosos. En los niños en necesaria en ocasiones la sedación para poder realizar maniobras de reducción.
También es útil el uso de anestésicos locales ya se tópico con lidocaína al 2% durante 15 minutos cubierto con una gasa para favorecer su absorción, o bloqueo troncular a nivel del nervio dorsal del pene con lidocaína al 1%.
La reducción manual por lo general es factible cuando el cuadro no tiene muchas horas de evolución; en los casos de reducción difícil se pueden realizar diversas maniobras para facilitarla:
- Vendaje compresivo elástico y frío local: Esta maniobra es útil siempre que no esté lesionada la piel55.
- Uso de agentes osmóticos: Dextrosa al 50% o Manitol al 20% en la superficie cutánea por 30-45 minutos empapando una gasa sobre la zona afectada56, provoca disminución del edema por osmosis.
- Técnica de Perth-Dundee: que consiste en puncionar con aguja fina repetidamente la zona edematosa del prepucio, asociado a compresión suave, permite el drenaje del líquido facilitando la reducción57.
En caso de que estas maniobras no sean suficientes para resolver el problema, es posible realizar procedimientos invasivos como:
- Punción-aspiración: bajo bloqueo anestésico con un torniquete en la base del pene, realizando una punción del glande con una aguja 20 G y aspirando aproximadamente 10 ml. se logra bajar el volumen distal del pene58.
- Incisión longitudinal del anillo estenótico: a nivel dorsal o lateral, que luego de la reducción se puede completar con suturas transversales con material reabsorbible.
Resuelta la urgencia se aconseja realizar la circuncisión en forma diferida, una vez se resuelva el edema de la zona y las alteraciones de la perfusión.
DOLOR TESTICULAR CRÓNICO
Introducción
El dolor testicular crónico se define como 3 meses de dolor testicular constante o intermitente, el cual es significativamente molesto para el paciente.
Es la causa de alrededor de 2.5 a 5% de todas las consultas urológicas. Cuando no puede ser atribuido directamente a una causa específica o identificable, se denomina “dolor testicular crónico idiopático” 59. Otros nombres son “orquidinia crónica” y “Síndrome doloroso escrotal crónico” (CSPS por sus siglas en inglés) 60.
La evaluación del paciente puede ser confusa sobre todo cuando se trata de una causa idiopática y la terapia conservadora es a menudo ineficiente, haciendo que su diagnóstico y posterior tratamiento sean desafiantes.
Terapias conservadoras son usualmente usadas en primera instancia, pero muchos procedimientos invasivos terminan siendo opciones cuando los tratamientos de primera línea fallan. Opciones quirúrgicas incluyen bloqueos del cordón espermático, varicocelectomía, epididectomía, vaso-vasostomía (si paciente había sido sometido a vasectomía previa), denervación del cordón espermático, inyección de Botox®, orquiectomía, entre otras 61.
Epidemiología y Etiología
La orquialgia crónica se presenta con mayor frecuencia en hombres entre los 35 y los 40 años, y su incidencia está aumentando. Suele asociarse con infertilidad masculina, prostatitis crónica, dolor lumbar, estrés y síndrome del intestino irritable.
Las posibles causas orgánicas identificables incluyen trastornos estructurales como espermatoceles, varicoceles, infección, trauma, fibrosis, tumores, torsión intermitente, torsión de un apéndice testicular, epididimitis crónica, distensión lumbar, vasculitis (como púrpura de Schönlein – Henoch), síndrome de dolor post vasectomía, atrapamiento nervioso por cirugía de hernia o fibrosis perineural, disfunción del suelo pélvico o dolor referido de otro sitio como un cálculo ureteral.
Las causas menos comunes incluyen neuropatía diabética, tumores retroperitoneales, cistitis intersticial, aneurismas aórticos abdominales, peritonitis, inflamación epididimaria inducida por amiodarona, trastornos musculoesqueléticos pélvicos, osteítis púbica y poliarteritis nodosa. La orquialgia crónica también puede estar asociada con el síndrome de dolor pélvico crónico (SDPC), posiblemente a través del reflujo intraprostático, o ambos pueden estar describiendo la misma entidad. Hasta el 50% de los hombres con SDPC o prostatitis crónica también presentan orquialgia crónica 62-65.
La inervación sensitiva somática primaria del testículo proviene del nervio ilioinguinal y la rama genital del nervio genitofemoral. Sin embargo, cualquier órgano o tejido que comparta una vía nerviosa con el escroto o los testículos (L1-L2 y S2-S4) puede referir dolor a la zona genital. La lumbalgia o la radiculitis que afecta las raíces nerviosas de T10 a L1 pueden referir dolor a los testículos, y cualquier estímulo infeccioso, traumático o inflamatorio que afecte a los nervios del escroto puede ser percibido por el paciente como orquialgia.
Las fibras sensitivas tanto del testículo como del uréter superior utilizan los segmentos medulares T11 y T12, lo que explica por qué los cálculos ureterales pueden causar dolor testicular. La disfunción o los espasmos de los músculos del suelo pélvico pueden influir en el SDPC, pero también pueden estar implicados en algunos casos de orquialgia crónica.
La púrpura de Schönlein – Henoch es una causa poco frecuente de dolor testicular crónico, pero debe considerarse como parte del diagnóstico diferencial, especialmente en pacientes jóvenes (menores de 20 años). Se trata de una vasculitis sistémica con una incidencia máxima alrededor de los 4 a 5 años. Afecta el escroto entre el 2 % y el 38 % de las veces y, en ocasiones, puede diagnosticarse erróneamente como un problema testicular agudo que requiere cirugía urgente. Se caracteriza por un edema marcado del escroto con flujo vascular testicular intacto, un epidídimo agrandado e hidrocele.
La amiodarona se ha asociado con un síndrome inflamatorio epididimario estéril en hasta el 11 % de los pacientes adultos que la toman. Se cree que esta afección se debe a las concentraciones muy altas del fármaco que a veces se encuentran en el tejido testicular y epididimario66.
La orquialgia crónica suele tener un componente psicológico, que incluye problemas como trastorno de somatización, depresión mayor, dolor crónico en otras zonas, entre otros.
Cuando no se puede identificar una etiología específica, lo que ocurre en aproximadamente el 25% al 50% de los casos, se denomina orquialgia crónica idiopática y se cree que se debe a una inflamación neurogénica o a una sensibilización nerviosa, posiblemente por una sobreestimulación prolongada.
Fisiopatología
La fisiopatología precisa del dolor crónico por orquialgia no se comprende bien, aunque la teoría predominante es la hipersensibilidad de las fibras sensoriales en las vías nerviosas periféricas, posiblemente debida a la plasticidad o a la estimulación repetida. Esto tiene un efecto tanto central como periférico, donde se establece un umbral de estimulación más bajo que facilita la activación del potencial de acción con mayor frecuencia y menor tiempo de latencia, lo que finalmente resulta en una activación nerviosa autónoma incluso sin un estímulo específico.
Otra teoría es la degeneración walleriana de los nervios periféricos pélvicos. La degeneración walleriana describe un trastorno en el que se produce la autodestrucción del axón de la célula nerviosa. Esta degeneración activa y utiliza neutrófilos, citocinas y macrófagos, pero finalmente provoca hipersensibilidad neuronal y dolor crónico. Este proceso elimina los residuos inhibidores, lo que puede favorecer la regeneración y la recuperación axonal. El resultado neto es que los pacientes sienten dolor con un menor nivel de estimulación en las zonas afectadas por la degeneración neuronal walleriana (un umbral de dolor más bajo)61.
Se ha detectado degeneración walleriana en tres localizaciones específicas del cordón espermático de pacientes con orquialgia crónica: las fibras musculares cremastéricas, la vaina y los tejidos perivasales, y el tejido lipomatoso periarterial posterior. Los pacientes con orquialgia crónica han mostrado un número significativamente mayor de axones nerviosos con degeneración walleriana en sus cordones espermáticos, en comparación con la población masculina general.
Los nervios más comúnmente afectados son el ilioinguinal, el pudendo, el iliohipogástrico y la rama genital de los nervios genitofemorales.
El síndrome de dolor post vasectomía se ha asociado con hallazgos histológicos como engrosamiento de las membranas basales celulares, fibrosis intersticial testicular y degeneración de los espermatozoides. Se cree que el mecanismo real del dolor en estos pacientes es multifactorial e incluye daño directo del cordón espermático, inflamación de los nervios del cordón espermático, congestión epididimaria, fibrosis perineural, estallido epididimario y desarrollo de anticuerpos antiespermáticos, así como posibles factores psicológicos 67-69.
Historia Clínica y Examen Físico
Se debe hacer una correcta evaluación del dolor, duración, severidad, localización, irradiación, etc. (Figura1).
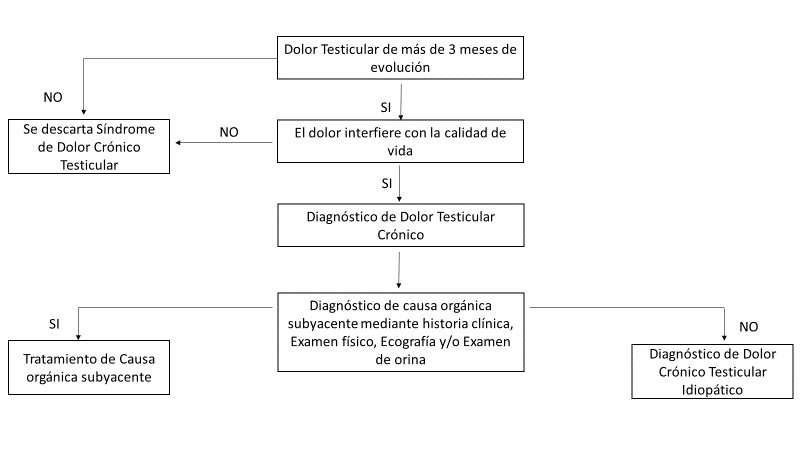
Fig.1. Algoritmo de evaluación y diagnóstico de un Dolor testicular crónico 70
Es fundamental establecer una buena relación médico – paciente y realizar una historia clínica y un examen físico detallados, con especial atención a los antecedentes sexuales y quirúrgicos. Se debe explorar y documentar cualquier asociación del dolor con la micción, las deposiciones, las actividades físicas intensas, las relaciones sexuales o permanecer sentado durante un tiempo prolongado. La historia clínica debe incluir detalles muy específicos del dolor, incluyendo la ubicación exacta, la intensidad, el momento de la aparición, los factores agravantes, la intensidad del inicio y la irradiación a otros órganos o zonas. Por ejemplo, permanecer sentado durante un tiempo prolongado y el estreñimiento suelen agravar el dolor en pacientes con orquialgia crónica idiopática, mientras que los pacientes con cistitis intersticial tienden a presentar dolor suprapúbico asociado a la función vesical 70.
La exploración física debe centrarse en el escroto y los genitales. Es útil examinar al paciente tanto de pie como sentado. Comenzar siempre examinando el lado no doloroso. Se debe examinar cuidadosamente cada porción del testículo (testículo, epidídimo y conducto deferente) para detectar dolor a la palpación, inflamación y nódulos anormales. Se debe realizar un tacto rectal para evaluar la posible prostatitis y la tensión muscular anormal del suelo pélvico. Si es posible, se debe intentar identificar el origen anatómico específico del dolor 71.
El dolor del suelo pélvico o la debilidad muscular pueden influir en la orquialgia crónica en algunos hombres. En un estudio, el 93 % de 41 hombres con orquialgia idiopática crónica presentaron al menos un síntoma de disfunción del suelo pélvico y el 88 % de ellos mostraron un aumento de la tensión muscular del suelo pélvico en la prueba electromiográfica.
Una historia detallada debe incluir un screening de salud mental. Los factores psicológicos parecen desempeñar un papel importante en el dolor testicular crónico, especialmente cuando no se puede identificar una causa orgánica. Los problemas psicológicos que pueden afectar al dolor genital crónico incluyen disfunción sexual, ansiedad, antecedentes de abuso sexual, depresión mayor y trastorno de somatización.
Exámenes de apoyo
Se debe realizar un examen de orina completa y un urocultivo de forma rutinaria. En determinados pacientes, se debe obtener un cultivo de semen. Los niveles de testosterona y vitamina B12 suelen ser deficientes en muchos pacientes (76%) con orquialgia crónica 71,72.
La ecografía testicular es el principal estudio de imagen y la principal herramienta diagnóstica para la orquialgia crónica.
En algunos casos, se debe considerar una tomografía computarizada abdominopélvica debido a la posibilidad de cálculos ureterales, aneurismas o hernias inguinales que causen o contribuyan al dolor. La resonancia magnética de columna no se recomienda de forma rutinaria, excepto en casos seleccionados de pacientes con dolor simultáneo de espalda o cadera.
La evaluación de la orquialgia crónica puede ser difícil y obligar a los pacientes a consultar a varios médicos. Se ha informado que el paciente promedio se somete a un promedio de 4,7 a 7,2 estudios de diagnóstico y 1,6 procedimientos quirúrgicos73.
Tratamiento
Se recomienda un enfoque multidisciplinario para los pacientes con orquialgia crónica. Idealmente, esto incluiría especialistas en manejo del dolor, psiquiatría, fisioterapeutas especializados en suelo pélvico, así como atención primaria y urología. Este tipo de enfoque, junto con la terapia conservadora, debe intentarse antes de recurrir a procedimientos quirúrgicos invasivos e irreversibles74-76.
El manejo de esta patología es variado y complejo. Los tratamientos de primera línea, y por lo tanto menos invasivos, generalmente son ineficientes. Las opciones quirúrgicas terminan siendo el tratamiento definitivo.
Si se encuentra una causa evidente del dolor, se debe iniciar un tratamiento específico (hernias, espermatoceles, epididimitis). Si no tiene éxito o no se encuentra una etiología específica, se inicia un ciclo de terapia conservadora.
Si el paciente toma amiodarona, es posible que deba suspenderse el fármaco, ya que la orquialgia que a veces produce no es autolimitada 77,78.
En la Tabla 3 se resumen los tipos de tratamientos:
| I.- MANEJO NO QUIRÚRGICO |
| 1.- Suspensión testicular |
| 2.- Compresas Tibias |
| 3.- Antibióticos |
| 4.- AINE |
| 5.- Antidepresivos tricíclicos y Neuromoduladores (Gabapentina, Carbamazepina) |
| 6.- Vitamina B12, Testosterona, Alfabloqueadores * |
| 7.- Estimulación eléctrica transcutánea de nervio (TENS) |
| 8.- Radiofrecuencia Pulsada |
| II.- TRATAMIENTOS MÍNIMAMENTE INVASIVOS |
| 1.- Bloqueo de cordón espermático |
| 2.- Bloqueo de plexo pélvico guiado por ecografía transrectal |
| 3.- Denervación de cordón espermático laparoscópico |
| III.- TRATAMIENTOS QUIRÚRGICOS ABIERTOS |
| 1.- Denervación microquirúrgica de cordón espermático |
| 2.- Reversión de vasectomía |
| 3.- Epididectomía |
| 4.- Varicocelectomía |
| 5.- Orquiectomía |
Tabla 3. Tipos de tratamiento para el dolor testicular crónico.
La terapia conservadora incluye calor, suspensión testicular, antibióticos, analgésicos, AINE, antidepresivos, anticonvulsivos (Gabapentina y Pregabalina), bloqueos nerviosos regionales y locales, fisioterapia del suelo pélvico y psicoterapia durante al menos 3 meses. Si bien la terapia conservadora casi siempre se ha considerado el tratamiento de primera línea, su éxito es relativamente bajo, oscilando entre el 4,2 % y el 15,2 % en algunos estudios.
El tratamiento comienza con consejos dietéticos y de estilo de vida que generalmente consisten en eliminar la cafeína, los cítricos, las especias picantes y el chocolate, así como evitar el estreñimiento y permanecer mucho tiempo sentado.
Los antibióticos recetados suelen ser trimetoprima/sulfametoxazol o una quinolona. Suelen recetarse durante 2 a 4 semanas. No se recomienda el tratamiento antibiótico empírico, solo si existen signos objetivos o una sospecha razonable de infección.
El tratamiento farmacológico inicial suele consistir en AINE. Suelen recetarse durante al menos 30 días. Los fármacos de elección incluyen ibuprofeno, naproxeno, celecoxib o piroxicam. Las tasas de recurrencia tras el uso eficaz de AINE alcanzan el 50 %. Se deben evitar los analgésicos narcóticos, excepto en caso de dolor intenso ocasional.
Los antidepresivos tricíclicos actúan bloqueando la recaptación de noradrenalina y serotonina en el cerebro. Se cree que su efecto analgésico se debe a la inhibición de los bloqueadores de los canales de sodio y calcio de tipo L en la asta dorsal de la médula espinal. La amitriptilina es eficaz para el dolor neuropático. Se recomienda en dosis única de 25 mg al acostarse y suele requerir al menos de 2 a 4 semanas para que su eficacia se manifieste, aunque esto puede tardar hasta 8 semanas79.
Si la terapia tricíclica no es eficaz después de 30 días, el siguiente enfoque terapéutico conservador sería añadir un fármaco como la gabapentina a dosis de 300 mg tres veces al día o pregabalina a dosis de 75 a 150 mg al día. Se recomiendan debido a su eficacia comprobada en el dolor neuropático y su relativa ausencia de efectos secundarios. Si el dolor persiste más de 30 días, el tratamiento se considera ineficaz. En un pequeño estudio, más del 60 % de los pacientes con orquialgia crónica idiopática mostraron un alivio significativo del dolor.
La fisioterapia del suelo pélvico es útil para quienes presentan disfunción muscular pélvica o puntos gatillo miofasciales identificables. En pacientes adecuadamente seleccionados, alrededor del 50 % ha notado una mejoría del dolor después de 12 sesiones. También parece que la fisioterapia puede mejorar las puntuaciones de dolor y calidad de vida en pacientes con orquialgia crónica, incluso después de otros tratamientos. Por lo tanto, la evaluación y el tratamiento con fisioterapia deben considerarse una opción terapéutica eficaz y de bajo riesgo para los pacientes con orquialgia crónica80.
El siguiente paso es el bloqueo del cordón espermático, que se recomienda antes de realizar cualquier procedimiento quirúrgico invasivo o irreversible. Generalmente, se realiza mediante la inyección de 20 ml de bupivacaína al 0,25 % sin epinefrina. La inyección se administra directamente en el cordón espermático, a la altura del tubérculo púbico. La ecografía puede ser útil si la anatomía presenta dificultades debido a la constitución corporal o a una cirugía previa. Si los nervios del cordón espermático están involucrados en las señales de dolor, la inyección debería aliviar rápidamente las molestias testiculares. Si bien esto suele proporcionar alivio, rara vez es a largo plazo. A los pacientes que experimentan más del 90 % de alivio del dolor se les pueden ofrecer bloqueos repetidos hasta cada dos semanas. Si la inyección no alivia el dolor, no se repite. La intervención quirúrgica está indicada si el bloqueo del cordón espermático tiene al menos un 50 % de éxito en la reducción de la orquialgia81.
Aproximadamente entre el 1 % y el 2 % de los hombres que se someten a vasectomía desarrollarán dolor testicular constante o intermitente que dure más de 3 meses, lo que se define como síndrome de dolor post vasectomía. Los pacientes post vasectomía que no respondan a la terapia conservadora deben considerar la reversión de la vasectomía. Esto se recomienda especialmente si las imágenes escrotales muestran evidencia de congestión epididimaria y existe una asociación del dolor testicular con las relaciones sexuales. La tasa de éxito de la reversión de la vasectomía en pacientes con orquialgia crónica y síndrome de dolor post vasectomía se ha reportado en un 69 %. Los granulomas espermáticos deben extirparse si presentan sensibilidad o contribuyen al dolor escrotal.
Los varicoceles son hallazgos relativamente comunes en hombres con orquialgia y se presentan en el 2% al 10% de estos pacientes. Diversos estudios han reportado un alivio parcial o completo del dolor después de la cirugía de varicocele en el 72,4% al 94,3% de los hombres.
La epididimectomía es una opción quirúrgica más agresiva con alta tasa de éxito (más del 90%) en pacientes seleccionados cuando el origen del dolor se localiza en el epidídimo, como en el caso de un espermatocele o un granuloma. También demuestra un éxito razonable en el control del dolor post vasectomía como alternativa a la reversión de la vasectomía. La epididimectomía tiene menos éxito en pacientes con epididimitis crónica (43% de satisfacción del paciente).
La denervación microquirúrgica del cordón espermático (MDSC) se ha convertido en el estándar quirúrgico cuando se indica un procedimiento para la orquialgia crónica idiopática que no responde a terapias conservadoras. Se han reportado muy buenos resultados con MDSC (hasta un 76,5%), especialmente si los pacientes han tenido una respuesta positiva a un bloqueo del cordón espermático9. Descrita originalmente por Devine y Schellhammer en 1978, se realiza con un microscopio quirúrgico para evitar lesiones en las arterias testiculares, que de otro modo serían muy difíciles de visualizar 82.
El procedimiento se realiza generalmente a través de una incisión inguinal, exponiendo el cordón espermático. Una incisión subinguinal es una alternativa aceptable. El testículo suele dejarse en su lugar en el escroto. El cordón se diseca cuidadosamente con un microscopio para localizar la arteria testicular, que se identifica y aísla. Esta arteria se conserva junto con la arteria del conducto deferente, si está presente. Se extirpa la fascia perivascular, ya que este tejido está lleno de nervios aferentes. Generalmente, se realiza una vasectomía si no se ha realizado previamente. Dejar el conducto deferente por razones de fertilidad tiende a reducir el éxito del procedimiento. Sin embargo, algunos expertos recomiendan dejar el conducto deferente después de extirpar la fascia perivascular unos 2 cm, para evitar la congestión epididimaria y el posible síndrome de dolor post vasectomía. La arteria del conducto deferente se conserva si no se ha sacrificado previamente. Se cortan las fibras musculares cremastéricas, con cuidado de no lesionar la arteria cremastérica. El objetivo del procedimiento es seccionar todos los nervios del cordón espermático, preservando la irrigación arterial (arteria testicular, arteria cremastérica y arteria del conducto deferente) y algunos vasos linfáticos que se conservan para reducir la probabilidad de desarrollar una hidrocele postoperatorio. También se sacrifican las venas testiculares y el nervio ilioinguinal. El extremo proximal del nervio ilioinguinal se entierra para minimizar la formación de neuromas.
Aproximadamente entre el 70 % y el 80 % de los hombres experimentan un alivio completo de los síntomas y entre el 10 % y el 20 % experimentan un alivio parcial del dolor tras la MDSC. Incluso en pacientes que se han sometido a una intervención quirúrgica previa, la MDSC proporcionó al 50 % un alivio completo del dolor. La resolución completa del dolor después de esta cirugía puede tardar hasta 3 meses, pero el 40% notó un alivio completo del dolor inmediatamente después de la MDSC.
Las posibles complicaciones incluyen la formación de hidrocele (riesgo inferior al 1%), infecciones de la herida, hematomas y atrofia testicular (riesgo del 1%).
La reversión de la vasectomía puede ser eficaz para aliviar el síndrome de dolor post vasectomía que no responde a medidas conservadoras. Si bien existen estudios relativamente pequeños, estos muestran consistentemente altas tasas de alivio del dolor con la vasovasostomía, con un alivio completo del dolor entre el 50% y el 69% de los pacientes. Si el procedimiento no proporciona un alivio sustancial del dolor, se incluyen causas neuropáticas, atrapamiento nervioso, cicatrices postoperatorias y obstrucción continua de los vasos sanguíneos. En una serie de 6 hombres que presentaron dolor persistente tras la reversión inicial de la vasectomía, se realizó una segunda reversión, y el 50 % de ellos notó alivio del dolor68.
El tratamiento quirúrgico de último recurso es la orquiectomía, donde el abordaje inguinal muestra una tasa de éxito ligeramente mayor que el abordaje transescrotal. Desafortunadamente, incluso este tratamiento de último recurso no es completamente eficaz para aliviar el dolor crónico y podría provocar hipogonadismo o dolor fantasma por lo que es importante informar y asesorar a los pacientes al respecto 83.
EPIDIDIMITIS Y ORQUIEPIDIDIMITIS
La epididimitis se define como la inflamación del epidídimo, la cual puede ser por múltiples causas, donde la más frecuente es de origen infeccioso84.
La orquiepididimitis es la inflamación del epidídimo y el testículo, cuadro que se presenta principalmente cuando una epididimitis infecciosa severa progresa comprometiendo el testículo. La epididimitis crónica es la fibroplasia de parte o todo el epidídimo que se produce en etapas finales de una epididimitis severa o tratada en forma inadecuada.
La orquitis es la inflamación del testículo sin compromiso epididimario; puede ser por causa viral, como en la orquitis urliana, bacteriana, granulomatosa, traumática o idiopática.
Fisiopatología
La principal causa de epididimitis es por pasaje retrógrado de orina desde la uretra prostática al epidídimo vía conductos eyaculadores y vasos deferentes. Normalmente la disposición oblicua de los eyaculadores en relación con la uretra previene el reflujo. El paso de orina estéril puede producir un proceso inflamatorio químico del epidídimo y si estar contaminada la orina una epididimitis infecciosa84.
Existe, según esto, factores y condiciones de riesgo para presentar una epididimitis, los que son:
- Factores obstructivos uretrales o prostáticos, como la hiperplasia prostática benigna.
- Maniobras de Valsalva al realizar ejercicios extenuantes con vejiga llena, como en la Halterofilia, se produce reflujo de orina por los eyaculadores.
- La instrumentación de la uretra, como cateterización o procedimientos endoscópicos vesicales.
- Anormalidades anatómicas, como la presencia en los niños de utrículo prostático, valvas de uretra posterior, desembocadura anómala de uréter, duplicidad uretral u otras alteraciones funcionales como disinergia vésico-esfinteriana. En un estudio se encontró que el 47% de los pacientes prepuberales con epididimitis tenían asociado anormalidades urogenitales85,86.
- La actividad sexual, aumenta la incidencia de epididimitis infecciosa.
En los niños la causa infecciosa es menos común: en un estudio se encontró solo 4,1% de urocultivos positivos asociados a epididimitis87, en otro estudio en niños con malformaciones ano rectales y fístulas recto-urinaria, no fue habitual que presentaran epididimitis88. La epididimitis se puede acompañar de uretritis, prostatitis o cistitis.
Existen otras causas de epididimitis (Tabla 4)89 no relacionadas al reflujo, como son la epididimitis en personas con síndrome de Behcet, la orquiepididimitis asociada al Púrpura de Shonlein-Henoch o la epididimitis asociada a altas dosis de amiodarona, que se observa entre 3-11% de los pacientes que consumen más de 200 mg/día, ya que se concentra en el epidídimo y se produce una reacción antígeno anticuerpo. La Sarcoidosis puede también producir epididimitis hasta en un 5% de los pacientes. La vasectomía puede provocar una epididimitis crónica cuando se deja el cabo proximal abierto, produciéndose extravasación de espermatozoides con reacción inflamatoria local secundarias.
| Etiología | Principal causa |
| Bacteriana | Flora Entérica, Gérmenes de transmisión sexual |
| Viral | Virus de Papera, Adenovirus, Enterovirus |
| Fúngico | Candida Albicans, Histoplasma Capsulatum |
| Parasitaria | Tricomonas Vaginalis, Schistosoma ssp., Filariasis |
| Inducido por Drogas | Amiodarona |
| Reumática | Sd. Behcet, Purpura Shcoenlein-Henoch, Vasculitis |
| Inducida por Obstrucción | Vasectomía |
Tabla 4. Etiología de Epididimitis
Epidemiología
Se estima que 1/1000 hombres/año tienen epididimitis, lo que determina en Estados Unidos de Norte América unas 600.000 consultas al año; la epididimitis es la quinta causa de consulta urológica de personas entre 18 y 50 años. El 72% de las epididimitis ocurren entre los 20 y 59 años; la epididimitis en pacientes prepuberales es rara.
En relación con la epididimitis infecciosa, el gérmen causal varía según la edad del paciente: por coliformes (E. coli, Pseudomona, Proteus, Klebsiella) son más frecuentes en niños y adultos sobre 35 años. En adultos con prácticas sexuales vía anal también son frecuentes las infecciones por coliformes90. Clamidia es el agente causal más común en los adultos jóvenes con vida sexual activa (menores de 35 años) presentándose en más del 50% de los casos, aunque muchas veces el cultivo sea negativo91. También se puede ver en este grupo infecciones por Neiseria gonorreae, Treponema pallidum y Gardnerella vaginalis.
Pacientes con epididimitis secundaria a un germen de transmisión sexual tienen 2-5 veces más riesgo de adquirir VIH92. Las parejas sexuales de los pacientes con epididimitis por gérmenes de transmisión sexual deben ser evaluados y tratadas. La epididimitis tuberculosa se ve en zonas endémicas y por lo general se acompaña de tuberculosis urinaria. Se produce por vía hematógena pero ocasionalmente se ha descrito en pacientes que reciben instilaciones vesicales con BCG por cáncer vesical (0,4%).
La orquiepididimitis de origen viral es frecuente en niños, siendo la más frecuente la urliana, aunque se puede presentar por otros virus como la varicela. Otros raros agentes causales como la brucelosis se presentan en personas que trabajan con animales (lecherías) y a causa de Cándida, Citomegalovirus o Blastomicosis en pacientes inmunocomprometidas.
Cuadro clínico
La sintomatología por lo general no difiere de la orquiepididimitis. Presenta dolor genital gradual y progresivo, unilateral, aunque en un 5-10% puede ser bilateral; ocasionalmente presentan disuria, tenesmo y aumento de la frecuencia miccional. Sólo el 25% de los adultos presentan fiebre o escalofríos, pero nunca presentan náuseas ni vómitos, lo que es importante para el diagnóstico diferencial.
Al examen físico encontramos sensibilidad y aumento de volumen epididimario el cual puede ser en primer lugar en la cola y luego extenderse al cuerpo y la cabeza del epidídimo, comprometer el cordón (funiculitis) o al testículo ipsilateral. No se observa elevación del genital comprometido y existe presencia de reflejo cremasteriano. Puede haber compromiso de la piel del escroto con edema, eritema y celulitis, y adherencia del escroto al genital en procesos intensos y avanzados, además de hidrocele reactivo. Al levantar el genital comprometido el dolor se alivia (signo de Prehn positivo).
En el caso de la epididimitis crónica, lo que destaca es el dolor genital unilateral recurrente o constante de más de 3 meses de evolución. En este caso, al examen físico se encuentra engrosamiento parcial o total de epidídimo, sensibilidad de este durante el examen, pero sin compromiso del escroto ni del testículo93. Hongo y colaboradores publicaron un algoritmo que provee un 98-100% de especificidad para predecir la gravedad de la epididimitis, basada en la presencia de Diabetes Mellitus, fiebre, PCR alta, leucocitosis y nitrógeno ureico94.
Diagnóstico diferencial
Es importante diferenciarlo de la torsión testicular, la que es una verdadera urgencia urológica, y del tumor testicular.
Otros diagnósticos para considerar son:
- Hernia inguinal e inguino-escrotal
- Hidrocele
- Algia testicular idiopática
- Edema escrotal idiopático
- Quiste epididimario
- Varicocele
- Tumor de epidídimo
- Hematocele
- Piocele
- Torsión de apéndice testicular
En la Tabla 5 se presentan las características distintivas de los diagnósticos diferenciales más relevantes93.
| Diagnóstico | Presentación | Hallazgos al examen | Hallazgos Ecográficos |
| Epididimitis | Gradual dolor y aumento de volumen en uno o dos días. | Aumento de volumen epididimario, sensible, con signo de Prehn (+), reflejo cremasteriano presente. | Aumento de tamaño del epidídimo y aumento del flujo sanguíneo al Doppler. |
| Cáncer Testicular | Sobre el 15% se asocia a dolor. | Nódulo firme del testículo, generalmente no sensible. | Masa heterogénea que se originan en el testículo. |
| Torsión Testicular | Dolor súbito e intenso. | Testículo alto, ausencia de reflejo cremasteriano, con la suspensión testicular aumenta el dolor. | Disminución o ausencia de flujo sanguíneo al Doppler. |
| Torsión de apéndice Testicular | Dolor súbito, de menor intensidad. | Signo del punto azul. Zona azulada en relación con el apéndice infartada o necrosada. | Apéndice mayor de 5 mm. con aumento del flujo sanguíneo peri apendicular al Doppler. |
Tabla 5. Diagnóstico diferencial de dolor testicular agudo84.
Estudio Complementario
El diagnóstico de epididimitis y orquiepididimitis por lo general es realizado mediante la clínica, sin necesidad de estudios complementarios; ante la duda y eventualmente establecer un agente causal, se pueden realizar exámenes complementarios.
El examen de orina alterado y urocultivo positivo se encuentran presentes en el 50% de los menores de edad95 y pacientes ancianos, pero considerando a toda la población con epididimitis puede ser sólo el 10%. El cultivo de secreción uretral es conveniente si ella está presente, en busca de gérmenes asociados a infecciones de transmisión sexual. Leucocitosis y PCR elevado son sugerentes de infección y pueden orientar el diagnóstico diferencial con otra causa de dolor testicular, aunque no siempre están presentes.
El estudio imagenológico es importante si hay duda diagnóstica. El uso de ecografía y ecografía Doppler son útiles para establecer la diferencia con torsión testicular, pero siempre el juicio clínico es más importante ya que la ecografía tiene limitaciones al ser dependiente del operador y de la cooperación del paciente. La sensibilidad para torsión testicular en la ecografía Doppler color es de 82-100% y la especificidad de 88-100%96, mientras que la sensibilidad para la epididimitis es de 92-100%97,98.
En el Doppler se busca la perfusión del genital, la cual puede estar aumentada en la epididimitis y el tumor testicular y esta abolida en la torsión. La confirmación ecográfica no es necesaria si el diagnóstico es claro; la ecografía en estos casos es confirmatoria sólo en 69% de los casos. La ecografía también es útil para detectar abscesos intratesticulares.
En la epididimitis crónica característicamente se ve a la ecografía engrosamiento del epidídimo con ecos heterogéneos y calcificaciones ocasionales, así como engrosamiento de la túnica vaginal y, en ocasiones, compromiso testicular.
Otros estudios imagenológicos no son necesarios inicialmente, pero sí en forma diferida para aclarar dudas diagnósticas, como en los niños prepuberales en quienes es importante descartar malformaciones del sistema genitourinario (cistografía, Urotac, uretrocistoscopia) o en pacientes que se sospeche una epididimitis tuberculosa.
Avances en el Diagnóstico
- Uso Optimizado de la Ecografía Doppler: Los últimos años han consolidado el uso de la ecografía Doppler color como herramienta diagnóstica esencial, el uso de equipos de última generación aumenta su sensibilidad. El interés del Eco Doppler radica en la posibilidad de diagnosticar la isquemia testicular con seguridad y rapidez. Los procesos inflamatorios como la epididimitis presentan un patrón característico de hiperemia con baja resistencia, lo que les diferencia claramente del patrón vascular de alta resistencia de la torsión testicular.
- Criterios Diagnósticos Actualizados: Las guías más recientes han refinado los criterios para solicitar estudios auxiliares. En niños con epididimitis aguda no complicada, no se debe solicitar examen general de orina, urocultivo ni biometría hemática por la baja utilidad diagnóstica. Sin embargo, en adolescentes con prácticas sexuales de riesgo se recomienda realizar exudado uretral y pruebas específicas para gonorrea y clamidia.
- Biomarcadores Emergentes: La investigación reciente ha identificado biomarcadores urinarios prometedores. La proteína 10 inducible por interferón gamma (IP-10) y el ligando inductor de apoptosis relacionado con el factor de necrosis tumoral (TRAIL) han surgido como biomarcadores útiles para discernir entre infecciones virales y bacterianas. Estos biomarcadores ofrecen ventajas significativas como la medición no invasiva en muestras urinarias, la capacidad para distinguir infecciones bacterianas de virales y el potencial para monitorizar la respuesta al tratamiento.
Tratamiento
La base del tratamiento es el uso de analgésicos, antiinflamatorios y antibioterapia. Es importante además tomar medidas generales para una adecuada respuesta: reducción de la actividad física e incluso el reposo son importantes, la suspensión escrotal ayuda a disminuir el dolor, así como el uso de paños fríos. En caso de intenso dolor se puede realizar bloqueo nervioso a nivel del cordón espermático que es útil también para facilitar el examen físico en pacientes con mucho dolor. Se debe evitar la instrumentación de la vía urinaria.
Antibioterapia
La elección del antibiótico depende del germen aislado o sospechado según la edad del paciente, los antecedentes mórbidos y su vida sexual. En la tabla 6 99,100 se resume la elección del tratamiento, aunque este debe adaptarse según la resistencia antibiótica local y evaluarse la duración del tratamiento antibiótico según la evolución caso a caso.
| Población | Agente causal más frecuente | Tratamiento antibiótico |
| Niños menores de 2 años | Varios | Preferir antibióticos para tratamiento a gérmenes entéricos. |
| Niños entre 2 y 14 años | Varios | Tratar según agente causal en caso de aislarlo, sino solo AINEs. |
| Adultos menores de 35 años sexualmente activos | Gonorrea o Clamidia | Ceftriaxona 250 mgrs im por una vez y Doxiciclina 100 mgrs cada 12 horas por 10 días. |
| Adultos con prácticas sexuales vía anal | Gonorrea, Clamidia o Gérmenes entéricos | Ceftriaxona 250 mgrs im. Por una vez y Levofloxacino 500 mgrs al día por 10 días. |
| Adultos mayores de 35 años o que se instrumentalizó la vía urinaria. | Gérmenes entéricos | Levofloxacino 500 mgrs día por 10 días. |
Tabla 6. Tratamiento antibiótico empírico101
Novedades en el Tratamiento
- Actualización de Esquemas Antibióticos: Los protocolos de tratamiento han evolucionado considerablemente en respuesta a la creciente resistencia antimicrobiana. Las fluoroquinolonas, tradicionalmente utilizadas como primera línea, ahora enfrentan tasas de resistencia significativas. Actualmente, el ciprofloxacino presenta mucha resistencia por parte de las bacterias, lo que ha llevado a reconsiderar su uso como primera opción. Los esquemas actualizados incluyen: Levofloxacino 500 mg vía oral una vez al día durante 10 días; Doxiciclina 100 mg vía oral dos veces al día durante 14 días; Trimetoprima/sulfametoxazol 160/800 mg vía oral dos veces al día; Ceftriaxona 500 mg intramuscular (dosis única) combinada con antibióticos orales en casos específicos.
- Enfoque Diferenciado por Edad: Las guías actuales recomiendan un enfoque más conservador en niños. En niños y adolescentes con epididimitis aguda no complicada se recomienda no usar antibiótico, únicamente analgésico (paracetamol por 7 días). El tratamiento antimicrobiano se reserva para pacientes que presentan piuria o urocultivo positivo.
- Resistencia Antimicrobiana: Un Desafío Creciente: La resistencia a las fluoroquinolonas se ha convertido en un problema crítico. En España, la resistencia a ciprofloxacino en aislados de Escherichia coli alcanzó el 19% en 2002. Esta tendencia ha continuado, con múltiples evidencias que demuestran la asociación entre la resistencia y el consumo de fluoroquinolonas. Para abordar la resistencia antimicrobiana, se recomienda conocer la flora bacteriana y resistencia antimicrobiana local, elegir antimicrobianos con menor resistencia local, considerar efectos secundarios en la selección del tratamiento y realizar cultivos de control para confirmar erradicación.
- El tratamiento quirúrgico en casos agudos está indicado en caso de mala respuesta al tratamiento antibiótico, con formación de abscesos intratesticulares y fistulas cutáneas, realizándose orquiectomía total y aseo quirúrgico. La epididimectomía es rara en fase aguda de una epididimitis, pero es una alternativa de tratamiento en caso de epididimitis crónica refractaria al tratamiento médico.
En la epididimitis crónica el tratamiento sugerido son dos semanas de antiinflamatorios no esteroidales (AINEs) inicialmente; si las molestias no ceden agregar antidepresivos tricíclicos o neurolépticos como gabapentina. En caso de persistencia de las molestias puede ser necesaria la resección quirúrgica del epidídimo.
Complicaciones y Manejo a Largo Plazo
- Impacto en la Fertilidad: Los avances recientes han clarificado mejor las consecuencias de la epididimitis en la fertilidad masculina. La inflamación prolongada puede causar obstrucción en los conductos que transportan espermatozoides, resultando en azoospermia u oligospermia. Las infecciones no tratadas pueden dañar los espermatozoides y reducir su capacidad fecundante.
- Prevención de Recurrencias: Para casos de epididimitis bacteriana recurrente secundaria a uretritis o prostatitis crónicas, se considera la vasectomía como medida preventiva. En pacientes con sondas uretrales permanentes, se recomienda la cistostomía suprapúbica o regímenes de autocateterismo.
Tecnologías Emergentes y Perspectivas Futuras
- Papel de la Microbiota: La investigación emergente sobre probióticos y microbiota genital masculina abre nuevas perspectivas preventivas. Los probióticos han demostrado beneficios en la prevención de infecciones genitourinarias mediante mecanismos inmunológicos y no inmunológicos.
Los últimos cuatro años han marcado avances significativos en el manejo de la epididimitis, particularmente en el enfoque personalizado del tratamiento antimicrobiano y la optimización de herramientas diagnósticas. La creciente resistencia antimicrobiana ha obligado a revisar protocolos tradicionales, mientras que tecnologías emergentes como la farmacogenómica y la inteligencia artificial prometen revolucionar el diagnóstico y tratamiento futuro. El enfoque actual privilegia estrategias conservadoras en población pediátrica y tratamientos dirigidos en adultos, siempre considerando factores locales de resistencia antimicrobiana.
La epididimitis crónica se define como la inflamación del epidídimo que dura más de seis semanas o que reaparece de forma recurrente. El diagnóstico comienza con la evaluación clínica, que incluye la historia de síntomas y el examen físico, donde se busca hinchazón, sensibilidad y dolor en el epidídimo. Para confirmar el diagnóstico y descartar otras causas como la torsión testicular, es fundamental realizar una ecografía Doppler testicular, que evalúa el flujo sanguíneo en el área afectada. Además, se pueden solicitar análisis de orina, urocultivo y exudado uretral para identificar infecciones bacterianas o de transmisión sexual, especialmente en pacientes sexualmente activos o con prácticas de riesgo. Además, se recomienda una evaluación urogenital completa, incluyendo pruebas como proteína C reactiva y ultrasonido testicular y renal para descartar anomalías.
En el tratamiento de la epididimitis crónica se recomienda el manejo con antiinflamatorios por 3 a 4 semanas asociado a antibioterapia si se aísla algún germen causal. En casos de persistencia de las molestias se puede realizar epididimectomía para la resolución del problema.
HIDROCELE Y ESPERMATOCELE
Introducción
Cambios quísticos intraescrotales como el hidrocele o el espermatocele son comunes en la práctica urológica general. Se estima que aproximadamente un 10% de hombres asintomáticos tienen un leve o moderado aumento del fluído extratesticular y un 30% presentan estructuras quísticas en el epidídimo102. Se estima que la incidencia anual es de 59.9/100.000 hombres para hidrocele y 38.5/100.000 para espermatocele 103.
Un hidrocele es una acumulación anormal de líquido seroso entre las dos capas de la túnica vaginal del testículo104.
El espermatocele es una estructura quística que contiene líquido de aspecto lechoso con espermatozoides, normalmente ubicado en la cabeza del epidídimo103.
Epidemiología y Etiología
Durante el desarrollo los testículos se forman retroperitonealmente en el abdomen y descienden al escroto a través del canal inguinal en la tercera semana de gestación. Este descenso de los testículos al escroto se acompaña de un pliegue peritoneal del proceso vaginal. Normalmente la porción proximal del proceso vaginal se oblitera, mientras que la porción distal persiste como la túnica vaginal que cubre las caras anterior, lateral y medial de los testículos105.
Al nacer, entre el 80 % y el 90 % de los bebés varones a término presentan un proceso vaginal permeable. Esta cifra disminuye progresivamente hasta estabilizarse en aproximadamente el 25 % al 40 % a los dos años.
Existen cuatro mecanismos básicos por los cuales se puede desarrollar un hidrocele106:
- Conexión con la cavidad peritoneal a través de un proceso vaginal permeable (congénito).
- Producción excesiva de líquido.
- Absorción defectuosa de líquido.
- Interferencia con el drenaje linfático de las estructuras escrotales.
En el adulto la principal causa es idiopática, aunque también puede ser reactiva tras infecciones, trauma, tumores u obstrucción linfática posterior a cirugías inguinales como hernioplastias o trasplante renal107.
Con respecto al espermatocele, su etiología es desconocida. Factores obstructivos o trauma pueden estar implicados103.
Diagnóstico
La mayoría de los pacientes con hidrocele presentan aumento de volumen escrotal indoloro que impide la palpación de los testículos, con transiluminación positiva y fluctuación. El examinador debe observarlo tanto en decúbito supino como en posición vertical.
El hidrocele predomina en la mediana edad y en la vejez. Al ser indoloro, alcanza un tamaño considerable antes de que el paciente busque atención médica.
Pueden diagnosticarse con la historia clínica y la exploración física. Sin embargo, ante la presencia de cualquier afección médica concomitante o para descartar otras afecciones médicas o quirúrgicas, se deben considerar estudios adicionales como la ecografía testicular.
El dolor escrotal o la imposibilidad de delinear la anatomía testicular a la palpación son una indicación para la ecografía, ya que proporciona un excelente detalle del parénquima testicular. Durante la ecografía, el hidrocele se presenta como una zona anecoica o ecolúcida que rodea el testículo. La ecografía también puede ayudar a determinar el tamaño y la caracterización del hidrocele. Los espermatoceles, los tumores testiculares y la atrofia testicular se pueden distinguir fácilmente mediante ecografía108.
Los diagnósticos diferenciales de hidrocele incluyen:
- Hernia inguinal
- Quiste epididimario
- Espermatocele
- Tumor testicular
- Edema escrotal
- Varicocele
- Epididimitis / Orquitis
El espermatocele es normalmente asintomático y generalmente es un hallazgo al examen físico o en ecografías testiculares. Se caracteriza por ser una masa quística indolora normalmente en la cabeza del epidídimo que se puede separar fácilmente del testículo. Cuando hay dudas, la ecografía puede ser de utilidad109.
Tratamiento
La cirugía es el tratamiento de elección para el hidrocele y está justificada cuando se complica o presenta síntomas.
Existen dos abordajes quirúrgicos comunes disponibles para la hidrocelectomía:
- Plicatura: Esta técnica es adecuada para hidroceles de pared delgada. La plicatura de Lord consiste en abrir la capa parietal de la túnica vaginal agrupándola en forma circunferencial a modo de un collarín alrededor del testículo y el epidídimo mediante la aplicación de múltiples suturas interrumpidas de catgut crómico para que el saco forme tejido fibroso. Al existir una disección mínima, el riesgo de hematocele o infección se reduce significativamente. No está recomendada en casos de paquivaginitis110.
- Escisión y eversión: Esta técnica es adecuada para hidroceles grandes de pared gruesa111. El saco de la vaginal es disecado y resecado, dejando una pequeña porción de capa alrededor del testículo. Se evierte y se controla el sangrado suturando de manera continua ambos bordes libres alrededor de las estructuras del cordón (procedimiento de Jaboulay o Winkleman). Se debe tener especial cuidado de no dañar el epidídimo, los vasos testiculares ni el conducto deferente. (Figuras 2-4)112.
Fig. 2. Apertura de Túnica vaginal 112.
Fig. 3. Resección de tejido redundante 112.
Fig. 4. Eversión de túnica vaginal y cierre hemostático de ambos extremos de la túnica vaginal 112
Aspiración
Este es otro método para tratar el hidrocele, especialmente en pacientes que no toleran la cirugía. La punción debe realizarse en el polo inferior del hidrocele. Sin embargo, el líquido casi siempre reaparece en aproximadamente una semana113. Además, el riesgo de hematocele e infección tras la aspiración es alto. La aspiración seguida de una inyección de un esclerosante (tetraciclina o doxiciclina) ha demostrado ser eficaz, pero dolorosa114.
Aunque son procedimientos quirúrgicos de baja complejidad, pueden presentar complicaciones en el postoperatorio y en su recuperación109, los cuales podrían ser:
- Sangrado / Hematoma escrotal (8.8%)
- Piocele
- Infección (5.3%)
- Recurrencia
En el espermatocele la cirugía está indicada muy ocasionalmente, generalmente por dolor o aumento de volumen considerable que aqueja estéticamente al paciente. Cuando está indicada por dolor, hay que advertir al paciente que es probable que este no ceda115. La espermatocelectomía debería ser realizada sin abrir el quiste. La estructura quística debe ser escindida del epidídimo sin movilizar excesivamente este último del testículo. Los extremos del epididímo deben ser aproximados con suturas116.
TORSION TESTICULAR
Corresponde en realidad a la torsión aguda del cordón espermático del testículo. Su incidencia es de 4.5/100.000 hombres menores de 25 años al año y corresponde al 10-15% de las causas de síndrome escrotal agudo en el adolescente, siendo la principal causa de pérdida testicular y orquiectomía en este grupo de pacientes. Puede ocurrir a cualquier edad, pero generalmente tiene una presentación bimodal: durante el primer año de vida y luego entre los 13-16 años de edad117-121.
En los adolescentes la torsión del cordón espermático es intravaginal. El teste está suspendido del mesorquio, el cual es largo y se inserta anómalamente hacia medial del borde testicular. Esto significa que el teste no “cuelga” verticalmente, sino de manera horizontal (malformación en “badajo de campana”), lo que favorece su torsión ante alguna contracción cremastérica. El cremáster, a su vez, se inserta de forma espiral alrededor del cordón, pudiendo ocurrir un efecto de rotación y ascenso ante estímulos mecánicos y/o térmicos6. La malformación “en badajo de campana” es bilateral en el 88-90% de los casos. Como consecuencia de la torsión del cordón se produce isquemia testicular por oclusión, inicialmente venosa y luego arterial, que lleva a la necrosis hemorrágica del tejido testicular. Inmediatamente tras la detorsión puede generarse aún más daño tisular debido al proceso de reperfusión. Las células germinales son las más lábiles ante la isquemia, pudiendo no recuperar su función después de la cirugía. Las células de Sertoli, en cambio, suelen preservar su funcionalidad122.
Los dos principales factores que determinan la extensión del daño testicular son el tiempo de evolución y el grado de torsión del cordón.
 Fig. 5. Imagen macroscópica de torsion testicular (J Urol. 2012 Oct;188(4 Suppl):1417-22.)
Fig. 5. Imagen macroscópica de torsion testicular (J Urol. 2012 Oct;188(4 Suppl):1417-22.)
Está comprobado que el testículo torcido es rescatable generalmente durante las primeras 6 a 8 horas desde el inicio del cuadro. Sin embargo, si el grado de torsión del cordón es superior a 360º el testículo puede tener ya su vitalidad comprometida a las 4 horas de evolución. La literatura establece que las torsiones testiculares operadas antes de las primeras 6 horas tienen una sobrevida testicular de 90-100%. Cuando la cirugía ocurre entre las 6 y 12 horas, la sobrevida testicular desciende a 20-50%. Sobre las 12 horas de evolución la sobrevida testicular será menor al 10%121,122.
La torsión testicular debe ser reconocida ya que se presenta habitualmente en los servicios de urgencia. A pesar de una intervención quirúrgica rápida, hasta el 40% de los testículos puede no ser salvado. De los testículos que se consideran viables en el momento de la exploración escrotal, más del 25% progresa a atrofia testicular.
Condiciones anatómicas y factores desencadenantes involucrados en la torsión testicular son descritos en la Tabla 7.
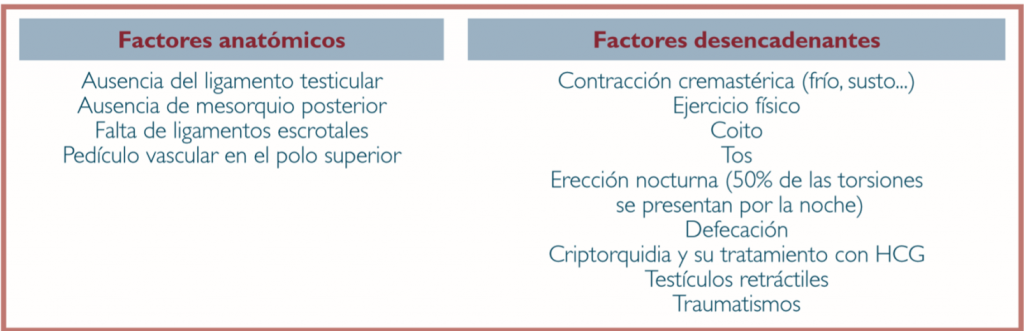
Tabla 7. Factores asociados a torsión testicular
Presentación clínica
El dolor es agudo, de inicio brusco, de intensidad progresiva, puede irradiarse al canal inguinal o al hemiabdomen inferior y acompañarse de náuseas y vómitos. En general, no hay eventos precipitantes, pudiendo presentarse mientras el niño duerme o al momento de despertar, aunque ocasionalmente está en relación con períodos de actividad física importante o frío intenso.
Algunos pacientes debutan con dolor a nivel del hemiabdomen inferior y/o inguinal. Después de algunas horas el dolor puede migrar hacia el escroto. Si ante esta presentación clínica no se ha sospechado inicialmente una torsión testicular, el diagnóstico definitivo puede ser tardío y asociarse a pérdida testicular. El testículo es inervado por los segmentos medulares T10-T11. El escroto por su parte es inervado por los segmentos L1 (por cara anterior) y S2-S3 (por cara posterior); ello explica que el dolor inicial pueda ser abdominal, es decir extra escrotal, y luego migrar a escroto123. De aquí la importancia de considerar siempre la torsión testicular dentro del diagnóstico diferencial de un dolor abdominal, particularmente en el adolescente124.
Al examen físico se observa moderado edema y eritema escrotal, con la piel indurada. El testículo afectado puede palparse ascendido y en posición horizontal, con el cordón espermático engrosado y doloroso. El reflejo cremastérico esta abolido. No hay alivio del dolor con la elevación escrotal (signo de Prehn negativo). Otra presentación clínica es la torsión testicular intermitente: el paciente refiere una historia recurrente de dolor agudo de inicio súbito, que cede espontáneamente después de algunas horas. El factor desencadenante suele ser el ejercicio o el frío. El cuadro cede espontáneamente. El examen físico es normal y la ecografía puede mostrar sólo una hipervascularización testicular. La torsión testicular intermitente puede causar isquemia segmentaria generando hipotrofia testicular120.
Estudio complementario
No existen pruebas de laboratorio que orienten el diagnóstico hacia una torsión testicular.
La ultrasonografía doppler puede servir de apoyo, con la ventaja de ser una técnica accesible, rápida y no invasiva. Sin embargo, durante las primeras horas de evolución suele resultar completamente normal. A medida que la torsión evoluciona clínicamente, aumentan también los hallazgos en la ultrasonografía: el teste se edematiza y aparecen zonas hipoecogénicas que corresponden a infartos hemorrágicos. El epidídimo está también edematizado y aumentado de volumen; se observa también engrosamiento de los tejidos peri-testiculares. Resulta útil y orientador visualizar el cordón espermático, sobre todo si se identifica la zona de torsión y el aspecto de espiral torcido.
El doppler puede además constatar ausencia de flujo en el testículo y en el cordón espermático. Su sensibilidad no es muy elevada (60-65%), pero su especificidad es alta (97-100%). La presencia de flujo testicular no descarta la torsión. El único criterio doppler que descarta la torsión es la perfusión arterial y venosa conservada a nivel testicular central125. Con total independencia de la disponibilidad de ultrasonografía, la exploración quirúrgica es el gold standard diagnóstico y terapéutico: cuanto más precoz, mayores son las posibilidades de rescate testicular126,127.
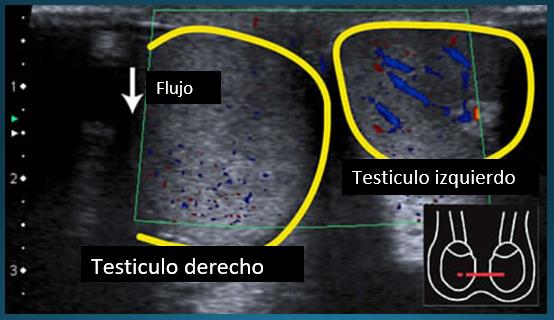
Fig 6. Flujo arterial disminuido en torsión testicular
Tratamiento
El tratamiento es quirúrgico con abordaje por vía escrotal. Luego de destorcer el cordón se debe observar durante algunos minutos el testículo para verificar si se produce reperfusión testicular. Este es un buen momento para realizar la orquidopexia contralateral; como se señaló, la malformación en “badajo de campana” es bilateral hasta en el 90% de los pacientes. La decisión de realizar una orquiectomía es compleja. La indicación formal es la evidencia de una necrosis testicular completa.
Frecuentemente existen dudas sobre la viabilidad de la gónada; la orquiectomía en estos casos por el riesgo de generar una reacción autoinmune, suponiendo que al romper la barrera hemato-espermática se generarían anticuerpos contra las espermatogonias, no ha sido demostrada. Hoy en día la decisión de extirpación por esta razón es controversial122. Asimismo, existe controversia respecto al tipo de pexia testicular. Clásicamente la pexia se realiza con dos puntos transalbugíneos, uno en cada polo testicular, con material no absorbible. La propuesta actual consiste en situar el teste en un neobolsillo de dartos, sin necesidad de puntos de fijación. No hay estudios comparativos sobre la incidencia de torsión recidivante empleando una u otra técnica. Las recomendaciones actuales son evaluar estrechamente la evolución testicular tras realizar una capsulotomía extensa, lo que permitiría disminuir el riesgo de un síndrome compartamental testicular128.
Kutikov et al en su reporte de casos propone la realización de incisión de la túnica albugínea y describe la mejoría clínica de la apariencia testicular y reaparición de isquemia cuando se vuelve a cerrar, por lo que propone adicionalmente la realización de un injerto con túnica vaginal para el cubrir el defecto128.
Con base a esta técnica quirúrgica, Figueroa et al en Toronto realizó un estudio comparativo sobre el número de orquiectomías realizadas en pacientes con torsión testicular a quienes únicamente se les práctico detorsión vs pacientes llevados a fasciotomía de túnica albugínea con injerto de túnica vaginal. Reportaron una reducción en el número de orquiectomía del 35.9% al 15%, con una tasa de salvamiento testicular del 54,6%129.
En cuanto a la técnica quirúrgica, posterior a la detorsión del testículo se procede a realiza una incisión generosa de la túnica albugínea la cual se extiende desde el polo superior al inferior del testículo, exponiendo el parénquima testicular, se confecciona el injerto de túnica vaginal del hemiescroto afectado bajo las mismas dimensiones de la incisión (figura 7). Se debe posicionar el injerto y suturar con sutura absorbible 5-0. Posteriormente se realiza fijación del testículo en el polo inferior al dartos con sutura absorbible130.
Fig.7 Técnica quirúrgica injerto túnica vaginal
Síndrome compartamental testicular (STC)
Un síndrome compartamental se define como una condición en que aumenta la presión dentro de un espacio limitado comprometiendo la circulación y la función de los tejidos en ese espacio.
El SCT se inicia con isquemia testicular, que genera hipoxia dentro del endotelio y los tejidos circundantes del testículo, lo que resulta en disfunción endotelial. Esto desencadena inflamación, edema y adhesión de neutrófilos y plaquetas, promovida por moléculas de adhesión como selectinas e integrinas. Los neutrófilos liberan especies reactivas de oxígeno (ROS) que no solo oxidan proteínas y ADN, sino que también causan peroxidación de fosfolípidos, lo que lleva a la destrucción de la membrana y la consiguiente liberación de enzimas autolíticas.
Durante la reperfusión ocurre una lesión por isquemia-reperfusión, que empeora el daño mediante una producción masiva de ROS, especialmente por xantina oxidasa (en el endotelio) y NADPH oxidasa (en leucocitos). Esto reduce los niveles de óxido nítrico (NO), afectando la vasodilatación y favoreciendo aún más la inflamación y el edema.
La disfunción endotelial prolongada compromete la microcirculación testicular. Las arteriolas sufren vasoconstricción, los capilares colapsan debido a la mayor presión extraluminal del edema y la disminución de la presión intraluminal de la adhesión de plaquetas y leucocitos, y las vénulas presentan gran adhesión celular, agravando el flujo venoso. Este proceso puede perjudicar la espermatogénesis y la función de las células de Leydig, con impacto potencial en la fertilidad131.
Conclusiones
La exploración quirúrgica precoz está indicada ante todo cuadro clínico sugerente de torsión del cordón espermático. La ecografía doppler testicular puede ser de utilidad para despejar o confirmar una sospecha diagnóstica: si el flujo testicular está conservado o aumentado, el manejo será conservador; si el flujo testicular está ausente, procede la exploración quirúrgica inmediata. Si la duda persiste está indicada la cirugía para asegurar la viabilidad testicular. Las técnicas descompresivas del síndrome compartimental testicular presentan mayor éxito en reperfusión y disminuyen complicaciones tardías asociadas a la torsión testicular. Está indicado realizar pexia del testículo contralateral en el mismo acto quirúrgico o a posterior si no se hizo en primera instancia.
PRIAPISMO
Introducción
El priapismo se define como una erección prolongada y dolorosa, sin relación con el deseo sexual. La Asociación Americana de Urología (AUA) y la Asociación Europea de Urología (EAU) consideran dentro de la definición un tiempo de erección mayor a 4 horas. El término priapismo viene del dios griego Priapos, cuya figura presenta una permanente y desproporcionada erección; en la civilización clásica encarnaba la fuerza fecundadora de la naturaleza. Fisiopatológicamente existe un desbalance entre el flujo arterial y el drenaje venoso peneano. El estado de erección se limita a los cuerpos cavernosos, sin afectar al cuerpo esponjoso o el glande como ocurre en la erección fisiológica. Con la introducción de inyecciones intracavernosas de fármacos vasoactivos en la práctica médica, la incidencia del priapismo aumentó enormemente, transformándose en una entidad frecuente en la consulta de urología general.
Fisiopatología
Para una respuesta eréctil normal debe existir un equilibrio hemodinámico entre el aporte arterial y el drenaje venoso de los cuerpos cavernosos. La ruptura de este equilibrio se traduce en una erección prolongada o en la detumescencia del pene. Se han descrito dos mecanismos responsables, con etiología, pronóstico y tratamiento diferentes132-136
.
Priapismo no isquémico, de alto flujo o arterial
La prolongación de la erección se debe a un flujo arterial aumentado de manera permanente, siendo el drenaje venoso normal pero insuficiente para provocar la detumescencia. No se debe a una miorrelajación activa de los cuerpos cavernosos. Es mejor tolerado que el priapismo isquémico porque no existe éstasis sanguíneo. Suele ser provocado por una fístula arteriocavernosa adquirida asociado a un trauma arterial o peneano con laceración de la arteria cavernosa o una de sus ramas. Aquí las lesiones cavernosas son menos graves y necesitan más tiempo que en el priapismo isquémico para manifestarse; generalmente la evolución de la erección es favorable (Figura 8).

Fig. 8. Fisiopatología del priapismo de alto flujo
Priapismo isquémico, de bajo flujo o veno-oclusivo
Es la forma más frecuente de presentación del priapismo la que puede evolucionar con alteraciones permanentes en la erección. Existe una obstrucción parcial o completa del drenaje de los cuerpos cavernosos. Una vez que éstos han llegado a su máxima expansión, la obstrucción impide que se produzca flujo de entrada de sangre arterial produciéndose un estado isquémico dentro de los cuerpos cavernosos (Figura 9).
Fig. 9. Fisiopatología del priapismo de bajo flujo
La obstrucción puede deberse a una compresión extravascular o intravascular de las venas de drenaje. El priapismo que se inicia por compresión extravascular puede acabar teniendo un componente intravascular debido a la formación de trombos en las vénulas de drenaje como consecuencia del éstasis sanguíneo. De la misma forma, al priapismo iniciado por obstrucción intravascular puede añadirse un componente extravascular debido al edema en el tejido trabecular.
Iniciada la isquemia, la pO2 y el pH de la sangre atrapada en los cuerpos cavernosos disminuyen, pudiendo llegar a la anoxia (pO2 de 0-10 mm Hg) y acidosis severa (pH de 6,6) luego de 3-4 horas desde su inicio. Tanto la acidosis como la anoxia causan depresión de la contractilidad del músculo trabecular, lo cual impide la desactivación del mecanismo veno-oclusivo necesario para que se produzca el drenaje de los cuerpos cavernosos135.
Dentro de los mecanismos propuestos está el déficit tanto de NO como de prostaglandina (PG) I2, ambos potentes inhibidores de la agregación plaquetaria, así como de la activación de las células inflamatorias. Su síntesis en el cuerpo cavernoso depende de la concentración de oxígeno y en la hipoxia (pO2 < 25 mm Hg) está prácticamente bloqueada. La ausencia de óxido nítrico y de PG I2 favorece la agregación plaquetaria y la formación de trombos en las vénulas, así como la infiltración del tejido trabecular por células inflamatorias. Estos hallazgos son tardíos en la evolución del priapismo, coincidiendo con la hipoxia severa. La primera alteración es el edema del tejido trabecular. Durante las primeras 12 horas dicho edema es escaso y el infiltrado de linfocitos esporádico. Entre 12 y 24 horas se producirá daño celular, afectándose primero las células de las fibras musculares lisas y luego las endoteliales, transformándose en células semejantes a fibroblastos, no contráctiles y capaces de sintetizar colágeno, lo que evoluciona a fibrosis. A partir de las 24 horas aparece necrosis focal de las células y se hace irreversible el daño de la erección. Si el priapismo se prolonga más de 48 horas surgen coágulos en los espacios cavernosos, desapareciendo el endotelio con masiva infiltración inflamatoria, necrosis celular y fibrosis trabecular133,135.
Etiología
Se clasifica en primario o idiopático y secundario.
- Primario: 30-40% de los pacientes. Éstos suelen tener un patrón anormal de actividad eréctil en la prueba de tumescencia nocturna. El edema trabecular consecutivo a erecciones prolongadas sería el punto de partida. Suelen referir como antecedente estimulación sexual potenciada a veces por fármacos. Casi siempre este tipo de priapismo se presenta como isquémico o de bajo flujo. Con mejor conocimiento de la actividad farmacológica, disminuye su incidencia ya que se reclasifica como priapismo secundario a fármacos137-141.
2. Secundario: 60-70% de los pacientes. Sus causas son diversas:
2.1. Medicamentos y drogas: 20% de las causas de priapismo. La inyección intracavernosa (IIC) de fármacos vasoactivos es una de las causas más frecuentes de priapismo, relacionado con el mayor uso de estos agentes en el tratamiento de la disfunción eréctil. Estos fármacos actúan incrementando el flujo arterial con disminución del retorno venoso. Se incluyen también antagonistas beta-adrenérgicos, atropina y prostaglandinas. En las IIC las sustancias más utilizadas son los relajantes de la musculatura lisa (papaverina) y los antagonistas alfa-adrenérgicos (fenoxibenzamina, fentolamina y nicergolina). Se ha generalizado la utilización de prostaglandinas, acorde menor riesgo de priapismo. Psicofármacos: fenotiazinas, trazodona, clonazepam. Antihipertensivos: prazosina, hidralazina, labetalol. Anticoagulantes, anestésicos. Otros: tamsulosina, tolbutamida, andrógenos, corticoides, alcohol y cannabis, éstos dos últimos también como potenciadores de otros fármacos.
2.2. Causas locales: trauma perineal y/o peneano, fístulas arteriovenosas por punción. Neoplasias, inflamaciones perineo-genitales.
2.3 Hematológicas: Leucemia supone el 15% de los casos en niños y el 3-6% en adultos. Leucemia crónica con mayor frecuencia provoca priapismo, aunque también la leucemia mieloblástica aguda y linfoblástica. Existe acumulación celular en los cuerpos cavernosos y en la vena dorsal del pene, infiltración leucémica del nervio sacro, obstrucción mecánica de venas y nervios abdominales consecutiva a la esplenomegalia y la estimulación directa del sistema nervioso central. El mieloma múltiple por aumento de la viscosidad plasmática, la talasemia, la policitemia y la anemia hemolítica congénita no esferocítica, también pueden provocar priapismo. La trombocitopenia presenta hemorragias espontáneas con trombosis de las venas superficiales y profundas, contribuyendo al éstasis. Anemia de Células Falciformes es una causa clásica en literatura anglosajona, constituyendo del 10 al 30% de los casos. En afroamericanos y sobre todo niños puede alcanzar hasta un 63%, con recurrencias frecuentes. En ellos las lesiones irreversibles son menos frecuentes que en los adultos, aunque sigue siendo una enfermedad rara en Chile. La acumulación de glóbulos rojos deformes produce enlentecimiento del flujo durante la erección, incrementando la acidosis y la hipoxia, produciéndose nuevas acumulaciones de células y enlentecimiento adicional del drenaje venoso.
2.4. Neurológicas: 3%, procesos irritativos del sistema nervioso central (SNC) pueden generar hiperestimulación de los centros de la erección cerebral o medular. También la esclerosis múltiple, tabes dorsal, mielitis transversa, rotura de aneurisma intracraneal, compresiones de la cola de caballo por HNP, por estenosis degenerativa del canal lumbar o por aracnoiditis y trauma encefálico o raquimedular. (priapismo del ahorcamiento).
2.5. Urológicas: actúan sobre el SNC por irritación local: condilomas acuminados intraruretrales, parafimosis, balanopostitis, prostatitis, uretritis, litiasis vesicales y uretrales.
2.6. Neoplasias: 3-8% de las causas de priapismo. El flujo venoso disminuído por la obstrucción neoplásica local o metastásica. El priapismo es muy frecuente en los carcinomas metastásicos de pene o por invasión peneana de neoplasias cercanas (vesical, prostática y rectal).
2.7. Metabólicas: Diabetes Mellitus tipo 1 en el 5,7% de los casos. Amiloidosis, Enfermedad de Fabry, en la que depósitos lipídicos ocluyen el sistema venoso produciendo estasis. Menos frecuente, la alimentación parenteral.
2.8. Enfermedades infecciosas: es anecdótica: parotiditis con o sin orquitis, tularemia, rabia y rickettsiosis. En Egipto una causa frecuente de priapismo en niños es la picadura de alacranes.
Cuadro clínico
Diagnóstico 137-142
El priapismo debe considerarse en primera instancia como una urgencia médica y se debe determinar a la brevedad si es o no isquémico. El urólogo general debe indagar sobre episodios previos de erecciones prolongadas y preguntar sobre la toma de medicamentos, alteraciones hematológicas, presencia de tumores, retención urinaria, etc.
Puede haber historia de erecciones frecuentes o prolongadas (en general menos de 2-3 horas) que llegan a la detumescencia espontánea o de episodios post eyaculación donde el pene se ha mantenido erecto durante un tiempo prolongado. La anamnesis próxima en general es suficiente para sospechar una u otra forma de priapismo.
El priapismo de alto flujo (PAF), no isquémico o arterial, se manifiesta como un cuadro menos dramático, con dolor menos intenso, siendo la consistencia del pene más elástica. Por el contrario, en el priapismo de bajo flujo (PBF), isquémico o veno-oclusivo, el paciente tiene el pene muy rígido y doloroso.
El paciente debe tener una anamnesis y exploración física completas, que han de insistir en características de dolor y tiempo de evolución, patologías de base, uso de fármacos, antecedente de IIC de fármacos vasoactivos, consistencia de la erección. Hay que determinar la hemodinamia de los cuerpos cavernosos. Esto puede hacerse con la gasometría cavernosa y/o con el ecodoppler peneano. Durante la erección normal la pO2 en la sangre de los cuerpos cavernosos es de tipo arterial (pO2 100 mm Hg). Se realiza la punción-aspiración de sangre de los cuerpos cavernosos, fijándose en la presión a la que sale, el resultado de la gasometría (pH, pCO2, pO2, CO3H y BE) revelará las características del flujo sanguíneo. Se debe de interpretar mediante su comparación con la gasometría arterial.
En el PBF habrá hipoxia y acumulación de desechos metabólicos ácidos. Si la pO2 arterial es 100 mm Hg y la del cuerpo cavernoso es 60 mm Hg, existe un estado isquémico. La acumulación de CO2 y la reducción del pH son esperables a las 3-4 horas de isquemia y nos guían hacia el diagnóstico. El ecodoppler comprobará un incremento del flujo arterial en el PAF, mientras que será evidente en el PBF que no existe dicho incremento.
La cavernosografía demuestra la aparición de un flujo venoso normal tras la inyección de contraste en los cuerpos cavernosos en el PAF. En el PBF el flujo de salida del contraste yodado desde los cuerpos cavernosos es lento y disminuido. La arteriografía de arteria pudenda interna se aprecia opacificación de los cuerpos cavernosos por el contraste proveniente del sistema arterial en el caso del PAF. En el PBF no se visualizarán las arterias cavernosas, sólo las dorsales y bulbouretrales. La gammagrafía demostrará en el PAF como el 99 Tc intravenoso o intracavernoso se distribuye regularmente por ambos cuerpos cavernosos. En la PBF la difusión del isótopo se encuentra muy disminuido.
Priapismo de bajo flujo
El paciente presenta una erección dolorosa de varias horas de duración. Exceptuando los casos asociados a IIC, el paciente suele notar por primera vez la erección prolongada al despertarse, en mitad de la noche, o después de mantener relaciones sexuales. Esta relación temporal con erecciones nocturnas o sexuales sugiere que en muchos casos la alteración primaria es la interferencia con los mecanismos fisiológicos que regulan la detumescencia. El pene resulta doloroso al tacto, con compromiso de sólo los cuerpos cavernosos; el glande es flácido y la superficie ventral del pene es plana ya que no participa el cuerpo esponjoso como en una erección normal. En los casos asociados a IIC, el paciente acude al Servicio de Urgencias porque se le indicó en la consulta que así lo hiciera, si la erección persistía más allá de cuatro horas. Esto ocurre en las fases iniciales del tratamiento de la disfunción eréctil cuando se titula la dosis más adecuada del fármaco y en pacientes jóvenes o que presentan disfunción eréctil neurogénica. Ocurre con mayor frecuencia cuando el fármaco inyectado es la papaverina (2-10%) y menos frecuentemente con prostaglandina E1 (< 1%).
Con gasometría con valores de pH < 7,35, pO2 < 80 mm Hg y pCO2 > 45 mm Hg se catalogará como priapismo de bajo flujo. Acorde el tiempo de evolución y resultados de gases en sangre cavernosa, se diferencian dos situaciones:
- PBF en fase no isquémica: tiempo de evolución menor de 12 horas. Gasometría moderadamente alterada.
- PBF en fase isquémica: tiempo de evolución mayor 12 horas, valores gasométricos muy alterados. En este caso, el edema trabecular, la trombosis de las venas de drenaje y la profunda depresión de la contractilidad del músculo trabecular hacen que la irrigación con agonistas α-adrenérgicos fracase.
Priapismo no isquémico (arterial o de alto flujo)
El paciente refiere historia de trauma que, cuando es una contusión perineal o de pene, puede haber ocurrido desde unas horas, hasta unos días antes de la aparición del priapismo. Cuando se trata de un trauma penetrante, el priapismo suele instaurarse de inmediato. Aunque algunos pacientes manifiestan ciertas molestias asociadas con la erección, esta forma de priapismo suele ser indolora y no presenta el dolor isquémico severo que caracteriza el priapismo veno-oclusivo. El pene suele estar en un estado de erección incompleta (60-75%), no es doloroso al tacto y presenta consistencia elástica.
Tratamiento 145-150
El tratamiento del priapismo debe ser considerado como una urgencia. Urgencia diferida cuando se trata de un PAF y urgencia inmediata si se trata de un PBF, especialmente si se demuestra que está en la fase de isquemia cavernosa. Puede resolverse espontáneamente, lo que ocurre con más frecuencia en el niño, por lo que a veces precisa observación. Sin embargo, es recomendable establecer un tiempo prudente de espera (3-4 horas), superado el cual será necesario instaurar tratamiento. Sea cual fuere el tipo de priapismo, la sedación y la analgesia, así como una adecuada hidratación del paciente, deben ser la norma (Figura 10).
Fig. 10. Algoritmo para el manejo del priapismo
Priapismo de bajo flujo
Con gasometría con valores de pH < 7,35, pO2 < 80 mm Hg y pCO2 > 45 mm Hg se catalogará como PBF. Acorde el tiempo de evolución y resultados de gases en sangre cavernosa, se diferencian dos situaciones:
1. Fase no isquémica: aspiración-lavado de los cuerpos cavernosos, junto con inyección intracavernosa de fármacos alfa1-adrenérgicos. Si esto fracasa, está indicado el tratamiento quirúrgico.
El drenaje de la sangre de los cuerpos cavernosos en un priapismo de corta duración (4-8 horas) no suele necesitar anestesia, ya que suele ser poco doloroso y, en general, no requiere mucha manipulación. No obstante, se puede anestesiar el surco balanoprepucial, lo que permite introducir agujas de mayor calibre. Para los priapismos más dolorosos y de mayor duración, se puede realizar un bloqueo del nervio dorsal, así como de ramas nerviosas cutáneas alrededor de la base del pene (bloqueo sensorial del pene). En pacientes agitados, con mucho dolor o con priapismo de larga duración es aconsejable la anestesia espinal o epidural o incluso la anestesia general. Se deben utilizar agujas de calibre grueso (de 19 a 14 G). La aspiración se debe hacer lentamente a la vez que se ejerce compresión o masaje del pene. Si la aspiración causa detumescencia total del pene, se cierra la aguja de drenaje y se espera aproximadamente 15-20 minutos para ver si la erección se vuelve a restablecer o el pene permanece flácido. Si la erección reaparece, se plantea la inyección intracavernosa de alfa-agonistas como fenilefrina o metoxamina, monitorizando frecuencia cardíaca y presión arterial.
La fenilefrina se puede preparar de dos formas distintas, dependiendo si es para inyección o para irrigación. Para inyección se utiliza una solución de 1 mg de fenilefrina por cada 1 ml de suero fisiológico (SF) con dosis de 0,2-0,3 ml (de 200 a 300 mg de fenilefrina por inyección) que se pueden repetir sin exceder 1-1,5 mg. Para irrigación, se mezclan 10 mg de fenilefrina en 1 litro de SF, obteniendo en la solución una concentración de fenilefrina de 10 mg/ml. La irrigación se hace con 20-30 ml de esta solución con lo cual, al igual que para la inyección, con cada irrigación se introducen entre 200-300 mg de fenilefrina en el cuerpo cavernoso. Ante una crisis hipertensiva tras la administración de cualquiera de estos agonistas adrenérgicos, se puede administrar nifedipino 10 mg por vía sublingual.
La metoxamina se prepara diluyendo una ampolla (20 mg) en 5 ml de SF, inyectándose 1-2 ml de esta solución (4-8 mg de metoxamina) pudiéndose repetir la dosis hasta 30 mg en total (1,5 ampollas).
Cuando la sangre del cuerpo cavernoso ha aumentado considerablemente su viscosidad debido al prolongado período isquémico, el drenaje de los cuerpos cavernosos puede ser difícil. En este caso se puede intentar la irrigación de los cuerpos cavernosos inicialmente con 20-30 ml de suero fisiológico para facilitar el drenaje. Una vez drenados parcialmente los cuerpos cavernosos y observando la aparición de sangre fresca, se puede completar el drenaje y la detumescencia del pene irrigando con fenilefrina.
2. Fase isquémica: en este caso, y dado el mal pronóstico en cuanto a mantener la función eréctil, es aconsejable practicar directamente el tratamiento quirúrgico.
Priapismo de alto flujo
Gasometría de punción de cuerpo cavernoso muestra valores pH >7,35, pO2 > 80 mm Hg y pCO2 < 45 mm Hg y buen flujo doppler. Se sugiere mantener al paciente con hidratación adecuada. Posteriormente se procede a la inyección intracavernosa con agonistas α-adrenérgicos. Debido a la falta de compromiso isquémico de los cuerpos cavernosos, el tratamiento no es urgente, pudiéndose diferir. Esto lleva, incluso, al planteamiento por algunos autores de si es necesario o no tratar a estos pacientes. La falta de urgencia en el tratamiento es importante ya que tratamientos como la arteriografía supraselectiva pudenda con embolización de la arteria lacerada, pueden no estar disponibles en algunos centros médicos, requiriendo el traslado del paciente. La utilización del ecodoppler color permite una excelente visualización y localización de fístulas arterio-lacunares, lo cual permite confirmar el diagnóstico.
La arteriografía es una técnica invasiva que debe utilizarse con fines terapéuticos. La embolización con 3 ml de coágulo autólogo es efectiva como tratamiento definitivo en la mayoría de los pacientes. Tanto el coágulo autólogo como la esponja de gelatina son reabsorbidos con el tiempo, con recanalización de la arteria embolizada; puede realizarse seguimiento con ecodoppler color. El fracaso con la embolización arterial supraselectiva obliga a utilizar medios quirúrgicos más agresivos como son la ligadura directa de la arteria lesionada.
Tratamiento etiológico 143,145
El objetivo es cesar la estimulación patológica sobre la erección y disminuir recidivas.
Priapismo secundario a IIC de fármacos vasoactivos: se recomienda ejercicio físico durante unos 30 minutos, medida que en algunos casos logra la detumescencia. Si con esta medida no conseguimos resultados o bien el tiempo transcurrido de erección es prolongado, se debe proceder a la punción-aspiración en la cara lateral de los cuerpos cavernosos, cerca de la base del pene, con aguja tipo mariposa de 19G. Si el cuadro no remite, está indicada la IIC de fármacos agonistas α1 adrenérgicos. De persistir el priapismo, se hospitaliza el paciente para punción-aspiración bilateral, con toma de sangre para gasometría. Priapismo secundario farmacológico: supresión de agente causal. Anemia de células falciformes: hidratación, alcalinización y analgesia. Si persiste el priapismo, se debe realizar transfusión de glóbulos rojos, manteniendo la hemoglobina mayor al 12%. Leucemia: quimioterapia específica y radioterapia local. Evitar derivaciones quirúrgicas. Mieloma múltiple: quimioterapia y eritrocitoforesis. Trombocitopenia: plaquetoforesis. Neoplasias: quimio y/o radioterapia. También se ha utilizado trombolisis.
Tratamiento quirúrgico 144,147
Todas las técnicas de derivación están indicadas en la fase de isquemia avanzada y acidosis, cuando los métodos terapéuticos más conservadores (punción-aspiración-lavado e inyección con agonistas adrenérgicos) han fracasado en la restauración del drenaje venoso de los cuerpos cavernosos. Persiguen la creación de cortocircuitos por donde se drene la sangre acumulada en los cuerpos cavernosos.
Derivación cavernosoesponjosa transbalánica: la técnica más simple y más aconsejada inicialmente es la técnica de Winter. Mediante una aguja de biopsia prostática tipo Tru-cut, con anestesia local o regional, se atraviesa el glande y un cuerpo cavernoso. Con la realización de varios disparos se consigue la formación de varias fístulas en cada cuerpo cavernoso.
La misma técnica, pero con incisión con bisturí es la llamada técnica de Ebbehoj.
Menos usada es la técnica que realiza una derivación entre el cuerpo esponjoso y los cuerpos cavernosos o técnica de Al-Ghorab: con una incisión dorsal transversa en el glande se libera y escinde un círculo de tejido de ambos ápices cavernosos, cerrando posteriormente la mucosa balánica.
Derivación cavernosoesponjosa a nivel de la base del pene, incidiendo a nivel de periné se realiza una anastomosis entre dichas estructuras. Puede ser uni o bilateral.
Derivación safenocavernosa: Si con las técnicas anteriores no se soluciona el cuadro, se procede con la técnica de Gryhack, con vías de abordaje combinada crural y peneana se consigue el drenaje cavernoso por la vena safena interna.
Prótesis de pene: alternativa válida para PAF y PBF de más de 24 hrs. de evolución, donde las derivaciones tienen bajas tasas de éxito, acorde lineamientos de la AUA y la EAU. De preferencia prótesis de 3 componentes, en manos de experto.
Pronóstico
Independientemente de la etiología, el pronóstico depende del tiempo de evolución y de ello depende el enfoque terapéutico. A partir de las 24 horas aparece necrosis focal y la posibilidad de que las lesiones sean reversibles va disminuyendo. Si persiste durante más de 48 horas, se producirá pérdida de endotelio, coágulos intracavernosos, necrosis de vasos y nervios, inflamación y necrosis de la musculatura lisa. La evolución natural, una vez producidas estas lesiones, es hacia la flacidez peneana, dejando como secuela una disfunción eréctil.
PAF y el que se produce en los niños tiene mejor pronóstico en relación a la erección posterior. Es básico explicar al paciente los objetivos que se persiguen con el tratamiento y las escasas posibilidades de mantener una buena erección posteriormente, cercana al 50%147.

Figura 11. Diagnóstico y manejo médico del priapismo
ENFERMEDAD DE PEYRONIE
Definición
La Enfermedad de Peyronie (PD) es el desarrollo progresivo de una placa fibrótica en la túnica albugínea peneana, que en la erección puede generar deformidades como incurvaciones, estrechamiento o acortamiento, pudiéndose acompañar de dolor y alteraciones en la calidad de vida sexual. Tiene una incidencia es de 22,4 a 25,6 casos por 100.000 hombres, una prevalencia del 0,4 al 13% y se presenta con mayor frecuencia entre los 50 y 60 años 138-139.
Esta enfermedad es motivo de consulta poco frecuente para el urólogo, en un estudio brasileño de 656 pacientes que consultan al urólogo en el sistema público, es un hallazgo clínico en un 13% de los pacientes que consultan por otra causa urológica y un 0,25% de los pacientes consultan específicamente por la enfermedad 3; de hecho, muchos pacientes tienen distintos grados de incurvación peneana en erección, que no les revisten mayor disconfort en la actividad sexual y la placa fibrótica se presenta como un hallazgo en el examen físico. Los factores de riesgo más relevantes son tabaquismo, diabetes y obesidad 140. Existe asociación con otras enfermedades como la retracción palmar de Dupuytren, contractura de fascia plantar y timpanoesclerosis 141.
Fisiopatología
La teoría del microtrauma describe que en la actividad sexual se presentan poco perceptibles pero reiteradas lesiones en la túnica albugínea, con depósito extravascular de proteínas, atrapamiento de fibrina, reclutamiento de macrófagos, sobreexpresión de citoquinas proinflamatorias y liberación de elastasa, generando mayor proporción de colágeno tipo 3 en la albugínea, con remodelación patológica por fibroblastos, dejando tejido cicatricial que nuevamente vuelve a sufrir lesiones en la próxima actividad sexual, perpetuando ciclos de reparación y fibrosis que generan una placa rígida en la túnica albugínea , que pierde su capacidad elástica y distensibilidad en este sitio, sirviendo de pivote para que en el llenado de los cuerpos cavernosos en la erección se produzca deformidad peneana 141-143 .
Diagnóstico
Anamnesis: hay que diferenciar deformidades congénitas de las adquiridas, consultar por antecedentes de trauma peneano, preguntar por calidad de la erección previa y actual, antecedentes personales o familiares de enfermedades como el Dupuytren. Se puede objetivar la erección con cuestionarios dirigidos como el IIEF-5 y existen instrumentos como el Disease Questionnaire Peyronie´s, de reciente validación. No olvidar los aspectos psicológicos, investigar cómo le afecta la enfermedad a la calidad de vida del paciente 144-146. Se deben diferenciar 2 fases de la enfermedad, activa primero y estable después, ya que los tratamientos varían en cada fase. En la fase activa, el síntoma cardinal es el dolor peneano, que puede ocurrir con o sin erección. Puede estar el antecedente de trauma peneano durante el coito y la placa y/o deformidades no van a ser evidentes; la erección puede estar conservada. En la fase estable, los síntomas se han mantenido estables por más de 3 meses, el dolor con o sin erección ha disminuido su intensidad y la deformidad, que habitualmente es una curvatura dorsal o dorsolateral, se hace evidente en erección.
Examen físico: es poco probable que el paciente tenga el pene erecto en el box, por lo que primero hay que medir el largo peneano en flacidez, palpar el pene buscando el número, ubicación, tamaño y consistencia de la o las placas. Si existen placas a ambos lados del pene o en el septo intercavernoso, pueden provocar un acortamiento del pene sin curvatura. El gold standard sigue siendo examinar el pene en erección después de aplicar IIC, donde se medirá el largo del pene, rigidez de la erección, grados de desvío del eje axial de la curvatura, deformidades rotacionales y estabilidad peneana; esto tiene mayor utilidad en el paciente que además refiere síntomas de disfunción eréctil. Si no se dispone de IIC, ayuda que el paciente muestre fotos de su pene en erección máxima ayudado por iPDE-5.
Exámenes complementarios
Ecodoppler color peneano: este examen se hace con el pene en erección y sus resultados están estandarizados y validados para un pene bajo el efecto de IIC; también puede servir realizarlo bajo el efecto de gel endouretral como alprostadil. Su objetivo es identificar el grosor de la albugínea, características y número de las placas, siendo de mal pronóstico la calcificación y la presencia de múltiples placas 147-148. Evaluando la velocidad sistólica máxima, velocidad diastólica final e índice de resistencia, también identifica insuficiencia arterial o disfunción veno-oclusiva. No está disponible en todos los centros y su utilidad es mayor en la planificación de la cirugía.
Resonancia magnética: RM en fase T2 sin substracción del tejido adiposo tiene gran utilidad para determinar las características de la placa y los tejidos adyacentes, pero no está disponible en todos los centros y, por su alto costo, se utiliza sólo en centros de referencia cuando la ecografía es insuficiente.
Tratamiento Médico
Los objetivos del tratamiento de PD son tratar el dolor, corregir la deformidad peneana preservando el largo peneano y mantener una erección que permita actividad sexual satisfactoria. Dentro de la terapia de inyección intralesional, se ha descrito la colagenasa de clostridium histolyticum (CCH), verapamilo y el interferón α-2b.
El primero de éstos es el único aprobado por la FDA149. Se estipula que hidroliza fibras de colágeno y disminuye la producción de matriz extracelular, citoquinas y factores de crecimiento, degradando placas existentes y suprimiendo su nueva formación. Los primeros 2 ensayos clínicos (IMPRESS I y II) evidenciaron mejorías significativas en el cambio porcentual de la curvatura del pene (34% vs 18%) y en la puntuación de molestias por síntomas (PDQ) (−2.8 vs −1.8) vs placebo. Estos datos fueron analizados 5 años después por Goldstein et al, evidenciando una disminución adicional de 9% en la curvatura y mayor disminución en el PDQ 150. Posteriormente, múltiples estudios han demostrado una mejora en el grado de curvatura entre 13° a 23°, PDQ e IIEF. Un estudio de seguimiento a largo plazo (promedio de 4.7 años) encontró que los factores más importantes para la satisfacción del paciente son las mejoras objetivas en la curvatura y la función sexual. La misma investigación señaló que la insatisfacción a largo plazo se asociaba con el dolor durante la inyección, la duración del tratamiento y la falta de mejoría percibida.
Para mejorar la eficacia, algunos centros han modificado los protocolos combinando la CCH con terapia de tracción peneana y modelado más vigoroso, reportando mejores resultados 151-152.
El verapamilo y el interferón α-2b no tienen efectividad demostrada.
La terapia de tracción peneana (PTT), descrita desde el año 2008, ha demostrado mejoría estadísticamente significativa en la curvatura peneana, longitud y en la capacidad de lograr una relación sexual penetrativa en comparación a terapia oral y tópica 153, pero carece de estudios a largo plazo. PTT es más efectiva en la fase aguda de la enfermedad y en pacientes con placas no calcificadas, requiriendo un alto grado de cumplimiento por parte del paciente para ser eficaz 154.
La terapia de erección por vacío (VED) carece de evidencia y de resultados como monoterapia155, asociado a la dificultad de comparar la variedad de dispositivos existentes.
Dentro de las nuevas opciones, la terapia de ondas de choque de baja intensidad (LiESWT) cuenta sólo con estudios retrospectivos y prospectivos monocéntricos, sin resultados concluyentes156. En línea con esto, una reciente revisión sistemática y metaanálisis de ensayos controlados aleatorizados confirmó que LiESWT puede reducir el tamaño de la placa y aliviar el dolor, pero no tiene un efecto significativo en la mejoría de la curvatura ni en la función sexual157. Por lo tanto, tanto la guía clínica de AUA como la de EAU indican que sólo se puede ofrecer como terapia para el manejo del dolor158.
El plasma rico en plaquetas (PRP) y los antioxidantes no tienen evidencia que avale su uso. Si bien estudios preliminares sobre PRP y toxina botulínica (Botox®) han mostrado resultados promisorios, se necesita más investigación para establecer su eficacia y seguridad a largo plazo. Cabe mencionar que actualmente no existe recomendación para tratamiento por vía oral por parte de las principales guías clínicas, ya que sus resultados en seguridad y eficacia son heterogéneos y no probados. En estos casos, sólo se podría indicar iPDE-5 para mejorar la calidad de la erección159.
TRATAMIENTO QUIRÚRGICO
Son indicaciones de cirugía la falla del manejo médico, placas múltiples desde el comienzo de la enfermedad, preferencia del paciente cuando la enfermedad se encuentra en fase estable. Deben haber pasado 6-12 meses desde el inicio de la enfermedad, placa estable por 3-6 meses y deformidad que dificulta el coito. Deben objetivarse el desempeño sexual previo en cuanto a frecuencia de actividad sexual, calidad de la erección previa y molestias en el coito secundarias a la deformidad peneana (incurvación, acortamiento, rotación). Se deben exponer expectativas reales respecto del cumplimiento de los objetivos de tratamiento con la cirugía y sus riesgos. Hacer énfasis en la posibilidad de acortamiento peneano, en el concepto sobre que el pene es recto en términos funcionales si tiene una desviación post cirugía menor a 20°, que puede presentar disfunción eréctil y que puede necesitar procedimientos adicionales160.
Existen 3 tipos de cirugía para PD:
1. Plicaturas: de preferencia se indica en hombres con pene de largo conservado porque la cirugía lo acortará al unir puntos en el lado convexo de la curvatura. La función eréctil idealmente debe estar conservada con o sin ayuda farmacológica y no debe haber deformidad en “reloj de arena”. Hacer una incisión como la de la circuncisión facilita la exposición de la túnica albugínea con estas técnicas. Tasas de éxito entre un 42-100%, que mejoran con dispositivos de tracción desde el postoperatorio temprano, después de la cicatrización cutánea. Pacientes no satisfechos con la cirugía refieren acortamiento del pene (95%), disfunción eréctil (8%), dolor (10%), deformidad peneana persistente (2-28%) y disminución en la sensibilidad (24%).
a) Técnica de Nesbit: consiste en la escisión de una o más elipses de la túnica albugínea en el lado convexo de la curvatura, con el fin de acortarla mediante puntos de material no reabsorbible con nudos que deben estar relativamente laxos para mantenerse en su posición en la erección y con esto, rectificar el pene. Fue descrita en el año 1965 para tratar curvaturas congénitas del pene.
b) Técnica de Yachia: mismo principio que en el Nesbit, pero se realiza una incisión vertical en la albugínea, que se cierra transversalmente.
c) Plicaturas puras: sin incisiones en la albugínea, consiste en pasar puntos tipo Lembert en forma extendida uniendo el tejido en la convexidad de la curvatura.
d) Plicaturas de túnica albugínea: se realizan incisiones transversales en las fibras longitudinales externas de la albugínea, respetando las fibras circulares internas, separadas entre 0,5 a 1 cm. Se remueven las fibras longitudinales entre las 2 incisiones transversales para disminuír el aumento de volumen de la plicatura.
2. Técnicas con Injertos: indicados en pacientes con acortamiento peneano severo, deformidades severas, placas grandes, pene en “reloj de arena”, pero con función eréctil todavía conservada. Debe mencionarse al paciente que los injertos no aseguran que se vuelva al largo original del pene previo a PD. Para el injerto está en desarrollo la bioingeniería de tejidos, se utiliza submucosa de intestino delgado, vena safena, fascia temporal, fascia lata, túnica vaginal, etc. Debe mencionarse siempre la posibilidad de complicaciones también en el sitio donante del tejido.
a) Incisionales: se realizan incisiones en la albugínea para después injertar tejido en la concavidad de la curvatura, alargándola y rectificando el pene. Por mencionar algunas técnicas se utilizan incisiones en “doble Y”, “en H” y la geométrica de Egydio.
b) Excisionales: pueden ser totales o parciales. Teóricamente las técnicas de excisión parcial de la placa, disminuyen el riesgo de un daño irreversible al tejido eréctil, con la menor probabilidad de disfunción eréctil por falla en el mecanismo veno-oclusivo.
3. Prótesis peneana: es el gold standard de tratamiento del paciente con PD con indicación quirúrgica y disfunción eréctil161. En manos de un cirujano con experiencia sus tasas de éxito son mayores al 80%. Las inflables tienen mayor grado estadístico de evidencia y recomendación, con mejores resultados estéticos y funcionales. La infección y extrusión de prótesis son las complicaciones más temidas. Debe informarse al paciente muy bien en que consiste el tratamiento y explicar claramente su funcionamiento6.
Inteligencia Artificial
Considerando las dificultades que puede presentar la medición correcta de angulación o de la placa en base a la goniometría o fotografías 2D (especialmente en deformidades complejas o múltiples placas), se han desarrollado nuevas tecnologías con IA para crear modelos 3D que permiten una mayor precisión en las mediciones de curvatura y ángulo, con el objetivo a futuro de automatizar las mediciones con una correcta evaluación de deformidades/placa(s) y así tomar una correcta decisión terapéutica. Esta tecnología aún está en desarrollo162.
CONCLUSIONES
PD es poco frecuente en la literatura. Sin embargo, su incidencia y prevalencia están sometidas sesgos, como incurvaciones que los pacientes no consideran enfermedad, presentar otro motivo de consulta o que se presente como un hallazgo al entrevistar al paciente.
Habitualmente existe un desmedro en la calidad de vida sexual del paciente, lo que conlleva trastornos del ánimo que también deben tratarse; “siéntese a escuchar a su paciente y pareja”. Es responsabilidad del urólogo identificar tempranamente esta enfermedad y explicarle al paciente y su pareja las opciones de tratamiento.
Debe aclararse que el tratamiento de esta enfermedad habitualmente es multimodal, incluyendo manejo médico, quirúrgico, kinésico y psiquiátrico.
No todos los urólogos manejan las variadas técnicas quirúrgicas para resolver esta enfermedad y es responsabilidad del urólogo en formación adentrarse en esos temas, que escapan a los objetivos de este capítulo. Cuando se presente un paciente con PD en su centro formador, aprovéchelo como una oportunidad para profundizar conceptos urológicos y quirúrgicos, que a menudo se olvidan en el ejercicio profesional.
VARICOCELE
Introducción
La asociación de varicocele con infertilidad masculina data desde el siglo cuando Celsius reportó la relación entre venas escrotales dilatadas y atrofia testicular163.
Macomber y Sanders demostraron en 1929 el beneficio reproductivo de la varicocelectomía al reportar parámetros seminales normales y fertilidad después del procedimiento en paciente con oligospermia e infertilidad164. A pesar de este y otros reportes, la varicocelectomía no se popularizó como un tratamiento quirúrgico en hombres infértiles hasta el trabajo de Tulloch en 1955. En esta serie de 30 paciente que fueron a varicocelectomía unilateral o bilateral, se demostró una mejoría en los parámetros seminales en 26 pacientes, de los cuales 10 recobraron la fertilidad normal con éxito en tasa de embarazo165, concluyendo que “cuando un varicocele está asociado con subinfertilidad, el varicocele debiese ser tratado”.
En primera instancia los vasos venosos sólo se clampeaban con un tipo de elásticos vasculares, los cuales fueron discontinuados a inicios del siglo XX por ligadura o resección del plexo pampiniforme a través de una vía inguinal o escrotal.
Debido a las altas tasas de falla y alto riesgo de dañar arterias terminales en el abordaje escrotal, Ivanissevich presentó una ligadura alta de la vena espermática interna, a través de una incisión inguinal alta o retroperitoneal166. En 1960 presentó su experiencia con 4470 casos, demostrando bajas tasas de complicaciones y también de tasa de falla, por lo que muchos urólogos continúan usada alguna modificación de su técnica hasta hoy en día167. Otras técnicas más avanzadas, como la microcirugía en 1980 han demostrado buenas tasas de éxito con menor morbilidad, al poder realizar de mejor manera la preservación de la arteria espermática interna y de vasos linfáticos168-179.
Anatomía
El varicocele es definido como una dilatación tortuosa de las venas del plexo pampiniforme. Clínicamente se encuentra en mayor medida en el lado izquierdo, aunque hay una amplia variación en reportes sobre la prevalencia de varicocele bilateral, que va desde 30 a 80%171. Un varicocele sólo del lado derecho es extremadamente raro y en caso de encontrarse debería estudiarse una posible masa retroperitoneal.
La razón por la prevalencia de varicoceles izquierdos puede ser clarificada por la anatomía retroperitoneal. La vena espermática interna izquierda drena de manera perpendicular en la vena renal ipsilateral; en cambio a derecha desemboca de manera oblicua en la vena cava inferior. Además, a izquierda la vena espermática tiene una longitud 8-10 cm más larga que la derecha, lo que genera un aumento de la presión hidrostática, como lo hace también su inserción perpendicular en la vena renal izquierda. Esto produce dilatación y tortuosidad de las venas gonadales por alteración del mecanismo valvular venoso172.
Otros estudios anatómicos descubrieron que recurrencias o el mismo varicocele era producto de venas espermáticas externas. Coolsaet173 analizó de manera retrospectiva 67 paciente con varicocele izquierdo quienes fueron a venografía preoperatoria y demostraron que la causa del varicocele era por disfunción en vena espermática interna, obstrucción de la vena iliaca común (resultando en dilatación de venas espermáticas externas) o ambos mecanismos. Murray174 evaluó 44 recurrencias de varicocele y reportó que 58% eran debido a colaterales inguinales (espermáticas externas).
Fisiopatología
Es conocido que el varicocele puede causar daño testicular progresivo e infertilidad. Lipschultz y Corriere demostraron que el varicocele resulta en atrofia testicular tanto en hombres fértiles como subfértiles175. Scott reportó sus hallazgos tras realizar biopsias testiculares bilaterales en 17 pacientes con varicocele unilateral, encontrando hipoespermatogénesis con disminución del grosor del epitelio germinal en ambos testículos176. Otros estudios han confirmado estos hallazgos y han reportado además áreas de ausencia de espermatogénesis y desprendimiento de células espermatogénicas177.
Las alteraciones producidas a nivel testicular por el varicocele son progresivas. Chehval y Purcell178 siguieron a hombres con varicocele en estudio por infertilidad; en intervalos de 9 y 96 meses encontraron una deterioración estadísticamente significativa en la densidad de espermas y motilidad, sugiriendo la deterioración testicular progresiva.
Diferentes hipótesis intentan explicar la correlación entre varicocele y disfunción testicular. El mecanismo más ampliamente conocido es la hipertermia testicular. Los testículos humanos están aproximadamente 1 a 2°C inferior a la temperatura normal del cuerpo. La termorregulación escrotal es mantenida por una delgada piel escrotal con ausencia de grasa subcutánea y un sistema de intercambio de calor que involucra al plexo pampiniforme. Los primeros en hablar de este sistema fueron Dahl y Herrick179 y en 1973 Zorgniotti y Macleod180 reportaron que pacientes oligozoospérmicos con varicocele tenían una temperatura intraescrotal bilateral significativamente más alta que pacientes normales, con una temperatura 0.6 a 0.7°C mayor. Estudios en animales y humanos han confirmado que el adicionar calor puede ser deletéreo para la espermatogénesis. Lue181, por ejemplo, demostró que escroto de ratas expuestos a 43°C por 15 minutos resultaba en un aumento de la apoptosis en espermatocitos y espermátidas.
Estudio
Presentación clínica y diagnóstico
El varicocele está presente en 15-20% de la población general, pero en pacientes con infertilidad se eleva a aproximadamente 35-40%182.
Un meticuloso examen físico es necesario para un acertado diagnóstico. Las condiciones ideales son una sala con buen ambiente y calor, un paciente que colabore y un tratante experimentado. Para facilitar el examen, el escroto debe estar con buena temperatura y relajado. Un ambiente frio o un paciente no confortable puede resultar en una retracción del escroto, lo que provocará dificultad para palpar un posible varicocele. Algunos clínicos incluso recomiendan usar un paño caliente para asegurar un examen físico eficiente183. El paciente debe ser examinado tanto en decúbito como de pie. Las venas tortuosas dilatadas han sido descritas como “bolsas de gusanos” por Dubin y Ameral184 y pueden reducirse significativamente o incluso desaparecer en la posición decúbito supino. Cuando hay sospecha de varicocele, pero no claramente palpable, debe realizarse maniobras de Valsalva en bipedestación.
Hallazgos típicos incluyen venas dilatadas sobre el testículo dentro del cordón espermático, más comúnmente en el lado izquierdo, asociado o no atrofia testicular. El varicocele derecho exclusivo es extremadamente raro y debe sospecharse patología del retroperitoneo en su etiología. De igual forma, un varicocele que no se reduce en posición supina debiese incluir las mismas sospechas e indicar estudio retroperitoneal.
Existen varios sistemas de clasificación. El propuesto por Dubin y Alemar185 describe sólo varicocele clínico:

| Tabla 8. Grados de Varicocele |
Varicocele clínico es definido como aquel que es palpable en el examen físico y sólo estos han sido asociados a infertilidad. Aunque existen diferentes modalidades radiológicas disponibles, el uso rutinario de imágenes no está recomendado para la detección del varicocele subclínico, es decir, no palpable185. A saber:
Ecografía
La ultrasonografía escrotal no está indicada de rutina en evaluación de hombres con varicocele. Sin embargo, cuando el examen físico no es concluyente puede ser usada para aclarar el diagnóstico. Chiou186 demostró una sensibilidad de 93% y especificidad de 85% para el flujo doppler color cuando era comparado con el examen físico; todos los varicoceles grado 2 y 3 encontrados en el examen físico fueron detectados bajo la ecografía doppler color. Petros187 demostró que la ecografía doppler detectó 93% de los varicoceles encontrados en el examen físico, mostrando la mejor correlación con la venografía. Por lo tanto, cuando el examen físico es dificultoso, la ecografía doppler puede ser útil en el diagnóstico.
La detección de varicocele subclínicos mediante ultrasonido y su manejo es controversial. Mihmanli188 utilizó ecografía doppler color en 208 unidades testiculares en pacientes infértiles en ausencia de varicocele palpable y encontró 94 varicoceles subclínicos. Sin embargo, la corrección de estos varicoceles no se asoció con mejoría de la fertilidad. Grasso189 randomizó 68 pacientes infértiles con varicocele subclínico operados vs. observación y no encontró mejoría en la calidad del espermiograma o paternidad. Yamamoto190 reportó resultados similares en 85 pacientes infértiles, observando una mejoría en la densidad espermática pero no diferencias significativas en la motilidad espermática, morfología o tasas de embarazo. Mientras no exista evidencia que muestre un beneficio reproducible del tratamiento del varicocele subclínicos, el uso de la ecografía como screening de venas espermáticas dilatadas no está indicado.
Venografía
La venografía espermática retrógrada es generalmente considerado el examen más sensible para la detección de varicocele. Dado su carácter invasivo usualmente se realiza sólo en conjunto con una oclusión terapéutica.
En pacientes con varicocele palpable, el reflujo ha sido reportado en 100% de los pacientes191. Sin embargo, su especificidad ha sido cuestionada por una tasa de falsos positivos considerable. Netto Junior192 demostró que no había diferencia estadísticamente significativa en presencia de reflujo de vena espermática en pacientes subfértiles con varicocele, fértiles con varicocele y en controles normales.
Hart193 realizó venografía intraoperatoria demostrando una tasa de 16% de drenaje contralateral que podría haber resultado en varicocele persistente. Dado la baja tasa de recurrencia y los avances con la microcirugía, la venografía intraoperatoria no es de rutina. Sin embargo, puede dar una mayor precisión anatómica en pacientes con varicocele persistente o recurrente.
Indicaciones de tratamiento
Infertilidad
Según la AUA Best Practice Policy “Report on Varicocele and Infertility”, el varicocele debiese ser tratado cuando todas las siguientes condiciones están presentes194:
1.-Varicocele palpable al examen físico escrotal
2.-Infertilidad
3.-Pareja femenina con fertilidad normal o causa potencialmente tratable
4.-Pareja masculina tiene espermiograma anormal
En pacientes infértiles el tratamiento del varicocele no está indicado si los parámetros del espermiograma están normales o si el varicocele es subclínico. Hombres adultos que no están activamente tratando de concebir, pero presentan un varicocele incidental, deben ir a consejería sobre los riesgos posibles en relación a temas de fertilidad y ofrecer un espermiograma.
Hombres con varicocele clínicamente palpable y espermiograma normal, pueden tener riesgo de disfunción testicular a futuro. Witt195 demostró que el varicocele era capaz de causar perdida de fertilidad progresiva. En su estudio retrospectivo observó que el varicocele fue identificado como causa de infertilidad en el 69% de hombres con infertilidad secundaria vs. 50% de hombres con infertilidad primaria, concluyendo que el varicocele altera progresivamente la fertilidad, lo que fue corroborado por Gorelick196. Por esta razón, a adultos jóvenes con varicocele clínicamente palpable, espermiograma normal y deseo futuro de paternidad se les puede ofrecer monitoreo con espermiograma cada 1 o 2 años. Frente a un resultado anormal, el espermiograma debe ser repetido y ofrecer tratamiento quirúrgico si persiste dicha alteración.
Hipogonadismo
El efecto negativo y progresivo del varicocele sobre la función de las células de Leydig ha sido propuesto por la asociación de varicocele y bajos niveles de testosterona sérica (TS). Es controversial el beneficio de la varicocelectomía para mejorar los niveles de TS. Los primeros estudios no mostraron un aumento estadísticamente significativo de dichos niveles post cirugía. Sin embargo, mucho de los estudios fueron de cohortes pequeñas197,198 e incluyeron pacientes con niveles de TS normales o muy cercano a la normalidad199,200.
Hombres jóvenes con hipogonadismo pueden presentar baja energía, libido disminuida y disfunción eréctil. Srini201 evaluó 200 hombres infértiles hipogonádicos con varicocele clínico y los dividió en 2 grupos: a quienes se realizó varicocelectomía vs. técnicas de reproducción asistida. En el primer grupo observaron un aumento estadísticamente significativo en la tasa de TS con 78% de pacientes logrando su normalidad; no hubo cambios en niveles de TS en hombres que fueron a técnicas de reproducción asistida. Además, observaron una reducción de pacientes con disfunción eréctil en el grupo de varicocelectomía, disminuyendo la prevalencia desde 44 a 31%, mientras en el otro grupo hubo leve aumento de 39% a 41%. La varicocelectomía en hombres con baja TS es discutible y actualmente no es una indicación clara de cirugía, excepto asociada a infertilidad. Existe evidencia emergente de aumento de TS luego de varicocelectomía con técnica microquirúrgica y podría ser a futuro una opción quirúrgica de tratamiento del hipogonadismo.
Varicocele sintomático
El varicocele puede presentar dolor, típicamente localizado al escroto o región inguinal, descrito por el paciente como una “sensación de peso”. Existe una gran variabilidad en la frecuencia, carácter e intensidad de este disconfort y se deben descartar otras causas de dolor antes de ser tratado el varicocele. Medidas conservadoras incluyen soporte/elevación escrotal, AINEs y analgésicos. Cuando estas resultan ineficientes puede ser indicado el tratamiento quirúrgico. Existe variabilidad considerable respecto a los resultados quirúrgicos en varicoceles sintomáticos, pero la mayoría de los reportes muestran altas tasas de éxitos en alivio del dolor, con tasas entre 42-100%202, incluyendo técnica microquirúrgica subinguinal203 y otras como laparoscópica y robótica204,205.
Tratamiento
El objetivo del tratamiento es detener el drenaje venoso espermático interno del testículo, preservando la arteria espermática interna, el conducto deferente y los vasos deferenciales y linfáticos del cordón espermático. Tratamientos definitivos incluyen cirugía y embolización venosa guiada por rayos. Aunque todos los tipos de tratamiento han mostrado ser efectivos, existe preferencia por la cirugía dado la experiencia con las diferentes técnicas y la baja tasas de complicaciones.
Abordaje inguinal y subinguinal
El abordaje inguinal fue inicialmente descrito por Ivanissevich67: exposición e incisión de la aponeurosis del oblicuo externo cuidando no dañar el nervio ilioinguinal. El cordón espermático es identificado y movilizado a nivel del tubérculo púbico y cuidadosamente levantado y asegurado con un drenaje tipo Penrose. Esta exposición también facilita la exposición de los vasos externos cremastéricos que pueden contribuir al varicocele. Con magnificación o microcirugía, el abordaje inguinal permite una excelente identificación de la arteria y vena espermática interna.
El abordaje subinguinal no considera abrir la fascia del oblicuo externo y ha mostrado menos disconfort postoperatorio206,107 y es preferido en muchos centros. Después de la incisión en piel a nivel del anillo inguinal externo, el cordón espermático es movilizado inmediatamente debajo del nivel del tubérculo púbico y asegurado con un Penrose para luego iniciar la disección del cordón, identificando las estructuras a preservar y las venas a ligar. La varicocelectomía microquirúrgica ha demostrado tener altas tasas de éxito y mínimas complicaciones cuando es comparada con modalidades no microquirúrgicas208, 209.
Estudios retrospectivos de cohortes numerosas han documentado tasas de recurrencia y complicaciones extremadamente bajas. Esas complicaciones incluyen hidrocele, atrofia testicular, dolor recurrente e infección210,211. Todos los pacientes deben ser informados sobre las indicaciones, riesgos y beneficios de la cirugía.
Abordajes quirúrgicos alternativos
El abordaje retroperitoneal descrito por Palomo212 involucra la ligadura de la vena espermática interna, superior al anillo interno. La incisión se realiza nivel del anillo interno, medial a la espina iliaca anterosuperior, y la disección se hace a través de los músculos y fascias del oblicuo externo e interno. La vena espermática interna es visualizada y luego ligada y seccionada. La principal ventaja de esta técnica es que es posible identificar la vena espermática interna antes de las colaterales, pero no permite acceder a las venas espermáticas externas, las cuales pueden contribuir a la persistencia del varicocele en el postoperatorio. Adicionalmente algunos pacientes pueden tener mayor dolor postoperatorio debido a la disección de la musculatura abdominal209.
El abordaje escrotal no es una técnica adecuada por su alta tasa de lesión de arteria espermática y la atrofia testicular secundaria, así como un inaceptable 40% de incidencia de hidrocele213, por lo que no se considerada una opción quirúrgica en la actualidad.
La varicocelectomía vía laparoscópica es una alternativa de abordaje por vía intraperitoneal. El procedimiento es similar al abordaje retroperitoneal abierto donde los vasos espermáticos externos no son identificados y se pone en riesgo la persistencia del varicocele. Sin embargo, hay menos dolor postoperatorio y retorno más rápido a la actividad normal. Una ventaja adicional de la laparoscopía es que puede realizarse con las mismas incisiones en caso de ser bilateral. La técnica ha demostrado ser segura y eficaz en manos experimentadas, aunque la incidencia de hidrocele y recurrencia son más altas que con microcirugía214.
Oclusión venosa percutánea
La embolización es considerada un abordaje no quirúrgico de varicocelectomía. La ventaja es la recuperación más rápida y con menor dolor. La tasa de éxito es ligeramente menor que con técnicas abiertas, con resultados que van entre 85- 95%215,216. Las complicaciones incluyen perforación vascular, migración del coil o balón, riesgo de reacciones alérgicas al contraste, así como la exposición a la radiación y sus potenciales efecto en la espermatogénesis, sobre todo de pacientes subfértiles.
Resultados
La mayoría de los estudios son retrospectivos y no randomizados, reportando mejoría del espermiograma y de la fertilidad. Aunque los resultados son buenos, generalmente contienen una diversa población de pacientes con variedad de criterios de inclusión y exclusión, inadecuados diseños de estudio y datos limitados en relación con variables pre y postoperatorias, por lo que realizar un meta-análisis es desafiante. Algunos estudios sugieren que la cirugía no es beneficiosa, especialmente en relación con resultados de embarazo218,219. Para aclarar esta situación, el National Institutes of Health inició un estudio multicéntrico controlado y randomizado para mejorar la obtención de datos sobre las tasas de embarazos y nacimientos. Sin embargo, el estudio tuvo que ser interrumpido después de 2.5 años por el bajo reclutamiento (sólo 3 pacientes fueron randomizados) debido a la renuncia de la mayoría de los pacientes que quedarían en el brazo placebo220.
Schlesinger221 demostró mejoría de parámetros seminales post varicocelectomía en hombres subfértiles. Un meta-análisis más reciente de Agarwal222 confirmó dichos hallazgos con criterios de inclusión más estrictos que meta-análisis previos: hombres con infertilidad y varicocele clínicamente palpable unilateral o bilateral con al menos un parámetro alterado en el espermiograma y que fueron a varicocelectomía quirúrgica. Seleccionó 17 estudios demostrando un aumento de la concentración espermática en 9.7 millones/ml y de la motilidad en 9.92% después de la varicocelectomía microquirúrgica. Post ligadura alta, el análisis mostró un incremento de la concentración espermática en 12 millones/ml y motilidad en 11.7%. La morfología aumentó 3.1% con ambos abordajes. Concluyeron que la varicocelectomía es un tratamiento efectivo para mejorar los parámetros del espermiograma en hombres infértiles con varicocele clínicamente palpable.
A pesar de ello el tratamiento del varicocele para la fertilidad permanece en controversia. Hay considerable variabilidad respecto a las tasas de embarazo post reparación del varicocele en parejas infértiles. Una revisión reciente concluye que la calidad de la evidencia es baja para mejorar las chances de embarazo en parejas infértiles luego de varicocelectomía223.
Marma224 exploró la eficacia de la varicocelectomía respecto al embarazo espontáneo, encontrando que hombres infértiles con varicocele clínicamente palpable tuvieron 2.6 a 2.8 veces más probabilidades de tener un embarazo espontáneo tras una varicocelectomía comparados con la observación. Abdelmeguid225 corroboró estos hallazgos: 145 hombres infértiles con varicocele clínico fueron randomizados 1:1 en un brazo control de observación vs. varicocelectomía microquirúrgica subinguinal. No hubo cambios en los análisis de semen en brazo control, pero en el brazo del tratamiento demostraron una mejoría significativa en la concentración espermática, motilidad y morfología. Además, pacientes que fueron a varicocelectomía tuvieron 3 veces más probabilidad de tener un embarazo espontáneo comparado con su contraparte.
En pacientes con azoospermia no obstructiva u oligozoospermia severa el hallazgo de varicocele varía entre 4.3-13.3% y el tratamiento en estos pacientes es controversial, dada la probabilidad que esos hombres aún sean subfértiles posterior a la cirugía25. Weedin226 realizó un meta-análisis utilizando 11 publicaciones de los últimos 20 años: 223 hombres con azoospermia fueron a varicocelectomía, 39.1% de ellos presentó motilidad espermática en el eyaculado post cirugía y se reportó 14 embarazos espontáneos. Sin embargo, patología testicular de baso fue un predictor de éxito; pacientes con detención en la maduración (42.1%) o hipoespermatogénesis (54.5%) tuvieron probabilidad mayor de beneficiarse que aquellos con histopatología “Sertoli cell only” (11.3%, p <0.001), concluyendo que la histopatología debe ser considerada antes de la reparación del varicocele en estos pacientes.
Dos revisiones sistemáticas y meta-análisis recientes sobre el impacto de la varicocelectomía en niños y adolescentes analizaron la evidencia sobre la cirugía en este grupo de pacientes, evaluando tamaño testicular, parámetros del espermiograma y resultados a largo plazo, tanto en fertilidad como en tasas de embarazo. El primer estudio muestra que la cirugía mejora el volumen testicular en 1,52 ml (CI: 0.73-2.31) e incrementa el total de concentración espermática con diferencia media de 25.5 millones (CI: 12.8-38.2) cuando se compara con la observación. Cirugía abierta y laparoscópica tienen similares tasas de éxito. Una disminución significativa en formación de hidrocele fue observada en cirugía conservadora de vasos linfáticos (p = 0.02). Los resultados son limitados por la heterogeneidad de los datos publicados, la falta de seguimiento y resultados a largo plazo, concluyendo que existe moderada evidencia sobre los beneficios del tratamiento quirúrgico del varicocele, especialmente en adolescentes, en términos de volumen testicular y concentración espermática. La evidencia actual no demuestra superioridad entre técnicas quirúrgicas en términos de éxito del tratamiento. Los resultados a largo plazo incluyendo paternidad y fertilidad son desconocidos227.
En el segundo estudio se analizaron pacientes hasta 21 años de edad con diagnóstico de varicocele y se separaron en aquellos que recibieron tratamiento quirúrgico/radiológico vs. los no lo recibieron, observando mejoría del volumen testicular (diferencia media de 3-18 ml (CI: 1.9-4.42) y de la cuenta de espermios (diferencia media de 25.5 x 10e6/ml (CI 12.8-38.2) en aquellos pacientes que recibieron tratamiento. Concluyen que hay un nivel de evidencia bajo a moderado que muestra que el tratamiento de adolescentes con varicocele está asociado con mejoría en el tamaño, crecimiento testicular y en la concentración espermática, pero que al igual que las demás revisiones, los efectos en fertilidad como tasas de paternidad son desconocidos228.
Bibliografía
- Vohra S, Badlani G. Balanitis and balanoposthitis. Urol. Clin. North Am. 1992 Feb;19(1):143-7.
- Morris BJ, Krieger JN. Penile Inflammatory Skin Disorders and the Preventive Role of Circumcision. Int J Prev Med. 2017;8:32.
- SK Edwards, CB Bunker, Fabian Ziller and Willem I van der Meijden. 2013 European guideline for the management of balanoposthitis. International Journal of STD & AIDS 2014, Vol. 25(9) 615–626
- Mallon E, Hawkins D, Dinneen M, Francics N, Fearfield L, Newson R, et al. Circumcision and genital dermatoses. Arch Dermatol. 2000;136(3):350-4.
- English JC 3rd, Laws RA, Keough GC, Wilde JL, Foley JP, Elston DM. Dermatoses of the glans penis and prepuce. J Am Acad Dermatol. 1997;37(1):1-24.
- Samuel M, Brady M, Tenant-Flowers M, Taylor C. Role of penile biopsy in the diagnosis of penile dermatoses. Int J STD AIDS. 2010;21(5):371-2.
- Borghi, Virgili, Corazza. Dermoscopy of Inflammatory Genital Diseases: Practical Insights. Dermatol Clin 36 (2018) 451–461 https://doi.org/10.1016/j.det.2018.05.013
- Aridogan IA, Izol V, Ilkit M. Superficial fungal infections of the male genitalia: a review. Crit Rev Microbiol. 2011 Aug;37(3):237-44.
- Lisboa C, Ferreira A, Resende C, Rodrigues AG. Infectious balanoposthitis: management, clinical and laboratory features. Int J Dermatol. 2009;48(2):121-4.
- Edwards SK, Bunker CB, Fabian Ziller, Van der Meijden WI. 2013 European guideline for the management of balanoposthitis. Int J STD AIDS. 2014;25(9):615-26.
- Fistarol SK, Itin PH. Diagnosis and treatment of lichen sclerosus: an update. Am J Clin Dermatol. 2013;14(1):27-47.
- Edmonds EV, Hunt S, Hawkins D, Dinneen M, Francis N, Bunker CB. Clinical parameters in male genital lichen sclerosus: a case series of 329 patients. J Eur Acad Dermatol Venereol. 2012;26(6):730-7.
- Bunker CB, Edmonds E, Hawkins D, Francis N, Dinneen M. Re: Lichen sclerosus: review of the literature and current recommendations for management: J. M. Pugliese, A. F. Morey and A.
- Bunker CB, Neill SA. The genital, perianal and umbilical regions. En: Burns T, Breathnach S, Cox N, Griffith C, editors. Rook’s textbook of dermatology. Vol. 71. 8th ed. New York: Wiley-Blackwell, 2010. p. 1-102.
- MacDonald A, Burden AD. Psoriasis: advances in pathophysiology and management. Postgrad Med J. 2007;83(985):690-7. Pub
- Edwards SK, Bunker CB. Other conditions affecting the male genitalia. En: Rogstad K, editor. ABC of sexually transmitted infections. 6th ed. Oxford: Wiley-Blackwell; 2011. p. 35-41.
- Teichman JM, Sea J, Thompson IM, Elston DM. Noninfectious penile lesions. Am Fam Physician. 2010;81(2):167-74. PubMed
- Buechner SA. Common skin disorders of the penis. BJU Int. 2002;90(5):498-506.
- Ozkaya-Bayazit E. Specific site involvement in fixed drug eruption. J Am Acad Dermatol. 2003;49(6):1003-7.
- Álvarez-Avella A, Masferrer E, Martín-Sala S, Jucglà A. Carcinoma epidermoide de pene. Piel (Barc). 2012;27(1):15-22.
- Gardiner, D. (1949) The fate of the foreskin: a study of circumcision. Br. Med. J.2, 1433–1437.
- Oster, J. (1968) Further fate of the foreskin. Incidence of preputial adhesions, phimosis, and smegma among Danish schoolboys. Arch. Dis. Child.43, 200–203.
- Yang, C., Liu, X., and Wei, G.H. (2009) Foreskin development in 10 421 Chinese boys aged 0-18 years.World J. Pediatr.5, 312–315
- Arthur S. McPhee; Alastair C. McKay. Phimosis Last Update: January 30, 2019.
- Babu R, Harrison SK, Hutton KA. Ballooning of the foreskin and physiological phimosis: is there any objective evidence of obstructed voiding? BJU Int. 2004 Aug;94(3):384-7
- Chalmers, R.J., Burton, P.A., Bennett, R.F., Goring, C.C., and Smith, P.J. (1984) Lichen sclerosus et atrophics. A common and distinctive cause of phimosis in boys. Arch.Dermatol.120, 1025–1027
- Cooper, G.G., Thomson, G.J.L., andRaine, P.A.M. (1983) Therapeutic retraction of the foreskin in childhood. Br. Med. J.286, 186–187.
- Tsugaya, M., Nagata, D., and Itoh, Y. (1999) The conservative therapy for phimosis of boys. Jpn. J. Pediatr. Urol. 8, 128–133.
- Monsour, M.A., Rabinovitch, H.H., and Dean, G.E. (1999) Medical management of phimosis in children: our experience with topical steroids. J. Urol.162, 1162–1164.
- Kragballe, K.(1989) Topical corticosteroids: mechanisms of action. ActaDerm.Venereol.Suppl. (Stockh.)151, 7–10.
- Zheng, P.S., Lavker, R.M., Lehmann, P., and Kligman, A.M. (1984) Morphologic investigations on the rebound phenomenon after corticosteroid-induced atrophy in human skin. J. Invest.Dermatol. 82, 345–352.
- Yanagisawa, N., Baba, K., Yamagoe, M., and Iwamoto, T. (2000) Conservative treatment of childhood phimosis with topical conjugated equine estrogen ointment. Int. J. Urol.7, 1–3.
- Matsuoka, N., Hioki, T., Okada, T., Okagaki, T., andMiyakawa, M. (1994) Follow-up studies of children who underwent dorsal slit. Jpn. J.Clin. Urol.48, 843–846.
- Nieuwenhuijs, J.L., Dik, P., Klijn, A.J., and de Jong, T.P. (2007) Y-V plasty of the foreskin as an alternative to circumcision for surgical treatment of phimosis during childhood. J.Pediatr. Urol.3, 45–47
- Dessanti, A., Ginesu, G., Iannuccelli, M., and Balata, A. (2005) Phimosis. Preputialplasty using transversal widening on the dorsal side with EMLA local anesthetic cream. J. Pediatr. Surg. 40,713–715.
- Emmett, A.J. (1982) Z-plasty reconstruction for preputial stenosis–a surgical alternative to circumcision. Aust.Paediatr. J.18, 219–220.
- Glass, J.M. (1999) Religious circumcision: a Jewish view. BJU Int.83(Suppl 1), 17–21.
- Rizvi, S.A.H., Naquvi, S.A.A., Hussain, M., and Hasan, A.S. (1999) Religious circumcision: a Muslim view. BJU Int. 83(Suppl 1), 13–16.
- Schoen, E.J., Colby, C.J., and Ray, G.T. (2000) Newborn circumcision decreases incidence and costs of urinary tract infections during the first year of life. Pediatrics105, 789–793.
- Cook, L.S., Koutsky, L.A., and Holmes, K.K. (1994) Circumcision and sexually transmitted disease. Am J Public Health 84, 197–201.
- Auvert, B., Taljaard, D., Lagarde, E., Sobngwi-Tambekou, J., Sitta, R., andPuren, A. (2005) Randomized, controlled intervention trial of male circumcision for reduction of HIV infection risk: the ANRS 1265 Trial. PLoS Med. 2, e298.
- UNAIDS/WHO/SACEMA Expert Group on Modeling the Impact and Cost of Male Circumcision for HIV Prevention (2009) Male circumcision for HIV prevention in high HIV prevalence settings: what can mathematical modeling contribute to informed decision making? PLoS Med. 6(9), e1000109.
- Dillner, J.,von Krogh, G., Horenblas, S., and Meijer, C.J. (2000) Etiology of squamous cell carcinoma of the penis. Scand. J. Urol. Nephrol.205, 189–193.
- Hohlfeld A, Ebrahim S, Shaik MZ, Kredo T. Circumcision devices versus standard surgical techniques in adolescent and adult male circumcisions (Review). Cochrane Database of Systematic Reviews 2021, Issue 3. Art. No.: CD012250. DOI: 10.1002/14651858.CD012250.pub2.
- https://www.msdmanuals.com/es/hogar/salud-masculina/trastornos-del-pene-y-de-los-test%C3%ADculos/fimosis-y-parafimosis
- https://www.msdmanuals.com/es/professional/trastornos-urogenitales/trastornos-peneanos-y-escrotales/fimosis-y-parafimosis
- https://urologiapepauguet.com/blog/fimosis-causas-sintomas-complicaciones-y-tratamiento/
- https://www.clinicaalemana.cl/articulos/detalle/2022/fimosis-en-adultos-cual-es-su-tratamiento
- https://centromedicobadal.es/blog/fimosis-en-adultos/
- https://www.quironsalud.com/blogs/es/nigota/fimosis-anomalia-congenita-frecuente-pene
- https://rocclinic.com/blog/fimosis-adultos/
- https://www.viamedsalud.com/patologias/urologia/fimosis-en-adultos/
- Choe JM. Paraphimosis: current treatment options. Am Fam Physician. 2000 Dec 15;62(12):2623-6, 2628
- Herzog LW, Alvarez SR. The frequency of foreskin problems in uncircumcised children. Am. J. Dis. Child. 1986 Mar;140(3):254-6.
- Pohlman GD, Phillips JM, Wilcox DT. Simple method of paraphimosis reduction revisited: point of technique and review of the literature. J Pediatr Urol. 2013 Feb;9(1):104-7
- Anand A, Kapoor S. Mannitol for paraphimosis reduction. Urol. Int. 2013;90(1):106-82
- Flores S, Herring AA. Ultrasound-guided dorsal penile nerve block for ED paraphimosis reduction. Am J Emerg Med. 2015 Jun;33(6):863.e3-5
- Tews M, Singer JI. Paraphimosis clinical manifestations, diagnosis and treatment. En: Baskin LS, Stack AM, Richie JP, Wiley JF II, editors. UpToDate; 2017
- Benson JS, Abern MR, Larsen S, Levine LA. Does a positive response to spermatic cord block predict response to microdenervation of the spermatic cord for chronic scrotal content pain? J Sex Med. 2013 Mar;10(3):876-82.
- Chaudhari R, Sharma S, Khant S, Raval K. Microsurgical Denervation of Spermatic Cord for Chronic Idiopathic Orchialgia: Long-Term Results from an Institutional Experience. World J Mens Health. 2019 Jan;37(1):78-84.
- Narita M, Moriyoshi K, Hanada K, Matsusue R, Hata H, Yamaguchi T, Otani T, Ikai I. Successful treatment for patients with chronic orchialgia following inguinal hernia repair by means of meshoma removal, orchiectomy and triple-neurectomy. Int J Surg Case Rep. 2015;16:157-61.
- Grayson CT, Criman ET, Cefalu LM, Roedel EQ, Hong SS, Yheulon CG. Litigation Patterns in Inguinal Hernia Surgery: A 25 Year Review. J Surg Res. 2018 Dec;232:266-270.
- Redmond EJ, Mac Namara FT, Giri SK, Flood HD. Blunt testicular trauma – is surgical exploration necessary? Ir J Med Sci. 2018 Nov;187(4):1109-1113.
- Moore JR, Pathak RA, Snowden C, Bolan CW, Young PR, Broderick GA. Multispecialty retrospective review of the clinical utility of pelvic magnetic resonance imaging in the setting of pelvic pain. Transl Androl Urol. 2017 Dec;6(6):1155-1158.
- Calixte N, Tojuola B, Kartal I, Gudeloglu A, Hirsch M, Etafy M, Mendelson R, Djokic B, Sherba S, Shah K, Brahmbhatt J, Parekattil S. Targeted Robotic Assisted Microsurgical Denervation of the Spermatic Cord for the Treatment of Chronic Orchialgia or Groin Pain: A Single Center, Large Series Review. J Urol. 2018 Apr;199(4):1015-1022
- Shen Y, Liu H, Cheng J, Bu P. Amiodarone-induced epididymitis: a pathologically confirmed case report and review of the literature. Cardiology. 2014;128(4):349-51.
- Tan WP, Levine LA. Micro-Denervation of the Spermatic Cord for Post-Vasectomy Pain Management. Sex Med Rev. 2018 Apr;6(2):328-334.
- Sinha V, Ramasamy R. Post-vasectomy pain syndrome: diagnosis, management and treatment options. Transl Androl Urol. 2017 May;6(Suppl 1):S44-S47.
- Calixte N, Brahmbhatt J, Parekattil S. Genital pain: algorithm for management. Transl Androl Urol. 2017 Apr;6(2):252-257.
- John T. Sigalos , Alexander W. Pastuszak. Chronic orchialgia: epidemiology, diagnosis and evaluation. Transl Androl Urol 2017;6(Suppl 1):S37-S43
- Sigalos JT, Pastuszak AW. Chronic orchialgia: epidemiology, diagnosis and evaluation. Transl Androl Urol. 2017 May;6(Suppl 1):S37-S43.
- Kiritsy MP, Siefferman JW. Spinal Cord Stimulation for Intractable Testicular Pain: Case Report and Review of the Literature. Neuromodulation. 2016 Dec;19(8):889-892.
- Yamamoto M, Hibi H, Katsuno S, Miyake K. Management of chronic orchialgia of unknown etiology. Int J Urol. 1995 Mar;2(1):47-9.
- Belanger GV, VerLee GT. Diagnosis and Surgical Management of Male Pelvic, Inguinal, and Testicular Pain. Surg Clin North Am. 2016 Jun;96(3):593-613.
- Tojuola B, Layman J, Kartal I, Gudelogul A, Brahmbhatt J, Parekattil S. Chronic orchialgia: Review of treatments old and new. Indian J Urol. 2016 Jan-Mar;32(1):21-6.
- Tan WP, Levine LA. An overview of the management of post-vasectomy pain syndrome. Asian J Androl. 2016 May-Jun;18(3):332-7.
- Sadek I, Biron P, Kus T. Amiodarone-induced epididymitis: report of a new case and literature review of 12 cases. Can J Cardiol. 1993 Nov;9(9):833-6.
- Nikolaou M, Ikonomidis I, Lekakis I, Tsiodras S, Kremastinos D. Amiodarone-induced epididymitis: a case report and review of the literature. Int J Cardiol. 2007 Sep 14;121(1):e15-6.
- Sinclair AM, Miller B, Lee LK. Chronic orchialgia: consider gabapentin or nortriptyline before considering surgery. Int J Urol. 2007 Jul;14(7):622-5.
- Basal S, Ergin A, Yildirim I, Goktas S, Atim A, Sizlan A, Irkilata HC, Kurt E, Dayanc M. A novel treatment of chronic orchialgia. J Androl. 2012 Jan-Feb;33(1):22-6.
- Benson JS, Abern MR, Larsen S, Levine LA. Does a positive response to spermatic cord block predict response to microdenervation of the spermatic cord for chronic scrotal content pain? J Sex Med. 2013 Mar;10(3):876-82.
- Chaudhari R, Sharma S, Khant S, Raval K. Microsurgical Denervation of Spermatic Cord for Chronic Idiopathic Orchialgia: Long-Term Results from an Institutional Experience. World J Mens Health. 2019 Jan;37(1):78-84.
- Narita M, Moriyoshi K, Hanada K, Matsusue R, Hata H, Yamaguchi T, Otani T, Ikai I. Successful treatment for patients with chronic orchialgia following inguinal hernia repair by means of meshoma removal, orchiectomy and triple-neurectomy. Int J Surg Case Rep. 2015;16:157-6
- Taylor SN. Epididymitis. Clin Infect Dis. 2015 Dec 15. 61 Suppl 8:S770-3
- Siegel A, Snyder H, Duckett JW. Epididymitis in infants and boys: underlying urogenital anomalies and efficacy of imaging modalities. J Urol. 1987 Oct. 138(4 Pt 2):1100-3.
- Redshaw JD, Tran TL, Wallis MC, deVries CR. Epididymitis: a 21-year retrospective review of presentations to an outpatient urology clinic. J Urol. 2014;192(4):1203-1207.
- Santillanes G, Gausche-Hill M, Lewis RJ. Are antibiotics necessary for pediatric epididymitis?. Pediatr Emerg Care. 2011 Mar. 27(3):174-8
- Raveenthiran V, Sam CJ. Epididymo-orchitis complicating anorectal malformations: collective review of 41 cases. J Urol. 2011 Oct. 186(4):1467-72
- Vera M., Adrian P., Mark P H., Andreas M. Epididymitis: revelations at the convergence of clinical and basic sciences Asian J Androl. 2015 Sep-Oct; 17(5): 756–763.
- [Guideline] 2015 Sexually Transmitted Diseases Treatment Guidelines: Epididymitis. Centers for Disease Control and Prevention. Available at http://www.cdc.gov/std/tg2015/epididymitis.htm. Accessed: December 15, 2017
- Trei JS, Canas LC, Gould PL. Reproductive tract complications associated with Chlamydia trachomatis infection in US Air Force males within 4 years of testing. Sex Transm Dis. 2008 Sep. 35(9):827-33.
- Nusbaum MR, Wallace RR, Slatt LM, Kondrad EC. Sexually transmitted infections and increased risk of co-infection with human immunodeficiency virus. J Am Osteopath Assoc. 2004 Dec. 104 (12):527-35
- Trojian TH, Lishnak TS, Heiman D. Epididymitis and orchitis: an over- view. Am Fam Physician. 2009;79(7):583-587.
- Hongo H, Kikuchi E, Matsumoto K, Yazawa S, Kanao K, Kosaka T, et al. Novel algorithm for management of acute epididymitis. Int J Urol. 2016 Oct 6.
- Santillanes G, Gausche-Hill M, Lewis RJ. Are antibiotics necessary for pediatric epididymitis?. Pediatr Emerg Care. 2011 Mar. 27(3):174-8
- Nason GJ, Tareen F, McLoughlin D, McDowell D, Cianci F, Mortell A. Scrotal exploration for acute scrotal pain: A 10-year experience in two tertiary referral paediatric units. Scand J Urol. 2013 Jan 3.
- Rizvi SA, Ahmad I, Siddiqui MA, Zaheer S, Ahmad K. Role of color Doppler ultrasonography in evaluation of scrotal swellings: pattern of disease in 120 patients with review of literature. Urol J. 2011. 8(1):60-5
- Yu KJ, Wang TM, Chen HW, Wang HH. The dilemma in the diagnosis of acute scrotum: clinical clues for differentiating between testicular torsion and epididymo-orchitis. Chang Gung Med J. 2012 Jan-Feb. 35(1):38-45.
- Tracy CR, Steers WD, Costabile R. Diagnosis and management of epi- didymitis. Urol Clin North Am. 2008;35(1):101-108.
- Center for Disease Control and Prevention. 2015 sexually transmitted diseases treatment guidelines. Epididymitis. http://www.cdc.gov/std/ tg2015/epididymitis.htm. Accessed October 20, 2015.
- Crawford P, Crop JA. Evaluation of scrotal masses. Am Fam Physician. 2014;89(9):723-727.
- Leung M, Gooding, Williams RD. High resolution sonography of scrotal contents in asymptomatics subject. A J R am J Roentgenol. 1984; 143: 161 – 164.
- Karl-Johan Lundström, Lars söderström, Henning Jernow, Pär Stattin & Pär Nordin. Epidemiology of Hydrocele and Spermatocele; incidence, treatment and complications. Scandinavian Journal of Urology. 2019; 53: 134-138.
- Dagur G, Gandhi J, Suh Y, Weissbart S, Sheynkin YR, Smith NL, Joshi G, Khan SA. Classifying Hydroceles of the Pelvis and Groin: An Overview of Etiology, Secondary Complications, Evaluation, and Management. Curr Urol. 2017 Apr;10(1):1-14.
- Valentino M, Bertolotto M, Ruggirello M, Pavlica P, Barozzi L, Rossi C. Cystic lesions and scrotal fluid collections in adults: Ultrasound findings. J Ultrasound. 2011 Dec;14(4):208-15.
- Sherchand JB, Obsomer V, Thakur GD, Hommel M. Mapping of lymphatic filariasis in Nepal. Filaria J. 2003 Mar 19;2(1):7.
- Ein SH, Nasr A, Wales P, Gerstle T. The very large recurrent postoperative scrotal hydrocele after pediatric inguinal hernia repair: a rare problem. Pediatr Surg Int. 2009 Mar;25(3):239-41.
- D’Andrea A, Coppolino F, Cesarano E, Russo A, Cappabianca S, Genovese EA, Fonio P, Macarini L. US in the assessment of acute scrotum. Crit Ultrasound J. 2013 Jul 15;5 Suppl 1(Suppl 1):S8.
- Jorge Rioja, Francisco M. Sánchez-Margallo. Jesús Usón and Luis A. Rioja. Surgery Illustrated – Surgical Atlas Adult Hydrocele and Spermatocele. BJUI. 2011; 107, 1852-1864.
- Lord PH. A bloodless operation for the radical cure of idiopathic hydrocele. Br J Surg 1964; 51: 914-6
- Cimador M, Castagnetti M, De Grazia E. Management of hydrocele in adolescent patients. Nat Rev Urol. 2010 Jul;7(7):379-85.
- Jaboulay M. Chirurgie des centres nerveux des visceres et des members. Lyon/Paris: Stock 1902; 2: 192
- Lund L, Kloster A, Cao T. The long-term efficacy of hydrocele treatment with aspiration and sclerotherapy with polidocanol compared to placebo: a prospective, double-blind, randomized study. J Urol. 2014 May;191(5):1347-50.
- Francis JJ, Levine LA. Aspiration and sclerotherapy: a nonsurgical treatment option for hydroceles. J Urol. 2013 May;189(5):1725-9
- Nesbit JA. Hydrocele and Spermatocele. In graham SD, Keane TE, Glenn JF eds, Glenn’s Urology Surgery Philadelphia Lippincott Williams et Wilkins, 2004; 598-602
- Hinmn F Jr ed, Atlas of Urology Surgery. Philadelphia: WB Saunders et Co. 1989: 307-14
- Makela E., Lahdes-Vasama T., Rajakorpi H., Wikström S. A 19-year review of paediatric patients with acute scrotum. AS Scand J Surg 2007; 96 (1): 62-66.
- Gunther P., Rubben I. The Acute Scrotum in Childhood and Adolescence. Dtsch Arztebl Int 2012; 109 (25): 449-458.
- Mansbach J.M., Forbes P., Peters C. Testicular torsion and risk factors for orchiectomy. Arch Pediatr Adolesc Med 2005; 159: 1167-1171.
- Sharp V., Kieran K., Arlen A. Testicular Torsion: Diagnosis, Evaluation and Management. American Family Physician 2013; 88 (12): 835-840.
- Mellick L.B. Torsion of the testicle: it is time to stop tossing the dice. Pediatr Emerg Care 2012; 28:80.
- Drlik M., Kocvara R. Torsion of espermatic cord in children: A review. J Pediatr Urol 2013; 9:259-266.
- Corbett C.R., Baer S.T., Grimmett B.M. Testicular torsion presenting with abdominal pain. J R Coll Gen Pract 1986; 36: 36-38.
- Zenon Pogorelic, Ivana Mrklic, Ivo Juric. Do not forget to include testicular torsion in differential diagnosis of lower acute abdominal pain in young males. Journal of Pediatric Urology 2013; 9: 1161-1165.
- Kalfa N., Veyrac C., et al. Multicenter assessment of ultrasound of the spermatic chord in children with acute scrotum. J Urol 2007; 177(1): 297-301.
- Murphy F.L., Fletcher L., Pease P. Early scrotal exploration in all cases is the investigation and intervention of choice in the acute paediatric scrotum. Pediatr Surg Int 2006; 22: 413–416.
- DaJusta D., Granberg C., Villanueva C., Baker L. Contemporary review of testicular torsion: New concepts, emerging technologies and potential therapeutics.
- Kutikov A, Casale P, White MA, Meyer WA, Chang A, Gosalbez R, Canning DA. Testicular compartment syndrome: a new approach to conceptualizing and managing testicular torsion. Urology. 2008 Oct;72(4):786-9.
- Figueroa V, Pippi Salle JL, Braga LH, Romao R, Koyle MA, Bägli DJ, Lorenzo AJ. Comparative analysis of detorsion alone versus detorsion and tunica albuginea decompression (fasciotomy) with tunica vaginalis flap coverage in the surgical management of prolonged testicular ischemia. J Urol. 2012 Oct;188(4 Suppl):1417-22.
- Porras Luenga, M.L. (2024) Efectividad de la incisión de túnica albuginea e injerto de túnica vaginal para el manejo de la torsión testicular en menores de 18 años : revisión sistemática de la literatura de la técnica quirúrgica. Universidad Internacional de Andalucía
- Gandhi J, Dagur G, Sheynkin YR, Smith NL, Khan SA. Testicular compartment syndrome: an overview of pathophysiology, etiology, evaluation, and management. Transl Androl Urol. diciembre de 2016;5(6):927-34.
- Alan Wein, Louis Kavoussi, Andrew Novick, Alan Partin, Graig Peters, Campbell/Walsh, Urology 11 Ed, Tomo I, Cap II, Pags -, Ed. Panamericana, 2016
- Serjeant GR, de Ceulaer C, Maude GH. Stilboestrol and stuttering priapism in homozygous sickle-cell disease, Lancet 1985;2(8467):1274-6.
- Bachir D, Galacteros E, Lee K, Virag R. Two years experience in management of priapism and impotence in sickle cell disease [abstract]. Blood 1996;88:14a.
- Broderick GA, Gordon D, Hypolite J, Levin RM. Anoxia and smooth muscle dysfunction: a model for ischaemic priapism. Journal of Urology 1994;151(1):259-62.
- Davies SC, Oni L. The management of patients with sickle cell disease. BMJ 1997;315(7109):656-60.
- Elbourne DR, Altman DG, Higgins JPT, Curtin F, Worthington HV, Vail A. Meta-analysis involving cross-over trials: methodological issues. International Journal of Epidemiology 2002;31(1):140-9
- Alan J. Wein, Louis R. Kavoussi, Alan W. Partin, Craig A. Peters, Levine L, Larsen S, Campbell-Walsh Urology, part V, Ch 31: Diagnosis and Management of Peyronie Disease, 2016.
- Nehra A et al, Peyronie’s Disease: AUA Guideline J Urol. 2015; 194(3):745-753
- Hatzimouratidis K et al, EAU Guidelines on penile curvature, Eur Urol. 2012 Sep;62(3):543-52. doi: 10.1016/j.eururo.2012.05.040. Act 2017.
- Bella AJ, Greenfield JM (Chile KA editor). Peyronie’s Disease: Epidemiology, Pathophysiology and Evaluation. AUA Core Curriculum, American Urological Association Education and Research Inc. AUA University, Feb 2020. https://university.auanet.org/core_topic.cfm?coreid=103.
- Segundo A. et al, Prevalence, Risk Factors and Erectile Dysfunction associated with Peyronie´s Disease Among Men Seeking Urological Care, Sex Med 2020; 1-7
- Bella AJ et al, 2018 Canadian Urological Association guideline for Peyronie’s disease and congenital penile curvature, CUAJ, V 12, I 5, 2018
- Özbir S. et al, The role of inflammatory parameters (neutrophil-to-lymphocyte ratio, platelet-to-lymphocyte ratio, and monocyte-to-eosinophil ratio) in patients with Peyronie’s disease. Andrology. 2019 Sep 12. doi: 10.1111/andr.12702.
- Coyne KS, Currie BM, Thompson CL, et al. Responsiveness of the Peyronie’s Disease Questionnaire (PDQ). J Sex Med 2015;12:1072-9. https://doi.org/10.1111/jsm.12838
- Smith JF, Brant WO, Fradet V, et al Penile sonographic and clinical characteristics in men with Peyronie’disease. J Sex Med 2009; 6:2858-67. https://doi.org/10.1111/j.1743-6109.2009.01438.
- Bekos A, Arvaniti M, Hatzimouratidis K, et al. The natural history of Peyronie’s disease: An ultrasonograpbased study. Eur Urol 2008; 53:644-50. https://doi.org/10.1016/j.eururo.2007.07.013
- Sultan Al-Thakafi, Naif Al-Hathal. Peyronie’s disease: a literature review on epidemiology, genetics, pathophysiology, diagnosis and work-up. Transl Androl Urol 2016;5(3):280-289
- Reddy AG, Dai MC, Song JJ, Pierce HM, Patel SR, Lipshultz LI. Peyronie’s Disease: An Outcomes-Based Guide to Non-Surgical and Novel Treatment Modalities. Res Rep Urol. 2023 Feb 2;15:55-67. doi: 10.2147/RRU.S278796. PMID: 36756281; PMCID: PMC9901485.
- Gelbard M, Goldstein I, Hellstrom WJ, et al. Clinical efficacy, safety and tolerability of collagenase clostridium histolyticum for the treatment of peyronie disease in 2 large double-blind, randomized, placebo controlled Phase 3 studies. J Urol. 2013;190(1):199–207. doi:10.1016/j. juro.2013.01.087
- Song J, Dai M, Naeem T, et al. (398) The Correlates of Satisfaction with Long-term Outcomes Following Collagenase Clostridium Histolyticum Treatment for Peyronie’s Disease. J Sex Med. 2024 Feb; 21(Supplement_1): qdae001.383.
- Cleveland Clinic. Advancements in Treating Peyronie’s Disease With Collagenase Injections. Consult QD. Publicado el 7 de mayo de 2024.
- lCapoccia E, Ziegelmann M, Emmerson J, Lankford J, Ofori-Marfoh C, Levine L. Long-term patient-reported outcomes in men with Peyronie’s disease undergoing nonsurgical and nonintralesional injection management. Int J Impot Res. 2021;33(1):75–81. doi:10.1038/s41443-020-0231-y
- Ziegelmann M, Savage J, Trost L. Penile traction therapy and Peyronie’s disease: a state of art review of the current literature. Sex Med Rev. 2013;1(2):85-93.
- MacDonald LP, Armstrong ML, Lehmann KJ, Acker MR, Langille GM. Outcome analysis of patients with Peyronie’s disease who elect for vacuum erection device therapy. Can Urol Assoc J. 2020;14(9):E428–e431. doi:10.5489/cuaj.6205
- Bakr AM, El-Sakka AI. Extracorporeal shockwave therapy in Peyronie’s Disease: systematic review and meta-analysis. J Sex Med. 2021;18 (10):1705–1714. doi:10.1016/j.jsxm.2021.06.012
- Liu Y, Gao Y, Wang Y, et al. Updated recommendations on the therapeutic role of extracorporeal shock wave therapy for peyronie’s disease: systematic review and meta-analysis. BMC Urol. 2023 Sep 12;23(1):151.
- Salonia A, Bettocchi C, Carvalho J, et al. EAU Guidelines on Sexual and Reproductive Health. European Association of Urology; 2024.
- Palmieri A, Imbimbo C et al. Tadalafil once daily and extracorporeal shock wave therapy in the management of patients with Peyronie’s disease and erectile dysfunction: Results from a prospective randomized trial. Int. J. Androl. 2012, 35, 190–195.
- Anti-Aging Medical & Laser Clinic. Men’s Health Peyronie’s Disease: Exploring the Latest Advances in Treatments. Publicado el 24 de julio de 2023.
- Romero-Otero J, Garcia-Gomez B, S-Vilches A, et al. Satisfaction assessment study in patients (and their partners) with/without Peyronie’s disease and penile prosthesis implantation. Actas Urol Esp (Engl Ed). 2024;48(5):342-348
- Furtado TP, Osadchiy V, Eleswarapu SV. The Promise of Artificial Intelligence in Peyronie’s Disease. Curr Urol Rep. 2024 Sep 21;26(1):3. doi: 10.1007/s11934-024-01233-5. PMID: 39305366; PMCID: PMC11416409.
- Kaufman SL, Nagler HM. The varicocele: concepts of pathophysiology – present and future. World J Urol 1986;4:88–97.
- Macomber D, Sanders MB. The spermatozoa count: its value in the diagnosis, prognosis, and treatment of sterility. N Engl J Med 1929;200:981–4.
- Tulloch WS. Varicocele in subfertility: results of treatment. Br Med J 1955;2(4935):356–8.
- Glezerman M. A short historical review and comparative results of surgical treatment for varicoceles. In: Glezerman M, Jecht EW, editors. Varicocele and male infertility II. New York: Springer; 1984. p. 87–93.
- Ivanissevich O. Left varicocele due to reflux: experience with 4,470 operative cases in forty-two years. J Int Coll Surg 1960;34:742–55.
- Wosnitzer M, Roth JA. Optical magnification and Doppler ultrasound probe for varicocelectomy. Urology 1983;22:24–6.
- Kaye KW. Modified high varicocelectomy: outpatient microsurgical procedure. Urology 1988;32:13–6.
- Gilbert BR, Goldstein M. New directions in male reproductive microsurgery. Microsurgery 1988;9: 281–5.
- Gat Y, Bachar GN, Zukerman Z, et al. Varicocele: a bilateral disease. Fertil Steril 2004;81:424–9.
- Nagler HM, Grotas AB. Varicocele. In: Lipshultz LI, Howards SS, Niederberger CS, editors. Infertility in the male. 4th edition. New York: Cambridge University Press; 2009. p. 331–61.
- Coolsaet BL. The varicocele syndrome: venography determining the optimal level for surgical management. J Urol 1980;124:833–9.
- Murray RR Jr, Mitchell SE, Kadir S, et al. Comparison of recurrent varicocele anatomy following surgery and percutaneous balloon occlusion. J Urol. 1986;135:286–9.
- Lipshultz LI, Corriere JN Jr. Progressive testicular atrophy in the varicocele patient. J Urol 1977;117: 175–6
- Scott LS. Varicocele: a treatable cause of subfertility. Br Med J 1961;1:788–90.
- Saypol DC. Varicocele. J Androl 1981;2:61–71.
- Chehval MJ, Purcell MH. Deterioration of semen parameters in men with untreated varicocele: evidence of progressive testicular damage. Fertil Steril 1992;57:174–7.
- Dahl EV, Herrick JF. A vascular mechanism for maintaining testicular temperatures by countercurrent exchange. Surg Gynecol Obstet 1959; 108:697–705.
- Zorgniotti AW, Macleod J. Studies in temperature, human semen quality, and varicocele. Fertil Steril 1973;24:854–63.
- Lue YH, Sinha-HikimAP, Swerdloff RS, et al. Single exposure to heat induces stage-specific germ cell apoptosis in rats: role of intratesticular testosterone on stage specificity. Endocrinology 1999;140:1709–17.
- Fretz PC, Sandlow JI. Varicocele: current concepts in pathophysiology, diagnosis, and treatment. Urol Clin North Am 2002;29:921–37.
- Zini A, Boman J. Varicocele. In: Goldstein M, Schlegel PN, editors. Surgical and medical management of male infertility. 1st edition. New York: Cambridge University Press; 2013. p. 137–49.
- Dubin L, Amelar RD. The varicocele and infertility. In: Amelar RD, Dubin L, Walsh PC, editors. Male infertility. Philadelphia: Saunders; 1977. p. 57–68.
- Sharlip ID, Jarow JP, Belker AM. AUA best practice policy: report on varicocele and infertility. Baltimore (MD): American Urological Association Inc; 2001.
- Chiou RK, Anderson JC, Wobig RK, et al. Color Doppler ultrasound criteria to diagnose varicoceles: correlation of a new scoring system with physical examination. Urology 1997;50: 953–6.
- Petros JA, Andriole GL, Middleton WD, et al. Correlation of testicular color Doppler ultrasonography, physical examination, and venography in the detection of left varicoceles in men with infertility. J Urol 1991;145:785–8.
- Mihmanli I, Kurugoglu S, Cantasdemir M, et al. Color Doppler ultrasound in subclinical varicocele: an attempt to determine new criteria. Eur J Ultrasound 2000;12:43–8.
- Grasso M, Lania C, Castelli M, et al. Low-grade left varicocele in patients over 30 years old: the effect of spermatic vein ligation on fertility. BJU Int 2000;85:305–7.
- Yamamoto M, Hibi H, Hirata Y, et al. Effect of varicocelectomy on semen parameters and pregnancy rate in patients with subclinical varicocele: a randomized prospective controlled study. J Urol 1996;155:1636–8.
- Ahlberg NE, Bartley O, Chidekel N, et al. Phlebography in varicocele scroti. Acta Radiol Diagn (Stockh) 1966;4:517–28.
- Netto Junior NR, Lerner JS, Paolini RM, et al. Varicocele: the value of reflux in the spermatic vein. IntFertil 1980;25:71–4.
- Hart RR, Rushton HG, Belman AB. Intraoperative spermatic venography during varicocele surgery in adolescents. J Urol 1992;148:1514–6.
- Sharlip ID, Jarow JP, Belker AM. AUA best practice policy: report on varicocele and infertility. Baltimore (MD): American Urological Association Inc; 2001.
- Witt MA, Lipshultz LL. Varicocele: a progressive or static lesion? Urology 1993;42:5413.
- Gorelick JI, Goldstein M. Loss of fertility in men with varicocele. Fertil Steril 1993;59:6136.
- Hudson RW, Perez-Marrero RA, Crawford VA, et al. Hormonal parameters of men with varicocele before and after varicocelectomy. Fertil Steril 1985;43:905–10.
- Segenreich E, Shmuely H, Singer R, et al. Andrological parameters in patients with varicocele and fertility disorders treated by high ligation of the left spermatic vein. Int J Fertil 1986;31:200–3.
- Di Bisceglie C, Bertagna A, Baldi M, et al. Varicocele sclerotherapy improves serum inhibin B levels and seminal parameters. Int J Androl 2007;30:531–6
- Zheng YQ, Gao X, Li ZJ, et al. Efficacy of bilateral and left varicocelectomy in infertile men with left clinical and right subclinical varicoceles: a comparative study. Urology 2009;73:1236–40.
- Sathya Srini V, Belur Veerachari S. Does varicocelectomy improve gonadal function in men with hypogonadism and infertility? Analysis of a prospective study. Int J Endocrinol 2011;2011:916380.
- Schlegel PN, Goldstein M. Alternate indications for varicocele repair. Fertil Steril 2011;96:1288–93.
- Chawla A, Kulkarni G, Kamal K, et al. Microsurgical varicocelectomy for recurrent or persistent varicoceles associated with orchialgia. Urology 2005; 66:1072–4.
- Maghraby HA. Laparoscpic varicocelectomy for painful varicoceles: merits and outcomes. J Endourol 2002;16:2.
- Parekattil SJ, Brahmbhatt JV. Robotic approaches for male infertility and chronic orchialgia microsurgery. Curr Opin Urol 2011;21:493–9.
- Marmar JL, Kim Y. Subinguinal microsurgical varicocelectomy: a technical critique and statistical analysis of semen and pregnancy data. J Urol 1994;152:1127–32.
- AL-Kandari AM, Shabaan H, Ibrahim HM, et al. Comparison of outcomes of different varicocelectomy techniques: open inguinal, laparoscopic, and subinguinal microscopic varicocelectomy: a randomized clinical trial. Urology 2007;69:417–20.
- Cayan S, Kadioglu TC, Tefekli A, et al. Comparison of results and complications of high ligation surgery and microsurgical high inguinal varicocelectomy in the treatment of varicocele. Urology 2000;55:750–4.
- Ghanem H, Anis T, El-Nashar A, et al. Subinguinal microvaricocelectomy versus retroperitoneal varicocelectomy: comparative study of complications and surgical outcome. Urology 2004;64:1005–9.
- Goldstein M, Gilbert B, Dicker AP. Microsurgical inguinal varicocelectomy with delivery of the testis: an artery and lymphatic sparing technique. J Urol 1992;148:1808–11.
- Grober ED, O’Brien J, Jarvi KA, et al. Preservation of testicular arteries during subinguinal microsurgical varicocelectomy: clinical considerations. J Androl 2004;25:740–3.
- Bodie JA, Sandlow JI. Microsurgical subinguinal varix ligation: techniques and technical pearls. In: Sandlow JI, editor. Microsurgery for fertility specialists. 1st edition. New York: Springer; 2013. p. 35–48
- Iacono F, Capparelli G, Darmiento M. Bilateral varicocele repair by transscrotal extratunica vaginalis procedure in outpatients: a novel technique. Tech Urol 2000;6:196-200.
- Ding H, Tian J, Du W, et al. Open non-microsurgical, laparoscopic, or open microsurgical varicocelectomy for male infertility: a meta-analysis of randomized controlled trials. BJU Int 2012;110:1536–42.
- Nabi G, Asterlings S, Greene DR, et al. Percutaneous embolization of varicoceles: outcomes and correlation of semen improvement with pregnancy. Urology 2004;63:359–63
- Ferguson JM, Gillespie IN, Chalmers N, et al. Percutaneous varicocele embolization in the treatment of infertility. Br J Radiol 1995;68:700–3.
- Kamischke A, Nieschlag E. Varicocele treatment in the light of evidence-based andrology. Hum Reprod Update 2001;7:65–9.
- Krause W, Muller HH, Schafer H, et al. Does treatment of varicocele improve male fertility? Results of the “Deutsche Varikozelenstudie,” a multicentre study of 14 collaborating centres. Andrologia 2002;34:164–71.
- Rageth JC, Unger C, DaRugna D, et al. Longterm results of varicocelectomy. Urol Int 1992;48: 327–31.
- Sigman M. There is more than meets the eye with varicoceles: current and emerging concepts in pathophysiology, management, and study design. Fertil Steril 2011;96:1281–2.
- Schlesinger MH, Wilets IF, Nagler HM. Treatment outcome after varicocelectomy: a critical analysis. Urol Clin North Am 1994;21:517–29.
- Agarwal A, Deepinder F, Cocuzza M, et al. Efficac of varicocelectomy in improving semen parameters: new meta-analytical approach. Urology 2007;70: 532–8.
- Kroese AC, de Lange NM, Collins J, et al. Surgery or embolization for varicoceles in subfertile men. Cochrane Database Syst Rev 2012;(10):CD000479.
- Marmar JL, Agarwal A, Prabakaran S, et al. Reassessing the value of varicocelectomy as a treatment for male subfertility with a new meta-analysis. Fertil Steril 2007;88:639–46.
- Abdel-Meguid TA, Al-Sayyad A, Tayib A, et al. Does varicocele repair improve male infertility? An evidence-based perspective from a randomized, controlled trial. Eur Urol 2011;59:455–61.
- Weedin JW, Khera M, Lipshultz LI. Varicocele repair in patients with nonobstructive azoospermia: a meta-analysis. J Urol 2010;183:2309–15.
- Mesrur Selcuk Silay a, Lisette Hoen b, Josine Quadackaers c, Shabnam Undre d, Guy Bogaert e, Hasan Serkan Dogan f, Radim Kocvara g, Rien J.M. Nijman c, Christian Radmayr , Serdar Tekgul f, Raimund Stein i. Treatment of Varicocele in Children and Adolescents: A Systematic Review and Meta-analysis from the European Association of Urology/European Society for Paediatric Urology Guidelines Panel. Eur Urol. 2019 Mar;75(3):448-461
- Locke JA1, Noparast M1, Afshar K2. Treatment of varicocele in children and adolescents: A systematic review and meta-analysis of randomized controlled trials. J Pediatr Urol. 2017 Oct;13(5):437-445.

