Generalidades e historia de la cirugía robótica
El concepto de intervenciones médicas asistidas por robots no es nuevo y su desarrollo ha respondido a diversas necesidades. Uno de los factores clave que impulsó la investigación en cirugía robótica fue la necesidad de proporcionar atención quirúrgica a soldados en zonas remotas. En este contexto, el programa militar estadounidense Defense Advanced Research Projects Agency (DARPA) desarrolló el robot Bradley 557A, que en 1994 logró realizar la primera cirugía a distancia: una anastomosis vascular en un órgano exvivo1. Otro motivo fundamental para el desarrollo de la cirugía robótica fue la necesidad de una mayor precisión intraoperatoria, buscando realizar procedimientos más predecibles, con menor duración y mínima invasión2.
No fue hasta el año 2001 que se llevó a cabo la primera telecirugía completa con el sistema robótico Zeus. La intervención, una colecistectomía transatlántica, fue realizada por el cirujano francés Jacques Marescaux desde Estrasburgo, Francia, mientras que el paciente se encontraba en Nueva York, a 6.230 km de distancia. A esta histórica cirugía se le llamó Operación Lindbergh, en honor al primer vuelo transatlántico realizado por Charles Lindbergh entre Nueva York y París3.
En el ámbito de la urología, el primer procedimiento robótico fue realizado en 1988, cuando en el Imperial College of London se utilizó el robot PUMA (Programmable Universal Manipulation Arm) para realizar una resección transuretral de próstata4.
Sin embargo, la cirugía robótica no se incorporó a la práctica clínica habitual sino hasta el año 2000, con la introducción del Sistema de Cirugía Robótica da Vinci (Intuitive Surgical, Sunnyvale, CA). Este sistema marcó un hito en la evolución de la cirugía asistida por robots, estableciendo un nuevo estándar en intervenciones de alta precisión, dominando el mercado por casi 20 años5. Sin embargo, con el reciente vencimiento de muchas patentes de Intuitive Surgical, entramos en una nueva era en la que numerosos competidores intentan hacerse con una parte del mercado de la cirugía robótica, dentro de los que destacan Avatera, Hinotori, Revo-i, Senhance, Versius, Surgenius, Omnibot y Toumai.
Todos estos sistemas robóticos actuales se controlan mediante una dinámica de «maestro-esclavo», donde el robot en sí mismo no tiene autonomía si no cuenta con un operador humano. Estos sistemas se basan en datos capturados a través de sensores e imágenes para operar los cuales se transmiten a la consola del cirujano, el cual realiza los movimientos de los controles de mando para poder realizar una cirugía6.
Finalmente, múltiples avances han aparecido en el campo de la cirugía robótica en los últimos años, incluido tecnología de puerto único, disminución del diámetro de los instrumentos, el desarrollo de sistemas seguros para telecirugía, la implementación de realidad aumentada, la retroalimentación háptica, la integración con inteligencia artificial, entre otros. Estos avances no solo han transformado la práctica quirúrgica actual, sino que también abren nuevas posibilidades hacia una cirugía cada vez más autónoma, precisa y personalizada.
Principios básicos de la cirugía robótica en urología
Componentes de un sistema robótico
En el mundo existen más de 10 plataformas robóticas maestro-esclavo disponibles para urología, por lo cual los componentes pueden variar ampliamente entre ellos.
Analizaremos las tres partes básicas de un sistema robótico poniendo énfasis en las plataformas robóticas disponibles actualmente en Chile (Da Vinci, Versius, Hugo RAS, Omnibot y Toumai).
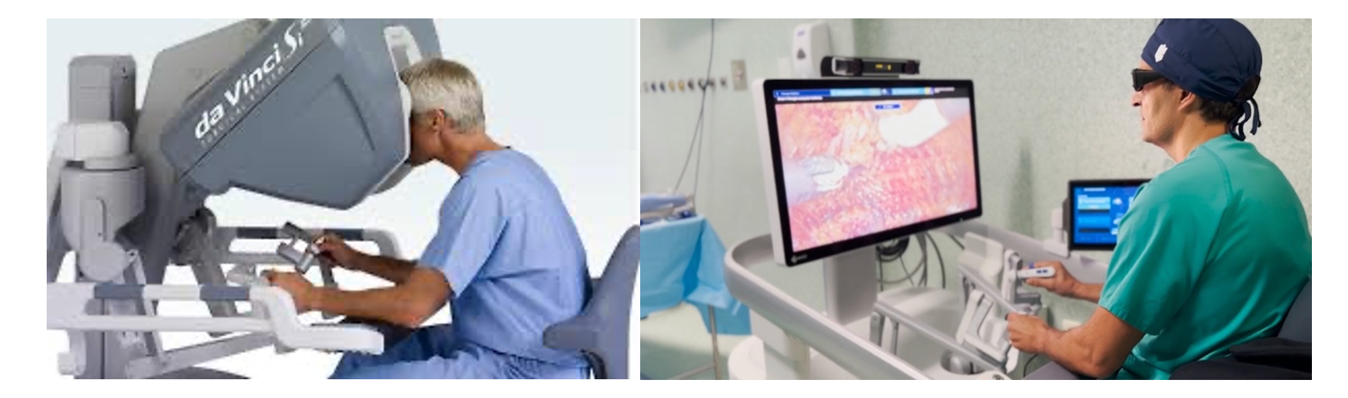
Consola del Cirujano
Lugar donde el cirujano principal, sin ropa estéril, controla los movimientos de los brazos robóticos. Esta consola es móvil, por lo que se puede posicionar en distintos sitios dentro del pabellón (Figura 1).
La consola, a su vez, está constituida por tres partes: controles de mando, sistema de visión y pedales.
Sistema de visión:
- Plataformas da Vinci, Toumai y Omnibot: el sistema de visión, definido como “cerrado”, está compuesto por un binocular con visión tridimensional (3D), en el cual el sistema procesa ambas imágenes provenientes de la cámara y proyecta cada una en una pantalla dentro de cada ojo del binocular, de manera que la imagen 3D es generada por nuestro cerebro.
- Plataforma Versius y Hugo RAS: el sistema de visión, definido como “abierto”, consiste en una pantalla 3D, la cual procesa ambas imágenes provenientes de la cámara robótica y las fusiona. El cirujano debe ocupar lentes 3D y permite que más cirujanos puedan observar la cirugía.
Controles de mando:
- Plataformas Da Vinci, Toumai, Hugo RAS y Omnibot: los controles de mando consisten en dos pares de anillos, en los cuales se introducen los dedos en forma de pinza. Estos tienen un rango de movimiento de 540 grados y el instrumento robótico replica los movimientos realizados por el cirujano. Tiene un botón llamado “finger clash”, que permite liberar el control para así acomodar las manos y seguir trabajando cómodamente.
- Plataforma Versius: todas las funciones asociadas al robot se realizan con el control de mando, incluido el movimiento de los instrumentos, la cámara y las funciones de corte y coagulación. El mando es similar a un joystick de una consola de juego. En la figura 2 se puede observar la estructura del control de mando.
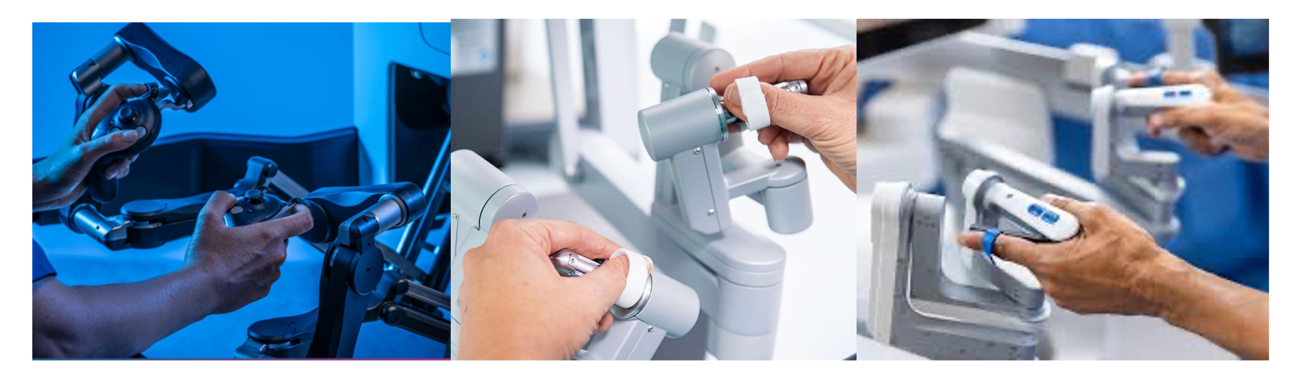
Figura 2. Controles de mando: a) Versius, b) Da Vinci, c) Hugo RAS
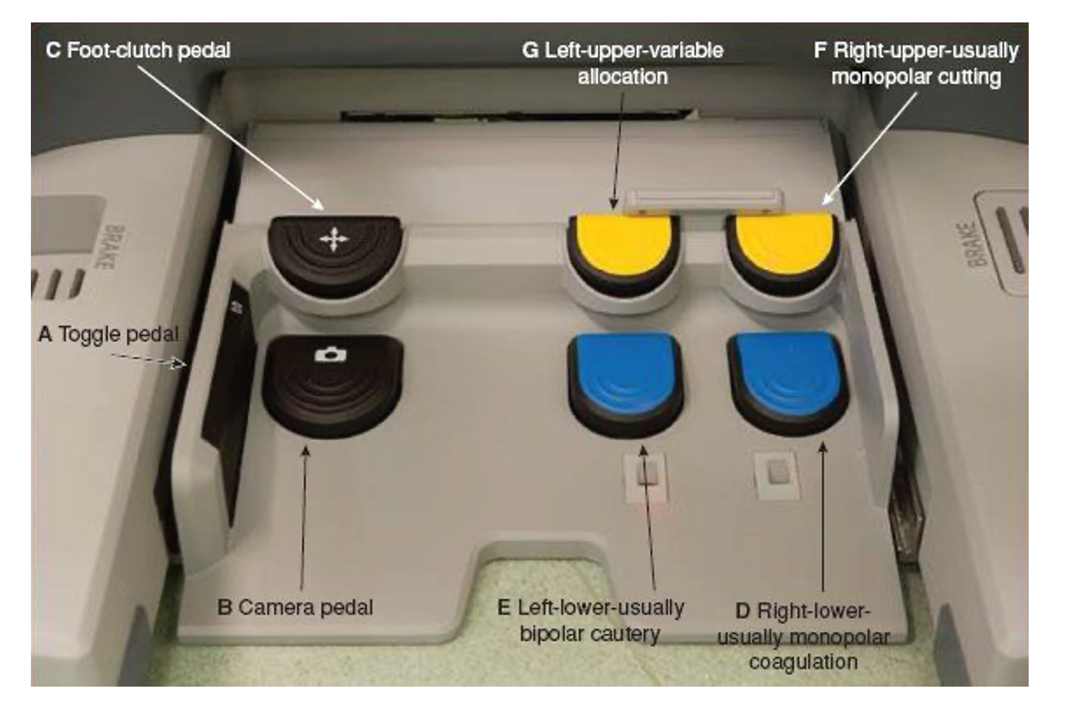
Sistema de pedales:
- Plataformas Da Vinci, Toumai, Hugo RAS y Omnibot: conformado por un pedal para manejar la cámara, otro llamado “Clutch”, el cual libera los controles de mando para así acomodarse libremente, un tercer pedal llamado “Arm swap pedal”, el cual facilita el cambio entre brazos, permitiendo la utilización del cuarto brazo alternadamente y dos pedales dobles, uno para cada brazo activo, los que activan la energía de corte o coagulación para cada instrumento (Figura 3).
- Plataforma Versius: no cuenta con pedales, todas las funciones se realizan con los controles de mando.
Carro paciente
Es el “robot” propiamente tal, con cuatro brazos de instrumentos. En los brazos, se posicionan los instrumentos a utilizar. Los brazos robóticos replicarán los movimientos del cirujano desde la consola de manera exacta (Figura 4).
Existen dos tipos de diseño del carro paciente:
- Único: todos los brazos nacen de una estructura en común. Utilizado por las plataformas da Vinci X, da Vinci Xi, Toumai y Omnibot.
- Múltiple o modular: Todos los brazos son independientes entre sí. Utilizado por las plataformas Hugo RAS y Versius.

Figura 4. Carro paciente: a) Carro único b) Carro modular
Carro Visión
Encargado de generar la imagen tridimensional de alta definición obtenida del área quirúrgica. Cuenta con un insuflador para generar el neumoperitoneo, una consola de energía y de un monitor bidimensional para que el ayudante vea la cirugía. Cabe destacar que en da Vinci esta pantalla es táctil y permite la realización de marcaciones que se verán en la consola del cirujano, siendo esta una excelente herramienta para el aprendizaje de la técnica (Figura 5).
La plataforma Versius no cuenta con Carro Visión.

Sistemas robóticos disponibles en Chile
Actualmente en Chile existen 5 plataformas robóticas comercializadas:
- Da Vinci X y Xi
- Hugo RAS
- Versius
- Omnibot
- Toumai
Da Vinci
La plataforma de cirugía robótica da Vinci, compuesta por seis modelos (S, Si, X, Xi, SP y 5) ha revolucionado múltiples especialidades quirúrgicas y se ha posicionado como el líder del mercado por más de 20 años.
Permite realizar cirugías de urología, ginecología, cirugía general, cirugía de tórax, cirugía pediátrica, cirugía de cabeza y cuello, cardiocirugía y cirugía de mama.
Intuitive Surgical comercializa cuatro modelos
- Da Vinci Xi (introducido en 2014)
- Da Vinci X (introducido en 2017)
- Da Vinci Single Port (SP) (introducido en 2018)
- Da Vinci 5 (introducido en 2024)
Los modelos da Vinci S y da Vinci Si han sido descontinuados y, hasta la fecha, los sistemas da Vinci SP y da Vinci 5 aún no han sido comercializados en Latinoamérica.
Todos los sistemas Da Vinci tienen en común que presentan una consola cerrada, un carro paciente y una torre visión.
Los instrumentos del sistema da Vinci tienen un diámetro de 8 mm y están equipados con tecnología «EndoWrist», término que se utiliza para describir un grupo de instrumentos articulados, dentro de los que se incluye tijeras, fórceps, portainjertos, retractores, instrumentos de energía monopolar y bipolar, grapadoras y selladores vasculares. Cada instrumento cuenta con siete grados de libertad de movimiento. Además, los sistemas da Vinci X y Xi utilizan los mismos instrumentos de manera intercambiable.
Sumado a lo anterior, los sistemas da Vinci incorporan la tecnología FireFly, basada en imágenes de fluorescencia infrarroja que detectan el verde de indocianina (ICG).
Da Vinci Xi
Introducido el año 2014 en el mercado, tiene como principales mejoras respecto a los modelos S y Si (Figura 6):
- Simplificación del acople entre brazo robótico y trocares, haciéndolo más intuitivo y rápido.
- Disminución del diámetro de la cámara a 8 mm, pudiendo esta ser posicionada en cualquier brazo robótico.
- Aumento de la longitud de los instrumentos a 62 cm.
- Sistema de posicionamiento de puerto guiado por láser que simplifica el acoplamiento y reduce el tiempo de configuración.
- El diseño de brazos está montado en un disco superior, denominado pluma, que permite que los brazos giren juntos como una unidad, lo que proporciona mayor flexibilidad y acceso a varias áreas del campo quirúrgico sin necesidad de reposicionamiento.
- Permite sincronizar la mesa de operaciones con los brazos robóticos para un posicionamiento sincronizado.
- Es posible modificar la intensidad del corte y coagulación de los instrumentos robóticos desde la consola del cirujano.
- Desarrollo de nuevos instrumentos avanzados, como engrapadora robótica articulada y sellador de vasos articulado.
Una de los principales incorporaciones del sistema da Vinci Xi es la función denominada “Targeting”. Esta función permite posicionar con precisión el brazo y los instrumentos del sistema alrededor del paciente para un acceso quirúrgico y una maniobrabilidad óptimos. Este proceso implica el uso de un sistema de orientación láser y una guía endoscópica para garantizar una configuración precisa y eficiente.
- Sistema de orientación láser: El sistema utiliza un láser para localizar el sitio quirúrgico y guiar el brazo de cámara a la posición correcta.
- Guía endoscópica: El cirujano realiza el acoplamiento (docking) de los brazos robóticos e introduce la cámara al interior del abdomen. Una vez dentro, el cirujano define la anatomía objetivo y los brazos robóticos se alinean automáticamente para optimizar su funcionalidad y evitar posibles colisiones de brazos.
Figura 6. Sistema Robótico Da Vinci Xi
Da Vinci X
Lanzado en 2017 como una alternativa más económica al Xi, pero con muchas características compartidas dentro de las que destacan (Figura 7):
- Misma consola del cirujano y carro visión que el Xi.
- Mismo diámetro de cámara y mismo sistema de acople brazo robótico- trócar
. - Instrumental compatible e intercambiable con sistema el sistema Xi.
- Posibilidad de modificar la intensidad del corte y coagulación de los instrumentos robóticos desde la consola del cirujano.
La principal diferencia entre los sistemas Xi y X radica en su impacto en el flujo de trabajo quirúrgico. El da Vinci Xi, al nacer los brazos de la pluma y al poseer un movimiento integrado con la mesa quirúrgica, permite optimizar los procedimientos multicuadrantes, reduciendo la necesidad de reacoplamiento y minimizando el tiempo operatorio. En cambio, el da Vinci X, al nacer los brazos desde la columna central, requiere reposicionamiento manual para acceder a diferentes cuadrantes, lo que puede prolongar la duración del procedimiento, aumentar el riesgo de colisión entre los brazos robóticos y puede requerir una planificación preoperatoria más meticulosa.

En resumen, el da Vinci Xi es un sistema más avanzado con mayor flexibilidad y capacidades para cirugías complejas y multi-cuadrantes, mientras que el da Vinci X ofrece una opción más económica con muchas de las ventajas del Xi, pero con limitaciones en la movilidad del carro quirúrgico.
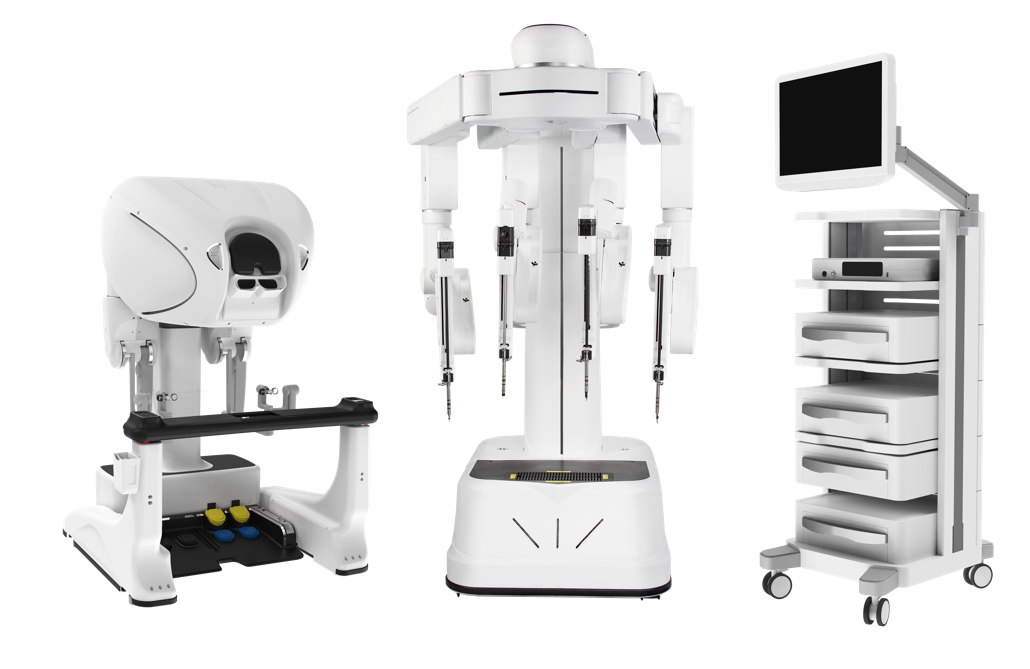
Hugo RAS
El sistema robótico Hugo™ RAS fue desarrollado por Medtronic en Minneapolis, EE.UU. y obtuvo la certificación CE en octubre de 2021. Desde su lanzamiento, el sistema Hugo RAS se ha incorporado en más de 20 países y se han realizado más de 8.000 procedimientos (Figura 8).
Permite realizar cirugías de urología, cirugía general y ginecología. Consta de una consola, una torre visión y cuatro carros de brazo robóticos independientes.
La consola de cirujano es abierta y requiere gafas 3D, con una resolución de 4K UHD (3840×2160 pixeles). Los controladores de mando son similares al da Vinci, pero con algunas diferencias (Figura 2). Adicionalmente, cuenta con pedales para control de cámara y funciones de corte y coagulación de los instrumentos.
Respecto al carro visión, el sistema Hugo RAS cuenta con un monitor para el ayudante, sin embargo, no se posible dibujar sobre éste. Destaca además, que el sistema está diseñado para ser actualizable, por lo que no es necesario adquirir un sistema más nuevo con el paso de los años.
Cada brazo robótico es independiente y cuenta con 6 bisagras y 7 grados de libertad. Los instrumentos son de 8 mm y tienen un largo entre 50 y 53 cm. La cámara es de 11 mm y se puede instalar en cualquier brazo, siempre que se considere un trocar de mayor diámetro. Sumado a lo anterior, el sistema cuenta con sellador de vaso Ligasure® articulado, sin embargo, no cuenta con engrapadora articulada. Desde marzo del 2025 cuenta con fluorescencia infrarroja con ICG.

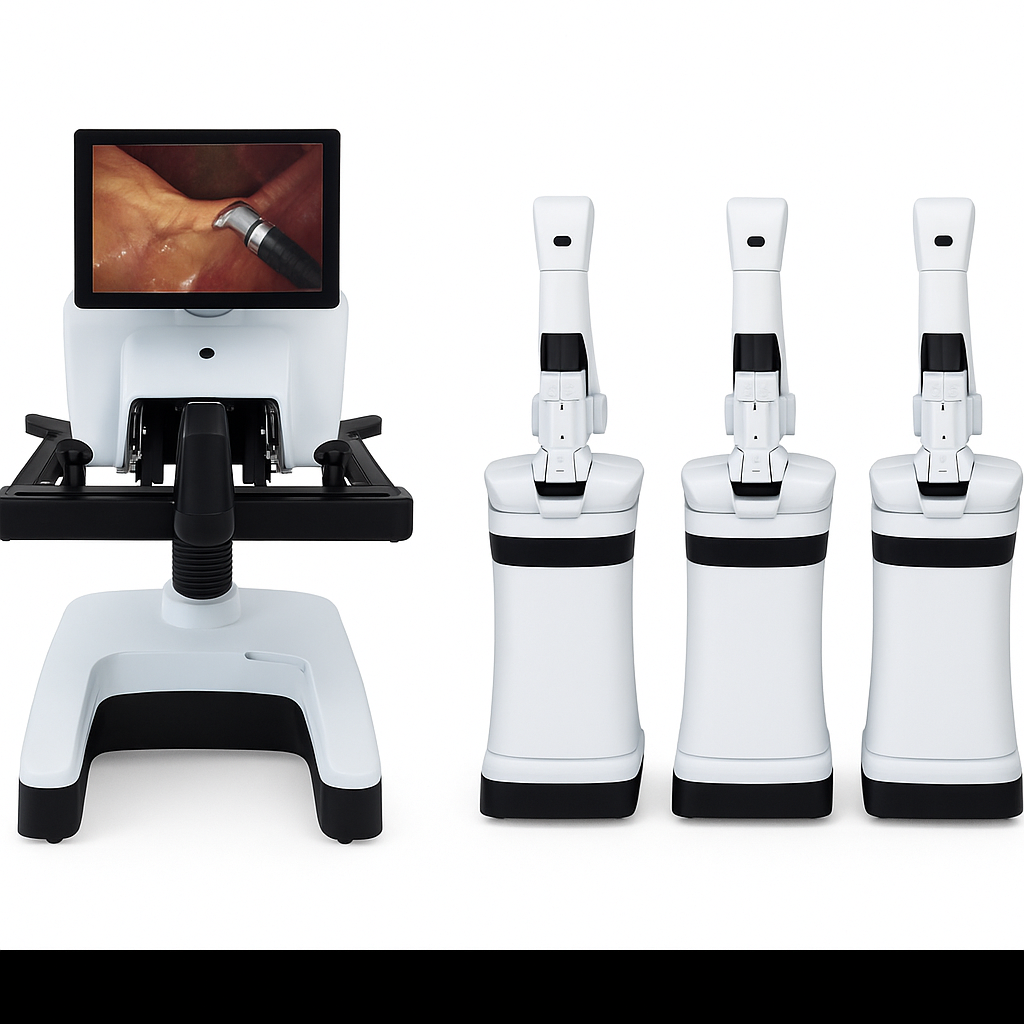
Versius
El sistema quirúrgico Versius fue desarrollado por CMR Surgical, en Cambridge, Reino Unido y obtuvo su certificación por la CE en 2019. Desde su aprobación, el sistema Versius se ha incorporado en más de 170 países, siendo la segunda plataforma robótica más utilizada en el mundo. Se han realizado más de 30.000 cirugías de diferentes especialidades, incluidas urología, cirugía general, ginecología, cirugía digestiva baja y cirugía de tórax, principalmente (Figura 9).
Está conformado por 4 carros portátiles montados cada uno a un brazo robótico independiente, uno para la cámara y tres para los instrumentos. La consola del cirujano tiene un diseño abierto, por lo cual requiere la utilización de anteojos 3D y la imagen está en calidad HD (1280x1080x60hz). El controlador de mando es similar a un controlador de juego, lo cual se consideró más cómodo y fácil de utilizar en el modelo preliminar. El control completo del dispositivo se encuentra en el controlador de mando, sin necesidad de pedales.
Los instrumentos articulados son delgados, de 6.8 mm de diámetro y pueden ser utilizados en trocares de 5 mm; permiten 7 grados de libertad y tienen una longitud de 30 cm. El endoscopio es de 10 mm y de 30 cm de longitud, por lo cual no se puede utilizar en todos los brazos, excepto se utilice un trocar de mayor diámetro. No cuenta con torre visión, por lo que es necesario una torre de laparoscopía con monitor para el ayudante e insuflador. No cuenta con sellador de vasos ni engrapadora articulada.
Cuenta con fluorescencia infrarroja con posibilidad de utilizar dos colores: ICG y Cien y permite 2 modos de visualización: en escala de grises y superposición.
Omnibot
La plataforma robótica Omnibot, desarrollada por Edge Medical/Reach Surgical, se lanzó al mercado en 2022 y obtuvo ese mismo año la aprobación de la NMPA (National Medical Products Administration), entidad China reguladora de medicamentos y dispositivos médicos, símil a la FDA o CE. A comienzos del año 2024 obtuvo la certificación de la CE para urología, ginecología, cirugía general y cirugía de tórax (Figura 10).
En menos de 3 años de funcionamiento, el Omnibot acumula más de 150 unidades instaladas en China y actualmente se comercializa en China, Polonia, Indonesia y Pakistán, con más de 8.000 intervenciones registradas (44 % urología, 17 % ginecología, 17 % bariátrica, 12 % cirugía general y 10 % torácica).
Al igual que sistema da Vinci, el Omnibot se compone de tres elementos principales: carro paciente, torre visión y la consola cirujano.
La consola del cirujano es cerrada, con una resolución de imagen Full HD de 1080p. Los controladores de mando y los pedales son idénticos al da Vinci. Desde la pantalla táctil de la consola del cirujano es posible modificar la angulación de la cámara pero no es posible modificar la intensidad del corte y coagulación de los instrumentos.
Respecto al Carro Visión, destaca que el procesador de imagen y fuente de luz independientes, a diferencia del da Vinci, que ambas vienen integrados en la cámara. El monitor no es táctil, lo que impide dibujar sobre las imágenes obtenidas de endoscopio.
En relación al Carro Paciente, el Omnibot cuenta con una pluma del cual emergen los brazos robóticos, similar al Da Vinci Xi. Esto facilita la realización de cirugías multicuadrantes y permite realizar el docking desde diferentes posiciones.
Respecto a los instrumentos, el largo es de 62-64 cm y el diámetro es de 8 mm con excepción de la cámara que es de 10 mm y requiere un trócar de mayor diámetro. La cámara se puede instalar en cualquier brazo, siempre que el trócar sea de 10 mm. La cámara tiene la función de fluorescencia infrarroja con ICG.
A la fecha, el Omnibot no cuenta con sellador de vasos articulado ni engrapadora articulada.
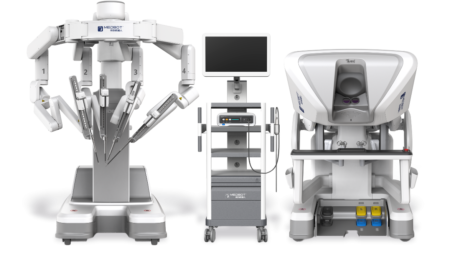
Toumai
La plataforma robótica Toumai, desarrollada por Microport en 2019 en China, obtuvo en 2022 la aprobación de la NMPA. Desde su aprobación, se han instalado más de 100 unidades en China en un periodo de 2 años, consolidándose como líder del mercado. Sumado a lo anterior, en mayo de 2024 obtuvo la aprobación CE (Figura 11).
Actualmente la plataforma está disponible en China, España, Italia, Bélgica, Panamá, Brasil, Ecuador, Angola, Marruecos, Georgia y recientemente se incorporó un Toumai al Hospital Italiano de Buenos Aires, Argentina.
El Toumai permite realizar cirugías de urología, ginecología, cirugía general, cirugía de tórax, cirugía pediátrica, cirugía de cabeza y cuello y cirugía de mama.
Similar al sistema Da Vinci, el Toumai se compone de tres elementos principales: carro paciente, torre visión y la consola cirujano.
La consola del cirujano es cerrada, inmersiva, con una resolución de imagen superior al da Vinci X y Xi (1920x1080x60hz vs 1280x1080x60hz). Los controladores de mando y los pedales son idénticos al da Vinci.
Respecto al Carro Visión, destaca que el procesador de imagen y fuente de luz independientes, a diferencia del da Vinci, que ambas vienen integrados en la cámara. El Carro Visión tiene la función “picture and picture”, que permite incorporar imágenes externas al monitor de la torre de visión, agregando un cuadro en campo quirúrgico. Sin embargo, el monitor no es táctil, lo que impide dibujar sobre las imágenes.
En relación al Carro Paciente, el Toumai cuenta con sistema de pluma, del cual emergen los brazos robóticos, similar al da Vinci Xi y Omnibot. Esto facilita la realización de cirugías multicuadrantes y permite realizar el docking desde diferentes posiciones. Incluye el botón “sub suspension joint button”, que permite mover los brazos robóticos de 2 en 2, lo que facilita el posicionamiento de brazos evitando colisiones de brazos. A diferencia del da Vinci Xi, el Toumai no cuenta con función de Targeting.
Adicionalmente, el Toumai cuenta con fluorescencia infrarroja con ICG con tres opciones de color en tiempo real. Gracias a la Inteligencia Artificial y la fusión de imágenes, el Toumai puede generar imágenes de inmunofluorescencia sobre imágenes en color, superando el enfoque tradicional con imágenes en blanco y negro.
Respecto a los instrumentos, el largo es de 66 cm, 4 cm más largo que el sistema da Vinci X y Xi. El diámetro de los instrumentos es de 8 mm, con excepción de la cámara que es de 10 mm y requiere un trócar de mayor diámetro. A la fecha, el Toumai no cuenta con sellador de vasos articulado ni engrapadora articulada robótica.
Comparación de las plataformas robóticas disponibles
En la Tabla 1 se resumen las principales características de las plataformas robóticas disponibles en Chile.
Tabla 1. Comparación plataformas robóticas disponibles en Chile.
| Sistema Robótico | Aprobación | Origen | Consola | Carro paciente | Óptica (mm) | Largo del instrumento (cm) | ICG | Engrapadora articulada | Sellador de vasos articulado |
| Da Vinci X y Xi | FDA y CE | USA | Cerrada | Único | 8 | 61-63 | Sí | Sí | Sí |
| Versius | CE | UK | Abierta | Múltiple | 10 | 30 | Sí | No | No |
| Hugo RAS | CE | USA | Abierta | Múltiple | 10 | 52-54 | Sí | No | Sí |
| Toumai | CE | China | Cerrada | Único | 10 | 66 | Sí | No | No |
| Omnibot | CE | China | Cerrada | Único | 10 | 62-64 | Sí | No | No |
Tecnología Single Port
Generalidades tecnología Single Port
En 2018, la FDA aprobó el sistema da Vinci Single Port (SP) para cirugía urológica. El sistema Da Vinci SP, desarrollado por Intuitive Surgical, representa una evolución significativa en la cirugía robótica mínimamente invasiva. Diseñado para realizar procedimientos complejos a través de una única incisión, el sistema SP ofrece características técnicas avanzadas que mejoran la precisión y reducen la invasión al paciente (Figura 12).
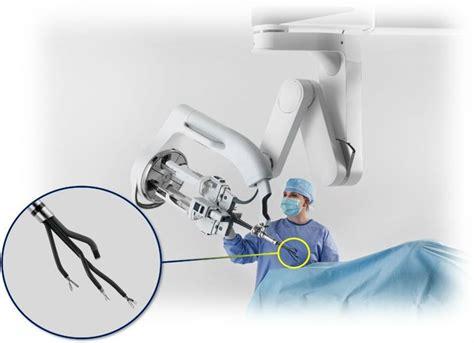
Una de las características distintivas del sistema da Vinci SP es su capacidad de articulación interna mejorada, que supera considerablemente la movilidad de los brazos utilizados en plataformas multipuerto (como X o Xi). Este avance es clave para su funcionamiento, especialmente en cavidades estrechas como el espacio de Douglas, la pelvis masculina o el retroperitoneo, optimizando los resultados clínicos y mejorando la experiencia del paciente.
Instrumentos Da Vinci SP: Tecnología EndoWrist SP
Los instrumentos SP, de 6 mm de diámetro, están diseñados con una arquitectura multisegmentada, que cuenta con una articulación dual que les permite ingresar de manera recta para luego expandirse en el interior del paciente. Los instrumentos están formados por (Figura 13):
- Shaft: parte larga y recta que atraviesa el puerto multicanal.
- Elbow: articula dentro del cuerpo, simulando un codo.
- Forearm: se expande dentro del cuerpo, permitiendo la triangulación.
- Tip: posee el mecanismo clásico de EndoWrist® con rotación, flexión y pinza.

Esto genera un arco de movimiento similar a un brazo humano dentro del cuerpo, pero más preciso y controlado. Cada instrumento puede rotar, flexionar y extenderse para alcanzar ángulos que serían imposibles con la cirugía laparoscópica o incluso con el sistema multipuerto.
Si bien es una plataforma de solo 8 años de existencia, cada vez son más las empresas desarrollando este tipo de robots quirúrgicos, por lo que prontamente se lanzarán al mercado otras plataformas SP, lo cual aumentará la experiencia, mejorará la competencia económica y entregarán más datos sobre los beneficios de esta técnica.
Diferencias entre Da Vinci SP y Da Vinci Multipuerto
En la tabla 2 se comparan las diferencias técnicas del Da Vinci SP y Da Vinci multipuerto y en la tabla 3 se comparan las ventajas y desventajas de la cirugía robótica SP versus cirugía robótica multipuerto 7-9.
Tabla 2. Comparación técnica Da Vinci SP y Da Vinci Multipuerto.
| Característica | Da Vinci X, Xi | Da Vinci SP |
| Número de brazos | 3–4 brazos externos independientes. | 1 brazo único multicanal. |
| Acceso | Múltiples trocares (8–12 mm) distribuidos. | Incisión única (25 mm). |
| Articulación | EndoWrist con 7 grados de libertad. | EndoWrist SP con doble articulación: hasta 90° adicionales. |
| Movilidad intraabdominal | Limitada por colisión externa. | Movimiento intracorpóreo fluido sin colisiones. |
| Cámara | Rígida, 3D-HD de 0° o 30°. | Flexible, articulada, 3D-HD, con rotación de 360°. |
Tabla 3. Ventajas y desventajas de la tecnología SP versus tecnología multipuerto.
| Característica | Cirugía Robótica Multipuerto | Cirugía Robótica Single Port |
| Historial y evidencia | Amplia trayectoria con más de 20 años de literatura que respalda resultados oncológicos comparables a la cirugía abierta. | Tecnología más reciente con evidencia emergente; destaca por su enfoque mínimamente invasivo. |
| Extensión del uso | Ampliamente utilizada en procedimientos urológicos diversos. | Uso creciente en procedimientos seleccionados, especialmente en espacios anatómicos estrechos. |
| Abordaje quirúrgico | Requiere múltiples incisiones para introducir los brazos robóticos. | Utiliza una sola incisión, generalmente umbilical, lo que reduce el trauma quirúrgico. |
| Dolor postoperatorio y recuperación | Mejora en comparación con cirugía abierta, pero mayor trauma que el SP. | Menor dolor postoperatorio, hospitalización más corta y recuperación potencialmente más rápida. |
| Resultados cosméticos | Cicatrices múltiples según el número de puertos utilizados. | Mejor resultado estético con una única cicatriz más discreta. |
| Posibilidad de cirugía ambulatoria | Menor frecuencia de procedimientos ambulatorios. | Potencial para cirugía ambulatoria debido a recuperación acelerada. |
| Eficiencia en espacios reducidos | Limitado en cavidades estrechas por la rigidez y colisión de los brazos múltiples. | Alta maniobrabilidad en espacios anatómicos reducidos, como pelvis masculina o retroperitoneo. |
| Costo | Generalmente más rentable por menor costo en insumos y plataforma consolidada. | Costos iniciales más altos; sin embargo, reducción en estancia hospitalaria podría compensarlos. |
| Accesibilidad y disponibilidad | Mayor disponibilidad en centros hospitalarios. | Menor disponibilidad y mayor curva de aprendizaje para el equipo quirúrgico. |
Nuevas abordajes mediante tecnología Single Port
Prostatectomía Radical Transvesical
Dentro de las técnicas novedosas desarrolladas gracias a esta plataforma, destaca la prostatectomía radical transvesical, que utiliza la vejiga como acceso, evitando la entrada a la cavidad peritoneal. Esta técnica ha demostrado tiempos operatorios y márgenes quirúrgicos comparables a la técnica multipuerto, pero asociado a menor requerimiento de opioides postoperatorios, rápida recuperación funcional y continencia completa a los 90 días mayor a un 90%. Además, permite estadías hospitalarias menores a 12 horas y puede realizarse bajo anestesia raquídea10.
Prostatectomía Radical Transperineal
Si bien la prostatectomía radical perineal fue el acceso más común para el tratamiento quirúrgico del cáncer de próstata durante casi siete décadas, esta técnica perdió popularidad debido a su complejidad técnica y al estrecho espacio operatorio11. El uso de sistemas robóticos, especialmente con la introducción de la plataforma SP, ha renovado el interés en la prostatectomía radical transperineal, sin embargo, su viabilidad aún se limita a centros seleccionados con amplia experiencia en esta técnica12.
El grupo de la Clínica Cleveland reportó la única serie clínica sobre RARP transperineal con plataforma SP. Se observaron resultados funcionales y oncológicos equivalentes a los 12 meses al comparar la plataforma SP perineal con la RARP transperitoneal multipuerto, pero a costa de mayores complicaciones y mayor tasas de márgenes quirúrgicos positivos (38.5% vs. 7.7%, p<0.01)13.
El abordaje perineal mínimamente invasivo podría representar una opción válida en pacientes con cirugía abdominal previa, ofreciendo además la posibilidad de realizar una linfadenectomía bilateral sin otro acceso.
Acceso retroperitoneal supino anterior (SARA)
Otra técnica desarrollada gracias a la plataforma SP, es el acceso “SARA” (Supine Anterior Retroperitoneal Access). Este abordaje facilita el abordaje retroperitoneal en posición supina, útil para la realización de cirugías oncológicas y reconstructivas del riñón y uréter. De esta manera, se evita el acceso al peritoneo y se disminuyen las complicaciones asociadas a la posición lateralizada estándar para el abordaje retroperiotoneal de las plataformas multipuerto.
Entre sus principales ventajas destaca un mejor control del dolor postoperatorio y la posibilidad de alta precoz, con hasta un 83% de los pacientes dados de alta el mismo día de la intervención y el resto, durante la mañana siguiente 14.
DA VINCI 5
Generalidades
El da Vinci 5 fue introducido en marzo del 2024 en Estados Unidos, luego de obtener la certificación de la FDA15. Intuitive Surgical optó por un lanzamiento escalonado en catorce programas de alto volumen para recopilar datos operativos previos a la liberación comercial completa. Entre los centros pioneros destacó el Hackensack University Medical Center (Nueva Jersey), que el 1 de abril de 2024 llevó a cabo las primeras cuatro prostatectomías robóticas con la nueva plataforma16.
Para el 30 de septiembre de 2024, ya existían más de 180 sistemas da Vinci 5 operativos y más de 12.000 procedimientos registrados. Se espera un lanzamiento comercial pleno en 2025 y la entrada en Europa en 202617.
Distintas modificaciones se han incorporado a esta nueva versión con el fin de mejorar la precisión quirúrgica y la experiencia del equipo en pabellón. Dentro de las modificaciones se incluye cambios en la consola del cirujano, mejoría en la imagen generada, incorporación sistema “Green-Dot”, cambios mecanismo de insuflación, entre otros, los cuales describiremos a continuación.
Características del sistema Da Vinci 5
En la tabla 4 se describen las principales diferencias entre el sistema da Vinci 5 y el sistema da Vinci Xi.
Consola del cirujano
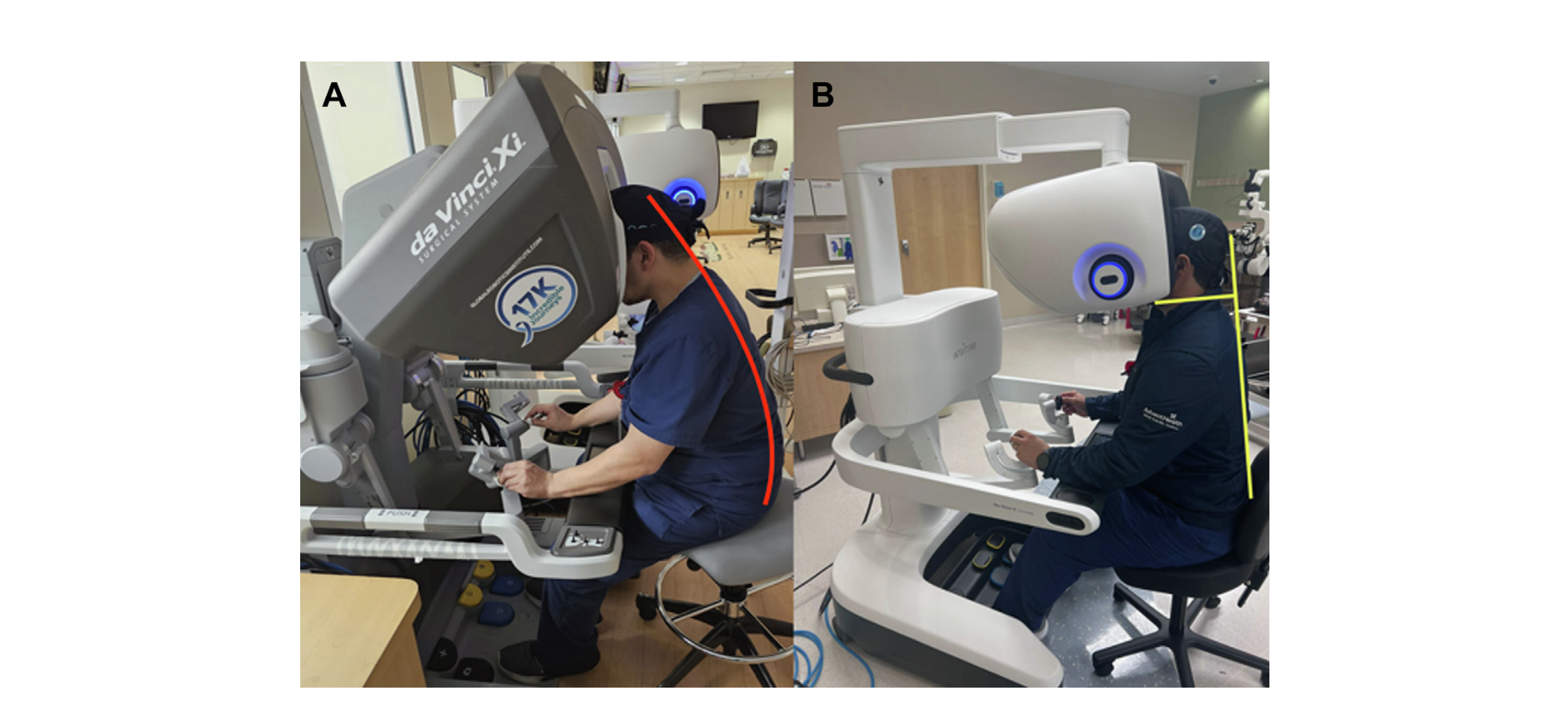
La consola del cirujano fue rediseñada, enfocado en mejorar la ergonomía del cirujano. Se amplía el rango de movimiento de la altura y el ángulo del el sistema de visión y apoyo cervical, logrando mantener el cuello recto. Esto podría disminuir la fatiga cervical-lumbar y lesiones musculoesqueléticas frecuentes asociados a mala postura en cirujanos robóticos18,19 (Figura 15). Adicionalmente, los controladores de mando son más livianos y están cubiertos con una superficie de goma.
Calidad de la Imagen
Respecto a la imagen, existe una mejoría en cuanto a la resolución, incluyendo un sistema de imagen 3D ultra HD, con 4 veces más pixeles que el da Vinci Xi20. En un primer reporte sobre la experiencia con el uso de da Vinci 5, el comité de cirujanos refieren que las nuevas imágenes parecen más precisas y con mejor definición18.
Interfaz del usuario unificada
Otro elemento que se agrega, es una interfaz del usuario unificada. Esto se refiere a que el carro del paciente, el carro visión y la consola del cirujano esta unificados en una interfaz, de manera que todas las funciones pueden ser realizadas desde los 3 componentes. De esta manera, el cirujano puede modificar la energía de los instrumentos, el ángulo del endoscopio, la insuflación, activar fireFly, grabar o sacar fotografías y obtener información sobre la retroalimentación háptica desde la consola del cirujano, sin retirar la cabeza del sistema de visión.
Función Green-Dot
El sistema cuenta con una nueva función de seguridad denominada “Green-Dot” que permite identificar que tan profundo se puede insertar el instrumento y la ubicación de este fuera del campo de la vista operatoria. Esta nueva función de seguridad, consiste en un mapa de la trayectoria que seguirá el brazo al momento de su introducción y un punto verde informará donde se ubicará la punta del instrumento (Figura 16). En caso de que la punta del instrumento fuera a impactar algún tejido, en la imagen no se puede observar el punto verde distal (a) informando sobre una trayectoria insegura. En caso de que se pueda observar el punto verde (b), informa sobre una trayectoria segura del instrumento sin riesgo de colisión con tejidos.
Estas actualización podrían reducir complicaciones relacionadas con la inserción de trocares y las lesiones fuera de la vista del cirujano, lo cual podría ser especialmente útil en cirujanos en su curva de aprendizaje18.

Sistema insuflación integrado
Otra modificación es el sistema de insuflación integrado. Este consiste en 2 conductos independientes que se pueden conectar a cualquiera de los trocares robóticos. Un trocar facilita la entrada de CO2 y el otro se encarga de extraer el humo, permitiendo mantener la presión intraabdominal estable a la vez que elimina el humo, similar al insuflador AirSeal®.
Instrumentos
Respecto a los instrumentos, se mantiene el diámetro y largo de estos, pero se incorpora la función de Retroalimentación Háptica, la cual consiste en una retroalimentación al controlador de mando sobre la fuerza ejercida a un tejido. Es importante destacar que la retroalimentación no otorga información sobre la fuerza de agarre de un instrumento, sino sobre la fuerza que se ejerce al empujar o traccionar un tejido. Esta función tiene 3 niveles de intensidad y podría reducir hasta en un 43% la tracción tisular18.
Los procedimientos de colocación y docking de trócares se asemejan a los del da Vinci Xi, utilizando trócares de 8 mm en todos los brazos, una configuración similar del carro del paciente y una articulación de brazo comparable.
Tabla 4. Comparación entre sistema da Vinci Xi y da Vinci 5.
| Característica | da Vinci Xi | da Vinci 5 |
| Ergonomía de la consola | Similar a generaciones anteriores | Mejorada |
| Controles de Mando | Similar a generaciones anteriores | Mejorada |
| Resolución de imagen | – | Mejorada |
| Instrumentos y trócares | 8 mm | 8 mm |
| Retroalimentación háptica | Ausente | Presente |
| Función “Green-Dot” | Ausente | Presente |
| Carro de paciente con cuatro brazos | Presente | Presente |
| Sistema propio de insuflación y evacuación de CO2 | Ausente | Presente |
| Consola cirujano, torre de visión y carro paciente integrados | Ausente | Presente |
Inteligencia Artificial en cirugía robótica
Generalidades de la Inteligencia Artificial (IA) en cirugía robótica
La IA consiste en el estudio y desarrollo de algoritmos que otorgan a las máquinas la capacidad de razonar y realizar funciones cognitivas como la resolución de problemas y la toma de decisiones, sin que un programador especifique cada paso. La IA ha revolucionado múltiples aspectos de la vida humana y una de las áreas donde tiene mayor impacto es en el campo de la medicina, donde permite a los médicos tomar decisiones más precisas al otorgar mayor información y además permite predecir los resultados de los pacientes con mayor grado de certeza.
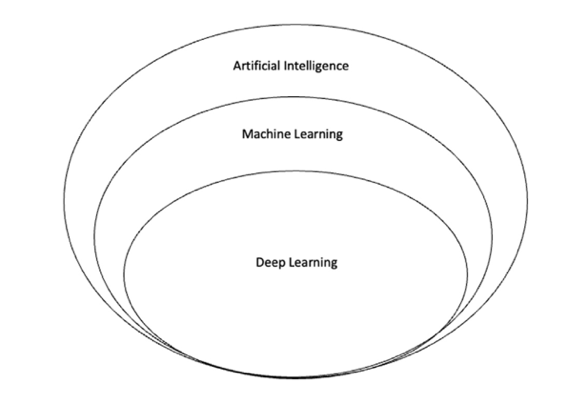
Cuando el modelo de IA usa grandes cantidades de ejemplos para “auto-aprender”, hablamos de “machine learning” (ML), en cambio, si las redes neuronales son profundas y procesan imágenes, vídeo o sonido, lo llamamos “deep learning “(DL). (Figura 17).
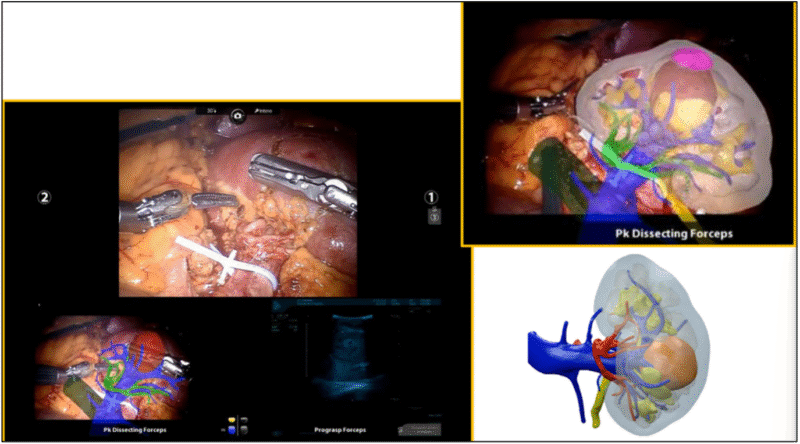
Los sistemas quirúrgicos robóticos actuales recopilan grandes volúmenes de información intraoperatoria a partir de sensores e imágenes en tiempo real, generando una gran cantidad de datos que sirven de sustrato para generar algoritmos con IA. De esta manera, la IA en cirugía robótica se ha centrado en buscar ampliar la autonomía de los sistemas robóticos y la asistencia inteligente durante el acto operatorio21 (Figura 18).
En términos generales, las mejoras intraoperatorias que proporciona la IA se pueden clasificar en dos categorías: autonomía robótica y evaluación/retroalimentación quirúrgica (Tabla 5).
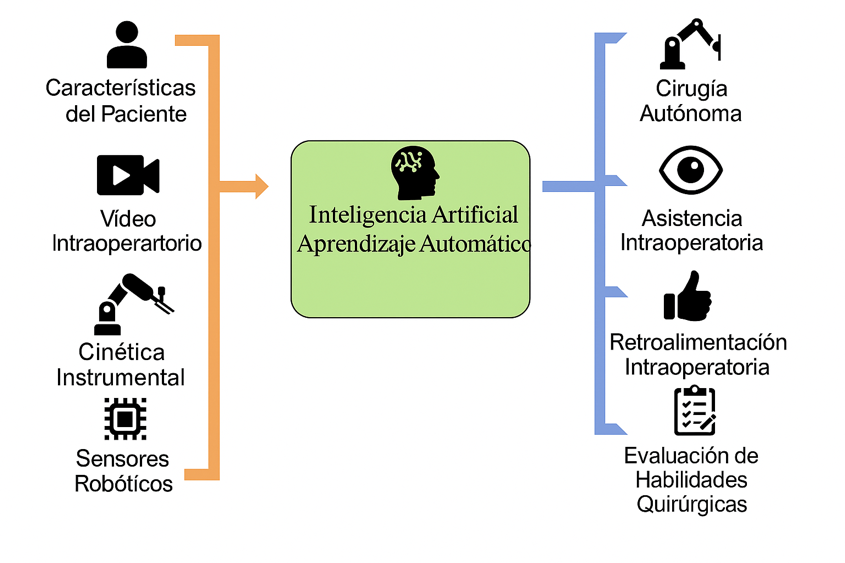
Figura 18. Datos de entrada y salida para el desarrollo de algoritmos de Inteligencia Artificial.
Tabla 5. Datos de entrada y salida para la aplicación de IA a cirugía robótica.
| Área | Objetivo | Datos de entrada | Salida del algoritmo |
| Autonomía Quirúrgica | Asistir o ejecutar pasos del procedimiento quirúrgico | Vídeo en tiempo real, cinética de los instrumentos, sensores de fuerza | Imagen mejorada, avisos de seguridad, movimientos automáticos |
| Evaluación y retroalimentación | Medir objetivamente la destreza y dar feedback | Vídeo, trayectorias de instrumentos, biosensores | Métricas de rendimiento, clasificación experto/novato, consejos personalizados |
Autonomía quirúrgica e IA
Existen diferentes niveles de autonomía en cirugía. Attanasio y colaboradores, describieron un total de 6 niveles de autonomía para robots quirúrgicos22 (Tabla 6).
El nivel 0 es ampliamente utilizado y hace referencia a todos los sistemas robóticos maestro-esclavo disponibles actualmente. En cambio el nivel 5, que hace referencia a plena autonomía, está en fase de estudio y no ha sido alcanzado actualmente.
Tabla 6. Niveles de autonomía para robots quirúrgicos.
| Nivel | Descripción | Ejemplo |
| Nivel 0 (sin autonomía) | El movimiento del robot lo controla exclusivamente el cirujano, sin ningún tipo de apoyo ni restricción. | Da Vinci, Hugo RAS, Omnibot, Versius, etc. |
| Nivel 1 (asistencia robótica) | Pueden interactuar con el cirujano para guiar o apoyar la ejecución de una tarea específica. | Realidad aumentada, retroalimentación háptica. |
| Nivel 2 (autonomía de tareas) | Pueden realizar tareas quirúrgicas específicas según las especificaciones proporcionadas por el cirujano. El control del robot pasa del operador humano a la máquina durante la ejecución de la tarea. | Aquablation. |
| Nivel 3 (autonomía condicional) | Cuentan con capacidades perceptivas para comprender el escenario quirúrgico, planificar y ejecutar tareas específicas y actualizar el plan durante la ejecución. De forma similar al nivel 2, el control del robot pasa del cirujano a la máquina durante la ejecución de la tarea. | Sutura endoscópica. |
| Nivel 4 (alta autonomía) | Pueden interpretar la información preoperatoria e intraoperatoria, diseñar un plan de intervención compuesto por una secuencia de tareas, ejecutarlo de forma autónoma y replanificarlo si es necesario. Un cirujano supervisa el sistema bajo el paradigma de control discreto. | Estudios en fantomas (resección tumoral guiada por palpación/fluorescencia). |
| Nivel 5 (plena autonomía) | Pueden realizar cirugías por sí solos, sin intervención humana. Este nivel no ha sido alcanzado actualmente. |
Dentro de las aplicaciones de la autonomía en IA encontramos:
Mejora de la imagen del campo quirúrgico
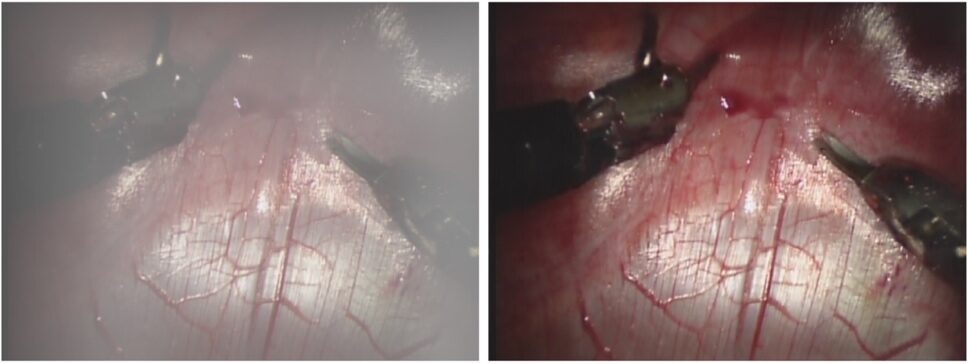
La mejora de imagen con IA en tiempo real permite una mejor identificación de estructuras anatómicas e instrumentos. Dentro de los avances en esta área, Ali et al. desarrollo un sistema capaz de eliminar el ruido, capaz de corregir los colores en tiempo real y capaz de mejorar el foco durante la artroscopia de rodilla, siendo superior a los métodos existentes23. Por otro lado, Wang et al. desarrolló un sistema capaz de eliminar el humo generado al utilizar electrocauterio, generando una imagen mejorada y sin humo. Este sistema está disponible en la plataforma Toumai24.
Reconocimiento de tejidos
La IA ha desarrollado sistemas capaces de proporcionar información sobre diferentes tejidos, mejorando la identificación de planos quirúrgicos. Se han desarrollado modelos para identificar el plano de disección en una gastrectomía asistida por robot25, sistemas que mediante imágenes de fluorescencia permite dirigir la disección durante cirugía oncológica orofascial26, entre otros.
Este avance en detección de tejidos mediante IA ha permitido fusionar modelos generados de imágenes obtenidas en forma preoperatoria con imágenes quirúrgicas en tiempo real, lo que se ha denominado Realidad Aumentada (RA). En otras palabras, un modelo de RA para cirugía es una plataforma que busca crear y mostrar información digital en tiempo real, superpuesta sobre el órgano real27.
En el campo de la urología distintos modelos de RA se han desarrollado. En el trabajo de Bianchi et al., se utilizaron imágenes por resonancia magnética multiparamétrica preoperatoria (para guiar la toma intraoperatoria de muestras de tejido para análisis y detectar márgenes durante la RARP (Figura 20). A partir de estas imágenes generaron un modelo tridimensional de realidad aumentada (RA-3D) que se superpuso al campo operatorio en la consola. El empleo de RA-3D redujo de forma significativa la tasa de márgenes positivos en la lesión índice frente al abordaje estándar sin RA (p = 0,01)28.
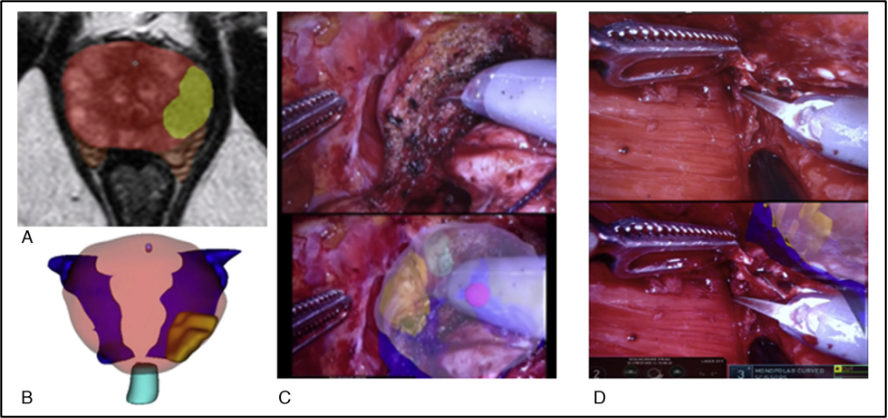
En 2018, Porpiglia et al. realizaron un estudio de casos y controles que comparó RAPN guiadas con RA-3D con un grupo control intervenido sin realidad aumentada. Los pacientes operados sin RA-3D presentaron una incidencia significativamente mayor de isquemia global (80 % frente a 24%; p < 0,01)29.
El mismo equipo publicó en 2020 un estudio retrospectivo de 91 pacientes con tumores renales complejos sometidos a RAPN: 48 intervenciones guiadas por un modelo 3D-RA y 43 con ecografía 2D. En comparación con los procedimientos Eco-guiados, la RA-3D se asoció con tasas más bajas de isquemia global (45,8 % vs. 69,7 %; p = 0,03), mayor frecuencia de enucleación tumoral (62,5 % vs. 37,5 %; p = 0,02) y menor apertura del sistema colector (10,4 % vs. 45,5 %; p = 0,003)30 (Figura 21).
Aún faltan estudios multicéntricos y randomizados que confirmen estos resultados y falta desarrollo tecnológico que permita superar los desafíos actuales de la RA, pero la tendencia sugiere que la RA se convertirá en un estándar complementario en la cirugía urológica mínimamente invasiva.
Retroalimentación Táctil
A diferencia de la cirugía abierta, donde la percepción táctil y la sensación de fuerza son fundamentales para manipular los tejidos con seguridad, la cirugía robótica convencional carece de una retroalimentación háptica directa. Aunque la nueva generación de plataformas puede mostrar valores de fuerza en la consola, muchos cirujanos encuentran difícil traducir esas cifras abstractas en la presión real ejercida sobre los tejidos intraoperatorios.
El interés por restaurar la sensibilidad háptica ha impulsado numerosos desarrollos tecnológicos. Zhu et al. crearon un sistema para cirugía transoral que integra sensores piezoeléctricos en las puntas de los instrumentos capaces de detectar fuerzas de hasta 15 N; estos valores se muestran en tiempo real en la consola, y alertas automáticas impiden superar umbrales considerados seguros31.
A pesar de estos avances, históricamente se ha aceptado que la visión tridimensional de alta definición y la precisión de los brazos robóticos compensan la ausencia de tacto32, por lo que será sumamente interesante ver si los datos clínicos de las cirugías realizadas con las nuevas plataformas robóticas serán lo suficientemente convincentes como para cambiar la opinión de la comunidad quirúrgica.
Avances en automatización
Se están realizando múltiples investigaciones para alcanzar niveles más altos de automatización con IA, con el objetivo de aliviar la carga física y mental intraoperatoria al automatizar determinadas tareas quirúrgicas.
Automatización de la sutura robótica
Uno de las áreas más estudiada es la automatización de la sutura robótica. En su trabajo, Marques Marinho et al. diseñaron una técnica que automatiza la formación del lazo durante la reparación de una fístula traqueoesofágica neonatal. Para ello, emplean modelos de inteligencia artificial que, en tiempo real, imponen restricciones al movimiento de los instrumentos —limitando ciertos grados de libertad— y guían al cirujano a lo largo de ese proceso. Al utilizar esta asistencia, los cirujanos informaron una disminución del esfuerzo físico y un tiempo de ejecución significativamente menor(Automatización nivel 2)33. En la misma línea, Saeidi et al. crearon un sistema robótico capaz de realizar de forma totalmente autónoma una anastomosis intestinal por vía robótica. Los datos obtenidos informan que su sistema de anastomosis supera la técnica manual y la técnica robótica de cirujanos expertos en cuanto a consistencia y precisión. (Automatización nivel 4)34.
Automatización de la cámara
Otra área de estudio es la automatización de la cámara. Eslamian et al. desarrollaron un modelo que incorpora seguimiento intraoperatorio de herramientas, datos cinemáticos robóticos y datos de imágenes intraoperatorias, capaz de definir de forma autónoma el campo quirúrgico y el zoom correcto para una visualización quirúrgica óptima35.
Aunque estos hallazgos aún no están disponibles en la práctica clínica, representan un avance significativo en la cirugía robótica potenciada por IA y anticipan numerosos progresos en automatización durante los próximos años.
IA en la evaluación y retroalimentación quirúrgica robótica
La cirugía robótica se ha posicionado como una herramienta indispensable en la era actual. Sin embargo, la vía óptima de capacitación en esta tecnología sigue sin estar claramente definida.
Una de las aplicaciones de la IA en la formación quirúrgica robótica es la generación automatizada de métricas objetivas, como el tipo de instrumento utilizado, los movimientos de las manos, el seguimiento ocular, el tiempo quirúrgico, la detección de errores, entre otros36. Estas métricas, que tradicionalmente requerían revisión manual por parte de los docentes, ahora pueden obtenerse en tiempo real mediante algoritmos de aprendizaje automático, disminuyendo el tiempo necesario para la formación en robótica y aumentando el acceso37.
La tecnología facilitadora central en este proceso es el **reconocimiento automático de gestos quirúrgicos**, conocidos como «surgemas». Estos gestos representan unidades mínimas de acción, -como insertar una aguja, realizar un corte o retirar una sutura- y constituyen la base para determinar las habilidades del cirujano, para diseñar programas de entrenamiento quirúrgico y para desarrollar niveles de autonomía en cirugía robótica. Incluso, su análisis se ha correlacionado con resultados clínicos38.
A pesar de los desafíos inherentes a la detección de surgemas —como su complejidad y la naturaleza multietapa de los gestos—, su estudio e identificación han contribuido al desarrollo de mejoras significativas en la simulación quirúrgica robótica y en los sistemas de retroalimentación intraoperatoria.
Evaluación experiencia quirúrgica y de resultados post operatorios
Hasta la fecha, el método de referencia para evaluar el desempeño del cirujano ha sido la determinación de la experiencia quirúrgica previa (número de casos) y/o la evaluación realizada por pares. Sin embargo, la evaluación por pares se ve limitada por la subjetividad y la alta variabilidad interobservador39.
Como una alternativa emergente, las **“automated performance metrics” (MAP)** ofrecen un enfoque objetivo, práctico y en tiempo real. Estas métricas se basan en el análisis de video y del movimiento de los instrumentos quirúrgicos y su combinación con algoritmos de ML permite desarrollar herramientas de evaluación objetivas del rendimiento del cirujano. Estudios preliminares han demostrado que las MAP pueden diferenciar el desempeño de cirujanos expertos y novatos, generando una evaluación imparcial y precisa40-43.
Además, Hung et al. demostraron que la combinación de MAP con algoritmos de ML no solo permite evaluar habilidades, sino también predecir resultados clínicos a corto plazo. En su estudio, a través del análisis de métricas quirúrgicas extraídas durante prostatectomías radicales asistidas por robot (RARP), lograron predecir la continencia urinaria posoperatoria. Los resultados mostraron que los cirujanos con APM más eficientes alcanzaron tasas significativamente mayores de continencia a los 3 y 6 meses posteriores al procedimiento44.
En conclusión, el uso de IA en la evaluación quirúrgica ofrece una herramienta objetiva y eficiente que supera las limitaciones de la evaluación tradicional, permitiendo no solo valorar el desempeño quirúrgico de forma imparcial, sino también predecir resultados clínicos a corto plazo.
Educación en cirugía robótica
La simulación quirúrgica constituye un pilar fundamental en la formación en cirugía robótica, dada la necesidad de desarrollar habilidades específicas en el uso de la consola, los instrumentos y las tecnologías asociadas. Esta exigencia técnica se asocia a una curva de aprendizaje más prolongada en comparación con la cirugía abierta45. Sin embargo, la efectividad de los simuladores actuales se encuentra limitada. Muchos de ellos utilizan física básica, lo que dificulta una representación precisa de deformaciones tisulares complejas. Como resultado, estos simuladores se centran en capacitar a los cirujanos en tareas simplificadas para mayor agilidad, en lugar de replicar las complejidades de las cirugías completas46.
En este contexto, la IA abre nuevas posibilidades para la simulación en cirugía robótica. La IA permite crear simulaciones quirúrgicas realistas a menor costo, facilitando el acceso a la formación y superando algunas limitaciones actuales47. Además, estos modelos pueden adaptarse para representar una mayor variedad de procedimientos, especialidades e incluso características específicas de los pacientes (como obesidad o variantes anatómicas), no disponible con los simuladores actuales.
El Método de Elementos Finitos (MEF) es actualmente el método de referencia para simular la deformación en tejidos blandos. Sin embargo, su aplicación ha estado restringida por la elevada complejidad computacional y la dificultad para estimar con precisión los parámetros de deformación tisular. En respuesta a esta limitación en la simulación actual, Wu et al. desarrollaron un modelo que integra datos reales de cirugías robóticas con modelos de simulación, logrando mejoras del 15-30 % en diversos parámetros de simulación48.
Otro avance impulsado por la IA es la retroalimentación intraoperatoria. Estudios recientes han explorado los efectos de la retroalimentación visual y auditiva en tiempo real durante procedimientos robóticos, demostrando beneficios concretos en el desempeño de cirujanos con menor experiencia. Estos hallazgos también podrían contribuir a personalizar los sistemas de retroalimentación según el perfil del cirujano, optimizando así el aprendizaje intraoperatorio49-51.
Aunque se dispone de evidencia limitada sobre la eficacia de los sistemas educativos potenciados por IA, se espera que estos enfoques personalizados mejoren la educación robótica y reduzcan la curva de aprendizaje.
Telecirugía en urología
Introducción a la Telecirugía
La telecirugía, constituye una de las aplicaciones más avanzadas de la telemedicina moderna. Utiliza sistemas robóticos quirúrgicos interconectados a través de redes digitales de alta velocidad para permitir que un cirujano opere a un paciente ubicado a kilómetros —o incluso continentes— de distancia. Esta tecnología ha emergido como una respuesta a múltiples desafíos contemporáneos, tales como la inequidad en el acceso a atención quirúrgica avanzada, la concentración de especialistas en centros urbanos y la necesidad de soluciones innovadoras para contextos de guerra, desastres naturales o regiones remotas con escasa cobertura médica.
Su hito histórico fue la «Operación Lindbergh» en 2001, donde un equipo en Nueva York realizó una colecistectomía laparoscópica en Estrasburgo utilizando el sistema ZEUS mediante una conexión de fibra óptica exclusiva52.
Desde entonces, la evolución ha sido exponencial. La aparición de plataformas robóticas más accesibles (como Toumai u Omnibot), la masificación de redes 5G y la integración de inteligencia artificial, sensores hápticos, y herramientas de simulación 3D han hecho posible que la telecirugía deje de estar en una fase experimental para convertirse en un recurso clínico viable y en constante desarrollo, especialmente en disciplinas como la urología, donde la cirugía mínimamente invasiva robótica está ampliamente consolidada53,54.
Componentes y requisitos técnicos
Para la implementación de telecirugía, se requiere de la integración de múltiples componentes, mencionados a continuación.
Plataformas robóticas interactivas: Para que una plataforma robótica pueda realizar telecirugía, debe contar con una elevada precisión en la ejecución de movimientos, así como compatibilidad con consolas remotas. Asimismo, es fundamental garantizar la estabilidad del sistema y contar con mecanismos que permitan continuar el funcionamiento del sistema ante una falla ( redundancia funcional).
Diversas plataformas emergentes, como Omnibot, Toumai y Kangduo han demostrado un rendimiento satisfactorio en escenarios clínicos reales55,56.
Redes de baja latencia (<200 ms): Cuando hablamos de latencia en telecirugía, nos referimos al retraso temporal entre la acción realizada por el cirujano (por ejemplo, mover un instrumento quirúrgico desde una consola) y la respuesta efectiva del sistema robótico en el sitio remoto donde se encuentra el paciente. La experiencia demuestra que una latencia mayor a 300 ms deteriora significativamente la precisión y aumenta el riesgo quirúrgico y se recomienda que sea <200 ms. En pruebas reales entre Orlando y Shanghái, la latencia se logró mantener en rangos de 137–185 ms, y en China se alcanzaron valores tan bajos como 30–60 ms mediante fibra óptica y 5G57,58.
El desarrollo de algoritmos de IA para compensación de latencia y la irrupción de redes 6G permitirán escalar la tecnología manteniendo seguridad y eficiencia en la transmisión59.
Ciberseguridad y redundancia de transmisión: La ejecución segura de procedimientos quirúrgicos a distancia exige la implementación de estrategias robustas de ciberseguridad y mecanismos de respaldo en la transmisión de información. Para esto se requieren canales de comunicación cifrados, servidores de respaldo, sistemas de detección de intrusos y protocolos de recuperación ante fallo para garantizar continuidad y confidencialidad60.
Soporte médico local: Toda cirugía remota debe contar con un equipo quirúrgico en el sitio del paciente entrenado para intervenir en caso de urgencias intraoperatorias o frente a desconexión o fallos técnicos del sistema.
Desafíos éticos, legales y de implementación
A pesar de los avances tecnológicos, la implementación a gran escala de la telecirugía enfrenta múltiples desafíos. Estos no solo involucran aspectos técnicos, sino que también abarcan dilemas éticos, marcos regulatorios insuficientes y barreras operativas reales que podrían comprometer su adopción segura y equitativa.
Una de las interrogantes más complejas es la **definición de la responsabilidad legar ante efectos adversos**. ¿Quién es legalmente responsable ante un evento adverso? ¿El cirujano remoto, el equipo local, la institución, o el proveedor de conectividad? La falta de claridad respecto a estas interrogantes ha dificultado su implementación generalizada. La literatura actual subraya la necesidad urgente de una legislación internacional que defina la responsabilidad legal, los estándares de calidad, la cobertura aseguradora y los mecanismos de resolución de conflictos en telecirugía61.
La **ciberseguridad** representa otro desafío clave en telecirugía, dado que los sistemas implican la transmisión en tiempo real de datos biomédicos altamente sensibles. Cualquier brecha en la seguridad puede comprometer la privacidad del paciente y la integridad del procedimiento. Por ello, se requieren sistemas de protección robustos que garanticen la confidencialidad y seguridad de la información médica53,59.
Aplicaciones y futuro de la telecirugía en urología
Experiencia Urológica en Telecirugía: La urología ha liderado múltiples ensayos y procedimientos reales en telecirugía. En China, se realizó una prostatectomía radical entre Beijing y Harbin (1300 km) en 60 minutos, con solo 100 ml de sangrado y recuperación completa al séptimo día55. En otra experiencia, tres urólogos ubicados en Beijing, Hunan y Hainan colaboraron en una cirugía con triple consola conectada en tiempo real56.
En Chile aún no se han publicado casos de telecirugía, aunque existen condiciones ideales para su introducción: múltiples plataformas robóticas instaladas, redes de baja latencia y capital humano entrenado, sumado a la incorporación en el mercado de plataformas robóticas con experiencia en telecirugía (Omnibot, Toumai).
El país ya cuenta con experiencias de telementoría quirúrgica, posicionándose como un candidato natural para ensayos piloto regionales.
Telementoría quirúrgica: La telementoría se define como la supervisión remota y en tiempo real de un procedimiento quirúrgico por parte de un experto. Esta modalidad pareciese ser el primer paso lógico, seguro y progresivo hacia una telecirugía completamente remota.
Permite al mentor observar, aconsejar y corregir al cirujano en formación desde otra ubicación. Se puede llevar a cabo en distintos niveles de complejidad, desde compartir la imagen quirúrgica junto con comunicación de audio, hasta una consola compartida que permita al menor tomar control del movimientos de los instrumentos.
La telementoría, al contar con supervisión activa, permite disminuir las curvas de aprendizaje, asegurar buenas prácticas en hospitales periféricos o centros formadores y mejorar la seguridad del paciente al disminuir la tasa de errores quirúrgicos y disminuir la dependencia a grandes centro urbanos61,62.
La telementoría por fases, donde un cirujano experto asiste remotamente en momentos críticos de la cirugía (por ejemplo, disección prostática, anastomosis vesicouretral), permite eficiencia operativa sin requerir disponibilidad completa, y es aplicable incluso en cirugías de alta complejidad.
Intervenciones multinacionales colaborativas: Los avances en conectividad permitirán que equipos quirúrgicos ubicados en distintos países participen de forma simultánea en un mismo procedimiento. Esto ya ha sido demostrado experimentalmente, como en el caso de la triple consola en China55. En el futuro, este enfoque podría convertirse en una alternativa de colaboración quirúrgica internacional, especialmente en intervenciones complejas que requieran experticia multidisciplinaria proveniente de diferentes centros de excelencia.
Red 6G y seguridad cuántica: La implementación de redes 6G reducirá la latencia a menos de 1 ms, lo que permitirá una experiencia quirúrgica prácticamente indistinguible de la presencial. Sumado a esto, los sistemas de seguridad cuántica (basados en principios de mecánica cuántica para el cifrado de datos) ofrecerán un nivel sin precedentes de protección frente a cualquier intento de interceptación o manipulación de la información. Esto generará una telecirugía segura, confidencial y con trazabilidad60.
Conclusión: La telecirugía en urología ha dejado de ser una posibilidad futura para convertirse en una realidad emergente, con resultados exitosos a nivel internacional. Su implementación requiere no solo avances tecnológicos, como plataformas precisas, redes de baja latencia y ciberseguridad robusta, sino también marcos legales claros, formación especializada y apoyo institucional.
En este contexto, Chile se posiciona estratégicamente en América Latina gracias a su creciente red de hospitales equipados con plataformas robóticas, disponibilidad de profesionales especializados y un entorno político favorable a la innovación tecnológica en salud. Se espera que Chile pueda concretar sus primeras experiencias en telecirugía en un futuro próximo, consolidándose como referente regional en telecirugía.
Bibliografía
1. Bowersox IC, Shah A, Jensen J, et al. Vascular ap- plications of telepresence surgery: Initial feasibility studies in swine. J Vasc Surg 1996;23(2):281–7.
2. Dario P, Hannaford B, Menciassi A. Smart surgical tools and augmenting devices. IEEE Trans Robot Autom 2003;19(5):782–92.
3. Shah J, Vyas A, Vyas D. The History of Robotics in Surgical Specialties. Am J Robot Surg. 2014;1(1):12–20. doi:10.1166/ajrs.2014.1006
4. Davies BL, Hibberd RD, Coptcoat MJ, et al. A surgeon robot prostatectomy-a laboratory evalu- ation. J Med Eng Technol 1989;13(6):273–7.
5. Brodie A, Vasdev N (2018) The future of robotic surgery. Ann Royal Coll Surg Engl 100(Supplement 7):4–13
6.Hashimoto DA, Rosman G, Rus D, Meireles OR (2018) Artifcial intelligence in surgery: promises and perils. Ann Surg 268(1):70. https://doi.org/10.1097/SLA.0000000000002693
7. Comparison of outcomes between single-port and multi-port robotic radical nephrectomy Kennedy E Okhawere , et al. J Robot Surg. 2024 Nov 15;18(1):407. doi: 10.1007/s11701-024-02127-x.
8. Single-Port Extraperitoneal vs. Multiport Transperitoneal Robot-Assisted Radical Prostatectomy: A Propensity Score-Matched Analysis Jaya S Chavali, et al. Cancers (Basel). 2024 Aug 28;16(17):2994. doi: 10.3390/cancers16172994.
9. A prospective study on single-port versus multiport patient-reported surgical outcomes Luca A. Morgantini, et al. https://doi.org/10.1002/bco2.290
10. Kaouk, J., Beksac, A. T., Abou Zeinab, M., Duncan, A., Schwen, Z. R., & Eltemamy, M. (2021). Single Port Transvesical Robotic Radical Prostatectomy: Initial Clinical Experience and Description of Technique. Urology, 155, 130–137. https://doi.org/10.1016/j.urology.2021.05.022
11. Laydner H, Akça O, Autorino R, et al. Third prize: perineal robot-assisted laparoscopic radical prostatectomy: feasibility study in the cadaver model. J Endourol. 2014. doi:10.1089/end.2014.0244
12. Garisto J, Bertolo R, Wilson CA, Kaouk J. The evolution and resurgence of perineal prostatectomy in the robotic surgical era. World J Urol. 2020;38(4):821–828. doi:10.1007/s00345-019-03004-1
13. Kaouk JH, Akca O, Zargar H, et al. Descriptive Technique and Initial Results for Robotic Radical Perineal Prostatectomy. Urology. 2016;94:129–138. doi:10.1016/j.urology.2016.02.063
14. Pellegrino, A. A., Chen, G., Morgantini, L., Calvo, R. S., & Crivellaro, S. (2023). Simplifying Retroperitoneal Robotic Single-port Surgery: Novel Supine Anterior Retroperitoneal Access. European urology, 84(2), 223–228. https://doi.org/10.1016/j.eururo.2023.05.006
15. Intuitive Surgical. (2024a, 14 de marzo). Intuitive announces FDA clearance of fifth-generation robotic system, da Vinci 5 [Nota de prensa].
16. Hackensack University Medical Center. (2024, 9 de abril). Hackensack Meridian Hackensack University Medical Center among first hospitals in the world to acquire and use the da Vinci 5 multiport robotic surgical system [Nota de prensa].
17. Intuitive Surgical. (2024b, 18 de octubre). Form 10-Q for the quarter ended September 30, 2024 [Informe regulatorio].
18. Covas Moschovas, M., Saikali, S., Gamal, A., Reddy, S., Rogers, T., Chiara Sighinolfi, M., Rocco, B., & Patel, V. (2024). First Impressions of the New da Vinci 5 Robotic Platform and Experience in Performing Robot-assisted Radical Prostatectomy. European urology open science, 69, 1–4. https://doi.org/10.1016/j.euros.2024.08.014
19. Patel E, Saikali S, Mascarenhas A, Covas Moschovas M, Patel V. Muscle fatigue and physical discomfort reported by surgeons performing robotic-assisted surgery: a multinational survey. J Robot Surg 2023;17:2009–18
20. Intuitive Surgical. (2024b, 18 de octubre). Form 10-Q for the quarter ended September 30, 2024 [Informe regulatorio]
21. Hashimoto DA, Rosman G, Rus D, Meireles OR (2018) Artifcial intelligence in surgery: promises and perils. Ann Surg 268(1):70. https://doi.org/10.1097/SLA.0000000000002693
22. Attanasio A, Scaglioni B, De Momi E, Fiorini P, Valdastri P (2021) Autonomy in surgical robotics. Annu Rev Control RobotAuton Syst 4(1):651–679. https://doi.org/10.1146/annurev-contr ol-062420-090543
23. Ali S, Jonmohamadi Y, Fontanarosa D, Crawford R, Pandey AK (2023) One step surgical scene restoration for robot assisted minimally invasive surgery. Sci Rep 13(1):3127. https://doi.org/10. 1038/s41598-022-26647-4
24. Wang F, Sun X, Li J (2023) Surgical smoke removal via residual swin transformer network. Int J Comput Assist Radiol Surg18(8):1417–1427. https://doi.org/10.1007/s11548-023-02835-z
25.Kumazu Y, Kobayashi N, Kitamura N et al (2021) Automated segmentation by deep learning of loose connective tissue fibers to define safe dissection planes in robot-assisted gastrectomy. Sci Rep 11(1):21198. https://doi.org/10.1038/ s41598-021-00557-3
26. Marsden M, Weyers BW, Bec J et al (2021) intraoperative margin assessment in oral and oropharyngeal cancer using label-free fuorescence lifetime imaging and machine learning. IEEE Trans Biomed Eng 68(3):857–868. https://doi.org/10.1109/TBME.2020. 3010480
27. Seetohul, J., Shafiee, M., & Sirlantzis, K. (2023). Augmented Reality (AR) for Surgical Robotic and Autonomous Systems: State of the Art, Challenges, and Solutions. Sensors (Basel, Switzerland), 23(13), 6202. https://doi.org/10.3390/s23136202
28. Bianchi L, Chessa F, Angiolini A et al (2021) The use of augmented reality to guide the intraoperative frozen section during robot-assisted radical prostatectomy. Eur Urol 80(4):480–488.https://doi.org/10.1016/j.eururo.2021.06.020
29. Porpiglia F, Checcucci E, Amparore D, Piramide F, Volpi G, Granato S, et al. Three-dimensional Augmented Reality Robot-assisted Partial Nephrectomy in Case of Complex Tumours (PADUA ≥10): A New Intraoperative Tool Overcoming the Ultrasound Guidance. Eur Urol 2020;78:229–38.
30. Porpiglia F, Fiori C, Checcucci E, Amparore D, Bertolo R.Hyperaccuracy Three-dimensional Reconstruction Is Able to Maximize the Efficacy of Selective Clamping During Robotassisted Partial Nephrectomy for Complex Renal Masses. Eur Urol 2018;74:651–60.
31. Zhu L, Yang S, Shen J, Wang C, Song A (2022) A force-sensing retractor for robot-assisted transoral surgery. Int J Comput Assist Radiol Surg 17(11):2001–2010. https://doi.org/10.1007/ s11548-022-02677-1
32. Van Der Meijden OAJ, Schijven MP. 2009. The value of haptic feedback in conventional and robotassisted minimal invasive surgery and virtual reality training: a current review. Surg. Endosc. 23:1180–90
33. Marques Marinho M, Oikawa R, Hayashi K, Takazawa S, Harada K, Mitsuishi M (2023) Design and validation of looping assistance methods in robotic-assisted neonatal surgical suturing in a chest model. Int J Med Robot Comput Assist Surg MRCAS 19(2):e2476. https://doi.org/10.1002/rcs.2476
34. Saeidi H, Opfermann JD, Kam M et al (2022) Autonomous robotic laparoscopic surgery for intestinal anastomosis. Sci Robot. https:// doi.org/10.1126/scirobotics.abj2908
35. Eslamian S, Reisner LA, Pandya AK (2020) Development and evaluation of an autonomous camera control algorithm on the da Vinci Surgical System. Int J Med Robot Comput Assist Surg MRCAS 16(2):e2036. https://doi.org/10.1002/rcs.2036
36. Bilgic E, Gorgy A, Yang A, et al. Exploring the roles of artificial intelligence in surgical education: a scoping review. Am J Surg. 2022;224:205e216.
37. Wu C, Cha J, Sulek J, et al. Eye-tracking metrics predict perceived workload in robotic surgical skills training. Hum Factors. 2020;62:1365e1386.
38. Ma R, Ramaswamy A, Xu J et al (2022) Surgical gestures as a method to quantify surgical performance and predict patient outcomes. NPJ Digit Med 5(1):187. https://doi.org/10.1038/ s41746-022-00738-y
39. Chen, J., Cheng, N., Cacciamani, G., Oh, P., Lin-Brande, M., Remulla, D., Gill, I. S., & Hung, A. J. (2019). Objective Assessment of Robotic Surgical Technical Skill: A Systematic Review. The Journal of urology, 201(3), 461–469. https://doi.org/10.1016/j.juro.2018.06.078
40. Hung AJ, Chen J, Jarc A, Hatcher D, Djaladat H, Gill IS. Development and validation of objective performance metrics for robot-assisted radical prostatectomy: A pilot study. J Urol 2018;199:296– 304. [PubMed: 28765067]
41. Chen J, Oh PJ, Cheng N, et al. Use of automated performance metrics to measure surgeon performance during robotic vesicourethral anastomosis and methodical development of a training tutorial. J Urol 2018;200:895–902. [PubMed: 29792882]
42. Judkins TN, Oleynikov D, Stergiou N. Objective evaluation of expert performance during human robotic surgical procedures. J Robot Surg 2008;1:307–12. [PubMed: 25484983]
43. Judkins TN, Oleynikov D, Stergiou N. Objective evaluation of expert and novice performance during robotic surgical training tasks. Surg Endosc 2009;23:590–7. [PubMed: 18443870]
44. Hung, A. J., Chen, J., Ghodoussipour, S., Oh, P. J., Liu, Z., Nguyen, J., Purushotham, S., Gill, I. S., & Liu, Y. (2019). A deep-learning model using automated performance metrics and clinical features to predict urinary continence recovery after robot-assisted radical prostatectomy. BJU international, 124(3), 487–495. https://doi.org/10.1111/bju.14735
45. Madan AK, Frantzides CT, Shervin N, Tebbit CL. Assessment of individual hand performance in box trainers compared to virtual reality trainers. Am Surg. 2003;69:1112e1114.
46. Knudsen, J. E., Ghaffar, U., Ma, R., & Hung, A. J. (2024). Clinical applications of artificial intelligence in robotic surgery. Journal of robotic surgery, 18(1), 102. https://doi.org/10.1007/s11701-024-01867-0
47. Salehinejad H, Colak E, Dowdell T, Barfett J, Valaee S. Synthesizing chest x-ray pathology for training deep convolutional neural networks. IEEE Trans Med Imaging. 2019;38:1197e1206.
48. Wu, J. Y., Kazanzides, P., & Unberath, M. (2020). Leveraging vision and kinematics data to improve realism of biomechanic soft tissue simulation for robotic surgery. International journal of computer assisted radiology and surgery, 15(5), 811–818. https://doi.org/10.1007/s11548-020-02139-6
49. Wu JY, Kazanzides P, Unberath M (2020) Leveraging vision and kinematics data to improve realism of biomechanic soft tissue simulation for robotic surgery. Int J Comput Assist Radiol Surg 15(5):811–818. https://doi.org/10.1007/s11548-020-02139-6
50. Ma R, Lee RS, Nguyen JH et al (2022) Tailored feedback based on clinically relevant performance metrics expedites the acquisition of robotic suturing skills-an unblinded pilot randomized controlled trial. J Urol 208(2):414–424. https://doi.org/10.1097/ JU.0000000000002691
51. Laca JA, Kocielnik R, Nguyen JH et al (2022) Using real-time feedback to improve surgical performance on a robotic tissue dissection task. Eur Urol Open Sci 46:15–21. https://doi.org/10. 1016/j.euros.2022.09.015
52. Marescaux J, Leroy J, Rubino F, Smith M, Vix M, Simone M, et al. Transcontinental robot-assisted remote telesurgery: feasibility and potential applications. Ann Surg. 2002;235(4):487–92.
53. Cagigas Fernández C, Gómez Ruiz M. Telecirugía y tementorización. Cir Esp. 2024;102(S1):23–29.
54. Motiwala ZY, Desai A, Bisht R, Lathkar S, Misra S, Carbin DD. Telesurgery: current status and strategies for latency reduction. J Robot Surg. 2025;19:153.
55. Moschovas MC, Rogers T, Patel V. First impressions of telesurgery robotic-assisted radical prostatectomy using the Edge medical robotic platform. Int Braz J Urol. 2024;50(6):754–763.
55. Rogers T, Moschovas MC, Patel V. Triple-console robotic telesurgery: first impressions and future impact. J Robot Surg. 2024;18:381.
56. Moschovas MC, Dohler M, Patel V. Telesurgery and global surgical equity: bridging continents with robotic innovation. Eur Urol. 2024;86:88–89.
57. Dohler M, Patel V, Moschovas MC. The crucial role of 5G, 6G, and fiber in robotic telesurgery. J Robot Surg. 2025;19:4.
58. Patel V, Marescaux J, Moschovas MC. International perspectives on regulatory frameworks for telesurgery. Eur Urol. 2024;86:88–89.
59. Motiwala ZY, Desai A, Misra S, Lathkar S, Carbin DD. Latency in telesurgery: causes, consequences, and solutions. J Robot Surg. 2025;19:153.
60. World Health Organization. WHA68.15: Strengthening emergency and essential surgical care and anaesthesia as a component of universal health coverage. Geneva: WHO; 2015.
61. Patel V, Rogers T, Moschovas MC. International multispecialty consensus statement and expert opinion of best practices in telesurgery. J Robot Surg. 2025;19:135.

